-
Medical journals
- Career
Metody přípravy mikročástic ve farmaceutické technologii
: Marika Bajerová; K. Dvořáčková; J. Gajdziok; R. Masteiková; M. Rabišková
: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
: Čes. slov. Farm., 2009; 58, 191-199
: Review Articles
Přehledový článek je zaměřen zejména na metody přípravy, charakterizaci mikročástic a dále na charakteristiku a příklady jejich možného využití ve farmakoterapii. Mikročástice jako násobná léková forma obvykle spadají mezi léky druhé generace, tedy léky s možností řízeného uvolňování. Ve srovnání s klasickými lékovými formami se vyznačují nižšími nežádoucími účinky a vyšší stabilitou. Aplikace léčiv v této lékové formě přináší vyšší efektivitu terapie při současném zvýšení compliance pacienta. Mezi nejčastěji používané metody přípravy mikročástic patří fázová separace-jednoduchá nebo komplexní, odpaření rozpouštědla, sprejové sušení, síťovací metody založené na tvorbě kovalentních nebo iontových vazeb. Okrajově je možné použít také metody extruze-sferonizace, formování a obalování mikročástic ve fluidní vrstvě a in situ polymerizace.
Klíčová slova:
mikročástice – příprava mikročástic – polymery – řízené uvolňováníÚvod
Perorální podání léčivých látek představuje jeden z nejstarších, nejčastějších a nejoblíbenějších aplikačních způsobů, kterými lze dosáhnout lokálního i systémového účinku. Biologickou dostupnost aktivní látky z lékových forem 1. generace lze jen obtížně předpovídat. Rychlost a rozsah absorpce látek se mění v závislosti na různých faktorech, kterými mohou být fyzikálně--chemické vlastnosti léčivých a pomocných látek, přítomnost potravy, proměnlivé pH, motilita gastrointestinálního traktu (GIT) a další 1). Aplikací poznatků o faktorech ovlivňujících biologickou dostupnost účinných látek vznikly léky 2. (léky s řízeným uvolňováním léčiva a terapeutické systémy) a 3. generace (transportní systémy), které jsou schopny řídit uvolňování léčiv v čase, případně zajistit cílenou biodistribuci léčiv 2, 3). Mezi léky s řízeným uvolňováním léčiva patří i částicové lékové formy tvořené lékovými mikroformami. Podle povahy technologického postupu výroby i vlastností lze lékové mikroformy rozdělit do několika skupin. Jsou to mikročástice, pelety, nanočástice, lipozomy, niozomy, farmakozomy, molekulové inkluze (uzávěrové komplexy cyklodextrinů), nově lze sem zařadit i dendrimery, nano - a mikrotubuly.
Počátek formování mikročástic se datuje do 30. let minulého století, kdy Bungenberg de Jong et al. zveřejnili práci, ve které se zabývali enkapsulací látek metodou koacervace. Ta byla také první metodou využitou v praxi při výrobě bezuhlíkatého kopírovacího papíru v 50. letech minulého století 4). Farmaceutické využití mikročástic přichází až o 30 let později, kdy se přípravy těchto lékových forem začíná využívat zejména pro maskování chutě a zápachu aktivních látek, ochranu léčivých látek proti vnějším vlivům, zejména před vlhkostí, světlem, oxidací vzdušným kyslíkem; dále pro zapracování kapalných látek do pevné formy; zlepšení sypnosti prášků; oddělení inkompatibilních látek a výrobu přípravků s řízeným uvolňováním léčivé látky 5).
Mezi mikročástice lze zahrnout všechny částicové systémy, které se pohybují ve velikostním rozmezí 1–1000 μm. Připravují se četnými, často poměrně složitými technologickými postupy, které vedou k produkci částic nejrůznější struktury, složení a fyzikálně-chemických vlastností. Volba vhodné výrobní metody závisí především na základních vlastnostech polymerního nosiče a na rozpustnosti účinné látky 6, 7). Aktivní látka může být homogenně rozložena v polymerní matrici, nebo enkapsulována polymerem za vzniku zásobníkového typu přípravku. Možné je také adsorbovat látku na povrch mikročástice iontovými nebo chemickými interakcemi. Z morfologického hlediska lze mikročástice rozdělit na dva typy:
- Mikrotobolky (zásobníkový typ) jsou systémy obsahující polymerní obal a jádro s průměrem v rozmezí 3–800 μm 8). Vnitřní obsah mikrotobolky – jádro může být v kapalné, pevné nebo plynné formě, tvoří 10–90 % hmotnosti celé částice a ovlivňuje konečný tvar mikrotobolky 9, 10). Na jádro těsně přiléhá polymerní obal, který může být označován také jako stěna, plášť nebo membrána.
- Mikrosféry (matricový typ) jsou tvořeny makromolekulární sítí nebo kontinuální lipidovou vrstvou, ve které je rozptýlena aktivní látka, ať už ve formě molekulární (roztok), nebo makroskopické (suspenze, emulze) 5).
Nejčastěji používanými pomocnými látkami (obr. 1) při přípravě mikročástic jsou makromolekulární látky přírodního, polosyntetického a syntetického původu, v jejichž molekule se jako článek v řetězu mnohokrát opakuje základní monomerní jednotka. Předmětem intenzivního zkoumání jsou především polymery přírodního původu. Jsou atraktivní zejména pro svůj organický původ, snadnou dostupnost, nízkou ekonomickou náročnost a jednoduchou chemickou modifikovatelnost 11).
1. Rozdělení pomocných látek používaných při přípravě mikročástic 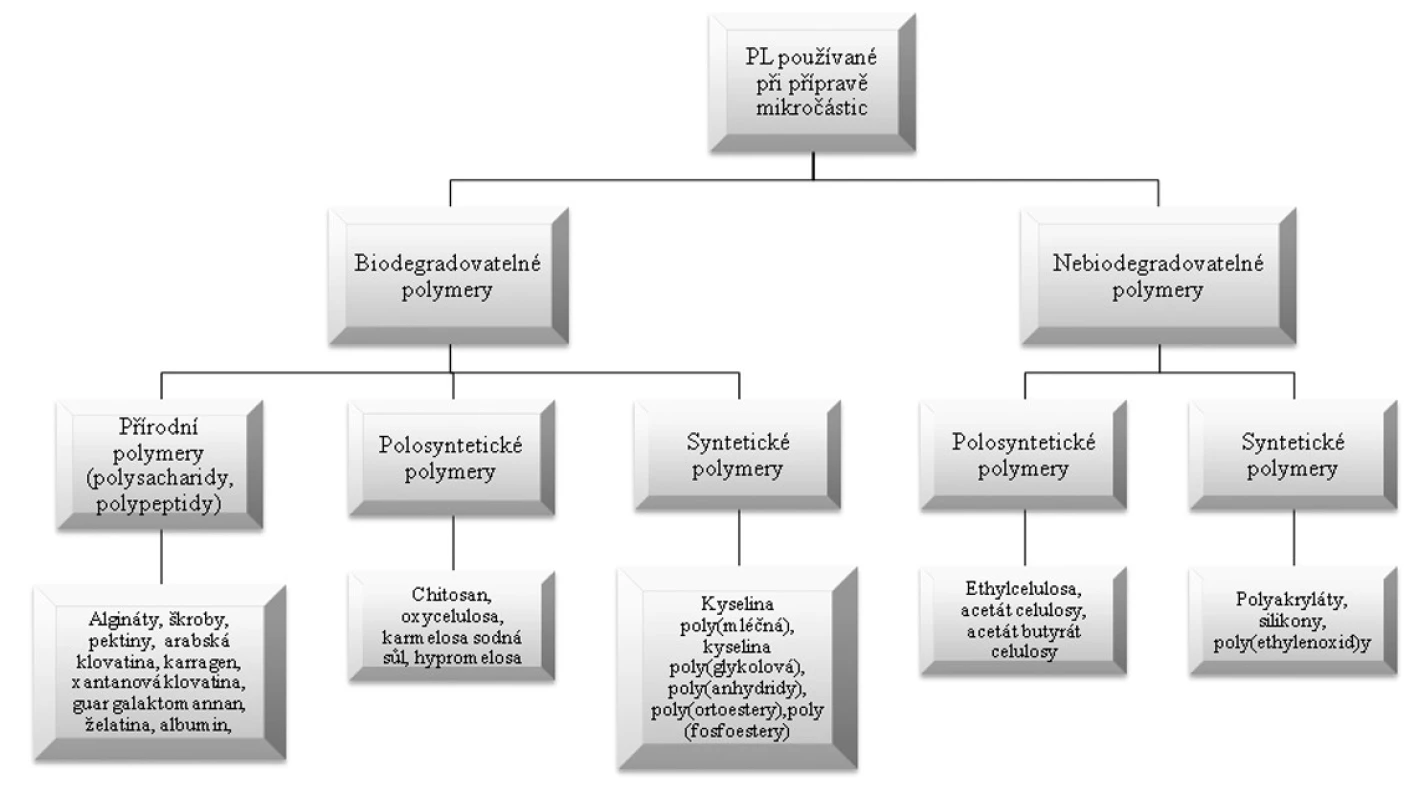
Pro přípravu mikročástic ovšem nelze použít všechny syntetické a přírodní polymery. Některé polymery jsou pro přípravu vhodnější než jiné. Za základní kritérium bývá považována schopnost polymeru adsorbovat se na aktivní látku tvořící jádro. Je proto nutná určitá kompatibilita. Princip kompatibility polymer-jádro může být chápán jako možné fyzikálně-chemické interakce (iontové, hydrofobní, vodíkové můstky). Většinou se používají hydrofilní polymery pro hydrofilní jádra a naopak. Existují však i výjimky, např. při enkapsulaci parfémových látek. V tomto případě se na tvorbu obalu používají slabě hydrofilní polymery, které zabraňují těkání parfému 12). Polymerní obal musí mít rovněž požadované chemické a mechanické vlastnosti. Nutná je stabilita, elasticita, pevnost, schopnost zachování kompaktnosti během výroby a další vlastnosti související s účelem použití. Vzhledem k praktickému použití je důležitá i ekonomická přijatelnost. Spolu s velkým počtem polymerů vhodných pro tvorbu obalu lze také použít velké množství přísad, a tím modifikovat jeho vlastnosti, např. barviva vylepšují estetické vlastnosti výsledných mikročástic. Některá aditiva mohou také zmenšit krystalinitu polymeru, a tím zlepšit uvolňování látky. Dalším z faktorů, které mohou mít vliv na vlastnosti připravených mikročástic, je použité rozpouštědlo. Ovlivňuje například pórovitost polymerního obalu, která se projevuje změnou jeho propustnosti 12).
Z přírodních a polosyntetických polymerů se nejčastěji používají arabská klovatina 13), pektiny 14), škroby 15), želatina 16), algináty 17), chitosan 18). Vzrůstající zájem při formulaci mikročástic je také o syntetické biodegradovatelné polymery, např. kopolymery kyseliny mléčné a glykolové 19) nebo poly(3-hydroxybutyrát)chitosan 20). Tento zájem je dán zejména rozvojem řady nově vznikajících technologií, jako je například tkáňové inženýrství, genová terapie, nanotechnologie aj. Mezi nejvýznamnější nebiodegradovatelné polymery je možné zařadit některé celulosové deriváty, především acetát celulosy a acetát butyrát celulosy 21), akrylátové polymery 22), polyvinylalkohol 23) a silikony 24). Důležitou skupinu látek používanými při výrobě mikročásticových systémů jsou látky lipofilní povahy, např. tuky a vosky 25). Jedná se o cetyalkohol 26), kyselinu stearovou, karnaubský vosk, glycerol palmito-stearát (Precirol®) 27) atd.
Výroba mikročástic
V současnosti jsou dostupné různé metody přípravy. Nejčastěji se tyto techniky rozdělují podle mechanizmu, který vede ke vzniku mikročástic na chemické (typ A) a fyzikálně-mechanické (typ B). Mezi chemické metody řadíme především fázovou separaci (koacervaci), polymerovou inkompatibilitu, polymerizaci v kontinuální kapalné fázi, in situ polymerizaci, tepelnou a iontovou gelaci aj. Mechanické postupy zahrnují sprejové sušení a chlazení, formování a obalování mikročástic ve fluidní vrstvě, extruzi taveniny, odstředivou extruzi a formování mikročástic odpařením rozpouštědla 28).
Fázová separace (koacervace)
Koacervace je metoda, při které dochází k rozdělení polymerního roztoku na dvě nemísitelné kapalné fáze, z nichž jedna bohatá na makromolekulární materiál se označuje jako koacervační fáze, a druhá, zředěná, se nazývá koacervační médium neboli supernatant. Koacervace se dělí podle mechanismu na jednoduchou a komplexní koacervaci. Jednoduchá koacervace je děj, kdy fázová separace nastává v přítomnosti jednoho typu makromolekulární látky na rozdíl od komplexní koacervace, která probíhá v přítomnosti dvou a více opačně nabitých polymerů. Během jednoduché i komplexní koacervace se vytváří drobné kapky, které se usazují nebo spojují a vytváří oddělenou koacervovanou fázi. Pokud jsou v roztoku přítomná jádra, kapky koacervátu se kolem nich hromadí a po přidání vhodného síťovacího činidla (např. glutaraldehydu nebo použití zvýšené teploty) vytváří stěnu mikrotobolek. Mícháním roztoku se může předejít shlukování a sedimentaci kapek koacervátu. V některých případech je nezbytný přídavek stabilizátoru, aby nedocházelo ke koagulaci výsledných mikročástic. Tvorba mikročástic koacervací obvykle vyžaduje další kroky pro jejich zpevnění. Těmi mohou být relativně jednoduché procesy vedoucí k odstranění zbytkového rozpouštědla, např. snížením teploty a propláchnutí srážecím roztokem nebo stabilizací síťovacími činidly 5, 9).
Jednoduchou koacervací nerozpustného polymeru ethylcelulosy se připravují mikrotobolky využívané v klinické praxi, např. s kyselinou acetylsalicylovou (Rhonal®, Aspirine UPSA® 325 mg), chloridem draselným (Cifru-K®) nebo mesalazinem (Pentasa®). Mikrotobolky s obsahem mesalazinu jsou formulovány do konečné formy tablet či tvrdých tobolek. Jsou určeny k perorální aplikaci, po níž se dosahuje prodlouženého uvolňování aktivní látky v gastrointestinálním traktu po dobu až 8 hodin. Tato skutečnost umožňuje rozdělení dávky léčiva tak, aby byla udržena jeho konstantní hladina 29). Metoda je také využívána při maskování nepříjemné chuti. Příkladem může být příprava mikročástic s obsahem sodné soli diklofenaku. Polymerem, vytvářejícím stěnu je v tomto případě ethylcelulosa 30).
Komplexní koacervaci lze vyvolat v systémech s dispergovanými hydrofilními koloidy nesoucími opačné elektrické náboje. Jako kladně nabitý polykationt se používají například želatina typu A nebo chitosan, jako polyanionty se nejčastěji uplatňují arabská klovatina, algináty, karagenany, karmelosa sodná sůl, polyfosfáty aj. Podstatou je vyrovnávání nábojů na koloidech při vhodně zvoleném pH 29). Metodě komplexní koacervace se věnuje velká pozornost v oblasti genetiky, v potravinářském průmyslu, zejména pro enkapsulaci silic, umělých sladidel, barviv, konzervačních látek, s vodou nemísitelných olejů (např. vitaminů a rostlinných olejů), a v zemědělském průmyslu, kde se metoda používá pro obalování semen 4).
Polymerová inkompatibilita
Metoda je založená na inkompatibilitě dvou chemicky odlišných polymerů. Využívá sice principu fázové separace, nicméně se liší od metody komplexní koacervace. V případě komplexní koacervace spolu reagují dva opačně nabité polymery a vytváří složený koacervát. Oba polymery se tedy stávají součástí stěny vznikající mikrotobolky. Metoda polymerové inkompatibility však spočívá ve smísení roztoků dvou chemicky odlišných, vzájemně inkompatibilních polymerů rozpuštěných v obvyklých rozpouštědlech a následném oddělení dvou polymerních fází v důsledku vzájemného odpuzování polymerních molekul. Stěnu mikrotobolek pak tvoří pouze jeden z polymerů, druhý polymer se přidává proto, aby vyvolal fázovou separaci. V konečné stěně mikročástic se tedy nevyskytuje, ačkoliv malé množství se zde může objevit ve formě nečistot 28).
Příkladem polymerové inkompatibility může být reakce ethylcelulosy a nízkomolekulárního polyethylenu. Nejprve se disperguje látka určená k enkapsulaci (jádra budoucí mikrotobolky) v horkém roztoku (80 °C) ethylcelulosy v cyklohexanu. Přidáním polyethylenu, který je rozpustný v horkém cyklohexanu a inkompatibilní s ethylcelulosou, se vyvolá fázová separace. Jádra mikrotobolky jsou rovnoměrně dispergována v obou fázích. Poté dochází k adsorpci ethylcelulosy na povrch jader mikrotobolek a vytvoření tenké obalové vrstvy. Systém se dále ochladí na teplotu místnosti, což vede k vysrážení ethylcelulosy, jejímu zpevnění a vytvoření pravých mikrotobolek 28).
Mikrotobolky připravené touto metodou mají většinou nepravidelný tvar s velikostí mezi 200–800 μm. Používají se zejména pro maskování chuti a pro prodloužené uvolňování léčiva. Většina těchto mikrotobolek obsahuje ethylcelulosový obal. Existují však i mikrotobolky o velikosti 20–120 μm s obsahem biodegradovatelného kopolymeru kyseliny mléčné a glykolové, které mohou být součástí parenterálních lékových forem. Příkladem komerčně enkapsulovaných léčivých látek je například chlorid draselný a kyselina acetylsalicylová 9, 28).
Síťovací metody
Síťovací metody mohou být rozděleny na chemické a fyzikálně-iontové metody. Chemické síťovací metody jsou založeny na tvorbě kovalentních vazeb mezi polymerem a aktivní látkou. Pro chemické zesíťování se používá glutaraldehyd, formaldehyd nebo přírodní látka genepin. Tyto látky se použily pro přípravu chitosanových mikročástic s obsahem interleukinů nebo plazmidů 31). Mezi interakce založené pouze na fyzikálních (elektrostatických) silách patří iontová gelace, kdy dochází k zesíťování polyelektrolytů v přítomnosti polyvalentních iontů. Typickým příkladem je vstřikování roztoku alginátu sodného do roztoku chloridu vápenatého, čímž se vytváří pevné gelové mikročástice 32). Hlavní nevýhodou alginátových mikročástic je nižší enkapsulační účinnost léčivé látky a její rychlé uvolnění v tenkém střevě. Mikročástice se navíc vyznačují také poměrně vysokou pórovitostí, která způsobuje uvolňování léčivé látky do roztoku CaCl2. Pro modifikaci uvolňování léčiva z alginátových mikročástic se často využívá tvorby polyelektrolytových komplexů vznikajících reakcí opačně nabitých polyelektrolytů. Ty pak vytváří na povrchu tenkou vrstvu, a tím zabraňují bobtnání výsledných gelových částic. Pro mikročástice vytvořené ze sodné soli kyseliny alginové se jako opačně nabitý polymer nejčastěji používá chitosan, dále poly-L-lysin nebo polyethylenimin 33). Další látkou používanou při přípravě mikročástic iontovou gelací je chitosan. Jako síťovací činidla se v tomto případě používají síran sodný, tripolyfosfát sodný, hydroxid sodný nebo citrát sodný. Tímto způsobem byly připraveny chitosanové mikročástice s Bordetella bronchiseptica antigenem obsahující dermonekrotoxin, které byly zkoušeny pro nosní vakcinaci prasat 34).
Dalšími polymerními systémy využívanými při iontové gelaci mohou být: chitosan/trifosfát, karmelosa sodná sůl/hlinité ionty (nebo chitosan), κ-karagen/draselné ionty (nebo chitosan), pektin/vápenaté ionty a gellan guma/vápenaté ionty. Posledně zmíněná metoda byla vyvinuta pro enkapsulaci živých buněk, dnes se používá i pro enkapsulaci ve vodě málo rozpustných léčivých látek 35, 36).
Mezipovrchová polymerizace
Podstatou je tvorba obalu mikrotobolky na povrchu kapky nebo pevné částice polymerizací dvou monomerů. Pokud se dva monomery rozpustí odděleně ve vzájemně nemísitelných rozpouštědlech (např. voda a alkan) a poté se tyto roztoky smíchají dohromady, monomery se začnou hromadit na mezifázi, kde spolu reagují a vytváří tenký polymerní film. S pokračující reakcí se vytváří stále silnější membrána až do úplného spotřebování rozpuštěných monomerů 6).
Metoda je založena na klasické reakci Schotten-Baumannové reakci mezi chloridem kyseliny a látkami obsahující aktivní vodík, jako jsou například aminy, alkoholy, polyestery, polyurea a polyurethany. Namísto chloridů lze použít i isokyanatany kyselin nebo kombinaci chloridů kyselin a isokyanatanů 9). Organický roztok obsahující chlorid kyseliny a látku určenou k enkapsulaci se disperguje do vodného roztoku obsahující povrchově aktivní látku. Za stálého míchání se k němu přidá vodný roztok obsahující druhý monomer, a tím dojde na povrchu kapek vnitřní organické fáze k mezifázové polymerizaci (interfaciální polymerizaci-IFP). Vzniklé mikrotobolky se filtrují, promyjí čištěnou vodou a vysuší rychlým promytím acetonem 6).
Kvalitu vznikající membrány mikrotobolek mohou ovlivnit další parametry, jako jsou například koncentrace monomerů, teplota, rychlost míchání a reakční čas. Metoda je používána pro výrobu mikrotobolek o velikosti 3–30 μm 6).Mezipovrchová polymerace nachází uplatnění především při enkapsulaci biologických molekul a proteinů (např. ureasy, arginasy, histidasy, glukosidasy, hemoglobinu, protilátek aj.) 29). Metoda se také využívá v kosmetickém průmyslu pro přípravu polyamidových mikrotobolek s obsahem jojobového oleje 37).
In situ polymerizace
Polymerizace in situ je metoda velmi blízká mezifázové polymerizaci (IFP), kde se stejně jako u ní stěny mikrotobolky vytváří polymerizací monomerního výchozího materiálu. Na rozdíl od IFP probíhá polymerizace pouze ve vnější kontinuální fázi a na fázovém rozhraní. Polymerizací výchozích látek vzniká nejdříve nízkomolekulární tzv. prepolymer, který se ukládá na povrchu dispergovaných jader, kde dochází k síťování polymerních řetězců a vzniku obalu mikrotobolky. Prvním příkladem této použité technologie byla enkapsulace různých s vodou nemísitelných kapalin do tobolek, jejichž stěna vznikla reakcí močoviny a formaldehydu ve vodném prostředí o kyselém prostředí 28). Metoda je velmi využívána při přípravě mikrotobolek s obsahem bezuhlíkatého inkoustu nebo parfémových testrů používaných v marketingových produktech kosmetických firem. Základem testrů jsou parfémy enkapsulované do mikročástic, které mechanickým namáháním inkorporovaný parfém uvolňují 9).
Odpaření/extrakce rozpouštědla
Metoda odpaření/extrakce rozpouštědla z vnitřní fáze emulze je jednou z nejpoužívanějších metod přípravy mikročástic, která je známá už od konce sedmdesátých let 20. století. Můžeme je dělit na základě různých kritérií:
- a) podle povahy vnější fáze (vodná, nevodná),
- b) podle dispergace účinné látky (roztok, suspenze, emulze),
- c) podle způsobu odstranění rozpouštědla (odpaření, extrakce).
Polymerní materiál se nejdříve rozpustí v těkavém organickém rozpouštědle, který představuje vnitřní fázi. Léčivá látka se rozpustí nebo disperguje v roztoku polymeru za tvorby roztoku, suspenze nebo emulze. Dále se organická fáze za stálého míchání emulguje do disperzního média (vnější fáze) obsahujícího vhodný emulgátor, který zabraňuje pozdějšímu splývání kapek emulze. Rychlost míchání je jedním z kritických faktorů ovlivňující velikost kapek emulze ve vnější fázi 38). Polymer se nesmí rozpouštět ve vnější fázi, jež zároveň musí být nemísitelná s fází vnitřní. Jakmile je emulze stabilizovaná, dochází k difuzi vnitřního rozpouštědla do kontinuální fáze a k jeho odpaření. Rychlost odpaření rozpouštědla může být ovlivněna teplotou disperze. Vzniklé mikrosféry zůstávají suspendované v kontinuální fázi, kde se sbírají filtrací nebo odstředěním, a jsou pak následně promyty a vysušeny. Sušení probíhá za sníženého tlaku nebo lyofilizací, čímž se získává volně tekoucí prášek 39, 40).
Ačkoliv je koncept této metody relativně jednoduchý, fyzikálně-chemická podstata procesu je složitější. Během tvorby mikročástic dochází k několika fázovým přechodům, zejména k odpařování vnitřního těkavého rozpouštědla na povrchu emulze, difuzi vnitřního rozpouštědla do vnější fáze a také k rozdělení aktivní látky mezi vnitřní a vnější fázi 40).
Odstranění rozpouštědla z emulze o/v
Obecně jsou upřednostňovány metody využívající vodu jako vnější fázi. Jsou ekonomičtější a odpadá potřeba recyklace vnější fáze. Polymerní materiál se nejdříve rozpustí v organickém rozpouštědle, např. dichlormethanu, chloroformu nebo ethylacetátu. Následně se v tomto médiu disperguje léčivá látka a celá směs je následně emulgována do vnější vodné fáze obsahující vhodný emulgátor. Léčivo může být v pevném stavu, nebo ve formě netěkavé kapaliny 6, 40). Mikrosféry připravené touto metodou jsou vhodné k zapracování lipofilních látek jako například steroidních hormonů, některých cytostatik, protizánětlivých léčiv a neuroleptik. Hydrofilní látky mohou představovat určitý problém, protože dochází k přechodu látky do vnějšího prostředí, a tím ke snižování enkapsulačního procesu. Aby nedocházelo k tomuto jevu, je možné modifikovat dispergující vnější fázi, např. saturací účinnou látkou (vhodné pouze pro látky s nízkou rozpustností ve vodě), změnou pH (výhodné pro ionizovatelné účinné látky) nebo přídavkem elektrolytů pro zvýšení osmotického tlaku 40). Metodou odstranění rozpouštědla z jednoduché emulze o/v byly připraveny mikročástice na bázi kopolymeru kyseliny mléčné a aminokyselin glycinu a leucinu s obsahem selektivního inhibitoru cyklooxygenasy-2 valdecoxibu. Mikročástice byly intramuskulárně aplikovány novozélandským bílým králíkům s revmatoidní artritidou, kde se léčivo uvolňovalo až po dobu 49 dní. Mezi výhody připravených mikročástic patří zejména zvýšená biologická dostupnost léčiva a snížení frekvence dávkování 41).
Odstranění rozpouštědla z emulze v/o/v
Tato metoda byla poprvé navržena Ogawou et al. pro přípravu mikrosfér s obsahem peptidů a proteinů. Je vhodná zejména pro snadno rozpustná léčiva, která se zapracovávají ve formě vodného roztoku do organického rozpouštědla za vzniku primární emulze typu v/o. Tato emulze, která je často stabilizována neiontovými emulgátory, je následně emulgována do vnější vodné fáze za vzniku dvojité emulze typu v/o/v. Organická fáze zabraňuje samovolné difuzi účinné látky mezi oběma vodnými fázemi, a plní tak funkci membránové bariéry 40, 42). Vlastnosti konečného produktu jsou pak ovlivňovány některými parametry jako například rozpustností a koncentrací léčiva, typem polymeru a organického rozpouštědla, typem a koncentrací emulgátoru, teplotou a viskozitou emulze 43).
Příkladem mikročástic připravených metodou odpaření rozpouštědla z emulze v/o/v je přípravek Enantone® LP. Jedná se o biodegradovatelné mikrosféry obsahující peptid leuprolelin určený k subkutánnímu podání ve formě suspenze při léčbě rakoviny prostaty. Tato léková forma zajišťuje kontinuální uvolňování peptidu do organismu po dobu 1 měsíce, čímž se výrazně zvyšuje compliance pacienta 29). Dalším příkladem mohou být mikročástice s obsahem levobunololu hydrochloridu na bázi poly(ε-kaprolaktonu) pro léčbu glaukomu. Inkorporací zmíněných mikročástic do termoreverzibilního gelu Pluronic F127 bylo dosaženo pomalejšího uvolňování léčiva ve srovnání s volnými částicemi, stejně jako v případě samotné účinné látky dispergované v termoreverzibilním gelu 44).
Odstranění rozpouštědla z nevodné emulze
Metoda je známa také pod označením o1/o2 emulze, kde je kontinuální vodná fáze nahrazena olejovou fází. Dispergovaná fáze bývá představovaná minerálními, nebo rostlinnými oleji, nebo netěkavými organickými rozpouštědly a musí být zcela nemísitelná s kontinuální fází. Nevýhodou této techniky může být omezené množství léčiv vhodných k enkapsulaci. Je vhodná zejména pro hydrofilní léčiva, kterými mohou být například cytostatika, protizánětlivá léčiva, antimalarika a sérový albumin 45, 46). Další nevýhodou může být manipulace s nevodnými rozpouštědly, která jsou často drahá a musí se recyklovat 40). Metoda byla použita například pro přípravu mikročástic z polyethylenglykolovaných derivátů pryskyřice s diklofenakem sodnou solí a diltiazemem hydrochloridem jako modelovými léčivy 47).
Extruze
Technologie extruze byla poprvé patentována v roce 1957. Zařízení pro extruzi se zjednodušeně skládá z odkapávacího zařízení a vytvrzovací lázně. Jejich modifikací pak vznikají různé metody extruze 48).
Mikročástice vznikají odkapáváním připravené disperze do vytvrzovací lázně, kde dochází ke gelaci nebo tuhnutí. Tyto lázně mohou sloužit také po přidání chemického činidla k chelataci nebo kovalentnímu zesíťování. Aby se zabránilo nežádoucí koagulaci vytvořených mikročástic, přidává se stabilizační činidlo 49).
Odstředivá extruze
Při přípravě metodou odstředivé extruze se využívá dvojité kapilární zařízení. Náplň mikrotobolky a obalový materiál jsou dávkovány vnitřním a vnějším ústím souosé dvojité kapiláry (trysky). Obal jádra je tvořený buď materiálem, který je kapalný při teplotě místnosti, pevnými látkami, jejichž teplota tání je menší než 80 oC (tavenina), nebo disperzemi účinných látek. Podmínkou metody je však vzájemná nemísitelnost obalového materiálu a jádra mikrotobolky, které bývá také kapalné. Ve špičce souosé kapiláry vytvoří kapaliny jednotný proud. Rotací zařízení se vytváří odstředivá síla, díky které se provazce materiálu rozlamují na menší kapky. Ty jsou pak dávkovány do vytvrzovací lázně, kde dochází ke zpevnění obalu ochlazením (pro tuky a vosky – extruze taveniny, viz dále), odstraněním rozpouštědla nebo zesíťováním. Mikrotobolky připravené odstředivou extruzi mají velikost od 150 μm až po několik milimetrů. Velikost výsledných mikrotobolek může být ovlivněna řadou parametrů jako například velikostí kapiláry, rychlostí nástřiku, rychlostí rotace přístroje, ale také použitým materiálem 9, 48).
Odstředivou extruzí vznikají mikrotobolky. Tato morfologie poskytuje vyšší stabilitu, kontrolovanější uvolňování aktivní látky ve srovnání s matricovými mikročásticemi. Enkapsulační účinnost je vysoká a může dosahovat až 80 % 50).
Extruze taveniny
Extruze je metoda založená na principu protlačování taveniny s dispergovanou účinnou látkou přes děrovanou přepážku. Tavenina může obsahovat malé množství vody (zpravidla méně než 10 %), aby se snížila její viskozita. Získávají se dlouhé cylindrické provazce, které padají do vytvrzovací lázně. V lázni dochází ke zpevňování a uzavření aktivní látky do polymerní matrice. Nejčastěji používanou vytvrzovací lázní bývá isopropylalkohol. Vlákna se nakonec rozlámou na menší fragmenty a vysuší se. V praxi se tato metoda používá hlavně v potravinářství pro přípravu mikročástic s obsahem citrusové silice 28, 48).
Sprejové sušení/chlazení
Tvorba mikročástic na základě změny teploty vnějšího prostředí je principem metod sprejového sušení a sprejového chlazení. Zatímco u sprejového chlazení je tavenina vstřikována do komory se studeným vzduchem, principem sprejového sušení je odpaření rozpouštědla z mikročástic v komoře s horkým vzduchem. Tyto metody našly využití nejen při přípravě mikročástic, ale i v jiných oblastech farmaceutické technologie, např. při úpravě pomocných látek, při výrobě granulátů a pelet, pro zvýšení rozpustnosti některých látek aj. 51).
Sprejové sušení
Metoda sprejového sušení byla vyvinuta již ve třicátých letech 20. století v anglických laboratořích firmy Boake, Roberts & Co. Tato technika přeměňuje kapalné látky na práškový produkt v uzavřeném systému a v jediné výrobní operaci 52).
Prvním krokem přípravy je dispergování látky určené k enkapsulaci ve velmi koncentrovaném (40–60%) vodném nebo organickém roztoku obalového materiálu. Při sprejovém sušení se zpravidla upřednostňuje vodné rozpouštědlo z důvodu možné hořlavosti organických rozpouštědel v uzavřeném systému. Matrice je zpravidla tvořená ve vodě rozpustným polymerem jako například arabská klovatina, želatina, modifikované a hydrolyzované škroby, algináty a další. Přednostně se využívají polymery, které nevytváří příliš husté a viskózní roztoky. Limitní použití je i u látek určených k zapracování do matrice. Používají se materiály s dostatečně vysokou teplotou varu a dobrou rozpustností ve vodě. Poté se disperze rozstřikuje do vyhřáté pracovní komory 28). Odpařováním rozpouštědla z mikrokapek dochází postupně ke zvyšování jejich viskozity, dokud nevzniknou pevné částice. Vysušené mikročástice pak padají na dno pracovní komory a jsou dále transportovány do cyklonového odlučovače prachu, odkud se odebírá finální produkt 48).
Mikročástice připravené touto metodou se vyznačují velkou pórovitostí a velikostí 10–300 μm. Mají tendenci tvořit aglomeráty. Nižší pórovitosti lze dosáhnout přídavkem plastifikátoru, který urychluje splývání kapek polymeru a tvorbu filmu. Vznikají tak sférické mikročástice s hladkým povrchem. Velikost mikročástic může být ovlivněna řadou parametrů, mezi které patří rychlost rozstřikování, velikost atomizační trysky, celková velikost pracovní komory a teplota vzduchu v komoře během sušení 5, 35).
Metoda poskytuje řadu výhod, mezi které patří nízká výrobní cena, vysoká enkapsulační účinnost, poměrně malá velikost a dobrá stabilita 48). Sprejové sušení má i své nevýhody, které souvisí s variabilitou procesních proměnných. Ty by měly být během procesu kontrolovány, aby se předešlo nízkému výtěžku, lepení mikročástic nebo vysokému obsahu vlhkosti 52).
Mikročástice připravené sprejovým sušením s použitím fosfátu betamethasonu jako aktivní látky, chitosanu, želatiny a blokového kopolymeru ethylenoxidu a propylenoxidu vykazovaly vysokou enkapsulační účinnost (95%). Připravené mikročástice splňovaly požadavky kladené pro přívod léčiva do plic a zajišťovaly přívod betamethasonu po dobu 12 hodin 31). Dalším příkladem může být přípravek Parlodel® LAR. Jedná se o mikrosféry s prodlouženým uvolňováním bromokriptinu (inhibitor sekrece prolaktinu, agonista dopaminu) enkapsulovaného uvnitř biodegradovatelného kopolymeru kyseliny mléčné a glykolové určeného pro injekční podání 29).
Sprejové chlazení
Sprejové chlazení je metoda, ve které je léčivá látka dispergována v horké tavenině tuků, vosků, mastných kyselin nebo jejich směsí. Následně se směs vstřikuje do komory se vzduchem, jehož teplota je nižší, než je teplota tání jednotlivých komponent. Základním předpokladem je, že jednotlivé látky mají definovanou teplotu tání, nebo tají v úzkém teplotním rozmezí. Teplota tání používaných materiálů by se měla pohybovat v rozmezí 45–122 °C. V důsledku absence odpařování rozpouštědla během procesu vznikají pevné, málo pórovité mikročástice 53).
Sprejovým chlazením se mohou modifikovat fyzikální a chemické vlastnosti enkapsulovaných látek, například zvýšení rozpustnosti málo rozpustných léčiv. Mezi výhody této metody patří absence rozpouštědla při přípravě a krátká formulační doba. Sprejové chlazení má ovšem i své nevýhody. Léčivo musí být stabilní při teplotě tavení a výsledný produkt se musí uchovávat za speciálních skladovacích podmínek 54). Mikročástice mohou být potom podávány jako náplň tvrdých želatinových tobolek, lisovány do tablet, nebo jako vnitřní fáze suspenzních systémů 53).
Metoda sprejového chlazení lipidových kapek vedla k vývoji lékových forem s modifikovaným uvolňováním theofylinu a ketoprofenu, u kterých byla lipofilní matrice vytvořena ze směsi glycerol-dibehenátu a kyseliny stearové 29). Dalším příkladem mohou být mikročástice na bázi polotuhých lipidů Gelucire 50/13 se špatně rozpustným piroxicamem. Množství uvolněného léčiva i rychlost disoluce byla vyšší ve srovnání s disolucí čisté látky 55). Příprava mikročástic sprejovým chlazením se také využívá pro maskování nepříjemné chuti. Metoda se použila při výrobě mikrosfér na bázi kyseliny palmitové a stearové s kyselinou benzoovou jako modelovým léčivem 56).
Obalování ve fluidní vrstvě
Obalování ve fluidní vrstvě se v praxi používá od šedesátých let 20. století a zavedla ho německá firma Glatt a švýcarská společnost Aeromatic-Fielder 57). Fluidní zařízení využívá fluidní vrstvu, tj. vrstvu částic vznášejících se účinkem proudícího vzduchu, jejíž chování připomíná promíchávanou kapalinu 58). Obalový materiál je ve fluidním zařízení rozstřikován proudem definovanou rychlostí ze zásobníku pomocí pumpy a je rozstřikovány proudem teplého vzduchu o vysokém tlaku, který zároveň nadnáší pevné částice. Kapky dopadají na povrch jader, rozprostírají se na něm a odpařují se. Na povrchu jader postupně krystalizují rozpuštěné látky. Ty jsou kapilárními silami přitahovány k povrchu částic a po odpaření veškerého rozpouštědla se tvoří pevné můstky. Jejich pevnost závisí na vlastnostech léčiva, pojiva a dalších pomocných látek 59, 60).
Existují tři typy fluidních zařízení: zařízení se spodním nástřikem (bottom-spray), zařízení s horním nástřikem (top-spray) a zařízení s tangenciálním nástřikem (tangential-spray), které se liší umístěním trysky. Zařízení se skládají z pracovní komory, ve které fluidují částice pomocí vzduchu přiváděného děrovanou přepážkou na dně komory. V horní části je systém filtrů bránící úletu jemného prášku. Materiál se vlivem fluidizačního vzduchu posunuje do expanzní komory, kde působením gravitační síly spadává zpět do pracovní komory. Nejvíce využívanou metodou při obalování mikročástic je fluidní zařízení se spodním (Wurster) nástřikem 61).
Mezi parametry ovlivňující obalování patří velikost násady mikročástic, jejich fyzikálně-chemické vlastnosti (velikost, tvar, tokové vlastnosti) a vlastnosti léčivé látky. Metoda je vhodná pro obalování mikročástic s velikostí od 30 μm, až po 1–2 mm. Výhodou jsou sférické částice, které mají menší povrch, a tím se zvyšuje účinnost obalování 62). Výhodami fluidních zařízení jsou vysoké výtěžky, stejnoměrnost tloušťky a hustoty vrstvy nanesené na jádra a vysoká reprodukovatelnost procesu 61). Fluidní metodou se enterosolventním obalem Eudragitem® L 30D-55 obalovaly mikročástice připravené metodou extruze-sferonizace. Tyto mikročástice byly testovány jako nosiče antigenu pro perorální vakcinaci selat. Následný rozvoj slizniční imunity by měl potenciálně zabránit infekcím, které způsobuje Escherichia coli 63).
Závěr
Mikročástice jsou intenzivně studovanou oblastí farmaceutické technologie. Redukce nežádoucích účinků a nové metody doručení léčiva na místo působení jsou některé z výhod, které tato léková forma nabízí. Podle narůstajícího počtu publikací v posledních letech lze usuzovat, že jde o lékovou formu s širokým potenciálem využití v nejrůznějších aplikacích. V oblasti farmacie je jejich budoucnost především v roli biodegradovatelného nosiče léčiv různých farmakologických skupin, odstranění některých nežádoucích účinků léčiva a zvýšení biologické dostupnosti léčiva.
Došlo 2. listopadu 2009 / Přijato 11. listopadu 2009
Adresa pro korespondenci:
PharmDr. Martina Bajerová
Ústav technologie léků FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: martina.bajerova@seznam.cz
Sources
Verma, R. K., Mishra, B., Garg, S.: Drug Develop. Ind. Pharm., 2000; 26 (7), 695–708.
2. Chalabala M. et al.: Biogalenika. In: Komárek, P., Rabišková, M.: Technologie léků. 3. vydání. Praha: Galén 2006; 161–190.
3. Vetchý, D., Ceral, J.: Neurol. pro praxi, 2005, 4, 218–220.
4. Gander, B. et al.: Coacervation/Phase Separation. In: Swabrick, J., Boylan, J. C. (ed.) Encyclopedia of Pharmaceutical Technology. 2. vydání, svazek 1. New York: Marcel Dekker Inc. 2002; 481–496.
5. Burgesss, D. J., Hickey, A. J.: Microsphere Technology and Applications. In: Swarbrick, J., Boylan, J. C. (ed.) Encyclopedia of Pharmaceutical Technology. 2. vydání, svazek 2. New York: Marcel Dekker Inc. 2002; 1783–1793.
6. Mathiowitz, E., Kreitz, M. R., Brannon-Peppas, L.: Microencapsulation. In: Mathiowitz, E. (ed.). Encyclopedia of Controlled Drug Delivery, svazek 2. New York: John Wiley & Sons Inc. 1999; 493–546.
7. Krejčová, K., Gryzcová, E., Rabišková, M.: Chem. Listy, 2009; 103, 81–87.
8. Jang, J. B., Sung, J. H., Choi, H. J.: J. Mater. Sci., 2005; 40, 1031–1033.
9. Thies, C.: A Survey of Microencapsulation Processes. In: Benita, S. (ed.). Microencapsulation: Methods and Industrial Applications. New York: Marcel Dekker Inc. 1996; 1–9.
10. Rabišková, M.: Praktické Lékárenství, 2005; 1, 29–30.
11. Sinha, V. R., Trehan, A.: J. Control Release, 2003; 90, 261–280.
12. Arshady, R.: J. Microencapsul., 1993; 10(4), 413–435.
13. Prata, A. S. et al.: Colloid Surfaces B 2008; 67, 171–178.
14. El-Gibaly, I.: Int. J. Pharm., 2002; 232, 199–211.
15. Tuovinen, L. et al.: Biomaterials, 2004; 25, 4355–4362.
16. Patel, Z. S., et al.: Acta Biomaterialia, 2008; 4, 1126–1138.
17. Mladenovska, K.: Int. J. Pharm., 2007; 342, 124–136.
18. Agnihotri, S. A., Aminabhavi, T. M.: J. Control Release, 2004; 96, 245–259.
19. Zhao, A., Rodgers, V. G. J.: J. Control Release, 2006; 113, 15–22.
20. Bazzo, G. C., Lemos-Senna, E., Pires, A. T. N.: Carbohyd Polymer, 2009; 77, 839–844.
21. Liu, J., Chan, S. Y., Ho, P. C.: J. Pharm. Pharmacol., 2002; 54(9), 1205–1212.
22. Trapani, A. et al.: Eur. J. Pharm. Sci., 2007; 30, 64–74.
23. Salama, R. O. et al.: J. Pharm. Sci., 2009; 98, 2709–2717.
24. Salonen, J. et al.: J. Control Release, 2005; 108, 362–374.
25. Albertini, B. et al.: J. Control Release, 2004; 100, 233–246.
26. Dvořáčková, K. et al.: Čes. a slov. Farm., 2008; 57, 269–274.
27. Savolainen, M. et al.: Int. J. Pharm., 2002; 244, 151–161.
28. Thies, C.: Microencapsulation: what it is and purpose. In: Vilstrup, P. (ed.). Microencapsulation of food ingredients. 1. vydání. Surrey: Leathered Publishing LFRA Lim. 2001; 1–30.
29. Richard J., BenoĒt J. P.: Techniques de l’Ingénieur, 2000; J 2210, 1–20.
30. Al-Omran, M. F. et al.: J. Microencapsul, 2002; 19(1), 45–52.
31. Fernandes, J. C., Tiera, M. J., Winnik, F. M.: DNA-Chitosan Nanoparticles for Gene Therapy: Current Knowledge and Future Trends. In.: Kumar, Ch. S. S. R. (ed.). Biological and Pharmaceutical Nanomaterials. 1. vydání. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA 2006; 68–113.
32. Yu, C-Y. et al.: Int. J. Pharm., 2008; 357, 15–21.
33. Setty, C. M., Sahoo, S. S., Sa, B.: Drug Develop. Ind. Pharm., 2005; 31, 435–446.
34. Mi-Lan, K. et al.: J. Microbiol Biotechnology, 2008; 18(6), 1179–1185.
35. Park, K., Yeo, Y.: Microencapsulation Technology. In: Swarbrick, J. (ed.), Encyclopedia of Pharmaceutical Technology. 3. vydání, svazek 2. New York: Marcel Dekker Inc. 2007; 2315–2326.
36. Yegin, B. A. et al.: J. Microencapsul, 2007; 24(4), 371–382.
37. Persico, P. et al.: J. Microencapsul, 2005; 22(5), 471–486.
38. Freitas, S., Merkle, H. P., Gander, B.: J. Control Release, 2005; 102, 313–332.
39. Rosca, I. D., Watari, F., Motohiro, U.: J. Control Release. 2004; 99, 271–280.
40. Benoit, J.-P. et al.: Biodegradable Microspheres: Advances in Production Technology. In: Benita, S. (ed.). Microencapsulation: Methods and Industrial Applications. New York: Marcel Dekker Inc. 1996; 35–72.
41. Agnihotri, S. M., Vavia, P. R.: Drug Develop. Ind. Pharm 2009; 35(9), 1043–1047.
42. Auweter, H.: Multiple-Core Encapsulation. Double Emulsion. In: Vilstrup, P. (ed.). Microencapsulation of food ingredients. 1. vydání. Surrey: Leathered Publishing LFRA Lim. 2001; 145–150.
43. Hachicha, W., Kodjikan, L., Fessi, H.: Intal. J. Pharm., 2006; 324, 176–184.
44. Karatas,, A. et al.: J. Microencapsul, 2009; 26(1), 63–74.
45. Lamprecht, A. et al.: Europ. J. Pharm. Biopharm., 2004; 58, 37–43.
46. Mana, Z., Pellequer, Y., Lamprecht, A.: Int. J. Pharm., 2007; 338, 231–237.
47. Morkhade, D. M. et al.: AAPS PharmSciTech, 2007; 8(2), E1–E9.
48. Madene, A. et al.: Int. J. Food Sci. Technol., 2006; 41, 1–21.
49. Rabišková, M.: Multiple-core encapsulation, Extrusion technology. In: Vilstrup, P. (ed.). Microencapsulation of food ingredients. 1. vydání. Surrey: Leathered Publishing LFRA Lim. 2001; 224–248.
50. Vasishtha, N., Schlameus, H. W.: Single-core encapsulation, Centrifugal Coextrusion Encapsulation. In: Vilstrup, P. (ed.). Microencapsulation of food ingredients. 1. vydání. Surrey: Leathered Publishing LFRA Lim. 2001; 120–132.
51. Esposito, E. et al.: Pharm. Dev. Technol., 2000; 2, 267–278.
52. Bruschi, M. L. et al.: Int. J. Pharm., 2003; 264, 45–55.
53. Hincal, A. A., Kas,, H. S.: Preparation of Micropellets by Spray Congealing. In: Ghebre-Selassie, I. (ed.). Multiparticulary Oral Drug Delivery. New York: Marcel Dekker Inc. 1994; 17–34.
54. Turton, R., Cheng, X. X.: Cooling process and congealing. In: Swabrick, J., Boylan, J. C. (ed.) Encyclopedia of Pharmaceutical Technology. 2. vydání, svazek 1. New York: Marcel Dekker Inc. 2002; 627–640.
55. Sheng, Q., Marchaud, D., Craig, D., Q. M.: J. Pharm. Sci., 2009; in press.
56. Sheng, Q., Deutsch, D., Craig, D. Q. M.: J. Pharm. Sci., 2008; 97(9), 3842–3854.
57. Kristensen, H. G., Schaefer, T.: Granulations, In: Swarbrick, J., Boylan, J. C. (ed.). Encyclopedia of Pharmaceutical Technology, svazek 7. New York: Marcel Dekker Inc. 1991; 121–160.
58. Rabišková, M.: Remedia, 2006; 16, 605–608.
59. Christensen F. N., Bertlesen P.: Drug Develop. Ind. Pharm., 1997; 235, 451–463.
60. Hemati, M., Cherif, R., Saleh, K., Pont, V.: Powder Technol., 2003; 130, 18–34.
61. Švarcová, M., Vetchý, D.: Čes. a slov. Farm., 2007; 56, 67–72.
62. Frey, Ch. R., Hall, H. S.: Single-core encapsulation, Film coating. In: Vilstrup, P. (ed.). Microencapsulation of food ingredients. 1. vydání. Surrey: Leathered Publishing LFRA Lim. 2001; 83–101.
63. Huyghebaert, N. et al.: Europ. J. Pharm. Biopharm., 2005; 9, 273–281.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2009 Issue 5-6-
All articles in this issue
- Methods of preparation of microparticles in pharmaceutical technology
- Hypolipidemic effect of amaranth constituents
- Influence of formulation technology on theophylline release from chitosan-based pellets
- Monitoring of surface cytotoxic drugs in the environment of hospital pharmacies in the Czech Republic
- Contributions to the development of advertising in pharmacy I
- A contribution to the histories of the pharmacies of the Brethren of Mercy in the territory of contemporary Slovakia in the first decades of the 20th century
- Examination of selected quality parameters of the parenteral nutrition AIO – a pilot study
- Antimycobacterial activity of novel derivatives of arylcarbonyloxyaminopropanols
- Comparison of renal accumulation of [DOTA0, 1-Nal3]-octreotide labelled with selected radiometals
- Adhesivity of branched plasticized oligoesters
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Methods of preparation of microparticles in pharmaceutical technology
- Contributions to the development of advertising in pharmacy I
- Examination of selected quality parameters of the parenteral nutrition AIO – a pilot study
- Hypolipidemic effect of amaranth constituents
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

