-
Medical journals
- Career
Štúdium lokálnych anestetík Časť: 187 Extrakcia 1-metyl-2-piperidínoetylesterov alkoxyfenylkarbámových kyselín z ľudskej plazmy polymérmi s odtlačkami molekúl a porovnanie s klasickou extrakciou tuhou fázou*
Authors: J. Čižmárik 2; M. Lachová 1; J. Lehotay 1; I. Skačáni 1
Authors‘ workplace: STU v Bratislave, Fakulta chemickej a potravinárskej technológie, Ústav analytickej chémie 1; Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra farmaceutickej chémie 2
Published in: Čes. slov. Farm., 2009; 58, 78-82
Category: Review Articles
Overview
Zosyntetizovali sa polyméry s odtlačkami molekúl na extrakciu 1-metyl-2-piperidínoetylesterov 2‑metoxyfenylkarbámovej kyseliny, ktorá sa použila ako templát. Pri syntéze sa použili funkčné monoméry akrylamid a kyselina metakrylová. Pripravené polyméry sa testovali ako sorbenty na extrakciu tuhou fázou (MISPE). Študovala sa ich kapacita a selektivita k derivátom 1-metyl-2-piperidínoetylesterov alkoxyfenylkarbámových kyselín, ktoré sú lokálne anestetiká. Zároveň rovnakou metódou sa pripravili polyméry bez použitia templátu, čím sa mohli zistiť nešpecifické interakcie medzi sorbentom a skúmanými látkami. Polymér pripravený pomocou metakrylovej kyseliny sa použil na predkoncentráciu 1-metyl-2-piperidínoetylesteru 2-metoxyfenylkarbámovej kyseliny z ľudskej plazmy, do ktorej sa pridala uvedená látka (1 μg v 1 ml plazmy).
Klúčové slová:
estery alkoxyfenylkarbámových kyselín – HPLC – sorbenty s odtlačkami molekúl – extrakcia tuhou fázouÚvod
Alkoxysubstituované estery fenylkarbámovej kyseliny patria do skupiny potenciálnych liečiv s lokálnymi anestetickými vlastnosťami 1). Niektoré z nich sa extrahovali z ľudskej plazmy, pričom na extrakciu sa použili polyméry s odtlačkami molekúl (MIP). Polyméry s odtlačkami molekúl patria medzi selektívne sorbenty, keďže na svojom povrchu obsahujú kavity s totožnými rozmermi molekúl templátu 2). Polyméry s odtlačkami molekúl sa môžu pripraviť rôznymi spôsobmi napríklad polymerizáciou 3, 4), polymerizáciou v suspenzii 5, 6), precipitačnou polymerizáciou 7, 8), viac krokovou polymerizáciou 9) atď. Polyméry s odtlačkami molekúl sú stabilné v rôznych rozpúšťadlách, sú termostabilné, môžu sa použiť v širokom rozsahu teplôt 10). Môžu sa uskladňovať v suchom stave pri laboratórnej teplote bez straty svojich špecifických vlastností.
V predkladanej práci sa opisuje príprava polymérov s odtlačkami molekúl polymerizačnou metódou, výsledný monolit sa rozdrvil na definované mikročastice, ktoré sa použili ako sorbenty v kolónovom systéme.
Polyméry bez odtlačkov molekúl (NIP) sa pripravili rovnakým spôsobom, bez použitia templátu a použili sa na porovnanie vlastností s polymérmi s odtlačkami molekúl. Rozdiel medzi sorpčnými vlastnosťami MIP a NIP (napríklad v sorpčných kapacitách) potom indikujú vplyv kavít, ktoré boli spôsobené templátom, ktorý sa pridal do polymerizačnej zmesi pri príprave MIP. Ak MIP bola pripravená správne, kavity majú požadované rozmery, potom interakcia medzi MIP a molekulami látky, ktorá sa použila ako templát bude väčšia, nakoľko bude k dispozícii viac sorpčných centier a stérických interakcií, ako v prípade NIP 11).
Prezentovaná skupina derivátov alkoxyfenylkarbámovej kyseliny zahrňuje 30 derivátov s rôznymi alkoxyskupinami od metoxy do decyloxyskupinu v rozdielnych polohách na benzénovom jadre. Teoretické štúdie fyzikálnych, chemických, farmakologických a chromatografických vlastností a biologické aktivity uvedených derivátov sa uvádzajú vo viacerých prácach 1, 12, 13).
Cieľom predkladanej práce je zistiť sorpčné vlastnosti polymérov s odtlačkami molekúl, keď sa použije templát s krátkou alkoxyskupinou (obr. 1). Vyhodnotí sa sorpčná kapacita a selektivita pripravených sorbentov MIP, ako templát sa použije 1-metyl-2-piperidínoetylester 2-metoxyfenylkarbámovej kyseliny. Na základe sorpčnej kapacity látok s podobou chemickou štruktúrou (rozdielna dĺžka a poloha alkoxyskupiny in 1-metyl-2-piperidínoetylesteru alkoxyfenylkarbámových kyselín) sa zistí selektivita pripravených polymérov. Polyméry s odtlačkami molekúl sa potom použijú na extrakciu a predkoncentráciu niektorých derivátov fenylkarbámovej kyseliny z ľudského séra. Na porovnanie selektivity extrakcie na polyméroch s odtlačkami molekúl sa použije klasická extrakcia tuhou fázou typu C18.
Image 1. Štruktúra študovaných látok Templát: R = -CH<sub>3</sub> v polohe 2 (2-MPCA). Ďalšie študované látky: R = -CH<sub>3</sub> v polohe 4 (4-MPCA), R = -C<sub>10</sub>H<sub>21</sub> v polohe 2 (2-DPCA) a R = -C<sub>10</sub>H<sub>21</sub> v polohe 4 (4-DPCA) 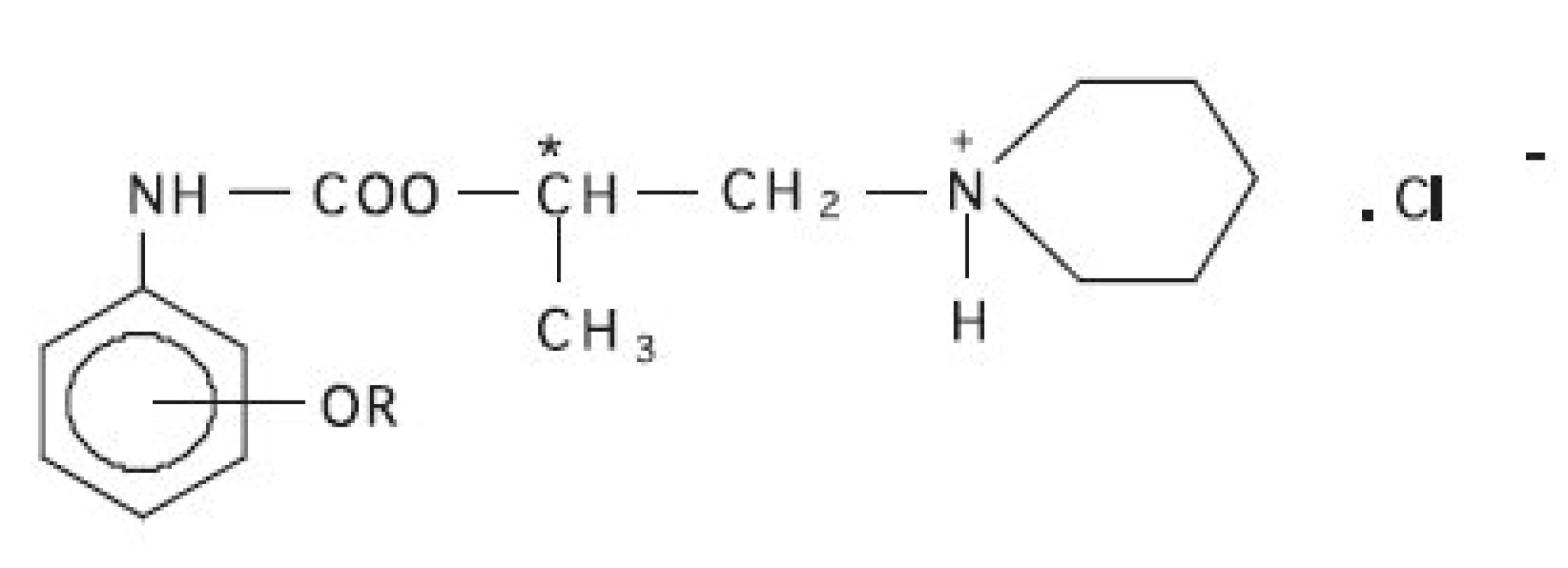
POKUSNÁ ČASŤ
Chemikálie
1-metyl-2-piperidínoetylestery alkoxyfenylkarbámovej kyseliny sa zosyntetizovali na Katedre farmaceutickej chémie, Farmaceutickej fakulty, UK v Bratislave podľa vypracovaného postupu 1). Acetonitril, metanol, metakrylová kyselina a dietylamín boli dodané fy. Merck, akrylamid, azobisizobutylonitril (AIBN) a etylénglykoldimetakrylát (EGDMA) sa získala od fy. Fluka, a kyselina octová sa získala od firmy Lachema. SPE kolónky Sep-Pak C18 boli dodané firmy Waters.
HPLC analýza
V práci sa použil HP 1100 systém (Hewlett-Packard, Germany), ktorý obsahoval vysokotlakové čerpadlo s odplyňovačom, spektrofotometrický detektor s diódovým poľom (DAD), trojcestný dávkovací ventil na 50 μl a HP počítač vybavený softvérom “ChemStation” na vyhodnotenie analýz. Použila sa analytická kolóna Separon SGX C18 (125 × 4 mm, 7 μm) (Watrex, USA), chromatografická separácia sa uskutočnila pri laboratórnej teplote. Mobilnou fázou bola zmes metanolu, acetonitrilu, kyseliny octovej a dietylamínu v objemových pomeroch 80 : 20 : 0.1 : 0,1, v/v/v/v, prietok mobilnej fázy bol 0,5 ml/min. Detekcia sa robila v rozsahu vlnových dĺžok od 190 do 400 nm a chromatografické záznamy sa vyhodnocovali pri vlnovej dĺžke 240 nm.
Príprava polymérov
Polyméry s odtlačkami molekúl sa pripravili metódou podľa Zhanga a spolupracovníkov 14). Zosyntetizovali sa dva polyméry na báze akrylamidu (MIP1) a metakrylovej kyseliny (MIP2), ktoré sa použili pri syntéze ako funkčné monoméry. Do reakčnej banky sa pridal monomér (1,8 mmol), templát 1-metyl-2-piperidínoetylester 2-metoxyfenylkarbámovej kyseliny (0,3 mmol) a porogén acetonitril (3 ml). Potom sa pridal EGDMA (9 mmol) a iniciátor polymerácie AIBN (9 mg). Polymerácia sa uskutočnila pri 60 oC na vodnom kúpeli počas 24 hodín. Po vysušení a rozomletí polyméru sa polymér preosial cez sito s otvormi 40 μm, veľmi malé častice sa odstránili flotáciou v acetóne a konečný produkt sa vysušil vo vákuu pri teplote 60 °C, čas sušenia bol 1 hodina. Templát z povrchu častíc polyméru sa odstránil Soxhletovým extrakčným zariadením, extrakcia sa uskutočnila zmesou metanolu a kyseliny octovej (9 : 1, v/v) objemom 70 ml až dovtedy, kým v extrakte sa už nenachádzal templát. Rovnaký postup sa použil aj na prípravu kontrolného polyméru bez odtlačkou molekúl templátu (NIP) s tým rozdielom, že pri polymerácii sa nepridával templát do polymerizačnej zmesi.
Zhodnotenie sorpčných vlastností MIP a NIP
Na naplnenie malej kolónky (objem 3 ml) z polypropylénu sa použilo 100 mg polyméru. Sorpčná kapacita kolónky sa merala v metanole, acetonitrile a vo vode. Pred nadávkovaním roztoku esteru 4-metoxyfenylkarbámovej kyseliny (2-MPCA), ktorý sa použil ako templát pri príprave polyméru, sa polymér v kolóne premyl 5 ml metanolu a potom sa nadávkoval roztok 2-MPCA (alebo inej látky, pre ktorú sa zisťovala kapacita kolónky). 2 MPCA sa postupne dávkoval do kolónky dovtedy, kým v eluáte sa nezistila prítomnosť 2-MPCA , čo indikovalo, že polymér už nie je schopný sorbovať ďalšie množstvo. Eluát sa zachytával vo forme 1 ml frakcií a každá frakcia sa analyzovala metódou HPLC. Koncentrácia 2-MPCA v acetonitrile a metanole bola 20 μg/ml.
Rovnakým spôsobom ako v prípade templátu sa zisťovala sorpčná kapacita kolóny pre štruktúrne podobné látky – ester 2-decyloxyfenylkarbámovej kyseliny (2 DPCA) a 4-metoxyfenylkarbámovej kyseliny (4 MPCA). Koncentrácia roztokov 4-MPCA a 2-DPCA bola 20 μg/ml.
Pracovný postup pri extrakcii
Do polypropylénovej kolóny sa dalo 100 mg polymérov MIP2 alebo NIP2. Na porovnanie selektivity extrakcie sa použila C18 kolónka pre extrakciu tuhou fázou (SPE). Kolónky sa najprv premyli 5 ml metanolu potom 5 ml acetonitrilu a nakoniec 5 ml vody. Potom sa do každej kolónky nadávkovalo 5 ml ľudskej plazmy s prídavkom štandardu. Koncentrácia študovaných analytov (2 MPCA, 4-MPCA, 2-DPCA a 4-DPCA) v plazme bola 1 μg/ml. Potom sa kolónky premyli 2 ml vody a vysušili sa. Suchý sorbent v kolónke sa premyl 1 ml acetonitrilu a a opäť sa vysušil. Analyty sa desorbovali z kolónky 2 ml zmesi metanol-kyselina octová (95 : 5, v/v). Eluát sa vákuovo odparil do sucha a rozpustil sa v 0,5 ml metanolu. Týmto postupom pridané analyty do séra sa môžu skoncentrovať 10×, čím sa zníži hodnota medze stanovenia tiež 10×. Extrakty sa prefiltrovali nylónovým mikrofiltrom (0,45 μm) a dávkovali sa do chromatografickej kolóny.
Výsledky a diskusia
Sorpčná kapacita pripravených polymérov
Sorpčná kapacita kolón naplnených MIP sa merala v rôznych rozpúšťadlách: v metanole, v acetonitrile a vo vode. Pred použitím sa kolónky prepláchli metanolom a potom sa dávkoval roztok analytu. Rovnaký postup sa použil aj pre kolónky naplnené s NIP. Sorpčné kapacity jednotlivých kolóniek pre templát sú uvedené v tabuľke 1. Špecifická sorpčná kapacita sa vypočítala z rozdielu sorpčných kapacít MIP a príslušného NIP.
Table 1. Sorpčné kapacity pripravených polymérov pre 2-MPCA (templát) v rôznych rozpúšťadlách (RSD = ± 5–14 %, n = 3) 
*Špecifická sorpčná kapacita sa vypočítala odčítaním množstva látky sorbovaného na NIP od množstva látky sorbovaného na MIP, Z tabuľky 1 je zrejmé, že najlepšia špecifická sorpčná kapacita pre 2-MPCA (templát) sa dosiahla v prípade MIP2 v acetonitrile, ktorý sa použil ako porogén pri polymerizácii. Kavity v polymére sa vytvárali v prostredí acetonitrilu a ich rozmery súvisia s rozmermi solvatovaných molekúl 2-MPCA práve v tomto prostredí. Možno predpokladať, že z tohto dôvodu sa dosiahla najvyššia špecifická sorpcia v acetonitrile. V prostredí metanolu je hodnota špecifickej sorpcie oveľa menšia, nakoľko solvatácia molekúl v tomto rozpúšťadle je iná a tým i rozmery solvatovaných molekúl budú rozdielne. Vysoká sorpčná kapacita 2-MPCA na MIP2 vo vodnom prostredí indikuje možnosť aj iných sorpčných mechanizmov, ktoré nie sú špecifické. V prípade MIP1 sa nedosiahla žiadna špecifická sorpcia 2-MPCA čo naznačuje, že i zloženie polyméru má podstaný vplyv na sorpčné mechanizmy. Podobne ako v predchádzajúcom prípade sa dosiahla vysoká sorpčná kapacita vo vode (ale nie špecifická), čo umožňuje použiť vodu ako extrakčné médium a následnou sorpciou na uvedených polyméroch zachytiť skúmané analyty, ktoré potom možno vymyť z kolónky metanolom.
Selektivita MIP
V ďalšej časti práce sa sledovala len selektivita MIP2, ktorá sa testovala pomocou dvoch štruktúrne podobných látok zo skupiny esterov alkoxyfenylkarbámových kyselín s rozdielnou dĺžkou reťazca a polohou alkoxyskupiny na benzénovom jadre. Vplyv dĺžky alkoxyskupiny na selektivitu MIP2 sa skúmal na základe špecifickej sorpčnej kapacity 1-metyl-2-piperidínoetylesteru 2-decyloxyfenylkarbámovej kyseliny (2-DPCA). Vplyv polohy alkoxyskupiny sa sledoval skúmaním sorpčných vlastností 1-metyl-2-piperidínoetylesteru 4-metoxyfenylkarbámovej kyseliny (4-MPCA). Polymér MIP2 sa najprv premyl metanolom a acetonitrilom a potom sa postupne dávkoval roztok skúmaného analytu do kolónky. Sorpčná kapacita MIP2 sa porovnávala so sorpčnou kapacitou NIP2, aby sa zistila špecifická sorpčná kapacita pre skúmané analyty. Výsledky meraní sa uvádzajú v tabuľke 2.
Table 2. Sorpčné kapacity pripravených polymérov pre dané látky v acetonitrile (RSD = ± 4–10 %, n = 3) 
*Špecifická sorpčná kapacita sa vypočítala odčítaním množstva látky sorbovaného na NIP od množstva látky sorbovaného na MIP. Výsledky uvedené v tabuľke 2 dokumentujú najväčšiu sorpčnú kapacitu pre 2-MPCA, čo sa očakávalo, nakoľko táto látka sa použila ako templát pri príprave MIP2. Hodnota špecifickej sorpčnej kapacity pre 4-MPCA bola približne rovnaká ako pre templát. Tieto látky sú veľmi štruktúrne podobné, rozdiel je len v polohe alkoxyskupiny na benzénovom jadre. Na druhej strane hodnota špecifickej sorpčnej kapacity bola menšia pre 2-DCPA ako pre 2-MPCA, čo je zrejme spôsobené dĺžkou alkoxyskupiny na benzénovom jadre. Z uvedeného vyplýva, že sorpčná kapacita súvisí viacej s rozmermi alkoxyskupiny (metoxyskupina je oveľa kratšia ako decyloxyskupina) ako s jej polohou, čo dokazuje dôležitosť predovšetkým stérických interakcií.
Analýza vzorky ľudskej plazmy
Do vzorky ľudskej plazmy sa pridali 2-MPCA, 4 MPCA, 2-DPCA a 4-DPCA, koncentrácia každej látky v plazme bola 1 μg/ml. Na prípravu vzorky k analýze sa pripravili kolónky C18, MIP2 a NIP2, čo umožnilo porovnanie špecifickej sorpcie uvedených látok v rôznych kolónkach. Kolónka typu C18 patrí medzi najbežnejšie kolónky používané na predkoncentráciu a odstraňovanie možných interferujúcich látok pri chromatografickej separácii, nevýhodou tejto predkolónky je malá selektivita. Kolónky sa najprv premyli metanolom, acetonitrilom a vodou, potom sa nadávkovala vzorka ľudskej plazmy. Po nadávkovaní vzorky sa premyli kolónky deionizovanou vodou, a sorbované látky sa vytesnili zmesou 0,5 ml metanolu a kyseliny octovej (95 : 5, v/v). Eluát sa vákuovo odparil do sucha, odparok sa rozpustil v 0,5 ml metanolu a roztok sa dávkoval do chromatografickej kolóny typu C18. Chromatografické záznamy vzoriek ľudskej plazmy bez prídavku a s prídavkom skúmaných látok použitím kolóniek C18, MIP2 a NIP2 sa uvádzajú na obrázkoch 2, 3 a 4. Účinnosť extrakcie uvedených látok zo vzorky ľudskej plazmy pre každú kolónku sa uvádzajú v percentách v tabuľke 3.
Image 2. Chromatografické záznamy vzorky ľudskej plazmy bez pridania študovaných látok po SPE na MIP2 (a), vzorky ľudskej plazmy po pridaní študovaných látok (1 μg/ml) po SPE na MIP2 (b), zmes štandardov (metanolický roztok, 10 μg/ml každého analytu) (c) Kolóna: Separon SGX C18. Mobilná fáza: metanol/acetonitril/ kyselina octová/dietylamín (80/20/0.1/0.1, v/v/v/v), izokratická elúcia. Prietok 0,5 ml/min. Detekcia DAD, 240 nm. Dávkovaný objem 50 μl. 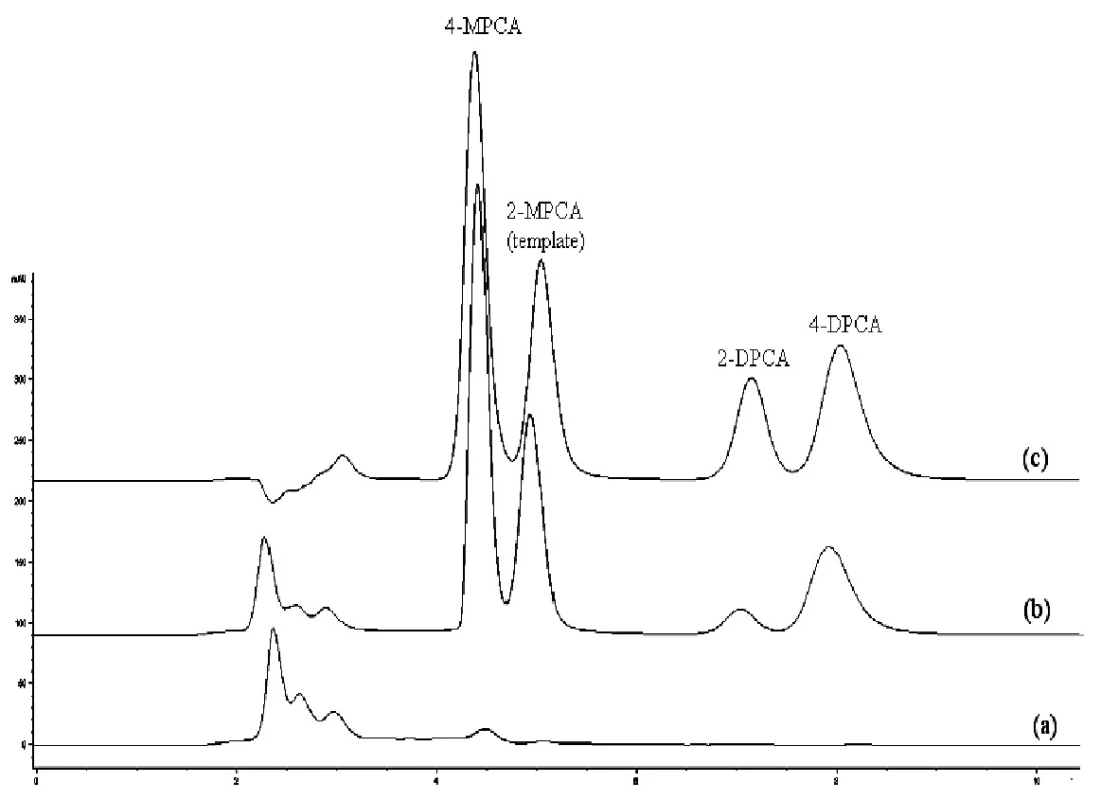
Image 3. Chromatografické záznamy vzorky ľudskej plazmy bez pridania študovaných látok po SPE na sorbente typu C18 (a), vzorky ľudskej plazmy po pridaní študovaných látok (1 μg/ml) po SPE na MIP2 (b), zmes štandardov (metanolický roztok, 10 μg/ml každého analytu) (c) Kolóna: Separon SGX C18. Mobilná fáza: metanol/acetonitril/ kyselina octová/dietylamín (80/20/0.1/0.1, v/v/v/v), izokratická elúcia. Prietok 0,5 ml/min. Detekcia DAD, 240 nm. Dávkovaný objem 50 μl. 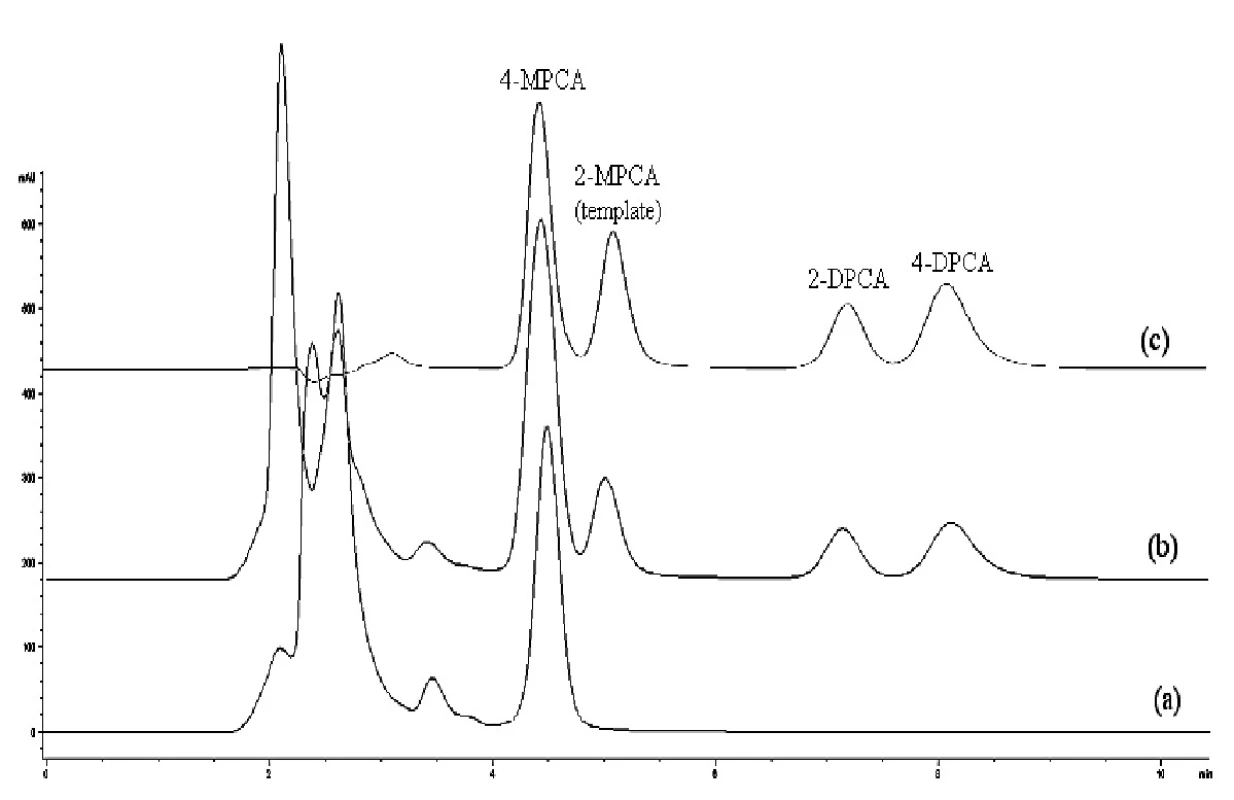
Z porovnania jednotlivých chromatografických záznamov vyplýva, že najlepšie sú odstránené interferujúce zložky pri použití kolónky MIP2. Na chromatografickom zázname vzorky ľudskej plazmy po použití SPE C18 (obr. 3a) je vidieť interferujúci pík neznámej látky, s rovnakým elučným časom ako 4-MPCA, čo dokumentuje, že táto látka pri použití C18 kolónky nemôže sa stanoviť. V prípade použitia kolónky MIP2 (obr. 2a) nedochádza k interferencii neznámej látky s 4-MPCA nakoľko táto látka je odstránená. Ak sa použije kolónka NIP2, účinnosť extrakcie je nižšia ako pri MIP2 i keď nedochádza k interferencii neznámej látky s 4-MPCA (obr. 4).
Image 4. Chromatografické záznamy vzorky ľudskej plazmy bez pridania študovaných látok po SPE na NIP2 (a), vzorky ľudskej plazmy po pridaní študovaných látok (1 μg/ml) po SPE na MIP2 (b), zmes štandardov (metanolický roztok, 10 μg/ml každého analytu) (c) Kolóna: Separon SGX C18. Mobilná fáza: metanol/acetonitril/ kyselina octová/dietylamín (80/20/0.1/0.1, v/v/v/v), izokratická elúcia. Prietok 0,5 ml/min. Detekcia DAD, 240 nm. Dávkovaný objem 50 μl. 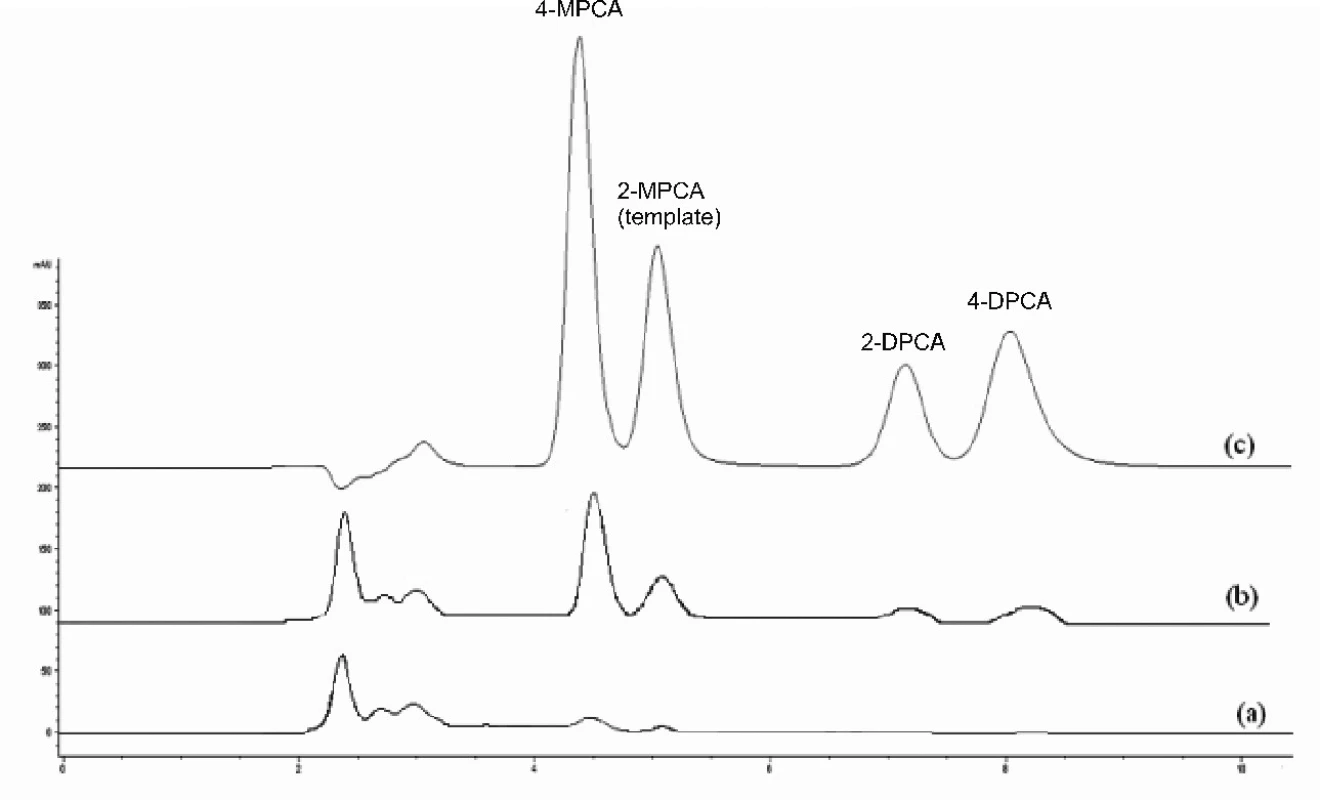
Účinnosť extrakcie templátu (2-MPCA) u štruktúrne podobnej látky 4-MPCA (rozdiel je len v polohe metoxyskupiny) pomocou MIP2 je viac ako 90 %. Účinnosť extrakcie pre látky s decyloxyskupinou (2-DPCA a 4 DPCA) je nižšia, čo je zrejme spôsobené väčším objemom molekúl. Porovnanie účinnosti extrakcie jednotivých kolóniek jednoznačne dokumentuje, že najlepšia účinnosť sa dosiahla na sorbente MIP2 (tab. 3).
Table 3. Účinnosť extrakcie daných látok zo vzorky ľudskej plazmy pomocou pripravených polymérov v % (RSD = ± 5–8 %) 
* interferencia s neznámou látkou z plazmy Imprintované polyméry s odtlačkami molekúl sa môžu úspešne použiť na selektívnu extrakciu tuhou fázou. Selektivita a kapacita závisí od výberu funkčného monoméru, porogénu (rozpúšťadlo, v ktorom sa uskutočňuje polymerácia) a templátu (spravidla analyt, ktorý sa stanovuje vo vzorke). Na základe dosiahnutých výsledkov možno konštatovať, že rozhodujúcim interakčnýcm mechanizmom boli stérické efekty, čo sa potvrdilo závislosťou špecifickej sorpčnej kapacity od objemu molekúl. Imprintované polyméry s odtlačkami molekúl možno úspešne použiť na selektívnu extrakciu tuhou fázou látok z biologických vzoriek, čo je v porovnaní s klasickou extrakciou na tuhej fáze typu C18 oveľa výhodnejšie.
Táto práca vznikla vďaka finančnej podpore Grantovej agentúry Slovenskej republiky (grant 1/0058/08), APVV projekt No. 20-035-205 a VEGA projekt č.1/4291/07.
Došlo 23. března 2009/ Přijato 8. dubna 2009
Adresa pre korešpondenciu:
prof. RNDr. Jozef Čižmárik, PhD.
Katedra farmaceutickej chémie FaF UK
Odbojárov 10, 832 32 Bratislava, SR
e-mail: cizmarik@fpharm.uniba.sk
Sources
1. Pokorná, M., Čižmárik, J., Sedlárová, E., Račanská, E.: Čes. a slov. Farm., 1999; 45, 80–86.
2. Caro, E., Marcé, RM., Borrull, F., Cormack, PAG., Sherrington, D. C.: Trac – Trends Anal. Chem, 2006; 25, 143–154.
3. Sun, Z., Schüssler, W., Sengl, M., Niessner, R., Knopp, D.: Anal. Chim. Acta, 2008; 620, 73–81.
4. Yavuz, H., Karakoc, V., Türkmen, D., Say, R., Denizli, A.: Int. J. Biol. Macromol., 2007; 41, 8–15.
5. Shi, X., Wu, A., Zheng, S., Li, R., Zhang, D.: J. Chromatogr. B., 2007; 850, 24–30.
6. Peréz-Moral, N., Mayes, AG.: Biosens. Bioelectron., 2006; 21, 1798–1803.
7. Tasselli, F., Donato, L., Drioli, E. J.: J. Membr. Sci., 2008; 320, 167–172.
8. Turiel, E., Martín-Esteban, A., Tadeo, J. L.: J. Chromatogr. A., 2007; 1172, 97–104.
9. Haginaka, J., Tabo, H., Kagawa, C.: J. Pharm. Biomed. Analysis, 2008; 46, 877–881.
10. Fischer, L., Muller, R., Ekberg, B., Mosbach, K.: J. Am. Chem. Soc., 1991; 113, 9358–9360.
11. Pichon, V.: J Chromatogr. A., 2007; 1152, 41–53.
12. Ďungelová, J., Lehotay, J., Hroboňová, K., Čižmárik, J., Armstrong, D. W: J. Liq. Chromatogr., 2002; 25, 299–312.
13. Rojkovičová, T., Hroboňová, K., Lehotay, J., Čižmárik, J.: Pharmazie, 2003; 58, 108–110.
14. Zhang, T., Liu, F., Chen, W., Wang, J., Li, K.: Anal. Chim. Acta., 2001; 450, 53–61.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2009 Issue 2-
All articles in this issue
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Beta-blokátory
- HPLC štúdium vplyvu teploty na separáciu niektorých enantiomérov sulfoxidov, stanovenie niektorých enantiomérov sulfoxidov v sére potkana
- Štúdium lokálnych anestetík Časť: 187 Extrakcia 1-metyl-2-piperidínoetylesterov alkoxyfenylkarbámových kyselín z ľudskej plazmy polymérmi s odtlačkami molekúl a porovnanie s klasickou extrakciou tuhou fázou*
- Využitie rádionuklidovej röntgenofluorescenčnej analýzy pri stanovení obsahu ťažkých kovov v dextránoch v tuhom a kvapalnom skupenstve
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- Produkce isoflavonoidů v suspenzní kultuře Trifolium pratense L.
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Beta-blokátory
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- Využitie rádionuklidovej röntgenofluorescenčnej analýzy pri stanovení obsahu ťažkých kovov v dextránoch v tuhom a kvapalnom skupenstve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

