-
Medical journals
- Career
Látky ovlivňující aktivitu kaspas
Authors: T. Bartl; P. Žádníková; R. Jiříkovská; B. Maroušková; L. Beneš
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav chemických léčiv
Published in: Čes. slov. Farm., 2008; 57, 29-34
Category: Original Articles
Overview
Kaspasy jsou enzymy sehrávající klíčovou roli v programované buněčné smrti – apoptóze. Dysregulace tohoto procesu vede k řadě onemocnění, na jejichž patogenezi se podílí apoptóza. Nemoci lze rozdělit do dvou skupin: na onemocnění s patologickou inhibicí apoptózy (nádorová onemocnění, některé autoimunitní nemoci) a onemocnění s patologickou indukcí apoptózy (neurodegenerativní onemocnění, AIDS). Práce uvádí přehled nejdůležitějších zástupců aktivátorů a inhibitorů kaspas, které apoptózu řídí, a jsou proto v současnosti intenzivně studovány. Spektrofotometricky byl stanoven vliv skupiny derivátů stobadinu, theofylinu a adeninu na aktivitu kaspasy 1. Studované sloučeniny vykázaly inhibiční aktivitu vůči testovanému enzymu, která u jednoho z derivátů překročila 80 %.
Klíčová slova:
kaspasy – aktivace – inhibice – apoptóza – deriváty stobadinu, theofylinu, adeninuÚvod
Buňka je základní funkční jednotkou každého živočišného či rostlinného organismu, splňuje jeho základní funkce, jako jsou růst, rozmnožování, metabolismus, pohyb a dědičnost. Normální buňka prodělává za fyziologických podmínek určité funkční i morfologické změny dané jejím genetickým programem. Pro správnou funkci organismu jako celku je důležitý nejen správný vznik a rozvoj buňky, ale i její včasný zánik. Zánik buňky může nastat nejenom jako konečný důsledek závažného poškození buňky, který se označuje jako nekróza, ale může být naprogramován se záměrem normální eliminace již nepotřebných buněk. V tomto případě mluvíme o apoptóze.
Apoptóza a nekróza se liší způsobem podmínek, za kterých probíhají, příčinami vzniku a množstvím postižených buněk 1). Nekróza probíhá za nepříznivých podmínek a dochází při ní k odumírání buněk většího rozsahu. Je způsobena náhodným poškozením buněk a navazující zánětlivou reakcí. V časné fázi nekrózy jsou narušeny buněčné membrány a buňky začnou „bobtnat“. Později dochází k rozpadu plazmatické a jaderné membrány a nastane únik vnitřního obsahu do okolí; tím se navodí zánětlivá reakce a nakonec rozpad postižené buňky 2–5). Apoptóza probíhá za fyziologických podmínek jako programovaný zánik buněk během embryogeneze, hormon dependentní involuce u dospělých 3). Sehrává centrální roli ve vývoji a v homeostáze živočichů a rostlin a je podkladem řady fyziologických i patologických mechanismů. Slovo apoptóza pochází z řečtiny: apo = od, ptein = padat. Je geneticky řízeným procesem, který je regulován vnějšími a vnitřními faktory. Pro buňku podléhající apoptóze jsou charakteristické morfologické a biochemické rysy, například ztráta asymetrie buněčné membrány, kondenzace chromatinu, zmenšení jádra, štěpení DNA, svrašťování buňky a nakonec její rozpad na apoptotická tělíska, která jsou pohlcena příslušnými buňkami bez vzniku zánětlivé reakce 3, 5–8) (tab. 1).
Table 1. Charakterizace nekrotické a apoptotické smrti 4, 7, 9, 10) 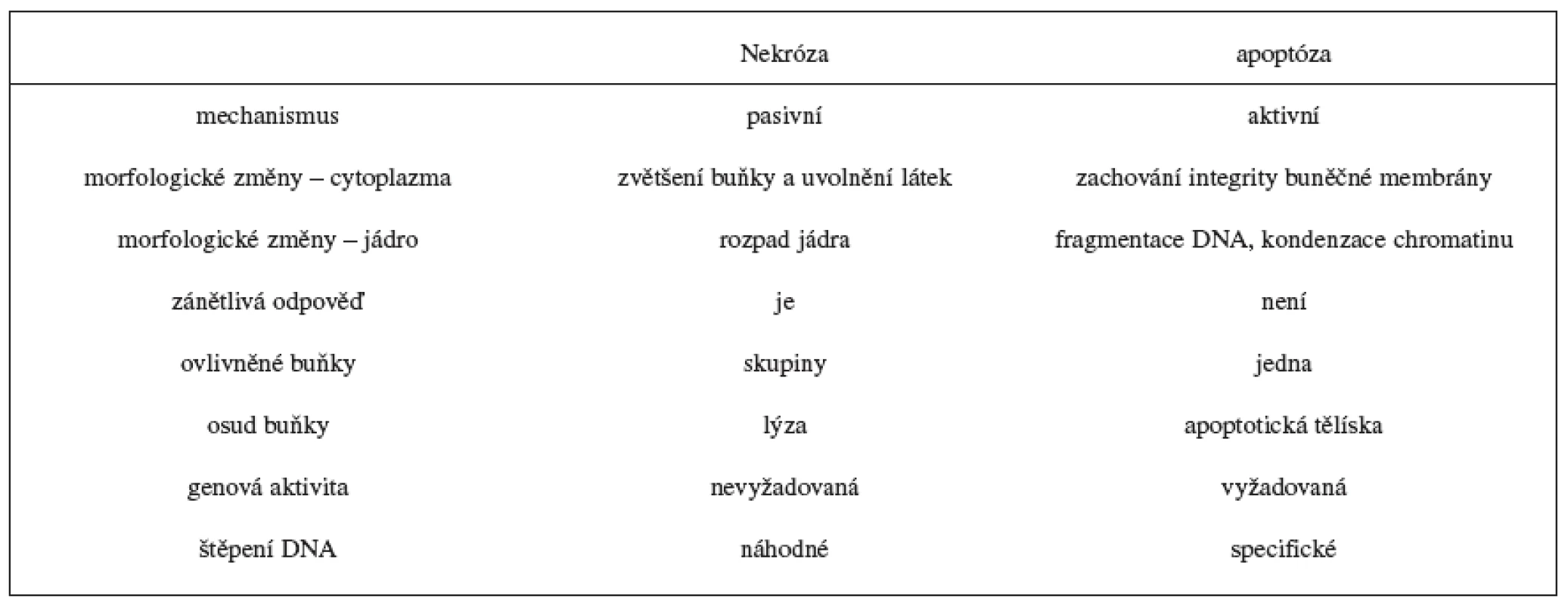
Mechanismus apoptózy
Proces apoptózy nastává proteolýzou pro buňku životně důležitých intracelulárních bílkovin. Enzymy, které tuto proteolýzu katalyzují (nebo aktivují jiné efektorové molekuly), se nazývají kaspasy. K aktivaci kaspas vedou dvě cesty. První, vnější, nastává po navázání ligandu na membránový „receptor smrti“ s následnou indukcí „buněčnou smrt navozujícího signalizačního komplexu“. Ten dává vzniknout aktivním kaspasam 8 a 10, které pak aktivují efektorové prokaspasy 3, 6, 7. Druhá, vnitřní cesta apoptózy, je způsobena poškozením vnější mitochondriální membrány, s následným uvolněním mitochondriálních proteinů. Jedním z nich je cytochrom c, který v cytosolu spouští tvorbu apoptosomu – molekulární základny složené z Apaf-1 (Apoptosis proteases--activating factor-1), dATP, cytochromu c. Uvedené děje ústí v aktivaci kaspasy 9, která štěpí a aktivuje efektorové prokaspasy 11–14). Vnitřní cesta apoptózy je regulována pro - a protiapoptotickými geny z rodiny Bcl-2, a tudíž kanálovými proteiny BclX a Bcl2, které udržují normální funkci mitochondriální membrány. Regulace jejich aktivity hraje centrální úlohu při apoptóze. Inhibicí této aktivity se změní permeabilita mitochondriální membrány, což vede k uvolnění cytochromu c z mitochondrií do cytosolu 13, 15 – 17).
Kaspasy
Termín KASPASA (caspasa) patří mezi tzv. zkratková slova (Cysteinyl Aspartate Specific ProteinaseS) 18).Jedná se o rodinu proteolytických enzymů – cysteinových proteas štěpících proteinovou molekulu s cysteinem v katalytickém místě na fragmenty se zbytky kyseliny asparagové. Kaspasy hrají ústřední roli v procesu apoptózy 19, 20).
Struktura a klasifikace kaspas
Vztah kaspas k apoptóze byl objeven v souvislosti s výzkumem červa Caenorhabditis elegans, přičemž bylo prokázáno, že produkt genu ced-3 je homologní se savčím interleukin-1 ß-konvertujícím enzymem (ICE, kaspasa 1). Později byla objevena celá řada příbuzných enzymů nazývaných kaspasy 2–14 21, 22).
Kaspasy mají podobnou sekvenci aminokyselin, strukturu a substrátovou specifitu. Všechny jsou exprimovány jako proenzymy a obsahuji tři hlavní domény: NH2 terminální doménu, velkou podjednotku (20 kD) a malou podjednotku (10 kD). NH2 terminální doména je vysoce variabilní a hraje roli v regulaci aktivace; velká a malá podjednotka tvoří po rozštěpení heterodimery. Kaspasy mají společný koncový pentapeptid QACXG, ve kterém X může být: R – arginin, Q – glutamin, D – kyselina asparagová (A – alanin, C – cystein, G – glycin). K proteolýze substrátu je v místě štěpení nezbytně nutná přítomnost kyseliny asparagové 22, 23).
Dělení kaspas dle funkce se prolíná s jejich dělením dle substrátové specifity:
- Kaspasy iniciační – jsou aktivovány v počáteční fázi apoptózy (kaspasa 2, 8, 9 a 10).
- Kaspasy efektorové (exekuční) – jsou to výkonné kaspasy, které jsou aktivovány v efektorové fázi (kaspasy 3, 6, 7).
- Kaspasy zánětu (inflamatorní) – jsou považovány za mediátory, účastnící se zánětu a nekrózy (kaspasa 1, 4, 5, 11, 12, 13, 14) 24–26).
Kaspasy důležité pro apoptózu zahrnují kaspasy 2, 3, 6, 7, 8 a 10. Hlavními regulátory aktivity kaspas je aktivace kaspasy 8 při indukci apoptózy receptorovou cestou, a aktivace kaspasy 9 při indukci apoptózy nereceptorovou cestou. Obě tyto kaspasy pak indukují aktivaci ostatních prokaspas 19, 24).
Kaspasy jsou syntetizovány v inaktivní formě jako proenzymy. Aktivovány jsou buď autokatalytickým štěpením, nebo jinými proteasami. Prokaspasa je ve specifických místech Asp-X štěpena, dochází k odštěpení CARD, DED domén, rozštěpení malé a velké podjednotky. Malá a velká podjednotka se pak společně váží za vzniku aktivního tetrameru 27, 28).
Patologické projevy apoptózy
Studium programované buněčné smrti se stalo v posledních letech objektem výzkumného zájmu, především z důvodů rozpoznání základní role, kterou apoptóza hraje v normálním vývoji organismu a stejně tak v jeho patofyziologii vedoucí k vývoji mnoha chorob. Tato onemocnění je možné rozdělit do dvou skupin – onemocnění s patologickou inhibicí apoptózy a onemocnění s patologickou indukcí apoptózy 10).
Do první skupiny zařazujeme onemocnění, ve kterých je apoptóza potlačena (tab. 2). Dochází tak k nekontrolovanému bujení buněk a nedostatečnému odstraňování starých, nepotřebných nebo poškozených buněk. Mezi onemocnění s patologickou inhibicí apoptózy patří nádorová onemocnění (folikulární lymfomy, karcinomy s mutací genu p53, hormon dependentní nádory, jako jsou karcinomy mléčné žlázy, prostaty a vaječníku), autoimunitní choroby (systémový lupus erythematodes, některé typy glomerulonefritid) a virové infekce (způsobené herpesviry a poxviry) 29, 30).
Table 2. Onemocnění související s inhibicí apoptózy 30–32) 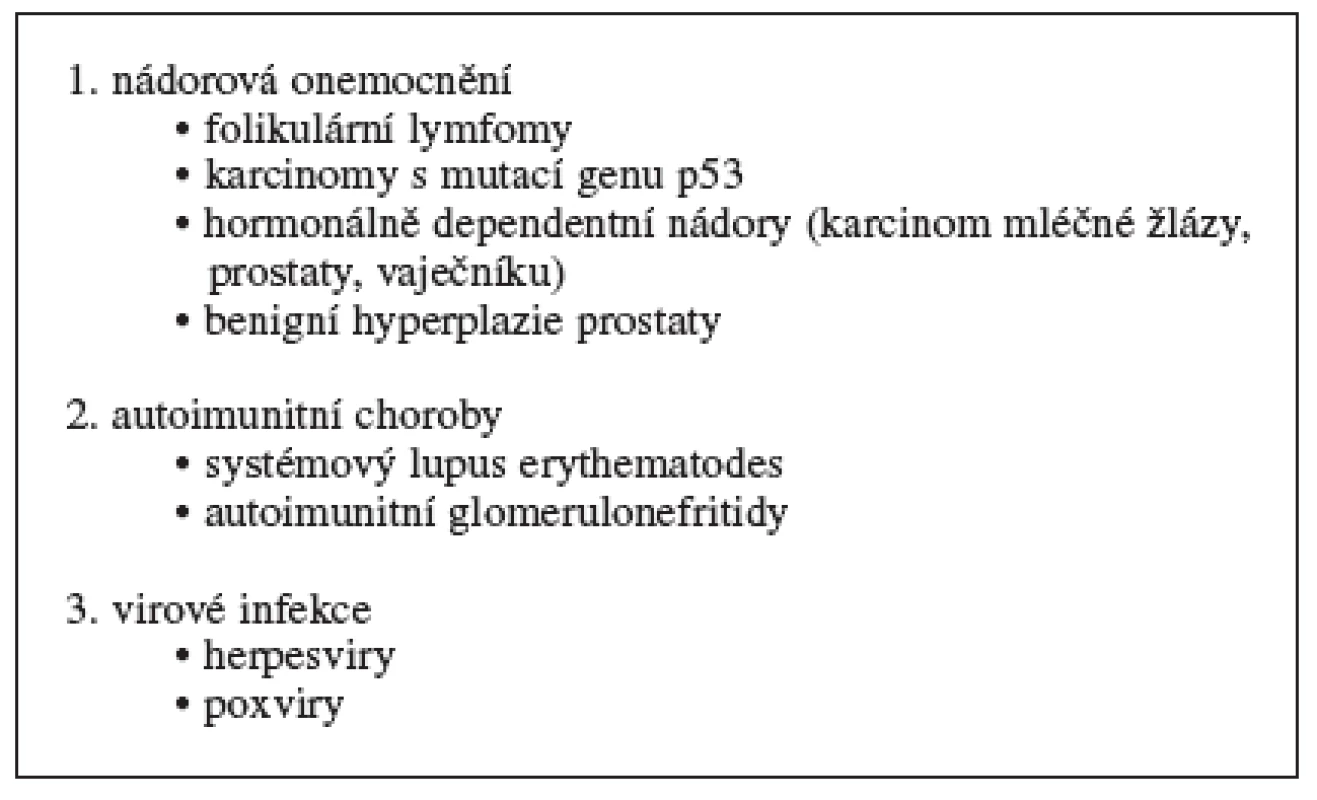
Do druhé skupiny jsou obvykle zařazovány nemoci, u nichž je apoptóza nadměrná a vede k poškození normálních orgánů a tkání (tab. 3). S patologickou indukcí apoptózy souvisí AIDS, neurodegenerativní onemocnění (Alzheimerova choroba, Parkinsonova choroba, amyotrofická laterální skleróza), myelodysplastické syndromy (aplastická anémie) a ischemická poškození (infarkt myokardu, mozková apoplexie) 29, 30).
Table 3. Onemocnění související s nadměrnou apoptózou 29, 30) 
Induktory apoptózy
U látek, které působí jako aktivátory apoptózy, se předpokládá využití k léčbě onemocnění, v jejichž patogenezi se uplatňuje nedostatečná apoptóza.
Do skupiny léčiv schopných indukovat apoptózu je možné zařadit gamcitabin 33, 34), thalidomid 35), doxorubicin 36, 37) i erektikum sildenafil 38). U některých látek schopných indukovat apoptózu není dosud známo, jakým mechanismem tento proces probíhá. Jedná se pravděpodobně o aktivaci receptorů nesoucích smrtící domény (rodina receptorů TNF), omezení účinků bcl-2 proteinu anebo aktivaci kaspas 39). Při použití těchto látek je však důležité a žádoucí, aby jejich působení bylo zaměřené cíleně na patologické buňky a nedocházelo k farmakologickému vyvolání chorob s nežádoucí indukcí apoptózy.
U některých již běžně užívaných léčiv byl podrobněji zkoumán mechanismus účinku na molekulární úrovni a bylo zjištěno, že na jejich působení se podílí indukce apoptózy, jak je tomu například u protinádorového paklitaxelu a antagonistů α1 receptorů, užívaných v léčbě benigní hyperplazie prostaty. Tato léčiva indukují apoptózu přímo v nádorových buňkách, resp. u hyperplastických buněk prostaty.
Inhibitory apoptózy
Do této skupiny jsou zařazovány látky schopné inhibovat apoptózu. Prozatím nejsou zavedena do praxe, ale představují potenciální farmaka léčby nemocí, u kterých je apoptóza neregulovatelná nebo nadměrná (např. AIDS, neurodegenerativní choroby, ischemické poškození buněk).
Mezi malé molekuly, které nemají peptidovou strukturu a vykazují inhibiční účinek na apoptózu, patří např. oxid dusnatý, zinečnaté ionty, chinony a dithiokarbamáty 40).
Problémem využití látek inhibujících apoptózu je jejich nejen terapeutické, ale i patologické působení v procesech navození prekancerogenních stavů. Proto role antiapoptických léčiv u neurodegenerativních chorob musí být nejprve detailněji prozkoumána 41). Mezi potenciální léčiva tohoto druhu s předpokládanou inhibicí apoptózy, a to nejčastěji mechanismem inhibice kaspas, mohou být zařazeny například pralnakasan 42, 43) a pralnaskan 44), ale ne u všech je mechanismus inhibice apoptózy znám. V patogenezi neurodegenerativních chorob hraje ústřední roli kaspasa 3.
Dosud popsané látky ovlivňující apoptózu, zvláště iniciací kaspas (např. thalidomid, leflunomid, bortezomib) nebo inhibicí kaspas (minocyklin, memantin i adeninové nebo jiné purinové deriváty), jsou strukturálně odlišné. Ovlivnění aktivity kaspas je atraktivním polem pro terapeutické ovlivnění mnoha onemocnění, souvisejících s apoptózou a některými zánětlivými nemocemi. V práci byl studován vliv sloučenin ze skupiny stobadinových 45) a purinových derivátů na aktivitu kaspasy 1 účastnící se celé řady patologických stavů 24–26).
POKUSNÁ ČÁST
Chemikálie
Ethylendiaminotetraoctová kyselina 99,5 % (EDTA), 4-(2--hydroxyethyl)-1-piperazinethansulfonová kyselina 99,5 % (HEPES),dithiothreitol 99 % (DTT) (Aldrich),ethanol pro UV, glycerol p. a. (Lachema), HEPES sodná sůl 99 % (Fluka), chlorid sodný p. a., kyselina chlorovodíková 35 % p. a. (ML chemica), polyethylen glykol p-(1,1,3,3-tetramethylbutyl)fenylether pro molekulární biologii (Triton® X-100), rekombinantní lidská kaspasa 1 z E. coli, specifický substrát pro kaspasu 1 Ac-YVAD-pNA (Calbiochem).
Přístroje
Spektofotometr HELIOS β (ThermoSpectronic), Vortex Nahita (Auxilab).
Metodika
Metodika práce se skládala z příprav tlumivého roztoku HEPES, roztoku substrátu, enzymového preparátu kaspasy 1 a roztoků efektorů vždy včas spotřeby a z vlastní metodiky stanovení biologické aktivity.
Tlumivý roztok HEPES – 0,01 mol.l-1, pH 7,4
Složení: 0,01 mol.l-1 HEPES kyselina; 0,01 mol.l-1 HEPES sodná sůl; 50 mmol.l-1 NaCl; 10 mmol.l-1 DTT; 1 mmol.l-1 EDTA; 5 % glycerol; 0,1 % TRITON® X-100.
Příprava
V destilované vodě bylo rozpuštěno příslušné množství HEPES kyseliny, HEPES sodné soli, NaCl, glycerolu a TRITONu® X-100, aby bylo dosaženo požadované koncentrace každé složky a byla upravena hodnota pH pufru na 7,4. DTT a EDTA byly přidány do roztoku až před použitím, aby se zamezilo žloutnutí roztoku 46).
Příprava roztoku substrátu
5 mg specifického substrátu pro kaspasu 1 (Mr 628,6) bylo rozpuštěno ve 100 μl DMSO a bylo přidáno 0,7 ml pufru HEPES. Vzniklých 800 μl roztoku bylo rozděleno po 100 μl na 8 dílů (koncentrace 10 mmol.l-1) a každý z dílů byl dále naředěn přidáním 400 μl pufru HEPES. Vznikly roztoky substrátu o objemu 500 μl a koncentraci 2 mmol.l-1 46).
Příprava enzymového preparátu z kaspasy 1
Komerčně dodané množství enzymu (300 μl ve formě roztoku s aktivitou 3000 U) bylo rozděleno na 5 částí po 60 μl, každá z částí byla zředěna pufrem HEPES na objem 300 μl (600 U) 46).
Příprava roztoků efektorů
Příslušné množství testovaných sloučenin bylo rozpuštěno v 500 μl DMSO tak, aby vznikly roztoky efektorů o koncentraci 10 mmol.l-1.
Stanovení biologické aktivity
Pro stanovení biologické aktivity bylo pipetováno příslušné množství HEPES pufru, 30 μl připraveného roztoku enzymu a 20 μl (pro koncentraci efektoru 500 μmol.l-1) resp. 40 μl (pro koncentraci efektoru 1000 μmol.l-1) roztoku testované sloučeniny tak, aby celkový objem činil 360 μl. Směs byla promíchána za použití přístroje Vortex, inkubována 5 min při teplotě 37 °C. Následně bylo přidáno 40 μl substrátu a směs byla opět důkladně promíchána. Měření absorbance probíhalo při vlnové délce 405 nm oproti slepému vzorku v časových intervalech 10 min po dobu 1 h. Vzorky byly inkubovány během měření při teplotě 37 °C. Zpracované výsledky jsou průměrem vždy dvou paralelních měření. Naměřené hodnoty absorbance odečtené v desetiminutových intervalech byly vyneseny do grafu vůči času a zpracovány lineární regresí. Změna aktivity enzymu byla vypočítána jako podíl absorbance systému s příslušným efektorem k absorbanci systému bez efektoru a vyjádřena v procentech.
VÝSLEDKY A DISKUZE
Působení kaspasy 1 vede k uvolňování p-nitroanilinu z enzymového substrátu, uvolněný p-nitroanilin byl stanoven spektrofotometricky. Nejvyšší hodnota absorbance byla zjištěna ve vzorcích bez přítomnosti efektorů. Přidání efektorů vedlo k poklesu hodnot absorbance svědčící o inhibičním působení testovaných sloučenin na aktivitu kaspasy 1. Hodnoty absorbance byly během měření odečítány v intervalu 10 min po celkovou dobu 1 h, kdy je enzymatická reakce lineární.
Naměřené hodnoty absorbance byly vyneseny na časové ose (graf 1) a byly vypočítány procenta inhibice aktivity enzymatické reakce pro jednotlivé koncentrace efektorů po čase 60 min (graf 2). Z grafu 2 vyplývá, že inhibiční účinek vzrůstá v koncentrační závislosti s množstvím použitých testovaných sloučenin. Nejvyšší inhibiční aktivitu (graf 3) ve skupině studovaných efektorů vykázaly stobadinové deriváty (I–V) (obr. 1), přičemž nejsilnější inhibiční aktivita v koncentraci efektoru 1000 μmol.l-1 byla nalezena u sloučeniny III, u které dosáhla 82,6 %, sloučeniny IV (75,6 %) a sloučeniny II (62,8 %). Uvedené stobadinové deriváty spojuje strukturální vztah, substituent stobadinového skeletu obsahuje bezprostředně za karbonylovou skupinou alespoň dvouuhlíkatý necyklický alkylový, popř. alkenylový řetězec.
Graph 1. Stanovení inhibiční aktivity sloučeniny III na aktivitu kaspasy 1 – závislost naměřených hodnot absorbance (405 nm) vůči času 
Graph 2. Stanovení inhibičního působení sloučeniny III v koncentracích 500 μmol.l-1 a 1000 μmol.l-1 na aktivitu kaspasy 1 po 60 min 
Graph 3. Srovnání inhibičního působení sloučenin I–IX v koncentraci 1000 μmol.l-1 na aktivitu kaspasy 1 po 60 min 
Inhibiční aktivita purinových sloučenin (VI–IX) (obr. 1) je nižší a v koncentraci 1000 μmol.l-1 dosahuje maximálně 35 % v případě látky VI. Vzájemný vztah mezi aktivitou a chemickou strukturou nelze pro nízký počet studovaných sloučenin prozatím navrhnout.
Image 1. Chemické struktury testovaných látek 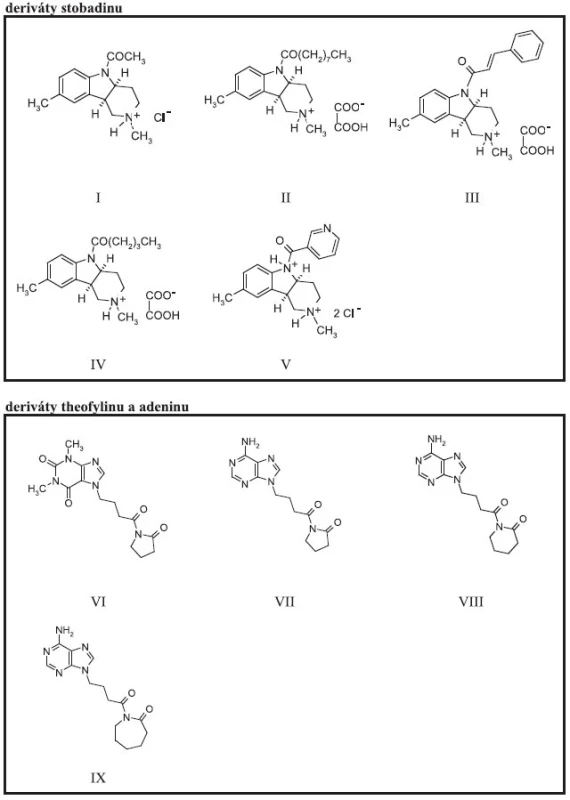
Došlo: 18. října 2007
Přijato: 29. listopadu 2007
Adresa pro korespondenci:
PharmDr. Bc. Tomáš Bartl
Ústav chemických léčiv FaF VFU
Palackého 1/3, 612 42 Brno
e-mail: tbartl@vfu.cz
Sources
1. Russell, S. W., Rosenau, W., Lee, J. C.: Am. J. Pathol., 1972; 69, 103–118.
2. Bózner, A., Fízel, A., Kopáčová, L. et al.: Farmakologická propedeutika, 1. vyd. Bratislava, Osveta, 1984; 277, 278.
3. https://www.zdravcentra.cz, staženo 5. 1. 2007.
4. Rosypal, S.: Úvod do molekulární biologie, 1. vyd. Blansko, Grafex, 1999; 485–488.
5. http://www.fnplzen.cz/, staženo 11. 2. 2007.
6. Steller, H.: Science, 1995; 267, 1445–1449.
7. Jacobson, M. D., Weil, M., Raff, M. C.: Cell, 1997; 88, 347–354.
8. Cohen, J. J.: Immunol. Today, 1993; 14, 126–130.
9. Trauth, B. C., Keesey, J.: Cell death. In: Trauth, B. C. Boehringer Mannheim, 1998; 34–61.
10. Rudin, C. M., Thompson, C. B.: Annu. Rev. Med., 1997; 48, 267–281.
11. Riedl, S. J., Shi, Y.: Nat. Rev. Mol. Cell Biol., 2004; 5, 897–907.
12. Li, P., Nijhawan, D., Budihardjo, I. et al.: Cell, 1997; 91, 479–489.
13. Reed, J. C.: Am. J. Pathol., 2000; 157, 1415–1431.
14. Green, D. R., Kroemer, G.: J. Clin. Invest., 2005; 115, 2610–2617.
15. Varfolomeev, E. E., Ashkenazi, A.: Cell, 2004; 116, 491–497.
16. Chinnaiyan, A. M.: Neoplasia, 1999; 1, 5–15.
17. Yan, N., Shi, Y.: Annu. Rev. Cell Dev. Biol., 2005; 21, 35–56.
18. Philchenkov, A.: J. Cell Mol. Med., 2004; 8, 432–444.
19. Ho, P. K., Hawkins, C. J.: FEBS Lett., 2005; 272, 5436–5453.
20. Yuan, J. Y., Shaham, S., Ledoux, S. et al.: Cell, 1993; 75, 641–652.
21. Twomey, C., McCarthy, J. V.: J. Cell Mol. Med., 2005; 9, 345–359.
22. Fan, T. J., Han, L. H., Cong, R. S., Liang, J.: Acta Biochim. Biophys. Sinica, 2005; 37, 719–727.
23. Wolf, B. B., Green, D. R.: J. Biol. Chem., 1999; 274, 20049–20052.
24. Degterev, A., Boyce, M., Yuan, J. Y.: Oncogene, 2003; 22, 8543–8567.
25. Shi, Y.: Mol. Cells, 2002; 9, 459–470.
26. Fuentes-Prior, P., Salvesen, G. S.: Biochem. J., 2004; 384, 201–232.
27. Lavrik, I. N., Golks, A., Krammer, P. H.: J. Clin. Invest., 2005; 115, 2665–2672.
28. http://is.muni.cz/ staženo 9. 2. 2007.
29. Jin, Z. Y., El-Deiry, W. S.: Cancer Biol. Ther., 2005; 4, 139–163.
30. Thompson, C. B.: Science, 1995; 267, 1456–1462.
31. http://ustavpatologie.upol.cz, staženo 15. 2. 2007.
32. Chwajol, B.: Urologie pro praxi, 2001; 3, 119–121.
33. http://www.sukl.cz/, staženo 14. 2. 2007.
34. Hideshima, T., Chauhan, D., Podar, K. et al.: Semin. Oncol., 2001; 28, 607–612.
35. http://www.chem-online.org/generic-pharmaceutical, staženo 19. 2. 2007.
36. Oancea, M., Mani, A., Hussein, M. A., Almasan, A.: Int. J. Hematol., 2004; 80, 224–231.
37. Ückert, S., Hedlund, P., Andersson, K. E. et al.: Eur. Urol., 2006; 50, 1194–1207.
38. Klener, P.: Sanquis, 2004; 36, 14–16.
39. http://redpoll.pharmacy.ualberta.ca, staženo 14. 2. 2007.
40. Graczyk, P. P.: Restor. Neurol. Neurosci., 1999; 14, 1–23.
41. Bonuccelli, U., Del Dotto, P.: Neurology, 2006; 67, 30–38.
42. Loher, F., Bauer, C., Landauer, N. et al.: J. Pharmacol. Exp. Ther., 2004; 308, 583–590.
43. http://merops.sanger.ac.uk, staženo 27. 2. 2007.
44. Concha, N. O., Abdel-Meguid, S. S.: Current Med. Chem., 2002; 9, 713–726.
45. Beneš, L., Pronayová, N.: Pharmazie, 1994; 49, 69–70.
46. Návody firmy Calbiochem: Calbiochem User Protocol, No. 218783.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 1-
All articles in this issue
- Antioxidační aktivita tinktur připravených z hlohových plodů a nati srdečníku
- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Hemostatické účinky oxidované celulosy
- Látky ovlivňující aktivitu kaspas
- Vliv auxinů na růst a akumulaci skopoletinu v suspenzní kultuře Angelica archangelica L.
- Studium vlastností tablet z přímo lisovatelné maltosy
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Hemostatické účinky oxidované celulosy
- Látky ovlivňující aktivitu kaspas
- Antioxidační aktivita tinktur připravených z hlohových plodů a nati srdečníku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

