-
Medical journals
- Career
Optická koherentní tomografie u benigních a maligních melanocytárních nádorů
Authors: I. Součková; P. Souček
Authors‘ workplace: Oftalmologická klinika FNKV, Praha, přednosta prof. MUDr. Pavel Kuchynka, CSc.
Published in: Čes. a slov. Oftal., 64, 2008, No. 6, p. 228-230
Overview
Cíl:
Posoudit význam OCT při posuzování tkáňových změn u malých choroidálních melanocytárních lézí.Metodika:
Sledovali jsme 20 nemocných s uveálním melanocytárním nádorem (9 s benigní lézí, 11 s maligní lézí). Fundus obou očí byl vyšetřen v arteficiální mydriáze pomocí nepřímého oftalmoskopu a Goldmannovy čočky. Dále byla získána fotodokumentace tumoru a makuly. U všech pacientů byl proveden ultrazvuk (UZ). U 9 jedinců byla provedena fluorescenční angiografie a u 8 angiografie s indocyaninovou zelení. Při provádění OCT jsme vyšetřovali vrchol, okraje tumoru, jeho okolí a makulu. Sledovací doba činila u benigních lézí 6–24, u maligních 6–48 měsíců. Pacienti, kteří vyžadovali terapii, byli léčeni pomocí laserové fotokoagulace, fotodynamické terapie s verteporfinem, brachyterapie, ozáření Leksellovým gama nožem či byla provedena enukleace, případně kombinací výše uvedených metod.Výsledky:
Vizus se při 1. vyšetření pohyboval u benigních lézí v rozmezí 1,0–0,1 a u maligních 1,0–0,07. Při poslední kontrole u benigních lézí zůstal stacionární, u maligních se zhoršil na 0,8–0. Prominence tumoru na UZ byla při 1. vyšetření u benigních lézí 1,3–1,7 mm a u maligních 1,4–2,8. Při poslední kontrole se u benigních lézí nezměnila, u maligních se pohybovala v rozmezí 0–3,8 mm. Tloušťka neuroretiny při 1. vyšetření činila u benigních lézí 140–357 μm, u maligních 173–680. Při poslední kontrole činila u benigních lézí 156–412, u maligních 124–506. Makulární objem činil při 1. vyšetření u benigních lézí 6,1–7,6 mm³, u maligních 5,9–14,4. Při poslední kontrole činil u benigních lézí 7,1–8,2, u maligních 3,8–8,8. Při kvalitativním hodnocení jsme sledovali přítomnost subretinální a intraretinální tekutiny, konvexní deformitu scanu, zvýšenou intraretinální reflektivitu, zvýšenou reflektivitu retinálního pigmentového epitelu (RPE), zvýšenou choroidální reflektivitu a porušení RPE.Závěr:
Dle výsledků našeho sledování je hodnocení sítnicových změn na OCT u malých melanocytárních choroidálních lézí jedním z důležitých prognostických nálezů. Toto vyšetření umožňuje včasnou detekci aktivace onemocnění, ještě před zjištěným růstem a tím i včasnou léčbu. Přesto je vhodné rozšířit soubor sledovaných pacientů i jejich sledovací dobu k potvrzení naší hypotézy.Klíčová slova:
optická koherentní tomografie, choroidální melanocytární tumor, tloušťka neuroretiny, makulární objemÚvod
Optická koherentní tomografie (OCT) je neinvazivní, bezkontaktní zobrazovací metoda, která umožňuje provádět řezy tkání s vysokou axiální rozlišovací schopností (Stratus OCT3, Zeiss, 8 μm). Podstatou se podobá vyšetření ultrazvukovému, ale namísto reflektivity akustické se využívá reflektivity optické (820 nm). Fyzikální princip zobrazování je dán kontrastem optické reflektivity mezi rozdílnými tkáňovými mikrostrukturami. Přístroj umožňuje měřit struktury a vzdálenosti s 10krát větší přesností než je tomu při ultrazvukovém vyšetření. Tento rozdíl je dán využitím světla nízkokoherentní interferometrií, jehož rychlost je přibližně milionkrát větší než rychlost zvuku. Slouží především k vyšetření makuly, papily zrakového nervu a vrstvy nervových vláken.
V kombinaci s dalšími vyšetřovacími metodami (fluorescenční angiografie (FAG), angiografie s indocyaninovou zelení (ICGAG), snímek v bezčerveném světle a ultrazvuk (UZ)) je OCT důležitá ke stanovení diagnózy u retinálních a především makulárních onemocnění. U některých chorob je nález patognomický. Dále slouží k indikaci k laserové či chirurgické léčbě, k porovnání s minulými nálezy, hodnocení efektivity léčby či spontánního průběhu onemocnění.
Jde o dynamickou vyšetřovací metodu, scany patrné na monitoru během vyšetření se mohou měnit v důsledku pohybu očí a fixace, videosnímek patrný na monitoru je nesimultánní a nemusí tudíž odpovídat provedenému scanu. Základním vyšetřením pro oblast makuly je provedení „radial lines“ (6mm řezy po 30st., jejichž střed je v místě fixačního bodu). Pro podrobné prostudování léze využíváme „OCT skopie“ (proscanování oblasti celé léze v řezech s velmi malým rozdílem vzdáleností od sebe). To je důležité, neboť orientace a lokalizace scanů dává rozdílné nálezy.
Při vyhodnocování provádíme jednak kvalitativní, jednak kvantitativní analýzu. Je nutné se vyvarovat mnoha chyb, jako je např. vyhodnocování typu „align + normalize“, které dává falešně pozitivní výsledky. Dále je to normální hyporeflektivita fovey, excentrická fixace pacienta, vyšetřování pacientů s těžkou myopií, u nichž se dá zlepšit kvalita scanů, jestliže pacienta vyšetřujeme s nasazenou kontaktní čočkou. Dále jsou horší výsledky u astigmatismu, při zkalených optických médiích a při porušeném slzném filmu. Nikdy není možné založit diagnózu na jednom scanu, vždy se musí provést minimálně „radial lines“. Provádění rychlých scanů by mělo být vyhrazeno pouze pro nespolupracující pacienty vzhledem k nižšímu rozlišení (1).
Novou generaci přístrojů představuje tzv. spektrální OCT s axiálním rozlišením scanu až 5 μm a rychlejším průběhem, což obojí vede k daleko přesnějšímu vyšetření.
Publikované práce týkající se problematiky OCT u melanocytárních nitroočních lézí jsou poměrně raritní.
Produkce subretinální tekutiny u malých melanocytárních lézí je z hlediska jejich maligního potenciálu považována za prognosticky nepříznivou. Nález ohraničené serózní elevace sítnice často předchází jejich růstu. Rozsáhlejší elevaci je možné identifikovat biomikroskopicky, malé množství subretinální tekutiny, především na vrcholu tumoru, však takto diferencovat nelze. I ultrasonografie (A-scan a B-scan) může zdokumentovat sítnicové změny, ale v detailním měřítku selhává také.
Na druhou stranu je z histopatologických studií známo, že i névy, svojí podstatou benigní, postihují sítnici nad tumorem v 10 % případů.
Proto je velmi důležité rozeznat např. plochou elevaci sítnice od jejího edému.
Díky svým vysokým rozlišovacím schopnostem si zde své místo našlo vyšetření pomocí OCT (3, 4).
Z hlediska přítomnosti a rozložení tekutiny v sítnici rozeznáváme 3 základní obrazy:
- chronický, charakterizovaný ztluštěním sítnice, nahromaděním intraretinální tekutiny difúzně či v cystoidních prostorech,
- aktivní, s přítomností subretinální tekutiny, při současném kvalitativním i kvantitativním normálním nálezu neuroretiny a
- smíšený, který je kombinací obou předchozích.
Dalšími nálezy na OCT může být naopak nepřítomnost separace retinálních vrstev, atrofie sítnice, zeslabení až vymizení vrstvy fotoreceptorů, přerušení kontinuity vrstvy RPE či jeho ztluštění v důsledku fibrózní metaplazie a s tím související různý stupeň reflektivity tumoru a sousedních tkání (2).
V neposlední řadě musíme diferenciálně diagnosticky pomýšlet na sekundární komplikace jako je choroidální neovaskularizace či polypy.
Hlavním cílem práce bylo posoudit význam OCT při posuzování tkáňových změn u malých choroidálních melanocytárních lézí.
Metodika
Sledovali jsme 20 nemocných s uveálním melanocytárním nádorem (9 s benigní lézí, 11 s maligní lézí), z toho bylo 12 žen a 8 mužů. Věk při stanovení diagnózy byl 32–78 let, u pacientů s benigní lézí se pohyboval v rozmezí 46–78 let (M = 58), u pacientů s maligní lézí 32–73 let (M = 56).
U všech pacientů byl vyšetřen vizus pomocí ETDRS optotypů (Early Treatment Diabetic Retinopathy Study), změřen nitrooční tlak a vyšetřen přední segment na štěrbinové lampě. Fundus obou očí byl vyšetřen v arteficiální mydriáze pomocí nepřímého oftalmoskopu a Goldmannovy čočky. Dále byla získána fotodokumentace tumoru a makuly na funduskameře. U všech pacientů byla provedena ultrasonografie, a to standardizovaný A-scan i B - scan. U některých jedinců byla provedena fluorescenční angiografie (9krát) či angiografie s indocyaninovou zelení (8krát). Při provádění OCT jsme vyšetřovali vrchol, okraje tumoru, jeho okolí a makulu. Oblast tumoru byla proscanována jednotlivými scany v délce 7 mm, u vyšetření makuly jsme použili „radial lines“ v délce 6 mm. Sledovací doba činila 6–48 měsíců, u benigních lézí 6–24 měsíců (M = 9), u maligních lézí 6–48 měsíců (M = 15). Vždy byly vyšetřeny obě oči, u léčených byly srovnány nálezy před a po léčbě. Pacienti, kteří vyžadovali terapii, byli léčeni pomocí laserové fotokoagulace, fotodynamické terapie s verteporfinem, brachyterapie, ozáření Leksellovým gama nožem či byla provedena enukleace, případně byla provedena kombinace výše uvedených metod.
Výsledky
Vizus při 1. vyšetření se pohyboval v rozsahu 1,0–0,07, z toho u benigních lézí 1,0–0,1 (M = 1,0) a u maligních lézí 1,0–0,07 (M = 0,45). Vizus při se poslední kontrole pohyboval v rozmezí 4/4–0, přičemž u benigních lézí zůstal stacionární, u maligních lézí se zhoršil na 4/5–0 (M = 0,38). Prominence tumoru na UZ ve standardizovaném A-scanu byla při 1. vyšetření 1,3–2,8 mm, z toho u benigních lézí 1,3–1,7 (M = 1,6) a u maligních lézí 1,4–2,8 (M = 1,9). Při poslední kontrole prominence tumoru na A – scanu činila 0–3,8 mm, přičemž u benigních lézí se nezměnila, u maligních lézí se pohybovala v rozmezí 0–3,8 mm (M = 0). Subretinální tekutina na UZ nebyla diagnostikována v žádném případě.
Z kvantitativní analýzy jsme na OCT hodnotili tloušťku neuroretiny ve fixačním bodě (μm) a makulární objem (mm3). Tloušťka neuroretiny při 1. vyšetření činila 140–680 μm, u benigních lézí to bylo 140–357 μm (M = 237 μm), u maligních lézí 173–680 (M = 316). Při poslední kontrole tloušťka neuroretiny činila 124–506 μm, u benigních lézí 156–412 μm (M = 233), u maligních lézí 124–506 μm (M = 174) (graf 1). Makulární objem činil při 1. vyšetření 5,9–14,4 mm3, u benigních lézí 6,1–7,6 mm3 (M = 7,1), u maligních lézí 5,9–14,4 mm3 (M = 8,8). Při poslední kontrole makulární objem činil 3,8 až 8,8 mm3, u benigních 7,1–8,2 mm3 (M = 7,2), u maligních se pohyboval v rozsahu 3,8–8,8 mm3 (M = 6,4) (graf 2). Při kvalitativním hodnocení jsme sledovali přítomnost či nepřítomnost subretinální tekutiny (1krát u benigních lézí, 11krát u maligních lézí), intraretinální tekutiny (4krát u benigních lézí, 8krát u maligních lézí), konvexní deformitu scanu (4krát u benigních lézí, 11krát u maligních lézí), zvýšenou intraretinální reflektivitu (4krát u benigních lézí, 5krát u maligních lézí), zvýšenou reflektivitu retinálního pigmentového epitelu (2krát pouze u benigních lézí), zvýšenou choroidální reflektivitu (7krát u benigních lézí, 6krát u maligních lézí) a porušený RPE (7krát u benigních lézí, 8krát u maligních lézí) (tabulka 1). Pomocí angiografického vyšetření byla jednou diagnostikována jako komplikace benigní léze choroidální neovaskularizace a 1krát polypoidální choroidální vaskulopatie.
Graph 1. Tloušťka neuroretiny ve fixačním bodě u benigních a maligních lézí 
Graph 2. Makulární objem u benigních a maligních lézí 
Table 1. Kvalitativní změny na OCT 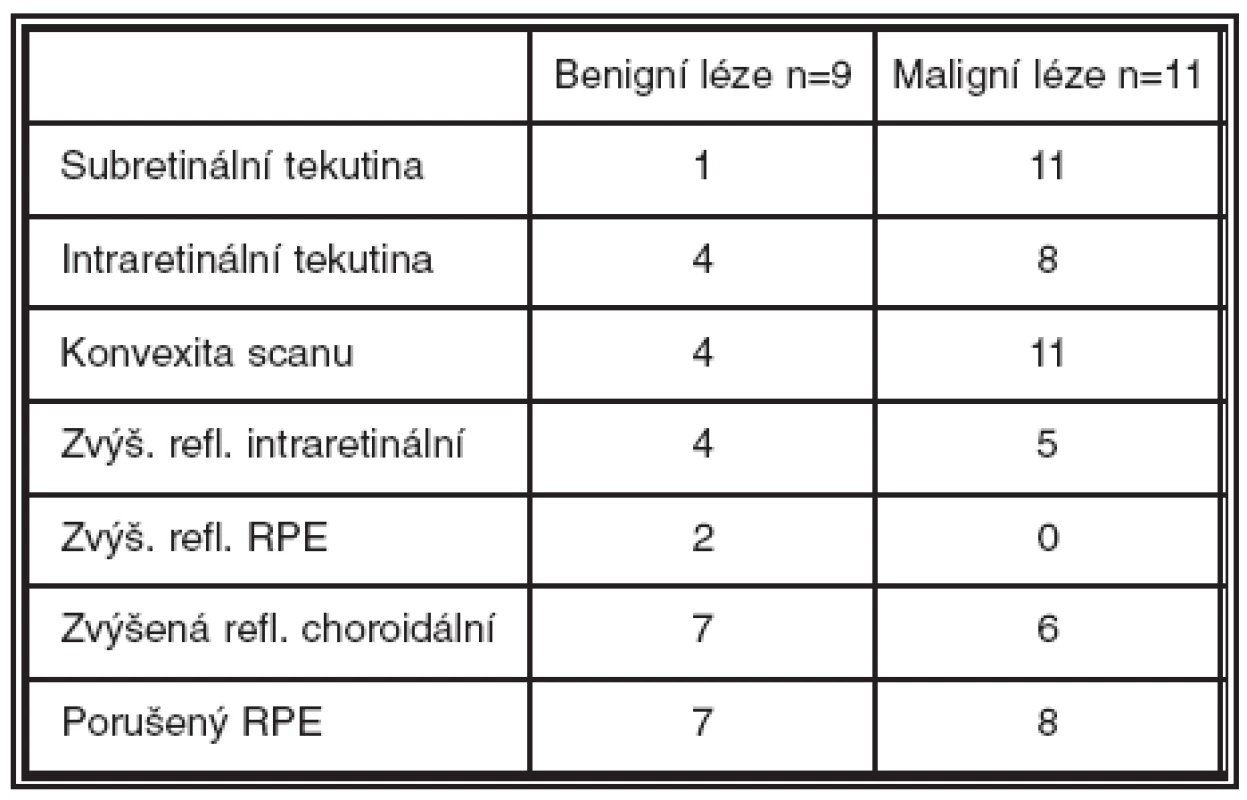
Diskuse
V současné době se k diagnostice choroidálních tumorů využívá především biomikroskopické vyšetření, UZ vyšetření, event. FAG či ICG.
Cílem této práce je posoudit význam OCT při posuzování sítnicových změn u malých choroidálních melanocytárních lézí. Chronický nález, který je typický pro benigní léze (choroidální névy) se ztluštěním sítnice nebo intraretinálními cystami bez nálezu subretinální tekutiny svědčí pro dlouhotrvající nález tumoru, který je neaktivní (4 případy benigních, 8krát u maligních lézí). Tyto změny vysvětlují event. pokles zrakové ostrosti a jsou projevem dlouhého trvání. Aktivní typ je charakterizován nálezem subretinální tekutiny nad nebo při okraji tumoru ve spojení s normálním kvalitativním i kvantitativním nálezem v oblasti neuroretiny a předpokládá se, že jde o pravé serózní odchlípení sítnice, která může indikovat aktivitu tumoru více než jeho růst (1krát u benigních, 11krát u maligních lézí). V našem souboru jsme smíšený typ identifikovali u benigních lézí 1krát (projev choroidální neovaskularizace), u maligních v 8 případech, což si vysvětlujeme aktivací původně benigní léze v průběhu dlouhodobého sledování (2). Dle našich zkušeností je vhodné provést jak vyšetření makuly, tak i oblast na vrcholu tumoru. Nevýhodou OCT vyšetření je to, že ho nemůžeme provést u periferních lézí.
Vzhledem k tomu, že signál OCT proniká pouze do povrchových vrstev choroidey, tak prominence či vaskularizace tumoru a posouzení event. postižení skléry je možné pouze pomocí ultrazvukového vyšetření (3). Z toho vyplývá, že tato vyšetření se navzájem doplňují. Avšak dle našich výsledků jsme sítnicové změny na UZ neidentifikovali v žádném případě.
Závěr
Dle výsledků našeho sledování je hodnocení sítnicových změn (aktivních versus chronických) na OCT u malých melanocytárních choroidálních lézí jedním z důležitých prognostických nálezů. Toto pacienta nezatěžující vyšetření umožňuje včasnou detekci aktivace onemocnění, ještě před zjištěným růstem, a tím i včasnou léčbu. V porovnání s UZ jsme byli schopni identifikovat i sítnicové nálezy, což na UZ nebylo možné. Přesto je vhodné rozšířit soubor sledovaných pacientů i jejich sledovací dobu k potvrzení naší hypotézy.
MUDr. Ilona Součková
Oftalmologická klinika FNKV
Šrobárova 50
100 34 Praha 10
e-mail: cihelko@fnkv.cz
Sources
1. Cihelková, I., Souček, P.: Atlas makulárních chorob, Praha, Galén/Karolinum, 2005, 724 s.
2. Espinoza, G., Rosenblatt, B., Harbour, JW.: Optical Coherence Tomography in the Evaluation of Retinal Changes Associated With Suspicious Choroidal Melanocytic Tumors, Am J Ophthalmol, 137, 2004, 1 : 90–95.
3. Schaudig, U., Hassenstein, A., Bernd, A. et al.: Limitations of Imaging Choroidal Tumors in vivo by Optical Coherence Tomography, Graefes Arch Clin Exp Ophthalmol, 236, 1998, 8 : 588–592.
4. Shields, CL., Mashayekhi, A., Materin, MA. et al.: Optical Coherence Tomography of Choroidal Nevus in 120 Patients, Retina, 25, 2005, 3 : 243–252.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2008 Issue 6-
All articles in this issue
- Orbitální tumory u dospělých – desetiletá studie
- Optická koherentní tomografie u benigních a maligních melanocytárních nádorů
- Syndrom vlající duhovky versus čočkoduhovkový retropulsní syndrom
- Liečba rubeózy dúhovky a neovaskulárneho glaukómu pri proliferatívnej diabetickej retinopatii pomocou anti-VEGF
- Intravitreální aplikace tkáňového aktivátoru plazminogenu v léčbě submakulární hemoragie – kazuistika
- Subjektivní vyšetření vrstvy nervových vláken sítnice a její hodnocení u zdravého oka a u glaukomu
- Trombolýza okluze centrální retinální arterie alteplázou
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Orbitální tumory u dospělých – desetiletá studie
- Syndrom vlající duhovky versus čočkoduhovkový retropulsní syndrom
- Liečba rubeózy dúhovky a neovaskulárneho glaukómu pri proliferatívnej diabetickej retinopatii pomocou anti-VEGF
- Trombolýza okluze centrální retinální arterie alteplázou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

