-
Medical journals
- Career
Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
Authors: L. Hrežová 1,2; M. Škorňa 2; J. Bednařík 1,2; T. Rohan 1,3
Authors‘ workplace: LF MU Brno 1; Neurologická klinika FN Brno 2; Klinika radiologie a nukleární medicíny, FN Brno 3
Published in: Cesk Slov Neurol N 2022; 85(1): 89-91
Category: Letters to Editor
doi: https://doi.org/10.48095/cccsnn202289Vážená redakce,
prezentujeme kazuistiku pacienta, u kterého byla potvrzena diagnóza cerebrálního hyperperfuzního syndromu (CHS).
Jedná se o relativně vzácný stav následující po karotické endarterektomii (carotid endarterectomy; CEA) nebo stentingu karotické arterie (carotid artery stenting; CAS) a je potenciálně preventabilní. Můžeme ho také charakterizovat jako fokální poškození mozku následující po revaskularizačním výkonu, obvykle následkem hyperperfuze [1]. Dle retrospektivní studie z roku 2009 [2] byla incidence CHS následující po CAS 1,6 %. U pacientů po CEA byla incidence 1,9 %, některé prameny uvádějí rozptyl 0,2–18,9 % [3].
Symptomy se nejčastěji rozvíjí do 12 h od zákroku [4], ale jejich výskyt je možný i měsíc po výkonu. CHS je charakterizován pulzující jednostrannou frontotemporální nebo periorbitální, někdy i difuzní bolestí hlavy, zvracením, poruchou vědomí, makulárním edémem a poruchou zraku, fokálními motorickými epileptickými záchvaty s častým sklonem k přechodu do bilaterálně tonicko-klonických, fokálním neurologickým deficitem a intracerebrálním či subarachnoidálním krvácením [3]. Většina pacientů má pouze mírnou symptomatiku, avšak při pozdní diagnostice může dojít k její progresi až k život ohrožujícímu stavu. V radiologickém nálezu dominují nepravidelný nebo difuzní edém bílé hmoty, postihující převážně zadní část parieto-okcipitálního laloku, fokální hemoragická infarzace a petechiální hemoragie [5].
Pro tyto nálezy je vhodnější vyšetření pomocí MR, jelikož je k postižení bílé hmoty mozku senzitivnější než CT, nicméně ani negativní radiologický nález nemůže CHS vyloučit [5].
Větší studie se shodují na třech nejvýznamnějších rizikových faktorech vzniku. Patří mezi ně aterosklerotická stenóza arteria carotis interna (ACI) větší než 90 %, závažná ateroskleróza na kontralaterální straně a dlouhotrvající preexistující arteriální hypertenze [5]. Závažnou karotickou stenózou indukovaná chronicky nižší perfuze vede ke kompenzační dilataci mozkových cév distálně od stenózy k zabezpečení normálního průtoku krve mozkem. V tomto dlouhodobě dilatovaném stavu cévy ztrácejí svou schopnost autoregulace v rámci změn krevního tlaku [6].
Referovaný 45letý pacient byl na naši kliniku poprvé přijat k plánované implantaci stentu a coilingu traumatického disekujícího aneuryzmatu arteria carotis interna vlevo s cca 80% stenózou (obr. 1). Nález na UZ koreloval s výše popsanou stenózou. Na ACI vlevo byly přítomny redukované toky s vysokou rezistencí (maximální systolická rychlost [peak systolic velocity; PSV] do 30 cm/s), na arteria cerebri media (ACM) byly symetrické rychlosti toku s nižší rezistencí vlevo (rezistenční index [RI] 0,37). Byla přítomna kolaterální cirkulace cestou arteria carotis externa-arteria ophtalmica a přední komunikanty. V neurologickém nálezu byl přítomen pouze Hornerův syndrom vlevo. Rodinná anamnéza byla nevýznamná, v předchorobí byly přítomny arteriální hypertenze a nikotinismus. Pacient medikoval perindopril-indapamid 4 mg/1,25 mg a pro karotickou disekci mu byla nasazena duální protidestičková terapie (dual antiplatelet therapy; DAPT – kyselina acetylsalicylová 100 mg + clopidogrel 75 mg). Zákrok proběhl bez komplikací, v neurologickém nálezu přetrvával Hornerův syndrom vlevo. Pacient po dimisi pokračoval v již zavedené DAPT. Před propuštěním mu byl proveden UZ karotid, kde v porovnání se vstupním vyšetřením došlo k normalizaci průtoku v levé ACI (PSV 60 cm/s, normální rezistence). Transkraniální barevná duplexní sonografie (transcranial colour-coded duplex sonography; TCCS) provedena nebyla. Při kontrole měsíc po zákroku si pacient stěžoval na asi týden trvající mírné levostranné hemikranie, poslední 2 dny pak s narůstající intenzitou a bolestí za levým okem, která se horšila vleže. Analgoterapie byla s efektem pouze v počátku obtíží. Neurologický nález byl beze změny. Na TCCS i UZ magistrálních mozkových tepen byl normální nález, se symetrickými toky na obou ACI, na ACM byla přítomna jen lehká asymetrie toků nesvědčící pro event. rozvoj CHS (vlevo PSV 120 cm/s, RI 0,46 a vpravo PSV 105 cm/s, RI 0,5). Pacientovi byla akutně provedena CT mozku vč. angiografie mozkových tepen, s nálezem edému bílé hmoty levé hemisféry s pravostranným středočárovým přesunem asi o 4 mm a četných hypodenzit v bílé hmotě levé hemisféry, bez známek zakrvácení (obr. 2A). Dle angiografie se stent jevil normálně průchodný. Pacient byl akutně přijat na monitorované lůžko k antiedematózní terapii (mannitol) a monitoraci krevního tlaku. V akutním režimu byla provedena MR mozku s nálezem, který odpovídal CHS (obr. 2B). Druhý den hospitalizace došlo u pacienta k rozvoji celkem tří generalizovaných tonicko-klonických epileptických paroxysmů s akutním respiračním selháním, nutností orotracheální intubace a umělé plicní ventilace (UPV). Arteficiální kóma bylo navozeno midazolamem. Do medikace byl přidán levetiracetam v denní dávce 3 g. Elektroencefalografie byla bez detekce epileptické aktivity. Hyperventilací na UPV byla navozena hypokapnie (pCO2 4 kPa) k podpoře vazokonstrikce. Třetí den byla vysazena sedativní medikace, pacient se probral k plnému vědomí, byl odpojen od UPV a následně extubován. Neurologický nález byl stacionární, intenzita hemikranie mírnější, hodnoty krevního tlaku se pohybovaly v mezích normy na stávající antihypertenzní medikaci a antiepileptika byla převedena do perorální formy. Po 2týdenní hospitalizaci byl pacient propuštěn do ambulantní péče. Na kontrolním UZ magistrálních mozkových tepen po 3 měsících byl normální symetrický nález na extrakraniálních mozkových tepnách. Na TCCS bilaterálně detekovány normální symetrické laminární toky na ACM (PSV 100 cm/s a RI 0,52 vlevo, PSV 96 cm/s a RI 0,52 vpravo) a normální dopředné toky na ACA oboustranně. Dle kontrolní MR za 3 měsíce došlo téměř k normalizaci nálezu v levé hemisféře. V plánu je další ambulantní kontrola za půl roku, vč. kontrolní MR a elektroencefalografie.
Image 1. Digitální subtrakční angiografie provedená z a. carotis communis vlevo znázorňující dissekující aneuryzma a. carotis interna vlevo o velikosti 11,6 x 4,5 mm působící nejméně 80% stenózu.
Fig. 1. Digital subtraction angiography performed from the left common carotid artery showing a left internal carotid artery dissecting aneurysm measuring 11.6 x 4.5 mm causing at least 80% stenosis.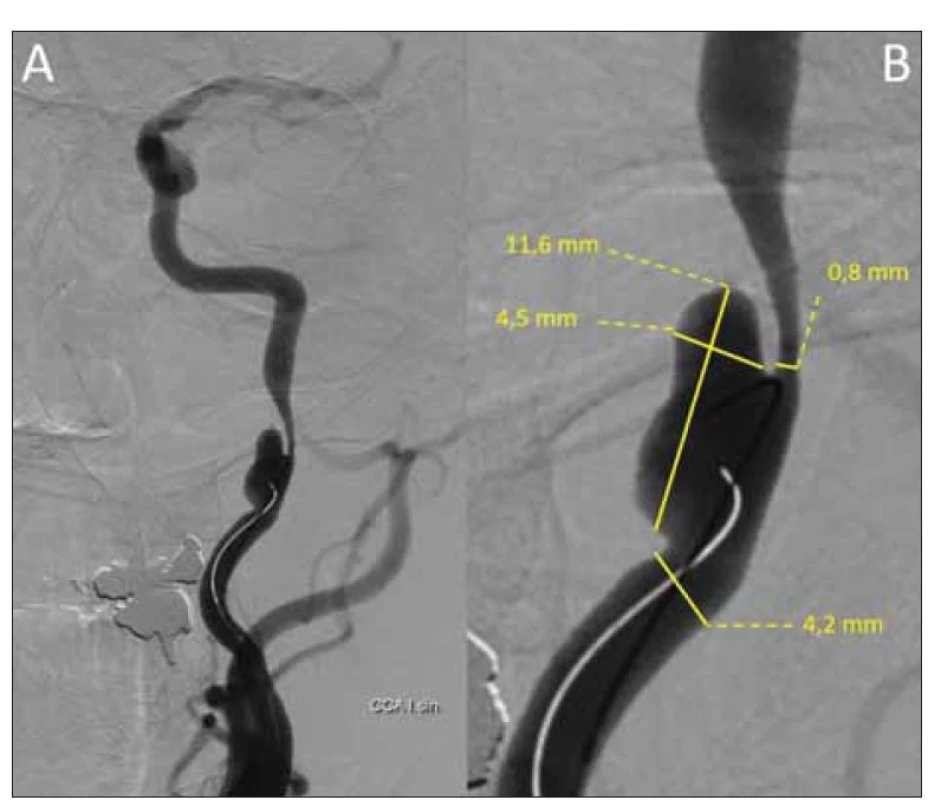
Image 2. (A) Na nativní CT mozku 28 dní po CAS jsou znázorněny mapovité hypodenzity lokalizované v bílé hmotě subkortikálně ve všech lalocích levé hemisféry, bez průkazu krvácení. (B) MR 28 dní po CAS znázorňuje patologický signál v subkortikální bílé hmotě levé hemisféry, který odpovídá vazogennímu edému (T2 hyperintenzní, T1 nativně hypointenzní, ADC hyperintenzní, bez změny signálu na DWI, tj. bez známek restrikce difuze). Změny jsou doprovázené vícečetnými okrsky patologického sycení leptomeningeálně (hyperintenzní na T1 postkontrastně).
ADC – apparent diffusion coefficient; CAS – stenting karotické arterie; DWI – difuzí vážené obrazy
Fig. 2. (A) Non-contrast CT of the brain 28 days after CAS shows confluent white matter hypodensities in the subcortical regions of all lobes of the left hemisphere, without hemorrhage. (B) MRI 28 days after CAS shows a pathological signal in the subcortical white matter of the left hemisphere corresponding to vasogenic edema (T2 hyperintense, non-contrast T1 hypointense, ADC hyperintense, no signal change on DWI, i.e., without signs of restricted diffusion). These changes are accompanied by numerous areas of pathological leptomeningeal enhancement (hyperintense on contrast-enhanced T1).
ADC – apparent diffusion coefficient; CAS – carotid artery stenting; DWI – diffusion-weighted imaging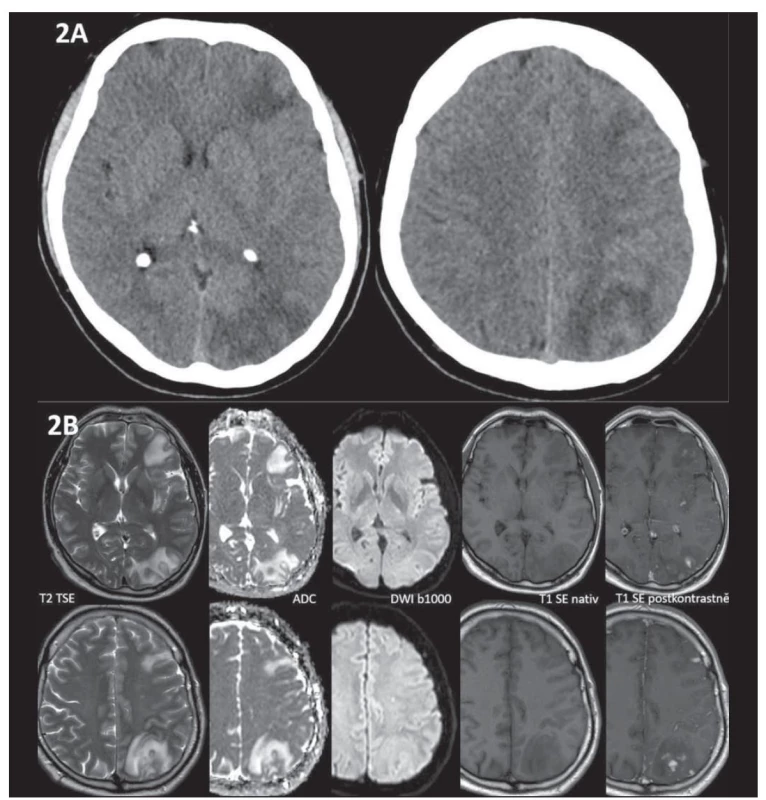
Při zpětném hodnocení případu je zřejmé, že se jednalo o pacienta s typickým klinickým obrazem CHS při relativně pozdním nástupu obtíží. Kromě významné stenózy jsme nedetekovali jiné rizikové faktory. Proti rozvoji také svědčila normotenze po celou dobu po zákroku a absence významnějšího zvýšení rychlostí toku v ACM. Normotenze (129/80 mm Hg, tepová frekvence 90) přetrvávala i při symptomatice CHS. Zajímavostí bylo, že i přes nasazenou antiedémovou terapii došlo ke zhoršení neurodeficitu s rozvojem epileptických paroxysmů. Zavedená sedace s hyperventilací již byla s terapeutickým efektem.
Právě důsledná monitorace a korekce krevního tlaku po zákroku se jeví jako nejvýznamnější v rámci prevence [7]. Většina studií doporučuje udržování krevního tlaku na úrovni do 140/90 mm Hg, u rizikovějších pacientů se doporučuje udržování těsné normotenze [3].
Zobrazovací metody jsou pro stanovení diagnózy klíčové. Transkraniální dopplerovská sonografie je široce dostupná metoda, která je schopna zhodnotit a předpovědět vznik CHS před operací, během i po ní [2,3].
Příznaky CHS jsou při včasně zahájené léčbě reverzibilní a jak ukazuje naše kazuistika, je nutné s možností rozvoje CHS počítat i po delším časovém odstupu od zákroku a u normotenzních pacientů. Zároveň chceme zdůraznit důležitost provádění TCCS po výkonu, kde by přítomnost asymetrie toků na ACM mohla predikovat vznik CHS.
Etické aspekty
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Pacient podepsal informovaný souhlas a se zpracováním svého případu ve formě kazuistiky souhlasí.
Rukopis byl přečten a schválen k publikaci všemi spoluautory a byly splněny požadavky na autorství.
Grantová podpora
Práce byla podpořena z prostředků MZ ČR – RVO (FNBr, 65269705) a projektem specifického výzkumu č. MUNI/A/1600/2020 z programu podpory studentských projektů na Masarykově univerzitě.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.MUDr. Lucia Hrežová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
62500 Brno
e-mail: hrezova.lucia@fnbrno.cz
Přijato k recenzi: 18. 11. 2021
Přijato do tisku: 2. 2. 2022
Sources
1. Farooq MU, Goshgarian C, Min J et al. Pathophysiology and management of reperfusion injury and hyperperfusion syndrome after carotid endarterectomy and carotid artery stenting. Exp Transl Stroke Med 2016; 8 (1): 7. doi: 10.1186/s13231-016-0021-2.
2. Moulakakis KG, Mylonas SN, Sfyroeras GS et al. Hyperperfusion syndrome after carotid revascularization. J Vasc Surg 2009; 49 (4): 1060–1068. doi: 10.1016/j.jvs.2008.11.026.
3. van Mook WN, Rennenberg RJ, Schurink GW et al. Cerebral hyperperfusion syndrome. Lancet Neurol 2005; 4 (12): 877–888. doi: 10.1016/S1474-4422 (05) 70251-9.
4. Huibers AE, Westerink J, de Vries EE et al. Editor’s choice – cerebral hyperperfusion syndrome after carotid artery stenting: a systematic review and meta-analysis. Eur J Vasc Endovasc Surg 2018; 56 (3): 322–333. doi: 10.1016/j.ejvs.2018.05.012.
5. Lin Y-H, Liu H-M. Update on cerebral hyperperfusion syndrome. J Neurointerv Surg 2020; 12 (8): 788–793. doi: 10.1136/neurintsurg-2019-015621.
6. Abou-Chebl A, Yadav JS, Reginelli JP et al. Intracranial hemorrhage and hyperperfusion syndrome following carotid artery stenting. J Am Coll Cardiol 2004; 43 (9): 1596–1601. doi: 10.1016/j.jacc.2003.12.039.
7. Kirchoff-Torres KF, Bakradze E. Cerebral hyperperfusion syndrome after carotid revascularization and acute ischemic stroke. Curr Pain Headache Rep 2018; 22 (4): 24. doi: 10.1007/s11916-018-0678-4.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2022 Issue 1-
All articles in this issue
- Editorial
- Poděkování recenzentům
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Komentář k článku autorů Fialová et al Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Poruchy čichu po transnazálních endoskopických operacích adenomu hypofýzy
- Česká verze nástroje Mini-BESTest a doporučení pro jeho klinické použití
- Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolesti
- Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
- Dilatace skalpu podkožními expandéry před sekundární počítačově modelovanou kranioplastikou z porózního polyethylenu
- Zemřel doc. MUDr. Vilibald Vladyka, CSc.
- Zemřela doc. MUDr. Miluše Havlová, CSc.
- Odešel prim. MUDr. Hanuš Baš, CSc.
- Prof. MUDr. Zdeněk Kadaňka, CSc., osmdesátiletý
- Výsledky chirurgické terapie meralgia paresthetica 15 pacientů
- Test-retest hodnocení spolehlivosti čichového testu (Odorized Markers Test)
- Vliv fluoxetinu na obnovu funkční nezávislosti u pacientů po akutní ischemické cévní mozkové příhodě a prognostické faktory
- Lokalizovaná neurofibromatóza typu 1 v mozaice
- Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

