-
Medical journals
- Career
Zobrazení difuzních tenzorů u pacientů s idiopatickým normotenzním hydrocefalem
Authors: T. Radovnický 1; D. Adámek 2; M. Derner 2; M. Sameš 1
Authors‘ workplace: Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Radiodiagnostické oddělení, Masarykova nemocnice v Ústí nad Labem, o. z. 2
Published in: Cesk Slov Neurol N 2017; 80/113(3): 328-331
Category: Original Paper
doi: https://doi.org/doi: 10.14735/amcsnn2017328Podpořeno grantem IGA MZ NT14448-3/ 2013. Děkujeme RNDr. Karlu Hrachovi, Ph.D., z Univerzity J. E. Purkyně v Ústí nad Labem za statistické zpracování dat.
Overview
Úvod:
V diagnostice idiopatického normotenzního hydrocefalu (iNPH) chybí spolehlivý nástroj. Perspektivu má magnetická rezonance (MR). Jednou z modalit MR je zobrazení difuzních tenzorů (DTI). Cílem bylo porovnat parametry DTI u pacientů před operací a po ní a u zdravých dobrovolníků.Metodika a materiál:
Pacientům byla provedena MR mozku před operací a 1 rok po operaci. Dále byli vyšetřeni zdraví dobrovolníci. Parametry DTI (frakční anizotropie; FA; průměrná difuzivita; MD) byly měřeny v předním a zadním raménku capsula interna a v corpus callosum (ALIC, PLIC, CC). Do studie bylo zahrnuto 27 pacientů s iNPH a 24 zdravých dobrovolníků.Výsledky:
U iNPH pacientů byla MD vyšší ve všech měřených oblastech než u zdravých dobrovolníků (p < 0,05). FA byla u pacientů vyšší jen v PLIC (p < 0,001). Jeden rok po operaci byl patrný pokles hodnoty FA v PLIC (p < 0,001). V jiných oblastech k poklesu FA či MD nedošlo. Hodnota FA v PLIC ani po operaci nedosáhla hodnot zdravých dobrovolníků (0,63 po operaci vs. 0,58 u kontrol).Závěr:
Hodnota FA v PLIC je u pacientů s iNPH signifikantně vyšší než u zdravých. Po operaci klesá. Hodnoty MD byly vyšší v ALIC, PLIC i CC. Po operaci pokles nenastává, což odráží stupeň degenerace bílé hmoty u pacientů s iNPH.Klíčová slova:
idiopatický normotenzní hydrocefalus – magnetická rezonance – zobrazení difuzních tenzorůÚvod
Idiopatický normotenzní hydrocefalus (iNPH) je nemoc známá již desítky let. Jedná se o dilataci mozkových komor s normálním tlakem mozkomíšního moku spojenou s poruchami chůze, demencí a inkontinencí [1,2]. Známe léčbu – implantaci zkratu (nejčastěji ventrikuloperitoneálního) [3,4], ale stále existují nejasnosti v patofyziologii a díky tomu i v optimálním diagnostickém algoritmu. Standardem jsou doplňkové testy (tap test, lumbální infuzní test, zevní lumbální drenáž). Jejich pozitivní výsledek diagnózu iNPH potvrdí, ale negativní výsledek diagnózu nevyloučí [5]. Jejich nevýhodou je navíc i jistá invazivita. Stále tedy nemáme široce akceptovanou a spolehlivou diagnostickou metodu pro přesnou identifikaci pacientů s iNPH. Tento fakt nabývá na významu zvláště ve chvíli, kdy si uvědomíme, že většina pacientů s touto diagnózou zůstává neodhalena, a tedy bez adekvátní léčby, protože jsou často vedeni pod jinou diagnózou (např. Alzheimerova či Parkinsonova choroba) [6,7]. Proto v posledních letech zaznamenáváme intenzivní snahu identifikovat specifické znaky iNPH na zobrazovacích vyšetřeních, zejména na magnetické rezonanci (MR). Diagnostika založená na MR by v sobě měla jasné výhody – jednoduchost, neinvazivitu, objektivitu, dostupnost. Omezena by byla jen obecnými kontraindikacemi MR. Zkoumán je obraz iNPH na konvenční MR – dilatace mozkových komor, periventrikulární hyperintenzity na T2 váženém obraze, disproporcionálně rozšířené subarachnoideální prostory apod. [8]. Existují ale i metody, které pomohou zobrazit mikrostrukturální změny mozkové tkáně. Mezi tyto metody patří zobrazení difuzních tenzorů (Diffusion Tensor Imaging; DTI). Tato metoda je založena na detekci pohybu molekul vody v mozkové tkáni. Používá difuzní gradienty k určení difuzního tenzoru a získání hodnot průměrné difuzivity (Mean Diffusivity; MD) a frakční anizotropie (FA) [9]. MD vyjadřuje difuzivitu bez ohledu na směr, FA vyjadřuje směrovou závislost procesu difuze. FA je vypočtena jako část difuzního tenzoru odpovídající anizotropii. Hodnota FA = 0 odpovídá izotropnímu médiu (v mozku je tímto médiem mozkomíšní mok). Symetrická anizotropie, kdy probíhá difuze jen jediným směrem, je vyjádřena hodnotou FA = 1. Tedy čím je hodnota FA vyšší, tím vyšší je anizotropie a směrové uspořádání v zobrazované tkáni. Komprimovaný nervový svazek vykazuje v rovině paralelní k průběhu vláken zvýšenou difuzivitu, v rovině kolmé sníženou. To vede celkově ke zvýšení frakční anizotropie v komprimovaném svazku [10]. Tento fakt lze využít právě v diagnostice hydrocefalu, kdy dilatované mozkové komory komprimují přilehlou bílou hmotu. V té se pak zvyšuje hodnota FA [11]. Cílem této studie bylo porovnat hodnoty DTI v určitých oblastech mozku u pacientů s iNPH před operací a po ní, dále porovnat hodnoty u pacientů, kteří z operace profitovali, a u těch, kteří ne. Naměřené hodnoty byly srovnány s referenčními hodnotami DTI získanými od zdravých dobrovolníků.
Metodika a materiál
Do této prospektivní studie jsme zahrnuli pacienty s iNPH a zdravé dobrovolníky. Všichni vyšetření podepsali informovaný souhlas, studie byla vedena v souladu s Helsinskou deklarací a byla schválena lokální etickou komisí. Pacienti s iNPH byli identifikováni na základě klinického a grafického vyšetření a pomocí doplňkových testů (suplementární testy – tap test, lumbální infuzní test). Při klinickém vyšetření byla odebrána kompletní anamnéza se zaměřením na délku trvání, dynamiku a tíži symptomů. Pokud informace od pacienta nebyly spolehlivé, byly získány od rodiny či ze zdravotnické dokumentace. Zvláštní důraz byl kladen na poruchy chůze. Radiologická kritéria pro zařazení do studie byla rozšíření komorového systému daná Evansovým indexem > 0,3; neprokázaná obstrukce v likvorových cestách a absence jiné patologie, která by mohla ovlivnit následné hodnocení DTI nebo klinického efektu operace. Po zhodnocení klinického a grafického nálezu byl proveden jeden ze suplementárních testů. U chodících pacientů byl proveden tap test, u imobilních lumbální infuzní test (celkem 12 lumbálních infuzních testů, 15 tap testů). Lumbální infuzní test provádíme dle standardního protokolu dle Katzmana a Husseye s vyčkáním steady state a měřením výtokového odporu (Rout) [12]. Test považujeme za pozitivní, pokud je Rout > 11 mm Hg/ ml/ min. Tap test provádíme odpuštěním 30 – 50 ml likvoru s měřením 10metrového testu chůze po 3 hod. Test je považován za pozitivní, pokud se oba parametry času a počtu kroků oproti testu před punkcí zlepší alespoň o 10 % nebo jeden z parametrů alespoň o 20 %. V případě pozitivity testu byl pacient indikován ke zkratové operaci a začleněn do studie. Zjednodušeně lze říci, že do studie byli zahrnuti pacienti splňující kritéria pravděpodobného nebo možného iNPH (probable, possible iNPH) [13] s pozitivním suplementárním testem. U všech operovaných pacientů byl zaveden ventrikuloperitoneální zkrat (VP shunt) s programovatelným ventilem (Codman®, Hakim® či Certas® s antisifonovou jednotkou Siphonguard®). Klinický efekt implantace byl zjišťován 1., 3., 6. a 12. měsíc po operaci. Pro hodnocení klinického stavu pacientů byla použita stupnice dle Kiefera [14] a modifikovaná Rankinova škála (mRS) [15], pro zhodnocení efektu operace pak NPH recovery rate dle Meiera [16]. Pacient, který se po implantaci VP shuntu zlepšil v mRS rok po operaci o 1 bod a v NPH recovery rate stupnici alespoň o 3 body, byl označen jako shunt responder. Pacient, který tohoto zlepšení nedosáhl, jako non-respondér. Dále byla vyšetřena skupina dobrovolníků stejné věkové charakteristiky, která na MR nesměla mít žádný signifikantní patologický nález, tedy ani dilataci komorového systému. Přípustná byla lehká korová atrofie. U všech pacientů bylo provedeno vyšetření MR na systému Siemens Avanto 1,5T (Erlangen, Německo) před operací a rok po operaci. Pro účely hodnocení parametrů DTI (FA a MD) byly naměřeny MR obrazy sekvencí spinového echa EPI s 20 směry kódování difuze (multi-directional diffusion weighted images, b faktor 1 000 s/ mm2, tloušťka vrstev 2 mm, echo čas 94 ms, repetiční čas 7 300 ms, FOV 382 × 382 mm2, velikost voxelu 2 × 2 × 2 mm3) a také obrazy bez difuzního vážení (b faktor = 0) (obr. 1). Hodnoty byly získány pomocí voxel-based analýzy parametrických map FA a MD (software Syngo MR, Siemens) v předním raménku capsula interna (ALIC), zadním raménku capsula interna (PLIC) a v těle corpus callosum (CC). Pro měření jsme preferovali levou mozkovou hemisféru, protože na našem pracovišti rutinně zavádíme VP shunt zprava a měření by mohlo být ovlivněno artefaktem ventilu. Měření bylo provedeno radiologem, který neměl přístup ke klinickým datům pacienta. Statistické zpracování dat bylo vykonáno pomocí softwaru R – project. Pro porovnání naměřených hodnot u pacientů před operací a po operaci jsme použili párový t-test, pro srovnání hodnot mezi pacienty a zdravými kontrolami dvouvýběrový t-test, pro test shody rozptylů pak F-test.
Image 1. Mapa frakční anizotropie u pacienta s iNPH. Fig. 1. Map of fractional anisotropy in a patient with iNPH. 
Do studie bylo zahrnuto 27 pacientů s iNPH věkového průměru 72,4 let (51 – 86 let). Mezi nimi bylo 17 mužů a 10 žen. Zdravých dobrovolníků jsme vyšetřili 24 (13 mužů a 11 žen) s věkovým průměrem 69,3 let (60 – 79 let). Všech 27 pacientů s iNPH podstoupilo implantaci VP shuntu.
Výsledky
Po operaci nastalo klinické zlepšení u 23 pacientů (85,2 % respondérů), u čtyř pacientů nikoli (14,8 % non-responderů). Výsledky FA a MD v ALIC, PLIC a CC jsou uvedeny v tab. 1 a 2. Při statistickém porovnání hodnot MD a FA v ALIC, PLIC a CC mezi pacienty před operací a zdravými kontrolami vyšlo najevo, že ve všech měřených oblastech byla MD vyšší u pacientů než u kontrol (p < 0,05). FA byla u pacientů signifikantně vyšší jen v PLIC (p < 0,001). Při srovnání hodnot u pacientů před operací a 1 rok po operaci byl patrný signifikantní pokles hodnoty FA v PLIC (p < 0,001). V jiných oblastech k poklesu FA či MD nedošlo. Hodnota FA v PLIC ani po operaci však nedosáhla hodnot zdravých dobrovolníků (0,63 po operaci vs. 0,58 u kontrol). Mezi skupinami shunt responderů a non-responderů byla bohužel výrazná asymetrie obou skupin (23 vs. 4 pacienti), proto statistické porovnání hodnot nebylo možné.
Table 1. Hodnoty FA v jednotlivých oblastech u pacientů před a po implantaci VP shuntu a u zdravých dobrovolníků. 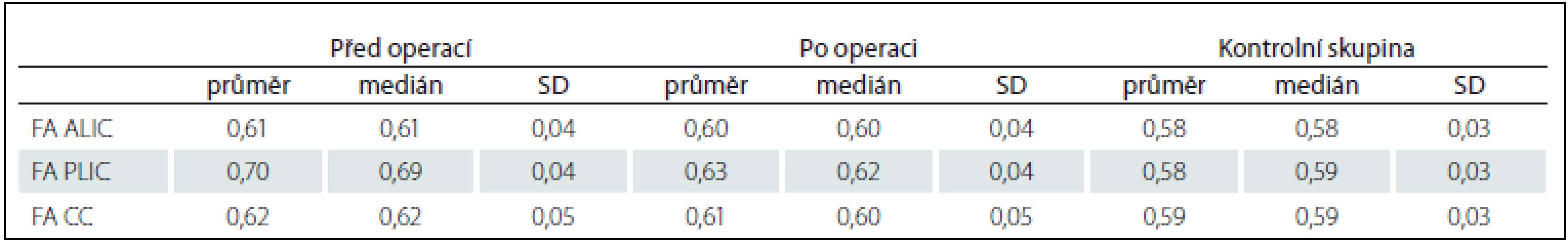
FA – frakční anizotropie, ALIC – přední raménko capsula interna, PLIC – zadní raménko capsula interna, CC – corpus callosum, SD – směrodatná odchylka. Table 2. Hodnoty MD v jednotlivých oblastech u pacientů před a po implantaci VP shuntu a u zdravých dobrovolníků. 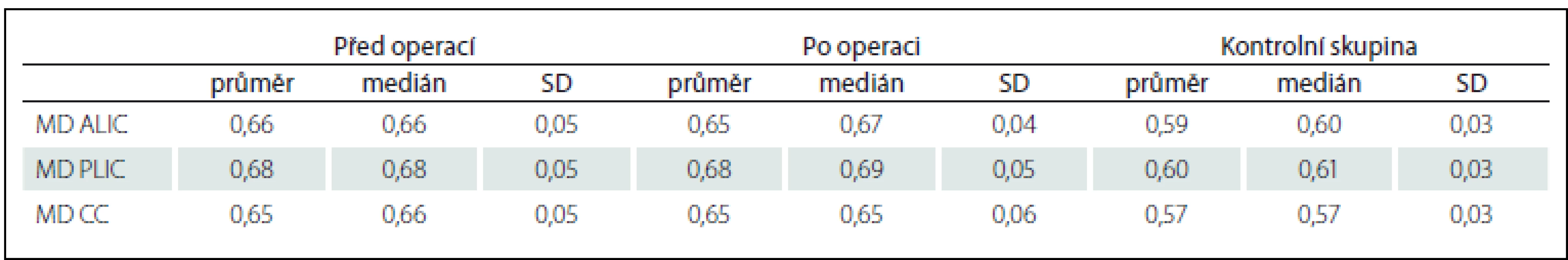
MD – průměrná difuzivita (jednotka 10–3 mm2/s), ALIC – přední raménko capsula interna, PLIC – zadní raménko capsula interna, CC – corpus callosum, SD – směrodatná odchylka. Diskuze
Schopnost DTI detekovat mikrostrukturální změny bílé hmoty dané kompresí dilatovanými mozkovými komorami byla již prokázána [17,18]. Publikované výsledky však zatím nevedly k začlenění této metodiky do diagnostického algoritmu iNPH. Naším cílem bylo analyzovat MD a FA v našem souboru a pokusit se etablovat DTI jakožto diagnostický nástroj iNPH. Na výsledky analýzy se podíváme z pohledu jednotlivých parametrů DTI, tedy FA a MD. FA byla u pacientů s iNPH před operací signifikantně vyšší nežli u kontrol pouze v PLIC (0,70 vs. 0,58). V jiných oblastech významný rozdíl nebyl nalezen. Po implantaci VP shuntu došlo k poklesu této hodnoty (0,63). Úrovně zdravých dobrovolníků ale pokles nedosáhl. PLIC lze tedy označit za oblast, která je relativně nejvíce postižena kompresí. Tento tlak se po zavedení VP shuntu snižuje, nicméně nedojde k návratu k fyziologickým hodnotám. Porovnáme-li naše výsledky s literárními údaji, pak zjistíme, že u pacientů s iNPH bývá právě elevace FA v PLIC s poklesem po derivaci likvoru nejčastějším nálezem [18 – 21]. Hattingen et al v jejich souboru pacientů s iNPH pozorovali vyšší hodnotu FA v PLIC než u zdravých dobrovolníků, ale v CC byla tato hodnota nižší. To vysvětlují tím, že PLIC leží laterálně od komorového systému a jeho tlak daný dilatací způsobuje jakousi konsolidaci vláken v této bílé hmotě. Tím se zvyšuje hodnota FA. Naopak CC probíhá, zjednodušeně řečeno, nad komorovým systémem a jeho dilatace tedy způsobí jakýsi rozestup či dezintegraci vláken v této struktuře. Tím se hodnota FA snižuje [18]. Stejný závěr studie prezentují Koyama et al, kteří dokonce našli korelát tíže poruchy chůze s nižší hodnotou FA v CC [22]. V našich výsledcích jsme nižší hodnotu FA v CC ale nenašli, a tuto teorii tedy potvrdit nemůžeme.
Při zhodnocení MD u pacientů před operací jsme oproti kontrolám zaznamenali signifikantně vyšší hodnotu jak v ALIC a PLIC, tak v CC. Shodný závěr uvádí Hattingen et al. MD vidí jako odraz určitého stupně axonální degenerace měřené bílé hmoty [18]. Po implantaci VP shuntu v žádné z měřených oblastí nedošlo k signifikantnímu poklesu. Znamená to tedy jistou nevratnost procesu degenerace. Nabízí se otázka, zda byla degenerace vyšší u non-respondérů oproti respondérům. Pro asymetrii skupin respondérů a non-respondérů jsme bohužel nemohli uskutečnit statistickou analýzu. Vypočítáme-li prostý průměr naměřených hodnot, pak měli non-respondéři skutečně před operací vyšší MD ve všech oblastech (MD ALIC 0,65 vs. 0,69, MD PLIC 0,66 vs. 0,77, MD CC 0,64 vs. 0,71). Statistickou významnost ale stanovit nemůžeme.
Hlavním limitem naší studie může být metodologie měření hodnot FA a MD. V našem případě byla použita voxel-based analýza parametrických map. V současné době jsou již k dispozici sofistikovanější metody, které umožňují přesné měření, zatížené minimální chybou (např. tract based spatial statistics). V době náběru dat pro tuto studii nebyla jiná metoda rutinně dostupná.
Naším hlavním cílem bylo začlenění MR do diagnostiky iNPH a pomoci tak zjednodušit celé vyšetřovací schéma, které je navíc v identifikaci iNPH pacientů relativně nespolehlivé [5]. I přes dosažené signifikantní výsledky jsme cíle však nedosáhli. Pravda je, že hodnoty FA i MD vykazují u pacientů s iNPH určité odlišnosti oproti zdravým kontrolám. Rutinní využití DTI v diagnostickém algoritmu iNPH ale naráží na několik problémů. Prvním z jich je relativní metodologická složitost a časová náročnost vyhodnocení DTI. Dalším problémem je interpretace výsledků pro konkrétního pacienta a přesah hodnot. Podíváme-li se např. na FA v PLIC, pak je zde u iNPH rozptyl hodnot 0,63 – 0,75. Pro zdravé je rozmezí naměřených hodnot 0,52 – 0,65. Naměříme-li tedy hodnotu např. 0,64, potom se nacházíme v šedé hraniční zóně. DTI tedy dokáže v diagnostice iNPH pouze napovědět. Každé centrum, které se touto chorobou zabývá, by mělo mít diagnostiku opřenou zejména o vyhodnocení klinického a grafického nálezu s přihlédnutím k suplementárním testům. I přesto ale naše studie poskytuje informace, které mohou pomoci k porozumění patofyziologických mechanizmů iNPH.
Závěr
Studie prokázala, že hodnota FA v PLIC je u pacientů s iNPH signifikantně vyšší než u zdravých dobrovolníků. Po derivaci likvoru klesá. Hodnoty MD byly vyšší v ALIC, PLIC i CC. Po operaci však pokles nenastává, což odráží určitý stupeň nevratné degenerace bílé hmoty u pacientů s iNPH. Využití DTI v diagnostice iNPH je doplňková metoda. Selekci pacientů k implantaci VP shuntu pouze na základě DTI zatím nelze doporučit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Radovnický
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 3316/12A
400 11 Ústí nad Labem
e-mail: tomas.radovnicky@kzcr.eu
Přijato k recenzi: 5. 1. 2016
Přijato do tisku: 1. 3. 2017
Sources
1. Adams RD, Fisher CM, Hakim S, et al. Symptomatic occult hydrocephalus with ‘normal’ cerebrospinal-fluid pressure. A treatable syndrome. N Engl J Med 1965;273 : 117 – 26.
2. Hakim S, Adams RD. The special clinical problem of symptomatic hydrocephalus with normal cerebrospinal fluid pressure. Observations on cerebrospinal fluid hydrodynamics. J Neurol Sci 1965;2(4):307 – 27.
3. Klinge P, Marmarou A, Bergsneider M, et al. Outcome of shunting in idiopathic normal-pressure hydrocephalus and the value of outcome assessment in shunted patients. Neurosurgery 2005;57(Suppl 3):S40 – 52.
4. Bergsneider M, Black PM, Klinge P, et al. Surgical management of idiopathic normal-pressure hydrocephalus. Neurosurgery 2005;57:S29 – 39.
5. Wikkelsø C, Hellström P, Klinge PM, et al. The European iNPH Multicentre Study on the predictive values of resistance to CSF outflow and the CSF Tap Test in patients with idiopathic normal pressure hydrocephalus. J Neurol Neurosurg Psychiatry 2013;84(5):562 – 8. doi: 10.1136/ jnnp-2012-303314.
6. Martín-Láez R, Caballero-Arzapalo H, López-Menéndez LÁ, et al. Epidemiology of Idiopathic Normal Pressure Hydrocephalus: a Systematic Review of the Literature. World Neurosurg 2015;84(6):2002 – 9. doi: 10.1016/ j.wneu.2015.07.005.
7. Jaraj D, Rabiei K, Marlow T, et al. Prevalence of idiopathic normal-pressure hydrocephalus. Neurology 2014;82(16):1449 – 54. doi: 10.1212/ WNL.0000000 000000342.
8. Kitagaki H, Mori E, Ishii K, et al. CSF spaces in idiopathic normal pressure hydrocephalus: morphology and volumetry. AJNR Am J Neuroradiol 1998;19(7):1277 – 84.
9. Le Bihan D, Turner R, Douek P, et al. Diffusion MRimaging: clinical applications. AJR Am J Roentgenol 1992;159(3):591 – 9.
10. Schonberg T, Pianka P, Hendler T, et al. Characterization of displaced white matter by brain tumors using combined DTI and fMRI. Neuroimage 2006;30(4):1100 – 11.
11. Uluğ AM, Truong TN, Filippi CG, et al. Diffusion imaging in obstructive hydrocephalus. AJNR Am J Neuroradiol 2003;24(6):1171 – 6.
12. Katzman R, Hussey F. A simple constant-infusion manometric test for measurement of CSF absorption. I. Rationale and method. Neurology 1970;20(6):534 – 44.
13. Relkin N, Marmarou A, Klinge P, et al. Diagnosing idiopathic normal-pressure hydrocephalus. Neurosurgery 2005;57(Suppl 3):S4 – 16.
14. Kiefer M, Eymann R, Komenda Y, et al. A grading system for chronic hydrocephalus. Zentralblatt Für Neurochir 2003;64(3):109 – 15.
15. Bloch RF. Interobserver agreement for the assessment of handicap in stroke patients. Stroke 1988;19(11):1448.
16. Meier U. The grading of normal pressure hydrocephalus. Biomed Tech 2002;47(3):54 – 8.
17. Assaf Y, Ben-Sira L, Constantini S, et al. Diffusion tensor imaging in hydrocephalus: initial experience. AJNR Am J Neuroradiol 2006;27(8):1717 – 24.
18. Hattingen E, Jurcoane A, Melber J, et al. Diffusion tensor imaging in patients with adult chronic idiopathic hydrocephalus. Neurosurgery 2010;66(5):917 – 24. doi: 10.1227/ 01.NEU.0000367801.35654.EC.
19. Kim MJ, Seo SW, Lee KM, et al. Differential diagnosis of idiopathic normal pressure hydrocephalus from other dementias using diffusion tensor imaging. AJNR Am J Neuroradiol 2011;32(8):1496 – 503. doi: 10.3174/ ajnr.A2531.
20. Hattori T, Ito K, Aoki S, et al. White matter alteration in idiopathic normal pressure hydrocephalus: tract-based spatial statistics study. AJNR Am J Neuroradiol 2012;33(1):97 – 103. doi: 10.3174/ ajnr.A2706.
21. Nakanishi A, Fukunaga I, Hori M, et al. Microstructural changes of the corticospinal tract in idiopathic normal pressure hydrocephalus: a comparison of diffusion tensor and diffusional kurtosis imaging. Neuroradiology 2013;55(8):971 – 6. doi: 10.1007/ s00234-013-1201-6.
22. Koyama T, Marumoto K, Domen K, et al. White matter characteristics of idiopathic normal pressure hydrocephalus: a diffusion tensor tract-based spatial statistic study. Neurol Med Chir 2013;53(9):601 – 8.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 3-
All articles in this issue
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Výsledky endokrinních funkcí hypofýzy po transsfenoidálních operacích afunkčních makroadenomů
- Radiologické nálezy u donošených novorozenců s hypoxicko-ischemickou encefalopatií
- Token test – validační studie české verze u osob vyššího věku a pacientů s neurodegenerativním onemocněním mozku
- Měření simulace – Test mince v ruce
- Efekty cílené orofaciální rehabilitace u pacientů s poruchou řečových funkcí po cévní mozkové příhodě
- Zobrazení difuzních tenzorů u pacientů s idiopatickým normotenzním hydrocefalem
- Anti-NMDAR protilátky u demyelinizačních onemocnění
- Pyridoxin dependentní epilepsie – kazuistiky
- Klasifikace nádorů centrálního nervového systému – WHO 2016 Update
- Kvalita života u soběstačných pacientů po cévní mozkové příhodě
- Myotonická dystrofie – jednota v různosti
- Febrilní křeče – méně je někdy více
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Úspěšná léčba meningoencefalitidy vyvolané Cryptococcus gattii Ommaya rezervoárem a intratékální injekcí amfotericinu B – kazuistika
- Diferenciální diagnostika bithalamické a palidální hypointenzity – kazuistika s mutací HEXB
- Signifikantní edém mozku u neprasklé arteriovenózní malformace – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myotonická dystrofie – jednota v různosti
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Febrilní křeče – méně je někdy více
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

