-
Medical journals
- Career
Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
Authors: J. Mraček 1; V. Runt 1; P. Duras 2; V. Přibáň 1
Authors‘ workplace: LF UK a FN Plzeň Neurochirurgické oddělení 1; LF UK a FN Plzeň Klinika zobrazovacích metod 2
Published in: Cesk Slov Neurol N 2014; 77/110(3): 373-379
Category: Case Report
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Overview
Blister aneuryzma je vzácná, avšak klinicky velmi závažná příčina subarachnoidálního krvácení. Jde o nepravé aneuryzma s velmi fragilní stěnou, jehož léčba je doprovázena vysokou morbiditou a mortalitou. Je považováno za diagnostickou a terapeutickou výzvu. V kazuistice prezentujeme případ prasklého blister aneuryzmatu karotické tepny, které bylo primárně zaklipováno, a časná pooperační reruptura byla řešena přímou suturou defektu krkavice. Přestože byla mateřská tepna úspěšně zrekonstruována, došlo s časovým odstupem k rozvoji maligní ischemie mozku. Autoři předkládají literární přehled léčebných strategií blister aneuryzmatu.
Klíčová slova:
aneuryzma – arteria carotis interna – subarachnoidální krvácení – endovaskulární léčbaÚvod
Blister aneuryzmata jsou vzácná, avšak velmi specifická skupina mozkových výdutí. Představují pouze 0,3 – 1 % všech intrakraniálních aneuryzmat a 0,9 – 6,5 % aneuryzmat arteria carotis interna (ACI) [1]. Zatímco běžná vakovitá (saccular, berry) aneuryzmata se vyskytují typicky ve větvení Willisova kruhu, blister aneuryzmata jsou lokalizována přímo na kmeni ACI mimo odstupující větve. Protože svým vzhledem připomínají puchýř, v anglosaské literatuře se pro ně vžil termín „Blood Blister‑like Aneurysms“ (BBA) [1,2]. BBA jsou charakterizována malými rozměry, hemisférickým tvarem bez preformovaného krčku, fragilní blanitou stěnou a atypickou lokalizací. Uvedené vlastnosti způsobují svízelnou léčitelnost výdutě s vysokým rizikem katastrofické periprocedurální ruptury. Přestože byla již prezentována řada terapeutických způsobů, léčba nemocných s BBA je stále doprovázena vysokou morbiditou a mortalitou (MM). Blister aneuryzma představuje v cévní neurochirurgii diagnostickou i terapeutickou výzvu. Autoři ve sdělení přinášejí svoji zkušenost s mikrochirurgickým řešením prasklého blister aneuryzmatu ACI a předkládají přehled literatury.
Kazuistika
Dvaačtyřicetiletý nemocný byl vyšetřen otorinolaryngologem pro třídenní progredující cefaleu zhoršující se při předklonu hlavy. Za příčinu bolestí byla považována hyperplazie sliznic v obou antrech. Nemocný byl odeslán do domácí péče s doporučením užívat nosní kapky. Po příchodu domů opakovaně zvracel, poté šel spát. Za hodinu byl nalezen dezorientovaný a pomočený. Během transportu do nemocnice došlo k prohloubení poruchy vědomí. Při přijetí byl v kómatu, na algický podnět reagoval decerebrací, spontánně periodicky dýchal (Hunt and Hess (HH) – 5, World Federation of Neurologic Surgeons (WFNS) – 5). Počítačová tomografie (CT) ukázala difuzní subarachnoidální krvácení s maximem v levé Sylviově rýze a obstrukční hydrocefalus na podkladě hematocefalu III. a IV. komory (Fisher 4, Barow Neurological Institute – BNI 5). CT angiografie (CTA) nezobrazila přesvědčivý zdroj krvácení. Akutně byla provedena drenáž pravé postranní komory. Doplněná digitální subtrakční angiografie (DSA) ukázala drobné (2mm) široce přisedlé aneuryzma na anteromediální ploše supraklinoidního segmentu ACI vlevo (obr. 1). V oblasti výdutě byl patrný spazmus ACI. Nález byl nevhodný k radiointervenčnímu řešení, DSA byla ukončena jako diagnostická. Lokalizaci aneuryzmatu jsme předpokládali při odstupu a. hypophysealis superior a indikovali mikrochirurgickou revizi. Z pterionální kraniotomie vlevo byla obnažena krkavice s aneuryzmatem, které bylo zavzato v adhezích po předchozích opakovaných krváceních, a nebylo proto zřejmé, že jde o tenkostěnnou blister výduť (obr. 2). Po nasazení dočasných svorek na ACI bylo zasvorkováno miniklipem (obr. 3). Peroperační fluorescenční angiografie (ICG) ukázala vyřazenou výduť a průchodnou ACI. Spastický segment ACI jsme obložili Spongostanem napojeným papaverinem. Operace proběhla bez komplikací. Při překladu nemocného z operačního stolu na transportní lůžko však náhle vznikla bilaterální mydriáza, v komorové drenáži se objevila čerstvá krev a došlo k vzestupu krevního tlaku na 240/ 120 torrů. Pro velmi pravděpodobnou rerupturu jsme provedli urgentní operační revizi. Při operaci byl odstraněn subdurální hematom a poté obnažena ACI, která byla po předchozím podání papaverinu značně dilatována. Záhy se objevilo masivní krvácení z defektu stěny ACI v místě původně klipované výdutě. Aneuryzma se svorkou bylo téměř v celém rozsahu odtrženo od stěny ACI. Mateřskou tepnu jsme dočasně zaklipovali a provedli suturu defektu jednotlivými stehy (8/ 0). Čas dočasného uzávěru tepny byl 10 min. Sutura byla zcela suficientní, ACI byla mírně stenózována (obr. 4). Tepna byla obalena vatičkou a zalepena Tissucolem. Vzhledem k předpokládanému otoku mozku po opakovaných atakách krvácení byl výkon ukončen hemisferální dekompresivní kraniektomií. CT včetně perfuzního vyšetření provedené první pooperační den nevykazovalo známky mozkové ischemie a alterace mozkové perfuze (obr. 5). CTA ukázala průchodnou krkavici v oblasti sutury zúženou podobně jako při vazospazmu před operací a chudší plnění periferie střední mozkové tepny (obr. 6). Nemocný byl řízeně ventilován, byla udržována arteriální hypertenze. Transkraniální dopplerometrie (TCD) potvrdila rozvoj vazospazmů v povodí levé ACI. Kontrolní CT provedené po dvou dnech ukázalo alteraci perfuze a rozvoj maligní ischemie v celém povodí levé ACI. Nemocný zemřel devět dní po operaci pod klinickým obrazem smrti mozku.
Image 1. Angiografie ukazuje drobné aneuryzma na spastickém supraklinoidním segmentu ACI. 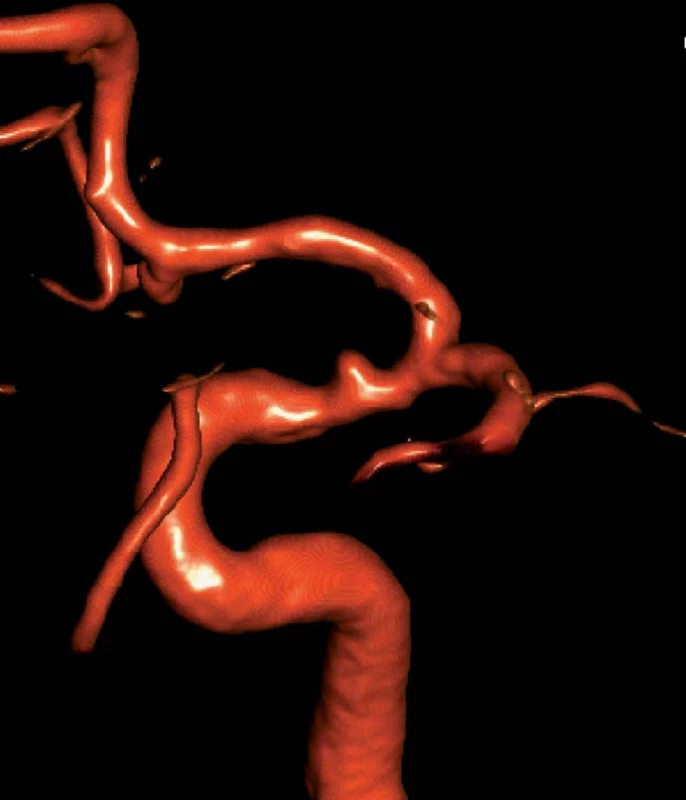
Image 2. Aneuryzma zavzaté v adhezích po recidivujícím subarachnoidálním krvácení. 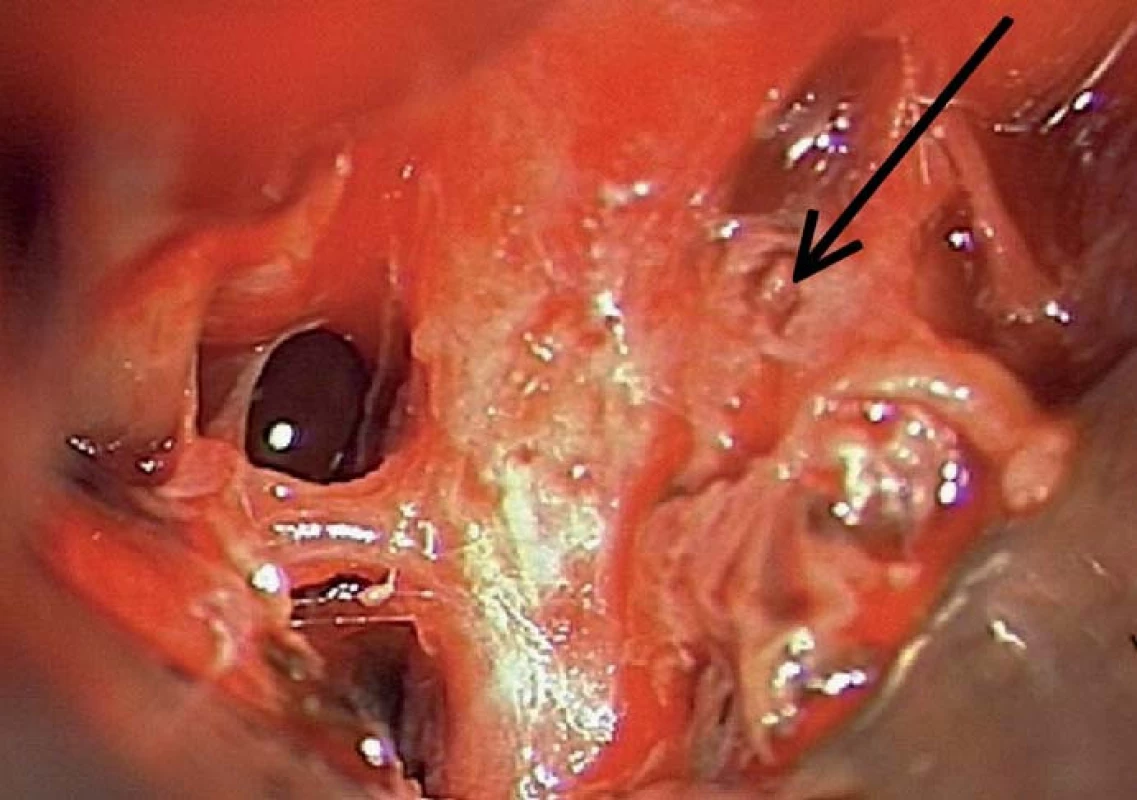
Image 3. Zasvorkované aneuryzma. 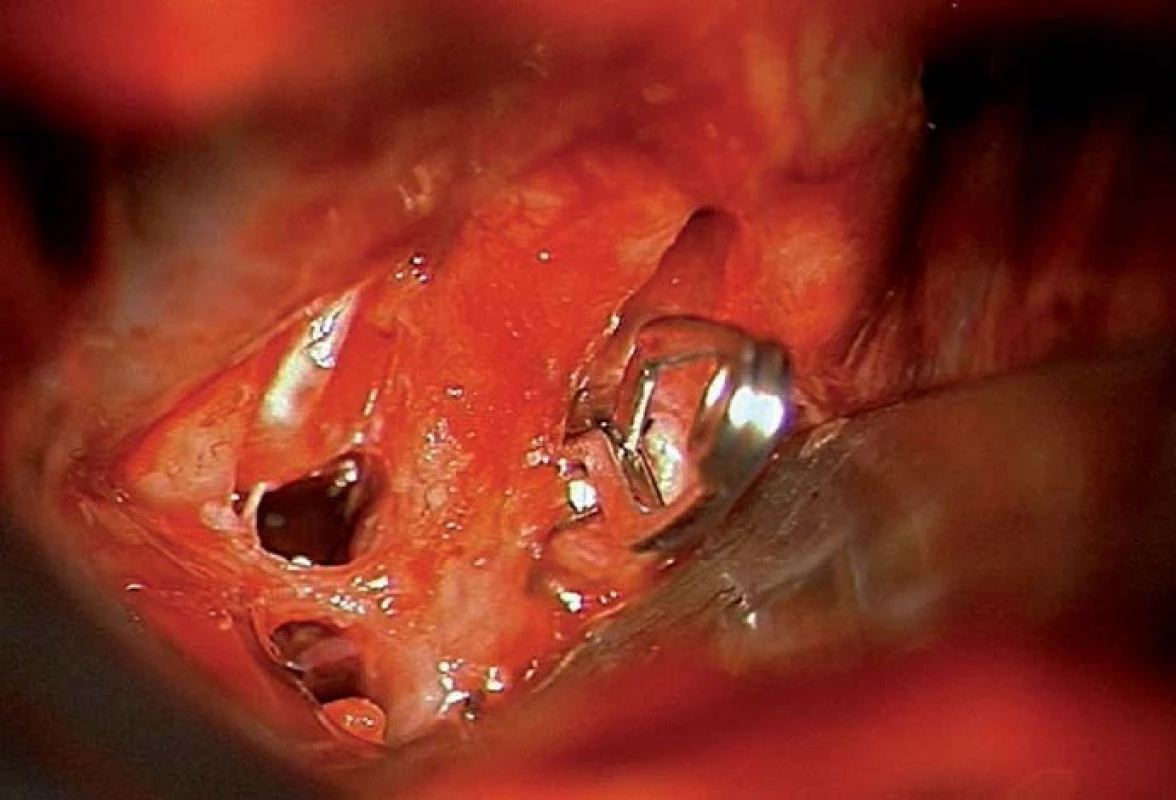
Image 4. Sutura defektu krkavice po reruptuře aneuryzmatu. 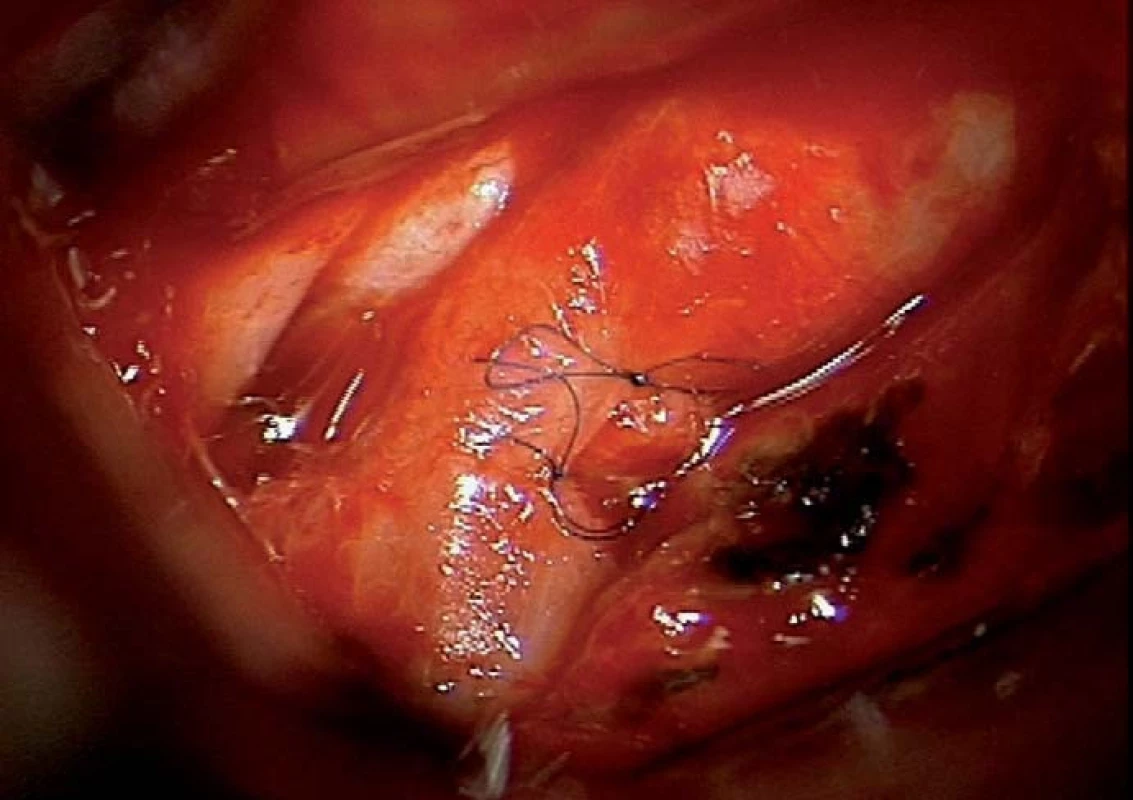
Image 5. Perfuzní počítačová tomografie ukazuje fyziologickou mozkovou perfuzi. 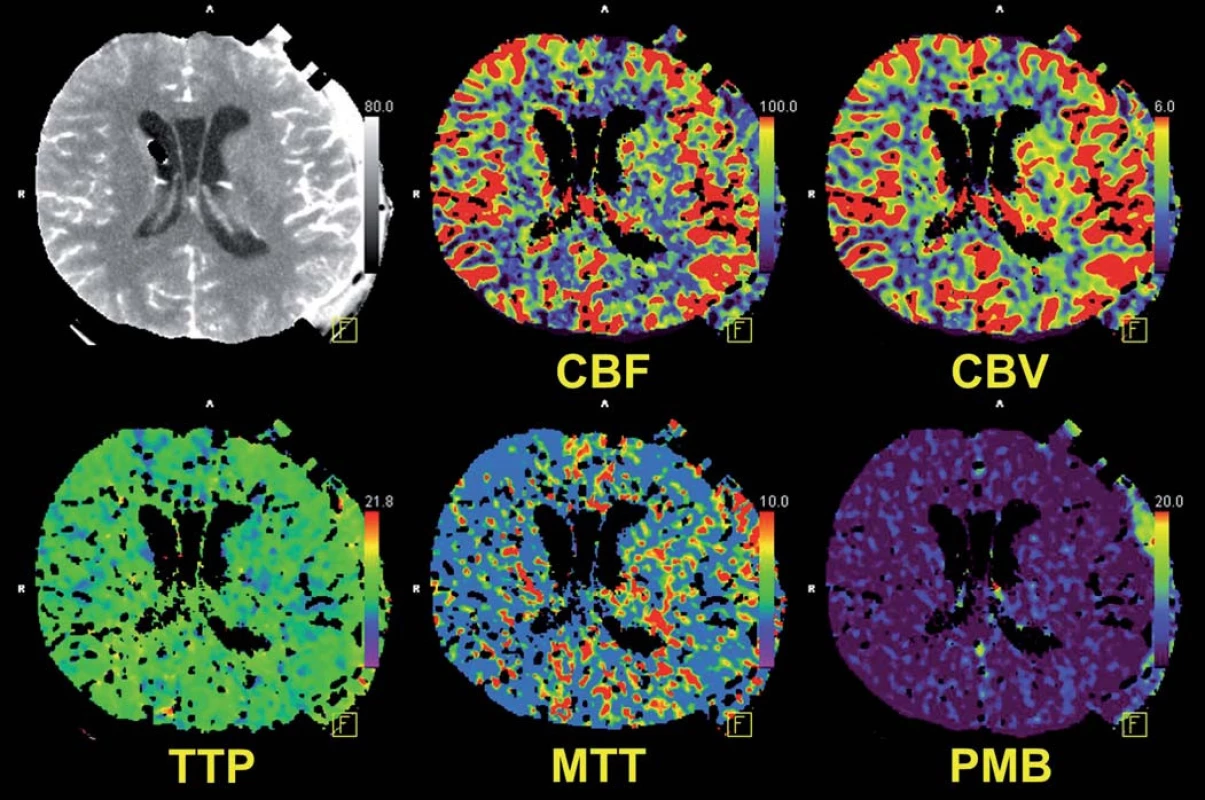
CBF – Cerebral Blood Flow, CBV – Cerebral Blood Volume, TTP – Time To Peak, MTT – Mean Transit Time, PMB – Permeability. Image 6. CT angiografie zobrazuje průchodnou, mírně zúženou krkavici po sutuře defektu a chudší náplň periferie střední mozkové tepny. 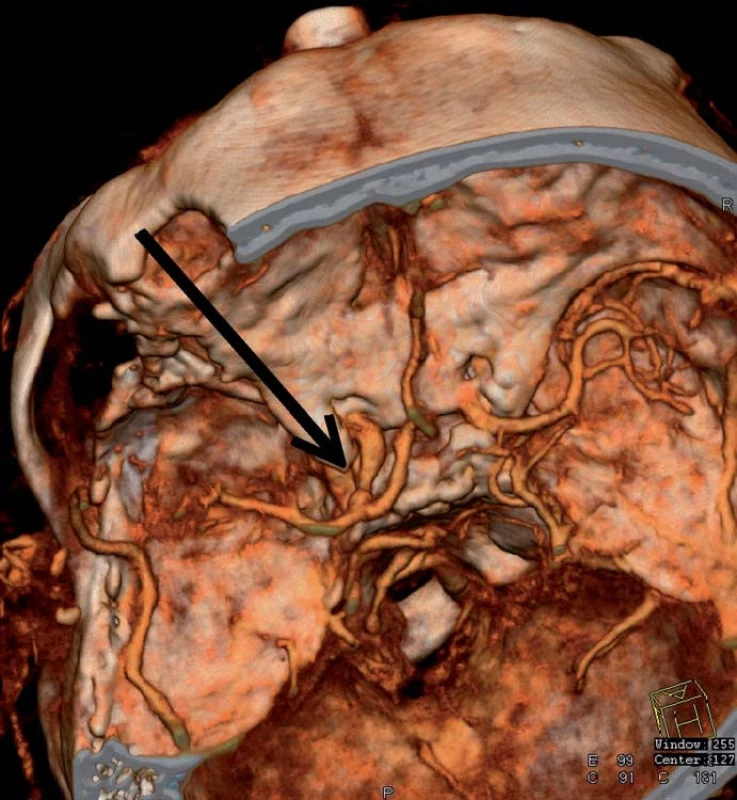
Diskuze
V poměrně chudých literárních zdrojích (převážně kazuistická sdělení nebo retrospektivně hodnocené malé soubory) je patrný panující respekt vůči blister aneuryzmatům, která Mitha označil za tajemství cévní neurochirurgie [3].
První zmínka o drobných aneuryzmatech dorzální stěny supraklinoidního segmentu ACI pochází z roku 1969 od Sundta et al [4]. Podle nejčastějšího výskytu na přední, anteromediální nebo anterolaterální stěně ACI (dle předozadní angiografické projekce) jsou tyto výdutě nazývány aneuryzmaty přední stěny ACI (ICA anterior wall aneurysms) [5]. Jiní autoři označují stejnou lokalizaci (dle peroperačního nálezu) jako aneuryzmata dorzální stěny ACI (ICA dorsal wall aneurysms), popřípadě mediodistální nebo horní stěny ACI (ICA superior wall aneurysms) [6,7]. Aby bylo zabráněno zmatkům v nomenklatuře, pokusili se Ogawa et al zavést termín „ICA trunk aneurysms“ [2]. Všeobecně přijatým a nejvíce užívaným názvem, prezentovaným Shigetou et al v roce 1992, se však stalo blister aneuryzma (blood blister‑like aneurysm) [8]. Kromě nejčastější lokalizace na anteromediální stěně C1 – 2 segmentu ACI, byl popsán výskyt BBA také v oblasti střední mozkové tepny, bazilární arterie a komplexu přední komunikanty [1,2,9].
Histologicky se BBA podstatně liší od běžných vakovitých (sacular, berry) aneuryzmat. Je tvořeno fokálním defektem tepenné stěny krytým pouze adventicií a tenkou fibrózní tkání, a není proto považováno za pravé aneuryzma, ale za pseudoaneuryzma (nepravé aneuryzma) (obr. 7) [1,2,7 – 9]. Etiopatogeneze BBA není spolehlivě objasněna, pravděpodobně je multifaktoriální. Předpokládá se, že vznik fokálního defektu souvisí s ulceracemi lamina elastica interna na podkladě aterosklerózy s následnou penetrací cévní stěnou. Na vzniku BBA se může podílet tzv. hemodynamický stres dominantně působící na ohyb anteromediální oblasti cévní stěny ACI, kde je popisováno nejsilnější turbulentní proudění. Tato teorie koreluje se signifikantně vyšším výskytem arterialní hypertenze u nemocných s BBA než s aneuryzmaty sakulárními [1,2,7 – 9]. Vzhledem k popisovanému výskytu karotické disekce u nemocných s BBA lze také disekci považovat za jednu z možných příčin. Subadventiciální disekce může vést k fokálnímu defektu všech vrstev cévní stěny s následným vznikem BBA [1,2,7 – 9]. Další, méně pravděpodobnou teorií je představa, že sakulární aneuryzma je pouze konečným vývojovým stadiem rostoucího BBA. Tuto hypotézu podporuje nezřídka pozorovaný růst BBA s následnou změnou do vakovitého tvaru [1,2,7 – 9]. Progrese BBA do aneuryzmatu sakulárního může být také způsobena organizací a růstem krevního koagula naléhajícího na defekt cévní stěny nebo pouhou rekanalizací původně trombozovaného aneuryzmatu. Zvažován byl rovněž infekční původ BBA, který však nebyl histologicky potvrzen [1,2,7 – 9]. Častější výskyt BBA aneuryzmat je popisován u žen, mladších nemocných a na pravostranné ACI [1,2,7 – 9].
Image 7. Schematický nákres ukazuje strukturální rozdíl mezi blister aneuryzmatem – A (fokální defekt cévní stěny krytý pouze adventicií a tenkou fibrózní tkání) a pravým vakovitým aneuryzmatem – B (stěna tvořená ztluštělou intimou a adventicií). 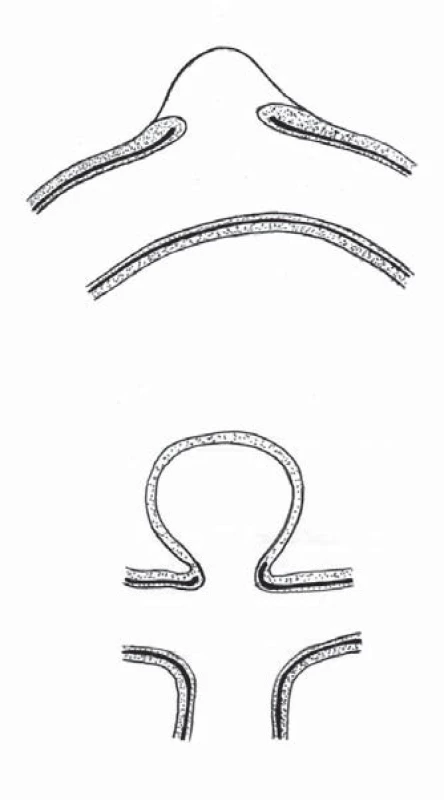
K úspěšné adekvátní léčbě BBA je nutné nejprve stanovení správné diagnózy, BBA se musí stát součástí diagnostické rozvahy. U nemocných se subarachnoidálním krvácením (SAK) a negativním angiografickým nálezem v predilekčních oblastech Willisova kruhu je proto třeba vždy pomýšlet na možnost výskytu BBA. Blister aneuryzma má typický vzhled puchýře – drobné, k mateřské tepně široce přisedlé výdutě bez preformovaného krčku. Malá velikost a atypická lokalizace bývá nejčastější příčinou, proč BBA nebývá na vstupním zobrazovacím vyšetření objeveno. Vzhledem k fragilitě stěny bývá také častěji komprimováno nebo obliterováno krevním koagulem. Soudí se též, že ruptura BBA v zadní cirkulaci může být jednou z potenciálních příčin perimezencefalického (pretrunkálního) SAK [10]. Senzitiva CTA není v diagnostice BBA stoprocentní. Při negativním nálezu na CTA by proto u nemocných se SAK měla být vždy doplněna třídimenzionální (3D) DSA, která je v zobrazení BBA nejspolehlivější. Diagnostickou potenci 3D DSA dokumentovali Gaughen et al [11]. Na prospektivně hodnocené DSA bylo BBA prokázáno u všech nemocných, zatímco CTA výduť spolehlivě neukázala ani při hodnocení retrospektivním. Není také výjimkou, že kontrolní zobrazení prokáže změnu tvaru a zejména růst BBA [11].
Vzhledem k uvedené charakteristice jsou BBA považována za maligní a jejich léčení je doprovázeno vysokou morbiditou a mortalitou. Incidence peroperační ruptury a nutnost obětovat mateřskou tepnu je u nemocných s BBA výrazně vyšší než u nemocných s aneuryzmaty vakovitými [9,10,12]. Vysoké riziko peroperační ruptury souvisí s fragilitou stěny aneuryzmatu a s adhezemi k okolním strukturám. Pouhé odstranění krevního koagula často způsobí katastrofální rupturu, proto je při operaci některými autory navrhována dokonce subpiální preparace aneuryzmatu [9].
Chirurgické léčebné možnosti jsou představovány přímým zasvorkováním (clipping) aneuryzmatickým miniklipem, zasvorkováním po předchozím obložení aneuryzmatu (wrapping clipping), samotným obložením (wrapping), suturou defektu tepny, použitím Sundtova graft klipu, podvazem ACI (trapping) s extra ‑ intrakraniálním (EC ‑ IC) bypassem nebo bez EC ‑ IC bypassu.
Poněvadž nelze na základě angiografie vždy spolehlivě rozhodnout, zda je aneuryzma klipovatelné, je vhodné mít před operací stále připraveny všechny léčebné alternativy. Při kraniotomii je důležité zachovat arteria temporalis superficialis jako potenciální donor bypassu. Vzhledem k vysokému riziku ruptury BBA na začátku preparace je vhodné obnažit ACI na krku.
Clipping BBA je považován za riskantní a v řadě případů jej ani nelze z různých technických důvodů použít (lokalizace aneuryzmatu, sklerotická ACI, odstupující větve). Podmínkou úspěšného přímého clippingu BBA je nasazení svorky paralelně s mateřskou tepnou (parallel clipping) a sevření přilehlých plnohodnotných okrajů tepny. Dobré výsledky clippingu paralelně nasazenou svorkou prezentovali McLaughlin et al [9]. BBA by mělo být svorkováno vždy při aplikovaném dočasném klipu na mateřské tepně. Při nemožnosti dočasného uzávěru mateřské tepny Garrett et al doporučují vyvolat krátkodobou srdeční zástavu podáním adenosinu [12]. Kazumata et al dokonce provádějí před pokusem o přímý clipping dočasný radial artery (RA) – midle cerebral artery (M2) bypass (předloktí je při operaci fixováno k okraji kraniotomie). Pokud se BBA podaří zasvorkovat, RA ‑ M2 bypass zruší a obnoví průtok radiální tepnou. V případě neúspěšného clippingu dokončí RA ‑ M2 bypass jako klasický high‑flow EC ‑ IC bypass a obětují ACI. Tímto postupem Kazumata šetří čas jedné sutury [13]. Stabilita svorky po přímém clippingu BBA by měla být při operaci vždy otestována elevací krevního tlaku. Za hlavní nevýhodu přímého svorkování je považováno vysoké riziko obtížně řešitelné ruptury a stenóza mateřské tepny [1,2,9]. Peroperační ruptura bývá způsobena chybnou indikací nebo nesprávným nasazením klipu. Po operaci může k ruptuře vést torze svorky tlakem frontálního či temporálního laloku, sklouznutí svorky nebo růst výdutě po nedokonalém nasazení klipu [1 – 9]. V našem případě se na pooperační ruptuře podílela pravděpodobně také dilatace původně spastické ACI po podání papaverinu.
Obložení BBA (wrapping) je doprovázeno vysokým rizikem reruptury s fatálním krvácením, a nepovažuje se proto za spolehlivou terapeutickou metodu [2].
Obložení výdutě a mateřské tepny s následným clippingem BBA přes použitý materiál (clipping on wrapping, clip wrapping) je naopak považováno za poměrně spolehlivé a jedno z nejčastěji používaných řešení [1,2,5 – 7]. K obložení se používá vatička, sval, fascie, goretex nebo silikon. Tento způsob vyřazení BBA však nelze ve všech případech použít, nejčastěji kvůli odstupujícím perforátorům. Někteří autoři připomínají riziko reruptury a růstu aneuryzmatu způsobené nedokonalým obložením BBA při obtížné identifikaci okrajů defektu [1].
Za možnou léčebnou alternativu, kterou lze použít při peroperační ruptuře, se dá považovat přímá sutura defektu stěny mateřské tepny [14 – 16]. Rekonstrukce tepny sešitím defektu je však velmi obtížná, neboť okraje defektu jsou často tenké a fragilní a vlastní defekt ACI je uložen velmi hluboko v úzkém koridoru. Při dorzální lokalizaci BBA není defekt dosažitelný a suturu nelze provést. Někteří autoři doplňují suturu wrappingem tepny a klipem [16]. Sutura v některých případech způsobí stenózu tepny, která může vést k ischemii [1]. Riziko ischemie také narůstá s prodlužující se dobou trvání dočasného klipu. Okuchi et al prezentovali případ masivního infarktu po sutuře defektu mateřské tepny, avšak při neúměrně dlouhém uzávěru trvajícím 50 min [17]. V našem případě byl čas dočasného uzávěru pouze 10 min. Za příčinu maligního infarktu považujeme kombinaci stenózy ACI a vazospazmů, nemůžeme ovšem vyloučit ani trombózu tepny. Pitevní nález však trombózu tepny v místě sutury přesvědčivě neprokázal.
Další terapeutickou možností je použití Sundtova graft klipu, který cirkulárně obejme mateřskou tepnu i s BBA, a je tak spolehlivou prevencí růstu a ruptury výdutě [4]. Jeho použití je cenné obzvláště v urgentních situacích, kdy nelze dočasně svorkovat a primárně řešit poškození mateřské tepny. Někteří autoři používají Sundtův klip jako pojistku po primární sutuře defektu [18]. Limitujícím faktorem použití Sundtova klipu jsou odstupující perforátory [19].
Ojedinělou léčebnou alternativu popsali Yanagisawa et al, kteří úspěšně zrekonstruovali rozsáhlý defekt ACI po ruptuře BBA použitím řady titanových sešívacích svorek (vascular closure staple clips) [20].
Obětování (trapping) mateřské tepny patří mezi klasické léčebné možnosti nejenom u nemocných s BBA. Při plánování strategie léčby BBA by měla být vždy vyšetřena patence přední komunikující arterie (ACoA) a zadní komunikující arterie (PCoA), aby byl znám stav kolaterálního oběhu a tolerance možného uzávěru ACI [1 – 3,7 – 9]. Balónkový okluzní test se v akutním stadiu SAK u prasklého BBA standardně neprovádí pro nutnost heparinizace a neúměrně vysoké riziko ischemických komplikací [7 – 9]. ACI by měla být vyřazena vždy šikmo naloženým klipem tak, aby byla zachována patence PCoA. Spetzler et al poukazují na problém při vyřazení ACI v případech, kdy aneuryzma odstupuje ze stejného segmentu jako arteria chorioidea anterior [3]. Ukazuje se však, že trapping ACI v akutním stadiu SAK (do 48 hod) vede často ke vzniku letální ischemie i u nemocných s předoperačně prokázaným dobrým kolaterálním oběhem. Příčinou je pravděpodobně kompromitované kolaterální zásobení a cévní autoregulace při akutním SAK a vazospazmech [21]. Trapping ACI v akutní fázi by proto měl být vždy doprovázen EC ‑ IC bypassem bez ohledu na stav kolaterálního oběhu. Primární indikace trappingu ACI u nemocných s BBA, doprovázeného vysokoprůtokovým EC ‑ IC bypassem, prováděným často i v akutním stadiu SAK, jsou nejčastěji doporučovány japonskými autory [22 – 24].
Endovaskulární možnosti léčby BBA jsou velmi omezené. Vzhledem k malé velikosti, nevyvinutému krčku a mimořádné fragilitě stěny je BBA v drtivé většině případů nevhodné k samotnému coilingu. Ojedinělé sdělení o úspěšném coilingu s remodelací balónkem u BBA, která však měla vakovitý tvar a vyvinutý krček, prezentovali Matsubara et al [25].
Za efektivnější alternativu je považován coiling v kombinaci se stentem (stent ‑ -assisted coiling) [26].
Mezi další uváděné endovaskulární techniky patří překrytí výdutě několika stenty, tzv. stent in stent technika [27,28] nebo kombinace stent in stent techniky a coilingu [28]. Chung et al úspěšně použili k vyřazení BBA postupně pět překrývajících se stentů v kombinaci s coilingem [29].
Moderní možností je vyřazení výdutě pomocí hustých stentů (flow diverterů), které usměrní krevní tok mimo výduť, čímž by mělo dojít k trombóze aneuryzmatu [30,31]. Slabou stránkou flow diverterů je časová prodleva ve vyřazení výdutě s rezultujícím rizikem ruptury a nezanedbatelné procento výskytu pozdního uzávěru mateřské tepny [30,31].
Léčebnou alternativou jsou stentgrafty (potažené stenty), které uzavřou ústí aneuryzmatu. Jejich výhodou je kompletní vyřazení výdutě hned při jejich zavedení, avšak zásadní nevýhodou rigidita stentu, která může vést k poškození mateřské tepny při jejich zavádění. Překážkou v použití stentgraftu jsou blízké odstupy perforátorů [32].
Obecným problémem při použití stentů v akutním stadiu SAK je indikace antiagregační léčby.V obavě z recidivy krvácení nejsou antiagregancia na některých pracovištích v průběhu ani před vlastní procedurou vůbec používána a podávají se bolusově až po skončení výkonu [31]. Jiní autoři popisují nízký výskyt reruptur a clopidogrel podávají již před stentingem [30].
Endovaskulární techniky (coiling) lze použít také při trappingu BBA [32].
V našem případě nebyla spolehlivě stanovena diagnóza BBA před operací, ale kvůli adhezím po recidivujícím SAK ani během operace. Před operací jsme výduť považovali za aneuryzma arteria hypophysealis superior. Clipping výdutě proto nebyl proveden paralelně s mateřskou tepnou a také kvůli spazmu ACI by nebylo možné do svorky sevřít okraje tepny. Na následné reruptuře se vedle neadekvátního nasazení klipu mohla podílet rovněž dilatace původně spastické tepny po lokálním podání papaverinu. Přestože tepna byla úspěšně zrekonstruována přímou suturou defektu a čas dočasného uzávěru byl příznivý, došlo s časovým odstupem k rozvoji maligní ischemie. Příčinou maligního infarktu mohla být kombinace hypoperfuze na podkladě stenózy ACI a vazospazmů, nevyloučili jsme však ani trombózu krkavice. Naše zkušenost nás přiměla doplnit naše aneuryzmatické instrumentarium o Sundtovy graft klipy a častěji indikovat 3D DSA u nemocných se SAK a negativní CTA.
Závěr
Blister aneuryzma ACI je nepravé aneuryzma doprovázené vysokou morbiditou a mortalitou, které se vyskytuje mimo obvyklé lokalizace mozkových výdutí. Předoperační rozpoznání blister aneuryzmatu je proto zásadní podmínka adekvátní léčby. Blister aneuryzma má vysoký sklon k fatální peroperační ruptuře často vedoucí k nutnosti obětovat mateřskou tepnu. Před operací by proto měl být vždy vyšetřen kolaterální oběh a operační tým by měl být připraven použít všechny potenciální léčebné strategie včetně clip wrappingu, přímé sutury tepny, Sundtova klipu, trappingu a EC ‑ IC bypassu. Endovaskulární léčebné možnosti jsou vzhledem k charakteristice blister aneuryzmatu značně limitované.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jan Mraček, Ph.D.
Neurochirurgické oddělení
LF UK a FN Plzeň
Mozartova 60
323 00 Plzeň
e-mail: mracek@fnplzen.cz
Přijato k recenzi: 15. 10. 2013
Přijato do tisku: 3. 1. 2014
Sources
1. Abe M, Tabuchi K, Yokoyama H, Uchino A. Blood blisterlike aneurysms of the internal carotid artery. J Neurosurg 1998; 89(3): 419 – 424.
2. Ogawa A, Suzuki M, Ogasawara K. Aneurysms at nonbranching sites in the supraclinoid portion of the internal carotid artery: internal carotid artery trunk aneurysms. Neurosurgery 2000; 47(3): 578 – 583.
3. Mitha AP, Spetzler RF. Blister‑like aneurysms: an enigma of cerebrovascular surgery. World Neurosurg 2010; 74(4 – 5): 444 – 445. doi: 10.1016/ j.wneu.2010.10.006
4. Sundt TM jr, Murphey F. Clip ‑ grafts for aneurysm and small vessel surgery. 3. clinical experience in intracranial internal carotid artery aneurysms. J Neurosurg 1969; 31(1): 59 – 71.
5. Horiuchi T, Kusano Y, Yako T, Murata T, Kakizawa Y, Hongo K. Ruptured anterior paraclinoid aneurysms. Neurosurg Rev 2011; 34(1): 49 – 55. doi: 10.1007/ s10143 – 010 – 0272 – 7.
6. Nakagawa F, Kobayashi S, Takemae T, Sugita K. Aneurysms protruding from the dorsal wall of the internal carotid artery. J Neurosurg 1986; 65(3): 303 – 308.
7. Ishikawa T, Nakamura N, Houkin K, Nomura M. Pathological consideration of a „blister‑like“ aneurysm at the superior wall of the internal carotid artery: case report. Neurosurgery 1997; 40(2): 403 – 405.
8. Shigeta H, Kyoshima K, Nakagawa F, Kobayashi S. Dorsal internal carotid artery aneurysms with special reference to angiographic presentation and surgical management. Acta Neurochir (Wien) 1992; 119(1 – 4): 42 – 48.
9. McLaughlin N, Laroche M, Bojanowski MW. Surgical management of blood blister‑like aneurysms of the internal carotid artery. World Neurosurg 2010; 74(4 – 5):483 – 493. doi: 10.1016/ j.wneu.2010.06.039.
10. Vishteh AG, Spetzler RF. Blister or berry aneurysm. J Neurosurg 1999; 91(6): 1062 – 1063.
11. Gaughen JR jr, Raghavan P, Jensen ME, Hasan D,Pfeffer AN, Evans AJ. Utility of CT angiography in the identification and characterization of supraclinoid internal carotid artery blister aneurysms. AJNR Am J Neuroradiol 2010; 31(4): 640 – 644. doi: 10.3174/ ajnr.A1893.
12. Garrett M, Spetzler RF. Surgical treatment of blister‑like aneurysms. World Neurosurg 2012; 77(1): 76 – 77. doi: 10.1016/ j.wneu.2011.07.041.
13. Kazumata K, Nakayama N, Nakamura T, Kamiyama H, Terasaka S, Houkin K. Changing treatment strategy from clipping to radial artery graft bypass and parent artery sacrifice in patients with ruptured blister‑like internal carotid artery aneurysms. Neurosurgery 2014; 10 (Suppl 1): 66 – 73. doi: 10.1227/ NEU.0000000000000076.
14. Yanaka K, Meguro K, Nose T. Repair of a tear at the base of a blister‑like aneurysm with suturing and an encircling clip: technical note. Neurosurgery 2002; 50(1): 218 – 221.
15. Lee JW, Choi HG, Jung JY, Huh SK, Lee KC. Surgical strategies for ruptured blister‑like aneurysms arising from the internal carotid artery: a clinical analysis of 18 consecutive patients. Acta Neurochir (Wien) 2009; 151(2): 125 – 130. doi: 10.1007/ s00701 – 008 – 0165 – 5.
16. Joo SP, Kim TS, Moon KS, Kwak HJ, Lee JK, Kim JH et al. Arterial suturing followed by clip reinforcement with circumferential wrapping for blister‑like aneurysms of the internal carotid artery. Surg Neurol 2006; 66(4): 424 – 428.
17. Okuchi K, Fujioka M, Maeda Y, Nonaka M, Sakaki T.Surgical treatment of internal carotid artery anterior wall aneurysm with extravasation during angiography – case report. Neurol Med Chir (Tokyo) 1999; 39(1): 40 – 44.
18. Yanaka K, Meguro K, Nose T. Repair of a tear at the base of a blister‑like aneurysm with suturing and an encircling clip: technical note. Neurosurgery 2002; 50(1): 218 – 221.
19. Park PJ, Meyer FB. The Sundt clip graft. Neurosurgery 2010; 66 (6 Suppl Operative): 300 – 305. doi: 10.1227/ 01.NEU.0000369923.05148.67.
20. Yanagisawa T, Mizoi K, Sugawara T, Suzuki A, Ohta T, Higashiyama N et al. Direct repair of a blister-like aneurysm on the internal carotid artery with vascular closure staple clips. Technical note. J Neurosurg 2004; 100(1): 146 – 149.
21. Meling TR, Sorteberg A, Bakke SJ, Slettebø H, Hernesniemi J, Sorteberg W. Blood blister‑like aneurysms of the internal carotid artery trunk causing subarachnoid hemorrhage: treatment and outcome. J Neurosurg 2008; 108(4): 662 – 671. doi: 10.3171/ JNS/ 2008/ 108/ 4/ 0662.
22. Ishikawa T, Mutoh T, Nakayama N, Yasuda H, Nomura M, Kazumata K et al. Universal external carotid artery to proximal middle cerebral artery bypass with interposed radial artery graft prior to approaching ruptured blood blister‑like aneurysm of the internal carotid artery. Neurol Med Chir (Tokyo) 2009; 49(11): 553 – 558.
23. Kawashima A, Okada Y, Kawamata T, Onda H,Kubo O, Hori T. Successful treatment of a blood blister‑like aneurysm of the internal carotid artery by trapping with a high‑flow bypass. J Clin Neurosci 2008; 15(7): 797 – 800. doi: 10.1016/ j.jocn.2007.03.012.
24. Kamijo K, Matsui T. Acute extracranial ‑ intracranial bypass using a radial artery graft along with trapping of a ruptured blood blister‑like aneurysm of the internal carotid artery. Clinical article. J Neurosurg 2010; 113(4): 781 – 785. doi: 10.3171/ 2009.10.JNS09970.
25. Matsubara N, Miyachi S, Tsukamoto N, Izumi T, Naito T, Haraguchi K et al. Endovascular coil embolization for saccular ‑ shaped blood blister‑like aneurysms of the internal carotid artery. Acta Neurochir (Wien) 2011; 153(2): 287 – 294. doi: 10.1007/ s00701 – 010 – 0898 – 9.
26. Doorenbosch X, Harding M. Primary treatment of a blood ‑ blister‑like aneurysm of the internal carotid artery with Guglielmi detachable coil embolisation. J Clin Neurosci 2008; 15(11): 1276 – 1279. doi: 10.1016/ j.jocn.2007.08.023.
27. Gaughen JR jr, Hasan D, Dumont AS, Jensen ME, McKenzie J, Evans AJ. The efficacy of endovascular stenting in the treatment of supraclinoid internal carotid artery blister aneurysms using a stent ‑ in‑stent technique. AJNR Am J Neuroradiol 2010; 31(6): 1132 – 1138. doi: 10.3174/ ajnr.A2016.
28. Kim BM, Chung EC, Park SI, Choi CS, Won YS. Treatment of blood blister‑like aneurysm of the internal carotid artery with stent ‑ assisted coil embolization followed by stent ‑ within‑a ‑ stent technique. Case report. J Neurosurg 2007; 107(6): 1211 – 1213.
29. Chung J, Kim BM, Lim YC. Five overlapping enterprise stents in the internal carotid artery ‑ to ‑ middle cerebral artery to treat a ruptured blood blister‑like aneurysm. Neurol Sci 2013; 34(8): 1485 – 1487. doi: 10.1007/ s10072 – 012 – 1231 – 6.
30. Martin AR, Cruz JP, Matouk CC, Spears J, Marotta TR.The pipeline flow ‑ diverting stent for exclusion of ruptured intracranial aneurysms with difficult morphologies. Neurosurgery 2012; 70 (1 Suppl Operative): 21 – 28. doi: 10.1227/ NEU.0b013e3182315ee3.
31. Causin F, Pascarella R, Pavesi G, Marasco R, Zambon G, Battaglia R et al. Acute endovascular treatment (< 48 hours) of uncoilable ruptured aneurysms at non‑branching sites using silk flow ‑ diverting devices. Interv Neuroradiol 2011; 17(3): 357 – 364.
32. Lee BH, Kim BM, Park MS, Park SI, Chung EC, Suh SH et al. Reconstructive endovascular treatment of ruptured blood blister‑like aneurysms of the internal carotid artery. J Neurosurg 2009; 110(3): 431 – 436. doi: 10.3171/ 2008.7.JNS08257.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 3-
All articles in this issue
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
- Pupilární reakce na barevné podněty
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Neurologické hypotézy u panické poruchy
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

