-
Medical journals
- Career
Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
Authors: K. Ďuriš 1,2; E. Neuman 1; A. Mrlian 1; V. Vybíhal 1; V. Juráň 1; M. Kýr 3; M. Smrčka 1
Authors‘ workplace: Neurochirurgická klinika LF MU a FN Brno 1; Ústav patologické fyziologie LF MU, Brno 2; Klinika dětské onkologie LF MU a FN Brno 3
Published in: Cesk Slov Neurol N 2014; 77/110(2): 196-201
Category: Original Paper
Práce byla sponzorována grantem IG MZ ČR č. NT 11092- 4.
Overview
Cíl:
Cílem práce bylo zjistit, zda existuje korelace mezi hodnotami PbtO2 a parametry transkraniální dopplerometrie (TCD) u pacientů s těžkým subarachnoidálním krvácením (SAK).Soubor a metodika:
Do souboru byli zařazeni pacienti s těžkým subarachnoidálním krvácením na podkladě ruptury aneuryzmatu mozkové tepny, kteří byli v klinickém stavu Hunt Hess 4 (HH4, sopor) a Hunt Hess 5 (HH5, kóma). U pacientů byl kromě standardních medicínských postupů, které zahrnují i TCD, prováděn monitoring oxygenace mozkové tkáně (partial pressure of oxygen in brain tissue – PbtO2, systém Licox). Hodnocena byla korelace mezi PbtO2 a parametry TCD.Výsledky:
Celkem jsme do souboru zařadili 27 pacientů, pět pacientů bylo následně vyřazeno pro špatnou pozici nebo předčasnou malfunkci PbtO2 čidla. U zkoumaného souboru korelovaly hodnoty PbtO2 s pulzatilním a rezistentním indexem v intervalech ± 10 min (PI: r = – 0,4077, p = 0,0074; RI: r = – 0,4055, p = 0,0077) a ± 60 min (PI: r = – 0,4145, p = 0,0064; RI: r = – 0,4089, p = 0,007), přičemž výchozí bod hodnocení odpovídal vyšetření TCD. U zkoumaného souboru nebyla signifikantní korelace mezi PbtO2 a rychlostmi toků na zkoumaných cévách.Závěr:
PbtO2 monitoring poskytuje informace o stavu oxygenace mozkové tkáně a její mikrovaskulatury. Nicméně neexistuje jednoduchá souvislost mezi hodnotami PbtO2 a rychlostmi toků na magistrálních cévách, které charakterizují cévní vazospazmy. Protože neznáme vztah mezi rychlostmi toků na magistrálních cévách a hodnotami PbtO2, jeví se v klinické praxi u pacientů s těžkým SAK vhodné paralelní užití TCD i PbtO2 monitoringu.Klíčová slova:
subarachnoidální krvácení – transkraniální dopplerometrie – cerebrální vazospazmyÚvod
Subarachnoidální krvácení (SAK) je závažná patologie, která ročně postihuje asi 10/ 100 000 obyvatel a která je spojena až s 50% mortalitou [1]. Nejčastěji je příčinou SAK ruptura aneuryzmatu mozkové tepny, jež odpovídá za cca 85 % případů [2]. Zásadní léčebný postup je ošetření aneuryzmatu (operačně nebo endovaskulárně) mající za cíl předejít opakovanému prasknutí aneuryzmatu, které je spojeno s úmrtností až 80 % [2]. Vedle opakovaného krvácení jsou nejzávažnější komplikací SAK cévní vazospazmy vedoucí k ischemizaci mozkové tkáně. Vazospazmy typicky vznikají mezi 4. a 14. dnem po atace krvácení, postihují asi 30 % pacientů a jsou zatíženy až 30% mortalitou [3 – 5]. Přesná příčina vzniku vazospazmů není známa, ale byla popsána celá řada faktorů, které se na jejich vzniku podílejí. Mezi nejdůležitější patří porucha kontraktility cév, dysfunkce endotelu, toxicita rozpadových produktů hemoglobinu a zánět [6,7]. V léčbě vazospazmů se používá HHH terapie (hypertenze, hemodiluce, hypervolemie), nimodipin a magnezium, avšak léčba vazospazmů je i dnes problematická a není dostatečně účinná [8]. Proto jsou vazospazmy předmětem intenzivního studia v experimentální i klinické rovině. Vedle objasnění patofyziologie jsou důležitým cílem výzkumu možnosti časné detekce vzniku vazospazmů.
Zlatým standardem v diagnostice vazospazmů je digitální subtrakční angiografie (DSA), která však není vhodná k monitoringu pacientů z důvodu invazivity a radiační zátěže [9]. K diagnostice a sledování vazospazmů se u pacientů po SAK v klinické praxi nejčastěji užívá transkraniální dopplerometrie (TCD). Ta není v diagnostice vazospazmů tak přesná jako DSA, je to však neinvazivní metoda umožňující relativně rychlé vyšetření u lůžka pacienta [9,10]. TCD zatím rutinně neumožňuje kontinuální monitorování, metoda je velmi závislá na vyšetřujícím lékaři, někteří pacienti jsou obtížně vyšetřitelní, a proto jsou zkoumány další metody sloužící k časné detekci vazospazmů [11]. Jednou z nadějných metod je tkáňová oxymetrie, která nalézá své uplatnění nejen u pacientů po SAK [12 – 14].
Cílem naší práce bylo zjistit, zda existuje korelace mezi hodnotami PbtO2 a parametry TCD u pacientů s těžkým subarachnoidálním krvácením.
Soubor a metodika
Projekt i všechny postupy byly schváleny etickou komisí FN Brno. Do souboru byli zařazeni pacienti s těžkým subarachnoidálním krvácením na podkladě ruptury aneuryzmatu mozkové tepny, kteří byli v klinickém stavu HH4 (sopor) a HH5 (kóma). Všechny léčebné postupy včetně ošetření aneuryzmatu, péče na jednotce intenzivní péče i vyšetření pomocí TCD probíhaly obvyklým způsobem. Obecným cílem léčby bylo ošetřit aneuryzma co nejdříve a dále udržovat systolický tlak minimálně na 140 torrů u pacientů bez vazospazmů a minimálně na 180 torrů u pacientů s vazospazmy. Léčba však byla v jednotlivých případech individualizována s ohledem na věk, celkový stav pacienta s důrazem na kardiovaskulární onemocnění. U pacientů zařazených do studie byl navíc prováděn monitoring PbtO2 (systém Licox). Čidlo bylo zavedeno čtvrtý den po SAK a kontinuální monitorování probíhalo tak, aby bylo pokryto období nejvyššího rizika vzniku vazospazmů. Monitoring byl ukončen v optimálním případě po 10 dnech od zavedení čidla nebo dříve v případě, že čidlo přestalo měřit (záporné nebo nulové hodnoty po dobu několika hodin). Monitorovanou oblastí bylo povodí arteria cerebri media ipsilaterálně k lokalizaci aneuryzmatu. V případě středočárových aneuryzmat bylo nejprve zhodnoceno, zda lze identifikovat dominantní cévu zásobující aneuryzma (např. dominantní ACA zásobující AcoA). Bylo‑li možné určit dominantní cévu, bylo čidlo zavedeno ipsilaterálně. Pakliže dominantní cévu nebylo možné určit, bylo čidlo zavedeno do nedominantní hemisféry.
Parametry PbtO2 byly hodnoceny jednak z celého období monitoringu (v dalším textu označován jako PbtO2 monitoring) a jednak z omezených časových úseků ± 10 min a ± 60 min v návaznosti na TCD vyšetření (v dalším textu označován jako korelace PbtO2 k TCD).
Hodnoty PbtO2 monitorování byly hodnoceny v souvislosti s následujícími klinickými parametry: klinický stav při přijetí (Hunt Hess skóre, dále jen HH), rozsah hematomu dle vstupního CT (Fischer skóre, dále jen Fischer) a výsledný stav pacienta (Glasgow Outcome Scale, dále GOS). Hodnoty PbtO2 byly pro každého pacienta zprůměrovány a průměrné hodnoty byly použity k další analýze. Ke statistickému zpracování dat byl použit Studentův t‑test a one ‑ way ANOVA.
Hodnocení korelace PbtO2 ve vztahu k TCD probíhalo ze záznamů odpovídajícím intervalům ± 10 min a ± 60 min, přičemž za uzlový bod bylo považováno vyšetření TCD. Průměrné hodnoty PbtO2 za daný časový interval byly korelovány s následujícími parametry TCD: maximální systolická rychlost toku (Peak Systolic Velocity, PSV), rychlost toku na konci diastoly (End Diastolic Velocity, EDV), střední průtoková rychlost (mean Velocity, Vmean), index pulzatility (Pulsatility Index, PI), index rezistence (Resistivity Index, RI). Korelace výše uvedených parametrů byla popsána pomocí Pearsonova korelačního koeficientu. Za hladinu významnosti byla považována hodnota α = 0,05.
Výsledky
Charakteristika souboru
Celkem bylo do souboru zařazeno 27 pacientů. Pět pacientů bylo následně vyřazeno. Důvodem k vyřazení byla poloha čidla v subdurálním prostoru (dva pacienti) nebo předčasná malfunkce čidla (tři pacienti). Z hodnoceného souboru 22 pacientů bylo 17 žen a pět mužů, přičemž průměrný věk souboru činil 53,3 let (minimum 28, maximum 70). Charakteristika souboru dle klinického stavu při přijetí: 15 pacientů bylo v klinickém stavu HH4 (sopor), v klinickém stavu HH5 (kóma) bylo sedm pacientů. Charakteristika souboru dle tíže krvácení: u šesti pacientů odpovídal CT nález stupni Fischer 3 (šířka hematomu nad 1 mm), u 16 pacientů byl nález odpovídající stupni Fischer 4 (hemocefalus). Charakteristika souboru dle lokalizace aneuryzmatu: aneuryzma bylo lokalizováno na ACM v 12 případech, u šesti pacientů bylo aneuryzma na AcoA a na AcoP bylo aneuryzma lokalizováno u čtyř pacientů. Operováno bylo 14 pacientů, zatímco coiling byl použit u osmi pacientů. Charakteristika souboru dle výsledného stavu: GOS 4 a 5 (dobrý výsledný stav) – tři pacienti, GOS 3 a 2 (neuspokojivý výsledný stav) – 11 pacientů, GOS 1 (smrt) – osm pacientů. Tab. 1 uvádí parametry GOS v souvislosti s přítomností vazospazmů. Za kritérium vazospazmů byla považována hodnota Vmean nad 120 cm/ s na arteria cerebri media a hodnota nad 90 cm/ s na arteria cerebri anterior [15]. Z tabulky je patrná tendence k vyššímu výskytu vazospazmů u pacientů s horším výsledným stavem, avšak k validnímu statistickému zpracování dat jsme neměli k dispozici dostatečný počet pacientů. Následující statistické analýzy byly provedeny za použití parametrických statistických metod vzhledem k přibližně normálnímu rozložení dat (zjištěno na základě grafické analýzy).
Table 1. Parametry GOS v souvislosti s přítomností vazospazmů. Je patrná tendence k vyššímu výskytu vazospazmů u pacientů s horším výsledným stavem, avšak k validnímu statistickému zpracování dat není dostatečný počet pacientů. 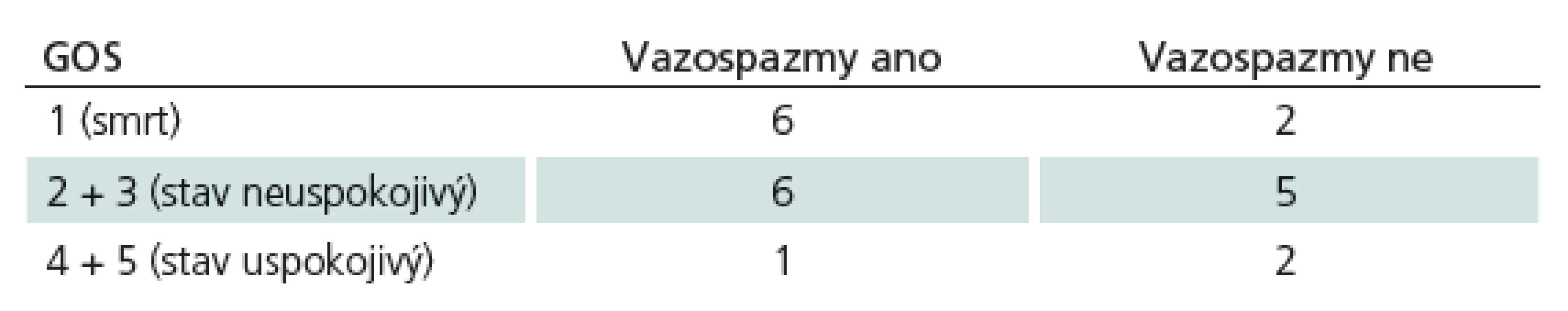
PbtO2 monitoring
Průměrná délka monitoringu PbtO2 činila u zkoumaného souboru 7,59 dní, přičemž nejkratší záznam trval 4,60 dne a nejdelší 10 dní. K hodnocení bylo použito celkem 22 záznamů. Parametry PbtO2 monitoringu v závislosti na HH, Fischer a GOS uvádí obr. 1. U zkoumaného souboru je patrná tendence k vyšším hladinám PbtO2 u pacientů v lepším klinickém stavu při přijetí (31,99 torru u skupiny HH4 vs 24,44 torru u skupiny HH5), u pacientů s lepším výsledným stavem (36,31 torru pro skupinu GOS 4 + 5; 28,85 torru pro GOS 3 + 2 a 23,27 pro skupinu GOS 1), avšak rozdíl není statisticky významný (p = NS pro všechny výše uvedené skupiny). U skupin dělených dle tíže krvácení není patrná žádná tendence k rozdílu v hodnotách PbtO2 (p = NS).
Image 1. Parametry PbtO<sub>2</sub> monitoringu v závislosti na HH, Fischer a GOS. Je patrna tendence k vyšším hladinám PbtO<sub>2</sub> u pacientů v lepším klinickém stavu při přijetí (HH4), u pacientů s lepším výsledným stavem (GOS 4–5), avšak rozdíl není statisticky významný. Není patrna žádná tendence k rozdílu v hodnotách PbtO<sub>2</sub> u skupin dělených dle tíže krvácení (Fischer). Data jsou vyjádřena jako průměr (m) a standardní chyba průměru (SEM). 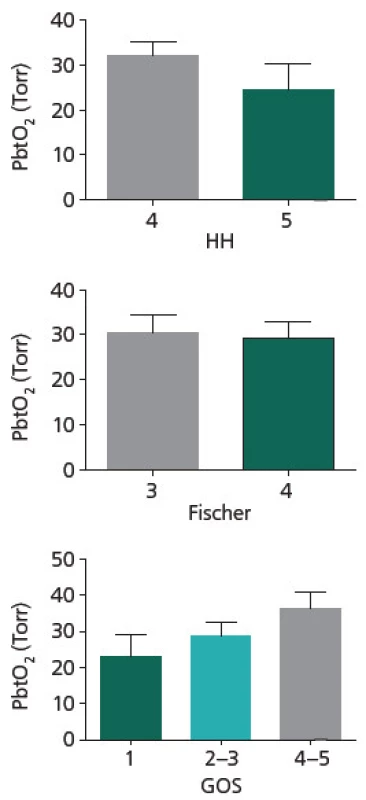
Korelace PbtO2 a TCD
Hodnocení bylo provedeno z hodnot PbtO2 v intervalu ± 10 a ± 60 min v návaznosti na vyšetření TCD. K hodnocení bylo použito celkem 42 záznamů od 22 pacientů. Tab. 2 ukazuje charakteristiky hodnot PbtO2 intervalů ± 10 min a ± 60 min u souboru jako celku a dále u skupin pacientů s a bez vazospazmů. Za kritérium vazospazmů byla považována hodnota Vmean nad 120 cm/ s na ipsilaterální arteria cerebri media. Rozdíly mezi hodnotami PbtO2 u skupin s vazospazmy a bez vazospazmů nejsou statisticky významné ani v jednom z výše uvedených intervalů (p = NS). Tab. 3 a obr. 2 ukazují výsledky korelační analýzy mezi jednotlivými parametry TCD a průměrnými hodnotami PbtO2 v daných časových intervalech. U zkoumaného souboru byla signifikantní korelace mezi PbtO2 a PI v intervalu ± 10 min (r = – 0,4077, p = 0,0074) i v intervalu ± 60 min (r = – 0,4145, p = 0,0064). Dále byla u zkoumaného souboru signifikantní korelace mezi hodnotami PbtO2 a RI v intervalu ± 10 min (r = – 0,4055, p = 0,0077) i v intervalu ± 60min (r = – 0,4089, p = 0,0072). U ostatních parametrů TCD (PSV, EDV, Vmean) korelace u zkoumaného souboru signifikantní nebyla ani v jednom časovém intervalu (p = NS, pro všechny uvedené parametry).
Table 2. Charakteristiky hodnot PbtO<sub>2</sub> v intervalech ± 10min a ± 60min u souboru jako celku a dále u skupin pacientů s a bez vazospazmů. Rozdíly mezi hodnotami PbtO<sub>2</sub> u skupin s vazospazmy a bez vazospazmů nejsou statisticky významné ani v jednom z intervalů. Data jsou vyjádřena jako průměr (m) a standardní chyba průměru (SEM). 
Table 3. Výsledky korelační analýzy mezi PbtO<sub>2</sub> a parametry TCD pro intervaly ± 10 min a ± 60 min. Signifikantní je korelace PbtO<sub>2</sub> s PI a RI v obou časových intervalech. U ostatních parametrů TCD (PSV, EDV, Vmean) korelace signifikantní není ani v jednom časovém intervalu. 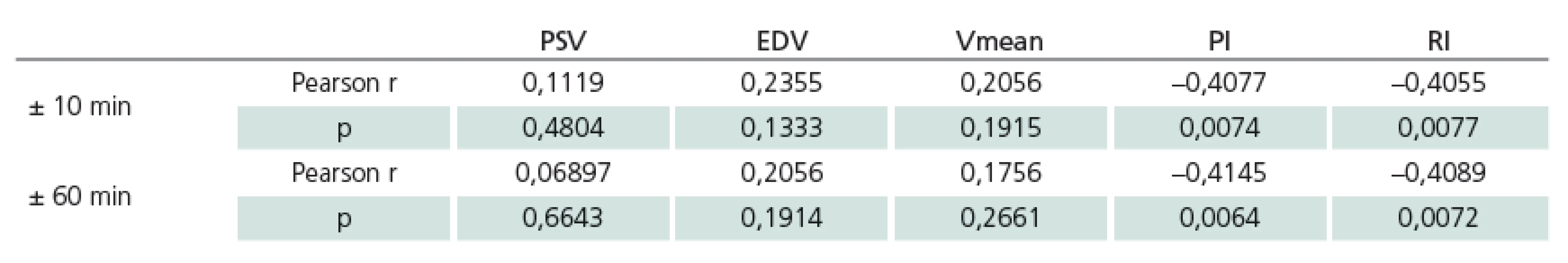
Image 2. Korelace mezi jednotlivými parametry TCD a průměrnými hodnotami PbtO<sub>2</sub> v intervalech ± 10 min a ± 60 min. Signifikantní je korelace PbtO<sub>2</sub> s PI a RI v obou časových intervalech. U ostatních parametrů TCD (PSV, EDV, Vmean) korelace signifikantní není ani v jednom časovém intervalu. 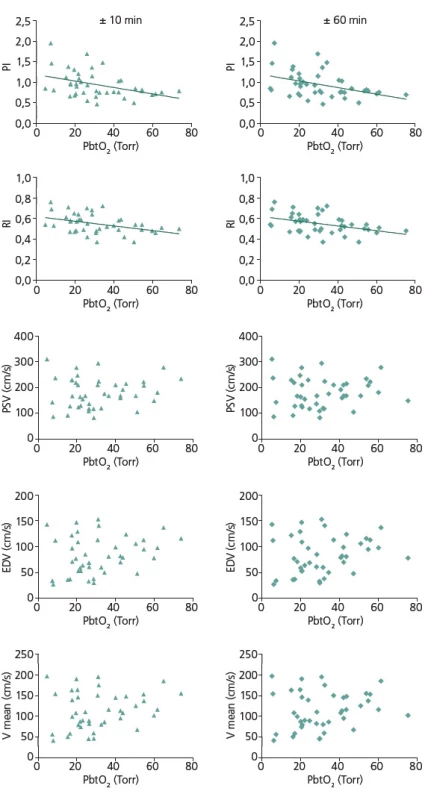
Diskuze
Cílem této práce bylo zjistit, zda existuje korelace mezi hodnotami PbtO2 a parametry TCD u pacientů s těžkým subarachnoidálním krvácením z ruptury aneuryzmatu mozkové tepny.
Tkáňová oxymetrie slouží ke kontinuálnímu měření parciálního tlaku kyslíku v tkáni (PbtO2). Jedná se s o invazivní metodu umožňující lokální měření PbtO2. Systém Licox, který používáme na naší klinice, funguje na principu polarografie a umožňuje měřit hodnoty PbtO2 z plochy o rozměrech 7,5 – 15 mm2 [16]. Klinicky významné vazospazmy jsou spojeny s ischemizací mozkové tkáně [17], a proto se tkáňová oxymetrie jeví jako vhodný nástroj k časné detekci následků vazospazmů. Problém však spočívá v tom, že dosud nebyly definitivně stanoveny meze fyziologických hodnot PbtO2. Například studie, kterou uveřejnili Jödicke, Hübner a Böcker uvádí jako dolní mez normy 19,5 torru [18], Meixensbergerova studie uvádí jako fyziologické hodnoty 48 torrů [19]. Za mez signalizující ischemii jsou však všeobecně považovány hodnoty 15 – 20 torrů, přičemž důležitá je doba, po kterou je mozek kritickým hodnotám vystaven [20,21]. U pacientů po kraniocerebrálním poranění bylo prokázáno, že s rostoucí dobou poklesu PbtO2 pod 15 torrů roste pravděpodobnost úmrtí [20]. U pacientů, kteří zemřeli následkem SAK, byl ve srovnání s přeživšími pacienty popsán vyšší výskyt středních hodnot PbtO2 pod 10 torrů [22]. Další studie prokázala, že dlouhodobý pokles PbtO2 pod 20 torrů je asociován s horším výsledným stavem [21]. Souvislost mezi parametry TCD a hodnotami PbtO2 však zatím popsána nebyla.
Monitorovanou oblastí bylo ve všech případech povodí ACM, neboť zavést čidlo do tohoto povodí je možné s vysokou mírou jistoty, což neplatí pro zavádění čidla do povodí ACA a monitoring v povodí ACP se na našem pracovišti neprovádí často. Znalost povodí monitoringu byla důležitá, protože hodnocení bylo provedeno na základě párování záznamů pořízených pomocí TCD a systému Licox. Z hlediska hodnocení praktického využití metody bylo tedy nejlepší provádět monitoring v povodí ACM, i když bylo aneuryzma lokalizováno v jiném povodí.
U námi zkoumaného souboru se u PbtO2 monitoringu průměrné hodnoty pohybovaly nad 20 torrů. To si vysvětlujeme tím, že monitoring byl zahájen poměrně časně po SAK (4. den), tedy v době, kdy ještě vazospazmy u většiny pacientů nejsou vyvinuty a dá se předpokládat, že hodnoty PbtO2 budou v tomto období vyšší než v období, kdy jsou již vazospazmy plně vyvinuty. Monitoring trval nejdéle po dobu 10 dní, potom bylo čidlo zrušeno, aby bylo minimalizováno riziko infekčních komplikací. Takový postup je považován za bezpečný a je spojen s minimálním rizikem pro pacienta [23]. Období monitoringu mezi 4. a 14. dnem po SAK bylo zvoleno proto, aby byla pokryta perioda největšího rizika vzniku vazospazmů, která je důležitá z klinického hlediska.
Průměrné hodnoty PbtO2 monitoringu nebyly u zkoumaného souboru významně rozdílné v závislosti na HH, Fischer ani GOS, přestože byla zjevná tendence k nižším hodnotám PbtO2 u pacientů v horším klinickém stavu při přijetí a s horším výsledným stavem. I tato skutečnost může být způsobena časnou aplikací monitoringu PbtO2, neboť se dá předpokládat, že hodnoty PbtO2 u pacientů v horším stavu a s horším výsledným stavem budou díky závažnému klinickému průběhu, který významně ovlivňují také vazospazmy, nižší v pozdějším období.
U zkoumaného souboru jsme hodnotili korelaci mezi parametry TCD a hodnotami PbtO2 v časových intervalech ± 10 min a ± 60 min. Tyto intervaly jsme zvolili, aby byl pokryt kratší i delší časový interval v návaznosti na TCD vyšetření, neboť dynamika mezi tokem v magistrálních cévách a parciálním tlakem kyslíku v tkáni není popsána. K hodnocení jsme použili 40 záznamů od 22 pacientů, což může vést k určitému zkreslení, které je však dle našeho názoru zanedbatelné. Vzhledem k tomu, že každý pacient může mít záznam pořízen v situaci s vazospazmy nebo bez nich, předpokládáme při hodnocení tohoto parametru minimální vliv charakteristiky jednotlivého pacienta a naopak zásadní vliv absence či přítomnosti vazospazmů.
U zkoumaného souboru jsme prokázali korelaci PbtO2 s PI a RI. PI vyjadřuje rozdíl rychlostí toků během systoly a diastoly (PI = (PSV – EDV)/ Vmean), tento parametr tedy zejména reflektuje nitrolební tlak. RI vystihuje pulzatilní tok krve odpovídající rezistenci mikrovaskulárního řečiště (RI = (PSV – EDV)/ PSV). Oba parametry charakterizují situaci v periferní oblasti, stejně jako tkáňová oxymetrie, která měří koncentraci kyslíku v tkáni. PI i RI jsou ovlivněny nejen cerebrálním perfuzním tlakem (pro který jsou kritické rychlosti toků na magistrálních cévách), ale také dalšími parametry, jako je například intrakraniální tlak. Dříve již bylo popsáno, že vyšší hodnoty PI i RI jsou spojeny s vyšším ICP a horším výsledným stavem [24]. V naší práci jsme prokázali, že vyšší hodnoty indexů PI i RI jsou spojeny s nižšími hladinami PbtO2, což zatím publikováno nebylo.
U zkoumaného souboru jsme neprokázali korelaci mezi PbtO2 s PSV, EDV ani Vmean. Tyto parametry reprezentují toky na magistrálních tepnách (v našem případě ACM), zatímco tkáňová oxymetrie měří koncentraci kyslíku v tkáni a absence korelace mezi těmito parametry a PbtO2 naznačuje, že mezi nimi neexistuje jednoduchá souvislost. Avšak dá se předpokládat hlubší souvislost mezi PbtO2 a výše zmíněnými parametry nejen z logiky věci samotné (průtok krve – koncentrace kyslíku), ale i proto, že PI i RI jsou parametry odvozené z těchto veličin; RI = (PSV – EDV)/ PSV, PI = (PSV – EDV)/ Vmean. Hodnocení hlubších souvislostí je však za daných okolností obtížné, neboť TCD monitoring není schopen poskytnout informaci o době vzniku vazospazmů, informuje nás pouze o jejich přítomnosti nebo nepřítomnosti. Nevíme tedy, zda v okamžiku, kdy jsou vazospazmy pomocí TCD diagnostikovány, tyto teprve vznikají, trvají delší dobu nebo již odeznívají. Takovou informaci by nám poskytl pouze kontinuální TCD monitoring, který by odhalil, kdy vazospazmy reálně vznikají a na tento okamžik by bylo možné centrovat výchozí bod hodnocení PbtO2. Tak by bylo teoreticky možné zjistit informace o dynamice mezi rychlostí toků na hlavních kmenech mozkových tepen a koncentrací kyslíku v tkáni a také vliv dalších parametrů, jako je např. ICP. Použití kontinuálního TCD monitoringu je však limitováno potenciálním nárůstem teploty tkáně, ke kterému může takto prováděný monitoring vést, a proto je v současnosti doporučováno používat kontinuální monitoring intermitentně [25]. Doporučený časový interval použití kontinuálního TCD monitoringu se pohybuje kolem 30 min [25]. Tento časový interval se zdá být z pohledu hodnocení dynamiky TCD PbtO2 dostatečný, neboť se dá předpokládat, že po změně rychlosti toků na magistrálních tepnách dojde ke změně koncentrace kyslíku v tkáni s menší latencí. Je však třeba zdůraznit, že zásadní vliv na hladiny PbtO2 mohou mít také další faktory, jako například periferní vazospazmy nebo mikroembolizace, které jsou však v klinických podmínkách obtížně definovatelné.
Znalost dynamiky mezi příčinou (vazospazmus), následkem (ischemie reprezentovaná hodnotou PbtO2) je důležitá klinická informace. Vzhledem ke skutečnosti, že tuto dynamiku zatím nejsme schopni detailně popsat, nelze v současnosti nahradit informaci, kterou nám poskytuje TCD, měřením PbtO2 a naopak. Proto se v klinické praxi jeví jako vhodné paralelní užití obou metod. Monitoring PbtO2 umožňuje kontinuální měření, je tedy schopen časně detekovat pokles PbtO2, který však nemusí být způsoben pouze vazospazmy. TCD vyšetření zase poskytne informaci o tom, zda jsou vazospazmy přítomny, avšak není schopné podat jakoukoliv časovou informaci. Z výše uvedeného také vyplývá, že zavedení kontinuálního TCD monitoringu by mohlo představovat výrazný přínos v léčbě pacientů po SAK.
Závěr
PbtO2 monitoring poskytuje informace o stavu mozkové tkáně a její mikrovaskulatury. Neexistuje jednoduchá souvislost mezi hodnotami PbtO2 a rychlostmi toků na magistrálních cévách, které charakterizují cévní vazospazmy. Protože neumíme určit dynamiku změn rychlostí toků na magistrálních cévách v souvislosti se změnami hodnot PbtO2, jeví se v klinické praxi u pacientů s těžkým SAK vhodné paralelní užití TCD i PbtO2 monitoringu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 13. 9. 2013
Přijato do tisku: 26. 11. 2013
MUDr. Kamil Ďuriš, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: kduris@med.muni.cz
Sources
1. Al ‑ Khindi T, Macdonald RL, Schweizer TA. Cognitive and functional outcome after aneurysmal subarachnoid hemorrhage. Stroke 2010; 41(8): e519 – e536.
2. van Gijn J, Kerr RS, Rinkel GJ. Subarachnoid haemorrhage. The Lancet 2007; 369(9558): 306 – 318.
3. van Gijn J, Rinkel GJ. Subarachnoid haemorrhage: diagnosis, causes and management. Brain 2001; 124(2): 249 – 278.
4. Heros RC, Zervas NT, Varsos V. Cerebral vasospasm after subarachnoid hemorrhage: an update. Ann Neurol 1983; 14(6): 599 – 608.
5. Kassell NF, Sasaki T, Colohan AR, Nazar G. Cerebral vasospasm following aneurysmal subarachnoid hemorrhage. Stroke 1985; 16(4): 562 – 572.
6. Al ‑ Tamimi YZ, Orsi NM, Quinn AC, Homer ‑ Vanniasinkam S, Ross SA. A review of delayed ischemic neurologic deficit following aneurysmal subarachnoid hemorrhage: historical overview, current treatment, and pathophysiology. World Neurosurg 2010; 73(6): 654 – 667.
7. Fisher CM, Kistler JP, Davis JM. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery 1980; 6(1): 1 – 9.
8. Weyer GW, Nolan CP, Macdonald RL. Evidence‑based cerebral vasospasm management. Neurosurg Focus 2006; 21(3): E8.
9. Rigamonti A, Ackery A, Baker AJ. Transcranial Doppler monitoring in subarachnoid hemorrhage: a critical tool in critical care. Can J Anesth 2008; 55(2): 112 – 123.
10. Lysakowski C, Walder B, Costanza MC, Tramèr MR.Transcranial Doppler versus angiography in patients with vasospasm due to a ruptured cerebral aneurysm: A systematic review. Stroke 2001; 32(10): 2292 – 2298.
11. Munch E, Vajkoczy P. Current advances in the diagnosis of vasospasm. Neurol Res 2006; 28(7): 703 – 712.
12. Hejčl A, Bolcha M, Procházka J, Sameš M. Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neurointenzivní péči. Cesk Slov Neurol N 2009; 72/ 105(4): 383 – 337.
13. Smrčka M. Monitoring pacientů s těžkým poraněním mozku. Cesk Slov Neurol N 2011; 74/ 107(1): 9 – 20.
14. Smrčka M, Ďuriš K, Juráň V, Neuman E, Kýr M. Peroperační monitoring tkáňové oxymetrie a peroperační užití hypotermie v chirurgii mozkových aneuryzmat. Cesk Slov Neurol N 2009; 72/ 105(3): 245 – 249.
15. Jarus ‑ Dziedzic K, Bogucki J, Zub W. The influence of ruptured cerebral aneurysm localization on the blood flow velocity evaluated by transcranial Doppler ultrasonography. Neurol Res 2001; 23(1): 23 – 28.
16. Nortje J, Gupta AK. The role of tissue oxygen monitoring in patients with acute brain injury. Br J Anaesth 2006; 97(1): 95 – 106.
17. Kumar A, Brown R, Dhar R, Sampson T, Derdeyn CP,Moran CJ et al. Early vs. delayed cerebral infarction following aneurysm repair after subarachnoid hemorrhage. Neurosurgery 2013; 73(4): 617 – 623.
18. Jödicke A, Hübner F, Böker DK. Monitoring of brain tissue oxygenation during aneurysm surgery: prediction of procedure‑related ischemic events. J Neurosurg 2003; 98(3): 515 – 523.
19. Meixensberger J, Dings J, Kuhnigk H, Roosen K.Studies of tissue PO2 in normal and pathological human brain cortex. Acta Neurochir (Wien) 1993; 59 (Suppl): 58 – 63.
20. Valadka AB, Gopinath SP, Contant CF, Uzura M, Robertson CS. Relationship of brain tissue PO2 to outcome after severe head injury. Crit Care Med 1998; 26(9): 1576 – 1581.
21. Schmidt JM, Ko SB, Helbok R, Kurtz P, Stuart RM, Presciutti M et al. Cerebral perfusion pressure thresholds for brain tissue hypoxia and metabolic crisis after poor ‑ grade subarachnoid hemorrhage. Stroke 2011; 42(5): 1351 – 1356.
22. Meixensberger J, Vath A, Jaeger M, Kunze E, Dings J, Roosen K. Monitoring of brain tissue oxygenation following severe subarachnoid hemorrhage. Neurol Res 2003; 25(5): 445 – 450.
23. Dings J, Meixensberger J, Jäger A, Roosen K. Clinical experience with 118 brain tissue oxygen partial pressure catheter probes. Neurosurgery 1998; 43(5): 1082 – 1095.
24. Soehle M, Chatfield DA, Czosnyka M, Kirkpatrick PJ.Predictive value of initial clinical status, intracranial pressure and transcranial Doppler pulsatility after subarachnoid haemorrhage. Acta Neurochir (Wien) 2007; 149(6): 575 – 583.
25. Nakagawa K, Ishibashi T, Matsushima M, Tanifuji Y,Amaki Y, Furuhata H. Does long‑term continuous transcranial Doppler monitoring require a pause for safer use? Cerebrovasc Dis 2007; 24(1): 27 – 34.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 2-
All articles in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
- Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

