-
Medical journals
- Career
Normotenzní hydrocefalus – komplikace z předrénování a jejich závislost na použitém ventilu
Authors: V. Vybíhal 1; G. Hanoun 1; Marek Sova 1; M. Smrčka 1; Z. Bortlíček 2; M. Keřkovský 3
Authors‘ workplace: Neurochirurgická klinika LF MU a FN Brno 1; Institut biostatistiky a analýz MU, Brno 2; Radiologická klinika LF MU a FN Brno 3
Published in: Cesk Slov Neurol N 2013; 76/109(2): 217-220
Category: Short Communication
Overview
Předrénování patří mezi komplikace normotenzního hydrocefalu i hydrocefalu obecně. Autoři se v práci zabývají srovnáním vlivu ventilů s fixním otevíracím tlakem a programovatelných ventilů s gravitační nebo antisifónovou jednotkou na vznik předrénování. Analyzován byl soubor od roku 2003 do roku 2011 sestávající z 82 pacientů s průměrným věkem 66,8 roků (medián 67,2 roků), z nichž u 42 byly implantovány ventily s fixním otevíracím tlakem a u 40 nemocných byly zavedeny ventily programovatelné. Pro předrénování bylo revidováno osm ze 42 pacientů s implantovaným ventilem s fixním otevíracím tlakem (19,0 %). Ve skupině pacientů s programovatelným ventilem nebyla žádná operační revize nutná kromě pacienta, který se nedostavil na plánovanou kontrolu a přišel později až o 11 měsíců. Programovatelné ventily s gravitačními jednotkami nebo antisifónovým zařízením statisticky významně redukují četnost výskytu komplikací z předrénování. Celkově se tak podílejí na zlepšení výsledků chirurgické terapie pacientů s normotenzním hydrocefalem a redukci nutných revizí zkratového systému.
Klíčová slova:
normotenzní hydrocefalus – shuntÚvod
Normotenzní hydrocefalus (NPH) je specifická forma komunikujícího hydrocefalu, kdy je dilatace komorového systému doprovázena klinickou trias sestávající se z poruchy chůze, demence a poruchy sfinkterových funkcí při normálním tlaku mozkomíšního moku (CSF) při lumbální punkci (60–240 mm vodního sloupce, resp. 4,4 mmHg až 17,7 mmHg).
Předrénování (overdrainage) patří mezi komplikace NPH i hydrocefalu obecně. Větší subdurální kolekce si pak vynutí nejen případnou korekci drenážního systému (změnu tlaku u programovatelných ventilů, výměnu ventilu nebo přidání antisifónového zařízení), ale také ošetření (většinou trepanaci s evakuací a případnou drenáží) subdurálního hematomu (SDH) či hygromu. Pacient je tak dále zatěžován a vystaven dalšímu riziku spjatému s opakovanými operačními výkony. Frekvence předrénování se podle literárních údajů pohybuje od 6 do 80 % [1]. Incidence SDH vzniklých po implantaci shuntu se udává od 2 do 17 % [2].
Cílem práce je srovnání vlivu ventilů s fixním otevíracím tlakem (VFOT) a programovatelných ventilů (PV) s gravitační nebo antisifónovou jednotkou u pacientů s normotenzním hydrocefalem na vznik předrénování, které je nutné řešit chirurgicky.
Soubor a metodika
Od počátku roku 2003 do konce roku 2011 bylo na naší klinice operováno celkem 82 pacientů s NPH. Průměrný věk byl 66,8 roků (medián 67,2 roků). Padesát čtyři (65,9 %) pacientů bylo s idiopatickým NPH a 28 (34,1 %) pacientů se sekundárním NPH. V souboru bylo 44 (53,7 %) mužů a 38 žen (46,3 %).
U 42 (51,2 %) pacientů byly implantovány VFOT (Contour-Flex) firmy Integra Neurosciences. Tyto ventily jsou založeny na principu ploché silikonové membrány a jsou uloženy v kónické polypropylenové základně. Vyráběny jsou ve čtyřech různých tlakových nastaveních a dvou velikostech. Ve 30 případech byly použity ventily střednětlaké (100 mm vodního sloupce) a ve 12 případech vysokotlaké (130 mm vodního sloupce).
U 40 (48,8 %) pacientů byly implantovány PV s přídavným zařízením redukujícím sifónový efekt. Byly použity dva typy těchto PV. U jedné skupiny se jednalo o ventily proGAV (programmable Gravity Assisted Valve) firmy Miehtke. Skládají se ze dvou částí – PV a gravitační jednotky, které jsou uloženy v pouzdrech z titanu. Programovatelnou část lze nastavit v rozpětí od 0 do 200 mm vodního sloupce s krokem po 10 mm. Jako mechanizmus je použita tantalová kulička na pružině. Ventil je navíc vybaven mechanickou aretací, která zabraňuje možné náhodné změně nastavené hodnoty externím magnetickým polem. Implantovány byly u 26 (31,7 %) pacientů.
U druhé skupiny byly použity PV Strata II firmy Medtronic. Využívají principu silikonové membrány uložené v polypropylenové základně. Je možno nastavit pět různých tlakových úrovní od 0,5 do 2,5 s krokem 0,5 odpovídající hodnotám přibližně 20, 45, 80, 115 a 145 mm vodního sloupce. Systém je také vybaven antisifónovým zařízením (tzv. Delta chamber) a je vyráběn v několika tvarových modifikacích. Tento druh ventilů byl implantován 14 (17,1 %) pacientům. Počty jednotlivých užitých ventilů jsou znázorněny v grafu 1.
Graph 1. Přehled jednotlivých druhů implantovaných ventilů v souboru. IN-CF – zkratka pro ventil Contour Flex firmy Integra Neurosciences 
U pacientů s PV nastavujeme nejčastěji otevírací tlak na hodnotu 100 mm vodního sloupce a případně následně snižujeme nastavenou hodnotu podle klinického efektu. Typ gravitační jednotky byl zvolen na základě doporučení firmy Miethke zohledňující věk, výšku a váhu, resp. body mass index pacientů.
Všichni pacienti byli před operací otestováni, zda je u nich předpoklad efektu zkratové operace. K testování byl použit lumbální infuzní test s technikou „steady state“, popřípadě ventrikulární infuzní test, zevní lumbální drenáž, event. zevní komorová drenáž, nebo jejich kombinace.
Data od roku 2003 do roku 2006 byla získána retrospektivně, od roku 2007 do roku 2011 byla sbírána prospektivně.
Sledování probíhalo v rozmezí od čtyř do 110 měsíců s průměrnou dobou 59,2 měsíců. Standardně pacienti po implantaci shuntu chodí na kontrolu na neurochirurgickou ambulanci za jeden, tři, šest a 12 měsíců po operaci a následně po jednom až dvou letech. V průběhu prvního roku jsou klinické kontroly doplňovány vyšetřením zobrazovací metodou – nejčastěji výpočetní tomografií (CT). Další CT vyšetření jsou pak indikována při změně klinického stavu či po přeprogramování ventilu.
Výsledky
U šesti pacientů (14,3 %) s VFOT bylo nutné operačně ošetřit vzniklé chronické SDH či hygromy (obr. 1). Indikovány k operaci byly asymptomatické hematomy tloušťky 10 mm a více, hematomy nebo hygromy symptomatické, popřípadě se zřetelně progredující velikostí. Současně byla nutná i korekce implantovaného zkratového systému. Ta byla provedena také u dvou pacientů pro hypotenzní bolesti hlavy zvýrazňující se při vertikalizaci (4,8 %). Z těchto zmíněných komplikací byla pouze jedna u pacienta se sekundárním NPH, zbylé se týkaly pacientů s idiopatickým NPH. Celkem bylo pro předrénování nutno revidovat osm pacientů (19,0 %), z nichž sedm nemocných mělo implantováno střednětlaký ventil a jeden nemocný vysokotlaký ventil. Ve třech případech bylo použito antisifónové zařízení, u čtyřech nemocných byl vyměněn stávající ventil za ventil s vyšším otevíracím tlakem a v jednom případě byl zaveden PV. Komplikace, které si vynutily operační řešení, vznikaly v průměru za 7,0 týdnů od implantace shuntu s minimem 2,7 týdnů a maximem 10,6 týdnů.
Image 1. Pacient komplikovaný předrénováním – chronický subdurální hematom (snímek uprostřed) na vyšetření pomocí výpočetní tomografie. Navíc je nově okcipitálně vpravo stav po proběhlém iktu, který v časném období po implantaci shuntu nebyl patrný (horní snímek). Po revizi – trepanaci a evakuaci chronického subdurálního hematomu a korekci zkratového systému – je vidět regrese velikosti SDH (dolní snímek). 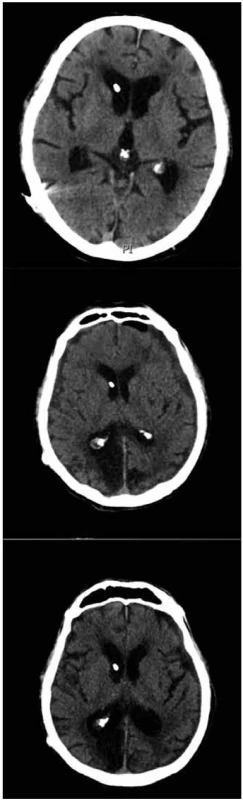
U žádného pacienta s PV dostavujícího se na pravidelné kontroly nebyla nutná operační revize. Počínající předrénování bylo vždy zachyceno včas a bylo řešeno přeprogramováním ventilu u 6 pacientů (15 %). U 1 pacienta, který se po přeprogramování ventilu nedostavil na plánovanou kontrolu, bylo nutno provést trepanaci a evakuaci oboustranného SDH s odstupem 11 měsíců. Další přeprogramování bylo provedeno z důvodu poddrénování u 10 pacientů (25 %). Celkem byl měněn nastavený otevírací tlak u 16 pacientů (40 %) na průměrnou hodnotu 90,4 mm vodního sloupce s minimem 40 mm a maximem 115 mm vodního sloupce. Srovnání počtu komplikací ve smyslu předrénování u hodnocených typů ventilů je zachyceno v grafu 2.
Graph 2. Srovnání komplikací (v %) z předrénování u pacientů s ventily s fixním otevíracím tlakem a programovatelnými ventily s gravitační nebo antisifónovou jednotkou. 
U pacientů, kde byly použity PV, bylo statisticky významné snížení rizika (Fisherův exaktní test, oboustranný, p = 0,0296) předrénování na rozdíl od pacientů, kteří měli zaveden VFOT.
Diskuze
O PV se literatura poprvé zmiňuje v roce 1973 [3]. Umožňují regulovat rychlost toku CSF přes celý zkratový systém neinvazivně a opakovaně. Tato jejich flexibilita se jeví užitečná i v managementu pooperačních komplikací, jakými může být poddrénování nebo předrénování s případným výskytem SDH.
Rizikovým faktorem vzniku subdurálních kolekcí je předrénování z nadměrné drenáže CSF přes zkratový systém. Dochází k redukci ventrikulárního objemu, následně k natažení a roztržení přemosťujících žil se vznikem SDH [2].
V retrospektivní studii Zemacka a Romnera z roku 2002 s 218 pacienty byl výskyt subdurálních kolekcí u 9,5 % pacientů s idiopatickým NPH a u 1,4 % pacientů se sekundárním NPH [4]. Celkem byl výskyt SDH u 10,9 % pacientů. V 2,2 % případů byla nutná chirurgická revize. Použity byly PV firmy Codman. Přeprogramování bylo provedeno u 63,3 % pacientů, z nichž 49,1 % bylo zlepšeno. Průměrná doba vzniku subdurální kolekce byla 4,5 měsíce po implantaci shuntu.
V prospektivní studii Boonové et al z roku 1998, v níž byly použity nízkotlaké a střednětlaké ventily, se vyskytly subdurální kolekce u 73 % pacientů s nízkotlakými ventily a u 34 % se střednětlakými ventily [5]. Vzniklé subdurální kolekce ale nijak podstatně klinický stav neovlivňovaly. Prospektivní studie Raftopoulose et al z roku 1996 uvádí výskyt chronických SDH u 17 % pacientů [6]. Jedním z faktorů, který má vliv na incidenci SDH, je důkladnost sledování pacientů po operaci. Vyšší incidence subdurálních kolekcí byla popsána ve studiích, kde byly rutinně prováděny CT kontroly [5].
Pokud je zaveden VFOT a je potřeba změnit nastavení otevíracího tlaku, je nutná operační revize [7]. Z toho jasně vyplývají výhody PV, jejichž přítomnost může pacienty případných operačních revizí ušetřit.
Problém u NPH je, že neexistuje zcela jasné pravidlo, podle kterého by bylo možné zvolit nejvhodnější nastavení otevíracího tlaku. Určitou výjimku představuje například firma Miethke, jež uvádí doporučované hodnoty jak pro nastavení programovatelného ventilu, tak i pro výběr gravitační jednotky. Ty závisejí na typu hydrocefalu, věku, výšce, hmotnosti, resp. body mass indexu, a též na poloze pacienta. Nezanedbatelné jsou také individuální rozdíly a časový faktor, kdy může dojít ke změnám intrakraniálních, popřípadě intraabdominálních (např. váhový přírůstek s eventuálním zvýšením intraabdominálního tlaku) poměrů, které si pak někdy vynutí změnu nastavených parametrů.
Někteří autoři doporučují iniciální nastavení vyššího tlaku a jeho následné snižování [4,8]. Jiní naopak podporují iniciální nastavení nižšího tlaku a jeho následné zvyšování v pooperačním období [9].
Řada autorů ke stanovení otevíracího tlaku používá rozdílných metod. Ke korekci nastaveného tlaku dva týdny po operaci použili Tsuji et al likvorodynamický test [10]. Nevýhodou je jeho invazivita a s ní spjatá rizika.
Sindou et al korigovali tlak na základě klinického obrazu, tíže příznaků a nálezu na vyšetření výpočetní tomografií [11]. V souboru byli pacienti s různými typy hydrocefalu a arachnoidálními cystami. Největší profit z možnosti přeprogramování ventilu měli pacienti s NPH a arachnoidálními cystami.
Otevírací tlak ventilu byl nastavován i podle vzorce HP = ICP + PPV + IAP, kde HP je hydrostatický tlak, ICP je intrakraniální tlak, PPV je nastavený otevírací tlak na ventilu a IAP je intraabdominální tlak měřený přes uretrální katétr [12]. Vzhledem k tomu, že intraabdominální tlak je závislý na body mass indexu (BMI), je možno jej na základě tohoto indexu poměrně přesně stanovit [13]. Závislost na pohlaví zjištěna nebyla. Navíc v průběhu času může dojít ke změnám intraabdominálního tlaku (obstipace, změna hmotnosti atd.), což může mít vliv na celkové vlastnosti zkratového systému a případně modifikovat klinický stav pacienta [14].
Jinou možností je nastavení otevíracího tlaku ventilu v rozsahu od 10 mm do 30 mm vodního sloupce pod úroveň naměřenou předoperačně [15]. U většiny pacientů došlo k ústupu klinických příznaků hydrocefalu až při finálním tlaku 30 mm vodního sloupce pod úroveň tlaku naměřenou předoperačně. Autoři doporučují postupné snižování tlaku ve dvou - až třítýdenních intervalech jako postup, který má zabránit vzniku předrénování. Iniciální průměrný otevírací tlak byl nastaven na 100 mm vodního sloupce.
Mezi tlakem naměřeným při lumbální punkci před operací a konečným tlakem nastaveným na PV po jednom roce nebyla nalezena závislost [12]. Svoji roli sehrává také denní režim pacienta – kolik času tráví v horizontální a vertikální poloze.
Ve studii srovnávající dva druhy ventilů firmy Miethke – DSV (Dual-Switch Valve) a GAV (Gravity Asssisted Valve), se při použití GAV nevyskytly žádné komplikace z předrénování na rozdíl od DSV [16]. Za důvod autoři považují to, že k aktivaci ventilů u GAV dochází při 30 až 40 stupních od horizontální roviny, kdežto u DSV až při 60 až 70 stupních. Za optimální vstupní tlak podle provedené studie autoři udávají 50 mm vodního sloupce. Gravitační jednotky tak považují za důležitý prvek v prevenci předrénování. Na druhé straně je ale třeba upozornit, že použití gravitačních jednotek může znamenat riziko poddrénování u ležících pacientů s mírně elevovanou hlavou, kdy dochází k aktivaci gravitační jednotky [17].
Ve studii s implantovanými PV Codman Hakim bylo použito nastavení vyšších vstupních tlaků v závislosti na výšce a váze pacientů. Průměrný otevírací tlak byl 155 mm vodního sloupce. I přesto bylo u 20 % pacientů zaznamenáno předrénování [12].
Ve studiích, kde nebyly použity ani gravitační jednotky, ani antisifónové zařízení, se vyskytovaly subdurální kolekce i přes vstupně výše nastavené tlaky [4,12,15]. Pokud byly k těmto ventilům přidány gravitační jednotky („shunt assistent“), došlo k výraznému redukování až vymizení předrénování [18]. Ve studii SVASONA bylo prokázáno, že gravitační jednotky redukují riziko vzniku předrénování až o 90 %, aniž ovlivňují výsledný efekt léčby [19,20].
Závěr
Programovatelné ventily s gravitačními jednotkami nebo antisifónovými zařízeními statisticky významně redukují četnost výskytu komplikací z předrénování. Podílejí se tak na zlepšení výsledků chirurgické terapie pacientů s normotenzním hydrocefalem a na redukci nutných revizí zkratového systému.
Seznam použitých zkratek
- CSF – mozkomíšní mok (CerebroSpinal Fluid)
- CT – výpočetní tomografie
- NPH – normotenzní hydrocefalus (Normal Pressure Hydrocephalus)
- PV – programovatelný ventil
- SDH – subdurální hematom
- VFOT – ventil s fixním otevíracím tlakem
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Václav Vybíhal
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: vvybihal@fnbrno.cz
Přijato k recenzi: 22. 5. 2012
Přijato do tisku: 13. 9. 2012
Sources
1. Meier U, Lemcke J. First clinical experiences in patients with idiopathic normal-pressure hydrocephalus with the adjustable gravity valve manufactured by Aesculap (proGAV(Aesculap)). Acta Neurochir Suppl 2006; 96 : 368–372.
2. Goodwin CR, Kharkar S, Wang P, Pujari S, Rigamonti D, Williams MA. Evaluation and treatment of patients with suspected normal pressure hydrocephalus on long-term warfarin anticoagulation therapy. Neurosurgery 2007; 60(3): 497–501.
3. Hakim S. Hydraulic and mechanical mis-matching of valve shunts used in the treatment of hydrocephalus: the need for a servo-valve shunt. Dev Med Child Neurol 1973; 15(5): 646–653.
4. Zemack G, Romner B. Adjustable valves in normal--pressure hydrocephalus: a retrospective study of 218 patients. Neurosurgery 2002; 51(6): 1392–1400.
5. Boon AJ, Tans JT, Delwel EJ, Egeler-Peerdeman SM, Hanlo PW, Wurzer HA et al. Dutch Normal-Pressure Hydrocephalus Study: randomized comparison of low - and medium-pressure shunts. J Neurosurg 1998; 88(3): 490–495.
6. Raftopoulos C, Massager N, Balériaux D, Deleval J, Clarysse S, Brotchi J. Prospective analysis by computed tomography and long-term outcome of 23 adult patients with chronic idiopathic hydrocephalus. Neurosurgery 1996; 38(1): 51–59.
7. Han YM, Yoo DS, Kim DS, Huh PW, Cho KS, Kang JK. A clinical analysis of the ventriculoperitoneal shunt with programmable shunt device. J Korean Neurosurg Soc 1999; 28 : 75–81.
8. Reinprecht A, Czech T, Dietrich W. Clinical experience with a new pressure-adjustable shunt valve. Acta Neurochir (Wien) 1995; 134(3–4): 119–124.
9. Turner DA, McGeachie RE. Normal pressure hydrocephalus and dementia – evaluation and treatment. Clin Geriatr Med 1988; 4(4): 815–830.
10. Tsuji O, Sato K. CSF dynamics in a patient with a programmable shunt. Acta Neurochir Suppl 1998; 71 : 364–367.
11. Sindou M, Guyotat-Pelissou I, Chidiac A, Goutelle A. Transcutaneous pressure adjustable valve for the treatment of hydrocephalus and arachnoid cysts in adults. Experiences with 75 cases. Acta Neurochir (Wien) 1993; 121(3–4): 135–139.
12. Miyake H, Kajimoto Y, Tsuji M, Ukita T, Tucker A, Ohmura T. Development of a quick reference table for setting programmable pressure valves in patients with idiopathic normal pressure hydrocephalus. Neurol Med Chir (Tokyo) 2008; 48(10): 427–432.
13. Cobb WS, Burns JM, Kercher KW, Matthews BD, Norton JH, Heniford TB. Normal intraabdominal pressure in healthy adults. J Surg Res 2005; 129(2): 231–235.
14. Kajimoto Y, Ohta T, Miyake H, Matsukawa M, Ogawa D, Nagao K et al. Posture-related changes in the pressure environment of the ventriculoperitoneal shunt system. J Neurosurg 2000; 93(4): 614–617.
15. Kim KH, Yeo IS, Yi JS, Lee HJ, Yang JH, Lee IW. A pressure adjustment protocol for programmable valves. J Korean Neurosurg Soc 2009; 46(4): 370–377.
16. Meier U, Kiefer M, Neumann U, Lemcke J. On the optimal opening pressure of hydrostatic valves in cases of idiopathic normal-pressure hydrocephalus: a prospective randomized study with 123 patients. Acta Neurochir Suppl 2006; 96 : 358–363.
17. Kaestner S, Kruschat T, Nitzsche N, Deinsberger W. Gravitational shunt units may cause under-drainage in bedridden patients. Acta Neurochir (Wien) 2009; 151(3): 217–221.
18. Meier U, Lemcke J. Is it possible to optimize treatment of patients with idiopathic normal pressure hydrocephalus by implanting an adjustable Medos Hakim valve in combination with a Miethke shunt assistant? Acta Neurochir Suppl 2006; 96 : 381–385.
19. Lemcke J, Meier U, Müller C, Fritsch M, Kiefer M, Eymann R et al. On the method of a randomised comparison of programmable valves with and without gravitational units: the SVASONA study. Acta Neurochir Suppl 2012; 114 : 243–246.
20. Lemcke J, Meier U, Müller C, Fritsch M, Eymann R, Kiefer M et al. Is it possible to minimize overdrainage complications with gravitational units in patients with idiopathic normal pressure hydrocephalus? Protocol of the randomized controlled SVASONA Trial (ISRCTN51046698). Acta Neurochir Suppl 2010; 106 : 113–115.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 2-
All articles in this issue
- Creutzfeldtova-Jakobova choroba
- Elektrofyziologické vyšetření pánevního dna
- Význam a limitace zrakových evokovaných potenciálů ve studiu patofyziologie migrény
- Habituace je významnější na pohybový podnět ve srovnání s reverzačním podnětem – pilotní studie
- Vyhodnocení sběru epidemiologických dat u cévních mozkových příhod z registru IKTA. Incidence cévních mozkových příhod v okrese Zlín
- Úloha neurootologa v záchytu poradiačních komplikací u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- Tortikolis při Griselově syndromu – kazuistiky
- X-viazaná adrenoleukodystrofia
- X-vázaná myotubulární myopatie u dvou bratrů v důsledku nové mutace v MTM1 genu – kazuistiky
- Zriedkavejšia príčina obštrukčného syndrómu spánkového apnoe – morbus Madelung. Kazuistiky
- Sonograficky navigované operace mozkových kavernomů
- Endoskopická ventrikulocisternostomie u dětí s předchozí implantací ventrikuloperitoneální drenáže
- Diagnostika, terapie a dispenzarizace meningeomů na NCHK FN Brno v letech 2005–2010
- Normotenzní hydrocefalus – komplikace z předrénování a jejich závislost na použitém ventilu
- Spinocerebelární ataxie typ 7 (SCA7) – kazuistika
- Lymeská borelióza jako příčina bilaterální neuroretinitidy s výraznou jednostrannou hvězdicovitou makulopatií u osmileté dívky
- Rozdíly v modulaci kortikální aktivity u pacientů po cévní mozkové příhodě s reziduální spasticitou ruky léčených botulotoxinem A
- Pozdní forma Tay-Sachsovy choroby napodobuje spinální svalovou atrofii III. typu – dvě kazuistiky
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Creutzfeldtova-Jakobova choroba
- Spinocerebelární ataxie typ 7 (SCA7) – kazuistika
- Lymeská borelióza jako příčina bilaterální neuroretinitidy s výraznou jednostrannou hvězdicovitou makulopatií u osmileté dívky
- Elektrofyziologické vyšetření pánevního dna
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

