-
Medical journals
- Career
Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
Authors: Š. Buršováihash2ihash4ihash6ihash8 1,2 1,2 1,2 2,3 1,2
Authors‘ workplace: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut MU, Brno 2; Anatomický ústav LF MU, Brno 3; Institut biostatistiky a analýz MU, Brno 4; Diabetologické centrum Interní gastroenterologické kliniky LF MU a FN Brno 5
Published in: Cesk Slov Neurol N 2012; 75/108(5): 562-572
Category: Original Paper
Overview
Cíl:
Ověřit validitu a prediktivní hodnotu vybraných skríningových testů pro detekci polyneuropatie – The Michigan Neuropathy Screening Instrument (MNSI) a The Utah Early Neuropathy Scale (UENS), a skríningového testu pro detekci neuropatické bolesti – DN4 – u pacientů s prediabetem a časným diabetem mellitem 2. typu (preDM/eDM2).Soubory a metodika:
Soubor 17 pacientů s preDM a 48 pacientů s eDM2 (s trváním do tří let) a kontrolní skupina 40 zdravých dobrovolníků bez poruchy glukózového metabolizmu byly extenzivně vyšetřeny se zaměřením na detekci neuropatie silných (LFN) a tenkých vláken (SFN).Výsledky:
Možná diabetická periferní neuropatická bolest (DPNP) byla detekována u 15 preDM/eDM2 pacientů (23,1 %). DN4 prokázal schopnost diferencovat pacienty s DPNP a bez ní, optimální cut-off hodnota však byla nižší než doporučovaná (≥ 1 bodů). Pomocí MNSI I bylo možné odlišit nemocné s klinicky podporovanou SFN (cut-off > 1 bod), zatímco pomocí MNSI II bylo možné diferencovat nemocné s klinicky i laboratorně podporovanou LFN (p = 0,003; p < 0,001) při použití doporučovaného kritéria ≥ 2–≥ 3 body. Pomocí UENS bylo navíc možné diskriminovat i nemocné s klinicky podporovanou SFN (p = 0,038), nikoliv však nemocné s laboratorně podporovanou SFN.Závěry:
Pomocí DN4 bylo možné detekovat nemocné s DPNP, při použití doporučovaných limitních hodnot má však spíše charakter konfirmačního než skríningového testu s vysokou specificitou a nižší senzitivitou. Pomocí MNSI I bylo možné diskriminovat nemocné s klinicky podporovanou SFN, avšak nikoli při použití doporučované hodnoty cut-off > 7 bodů. Pomocí MNSI II a UENS bylo možné u nemocných s preDM/eDM2 spolehlivě diskriminovat jedince s LFN a bez ní, pouze UENS však byl schopen diskriminovat nemocné s klinicky podporovanou SFN. Žádný z testů neprokázal dostatečnou validitu v detekci laboratorně podporované SFN.Klíčová slova:
prediabetes – diabetes mellitus 2. typu – neuropatie tenkých vláken – neuropatie silných vláken – časná diabetická neuropatieÚvod
Porucha glukózové tolerance (IGT) byla v několika studiích potvrzena jako častá příčina idiopatické neuropatie tenkých vláken (Small-Fiber Neuropathy, SFN), s udávanou prevalencí IGT mezi 34–35,6 %, což je 3krát více než u stejně staré kontrolní populace [1]. V naší studii u pacientů s neuropatií tenkých vláken tvořila IGT 14,3 % případů [2]. Pokud jsme však vyloučili případy s jinou zjištěnou příčinou SFN než IGT, tak IGT tvořila 32,1 % kryptogenních případů, což je srovnatelné s ostatními studiemi. Asociace mezi poruchou glukózové tolerance a polyneuropatií však dosud nebyla prokázána v prospektivní studii [3] a je nutno počkat na výsledek další studie [4]. V jiné studii u pacientů s diabetem mellitem 2. typu (DM2) nebo IGT a neuropatickou bolestí v oblasti nohou jsme vyšetřili šest nemocných s IGT a všichni měli známky postižení senzitivních tenkých nervových vláken potvrzené jak abnormální hodnotou hustoty intraepidermálních nervových vláken (IntraEpidermal Nerve Fiber Density, IENFD), tak abnormálním termickým prahem (Thermal Perception Threshold, TPT) [5], což je v souladu s názorem, že neuropatie asociovaná s IGT je převážně typu SFN. U časné diabetické neuropatie jsou podobně jako u IGT postižena převážně senzitivní nervová vlákna [6,7].
Ke skríningu diabetické polyneuropatie jsou používány jak jednotlivé jednoduché klinické testy (nejčastěji vyšetření vibrační citlivosti ladičkou nebo tlakové citlivosti 10g monofilamentem), tak komplexní validované skríningové testy, které obsahují exaktně definovanou kombinaci klinických vyšetření, v některých případech současně s identifikací senzitivních symptomů. Mezinárodně zřejmě nejrozšířenějším skríningovým testem je The Michigan Neuropathy Screening Instrument (MNSI), který má sebehodnotící dotazníkovou část vyplňovanou pacientem a následně skórovanou (MNSI I), a dále část klinickou, založenou na jednoduchém hodnocení trofických změn, reflexu Achillovy šlachy, vibrační a tlakové citlivosti (MNSI II). Tento skríningový test je pro potřeby definitivního stanovení diagnózy doplněn elektrofyziologickým vyšetřením (The Michigan Diabetic Neuropathy Score, MDNS) [8] podobně jako další často užívaný test: The Total Neuropathy Score (TNS) [9]. V současnosti existuje více než deset publikovaných a validovaných systémů ke skórování tíže polyneuropatie [10].
Většina skríningových metod a testů, stejně jako škál, užívaných k detekci a skórování tíže jak obecně polyneuropatie, tak specificky diabetické distální symetrické senzomotorické polyneuropatie, favorizuje postižení silných nervových vláken.
V naší literatuře se používá pětistupňová klasifikace podle Vondrové, která je rovněž výlučně založena na EMG nálezu a klinických příznacích postižení silných vláken (tj. reflexologickém nálezu, poruše vibrační citlivosti, propriocepce a přítomnosti paréz) [11,12].
Nověji byl zaveden The Utah Early Neuropathy Scale (UENS), který reflektuje nové poznatky o významném a častém postižení tenkých nervových vláken zejména v časné fázi diabetické polyneuropatie. Klade důraz především na poruchu algické percepce na dolních končetinách. Tento test má vyšší senzitivitu a lépe koreluje s nálezy laboratorních metod než MDNS [13].
Neuropatická bolest představuje spolu s dalšími senzitivními symptomy častý iniciální příznak diabetické polyneuropatie. Existuje několik validovaných skríningových testů, které jsou schopny diskriminovat neuropatickou a nociceptivní bolest [14]. Mezi nejčastěji používané a přitom jednoduché patří tzv. DN4 [15].
Cíl
Ověřit validitu a prediktivní hodnotu vybraných skríningových testů – MNSI a UENS u prediabetické a časné diabetické polyneuropatie.
Ověřit validitu a prediktivní hodnotu DN4 v detekci periferní diabetické neuropatické bolesti.
Soubor
V období leden 2009–prosinec 2010 byli na Neurologické klinice LF MU a FN Brno skríningově vyšetřeni pacienti s diabetem mellitem 2. typu (DM2), IGT nebo abnormální glukózou na lačno (Impaired Fasting Glucose, IFG), u kterých byla diagnóza stanovena na základě kritérií Světové zdravotnické organizace [16] a doporučení české diabetologické společnosti [17], a to bez ohledu na přítomnost neuropatických příznaků. Do studie byly zařazeny případy, které splňovaly následující vstupní kritéria:
- trvání DM2 < 3 roky (tj. doba od stanovení diagnózy nebo objevení prvních příznaků s možným vztahem k diabetu), nebo trvání IFG anebo IGT < 1 rok.
- vyloučení nemocí či stavů známých jako běžná možná alternativní příčina neuropatie (viz Metodika).
Zařazeno bylo:
- a) 48 pacientů s DM2 (30 mužů, 18 žen); věk: medián 59 let, 5.–95. kvantil: 32–71 let; trvání diabetu mellitu: medián 9 měsíců, rozmezí 1–36 měsíců – skupina časného DM2 (eDM2);
- b) 17 pacientů s buďto IFG, nebo IGT (10 mužů, 7 žen); věk: medián 62 let, 5.–95. kvantil: 35–74 let; trvání prediabetu: medián 1 měsíc, rozmezí 1–12 měsíců – skupina prediabetická (preDM);
- c) 40 zdravých dobrovolníků (23 mužů, 17 žen) bez diabetu či prediabetu; věk: medián 54,5 let, 5.–95. kvantil: 35–71 let – kontrolní skupina.
Metodika
Vyloučení alternativní příčiny neuropatie
Všichni předběžně vyšetření pacienti s DM2, prediabetem a kontrolní subjekty absolvovali před zařazením do studie následující vyšetření k vyloučení alternativní příčiny polyneuropatie:
- Detailní anamnézu zaměřenou na předchozí či současné onemocnění či léčbu, zejména: familiární výskyt neuropatie, přítomnost malignity, systémové vaskulitidy nebo zánětlivého onemocnění pojiva, hepatitidy C a dalších onemocnění jater, ledvin, krvetvorby, aplikaci neurotoxických léků.
- Kvantifikace konsumpce alkoholu a potvrzení škodlivého užívání alkoholu a možné alkoholové závislosti byla prováděna pomocí The Alcohol Use Disorders Identification Test (AUDIT) [18]. Jako limitní hodnota škodlivého užívání alkoholu byla použita hodnota ≥ 8 AUDIT skóre. Příjem alkoholu byl dále kvantifikován pomocí tzv. standardního nápoje (s.d.). Použili jsme limitní hodnotu 21/14 (muži/ženy) s.d./týden odpovídající 48/32 g alkoholu/den (tj. 3/2 čes-ké standardní nápoje) [2]. Pacienti a kontroly se škodlivým užíváním alkoholu přesahujícím limitní hodnoty buďto AUDIT skóre nebo počtu standardních nápojů nebyli zařazeni do studie.
- Abnormality následujících laboratorních testů sloužily jako vylučující kritéria: testy funkce ledvin (urea, kreatinin) a jater (bilirubin, transaminázy), antinukleární faktor, elektroforéza bílkovin v séru, hormony štítné žlázy, karbohydrát deficientní transferin, hladina vitaminu B12 a kyseliny listové v séru, významné změny krevního obrazu (včetně počtu krevních destiček a elevace středního objemu erytrocytu).
Všechny kontrolní subjekty měly normální hladinu glykemie v séru nalačno a perorální glukózový toleranční test.
Vyšetření prediabetických a diabetických pacientů
U všech nemocných jsme zjišťovali body mass index (BMI), přítomnost arteriální hypertenze a kouření.
Bolest byla klasifikována jako nociceptivní a neuropatická. Jako možná diabetická periferní neuropatická bolest (DPNP) byly klasifikovány případy s převažující distální a oboustrannou bolestí v oblasti nohou, která měla typický neuropatický charakter (tj. bolest charakteru pálení či bolestivého chladu), alespoň střední intenzitu (≥ 3 body na Lickertově numerické hodnotící škále, kde 0 reprezentuje „žádnou bolest“ a 10 „nejhorší možnou bolest“) a chronické trvání (tzn. > 6 měsíců). Tyto případy korespondovaly s kritérii možné neuropatické bolesti podle systému odstupňování diagnostické spolehlivosti přítomnosti neuropatické bolesti [19].
Klinické neurologické vyšetření zahrnovalo zhodnocení výbavnosti šlachových a okosticových reflexů, svalové síly, zhodnocení troficity svalů, kůže a kožních adnex, a vyšetření citlivosti.
Propriocepce charakteru polohocitu a pohybocitu byla vyšetřena v oblasti palců nohou.
Taktilní citlivost a přítomnost taktilní alodynie byly vyšetřovány smotkem vaty na špejli.
Kožní tlaková citlivost byla vyšetřována pomocí Semmes-Weinsteinova 10gramového monofilamenta a citlivost pro bolest kalibrovanou sterilní pomůckou NeurotipTM, spolu s monofilamentem kombinovanou v tzv. Neuropenu (Owen-Mumford Ltd, Oxford, UK). Vyšetření 10gramovým monofilamentem bylo prováděno na dorzu palce mezi nehtem a distálním interfalangeálním kloubem. Náhodně bylo aplikováno pět skutečných a pět falešných stimulů a za normální bylo považováno ≥ 8 správných odpovědí z 10 aplikovaných. Pomocí Neurotipu byla podobně vyšetřována citlivost pro bolest, kdy na plantární ploše palce nohy byly aplikovány náhodně ostré a tupé podněty a pacient je měl rozpoznávat [20].
Vibrace pomocí graduované ladičky 128 Hz byla vyšetřována na mediálním kotníku a dorzu palce nohy bilaterálně a k hodnocení byly použity publikované normy adjustované pro věk [21].
K hodnocení termické citlivosti byla použita pomůcka Tip-therm® (GmbH, Brüggen, Germany). Vyšetřující střídavě náhodně přikládal oba konce na špičku palce nohy a vyšetřovaný měl za úkol rozlišit chladný a teplý (méně chladný) podnět. Za normální odpověď bylo považováno ≥ 8 správných odpovědí [22].
Hodnocení prahu termické percepce (TPT) bylo prováděno pomocí systému Neurosensory analyser – modelu TSA-II (Medoc TSA 2001; Medoc, Ramat Yishai, Israel). Termické prahy byly vyšetřovány na dorzu pravé nohy za použití metody Limitů (randomizovaná a nerandomizovaná varianta) a metody Úrovní, a to jak pro teplo, tak pro chlad [23,24]. K hodnocení byly použity naše vlastní normativní hodnoty [25].
Hodnocení prahu vibrační percepce (Vibration Perception Threshold, VPT) bylo prováděno pomocí systému Vibratory sensory analyser – model VSA-3000 (Medoc, Ramat Yishai, Israel). Vibrační prahy byly vyšetřovány na plantární ploše hlavičky II.–III. metatarzu pravé nohy za použití metody Limitů a Úrovní. K hodnocení byly použity naše vlastní normativní hodnoty [25].
Spektrální analýza variability srdeční frekvence (SAVSF) byla vyšetřena pomocí systému VarCor PF 7 (Dimea group, Olomouc, ČR). Nejméně 300 R-R intervalů bylo analyzováno ve třech následných pozicích leh-stoj-leh a k hodnocení byla použita naše vlastní normativní data [26].
Elektromyografie (EMG) a kondukční studie (NCS) byly vyšetřeny na elektromyografu Keypoint II (Dantec, Skovlunde, Denmark) a výsledky byly hodnoceny pomocí vlastních normativních dat [27].
Hodnocení intraepidermální hustoty tenkých nervových vláken (IENFD) bylo provedeno ve vzorcích kožních biopsií z distálního bérce a u části pacientů také z proximálního stehna. Detaily použité metodiky byly publikovány [24,28,29] a jsou v souladu s recentními doporučeními [30]. K analýze byla použita vlastní normativní data [25].
Klinicky podporovaná neuropatie silných vláken (Large-Fiber Neuropathy, LFN klinická) byla definována jako areflexie patelárního reflexu a/nebo reflexu Achillovy šlachy oboustranně a abnormalita nejméně jedné ze senzitivních modalit, tj. propriocepce, taktilní, tlakové nebo vibrační citlivosti, a to oboustranně.
Laboratorně podporovaná neuropatie silných vláken byla definována jako abnormalita EMG/NCS podporující polyneuropatii a současně abnormalita VPT.
Klinicky podporovaná neuropatie tenkých vláken (SFN klinická) byla definována jako abnormalita jak termické citlivosti, tak citlivosti pro bolest oboustranně.
Laboratorně podporovaná neuropatie tenkých vláken byla definována jako abnormální IENFD i TPT.
Pro polyneuropatii asociovanou s prediabetem/časným diabetem (Prediabetes/Early Diabetes Associated Polyneuropathy, PEDAP) jsme stanovili dvě alternativní kritéria:
- PEDAP 1 + 1: nejméně jeden objektivní klinický příznak a jednu laboratorní abnormalitu jako známky postižení tenkých nebo silných vláken;
- PEDAP 2 + 2: nejméně dva objektivní klinické příznaky a dvě laboratorní abnormality jako známky postižení tenkých nebo silných vláken.
Senzitivní neuropatie tenkých vláken byla definována na základě kritérií dle Stewarta et al [31] a Lacomise [32] včetně vylučujících známek postižení silných nervových vláken (tj. porucha propriocepce na palci, porucha vibrace na kotnících a proximálněji, distální svalová slabost a atrofie, generalizovaná areflexie, abnormální nález na rutinním EMG/NCS).
DN4
Česká verze skríningového testu DN4 (příloha 1), který byl validován k diskriminaci neuropatické a non-neuropatické bolesti [15], byla přeložena do českého jazyka s použitím metody „forward-backward translation“. Obsahuje dvě varianty skóre: kratší, dotazníkovou část (DN4 I) založenou na zjištění přítomnosti typických deskriptorů neuropatické bolesti a výskytu doprovodných pozitivních senzitivních symptomů (doporučené cut-off ≥ 3 body ze 7 možných), a širší verzi skóre (DN4 II), v níž je část DN4 I doplněna třemi jednoduchými klinickými testy kožní citlivosti (doporučené cut-off ≥ 4 body z 10 možných).
MNSI
Česká verze skríningového testu, který byl validován k detekci diabetické polyneuropatie [8,33], byla přeložena do českého jazyka s použitím metody „forward-backward translation“. Test je složen z úvodní sebehodnotící dotazníkové části (MNSI I) a následné klinické části (MNSI II). MNSI I vyplňuje pacient-diabetik a obsahuje 15 položek, z toho 13 je skórováno a doporučované cut-off skóre je > 7 bodů (příloha 2a). Klinická část je složena z jednoduchého klinického vyšetření hodnotícího vzhled a troficitu kůže, výbavnost reflexu Achillovy šlachy, vibrační a tlakovou citlivost (pomocí ladičky a 10gramového monofilamenta) (příloha 2b). K hodnocení byla použita dvě alternativní cut-off skóre: ≥ 2 body a ≥ 3 body [34].
Příloha 2b. Klinická část – MNSI II. 
UENS
Utažská škála pro detekci neuropatie byla přeložena do českého jazyka s použitím metody „forward-backward translation“. Je založena na jednoduchém klinickém vyšetření obsahujícím hodnocení síly extenze, vibrace a polohocitu palců u nohou, přítomnosti alodynie nebo hyperestezie na noze, výbavnosti reflexu Achillovy šlachy a zejména vyšetření algické citlivosti na dolní končetině, na které je kladen největší důraz. Dolní končetina je pro účel tohoto vyšetření rozdělena topicky do šesti segmentů počínaje prsty a konče distální částí stehna, algická percepce je hodnocena 0–2 body v každém z těchto 12 segmentů a tvoří tak 24 ze 42 možných bodů (příloha 3). Jako cut--off skóre byla použita hodnota > 6 bodů, odvozená z výsledků souboru jedinců bez neuropatie v práci prezentující UENS [13].
Příloha 3. The Utah Early Neuropathy Scale. 
Statistická analýza
K popisu charakteristik souboru jsme použili frekvenční analýzu, dále odhad mediánu, 5. a 95. percentilů. Pro statistické hodnocení rozdílů mezi skupinami jsme použili Fisherův exaktní test. Plánovaný vzorek je zcela dostatečný pro provedení takových srovnání s rozlišovací schopností + 5 %, při plně akceptovatelné úrovni chyby I. druhu < 5 % a chyby II. druhu < 20 %. Byla provedena analýza ROC křivek (Receiver-Operating characteristics Curve) s cílem zhodnotit schopnost jednotlivých testů, skóre a škál diskriminovat pacienty s prediabetem a časným diabetem 2. typu s přítomností a bez přítomnosti neuropatické bolesti (DN4) a s přítomností neuropatie a bez ní (MNSI a UENS). Dále byly kalkulovány tzv. konstruktová validita testů (kdy konstruktem byla přítomnost neuropatie na základě předem definovaných kritérií) se stanovením senzitivity a specificity, a dále pozitivní a negativní prediktivní hodnoty standardním způsobem. Validita a prediktivní hodnota byly kalkulovány jednak za použití cut-off hodnot doporučovaných tvůrci testu nebo autory validačních studií, jednak byly kalkulovány optimální cut-off hodnoty pro daný soubor nemocných na základě ROC analýz. Standardní hodnota α < 0,05 byla použita jako hranice statistické významnosti.
Výsledky
Demografické a klinické charakteristiky souborů
Nebyly zjištěny rozdíly ve věku a zastoupení pohlaví mezi studovanými skupinami. Kontrolní skupina měla signifikantně nižší body mass index (BMI) a nižší podíl jedinců s arteriální hypertenzí ve srovnání se sdílenou skupinou preDM/eDM2, zatímco podíl nemocných s abnormálním AUDIT skóre, počtem standardních drinků a kuřáků se nelišil.
Byl přítomen trend k vyšší frekvenci jak klinických příznaků, tak laboratorních abnormalit svědčících pro neuropatii u eDM2 pacientů ve srovnání s pacienty s prediabetem s výjimkou IENFD hodnot z distálního lýtka, které byly statisticky významně častěji abnormální u eDM2 skupiny (p = 0,005). Absolutní hodnoty IENFD jak z proximálního stehna, tak z distálního lýtka byly však pouze nevýznamně nižší ve skupině eDM2 (p = 0,362 a 0,133).
Z těchto důvodů byla data z obou skupin nemocných s poruchou glukózového metabolizmu (preDM/eDM2) srovnávána souhrnně s kontrolní skupinou.
Neuropatická bolest typu DPNP a DN4
Možná neuropatická bolest typu DPNP byla přítomna u 12 eDM2 (25,6 %) a 3 preDM (17,6 %) pacientů, dohromady tedy u 15 (23,1 %) preDM/eDM2 případů (DPNP+ podskupina). Zbývajících 50 nemocných tvořilo podskupinu DPNP–. V kontrolní skupině jsme přítomnost neuropatické bolesti charakteru DPNP nezaznamenali (tab. 1).
Table 1. Podíl abnormálních nálezů jednotlivých testů v hodnocených skupinách. 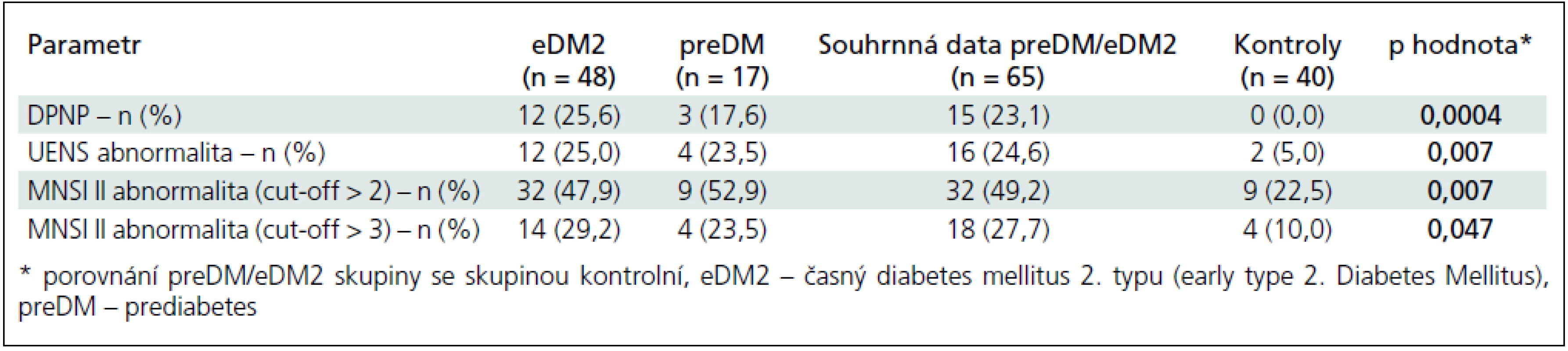
U všech 15 nemocných, klasifikovaných při zařazení do studie jako možná DPNP, byla splněna PEDAP 1 + 1 kritéria a u 8 z nich PEDAP 2 + 2 kritéria, což potvrdilo neuropatický charakter bolesti.
Abnormální skóre DN4 I bylo zjištěno u 8 z 15 (53,3 %) nemocných ze skupiny DPNP+ a u 5 z 50 DPNP – případů (10,0 %). Abnormální skóre DN4 II bylo přítomno u 6 z 15 nemocných ze skupiny DPNP+ (40,0 %) a u 2 z 50 nemocných ze skupiny DPNP – (4,0 %). Validita a prediktivní hodnota abnormálního skóre DN4 I, II a DN4 I a/nebo II jsou uvedeny v tab. 2.
Table 2. Validita a prediktivní síla vybraných skríningových testů. 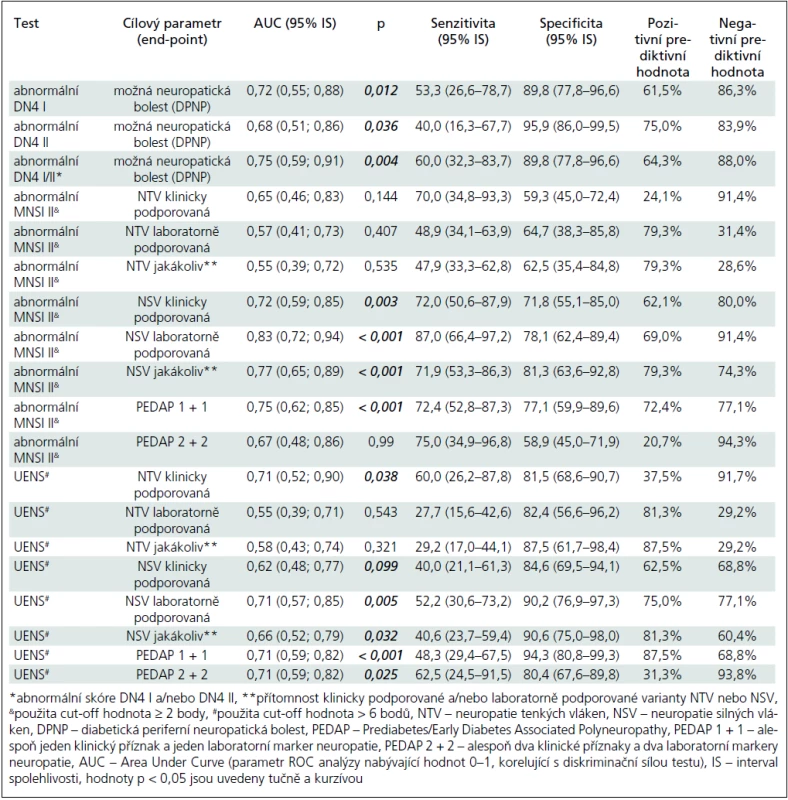
Optimální hodnotou cut-off pro DN4 I a II však byla hodnota ≥ 1, které ve srovnání s cutt-off hodnotami, doporučovanými tvůrci testu vedly k vyšší diskriminační schopnosti testu (viz hodnota plochy pod křivkou – AUC – Area Under Curve), vyšší senzitivitě, avšak na úkor specificity (tab. 3).
Table 3. Identifikace optimálních cut-offs diagnostických testů. 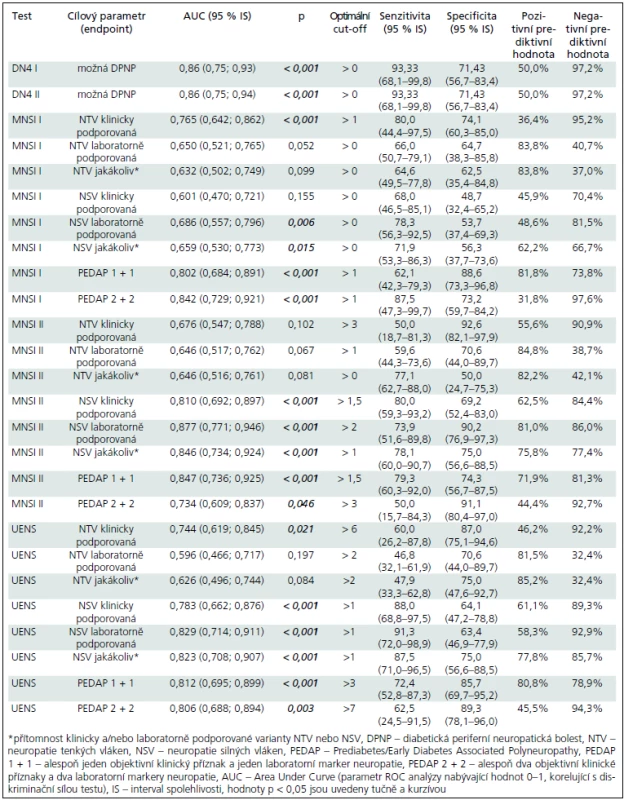
MNSI
MNSI I
Při použití doporučované hodnoty abnormálního skóre > 7 bodů jsme nezaznamenali abnormitu u žádného nemocného ze skupiny preDM/eDM2 ani u kontrolního subjektu a validitu ani prediktivní hodnotu jsme pro tento cut-off nehodnotili. Optimální hodnota limitní hodnoty (cut-off) se pohybovala mezi > 1 a > 0 body (tab. 3) a při jejím použití (> 1 bod) bylo možné diskriminovat klinicky podporovanou SFN.
MNSI II
Abnormální skóre MNSI II při použití dvou alternativních cut-off skóre ≥ 2 a ≥ 3 body bylo statisticky významně častější ve skupině preDM/eDM2 ve srovnání s kontrolní skupinou (tab. 1). Pro hodnocení validity a prediktivní hodnoty testu jsme použili cut-off ≥ 2 body. Test byl schopen diskriminovat pacienty s LFN (klinicky i laboratorně podporovanou) a bez LFN s relativně dobrou senzitivitou (72,0 a 87,0 %) a specificitou (71,8 a 78,1 %) (tab. 2), nikoliv však pacienty se SFN a bez ní.
Optimální cut-off hodnoty pro různé konstrukty se pohybovaly mezi > 0 až > 3 body, avšak i při použití optimální limitní hodnoty nebyl tento test schopen diferencovat nemocné se SFN a bez ní (tab. 3).
UENS
Abnormální skóre UENS bylo statisticky významně častější ve skupině preDM/eDM2 ve srovnání s kontrolní skupinou (tab. 1).
Optimální cut-off hodnoty se pohybovaly mezi > 1 až > 7 body, tento test byl schopen dobře diskriminovat LFN a klinicky podporovanou SFN, nikoliv však laboratorně podporovanou SFN (tab. 2 a 3).
Detailní výsledky jednotlivých použitých testů a jejich analýza se zaměřením na prevalenci a anatomický profil neuropatie asociované s prediabetem a časným diabetem mellitem 2. typu budou publikovány v samostatné práci [35].
Diskuze
V naší malé, avšak dobře definované skupině nemocných s prediabetem a časným diabetem mellitem 2. typu jsme prokázali, že skríningový test DN4 je schopen u nemocných s prediabetem nebo časným diabetem mellitem 2. typu diskriminovat jedince s DPNP, avšak při použití cut--off hodnot doporučovaných autory testu nemá test charakter skríningového, ale spíše konfirmačního testu (s vysokou specificitou, avšak nízkou senzitivitou). Dva často používané skríningové testy pro detekci polyneuropatie – MNSI II a UENS – se ukázaly validní zejména pro průkaz postižení silných vláken, méně pro průkaz klinicky manifestní léze tenkých senzitivních vláken (UENS a MNSI I). Žádný z těchto testů nebyl schopen detekovat laboratorně podporovanou neuropatii tenkých vláken, což je nejčastější iniciální typ neuropatie u nemocných s prediabetem a časným diabetem mellitem 2. typu.
Neuropatie asociovaná s IGT pravděpodobně reprezentuje nejčasnější stadium diabetické neuropatie [6]. V naší podskupině nemocných s prediabetem jsme nebyli schopni prokázat signifikantně vyšší podíl neuropatických abnormalit oproti kontrolní skupině s výjimkou abnormální IENFD z distálního lýtka, což bylo zřejmě podmíněno malým rozsahem souboru. Současně to však potvrzuje obecně akceptovaný fakt, že postižení senzitivních tenkých vláken je iniciální typ postižení u neuropatie asociované s prediabetem [36], podobně jako u časné diabetické polyneuropatie [6,7]. Odpovídá tomu i naše analýza anatomického profilu polyneuropatie asociované s prediabetem a časným DM2 [35] a v souladu s tím je i relativně vysoká prevalence DPNP v našem souboru (23,1 %). U diabetu je udávaná prevalence DPNP relativně nižší: 10–20 % [37] s ohledem na využití diagnostických metod, zohledňujících především postižení silných nervových vláken.
DN4 je jedním ze skríningových validovaných testů pro identifikaci neuropatické bolesti. Při diskriminaci jisté neuropatické bolesti oproti pacientům s nociceptivní bolestí byla prokázána jak u 7bodové (DN4 I), tak 10bodové škály (DN4 II) vysoká senzitivita (78,0 a 82,9 %) i specificita (81,2 a 89,9 %) [15]. V našem souboru nemocných s preDM a eDM2 byla senzitivita DN4 v detekci jedinců s možnou neuropatickou bolestí podstatně nižší (53,3 % u DN4 I, 40 % u DN4 II a 60 % při použití kombinovaného kritéria DN4 I a/nebo II s doporučovanými cut-off hodnotami). Specificita byla naproti tomu srovnatelná s validační studií [15], u DN4 II dosáhla 95,9 %! Relativně nižší validitu DN4 II lze vysvětlit faktem, že jednoduché klinické vyšetření rozšiřující DN4 I je zaměřeno převážně na detekci postižení silných vláken (které nebylo u většiny našich nemocných s DPNP přítomno) a taktilní alodynie (která se vyskytla pouze u jednoho pacienta). Pacienti s diabetem mellitem či prediabetem mohou kromě DPNP trpět řadou dalších bolestí v oblasti dolních končetin nociceptivního charakteru, a tento test lze tedy použít k rychlé klinické konfirmaci neuropatického charakteru bolesti, zatímco normální výsledek testu ještě možnost DPNP nevylučuje. Pokud by však měl tento test plnit funkci skríningového nástroje zejména s vysokou senzitivitou, je nutno použít nižší limitní hodnotu skóre – v našem souboru měla největší diskriminační schopnost (vyjádřenou hodnotou AUC během ROC analýzy) cut-off hodnota ≥ 1 bod u DN4 I i II. To však v praxi znamená, že pokud má bolest u pacienta s prediabetem nebo časným diabetem jednu z typických charakteristik neuropatické bolesti, např. pálivou bolest, je test pozitivní. Takto nastavený test však má limitovanou hodnotu pro erudovaného neurologa seznámeného s obrazem neuropatické bolesti, a může být přínosný spíše pro jiné specialisty, např. diabetology.
Dotazníková část MNSI I obsahuje některé otázky, které reflektují přítomnost pozitivních senzitivních symptomů, jež typicky doprovázejí neuropatii tenkých vláken. Při použití doporučené hodnoty cut-off skóre > 7 bodů však byl test u všech preDM/eDM2 pacientů i kontrol normální, a test tedy při použití navržené normy není schopen zachytit nemocné s incipientní neuropatií. Pro potřeby MNSI I jako skríningového testu k zachycení neuropatie tenkých vláken by bylo třeba podobně jako u DN4 snížit hodnotu cut-off na > 0–> 1, se stejnými závěry pro praktické použití jako u DN4.
Klinická část MNSI II je založena na testování těch kvalit citlivosti nebo příznaků, které jsou podmíněny postižením silných vláken – např. tlaková a vibrační citlivost, reflex Achillovy šlachy. Výsledky tedy zcela dle očekávání potvrdily, že MNSI II je validní test pro diskriminaci nemocných s neuropatií silných vláken a bez ní, a byl schopen diferencovat nemocné s prediabetem a časným DM2 oproti kontrolní skupině. Jako optimální hodnotu cut-off skóre jsme potvrdili hodnotu ≥ 2 body [34].
UENS byl navržen s úmyslem zachytit více postižení tenkých senzitivních vláken, které je častější u prediabetické i časné diabetické neuropatie. Více než polovinu celkového skóre (24 ze 42 bodů) tvoří algická citlivost. UENS tak byl schopen diskriminovat i predikovat rozvoj klinicky manifestní SFN, avšak skóre nekorelovalo s přítomností preklinické SFN, která je nejčastější formou neuropatie u prediabetu a časného DM2.
Limitace naší studie spočívala v relativně malém vzorku nemocných. Výhodou byla dobrá definice souborů, ze kterých byli vyloučeni jedinci s jinou možnou příčinou polyneuropatie, což je nedostatek většiny dosavadních studií [38]. Další předností je kontrolní soubor adjustovaný věkem k souboru nemocných s poruchou glukózového metabolizmu a dále vlastní normativní data pro kvantitativní metody, stratifikovaná vzhledem k věku [25,29].
Závěry
DN4 prokázal při diskriminaci jedinců s DPNP při použití doporučované cut-off hodnoty skóre spíše charakter konfirmačního než skríningového testu s vysokou specificitou a nižší senzitivitou.
MNSI I není vhodný nástroj pro skríning neuropatie u pacientů s prediabetem a časným diabetem 2. typu.
MNSI II a UENS u nemocných s preDM/eDM2 spolehlivě diskriminovaly jedince s LFN a bez ní, zatímco pouze UENS byl schopen diskriminovat nemocné s klinicky podporovanou SFN. Žádný z testů neprokázal dostatečnou validitu v detekci preklinické SFN, což je nejčastější iniciální typ neuropatie u nemocných s preDM/eDM2.
Použité zkratky
- MNSI I – The Michigan Neuropathy Screening Instrument, část I (II)
- (II)
- UENS – The Utah Early Neuropathy Scale
- preDM – prediabetes
- eDM2 – časný diabetes mellitus 2. typu (early DM2)
- LFN – neuropatie silných vláken
- SFN – neuropatie tenkých vláken
- DPNP – diabetická periferní neuropatická bo-lest (Diabetic Peripheral Neuropathic Pain)
- IGT – porucha glukózové tolerance (Impaired Glucose Tolerance)
- IENFD – intraepidermální hustota nervových vláken (IntraEpidermal Nerve Fiber Density)
- TPT – termický práh (Thermal Perception Threshold)
- MDNS – The Michigan Diabetic Neuropathy Score
- TNS – The Total Neuropathy Score
- IFG – Impaired Fasting Glucose
- AUDIT – The Alcohol Use Disorders Identification Test
- s.d. – standardní nápoj (standard drink)
- BMI – Body Mass Index
- VPT – vibrační práh (Vibration Perception Threshold)
- SAVSF – spektrální analýza variability srdeční frekvence
- EMG – elektromyografie
- NCS – kondukční studie periferních nervů (Nerve Conduction Studies)
- PEDAP – polyneuropatie asociovaná s prediabetem/časným diabetem (Prediabetes/Early Diabetes Associated Polyneuropathy)
- ROC – Receiver-Operating characteristics Curve
- AUC – plocha pod křivkou (Area Under Curve)
Vytvořeno s podporou grantového projektu IGA MZČR č. NS 9667-4 bolestivá diabetická neuropatie, projekt specifického výzkumu MUNI/A/0765/2011 a projektu „CEITEC – Středoevropský technologický institut“ (CZ.1.05/1.1.00/02.0068) z Evropského fondu regionálního rozvoje.
MUDr. Šárka Buršová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: bursova@email.cz
Přijato k recenzi: 24. 1. 2012
Přijato do tisku: 16. 2. 2012
Sources
1. Singleton JR, Smith AG. Neuropathy associated with prediabetes: what is new in 2007? Curr Diab Rep 2007; 7(6): 420–424.
2. Bednarik J, Vlckova-Moravcova E, Bursova S, Belobradkova E, Dusek L, Sommer C. Etiology of small--fiber neuropathy. J Peripher Nerv Syst 2009; 14(3): 177–183.
3. Tapp RJ, Shaw JE, de Courten MP, Dunstan DW, Welborn TA, Zimmet PZ. AusDiab Study Group. Foot complications in Type 2 diabetes: an Australian population-based study. Diabet Med 2003; 20(2): 105–113.
4. Dyck PJ, Dyck PJ, Klein CJ, Weigand SD. Does impaired glucose metabolism cause polyneuropathy? Review of previous studies and design of a prospective controlled population-based study. Muscle Nerve 2007; 36(4): 536–541.
5. Vlckova-Moravcova E, Bednarik J, Belobradkova J, Sommer C. Small-fibre involvement in diabetic patients with neuropathic foot pain. Diabet Med 2008; 25(6): 692–699.
6. Smith AG, Ramachandran P, Tripp S, Singleton JR. Epidermal nerve innervation in impaired glucose tolerance and diabetes-associated neuropathy. Neurology 2001; 57(9): 1701–1704.
7. Løseth S, Stålberg E, Jorde R, Mellgren SI. Early diabetic neuropathy: thermal thresholds and intraepidermal nerve fibre density in patients with normal nerve conduction studies. J Neurol 2008; 255(8): 1197–1202.
8. Feldman EL, Stevens MJ, Thomas PK, Brown MB, Canal N, Greene DA. A practical two-step quantitative clinical and electrophysiological assessment for the diagnosis and staging of diabetic neuropathy. Diabetes Care 1994; 17(11): 1281–1289.
9. Cornblath DR, Chaudhry V, Carter K, Lee D, Seysedadr M, Miernicki M et al. Total neuropathy score: validation and reliability study. Neurology 1999; 53(8): 1660–1664.
10. Cornblath DR. Diabethic neuropathy: diagnostic methods. Adv Stud Med 2004; 4(8A): S650–S661.
11. Vondrová H. Neurologické projevy diabetes mellitus. In: Vondrová H (ed). Neurologické projevy endokrinních onemocnění. Praha: Geum 2003 : 40–127.
12. Moravcová E, Bednařík J. Diabetická neuropatie. Neurol Prax 2006; 7(2): 31–35.
13. Singleton JR, Bixby B, Russell JW, Feldman EL, Peltier A, Goldstein J et al. The Utah Early Neuropathy Scale: a sensitive clinical scale for early sensory predominant neuropathy. J Peripher Nerv Syst 2008; 13(3): 218–227.
14. Bennett MI, Attal N, Backonja MM, Baron R, Bouhassira D, Freynhagen R et al. Using screening tools to identify neuropathic pain. Pain 2007; 127(3): 199–203.
15. Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 2005; 114(1–2): 29–36.
16. Definition, Diagnosis and Classification of Diabetes Mellitus and its Complications (document WHO/NCD/NDS/99.2). World Health Organisation 1999.
17. Laboratorní diagnostika a sledování stavu diabetu mellitu. Dostupné z: http://www.diab.cz/standardy.
18. Saunders JB, Aasland OG, Babor TF, de la Fuente JR, Grant M. Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption-II. Addiction 1993; 88(6): 791–804.
19. Treede RD, Jensen TS, Campbell JN, Cruccu G, Ostrovsky JO, Griffin JW et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology 2008; 70(18): 1630–1635.
20. Paisley AN, Abbott CA, van Schie CH, Boulton AJ. A comparison of the Neuropen against standard quantitative sensory-threshold measures for assessing peripheral nerve function. Diabet Med 2002; 19(5): 400–405.
21. Martina IS, van Koningsveld R, Schmitz PI, van der Meché FG, van Doorn PA. European Inflammatory Neuropathy Cause and Treatment (INCAT) group. Measuring vibration threshold with a graduated tuning fork in normal aging and in patients with polyneuropathy. J Neurol Neurosurg Psychiatry 1998; 65(5): 743–747.
22. Viswanathan V, Snehalatha C, Seena R, Ramachandran A. Early recognition of diabetic neuropathy: evaluation of a simple outpatient procedure using thermal perception. Postgrad Med J 2002; 78(923): 541–542.
23. Moravcova E, Bednarik J. Computer-assisted thermal threshold testing – normative data and sources of variability. Cesk Slov Neurol N 2003; 66/99(4): 263–269.
24. Vlckova-Moravcova E, Bednarik J, Dusek L, Toyka K, Sommer C. Diagnostic validity of epidermal nerve fiber densities in painful sensory neuropathies. Muscle Nerve 2008; 37(1): 50–60.
25. Buršová Š, Vlčková E, Hnojčíková M, Němec M, Bednařík J. Přístrojově asistované kvantitativní testování senzitivity – normativní data. Cesk Slov Neurol N 2012; 75/108(4): 444–453.
26. Vlčková E, Bednařík J, Buršová Š, Šajgalíková K, Mlčáková L. Spectral analysis of heart rate variability – normative data. Cesk Slov Neurol N 2010; 73/106(6): 663–672.
27. Kadanka Z, Bednarik J, Vohanka S. Practical Electromyography. 1st ed. Brno: IDPVZ 1994.
28. Moravcova E, Bednarik J, Feit J, Sommer C. The evaluation of intraepidermal nerve fiber density in skin biopsy of polyneuropathy patients. Cesk Slov Neurol N 2005; 68/101 : 219–226.
29. Buršová Š, Vlčková E, Hnojčíková M, Němec M, Dubový P, Bednařík J et al. Vyšetření hustoty intraepidermálních nervových vláken – normativní data. Cesk Slov Neurol N 2012; 75/108(4): 455–459.
30. Lauria G, Hsieh ST, Johansson O, Kennedy WR, Leger JM, Mellgren SI et al. European Federation of Neurological Societies. Peripheral Nerve Society. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on the use of skin biopsy in the diagnosis of small fiber neuropathy. Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society. Eur J Neurol 2010; 17(7): 903–912.
31. Stewart JD, Low PA, Fealey RD. Distal small-fiber neuropathy: results of tests of sweating and autonomic cardiovascular reflexes. Muscle Nerve 1992; 15(6): 661–665.
32. Lacomis D. Small-fiber neuropathy. Muscle Nerve 2002; 26(2): 173–188.
33. The Michigan Neuropathy Screening Instrument. Available from: http://www.med.umich.edu/mdrtc/profs/survey.html#mnsi.
34. Moghtaderi A, Bakhshipour A, Rashidi H. Validation of Michigan neuropathy screening instrument for diabetic peripheral neuropathy. Clin Neurol Neurosurg 2006; 108(5): 477–481.
35. Divisova S, Vlckova E, Hnojcikova M, Skorna M, Nemec M, Dubovy P et al. Prediabetes/early diabetes--associated polyneuropathy predominantly involves sensory small fibres. J Periph Nerv Syst. In print 2012.
36. Umapathi T, Tan WL, Loke SC, Soon PC, Tavintharan S, Chan YH. Intraepidermal nerve fiber density as a marker of early diabetic neuropathy. Muscle Nerve 2007; 35(5): 591–598.
37. Veves A, Backonja M, Malik RA. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options. Pain Med 2008; 9(6): 660–674.
38. Freeman R. Not all neuropathy in diabetes is of diabetic etiology: differential diagnosis of diabetic neuropathy. Curr Diab Rep 2009; 9(6): 423–431.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2012 Issue 5-
All articles in this issue
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



