-
Medical journals
- Career
Léčba spinálních paragangliomů – kazuistiky
Authors: L. Hrabálek 1; O. Kalita 1; M. Adamus 2; J. Macháč 1; M. Zlevorová 3; T. Wanek 1
Authors‘ workplace: LF UP a FN Olomouc Neurochirurgická klinika 1; LF UP a FN Olomouc Klinika anesteziologie a resuscitace 2; LF UP a FN Olomouc Onkologická klinika 3
Published in: Cesk Slov Neurol N 2012; 75/108(5): 626-629
Category: Case Report
Overview
Spinální paragangliomy jsou velmi vzácné nádory a vyskytují se intradurálně extramedulárně, většinou v oblasti filum terminale/caudy equiny, nebo méně často extradurálně. Autoři prezentují kazuistiky dvou mužů s tumory v oblasti bederní páteře. U prvního pacienta ve věku 28 let s typickou intradurální lokalizací L1–L2 byl tumor kompletně chirurgicky odstraněn. U druhého nemocného ve věku 68 let s atypickou extradurální a retroperitoneální lokalizací na obratli L4 byl pokročilý nádor částečně odstraněn z kombinovaného přístupu s náhradou obratlového těla. Následovala radioterapie. V obou případech nebyla prokázána lokální recidiva nebo metastázy a neurologický stav se zlepšil. Základem léčby paragangliomů je chirurgické odstranění, které je u pokročilých forem a vzhledem k výrazné vaskularizaci nádoru komplikované. Radioterapie je indikována při inkompletním odstranění nádoru nebo v případech recidivy paragangliomu. Chemoterapie nebo léčba izotopem 131I-metaiodobenzylguanidinu se využívá s menší efektivitou a převážně jen u maligních metastazujících forem nádoru.
Klíčová slova:
paragangliomy – bederní páteř – operace páteře – radioterapieÚvod
Neuroendokrinní tumory z chromafinních buněk mohou pocházet buď z dřeně nadledvin (feochromocytom), nebo mimodřeňově z paraganglií (paragangliom) připojených k autonomnímu nervovému systému [1,2]. Asi 90 % paragangliomů roste z glomus jugulare (jugulotympanické paragangliomy) nebo z glomus caroticum (chemodektomy), a nachází se tedy v oblasti hlavy a krku [3]. Spinální paragangliomy jsou velmi vzácné a vyskytují se intradurálně extramedulárně, většinou v oblasti filum terminale/caudy equiny, nebo méně často extradurálně [4].
Cílem této práce je prezentace dvou kazuistik spinálních paragangliomů a léčebné strategie těchto tumorů.
Kazuistika 1
Muž, ve věku 28 let, udával šest měsíců bolesti bederní páteře vystřelující do obou dolních končetin po zadních stranách stehen a lýtek. Obtíže měl trvalé, bez vztahu k námaze. Proto byla provedena magnetická rezonance (MR) lumbosakrální (LS) páteře s nálezem intradurálního a extramedulárního tumoru na úrovni L1–L2, na úrovni caudy equiny těsně pod conus medullaris, jenž byl z kaudální strany nádorem lehce komprimován. Tumor měl oválný tvar se zřetelným ohraničením a velikost 30 × 12 × 11 mm. V T2 a STIR zobrazení byl zčásti hyperintenzní a zčásti hypointenzní, v T1 izointenzní s míchou a postkontrastně se převážná část výrazně sytila (obr. 1 a 2).
Image 1. MR, T1 vážený obraz, sagitální rovina. Paragangliom intradurální na etáži L1–L2, hyperintenzní tumor po podání kontrastu. 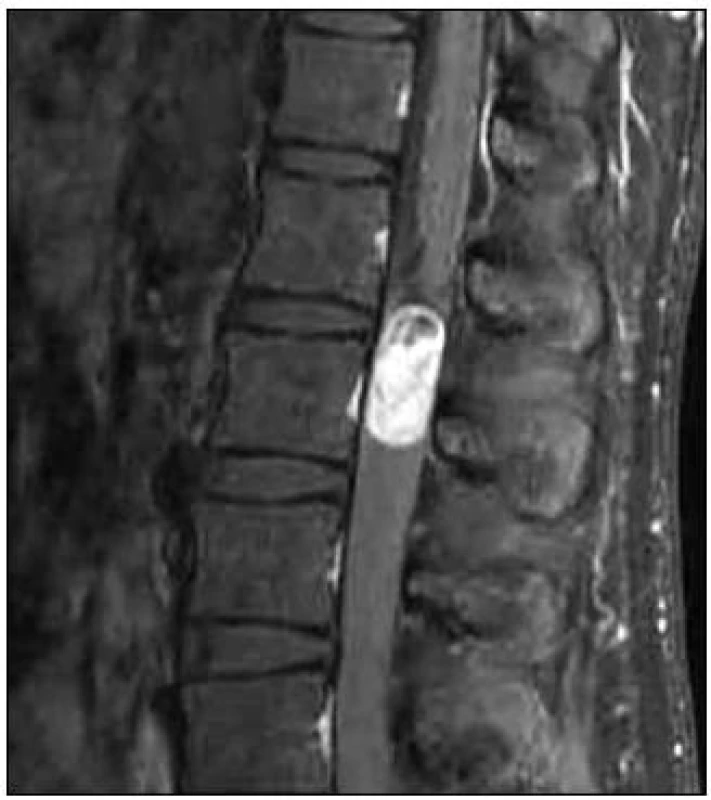
Image 2. MR, T1 vážený obraz, axiální rovina. Paragangliom intradurální na etáži L1–L2, hyperintenzní tumor po podání kontrastu. 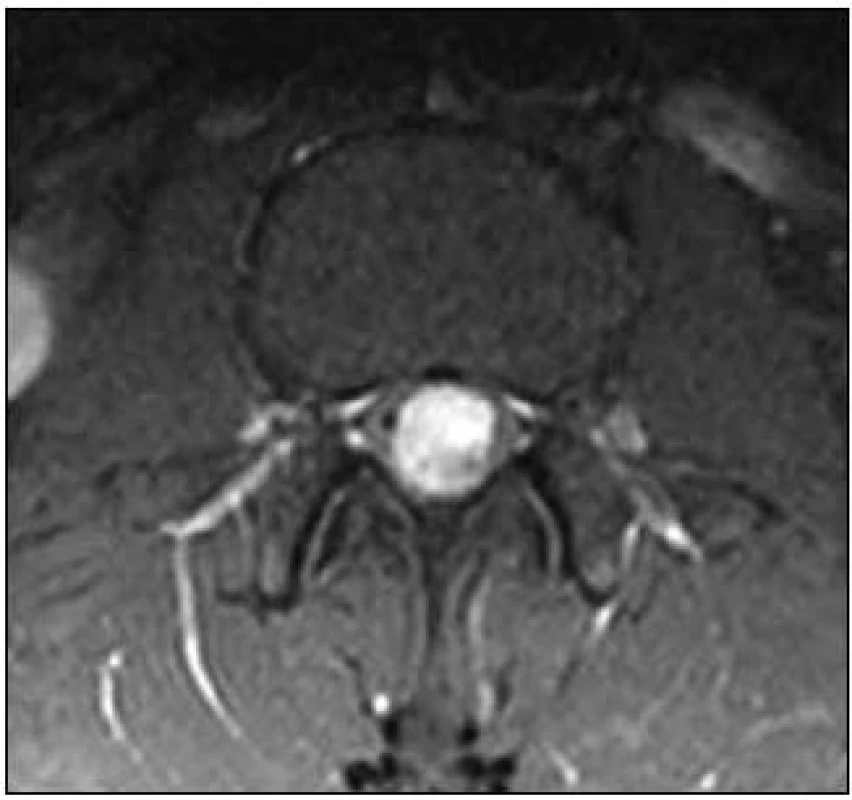
V lednu 2009 byl nemocný operován a z levostranné hemilaminektomie L1 a L2 kompletně (en bloc) exstirpován intradurální cévnatý tumor. Operační rána se zhojila bez komplikací a pacient udával okamžitou úlevu od předchozích bolestí páteře a dolních končetin, byl bez nového neurologického deficitu. Kontrolní MR LS páteře provedené opakovaně během 30 měsíců neprokázalo lokální recidivu.
Histologický a imunohistochemický nález
Hladká částice, histologicky vzhledu bohatě vaskularizovaného tumoru krytého vazivovým pouzdrem a tvořená mírně nepravidelnými, středně velkými oválnými až protáhlými buňkami s poměrně objemnou eozinofilní cytoplazmou a oválnými jádry s disperzní mitotickou aktivitou. Nádorové elementy solidně alveolárně utvářené, místy s náznaky pseudorozetovitých útvarů.
Imunohistochemicky exprimovaly neuroendokrinní markery (CD 56, NSE, synaptofyzin, ložiskový chromogranin), dále vimentin a pancytokeratiny AE1–3 cytoplazmaticky, zatímco GFAP, CD 99 a S 100 byly negativní. Prokázány byly ojedinělé S 100 protein pozitivní sustentakulární buňky.
Proliferační aktivita měřená indexem Ki 67 byla 10–15 %.
Histologický obraz a imunohistochemické vyšetření svědčí pro spinální paragangliom. Pro poněkud vyšší proliferační aktivitu jde o tumor nejisté biologické povahy.
Kazuistika 2
Muž, ve věku 68 let, si po dobu osmi let stěžoval na bolesti bederní páteře s iradiací do levé dolní končetiny v dermatomu L4. Pacient byl léčen konzervativně a nebyl odeslán k žádnému vyšetření. Až po progresi obtíží s motorickým oslabením levé dolní končetiny, nutností chůze o francouzské holi a nálezu hyporeflexie L2–L4 vlevo byla provedena MR LS páteře. MR odhalila tumor v levé třetině obratlového těla L4 postihující kompletně pedikl a zasahující extraspinálně vlevo do m. psoas a processus transversus L4 a malou porcí do páteřního kanálu extradurálně (obr. 3).
Image 3. MR, T2 vážený obraz, axiální rovina. Paragangliom extradurální a paravertebrální na etáži L4 vlevo, hypointenzní ložisko. 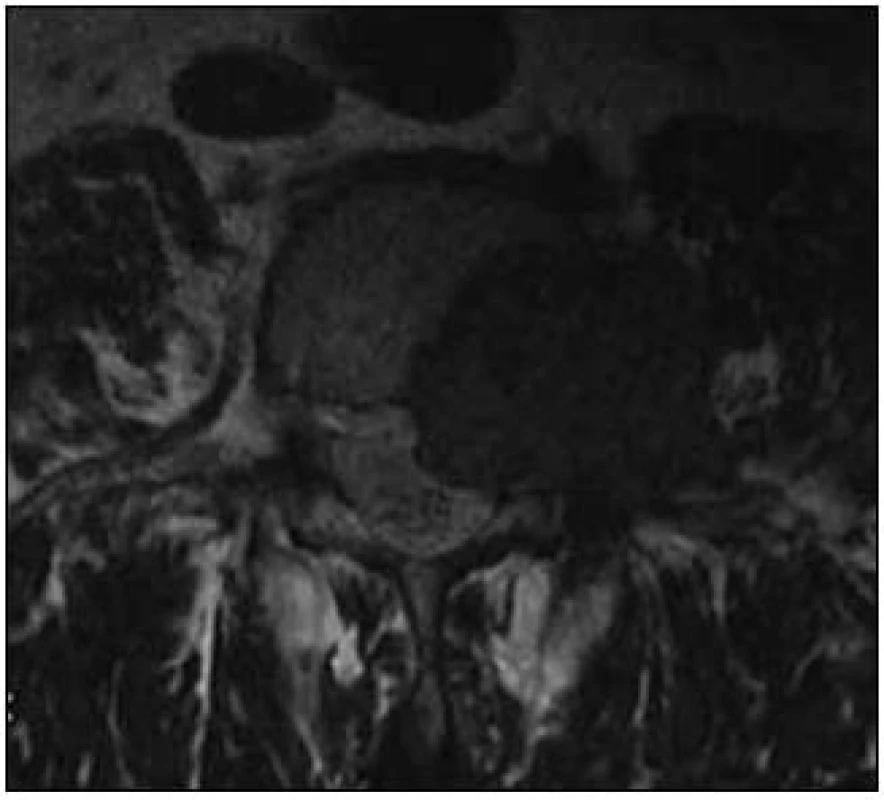
Byla indikována exstirpace tumoru z kombinovaného přístupu. V září 2010 po levostranné hemilaminektomii L4 byl shledán výrazně krvácivý tumor a byly uvolněny kořeny. Vzorek byl zaslán na histologické vyšetření, které prokázalo paragangliom. Pacient byl přeložen na rehabilitaci. Před plánovanou přední exstirpací tumoru se somatektomií L4, za čtyři měsíce od předchozí operace prokázalo kontrolní MR výraznou progresi nádoru na velikost 50 × 63 × 46 mm (obr. 4). Při zařazení do WBB klasifikace (Weinstein-Boriani-Biagini) byl rozsah 1–8 a A–D, dle Tomitovy klasifikace se jednalo o pokročilý Typ 6 [5,6]. Před touto operací byla zvažována intraarteriální embolizace tumoru, ale pro nebezpečí výskytu rozsáhlejších nekróz v okolí nakonec embolizace indikována nebyla. V únoru 2011 byl z levostranné lumbotomie z velké části exstirpován tumor s parciální somatektomií L4 (intralezionální extrakapsulární excize dle Borianiho) s následnou implantací titanového expandibilního implantátu Synex I (Synthes, USA). Operace byla provedena pod kontrolou peroperačního neurofyziologického monitoringu k identifikaci kořenů L4 a L5. Truncus sympaticus zůstal zachován. Krevní ztráty byly významné, a proto byla zadní perkutánní transpedikulární fixace šrouby (Spirit, Synthes, USA) L3–L5 doplněna po stabilizaci stavu za další tři dny (obr. 5 a 6). Operační rány se zhojily bez komplikací.
Image 4. MR, T1 vážený obraz, koronální rovina. Paragangliom extradurální a paravertebrální na etáži L3–L5 vlevo, hyperintenzní tumor po podání kontrastu. 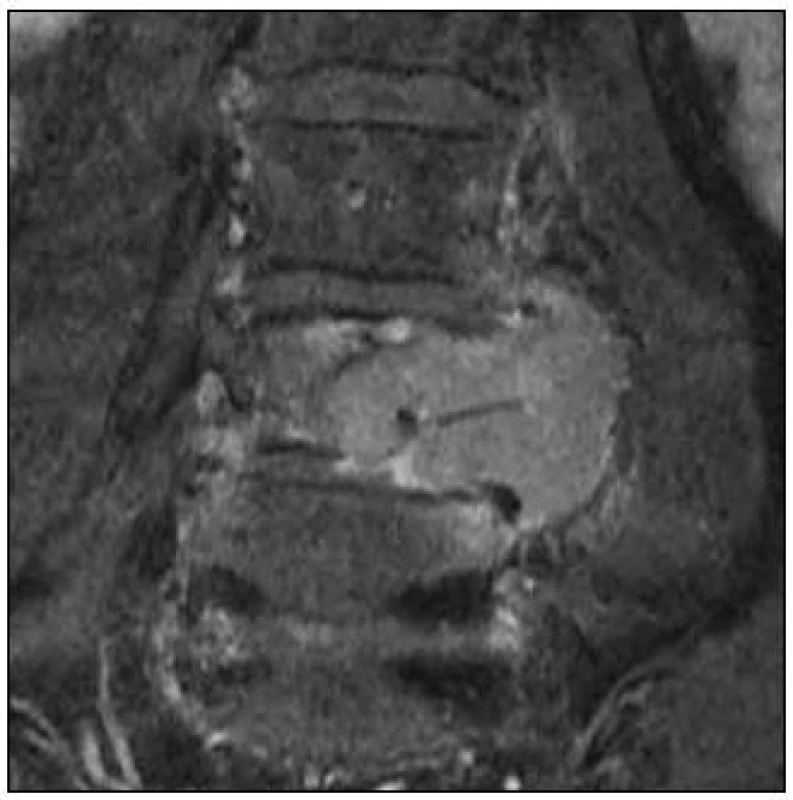
Image 5. Skiagram LS páteře předozadní. Náhrada obratlového těla L4 expandibilním implantátem s transpedikulární fixací L3–L5. 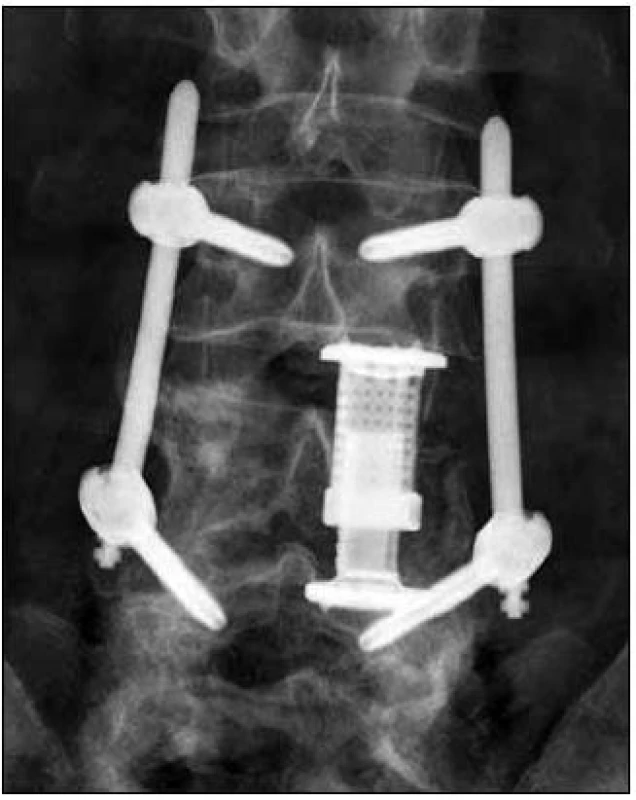
Image 6. Skiagram LS páteře bočný. Náhrada obratlového těla L4 expandibilním implantátem s transpedikulární fixací L3–L5. 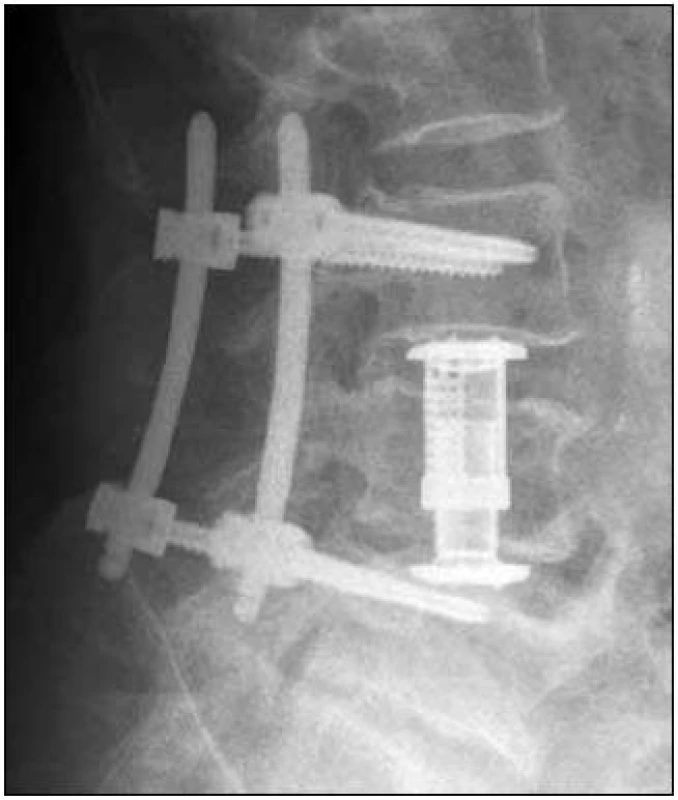
Následovala radioterapie, pacient byl ozařován normofrakcionovaně na oblast lůžka tumoru v oblasti L3–L5, na lineárním urychlovači. Byla použita dávka na frakci 2 Gy, celkem 25 frakcí do celkové ložiskové dávky 50 Gy.
Po osmi měsících od poslední operace byl schopen chůze o jedné francouzské holi s hypestezií, dyzestezií a slabostí v dermatomu L4 vlevo, tedy neurologický stav ve srovnání s předoperačním stavem byl nezměněn. Celotělové PET/CT (pozitronová emisní tomografie/počítačová tomografie) zatím vyloučilo výskyt metastáz. Opakované kontrolní MR zobrazily stacionární částečné reziduum tumoru v m. psoas paravertebrálně vlevo na úrovni obratlových těl L4 a L5. Vzhledem ke stabilizaci nádorového růstu s výskytem mimo páteřní a nervové struktury další operace ani jiná léčba již indikovány nebyly.
Histologický a imunohistochemický nález
Trabekulárně a solidně alveolární buněčný tumor z buněk epiteloidního vzhledu. Imunofenotyp se zastižením buněk hlavních (NSE pozitivní, chromogranin negativní, synaptofyzin sporně pozitivní, AE 1/3 negativní) a jen ojediněle i sustentakulárních (S 100 pozitivní, GFAP negativní).
Tumor markery: p53 pod 25 % pozitivních nádorových buněk, p16 prakticky negativní, EGFR: silná/středně silná kompletní membránová pozitivita byla lokálně silně variabilní (s možností arteficiálního výpadku), v místech pozitivity však dosahovala až 100 %.
Proliferační aktivita Ki 67 byla po druhé operaci oproti předchozí vyšší (silná jaderná pozitivita až 30 %, předtím 12–20 %).
Histologický obraz a imunohistochemické vyšetření svědčí pro spinální paragangliom. Pro vyšší proliferační aktivitu jde o tumor nejisté biologické povahy.
Cytogenetické vyšetření metodou fluorescenční in situ hybridizace (FISH)
Nebyly nalezeny delece v chromozomálních oblastech 1p36.3, 9p21.3, 19q13 ani delece genů p53, EGFR, RB1 a nakonec ani aneuzomie chromozomů 7, 10 a 13. Byl nalezen pouze zvýšený počet kopií genu MDM2 u 28 % jader.
Sledované geny a oblasti chromozomů tedy nevykázaly větší cytogenetické změny.
Diskuze
Paragangliomy se obvykle manifestují ve druhé a třetí dekádě života a postihují přibližně stejně muže i ženy. Paragangliomy jsou afunkční nebo funkční tumory, neboť mohou produkovat noradrenalin a zřídka i dopamin (zatímco feochromocytomy produkují adrenalin a noradrenalin). Klinicky se tyto katecholamin produkující nádory občas projevují epizodickou hypertenzí, palpitací, bolestí hlavy, pocením a úbytkem na váze. Funkční jsou obvykle retroperitoneálně lokalizované paragangliomy (25–60 % z nich) [7–10]. Paragangliomy mohou být i hereditární a gen pro autozomálně dominantní dědičnost pak bývá na chromozomu 11q nebo chromozomu 1 (1p36–p35 nebo 1q23.3) [11].
Spinální paragangliomy se typicky vyskytují v oblasti filum terminale a/nebo cauda equina intradurálně. Například ze 77 případů paragangliomů kaudy referovaných Aghakhanim et al jich 74 bylo intradurálně a jen tři intra-extradurálně [12]. Předpokládá se, že tyto tumory zde vznikají z latentních paragangliových buněk, další autoři popírají existenci těchto buněk a příčinou podle nich je aberantní buněčná migrace, reziduální neuroblasty nebo ependymální buňky [4]. Intradurální výskyt v oblasti caudy equiny byl také případ naší první kazuistiky.
Extradurální lokalizace je dána buď primárním výskytem, nebo častěji metastázováním do páteře [4]. Primární páteřní paragangliomy vyrůstají ze sympatiku, přesněji ze sympatických neuronů v hrudní nebo bederní části laterálních rohů míšních spojených přes komunikující větvě s truncus sympaticus [3]. U naší druhé kazuistiky nebylo možné určit, zda primární lokalizací byl obratel L4 nebo struktury retroperitonea. Dle rozboru literatury (MEDLINE) je náš případ paragangliomu extradurální oblasti bederní páteře a retroperitonea v pořadí teprve sedmým takovým sdělením [7,9,10,13–15].
Paragangliomy bývají obvykle benigní, typicky to platí pro oblast filum terminale a/nebo cauda equina [3,16]. Jen asi 6,5 % paragangliomů je maligní povahy. Přitom malignita není v tomto případě podmíněna histologickým nálezem (mitotická aktivita je i v benigních paragangliomech běžná), ale invazivitou a/nebo metastázováním, které se děje u intradurálních tumorů opět intradurálně, u extradurálních do plic, jater, lymfatických uzlin, kůže, prostaty a kostí [2,3].
Individuální chování jednotlivých paragangliomů se nedá spolehlivě předpovědět. Pro prognózu onemocnění je nejdůležitější lokalizace tumoru. Z oblasti hlavy a krku metastazuje jen asi 5 % paragangliomů [17–19]. Naopak pravděpodobnost metastazování, a tedy maligního chování retroperitoneálních mimodřeňových paragangliomů, je až 50 % [2,8,20–23]. Pro extrémně vzácný výskyt v této lokalizaci bylo přesto publikováno jen několik případů metastáz do páteře [2,22,23]. Protože byl referován průkaz metastáz až v odstupu 19 let, je nezbytná dlouholetá dispenzarizace všech nemocných.
V diagnostice paragangliomů je metodou volby MR, případně doplněná o PET/CT. Izotop 131I-metaiodobenzylguanidinu (131I-MIBG) se využívá v diagnostice kostních metastáz paragangliomů, zvláště dobře u jejich funkčních forem [1].
Základem léčby je pokud možno radikální odstranění nádoru. Nádor je výrazně vaskularizován, a proto se před operací obvykle provádí jeho embolizace, nejlépe pomocí Onyxu (ethylen vinyl alkohol polymer) [1]. Průměrná doba recidivy po chirurgické resekci je šest let a odhadovaná doba přežití za pět, resp. deset let od operace je 75 %, resp. 45 % [23].
Nádory jsou radiosenzitivní a celková doporučená dávka při radioterapii je obvykle v rozmezí 40–50 Gy, a to umožní lokální kontrolu růstu nádoru v 93 % případů, lze je ale ozářit i jednorázově radiochirurgicky [1,2,15]. První prokázali efektivitu radioterapie v léčbě paragangliomů v roce 1992 Schild et al [24]. Radioterapie se využívá především u solitárních primárních nebo sekundárních páteřních paragangliomů, kdy není možné radikální chirurgické odstranění, nebo v případech recidivy nádoru.
Chemoterapie může být úspěšná kombinací cyklofosfamid, doxorubicin a dakarbazin u 46–57 % těchto tumorů [10,15]. Další možností léčby je aplikace infuzí izotopu 131I-MIBG a obdobně jako chemoterapie má využití u maligních metastazujících forem nádoru [13,15,23]. Hruby et al prokázali pozitivní odpověď na 131I-MIBG u 30 % pacientů, zatímco v 57 % se velikost tumoru nezměnila a ve 13 % došlo k progresi růstu [15].
Závěr
Základem léčby paragangliomu je chirurgické odstranění, které je u pokročilých forem a vzhledem k výrazné vaskularizaci nádoru velmi komplikované. Radioterapie je indikována při inkompletním odstranění nádoru nebo v případech recidivy paragangliomu.
doc. MUDr. Lumír Hrabálek, Ph.D.
Neurochirurgická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: lumir.hrabalek@seznam.cz
Přijato k recenzi: 19. 9. 2011
Přijato do tisku: 16. 4. 2012
Sources
1. Kwan RB, Erasmus AM, Hunn AW, Dubey A, Waites P, Jessup PJ et al. Pre-operative embolisation of metastatic paraganglioma of the thoracic spine. J Clin Neurosci 2010; 17(3): 394–396.
2. Richter A, Halm HF, Lerner T, Liljenqist UR, Quante M. Long-term follow-up after en bloc resection and reconstruction of a solitary paraganglioma metastasis in the first lumbar vertebral body: a case report. J Med Case Rep 2011; 5 : 45.
3. Shin JY, Lee SM, Hwang MY, Sohn CH, Suh SJ. MR findings of the spinal paraganglioma: report of three cases. J Korean Med Sci 2001; 16(4): 522–526.
4. Laufer I, Edgar MA, Hartl R. Primary intraosseous paraganglioma of the sacrum: a case report. Spine J 2007; 7(6): 733–738.
5. Boriani S, Chevalley F, Weinstein JN, Biagini R, Campanacci L, De Iure F et al. Chordoma of the spine above the sacrum. Spine 1996; 21(13): 1569–1577.
6. Tomita K, Kawahara N, Baba H, Tsuchiya H, Fujita T, Tiribatake Y. Total en bloc spondylectomy. Spine 1997; 22(3): 324–333.
7. Blin V, Picquet J, Enon B, Rohmer V. Secreting paraganglioma of the organ of Zuckerkandl. A case report. J Mal Vasc 2002; 27(4): 239–242.
8. Enzinger FM, Weiss SW. Liposarcoma. Soft-tissue tumors. 2nd ed. Washington D.C.: The C.V. Mosby Company 1988 : 836–860.
9. Farthouat P, Platel JP, Meusnier F, Pourriére M, Thouard H. Secreting retroperitoneal paraganglioma. Apropos of a case. J Chir (Paris) 1997; 134(5–6): 248–251.
10. Patel SR, Winchester DJ, Benjamin RS. A 15-year experience with chemotherapy of patients with paraganglioma. Cancer 1995; 76(8): 1476–1480.
11. Mariman EC, van Beersum SE, Cremers CW, van Baars FM, Ropers HH. Analysis of os second family with hereditary non-chromaffin paragangliomas locates the underlying gene at the proximal region of chromosome 11q. Hum Genet 1993; 91(4): 357–361.
12. Aghakhani N, George B, Parker F. Paraganglioma of the cauda equina region – report of two cases and review of the literature. Acta Neurochir (Wien) 1999; 141(1): 81–87.
13. Buonuomo V, Ruggiero A, Rando G, D´Urzo C, Manzoni C, Pintus C. Malignant retroperitoneal paraganglioma: case report and review of the literature. Pediatr Hematol Oncol 2004; 21(8): 731–738.
14. De Roeck C, Petein M, Lurquin P, Hansen M, Mendes de Costa P. Malignant retroperitoneal paraganglioma. Case report and literature review. Acta Chir Belg 1992; 92(4): 181–186.
15. Hruby G, Lehman M, Barton M, Peduto T. Malignant retroperitoneal paraganglioma: Case report and review of treatment options. Australasian Radiology 2000; 44(4): 478–482.
16. Buchvald P, Jurák L, Mikuláštík J, Beneš V, Suchomel P. Paragangliomy kaudy a filum terminale. Neurol Prax 2011; 12(4): 286–289.
17. Duet M, Herman P, Wassef M, Huy PTB, Laredo JD. Bone metastases from head and neck paragangliomas: uncommon MR findings in an uncommon condition – report of three cases. J Magn Reson Imaging 2006; 24(2): 428–433.
18. Lee JH, Barich F, Karnell LH, Robinson RA, Zhen WK, Gantz BJ et al. American College of Surgeons commission on Cancer; American Cancer Society. National Cancer Data Base Report on malignant paragangliomas of the head and neck. Cancer 2002; 94(3): 730–737.
19. Lehmen JA, Babbel DM, Mikhitarian K, Choma TJ. Paraganglioma presenting as metastatic lesion in a cervical vertebra: a case report and review of the literature. Spine 2010; 35(5): E152–154.
20. Sclafani LM, Woodruff JM, Brennan MF. Extraadrenal retroperitoneal paragangliomas: natural history and response to treatment. Surgery 1990; 108(6): 1124–1130.
21. Singh NG, Sarkar C, Sharma MC, Garg A, Gaikwad SB, Kale SS et al. Paraganglioma of cauda equina: report of seven cases. Brain Tumor Pathol 2005; 22(1): 15–20.
22. Razakaboay M, Maillefert JF, Wendling D, Juvin R, Toussirot E, Tavernier C et al. Bone metastases from a paraganglioma. A review of five cases. Rev Rhum Engl Ed 1999; 66(2): 86–91.
23. Hamilton MA, Tait D. Metastatic paraganglioma causing spinal cord compression. Br J Radiol 2000; 73(872): 901–904.
24. Schild SE, Foote RL, Buskirk SJ, Robinow JS, Bock FF, Cupps RE et al. Results of radiotherapy for chemodectomas. Mayo Clin Proc 1992; 67(6): 537–540.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2012 Issue 5-
All articles in this issue
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

