-
Medical journals
- Career
Měření kognitivního deficitu u pacientů po ošetření mozkových aneuryzmat
Authors: L. Krámská 1; M. Preiss2 ,3; J. Hradil 4
Authors‘ workplace: Neurologické oddělení, Nemocnice Na Homolce, Praha 1; Psychiatrické centrum Praha 2; University of New York, Praha 3; Neurochirurgie, Krajská nemocnice Liberec, a. s. 4
Published in: Cesk Slov Neurol N 2012; 75/108(2): 185-190
Category: Original Paper
Overview
Cíl:
Hlavní výzkumný problém studie je možnost validního posouzení poklesu kognitivní výkonnosti u pacientů po chirurgické či endovaskulární intervenci na mozkovém aneuryzmatu.Soubor a metodika:
Autoři se zaměřují na rutinní klinický přístup v ČR – využití výsledků Wechslerovy inteligenční škály (WAIS-R) – porovnání celkové výše IQ s referenční normou, a dále na rozdíl mezi verbálním a neverbálním IQ. Celkem bylo neuropsychologicky vyšetřeno 80 pacientů z původních 168 přeživších subarachnoidální krvácení (SAK), s průměrným odstupem 1,7 roku od neurochirurgického zákroku.Výsledky:
Průměrné celkové, verbální i neverbální IQ bylo statisticky významně sníženo vzhledem k referenční normě (o 6,6 a 5 bodů). Průměrný rozdíl mezi verbálním a neverbálním intelektem nebyl statisticky významný (0,5 bodu IQ, p = 0,92).Závěr:
Autoři upozorňují na některé nedostatky v používání Wechslerovy inteligenční škály u této skupiny pacientů, především na absenci rozdílů mezi verbálním a neverbálním intelektovým výkonem, způsobenou možným vlivem difuzního poškození mozku; na stárnutí norem jako možnou příčinu absence kognitivního deficitu u části pacientů; na nedostatek informací o premorbidním stavu pacientů (vzhledem k nemožnosti provedení předoperačního vyšetření). Autoři doporučují využívání zkoušek premorbidního intelektu pro pacienty po neurochirurgických výkonech.Klíčová slova:
subarachnoidální krvácení – mozkové aneuryzma – kognitivní deficit – premorbidní intelektÚvod
Mozková aneuryzmata jsou relativně běžné onemocnění, jehož prevalence se, dle dokumentace z autopsií, zobrazovacích metod a epidemiologických studií, pohybuje mezi 2–6 % [1]. Incidence jejich ruptury ve většině zemí západní Evropy spadá do rozmezí 6–12 případů na 100 000 obyvatel. Na vysoké mortalitě a morbiditě tohoto onemocnění se nejvíce podílejí patofyziologické mechanizmy probíhající bezprostředně po prasknutí výdutě. Prognózu dále zhoršují následné komplikace, nejčastěji ve formě vazospazmů a hydrocefalu, svůj díl rizika nesou i metody ošetření krvácení. Ruptura a následné subarachnoidální krvácení (SAK) je nejen nejzávažnějším, ale bohužel také nejčastějším projevem aneuryzmatu a vede k náhlé smrti u 8–10 % pacientů. Přes veškerou léčbu je ruptura příčinou následného chronického neurologického deficitu až u 75 % přežívajících pacientů. Onemocnění postihuje jedince především v produktivním věku (průměrný věk pacientů je 50 let). Jen vzácně dochází k ruptuře před 20. rokem života (2 %) [2] a nad 60 let (10 %) případů [3].
V klinické praxi neurologů či neurochirurgů se nejčastěji používá pro hodnocení výsledku léčby SAK Glasgow Outcome Scale (GOS). V neuropsychologické praxi se často setkáváme s tím, že mnoho pacientů s dobrým neurologickým stavem (GOS I) vykazuje známky kognitivních a emočních poruch [4]. Kognitivní deficity bývají uváděny u více než 50 % pacientů, kteří SAK přežili [5]. Škála GOS je však zaměřena především na zhodnocení úrovně fyzického fungování a nezahrnuje hodnocení specifických psychických deficitů, které se u této skupiny pacientů mohou vyskytovat v překvapivě závažných formách. Absence neurologického deficitu u pacienta bohužel neznamená absenci deficitů neuropsychologických [6]. Závažnost deficitu v kognitivních doménách, ale i celkového neuropsychologického a psychosociálního fungování tedy může značně kontrastovat s jinak příznivým stavem neurologickým. Literatura dokládá, že zásadní změna vyšších mozkových funkcí může být ve svých efektech vnímána jako závažnější postižení než některé deficity neurologické [3,6]. I přes zřetelný význam diagnostiky kognitivních deficitů, která umožňuje zásadně a cíleně napomoci jinak obtížné reintegraci pacientů do běžného života, je péče neuropsychologa stále vnímána jako nadstandard. Jde ovšem jednoznačně o pole, které skrývá velké rezervy v systému zdravotní péče, kde samotné pochopení deficitu pacientem i jeho rodinou a cílená neuropsychologická rehabilitace dokáží zásadně ovlivnit subjektivní vnímání spokojenosti a kvality života. Přitom prevalence a rozsah kognitivních deficitů je v populaci pacientů po SAK alarmující. Například Egge et al [7] zjistili, že 93 % pacientů vykazovalo známky kognitivního deficitu, především v paměti, rychlosti zpracování informací, kognitivní flexibilitě a řešení problémů. Kognitivní deficit byl nalezen ve verbální a vizuální paměti [6,8,9], zpracování informací [10], verbální fluenci [11,12], tvorbě pojmů a myšlení [13].
V neuropsychologii existuje několik způsobů přímého či nepřímého stanovení kognitivního deficitu u pacientů po SAK, které jsou obvykle založeny na zhodnocení aktuální kognitivní a intelektové výkonnosti pomocí níže uvedených psychodiagnostických metod.
Postupy vycházející z komplexních Wechslerových inteligenčních škál WAIS-R/WAIS-III [14]:
- Porovnání dílčího verbálního, performačního a celkového IQ se známým premorbidním výkonem nebo s dosaženou úrovní vzdělání. Takto zjištěnou změnu lze vyjádřit v bodech IQ jako rozdíl mezi naměřeným a předchozím výkonem.
- Porovnání verbálního a performačního IQ ve WAIS-R, kdy klinicky nápadný je rozdíl 12–15 bodů. Čím vyšší je rozdíl, tím je pravděpodobnější oslabení kognitivních funkcí.
- Slovníkový/Informační scatter [15] byl v minulosti považován za nejlepší míru obecné inteligence a její premorbidní úrovně. Vypočítá se jako rozdíl profilového skóru daného subtestu a profilového skóru Slovníku, případně Informací. Získáme tak řadu skórů, které mají často zápornou hodnotu, neboť Slovník podle autorů nejlépe „drží“ (má největší odolnost vůči poškození mozku). Součet kladných i záporných diferenčních skórů představuje hypotetický úbytek bodů profilového skóru.
Metody odhadu:
- Zahrnutí demografických ukazatelů pro odhad premorbidních schopností je založeno na regresních rovnicích, do kterých se dosazují známé údaje, jako jsou věk, vzdělání, rasa, místo bydliště, povolání atd. Jsou značně specifické pro kulturu, ve které byly vytvořeny. Moderní standardizace inteligenčních testů již s vlivem demografických ukazatelů počítají a tato data jsou součástí informací získaných od zdravých osob. Metoda se využívá spíše výzkumně, než klinicky.
- Metoda nejlepšího výkonu je založena na srovnání různých ukazatelů – testových metod, pozorování, anamnézy. U pacienta zjistíme nejlepší výkon z řady úloh, z něhož pak vycházíme jako z nejlepšího ukazatele premorbidního stavu. Tato metoda má svoje omezení i výhody [16], je však nejjednodušší.
- Klinický odhad premorbidního intelektu na základě posouzení typu a kvality vzdělání a jeho výsledků. Tento postup je možné použít především v zemích, kde se nepříliš mění struktura vzdělávání a kde jsou jasně definovany primární kognitivní předpoklady jedince pro zvládnutí určitého typu vzdělávání.
- Zkoušky čtení slov – NART (National Adult Reading Test), test, který tvoří 50 jednoduchých, fonematicky nepravidelných slov. Předpokládá se, že výkon v testu ukazuje na premorbidní, především vzděláním podmíněnou úroveň intelektových funkcí. Chybový skór v NART se dosazuje do regresní rovnice, pomocí níž je odhadnuto premorbidní IQ a hloubka deficitu je stanovena jako rozdíl mezi aktuálním a odhadovaným IQ.
Statistický postup:
- Kognitivní deficit může být definován jako hodnota dvou a více standardních odchylek (SD) od běžné populační normy [16] podle věku a podle vzdělání. Výkon v pásmu normy (průměr ± ± 1 SD od normy) považujeme za nepřítomnost kognitivního deficitu. Kognitivní funkce jsou jindy hodnoceny jako mírně poškozené při SD 2–3 pod normou, a značně poškozené při SD 3 a více pod normou. Různí autoři používají různé normy, proto hloubka kognitivního deficitu přímo závisí na použitých normách.
- Porovnání skupiny pacientů s kontrolní skupinou umožňuje přesnější stanovení kognitivního deficitu. To je pouze za předpokladu nepřítomnosti jakéhokoli kognitivního oslabení či vlivu mimointelektových faktorů u kontrolní skupiny. Problém řady výzkumných studií je, že do kontrolních skupin nejsou zahrnuti zdraví jedinci, ale pacienti s jiným somatickým onemocněním, jehož výskyt může sám o sobě ovlivňovat aktuální kognitivní výkonnost.
Cílem této práce je zhodnocení výsledného neuropsychického stavu po ošetření mozkových aneuryzmat. Klademe si otázku, zda v období roku až několika let po zákroku pacienti ve zkoumaném souboru vykazují známky kognitivního oslabení. Vzhledem k tomu, že v době studie nebyla v české psychodiagnostice dostupná metoda pro odhad premorbidního intelektu (např. NART), vyhodnocujeme a posuzujeme aktuální možnosti testů a úskalí jejich interpretace.
Soubor
Na oddělení neurochirurgie Krajské nemocnice Liberec bylo v letech 2003–2008 ošetřeno celkem 168 pacientů s nálezem intrakraniálního aneuryzmatu mozkové tepny. Pacienti byli rozděleni dle škály Hunta a Hesse podle jednotlivých skórů: 19 pacientů (11 %) bylo ošetřeno elektivně, dále HH 1 – 36 pacientů (22 %), HH 2 – 45 pacientů (27 %), HH 3 – 24 pacientů (14 %), HH 4 – 27 pacientů (16 %), HH 5 – 16 pacientů (10 %). Soubor obsahoval pacienty s prasklým aneuryzmatem, kteří byli léčeni chirurgicky (clip) – 151 pacientů (90 %), a endovaskulárně (coil) – 13 (8 %). U dvou pacientů byl proveden wrapping a u jednoho urgentní podvaz krční tepny.
Celkem 86 pacientů (51 %) nebylo zařazeno do této studie. Padesát jedna pacientů (30 %) nemohlo být neuropsychologicky vyšetřeno z důvodu úmrtí, dále pro závažné neurologické postižení vylučující kompletní provedení testů (paréza či plegie dominantní končetiny, porucha smyslových orgánů, fatická porucha), nebo pro závažnou poruchu emocí neumožňující spolupráci. Dalších 21 % pacientů se k vyšetření nedostavilo.
Do studie tak bylo zařazeno celkem 80 pacientů (49 %), kteří byli vyšetřeni revidovanou Wechslerovou inteligenční zkouškou (WAIS-R). Soubor tvořilo 57 žen a 23 mužů. Průměrný věk byl 49,1 let (SD = 11,7), věkové rozpětí bylo od 19 do 78 let. Kromě 11 elektivních ošetřených byl skór dle Hunta a Hesse (HH): HH 1 u 23, HH 2 u 26, HH 3 u 11, HH 4 u 6 a HH 5 u 2 osob.
Všichni pacienti byli vyšetřeni jedním neuropsychologem (LK). V prvním sezení byl proveden podrobný rozhovor s pacientem a rodinou, dále byl administrován kompletní WAIS-R, česká pracovní verze NART (zkouška premorbidního intelektu), kresba postavy (průměrná doba vyšetření 2,5–3 hod). Vyšetření metodou WAIS-R trvalo průměrně 1,5 hod, v závislosti na psychomotorickém tempu pacienta. V druhém sezení byl pacientům administrován MMPI-II, SQUALA, semistrukturovaný rozhovor zaměřený na kvalitu života pro pacienta a rodinného příslušníka (cca 2,5 hod). Výsledky jiných metod než WAIS-R nebyly pro účely této studie použity.
Vzdělání souboru bylo porovnáno s populačními výsledky úrovně vzdělání obyvatelstva ČR (podle výsledků sčítání lidu v roce 2001). V tab. 1 jsou uvedena procenta vzdělání v našem souboru a populaci ČR ve věkovém pásmu 50–54 let. Hodnoty populace neobsahují osoby bez vzdělání a osoby, kde vzdělání nebylo zjištěno (u žen 1,2 %, u mužů 1,7 %).
Table 1. Vzdělání u souboru pacientů po SAK (muži a ženy zvlášť, v %) a vzdělání v referenčním souboru (obyvatelstvo ČR, muži a ženy ve věku 50–54 let v %). 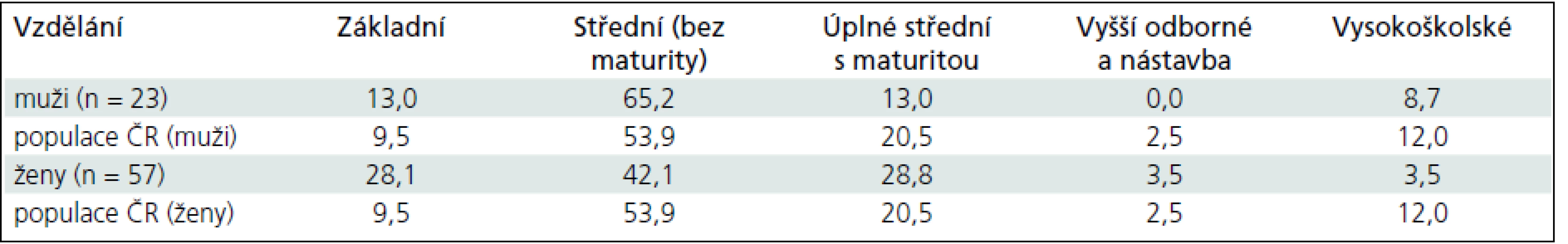
Metodika
Všechny osoby (n = 80) byly po zákroku vyšetřeny revidovanou Wechslerovou inteligenční zkouškou (WAIS-R), neboť novější verze WAIS-III nebyla v době studie standardizována na českou populaci. WAIS-R (Wechsler Adult Inteligence Scale-Revised) vznikla v roce 1981 revizí starší verze WAIS z roku 1955. U nás byla škála restandardizována v roce 1983 Říčanem et al [15] na základě původních amerických norem. Test se skládá z části verbální a performační. Verbální část tvoří šest subtestů (Informace, Opakování čísel, Slovník, Počty, Porozumění, Podobnosti), performační pět subtestů (Doplňování obrázků, Řazení obrázků, Kostky, Skládání předmětů, Symboly). Součet všech hrubých skórů se převádí na skóry vážené a jejich součtem se stanoví verbální, performační a celkové IQ. Dále je možné hrubé skóry převést na profilové, díky nimž můžeme porovnat výkon pacienta v jednotlivých subtestech s výkony skupiny vrstevníků.
Škála byla administrována v průměru 1,7 (rozsah 0,8–3,7) roku po zákroku. Inteligenční škála obsahovala všech 11 subtestů a byla standardně administrována a vyhodnocena podle manuálových norem.
Byly stanoveny dva způsoby měření kognitivního deficitu:
- podle celkové výše IQ, vypočtené z WAIS-R a porovnané s referenční hodnotou (průměr 100, SD 15),
- podle rozdílu mezi verbálním a neverbálním skórem inteligence (rozdíl VIQ-PIQ).
Oba postupy mají svá racionále – stanovení kognitivního oslabení podle výše celkového IQ je vhodné, pokud jsme schopni podle demografických a anamnestických parametrů (především vzdělání, profesní dráhy, zájmů aj.) odhadnout úroveň premorbidního IQ. Rozdíl V IQ – P IQ umožňuje navíc bez ohledu na celkovou výši IQ stanovit nerovnováhu mezi verbálními a neverbálními funkcemi, a tím pravděpodobné oslabení kognitivních funkcí. Čím vyšší rozdíl, tím bude pravděpodobnější kognitivní oslabení. Odchylka (+)15 a více bodů je považována za signifikantní, klinicky pravděpodobný ukazatel oslabení kognitivních funkcí [17,18].
Výsledky
Stanovení IQ
Průměrné celkové IQ souboru bylo 93,8 (SD = 13,4; rozpětí 65–135). Verbální IQ bylo v průměru 94,0 (SD = 13,9; rozpětí 66–135), neverbální 94,5 (SD = 12,9; rozpětí 68–128). Aktuálně naměřené verbální (t(79) = 3,9; p < 0,001), performační (t(79) = 3,8; p < 0,001) i celkové IQ (t(79) = 4,1; p < 0,001) je statisticky významně snížené vzhledem k normě (tab. 2).
Table 2. Test průměrů vůči referenční konstantě 100. 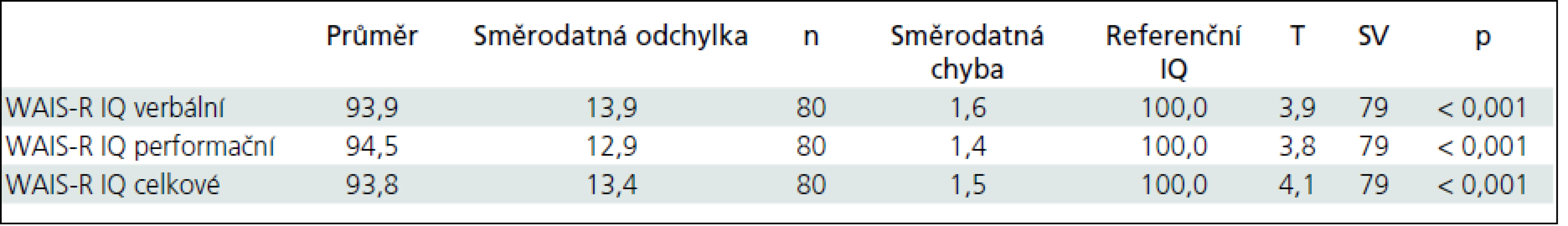
Průměrné hodnoty profilových skórů subtestů WAIS-R obsahuje graf 1. Předpokládané hodnoty populace dosahují vždy profilového skóru 10. Z grafu je patrné, v kterých subtestech má soubor pacientů po SAK hodnoty nižší či vyšší vzhledem k populační normě. V průměru dosahuje soubor ve většině parametrů podprůměrných hodnot vzhledem k populaci, pouze ve dvou případech (Podobnosti a Kostky) populační průměr mírně přesahuje. Nejvýznamněji podprůměrné hodnoty jsou v subtestu Informace (všeobecný přehled, dlouhodobá sémantická paměť) a Opakování čísel (koncentrace pozornosti, pracovní paměť).
Graph 1. Průměrné hodnoty jednotlivých subtestů WAIS-R (referenční hodnota populace je vždy skór 10). 
Rozdíl mezi verbálním a neverbálním IQ (VIQ-NIQ)
Rozdíl mezi verbálním a neverbálním IQ byl v průměru (–)0,5 (SD = 9,0; rozpětí (–)22–(+)24; p = 0,92. Rozdíly, které by ukazovaly na výraznou diskrepanci mezi verbálním a neverbálním IQ mělo šest osob (7,5 %), což není statisticky významné. Rozložení rozdílů ukazuje graf 2.
Graph 2. Rozdíly V IQ – N IQ (horizontálně jsou uvedeny počty bodů IQ). 
Diskuze
Neuropsychologické vyšetření je nezbytné vždy, když samotné onemocnění či léčebná intervence může ovlivnit kognitivní funkce a osobnostní charakteristiky. Cílem této studie bylo zjistit, zda i se značným časovým odstupem nalezneme u pacientů po ošetření aneuryzmat mozkových tepen nějaké známky kognitivního deficitu a zda tento deficit bude vykazovat specifické charakteristiky právě u této skupiny pacientů.
Jak prokazují nálezy celé řady studií týkající se kognitivních změn u pacientů po SAK, postižení kognitivních funkcí bývá značné. Přibližně u 30–50 % pacientů s dobrou neurologickou úzdravou (GOS-I) bývají přítomny trvalé poruchy v kognitivní kapacitě, kvalitě života a emočním přizpůsobení, četnost se liší dle jednotlivých studií [19–24]. Ve studiích, jež se zabývají následky SAK a samotného ošetření aneryzmatu, existují značné rozdíly ve složení vzorku pacientů, chirurgických a endovaskulárních postupech, péči na jednotkách intenzivní péče a použitých testových metodách. Nejčastějšími následky SAK jsou poruchy verbální a neverbální intelektové výkonnosti, krátkodobé a dlouhodobé paměti, abstraktního myšlení, flexibility, přesnosti vnímání a koncentrace pozornosti.
Přestože jsme zjistili, že kognitivní výkonnost byla u našich pacientů po SAK snížena v průměru o 6 bodů IQ vzhledem k normě, není možné tento výsledek brát jako exaktní důkaz deteriorace intelektové výkonnosti, a to především z těchto důvodů:
- Vzhledem k tomu, že SAK je akutní onemocnění mozku, které se projeví náhle, bez předchozího varování, obvykle není možné provést vstupní neuropsychologické vyšetření, jež by umožnilo srovnání s výsledky pooperačními. Nebylo tedy možné provést přímé měření kognitivního deficitu, které je zatíženo nejmenší chybou při měření deteriorace kognitivní výkonnosti.
- Přestože WAIS-R poskytuje možnosti měření kognitivního deficitu např. porovnáním VIQ a PIQ, nemusí být vždy zjištěna rozdílná výkonnost ve verbálních a performačních subtestech, ačkoli pacient vykazuje známky kognitivního oslabení. Dle dostupných studií se jeví velmi obtížné stanovit jednotný vztah mezi radiologickými nálezy ohraničených lézí a specifickým neuropsychologickým deficitem po SAK [9,11,25,26]. Tyto nálezy se týkají především pacientů s difuzním poškozením mozku, kde není zcela jasně lokalizovaná léze, což pacienti po SAK mohou být. To může být jeden z argumentů, proč jsme u naší skupiny pacientů po SAK nenalezli rozdíl mezi verbální a performační intelektovou výkonností, zvláště pokud došlo k rozsáhlejšímu ischemickému poškození mozku.
- Dalším důvodem, proč nebyl nalezen závažnější kognitivní deficit, může být použití samotné metody WAIS-R a jejích norem. Vzhledem k tomu, že normy pocházejí z 90. let 20. století, je velmi pravděpodobné, že zkouška mírně nadhodnocuje aktuální výkonnost pacientů. Tento fenomén se nazývá „Flynnův efekt“. J. R. Flynn [27] nalezl signifikantní nárůst standardizovaných IQ skórů z generace na generaci, což uzavírá tak, že tento nárůst odráží měnící se enviromentální faktory. Nárůst skórů se mění podle počtu let od standardizace daného testu. Domníváme se tedy, že skutečná intelektová výkonnost pacientů po SAK by byla nižší vzhledem k normální populaci, a tedy i hloubka kognitivního deficitu by byla větší.
- Pokud nemáme k dispozici údaje o kognitivní výkonnosti pacientů z premorbidního období, jsme odkázáni na postupy nepřímého měření kognitivního deficitu, tedy metody odhadu premorbidního intelektu. V klinické praxi v ČR však zatím není k dispozici žádná standardizovaná metoda odhadu premorbidního IQ. V současné době probíhá standardizace české verze zkoušky NART [28–30], která by v budoucnu mohla sloužit k přesnějšímu stanovení kognitivního deficitu právě u skupin pacientů, u nichž záznamy z předchozích psychologických vyšetření nejsou k dispozici.
- Odhad premorbidní úrovně může vycházet také z demografických a anamnestických údajů, jakými jsou např. vzdělání, pracovní zařazení apod. Porovnali jsme naši skupinu pacientů po SAK s demografickými údaji Českého statistického úřadu z hlediska vzdělání v ČR, zda se naše skupina pacientů příliš neliší od normální populace.
V případě, že by skupina pacientů zahrnovala větší počet např. vysokoškoláků, byla by hloubka deficitu nepoměrně vyšší, než kdyby převážnou část pacientů tvořili jedinci se základním vzděláním. To znamená, že pokud je naměřené průměrné IQ 94, a většina pacientů by měla vysokoškolské vzdělání, odhadované premorbidní IQ by se očekávalo v pásmu nadprůměru (> 120). Kognitivní deficit by byl tedy v tomto případě výrazný. Vzdělání našeho souboru pacientů bylo mírně horší než vzdělání zdravé populace, což také prokazuje nižší skór v subtestu Informace (průměrný profilový skór = 8), který je považován za ukazatel úrovně vzdělání. - Je otázka, zda jsou Wechslerovy inteligenční škály pro vyšetření pacientů po neurochirurgických zákrocích optimální. Wechslerovy škály jsou obecně považovány za měřítko kulturně podmíněných výkonů, a to mnohem více, než dílčí neuropsychologické testy, které měří spíše „biologickou inteligenci“ a kvalitu fungování centrální nervové soustavy. Nepochybnou výhodou Wechslerových škál je komplexní zhodnocení kognitivní výkonnosti, které je však v neuropsychologii nezbytné interpretovat také dle dílčích subtestů ve vztahu ke specifickým psychickým funkcím a nikoli pouze podle jednotlivých inteligenčních kvocientů.
Závěr
Objektivní neuropsychologické vyhodnocení psychického stavu pacientů po ošetření aneuryzmat mozkových tepen je značně obtížné. Některé překážky plné objektivity není možné eliminovat (absence hodnot premorbidního intelektu a osobnosti u těchto akutně přijímaných a akutně řešených pacientů), některé je možné částečně zmírnit (například standardizací a aktualizací populačních norem neuropsychologických testů premorbidního intelektu).
Vyhodnocení úspěšnosti léčby aneuryzmat mozkových tepen se v minulých desetiletích (zjevně s ohledem na závažnost tohoto onemocnění) zaměřovalo pouze na mortalitu, teprve s rozvojem mikrochirurgie, endovaskulárních intervencí a další léčby se začala sledovat neurologicky patrná morbidita. Až v posledních letech se objevují snahy o vyhodnocení kvality života pacientů [31,32], které jsou potencovány mimo jiné i snahou o srovnání výsledků dvou hlavních metod léčby (klip//coil) [33].
Neuropsychologické vyšetřování pacientů prokázalo, že alterace této, v běžném nemocničním provozu v podstatě nevyhodnotitelné sféry, může být značná a svým vlivem na kvalitu dalšího života pacienta může být závažnější než některé neurodeficity. Jednotlivé kazuistiky našeho souboru dokládají, že pacient s plným vědomím – se zhoršením kognitivních schopností a s osobnostními poruchami – může trpět více, než pacient s např. reziduální hemiparézou a chůzí s oporou.
Pro klinickou praxi z našich výsledků vyplývá:
- Rozdíl mezi naměřeným VIQ a PIQ nemusí být u pacientů po SAK významný, mnohem důležitější je porovnání variability dílčích subtestů a jejich kvalitativní neuropsychologická interpretace.
- Flynnův efekt může rozdíly mezi premorbidní úrovní a naměřenou postmorbidní úrovní (s dostupnými normami zdravé populace) pacientů zvyšovat, proto odhadovaná hloubka kognitivního deficitu může být u našeho souboru větší.
- Inteligenční baterie WAIS-R nemusí být optimální metodou pro hodnocení intelektového deficitu v neurochirurgické praxi, především pro svou časovou náročnost a kulturní podmíněnost. Je proto vhodné zařadit další neuropsychologické baterie (např. HRNB, RBANS aj.), a především metody zaměřené na premorbidní intelekt, na jejichž standardizaci intenzivně pracujeme.
- U pacientů po SAK se často jedná o globální poškození mozku, proto tato skupina pacientů nevykazuje známky lateralizace kognitivního deficitu.
Přijato k recenzi: 11. 7. 2011
Přijato do tisku: 29. 8. 2011
PhDr. Lenka Krámská, Ph.D.
Neurologické oddělení
Nemocnice na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: lenka.kramska@homolka.cz
Sources
1. King JT jr, Horowitz MB, Kassam AB, Yonas H, Roberts MS. The short form-12 and the measurement of health status in patients with cerebral aneurysms: performance, validity and reliability. J Neurosurg 2005; 102(3): 489–494.
2. Dombovy ML, Drew-Cates J, Serdans R. Recovery and rehabilitation following subarachnoid haemorrhage: part II long term follow up. Brain Inj 1998; 12(10): 887–894.
3. Hütter BO. Neuropsychological Sequelae of subarachnoid Hemorrhage. Vienna: Springer-Verlag 2000.
4. Jennett B, Bond M. Assessment of outcome after severe brain damage. Lancet 1975; 1(7905): 480–484.
5. Kreiter KT, Copeland D, Bernardini GL. Predictors of cognitive dysfunction after subarrachnoid hemorrhage. Stroke 2002; 33(1): 200–209.
6. Hütter B, Gilsbach J. Which neuropsychological deficits are hidden behind a good outcome (Glasgow = I) after aneurysmal subarachnoid hemorrhage? Neurosurgery 1993; 33(6): 999–1005.
7. Egge A, Waterloo K, Sjoholm H, Ingebrigsten T, Forsdahl S, Jacobsen EA et al. Outcome 1 year after aneurysmal subarachnoid hemorrhage: relation between cognitive performance and neuroimaging. Acta Neurol Scand 2005; 112(2): 76–80.
8. De Luca J. Cognitive dysfunction after aneurysm of the anterior communicating artery. J Clin Neuropsychol 1992; 14(6): 924–934.
9. Ogden JA, Mee EW, Henning M. A prospective study of impairment of cognition and memory and recovery after subarachnoid hemorrhage. Neurosurgery 1993; 33(4): 572–587.
10. Fertl E, Killer M, Eder H, Linzmayer L, Richling B, Auff E. Long-term functional effects of aneurysmal subarachnoid haemorrhage with special emphasis on the patient‘s view. Acta Neurochir (Wien) 199; 141(6): 571–577.
11. Berry E, Jones RAC, West CG, Brown JDK. Outcome of subarchnoid heamorrhage. An analysis of surgical variables, cognitive and emotional sequale related to SPECT scanning. Br J Neurosurgery 1997; 11(5): 378–387.
12. Mavaddat N, Sahakian BJ, Hutchinson PJ, Kirkpatrick PJ. Cognition following subarrachnoid hemorrhage from anterior communicating artery aneurysm: relation to timing of surgery. J Neurosurg 1999; 91(3): 402–407.
13. Tidswell P, Dias PS, Sagar HJ, Mayes AR, Battersby RD. Cognitive outcome after aneurysm rupture: relationship to aneurysm site and perioperative complications. Neurology 1995; 45(5): 875–882.
14. Wechsler D. WAIS-III, WMS-III. Technical Manual. San Antonio: The Psychological Corporation 1997.
15. Říčan P, Šebek M, Vágnerová M. Wechslerův inteligenční test pro dospělé. Bratislava: Psychodiagnostické a didaktické testy 1983.
16. Lezak MD, Howieson DB, Loring DV. Neuropsychological Assessment. New York: Oxford University Press 2004.
17. Bryson GJ. Differential rate of neuropsychological dysfunction in psychiatric disorders: comparison between the Halstead-Reitan and Luria-Nebraska batteries. Percept Mot Skills 1993; 76(1): 305–306.
18. Ballard C, Stephens S, Kenny RA, Tovee KM, O’Brien J. Profile of neuropsychological deficits in older stroke survivors without dementia. Dement Geriatr Cogn Disord 2003; 16(1): 52–56.
19. Sonesson B, Ljunggren B, Saveland H. Cognition and adjustment and early operation for ruptured aneurysm. Neurosurgery 1987; 21(3): 279–287.
20. Bornstein RA, Weir BKA, Petruk KC, Disney LB. Neuropsychological function in patients after subarachnoid hemorrhage. Neurosurgery 1987; 21(5): 651–654.
21. De Santis A, Laiacona M, Barbarotto R. Neuropsychological outcome of patients operated upon for an intracranial aneurysm. J Neurol Neurosurg Psychiatry 1989; 52(10): 1135–1140.
22. Kim DH, Haney CL, Ginhoven GV. Utility of outcome measures after treatment for intracranial aneurysms: a prospective trial involving 520 patients. Stroke 2005; 36(4): 792–796.
23. Al-Khindi T, Macdonald RL, Schweizer TA. Cognitive and functional outcome after aneurysmal subarachnoid hemorrhage. Stroke 2010; 41(8): e519–e536.
24. Proust F, Martinaud O, Gérardin E, Derrey S, Levèque S, Bioux S et al. Quality of life and brain damage after microsurgical clip occlusion or endovascular coil embolization for ruptured anterior communicating artery aneurysms: neuropsychological assessment. J Neurosurg 2009; 110(1): 19–29.
25. Vilkki J, Holst P, Ohman J, Servo A, Heiskanen O. Social outcome related to cognitive performance and computer tomographic findings after surgery for a ruptured intracranial aneurysm. Neurosurgery 1990; 26(4): 579–585.
26. Säveland H, Uski T, Sjöholm H, Sonnesson B, Brandt B. SPECT with technetium-99m-HMPAO in relation to late cognitive outcome for ruptured cerebral aneurysms. Acta Neurochir (Wien) 1996; 138(3): 301–307.
27. Flynn JR. What is intelligence? Beyond the Flynn Effect. Cambridge: Cambridge University Press 2007.
28. Krámská L. Možnosti měření premorbidního intelektu u pacientů po subarachnoidálním krvácení. Tvorba české verze zkoušky NART (dizertační práce). Praha: FF UK 2009.
29. Krámská L, Preiss M. Určování premorbidní úrovně – možnosti zkoušky čtení slov. Psychiatrie 2007; 11(1): 4–7.
30. Krámská L, Preiss M. Adaptation of the NART in Czech speakers – first experiences. J Int Neuropsychol Soc 2009; 15 (Suppl 2): 105.
31. Passier PE, Visser-Meily JM, Van Zandvoort MJ, Post MWM, Rinkel GJ, van Heugten C. Prevalence and Determinants of Cognitive Complaints after Aneurysmal Subarrachnoid Hemorrhage. Cerebrovasc Dis 2010; 29(6): 557–563.
32. Springer MV, Schmidt JM, Wartenberg KE, Frontera JA, Badjatia N, Mayer SA. Predictors of global cognitive impairment 1 year after subarachnoid hemorrhage. Neurosurgery 2009; 65(6): 1043–1051.
33. le Roux AA, Wallace MC. Outcome and Cost of Aneurysmal Subarachnoid Hemorrhage. Neurosurg Clin N Am 2010; 21(2): 235–246.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2012 Issue 2-
All articles in this issue
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Sulcus temporalis superior a jeho funkční význam
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou
- Poruchy výživy a metabolizmu u Parkinsonovy nemoci
- Měření kognitivního deficitu u pacientů po ošetření mozkových aneuryzmat
- Polysomnografické nálezy u dětí s poruchou pozornosti a hyperaktivitou (ADHD) vyšetřovaných pro poruchu spánku
- Léčba neurogenního hyperaktivního detruzoru po spinálním poranění aplikací botulinumtoxinu A. Porovnání endoskopické subslizniční a intramuskulární aplikace
- Naše zkušenosti s laterálním supraorbitálním přístupem při operacích mozkových aneuryzmat
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
- Terapeutické možnosti prevence cévní mozkové příhody u pacientů s karotickým stump syndromem – kazuistiky
- Oligosymptomatické formy myotonické dystrofie typu 2
- Odeznění traumatické pentaplegie u pacienta po kombinované zlomenině C1–C2
- Klinický standard pro diagnostiku a léčbu myasthenia gravis
- Diagnostika a léčba demence českými neurology a psychiatry
- Endoskopická ventrikulostomie III. komory v léčbě hydrocefalu u dětí s mozkovými tumory – zkušenosti jednoho centra
- Detekcia anaplastických ložísk v kontrastnou látkou sa nevýrazne farbiacich infiltratívnych gliómoch pomocou 5-aminolevulovej kyseliny – správa o piatich prípadoch
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

