-
Medical journals
- Career
Porovnání tíže afázie u demence a cévní mozkové příhody pomocí MASTcz a její vztah k tíži kognitivního deficitu
Authors: M. Košťálová 1; J. Bednařík 1; S. Skutilová 1; A. Mitášová 1; E. Bártková 1; K. Šajgalíková 1; A. Demovičová 1,3; L. Dušek 2
Authors‘ workplace: Neurologická klinika LF MU a FN Brno 1; Institut biostatistiky a analýz MU, Brno 2; Interní hematoonkologická klinika LF MU a FN Brno 3
Published in: Cesk Slov Neurol N 2010; 73/106(3): 246-252
Category: Original Paper
Overview
Cíl:
Zjistit výskyt a tíži afázie pomocí české verze skríningového testu pro detekci afázií The Mississippi Aphasia Screening Test (MASTcz) ve vztahu k tíži celkového kognitivního deficitu u syndromu demence a v porovnání s afázií u ložiskové cévní léze v dominantní hemisféře.Soubor a metodika:
Skupina A byla tvořena 149 nemocnými s cévní mozkovou příhodou (CMP) v levé dominantní hemisféře s afázií (potvrzenou logopedickým vyšetřením), 74 žen a 75 mužů, věk 68; 19 – 95 let (medián; rozptyl). Skupina B byla tvořena 52 nemocnými, kteří splňovali kritéria demence dle DSM ‑ IV a dosáhli abnormálního skóre Addenbrookského kognitivního testu (ACE) ≤ 82 bodů; 26 mužů a 26 žen, věk 74; 41 – 84 let (medián; rozptyl). Čtyřicet tři nemocných s ACE skóre 30 – 82 tvořilo podskupinu lehké až střední demence. Etiologicky šlo u 22 nemocných o Alzheimerovu demenci, u 30 nemocných o další příčiny demencí.Výsledky:
Podskupina s lehkou až střední demencí vykazovala statisticky významně nižší stupeň jazykového deficitu vyjádřeného pomocí jazykových indexů MASTcz ve srovnání se skupinou nemocných s afázií u CMP. Při použití cut‑off hodnoty celkového jazykového indexu (CJI) < 85 bodů jako kritéria pro přítomnost afázie bylo možné pomocí Receiver Operating Characteristic analýzy statisticky významně odlišit skupinu A (CMP) (131 ze 149 nemocných splnilo zvolené kritérium afázie) od skupiny Ba s lehkou až střední demencí (6 z 43 nemocných splnilo kritérium afázie, nejnižší zjištěná hodnota CJI byla 68 bodů); senzitivita testu byla 88,6 %, specificita 81,4 %, (p < 0,001).Závěr:
U nemocných s demencí až do počínajícího těžkého stadia zůstávají jazykové deficity relativně lehké oproti pacientům s afázií u CMP.Klíčová slova:
afázie – demence – Alzheimerova choroba – kognitivní deficit – porucha komunikacePráce byla vytvořena s podporou grantového projektu IGA MZČR č. NS10216-3/2009 s názvem „Diagnostika a patofyziologie deliria v intenzivní a pooperační péči“ a VZ MŠMT ČR MSM0021622404 „Vnitřní organizace a neurobiologické mechanismy funkčních systémů CNS“
Úvod
Poruchy řeči se vyskytují u fokálních mozkových lézí i multifokálních lézí nebo difuzního postižení v rámci neurodegenerativních onemocnění [1,2]. Jejich terminologie je dosud nejednotná a vysvětlení patofyziologie představuje zajímavý teoretický problém [2,3]. Jako afázie je označována porucha řeči vedoucí k jazykovému deficitu v důsledku ložiskové léze řečových center v kortexu dominantní hemisféry. Porucha řeči se vyskytuje i u syndromu demence, který je podmíněn multifokálním nebo difuzním postižením mozku. Má často podobný klinický obraz jako afázie u ložiskových lézí řečových (jazykových) center v dominantní hemisféře. V neurologické literatuře se tradičně hovoří o afázii u demence [4]. Přítomnost afázie je i jedním z diagnostických kritérií demence dle DSM ‑ IV. Jedna z variant frontotemporální demence s iniciální poruchou řeči nese označení primární progresivní afázie [4]. Kertesz et al použili k analýze jazykového deficitu u demencí Bostonskou klasifikaci afázií [5]. Naproti tomu zejména v logopedické literatuře se v poslední době hovoří v souvislosti s demencí o komunikační poruše nebo kognitivně‑komunikačním deficitu u demence [2,3]. Příčinou je, že porucha komunikace u demencí je komplexní; zahrnuje poruchu většiny kognitivních procesů, zejména paměti. Existuje i řada důkazů, že porucha komunikace včetně jazykového deficitu může mít u demence odlišný mechanizmus oproti afázii u ložiskových lézí [2,3]. Pro skupinu syndromů (zejména primární progresivní afázie, sémantická demence a progresivní anomie) objevujících se v rámci neurodegenerativních onemocnění, zvláště FTD a AD, se začíná používat termín progresivní jazykové poruchy (progressive language impairments) vymezující se oproti afáziím v důsledku jednorázového ložiskového postižení [6]. Pro větší srozumitelost se však při označení jazykového deficitu u demence přidržíme označení afázie.
V literatuře lze nalézt ojedinělé pokusy o diskriminaci jazykového deficitu u ložiskových lézí a demencí s nejednoznačným výsledkem [7]. Kromě teoretického významu může mít diskriminace i význam praktický, neboť oba typy postižení se mohou u jednoho nemocného kombinovat – typicky u multiinfarktové demence.
V předchozí práci jsme prokázali vysokou validitu české verze skríningového testu pro detekci afázií – the Mississippi Aphasia Screening Test (MASTcz) – v diskriminaci nemocných s afázií v důsledku cévní mozkové příhody (CMP) v levé dominantní hemisféře oproti zdravým kontrolám i proti postižení pravé nedominantní hemisféry bez afázie stejné etiologie [8]. Cílem této práce bylo zjistit výskyt a tíži afázie pomocí české verze skríningového testu pro detekci afázií the Mississippi Aphasia Screening Test (MASTcz) ve vztahu k tíži celkového kognitivního deficitu u syndromu demence a v porovnání s afázií u ložiskové cévní léze v dominantní hemisféře.
Metodika
Pro stanovení přítomnosti a tíže afázie byla použita česká verze the Mississippi Aphasia Screening Test (MAST) – originálního skríningového testu pro detekci afázie standardizovaného původně v anglickém jazyce [9,10]. Českou verzi (MASTcz) jsme vytvořili metodou „forward ‑ backward translation“ s určitou adaptací s ohledem na jazyková a kulturní specifika českého jazyka a následně jsme test standardizovali [7]. Jde o relativně jednoduchý test, jehož provedení trvá 10 – 15 minut, avšak umožňuje i kvantifikaci jazykového deficitu. Obsahuje celkem devět subtestů, sumární skóre prvních pěti tvoří tzv. Index Produkce (IP, maximum 50 bodů), sumární skóre dalších čtyř subtestů tvoří Index Rozumění (IR, maximum 50 bodů), součet obou subskóre pak tvoří Celkový Jazykový Index (CJI) vyjadřující tíži fatických poruch (maximum 100 bodů) – obr. 1 [11].
Obr. 1. Česká verze the Mississippi Aphasia Screening Test (MAST). 
K orientačnímu vyloučení preexistující těžší demence u nemocných s (CMP) – skupina A – byl použit test Blessed Dementia Scale (BDS) [12].
K stanovení diagnózy demence – skupina B – byla použita kritéria demence dle DSM IV [13]. K stanovení příčin demence byla zvolena kritéria Alzheimerovy choroby (AD) z roku 1984 [14] a další standardní kritéria pro diagnózu ostatních typů demence [4,15]. Tíže demence byla kvantifikována pomocí Addenbrookského kognitivního testu (ACE) a Mini‑Mental Status Examination (MMSE) jako součásti ACE [16].
Soubory
Pomocí MASTcz byly vyšetřeny dva soubory nemocných, jejichž mateřským jazykem byla čeština. Nezařazeni byli nemocní s poruchou zraku a sluchu bez možnosti použít kompenzační pomůcky (brýle, sluchadla).
Skupina A byla tvořena 149 nemocnými s CMP v levé dominantní hemisféře s afázií (ověřenou logopedickým vyšetřením). Šlo o 74 žen a 75 mužů, věk 68; 19 – 95 let (medián; rozptyl). Do souboru nebyli zařazeni pacienti s preexistující demencí zjištěnou pomocí BDS. Detailní vstupní a vylučující kritéria byla popsána v předcházející publikaci [8].
Skupina B byla tvořena 52 nemocnými s demencí, kteří splňovali kritéria demence dle DSM ‑ IV a dosáhli skóre Addenbrookského kognitivního testu (ACE) < 82 bodů. Šlo o 26 mužů a 26 žen, o průměrném věku 74; 41 – 84 let (medián; rozptyl). Demografické charakteristiky skupiny B s uvedením typu demence jsou shrnuty v tab. 1. Dle tíže demence bylo možné skupinu rozdělit na podskupinu Ba s lehkou až střední demencí (ACE skóre 30 – 82: lehká až střední demence), u devíti nemocných bylo ACE skóre ≤ 29 a MMSE < 10 (těžká demence). Etiologicky šlo u 22 nemocných o Alzheimerovu demenci (AD, podskupina Bb), u 12 o vaskulární demenci (VD), u sedmi o demenci v rámci Parkinsonovy nemoci (PD), u devíti o kombinaci AD + VD (smíšená demence), u jednoho o frontotemporální demenci (FTD) a u jednoho o demenci u progresivní supranukleární obrny (PSO, 30 nemocných tvořilo podskupinu Bc s demencí non‑AD typu) (tab. 1). Nezařazeni byli nemocní s vaskulární demencí multiinfarktového typu s infarktem v dominantní hemisféře o rozsahu minimálně 1/ 3 povodí a. cerebri media nebo s anamnézou afázie, alexie nebo agrafie.
Table 1. Základní charakteristika a data souboru B nemocných s demencí. 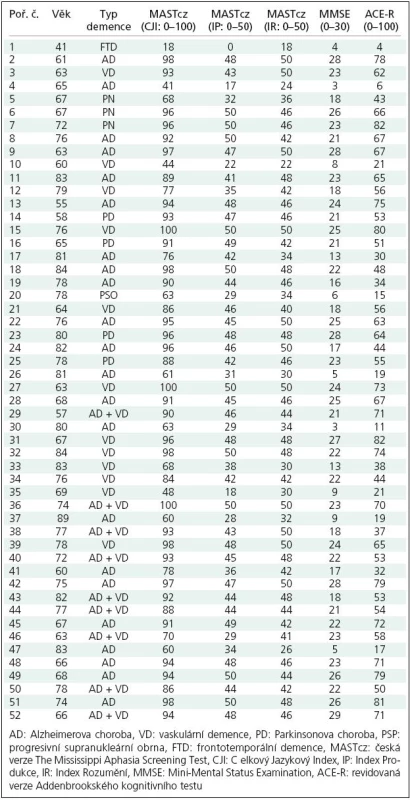
Informovaný souhlas před zahájením studie podepsali nemocní, případně jejich zákonní zástupci. Projekt byl schválen Etickou komisí LF MU a Etickou komisí FN Brno.
Statistické metody
Distribuce hodnot jazykových indexů v sou-borech A a B byla hodnocena pomocí testu Kolmogorov ‑ Smirnov. Porovnání hodnot jazykových indexů ve skupině As afázií se skupinou B s demencí a dále s podskupinami Ba, Bb a Bc bylo vzhledem k non‑normální distribuci provedeno neparametrickým U testem Mann‑-Whitney. Validita (senzitivita a specificita) hlavních parametrů MASTcz (CJI, IP a IR) v diskriminaci mezi skupinou nemocných s CMP a afázií a demencí na základě stupně jazykového deficitu byla stanovena metodou Receiver Operating Curve (ROC) analýzy za použití webového kalkulátoru [17] pro zjištění optimální křivky, SPSS software (verze 17.02) pro výpočet Area Under Curve (AUC) a testování významnosti, a MedCalc software (verze 11.1.0.0) pro výpočet konfidenčních intervalů pro senzitivitu a specificitu. Skupina A byla porovnána jednak s celou skupinou B s demencí a dále odděleně s podskupinami Ba, Bb a Bc.
ROC analýza oproti standardní metodě stanovení jedné normální limitní hodnoty (cut‑off) a následného určení senzitivity a specificity testu umožňuje na základě ROC křivky nalézt optimální cut‑off hodnotu pro potřebu daného testu.
Výsledky
Skupina nemocných se syndromem demence (B), zejména pak podskupina nemocných s lehkým až středním stupněm demence (Ba), ale i podskupiny Bb a Bc vykazovaly statisticky významně vyšší hodnoty jazykových indexů MASTcz (CJI, IP, IR) ve srovnání se skupinou nemocných s afázií u CMP (A) (p < 0,001) (tab. 1, 2). Pomocí ROC analýzy bylo možné na základě tíže afázie významně diskriminovat skupinu As CMP a afázií od skupiny B s demencí i podskupin Ba, Bb a Bc (obr. 2, tab. 3).
Table 2. Sumární výsledky testu MASTcz. 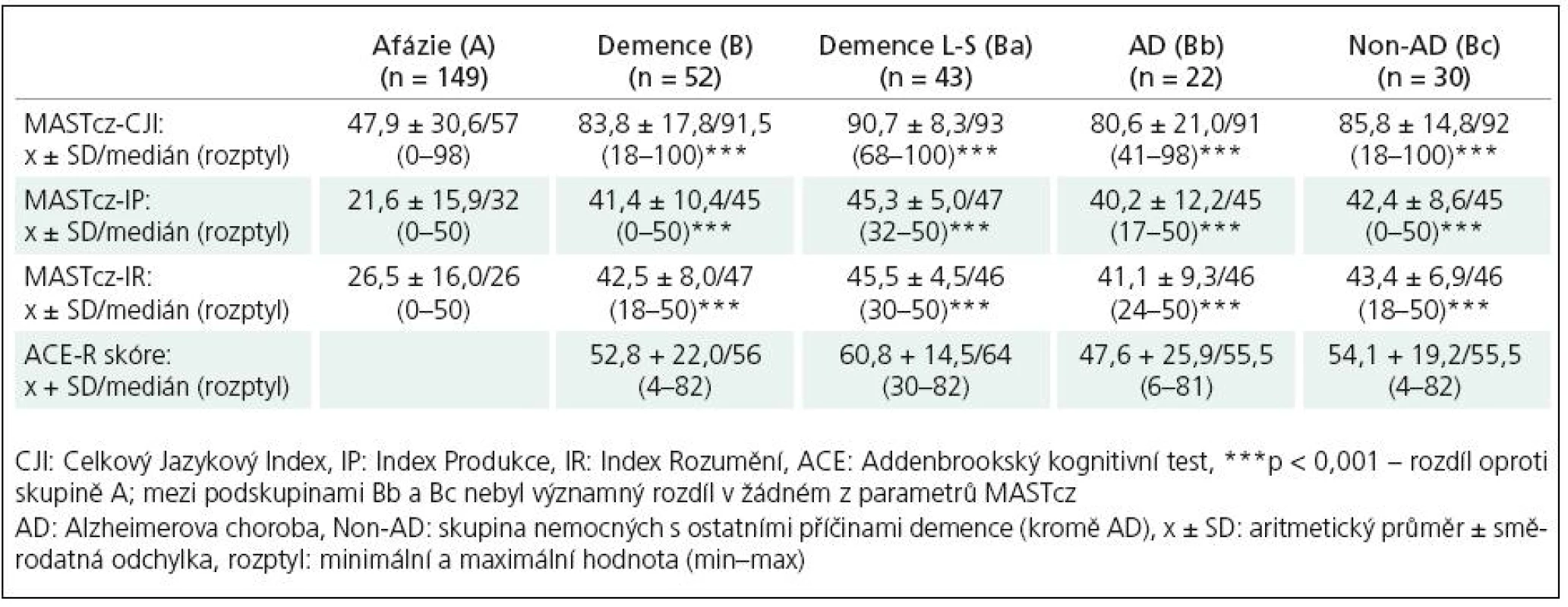
Image 1. Křivky „Receiver Operating Characteristics“ (ROC) analýzy. 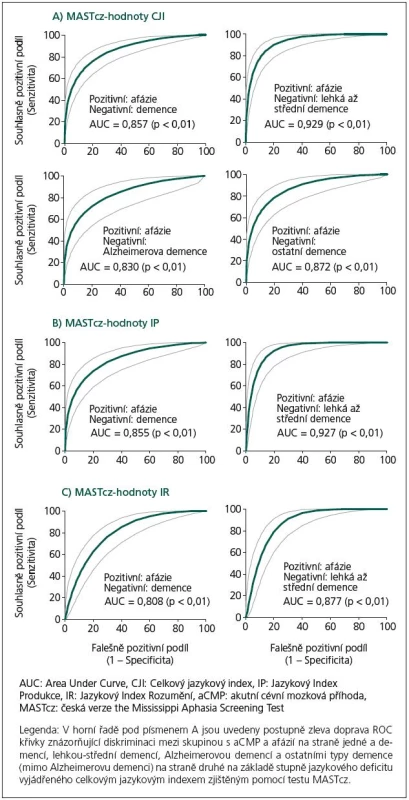
Table 3. Výsledky ROC analýzy. 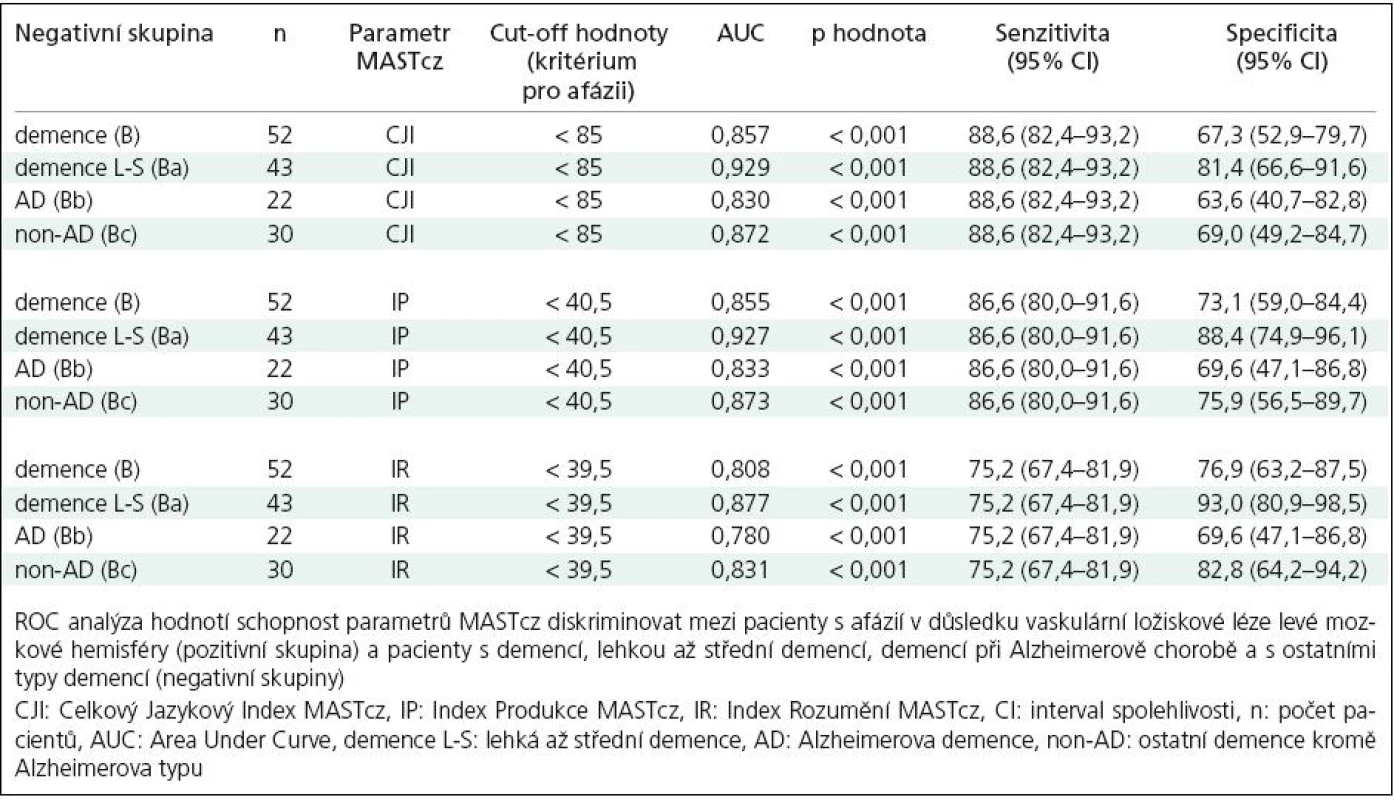
Při použití optimální cut‑off hodnoty celkového jazykového indexu (CJI) < 85 bodů jako kritéria pro přítomnost afázie bylo možné odlišit skupinu A(CMP) (131 ze 149 nemocných splnilo zvolené kritérium afázie) od skupiny B s demencí (16 z 52 nemocných s demencí splnilo kritérium afázie, senzitivita 88,6 %, specificita 68,3 %). Při diskriminaci mezi skupinami A a Ba (lehká až střední demence) se specificita zvýšila na 81,4 % při stejné senzitivitě: 6 z 43 nemocných splnilo kritéria afázie, hodnoty ACE 30 – 56, nejnižší zjištěná hodnota CJI byla 68. O něco nižší diskriminační schopnost než CJI měly další indexy MASTcz: IP a IR (obr. 2, tab. 3).
U všech nemocných s těžkou demencí (ACE ≤ 29) hodnoty indexů MASTcz splňovaly zvolené kritérium pro afázii (byly nižší než zvolená cut‑offs) včetně nemocné s temporální variantou FTD charakteru progresivní nonfluentní afázie, u dalších šlo o AD (5×), VD (2×) a PSP (1×, šlo o nemocného v pokročilém stadiu onemocnění). Nejvyšší hodnota MASTcz - CJI v této podskupině demencí byla 63.
Při porovnání stupně jazykového deficitu samostatně v podskupinách s demencí typu AD a non‑AD (podskupiny Bb a Bc) se hodnoty indexů MASTcz významně nelišily (tab. 2) a diskriminace oproti skupině nemocných s CMP s afázií byla pro obě podskupiny demencí obdobná (tab. 3, obr. 2).
Diskuze
Komunikační deficit u demencí je velmi variabilní, liší se u jednotlivých typů demencí a postihuje i nonverbální složku komunikace. Rousseaux et al [18] pomocí the Lille Communication test prokázali rozdíly v komunikačních deficitech u různých typů demencí: signifikantní deficit v motivaci ke komunikaci, verbální i nonverbální komunikaci oproti kontrolní skupině prokázali u pacientů s FDT, u AD pouze ve verbální komunikaci, zatímco u demence s Lewyho tělísky a mírného kognitivního deficitu byly komunikační schopnosti relativně zachovány. Výsledky ve všech doménách Lilleského testu korelovaly s výsledkem Mattisovy škály a MMSE. Uzavírají, že tíže komunikační poruchy souvisí s predilekční lokalizací léze prefrontálně u FTD a AD.
Jazykový deficit je přítomen jako hlavní symptom v iniciálním stadiu AD u 8 – 10 % nemocných [19,20] a je prakticky vždy přítomen v pokročilém stadiu AD [21]. Originální pacientka Alzheimerova [21] – Auguste D. – měla signifikantní jazykový deficit, stejně jako pacient Pickův [22] – August H. Arnold Pick v článku publikovaném v německy psaném medicínském časopise vydávaném v Praze označil tento deficit jako afázie [22].
Teoreticky lze předpokládat, že pomocí některého z testových nástrojů konstruovaných tak, aby zachytil a kvantifikoval specifické jazykové poruchy a minimalizoval komponenty paměti a verbální inteligence, bude možné diskriminovat většinu případů afázií v důsledku ložiskové léze jazykových center od jazykového deficitu u demence, zejména s lehčím stupněm kognitivního deficitu. Tyto dvě skupiny budou mít pravděpodobně nejen různou tíži, ale i profil jazykových deficitů. U demence bude patrně méně narušena fonologická a syntaktická rovina jazyka (např. nižší až téměř chybějící výskyt parafázií a agramatizmů) a naopak více narušena sémantika a lexikon (poruchy pojmenování a porozumění řeči), zatímco u afázie v důsledku ložiskové léze jsou narušeny všechny složky, i když v různé míře.
Takovým nástrojem je potenciálně Western Aphasia Battery (WAB) [23], zřejmě nejpoužívanější standardizovaná hodnotící škála pro kvantifikaci a klasifikaci jazykového deficitu. V rámci standardizace WAB u Alzheimerovy demence Appell et al [21] porovnali výsledek WAB u 25 nemocných s AD a 141 nemocných s afázií v důsledku CMP. Průměrný kvocient afázie byl ve skupině s AD dokonce nižší (50,1 bodů) oproti skupině s afázií vaskulární etiologie (53,5 bodů), šlo však o skupinu nemocných v pokročilém stadiu AD. Skupina s AD měla signifikantně vyšší skóre fluence a nižší skóre porozumění. Poruchy charakterizované primárně nižší fluencí (Brocova a transkortikální motorická afázie) byla pouze v 5 %, zatímco 44 % splňovalo kritéria Wernickeovy či transkortikální senzorické afázie. Při pozdější analýze [24] byly průměrné hodnoty afatického kvocientu podstatně jiné a vyšší než u většiny nemocných s afázií: u 93 pacientů s AD: 86,0 a po dvou letech 78,7; u 44 pacientů s primární progresivní afázií: 73,0 a 60,0; u PFD (17 pacientů): 80,9 a 62,9. Horner et al prokázali, že pomocí WAB za použití kvocientů psaní a čtení je možné diskriminovat Alzheimerovu demenci od afázie v důsledku fokálních cévních syndromů [7].
Na rozdíl od WAB je MAST podstatně méně časově náročnější, určený i pro nelogopedy, jehož hodnoty přitom významně korelují s hodnotami WAB [8]. MAST přitom umožňuje kvantifikaci jazykového deficitu a na rozdíl od WAB je k dispozici standardizovaná česká verze [8,11] s výbornou schopností diskriminace afázií oproti kontrolní skupině (senzitivita 96,6 %; specificita 96,7 %) i oproti cévním lézím pravé hemisféry (senzitivita 90,6 %; specificita 97,8 %) [8].
V naší práci jsme prokázali, že u demencí až do počínajícího těžkého stadia zůstávají jazykové deficity relativně lehké ve srovnání s afáziemi v důsledku ložiskových lézí dominantní hemisféry. Tento kvantitativní rozdíl umožňuje pomocí testu MASTcz diskriminovat mezi samostatnou afázií v rámci ložiskové léze v dominantní hemisféře a afázií u demence. Tento rozdíl byl významný i přes fakt, že ve skupině s CMP nebylo možné spolehlivě vyloučit koincidenci demence. Do skupiny A jsme sice nezařadili nemocné s abnormálním skóre BDS, avšak tento test se týká spíše aktivit denního života či jiných aspektů než vysloveně kognitivního testování, které u nemocného s afázií provést nelze.
U žádného z nemocných s demencí s lehkým nebo středním stupněm kognitivního deficitu (ACE ≥ 30) neklesla hodnota CJI MASTcz pod 68, což lze využít prakticky v případě podezření na koincidenci demence a ložiskové léze dominantní hemisféry. Obě skupiny (ložiskové léze a demence) se nelišily v tíži jazykového deficitu v případě těžkých demencí (ACE < 30) s těžkým celkovým kognitivním deficitem, kde je obvykle přítomna komplexní kognitivně‑komunikační porucha. Lze spekulovat o tom, do jaké míry je nízké skóre MASTcz ovlivněno výlučně jazykovým deficitem a nikoli poruchami dalších kognitivních funkcí.
Oproti teoretickým předpokladům, podle kterých u kortikálních demencí, zejména kortikálního typu, resp. s predilekčním postižením ve frontotemporální oblasti, lze očekávat časnější a těžší jazykový deficit typu afázie, jsme i ve skupině nemocných s demencí Alzheimerova typu zjistili obdobný stupeň jazykového deficitu jako u ostatních demencí, a to i přes obdobnou tíži kognitivního deficitu (tab. 2). Odpovídá to však pracím, které rozdíl ve výskytu afázie mezi kortikálními a subkortikálními demencemi nenalezly [25]. Výsledky však mohly být ovlivněny relativně malým rozsahem a ne zcela reprezentativním složením našeho souboru s demencí z hlediska jejich typu, resp. etiologie. Naše výsledky nelze rovněž generalizovat na formy demence, pro které je typický iniciální jazykový deficit – zejména varianty frontotemporální demence – primární progresivní afázii a sémantickou demenci [4]. Jediný nemocný s FTD měl nízké skóre CJI MASTcz: 18.
Z hlediska patofyziologie poruch komunikace u demencí a jejich praktické diferenciace oproti příbuzným stavům je kromě kvantitativních rozdílů ještě důležitější kvalitativní analýza jazykového deficitu a dalších složek poruch komunikace, která vyžaduje jiné diagnostické nástroje.
Závěr
U nemocných s demencí až do počínajícího těžkého stadia zůstávají jazykové deficity relativně lehké oproti pacientům s afázií u CMP. Při zjištění těžší fatické poruchy pomocí MASTcz (CJI < 68) u nemocného s demencí s lehkým až středním kognitivním deficitem (ACE ≥ 30) je třeba pomýšlet na možnost ložiskové cévní léze v dominantní hemisféře v rámci multiinfarktové demence nebo na koincidenci demence a ložiskového postižení dominantní hemisféry.
PhDr. Milena Košťálová
Neurologická klinika LF MU a FN Brno
Jihlavská 20,
625 00 Brno
e-mail: mkostal@fnbrno.czPřijato k recenzi: 15. 1. 2010
Přijato do tisku: 15. 3. 2010
Sources
1. Glosser G, Kaplan E. Linguistic and nonlinguistic impairments in writing: a comparison of patients with focal and multifocal CNS disorders. Brain Lang 1989; 37(3): 357 – 380.
2. Chapey R, Patterson PJ. Assesment of Language Disorders in Adults. In: Chapey R (ed). Language Intervention Strategies in Aphasia and Related Neurogenic Communication Disorders. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 64 – 160.
3. Hopper T, Bayles KA. Management of neurogenic communication disorders associated with dementia. In: Chapey R (ed). Language Intervention Strategies in Aphasia and Related Neurogenic Communication Disorders. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 988 – 1008.
4. Rektorová I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/ 105(2): 97 – 109.
5. Appell J, Kertesz A, Fisman M. A study of language functioning in Alzheimer patients. Brain Lang 1982; 17(1): 73 – 91.
6. Nickels L, Croot K. Progressive language impairments: Intervention and management. Editorial. Aphasiology 2009; 23 : 123 – 124.
7. Horner J, Dawson DV, Heyman A, Fish AM. The usefullness of the Western Aphasia Battery for differential diagnosis of Alzheimer dementia and focal stroke syndromes: preliminary evidence. Brain Lang 1992; 42(1): 77 – 88.
8. Kostálová M, Bártková E, Sajgalíková K, Dolenská A,Dusek L, Bednarík J. A standardization study of the Czech version of the Mississippi Aphasia Screening Test (MASTcz) in stroke patients and control subjects. Brain Injury 2008; 22(10): 793 – 801.
9. Nakase ‑ Thompson R, Manning E, Sherer M, Yablon SA, Vickery C, Harris C et al. Bedside screen of language disturbance among acute care admissions: Initial psychometrics of the Mississippi Aphasia Screening Test. Arch Clin Neuropsychol 2002; 17(8): 848.
10. Nakase ‑ Thompson R, Manning E, Sherer M, Yablon SA, Gontkovsky SLT, Vickery C. Brief assessment of severe language impairments: Initial validation of the Mississippi aphasia screening test. Brain Injury 2005; 19(9): 685 – 691.
11. Košťálová M, Bednařík J. Screening afázie: MASTcz. Dostupné z URL: http:/ / www.fnbrno.cz/ Article.asp?nDepartmentID=1355&nArticleID=2298&nLanguageID=1.
12. Blessed G, Tomlinson BE, Roth M. The association between quantitative measures of dementia and of senile change in the cerebral grey matter of elderly subjects. Br J Psychiatry 1968; 114(512): 797 – 811.
13. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed. Text revision. Washington, DC: American Psychiatric Association 2000.
14. McKhann G, Drachman D, Folstein M, Katzman R,Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS ‑ ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34(7): 939 – 944.
15. Ressner P, Hort J, Rektorová I, Bartoš A, Rusina R, Línek V et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/ 104(4): 494 – 501.
16. Hummelová - Fanfrdlová Z, Rektorová I, Sheardová K,Bartoš A, Línek V, Ressner P, Zapletalová J, Vyhnálek M, Hort J. Česká adaptace Addenbrookského kognitivního testu. Cesk psychol 2009; 53(4): 376 – 388.
17. Eng J. ROC analysis: web‑based calculator for ROC curves. Baltimore: Johns Hopkins University [updated 2006 May 17; cited 2008 February 20]. Dostupné z URL: http:/ / www.jrocfit.org.
18. Rousseaux M, Sève A, Vallet M, Pasquier F, Mackowiak Cordoliani MA. An analysis of communication in patients with dementia. J Neurol 2008; 255 (Suppl 2): 46 – 47.
19. Kertesz A, Appell J, Fisman M. The dissolution of language in Alzheimer’s disease. Can J Neurol Sci 1986; 13 (Suppl 4): 415 – 418.
20. Faber ‑ Langendoen K, Morris JC, Knesevich JW, LaBarbe E, Miller JP, Berg L. Aphasia in senile dementia of the Alzheimer type. Ann Neurol 1988; 23(4): 365 – 370.
21. Alzheimer A. On a peculiar disease of the cerebral cortex. Allgemeine Zeitschrift fur Psychiatrie 1907; 64 : 146.
22. Pick A. Über die Beziehungen der senilen Hirnatrophie zur Aphasie. Prager Medizinische Wogenschrift 1892; 17 : 165 – 167.
23. Kertesz A. Western Aphasia Battery. New York: Grune & Stratton 1982.
24. Blair M, Kertesz A, McMonagle P, Davidson W, Bodi N. Quantitative and qualitative analyse of clock drawing in FTD and AD. J Int Neuropsychol Soc 2006; 12(2):159 – 165.
25. Kramer JH, Duffy JM. Aphasia, apraxia, and agnosia in the diagnosis of dementia. Dementia 1996; 7(1): 23 – 26.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 3-
All articles in this issue
- Poraněný torakolumbální disk – indikace k náhradě předním přístupem podle magnetické rezonance
- Porovnání tíže afázie u demence a cévní mozkové příhody pomocí MASTcz a její vztah k tíži kognitivního deficitu
- Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Změny na perfuzní počítačové tomografii po konvenčním extra‑ intrakraniálním bypassu
- Zlomeniny pátého bederního obratle
- Sexuální dysfunkce a jejich výskyt u pacientů s epilepsií
- Využití regionální mozkové oxymetrie jako neinvazivní metody ke sledování pacientů v neurointenzivní péči
- Zhodnocení výsledků operací karotických tepen v letech 1997– 2009
- Chirurgická léčba neuroepitelových nádorů na přední straně kosti křížové – kazuistiky
- Komplikovaná herpetická nekrotizující meningoencefalitida s nutností neurochirurgické intervence – kazuistika
- Spondylogenní cervikální myelopatie
- Vyšetřovací metody cerebrovaskulární rezervní kapacity v nukleární medicíně a ostatní komplementární metody
- Thunderclap headache
- Kompletní úprava sluchu u vestibulárního schwannomu s opakovanou náhlou ztrátou sluchu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spondylogenní cervikální myelopatie
- Zlomeniny pátého bederního obratle
- Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Komplikovaná herpetická nekrotizující meningoencefalitida s nutností neurochirurgické intervence – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

