-
Medical journals
- Career
Spondylogenní cervikální myelopatie
: Z. Kadaňka
: Neurologická klinika LF MU a FN Brno
: Cesk Slov Neurol N 2010; 73/106(3): 209-226
: Minimonography
Spondylogenní cervikální myelopatie je závažné onemocnění míchy, které je zatím nedostatečně diagnostikováno, i když jde o nejčastější netraumatickou myelopatii u lidí starších 14 let (častější než sclerosis multiplex či nádory míchy). Je vyvolána rozvojem krční spondylózy, která zahrnuje kostní, fibrózní i kartilaginózní struktury krční páteře, jež vedou ke statickému či dynamickému útlaku míchy a jejích cév. Klinický obraz i průběh jsou silně variabilní. Z diagnostických prostředků jsou nejlepší MR a myelo/ CT. Terapie této potenciálně devastující nemoci je dosud neuspokojivá, protože nejsou známy indikační faktory pro konzervativní nebo chirurgickou léčbu a není známo optimální načasování operačního výkonu. Autoři shrnují historické a současné poznatky o této nemoci a přidávají své zkušenosti s její diagnostikou a léčbou.
Klíčová slova:
cervikální myelopatie – cervikální spondylóza1. Historické poznámky
Při zpracovávání historických kořenů jednotlivých jevů se obvykle snažíme najít toho jedince, tu událost, tu zlomovou změnu, která vedla k rozvoji studovaného jevu. Předpokládáme, že musel být přece někdo, kdo na to přišel (vynalezl kolo, přenos obrazu, počítač). Znovu a znovu jsme však překvapováni tím, že každá taková událost nevzniká náhlým vnuknutím při prozření skvělého jedince, ale každý objev či zlom je podmíněn bolestnými, pomalými, drobnými a často nezajímavými pokroky jeho předchůdců. Když se tedy snažíme najít ten skok, objevíme spíše nikdy nekončící plynulou řadu, ze které skok můžeme udělat jen tím, že jsme tu řadu přehlédli nebo nehledali. Za otce medicíny je považován Hippokratés (pravděpodobně 460–377 př. n.l.), ale ve skutečnosti nevíme, zda se jednalo o jednoho člověka, či více lidí téhož jména. Není nám rovněž známo, zda je autorem některé či žádné knihy z tzv. Hippokratovy sbírky (Corpus Hippocraticum), která obsahuje asi 60 prací psaných různým stylem v období přesahujícím více než sto let a kterou antičtí písaři sestavili v Alexandrii o 200 let později do jednoho svazku. Jde pravděpodobně o soubor prací (lékařská knihovna) medicínské školy z řeckého ostrova Kos, který byl centrem Asklepiovy sekty. Jiným důkazem chybění pokroku bez mnoha pomalých předchozích kroků je dlouhé období po pádu říše římské, kdy se pokrok výrazně zpomalil až téměř zastavil, i když se nepochybně rodili další geniální jedinci. Navíc ani nemůžeme vědět, co všechno bylo vykonáno, protože ne vše bylo zapsáno. To nikterak neznamená, že by byla podceňována úloha mimořádně nadaných jedinců ve vývoji vědeckých poznatků, ale je třeba zařadit na adekvátní místo zdánlivě drobnou, mravenčí práci – skutečný základ pokroku – a upozornit na její nezbytnost a důležitost. Následující výčet poznatků o onemocněních páteře, zvl. krční, s vědomím výše zmíněného, si nedělá nárok na úplnost, je mozaikovitý, ale snad výstižný.
Význam krční spondylózy jako příčiny paraparézy či kvadruparézy byl detailně rozpoznán a postulován až od 50. let minulého století [1]. Nicméně první poznatky o vztahu krční páteře a míchy a jejich patologii byly popsány již v nejstarších písemných záznamech. Vždy se však týkaly spíše případů poranění páteře.
První případ paraplegie vzniklé po traumatu krční páteře byl zaznamenán v Egyptě Imhotepem (3686 – 2613 př. n. l.) na papyru Edwina Smithe před více než 4 500 lety. Imhotep popsal luxace, subluxace a dislokace krčních obratlů. Dokázal rozlišit poranění horní části krční míchy, která vedou ke kvadruplegii, poruchám čití na všech končetinách a pomočování, a dolní části vedoucí k paraplegii dolních končetin. Autor poznamenává, že jde o neléčitelnou nemoc.
Hippokratova medicínská škola (460 až 375 př. n. l.) z předvědeckého období lékařství, která začala v magicko‑náboženském systému myšlení zavádět prvky racionality, spojovala poranění hlavy s poraněním krční páteře a znala principy trakcí. Galén – řecký učenec z Pergamonu (asi 129 – 199 n. l.), hlavní lékař skupiny gladiátorů, dospěl svým přesným pozorováním a pitvami lidí i zvířat (afrických opic) ke stejným poznatkům jako Imhotep; popsal deformity páteře a označil je jako skolióza, kyfóza a lordóza a snažil se je aktivně korigovat. Prováděl také vivisekce, při kterých přerušil míchu a studoval vliv tohoto zásahu na funkci svalů. Řecký lékař Pavel z Aeginy (asi 625 – 690 n. l.) provedl první laminektomii u poranění krční páteře a zavedl používání dlah u fraktur páteře. Další úspěšnou laminektomii uskutečnil až v roce 1829 Alban Smith z Kentucky. Andry (1658 – 1742) popsal muskuloskeletální systém a zavedl termín ortopedie. Zdůrazňoval význam cvičení na funkci páteře a důležitost podpůrných aparátů k nápravě skolióz. Od něj pochází symbol zkřiveného stromku přivázaného k rovnému kůlu.
James Parkinson (1817) se domníval, že příznaky, dnes známé jako parkinsonské, jsou způsobeny onemocněním, které postihuje krční páteř i míchu a pak postupuje do prodloužené míchy. Key (1838) ve své práci o paraplegii popsal dva případy degenerativního zúžení páteřního kanálu, zejména pak osifikaci zadního podélného vazu, který asi o jednu třetinu zužoval míšní kanál. Další úspěšnou operaci krční páteře po Albanu Smithovi provedl Horsley (1892) u mladého muže, který ochrnul po pádu na rameno; při operaci byla nalezena míšní komprese kostní strukturou vycházející ze šestého krčního obratle (Taylor, Collier, 1901). Gowers (1892) popsal kostní exostózy vycházející z obratlových těl komprimujících míchu a míšní kořeny. „Osteoartritické“ kompresivní syndromy byly častěji publikovány na přelomu století [2]. Elliot (1926) byl patrně prvním autorem po Gowersovi, kdo popsal spondylózu krční páteře, která může vést k útlaku kořenů. Stookey [3] a mnoho dalších po něm považovali míšní kompresi výhřezem meziobratlového disku za extradurální chondromy. Rozpoznali, že většina postižených krční spondylózou jsou muži ve středním věku (průměr byl 53 let). Dandy [4] zjistil, že tumor „chondroma“ odstraněný z bederního kanálu je vlastně uvolněný chrupavčitý materiál z ploténky. V publikaci se však dopustil chyby tím, že hovořil o tumorech. Použil sice tento termín v obecném smyslu slova a neměl na mysli neoplazma. To nicméně způsobilo, že jeho článek nevyvolal velký zájem odborné veřejnosti. Peet a Echols [5] byli podle Braina et al první [1], kdo tyto často popisované extradurální chondromy a ekchondrózy rozpoznali jako výhřezy meziobratlového disku. Histologicky šlo o nález několika kartilaginózních buněk rozesetých v acelulární matrix. Nenašli nic, co by svědčilo pro zánět či nádor. Podobné pozorování udělali Mixter a Barr [6] a přednášeli o tom v následujícím roce v odborné společnosti. Jejich článek publikovaný v roce 1934 získal světový ohlas. Tím zahájili novou éru zájmu o vertebrogenní nemoci, a především zájem chirurgů o odstraňování vyhřezlých meziobratlových disků. Bull (1948) upozornil na význam degenerace Luschkeových (unkovertebrálních) kloubů a zdůraznil, že osteofyty v neuroforaminech neznamenají vždy kompresi kořene a že naopak nález normálních neuroforamin na nativních rentgenových snímcích nemusí znamenat nepřítomnost této komprese.
Frykholm [7] rozlišil dva odlišné typy protruze disku. Jednak výhřez měkkého jádra (nucleus pulposus) přes trhlinu v anulus fibrosus, jednak protruzi anulus fibrosus, která může být lokalizovaná nebo difuzní. Výhřez nucleus pulposus (měkký výhřez) se může postupně fibrózně a kartilaginózně přeměnit a mohou se v něm objevit kalcifikace. Rozlišil i směr výhřezů disku na dorzomediální (komprese míchy), paramediální (unilaterální komprese míchy), dorzolaterální (komprese kořene), laterální (komprese a. vertebralis a vertebrálních vén) a přední výhřez (většinu asymptomatický). Často se kombinují dva nebo více směrů těchto výhřezů.
Brain et al [1] popsali podrobně klinický obraz 45 nemocných s krční spondylózou. Z nich mělo 38 míšní kompresi a sedm kompresi kořenovou. Mair a Druckman [8] usuzovali, že myelopatie je způsobena útlakem arteria spinalis anterior a jejich větví, což vede především k lézi předních míšních rohů, laterálních provazců a předních částí zadních provazců. Podle Taylora [9] se na míšní kompresi podílí také nařasené ligamentum flavum.
Skupina nemocných se spondylogenní cervikální myelopatií (SCM) publikovaných Brainem et al [1] byla léčena konzervativně i chirurgicky. Konzervativní léčba spočívala v klidu na lůžku, imobilizaci krku a fyzioterapii. Chirurgickou léčbu představovala oboustranná laminektomie. Autoři si uvědomovali, že při laminektomii není možné odstranit osteofyty ležící před míchou bez jejího poranění a operace měla pouze dekompresivní ráz. Jejich výsledky lze z moderního hlediska hodnotit obtížně vzhledem k tomu, že studie nebyla prospektivní, nebyl kvantifikován stupeň klinického postižení a metodika vyhodnocení nebyla přesněji popsána. Autoři však doporučovali léčit lehčí formy konzervativně (nebo alespoň zkusit tříměsíční konzervativní postup) a těžší, progredující a krátce trvající léčit chirurgicky. Clark a Robinson [10] zjistili na souboru 120 nemocných se spondylogenní cervikální myelopatií, že výsledky léčby nejsou uspokojivé. Doporučovali (podobně jako Brain et al [1]) léčbu začít imobilizací krku límcem a laminektomii rezervovat pro případy progredující i přes konzervativní léčbu.
K odstranění příčin intraspinální komprese se původně používaly zadní přístupy, které byly popsány již od 16. – 18. století, a první laminektomie pro intraspinální tumor byla povedena v 19. století. Spondylogenní cervikální myelopatie byla poprvé operována zadním přístupem až v 50. letech 20. století. Byly prováděny čtyři typy laminektomií: prostá, laminektomie s otevřením dury, laminektomie s přetětím ligamenta dentata a laminektomie s odstraněním disku, ale výsledky nebyly uspokojivé.
V letech 1950 – 52 zavedli Bailey a Bad-gley výhodnější fúzi obratlů předním přístupem místo dosud prováděné fúze zadní, o které se předpokládalo, že je spojena s rizikem nestability a neschopností zabránit pozdním komplikacím [11]. V roce 1955 Robinson a Smith [12] popsali přední přístup operací krční páteře pro spondylózu přes meziobratlovou ploténku, v roce 1958 Ralph Cloward [13] pak kulatý štěp pro fúzi předních krčních obratlů, v roce 1960 Hirsch [14] přední diskektomii bez fúze, v roce 1971 Hattori začal léčit tyto komprese laminoplastikou. Cílem laminoplastiky oproti laminektomii bylo zabránit pooperační invazi polaminektomické membrány do páteřního kanálu, což vedlo k pozdnímu zhoršení myelopatie.
Laminoplastika Z - tvaru spočívá v tom, že se lamina obrousí vzduchovou vrtačkou a provede se řez typu písmene Z do takto zeslabené laminy, aniž se exciduje (na rozdíl od laminektomie). Rozšíří se tím páteřní kanál, ale významně se nesníží stabilita páteře, protože se zachová kostěná ochrana. Hirabayashi et al v roce 1977 zavedli technicky jednodušší expanzivní open-door laminoplastiku jednostrannou (lamina se odklopí, jako se otevírají dveře v závěsech) [15]. Další vývoj vedl k zavedení „en bloc“ laminoplastiky“ [16] a Kurokawa et al popsali v roce 1980 „double‑door laminoplasty“, při které se k „otevření dveří“ rozštěpil procesus spinosus [17]. Vzhledem k tomu, že laminektomie v rozsahu 1 – 2 segmentů vykazovaly neuspokojivé výsledky, řadu let se prováděla standardně laminoplastika v rozsahu C3 – 7. V roce 2006 Hosono et al zavedli místo obvyklé laminoplastiky C3 – 7 tuto proceduru v rozsahu C3 – 6 a dosáhli lepších výsledků [18]. K laminoplastice se přistupuje především u stavů, kdy je SCM provázena hyperlordózou a komprese zepředu není příliš výrazná; a dále u lidí vyššího věku s polymorbiditou.
2. Etiopatogeneze
V patogenezi spondylogenní cervikálnímyelopatie se uplatňují následující faktory:
- rozvoj degenerativního procesu páteře (spondylóza),
- vrozená šíře páteřního kanálu,
- cévní zásobení míchy,
- opakovaná drobná traumatizace míchy.
Spondylóza je dlouhodobý degenerativní proces, který postihuje všechny struktury tvořící funkční spinální jednotku (segment) včetně disků, meziobratlových a unkovertebrálních kloubů, obratlových těl a ligament. Může způsobit stenotické změny v páteři takového stupně, že dochází ke kompresi nervových struktur. To vede po vyčerpání kompenzačních mechanizmů k projevům bolesti a poruchám funkce nervového a muskuloskeletálního systému.
2.1. Fyziologie meziobratlové ploténky
Meziobratlové ploténky složené ze dvou částí (měkké jádro a tuhé pouzdro) jsou tvořeny vodou, extracelulární matrix a kolagenem. Jsou nejvyšší v krčním a bederním úseku, kde jsou vystaveny největší mechanické zátěži a pohyb zde dosahuje největšího rozsahu. Všechny disky představují asi jednu čtvrtinu výšky páteře. Nucleus pulposus působí jako absorbér tlaku a nárazů v axiálním směru, které rozloží rovnoměrně do anulus fibrosus a krycích destiček. K tomu jej předurčuje jeho biochemické složení. Má vysoký obsah vody (v raném dětství až 90 %), která je nasáta do glykosaminglykanových proteinů. Ty se skládají z proteoglykanového jádra, na něž jsou přes objemné sférické polysacharidy připojeny chondroitin a keratinsulfát. Část z nich tvoří velké agregáty s kyselinou hyaluronovou; jsou metabolicky aktivnější a více na sebe vážou vodu. Proteoglykany jsou rozmístěny volně v aleolárním stromatu kolagenních vláken typu II, která tvoří 10 – 20 % měkkého jádra, zatímco v pevném pouzdře je kolagenu (typu I) 60 – 70 %. V měkkých jádrech ploténky krčních obratlů je vyšší obsah kolagenu než v jiných částech páteře, což koreluje s jejím větším torzním a střihovým přetížením [19].
Meziobratlový disk je největší avaskulární strukturou v lidském těle. Je zásobován difuzí dvěma cestami. Ta významnější je z krycích destiček, ve kterých se nacházejí cévní pupeny na spojení mezi hyalinní chrupavčitou částí krycí destičky a kostí. Jejich hustota je největší nad nucleus pulposus a směrem k periferii řídne [20]. Méně významné zásobení pochází ze zevní části anulus fibrosus.
Během mechanického tlaku na ploténku dochází k vytěsňování vody. To se projeví např. snížením tělesné výšky během dne (o 1 – 2 cm) a v noci pak nastává nasávání vody zpět. Tento pohyb vody a dalších látek se mimo difuze podílí na nutrici disku.
Ve výživě disku hrají rovněž roli neme-chanické faktory, jako jsou kouření a dia-betes, které ji významně narušují. Snižují sulfátový transport, difuzi kyslíku a zvyšují koncentraci laktátu v měkkém jádru [21]. Zvýšení pH a hladiny laktátu vede k poškození buněčných elementů (chondrocytů) v destičce, zvýšení aktivity degradačních enzymů a ztrátě proteoglykanové matrix.
2.2. Rozvoj spondylózy
Degenerativní proces, který – jak jsme uvedli – postihuje všechny struktury spinálního segmentu, začíná pravděpodobně na meziobratlovém disku. Rozvíjí se s přibývajícím věkem a urychluje různými nepříznivými faktory. Mezi ně patří porucha výživy ploténky a chrupavek (kouření, diabetes), mechanické přetěžování páteře (těžká fyzická aktivita a vibrace), prochlazení, ale také nedostatečná mechanická zátěž, kterou představuje nedostatek pohybu, a zejména úplná imobilizace [22].
V jádru přibývá kolagenních vláken typu I,což vede ke zvýšení tuhosti a snížení jeho elasticity. Zvětšuje se množství glykovaných kolagenních vláken, která mají nejen změněné mechanické vlastnosti, ale mohou také stimulovat buňky včetně chondrocytů k uvolňování cytokinů a proteáz, urychlujících tkáňovou degeneraci [23]. Klesá počet a aktivita fibroblastů. Přibývá rovněž neagregovaných proteoglykanů, velikost agregátů se zmenšuje a snižuje se obsah vody, kterou velké agregáty na sebe vážou. Začíná se stírat původně jasná hranice mezi nucleus pulposus a anulusfibrosus.
Anulární vlákna jsou organizována lamelárně a vytvářejí až 60 vrstev; v každé z nich jsou vlákna orientována v opačném směru. Obsahují méně glykosaminglykanových proteinů, ale více fibrokartilaginózních látek a kolagenu typu I. Při degenerativním procesu dochází k vytvoření trhlin v pevném pouzdře, které mohou pokračovat až na periferii. Celý disk se difuzně vyklenuje a skrze trhliny může docházet k fokálním vyklenutím podmíněným výhřezem měkkého jádra.
Současně dochází ke změnám krycích destiček. Ty sklerotizují, snižuje se množství cév vycházejících z kostní dřeně a zásobujících difuzí ploténky, což dále urychluje degeneraci a narušuje funkci plotének. Kolagenová vlákna, která zpočátku prostupují chrupavku krycí destičky, zmizí a zevní části anulus fibrosus se upínají přímo na kost. V těchto místech dochází později k tvorbě osteofytů. Osteoproduktivní změny spolu s deformací meziobratlových kloubů, které ztrácejí kloubní chrupavku, vedou k zužování páteřního kanálu a neuroforamin [24]. Degenerativní změny nastávají i na meziobratlových kloubech a jejich pouzdrech, unkovertebrálních spojích a ligamentech.
Meziobratlová ploténka je v přední části krční páteře vyšší než v zadní, což podmiňuje krční lordózu. Pokles přední části disku vede pak k vyrovnání lordózy až k případnému kyfotickému zvratu, což je jedna z časných známek spondylózy.
Výhřezy meziobratlových destiček a osteoproduktivní změny mohou směřovat dorzálně (komprese míchy), intraforaminálně (komprese kořenů), laterálně – včetně osteofytů z unkovertebrálních spojení (komprese a. vertebralis a vertebrálních vén) – nebo ventrálně, což je obvykle asymptomatické [7]. Difuzní koncentrické vyklenování meziobratlového disku (anulus fibrosus), které se nachází u nemocných vyššího věku, je třeba odlišovat od fokálních výhřezů, které jsou těžším stupněm degenerace; mají bezprostřední vztah k radikulopatiím.
Hypertrofie a nařasení ligamentum flavum je rovněž součástí degenerativního procesu a zesiluje stenotické tendence [9].
Osifikace zadního podélného vazu (OZPV) byla poprvé popsána u Asiatů a předpokládalo se, že se vyskytuje pouze u nich [25]. Radiologické známky OZPV v krční páteři byly zjištěny u 3,2 % asymptomatické japonské populace starší než 50 roků [26]. Ukázalo se však, že se nacházejí i mimo tuto geografickou oblast. Polovina nemocných s touto afekcí má současně idiopatickou difuzní skeletální hyperostózu – m. Forestier [27]. U nemocných s klinickými projevy SCM je OZPV primární složkou kompresivního procesu ve 27 % případů u japonské populace a v 20 – 25 % v USA [28]. Operační řešení nedává zcela uspokojivé výsledky a onemocnění progreduje i po operačním zákroku u 25 – 80 % nemocných. Nejlépe je osifikace vazu zřetelná na CT snímcích páteře. Při progresi onemocnění dochází k zužování páteřního kanálu a kompresi míchy zepředu. Osifikace může být různého typu – difuzní, fokální nebo smíšená, může mít tvar čtvercový, houbovitý, plošný aj.
Degenerativní změny krční páteře postihují především oblasti C5 – 7, což souvisí s rozložením mechanické zátěže, ale mohou se vyskytnout i ve vyšších etážích (C2 – 5).
Při sledování vlivu fyzické zátěže na rozvoj degenerativních změn bylo zjištěno, že nejmenší změny nastávají u lidí se střední a smíšenou fyzickou zátěží, což odpovídá patofyziologickým poznatkům, a nejmenší výskyt bolestí zad, což je méně srozumitelné, je spojen se sedavým zaměstnáním [29].
2.3. Vrozená šíře páteřního kanálu
Vrozená šíře páteřního kanálu je ovlivňována a řízena geneticky [30]. Průměrná předozadní šíře krčního páteřního kanálu činí v nejužším místě 17 mm, nejširší je kolem FOM (23 mm) a postupně se zužuje ke C4, kde dosahuje oněch 17 mm [31]. Za úzký spinální kanál se považuje stav, kdy sagitální průměr dosahuje 14 – 10 mm [32 – 34,97]. Často je používán jednoduchý index Pavlovové, který je ukazatelem relativní šíře kanálu a hodí se k určení kongenitální (prespondylózní) stenózy (obr. 1). Je to poměr mezi sagitální šíří páteřního kanálu a obratlového těla (C5) na prostém bočním snímku krční páteře. Normální hodnota je 1,0; dolní krajní hodnota je 0,8 [35]. V naší studii jsme zjistili index Pavlovové pod 0,8 u 50 % nemocných s SCM. Příklady vrozeně úzkého a vrozeně širokého kanálu jsou na obr. 2a, b.
1. Index Pavlovové (IP) je jednoduše zjistitelný parametr ke stanovení kongenitálně úzkého páteřního kanálu v krčním úseku. Jde o podíl šíře páteřního kanálu k šíři páteřního těla C5. Normálně dosahuje hodnoty 1, jako kongenitálně úzký kanál se považuje index menší 0,8. Úzký spinální kanál je rizikovým faktorem vzniku neurologických komplikací krční spondylózy, především spondylogenní cervikální myelopatie. 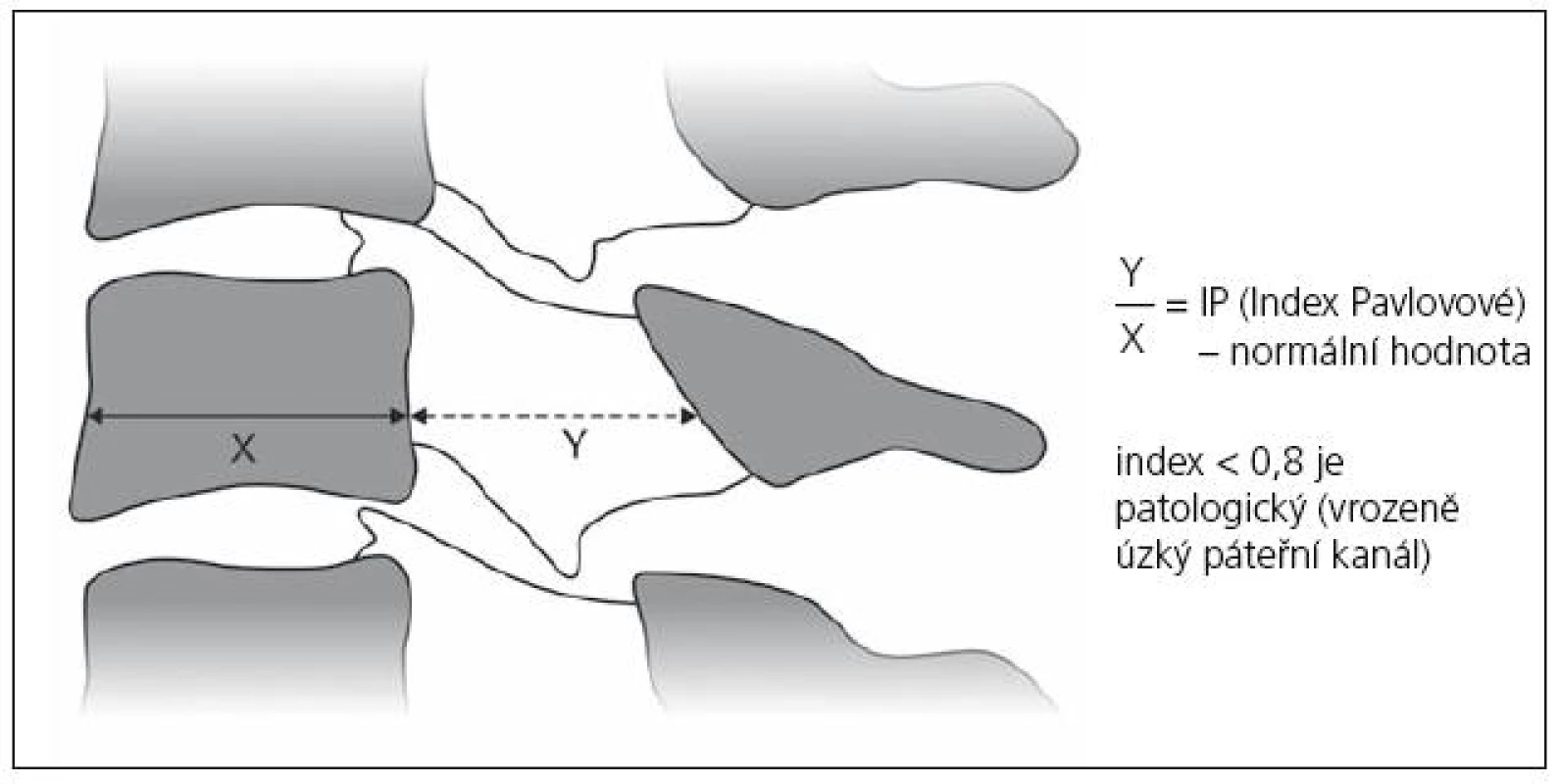
2. a. Ukázka vrozeně širokého páteřního kanálu – IP je 1,3. b. Ukázka vrozeně úzkého krčního páteřního kanálu – IP je 0,7. 
Pokud je kanál kongenitálně úzký, pak i malé degenerativní stenózující změny se projeví klinickou symptomatologií. Ke kongenitálně úzkému prostoru v páteřním kanálu mohou vést také postižení typu Klippel - Feilových deformací a abnormalit cervikokraniálního přechodu pocházející z abnormálního vývoje plodu (bazilární imprese, atlantookcipitální fúze, atlantoaxiální instabilita, malformace zubu epistrofeu, Chiariho malformace).
2.4. Vaskulární faktor
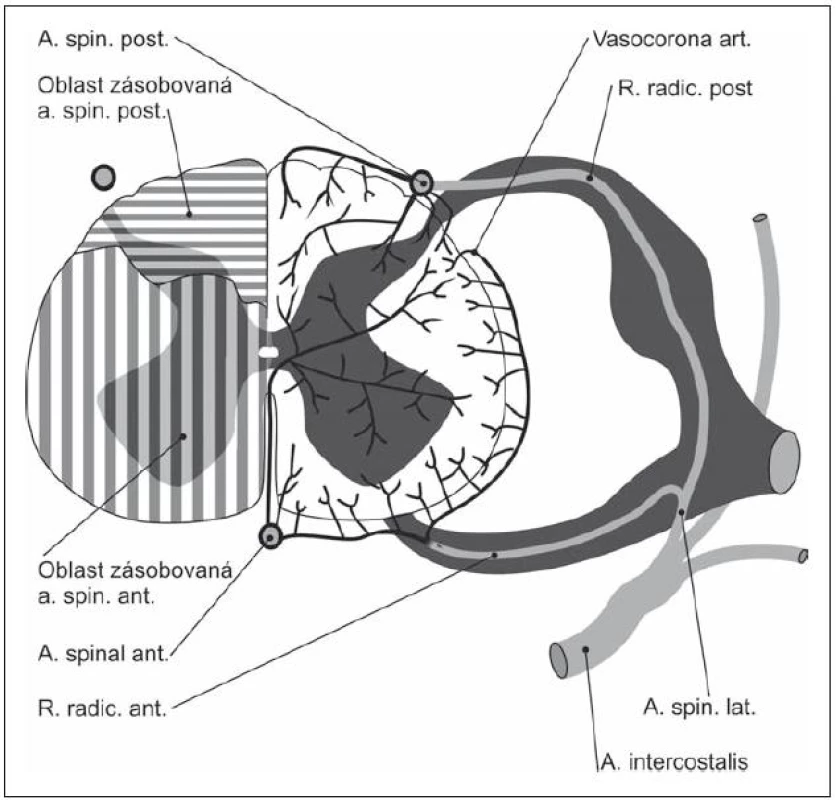
Význam cévního faktoru v rozvoji SCM byl postulován Mairem a Druckmannem [8], kteří předpokládali rozvoj míšního poškození tlakem osteoproduktivních struktur na a. spinalis anterior, jež zásobuje 65 – 70 % míšní tkáně (obr. 3). Někteří autoři uvažují rovněž o kompresi radikulárních cév při fibróze radikulárních pochev komprimovaných degenerativními změnami [36]. Vychází se z podobnosti klinického obrazu SCM a míšních ischemií. Nicméně význam vaskulárního faktoru v genezi SCM není dostatečně dokumentován a nálezy vycházející z možnosti podílu aterosklerotických změn a komprese cév jsou diskrepantní. Nebyla dosud identifikována trombóza a. spinalis anterior u SCM, spíše mechanická komprese vede k poškození jejich sulkálních a terminálních cév [37,38]. Vzhledem k tomu, že komprese a okluze větších spinálních arterií nebyla zjištěna, byl navržen koncept arteriálních spazmů a přechodného či trvalého selhání segmentální vazoregulace [39], zatím však dosud ve fázi hypotetické.
Co silně svědčí proti významu vaskulární složky v patogenezi SCM, je velmi pomalá progrese choroby u velké většiny nemocných. Aterosklerotické změny jsou na míšních cévách u nemocných s SCM vzácné i u těžkých míšních kompresí [40]. V klinické praxi dosud není k dispozici metoda, kterou by bylo možno stanovit podíl cévní složky na rozvoji patogenního procesu.
V klinice se však projevuje jiný aspekt cévního faktoru spočívající v riziku cévní nedostatečnosti ve vertebrobaziálním povodí vedoucí k přechodné nebo trvalé ztrátě zraku během chirurgického výkonu na krční páteři nebo po něm. K ní mohou přispívat rozvinutá ateroskleróza u takového nemocného, nevhodná poloha hlavy při operaci, velikost krevní ztráty, intraoperační hypotenze, kouření, vysoký tlak krevní, diabetes mellitus a vysoká krevní viskozita [41 – 45]. Akutní trombóza aterosklerotické karotidy během přední dekomprese je dalším rizikem pro pacienty s SCM [46,47].
2.5. Mechanický faktor
Při předklonu nebo záklonu hlavy se mícha v páteřním kanálu pohybuje kraniálně a kaudálně [32]. Při hyperextenzi se nařasí ligamenta flava a tlačí na míchu zezadu [48]. Nařasená ligamenta flava komprimují zadní a laterální provazce a vstupní zónu zadních kořenů do míchy. Během záklonu se příčná plocha míchy zvětšuje [49]. Tyto poznatky mohou vysvětlit občasné zhoršení klinických projevů a naopak jejich zklidnění po aplikaci fixačního límce. Příznaky se mohou zhoršovat při flexi hlavy. Mícha se může poranit tím, jak je napínána přes val ventrálních osteofytů. Rychlý nebo pomalý předklon (vzácněji záklon) je pohyb vyvolávající Lhermitteův příznak (pocit elektrických výbojů z krční páteře do trupu a končetin).
Rozvoj SCM je pravděpodobně podmíněn kombinací výše uvedených faktorů přímé komprese míchy s opakovanými drobnými traumaty a kompresí a nedostatečností cévního systému.
3. Rizikové faktory a prevence
3.1. Pracovní zátěž
Fyzická pracovní zátěž je často považována na rizikový faktor vedoucí k rozvoji či urychlení degenerativního procesu na páteři. Jsou to především zaměstnání s velkým nárokem na energii, s nutností zvedání břemen, práce v předklonu, opakované pohyby v páteři, zátěž vibracemi a prochlazení. Získávání přesných údajů o skutečné pracovní zátěži je však mimořádně náročný a složitý úkol. Pracovní zátěž může být měnlivá v průběhu dne, týdne, měsíce či roku, tatáž zátěž je pro určité jedince zátěží velkou, u jiného téměř zanedbatelnou. Získávání dat přímým měřením je nadmíru časově náročné, získávání údajů dotazníkem je zatíženo velkou chybou, protože pracovníci v očekávání případného odškodnění vykazují vědomě či podvědomě nepřesné údaje. Obecně sociálně‑zdravotní opatření vedoucí k odškodňování nemocí, které by mohly souviset s pracovní zátěží, ať již ve formě úlev v práci, krátkodobé či dlouhodobé pracovní neschopnosti nebo vedoucí k získání částečného či plného invalidního důchodu anebo uznání choroby z povolání, způsobují, že značná část nemocných považuje pracovní zátěž za příčinu svých potíží. V jedné studii bylo například zjištěno, že 70,9 % mužů, kteří byli nějakým způsobem odškodněni za svou nemoc (výhřez bederní meziobratlové ploténky), spojovalo její začátek s nějakou speciální náhlou událostí, ve srovnání s 35,5 % mužů, u kterých se o nějakou kompenzaci nejednalo [50]. Jedinci trpící vertebrogenními potížemi bývají zařazeni nebo přeřazeni do zaměstnání s menší fyzickou zátěží. Jejich potíže však přetrvávají nadále, takže se v podniku či odvětví, ve kterém jsou zaměstnanci vystaveni nízké fyzické zátěži, může paradoxně objevit větší počet zaměstnanců s vertebrogenními potížemi než v podniku se zátěží velkou. Tím jsou ovšem zásadně ovlivněny výsledky studií vlivu pracovní zátěže na rozvoj vertebrogenních potíží, které mohou vést k nesprávným závěrům a nesprávným doporučením. Všechny tyto faktory je třeba mít na mysli při hodnocení parametrů pracovní zátěže na vznik a rozvoj vertebrogenních chorob.
Většina studií ukazuje, že těžká fyzická práce je rizikový faktor pro vznik bolestí zad. Tyto studie jsou především soustředěny na nejčastější onemocnění páteře, kterými jsou lumbalgie, nicméně degenerativní onemocnění krční páteře je po lumbálním úseku druhou nejčastější příčinou vyřazení z práce. Ukazuje se, že povolání s vysokou fyzickou náročností mají častější výskyt bolesti zad než práce s lehčí zátěží. Není však znám práh fyzické zátěže, nad kterým je riziko již nepochybné. Studie, jež neprokázaly tento vliv fyzicky těžké práce na rozvoj degenerace páteře spojené s klinickými projevy, jsou pravděpodobně ovlivněny výše již zmíněnými zdroji chyb a svědčí o obtížnosti a složitosti těchto studií [51,52].
3.2. Statická zátěž
Dlouhodobé nucené sezení, stání a práce v trvalém předklonu mohou být rizikovým faktorem [53]. Zejména sezení spojené s vibracemi (řidiči dopravních prostředků) znamená až 3krát větší riziko výhřezu meziobratlové ploténky než u běžné populace [54].
I v této oblasti jsou publikovány práce prokazující, že samotné sezení nebo stání nemá vliv na vyšší výskyt bolestí zad [55].
3.3. Opakované předklony a otáčení
Zdá se, že existuje dostatek důkazů o tom, že časté ohýbání a otáčení páteře jsou rizikovými faktory pro vznik bolestí zad, i když je obtížné odlišit současný vliv zvedání břemen, který je obvykle s těmito pohyby spojen.
Zvláště riziková je kombinace zvedání břemene s úklonem a rotací a náhlý nečekaný maximální výkon [53,56]. Výskyt bolestí také koreluje s hmotností a velikostí zvedaného předmětu a počtem zvednutí.
3.4. Vibrace
Řada studií ukazuje na nepříznivý vliv dlouhodobých vibrací na páteř, což postihuje zejména letce a řidiče traktorů, nákladních aut a autobusů.
3.5. Sportovní aktivity
Sportovní aktivity zejména špičkového charakteru vedou k poškození páteře. V USA asi 9 % všech poranění páteře vzniká v souvislosti se sportem. Mezi nejrizikovější patří ragby, hokej, kopaná, zápasy, potápění, lyžování a dokonce i činnost „roztleskávaček“ spojená s řadou akrobatických prvků, stavěním „pyramid“ apod. [57].
3.6. Psychologické a psychosociální faktory
Nespokojenost se zaměstnáním, monotónní práce a špatné vztahy na pracovišti vedou častěji k bolestem zad, žádostem o odškodnění a častěji jsou příčinou pracovní neschopnosti. Bylo dokonce zjištěno, že psychologické faktory mají větší míru rizika pro vznik bolestí zad než těžká fyzická práce [58]. Při hledání příčin bolestí zad je nutné brát v úvahu i tento závažný faktor, protože patologické nálezy získané pomocí zobrazovacích technik jsou často klinicky němé a rozhodující v klinickém obraze může být právě faktor psychologický. To je mimořádně důležité především při rozhodování o operačním řešení vertebrogenních nemocí, protože psychologické faktory se mohou zásadním způsobem podílet na výsledcích operace a na dalším osudu nemocného.
4. Klinické projevy
Klinické projevy SCM jsou velmi pestré, což vyplývá z možnosti míšní komprese na jedné, dvou nebo mnoha úrovních krční páteře, a navíc z možné kombinace s kompresí jednoho či několika míšních kořenů. Lze je odvodit od poškození krční míchy a míšních kořenů, takže obsahuje projevy dysfunkce kortikospinální dráhy pro jednu nebo všechny končetiny (parézy centrálního typu), periferní motorické dráhy pro horní končetiny (kromě svalové slabosti jsou přítomny hypotrofie svalů a fascikulace), smíšené postižení periferního i centrálního motoneuronu na horních končetinách, poruchy čití povrchového i hlubokého pro jednu či všechny končetiny i trup a kořenové příznaky z oblasti C2 – Th1. U menší části nemocných jsou přítomny sfinkterové a sexuální poruchy. Bolesti pak mohou vznikat poškozením mnoha spinálních a paraspinálních struktur. Fascikulace, pokud se vůbec vyskytují, jsou na rozdíl od ALS (se kterou dochází k záměně nejčastěji) málo výrazné a více lokalizované, prakticky jen na horních končetinách. Výjimečně jsou klinické symptomy omezeny jen na dolní končetiny.
4.1. Začátek nemoci
Většinou je začátek i rozvoj nemoci pozvolný, s mírnou progresí nebo dlouhými obdobími stagnace anebo i regrese příznaků [1,59,60]. Výjimečně může dojít k rozvoji akutního syndromu krční míchy jako projevu náhlé dekompenzace předchozí těžké míšní komprese i po malém traumatu hlavy a krční páteře. Obvykle se v těchto případech pomýšlí spíše na mozkovou příhodu i přes normální nález typicky mozkových funkcí.
Doba trvání klinické symptomatologie zjišťovaná anamnesticky extrémně kolísá; může trvat několik hodin, dní nebo spíše týdnů až po mnoho let. Brain et al [1] uvádějí až 20leté trvání příznaků. Gregorius et al [60] udávají trvání nemoci 5 – 25 roků (průměr 3,75 roku), Sadasivan et al [61] průměrnou dobu 6,3 roku. V naší studii bylo zjištěno trvání míšní symptomatiky až 35 let, většinou však několik měsíců či let [62].
4.2. Věk a pohlaví
SCM postihuje převážně muže (poměr k ženám je 2 – 3 : 1) [1,60,62] a střední věk. Průměrný věk, ve kterém nemocný navštíví lékaře, je mezi 50 – 55 roky [1,60,62]. SCM je nejčastější myelopatií u lidí nejen nad 50 let věku [40,63,64], ale i nad 15 let [65] (SCM 23,6 %; spinální nádory 16,4 %; sclerosis multiplex 9,1 % – po MR 17,8 %; ALS/ MND 4,1 %).
4.3. Bolesti krční páteře
Brain et al ve své původní práci z roku 1952 [1] uvádějí, že bolest krční páteře není přítomna u nemocných s SCM, ale v monografii o cervikální spondylóze z roku 1967 [59] již shledávají její přítomnost u poloviny nemocných, my jsme ji zjistili u 67 % nemocných (tab. 1). Je nutné zdůraznit, že přítomnost bolesti v krční páteři může být důležitým diagnostickým příznakem a naopak její chybění může od diagnózy odvádět. Absence bolesti v krční páteři (30 – 50 % nemocných) tedy nesvědčí proti diagnóze SCM stejně jako normální funkční nález na krční páteři. Bolesti často vyzařují z krční páteře do ramen a horních končetin (41 %), mezi lopatky (51 %), do hlavy (30 %).
1. Porovnání prevalence klinických příznaků u spondylogenní cervikální myelopatie. 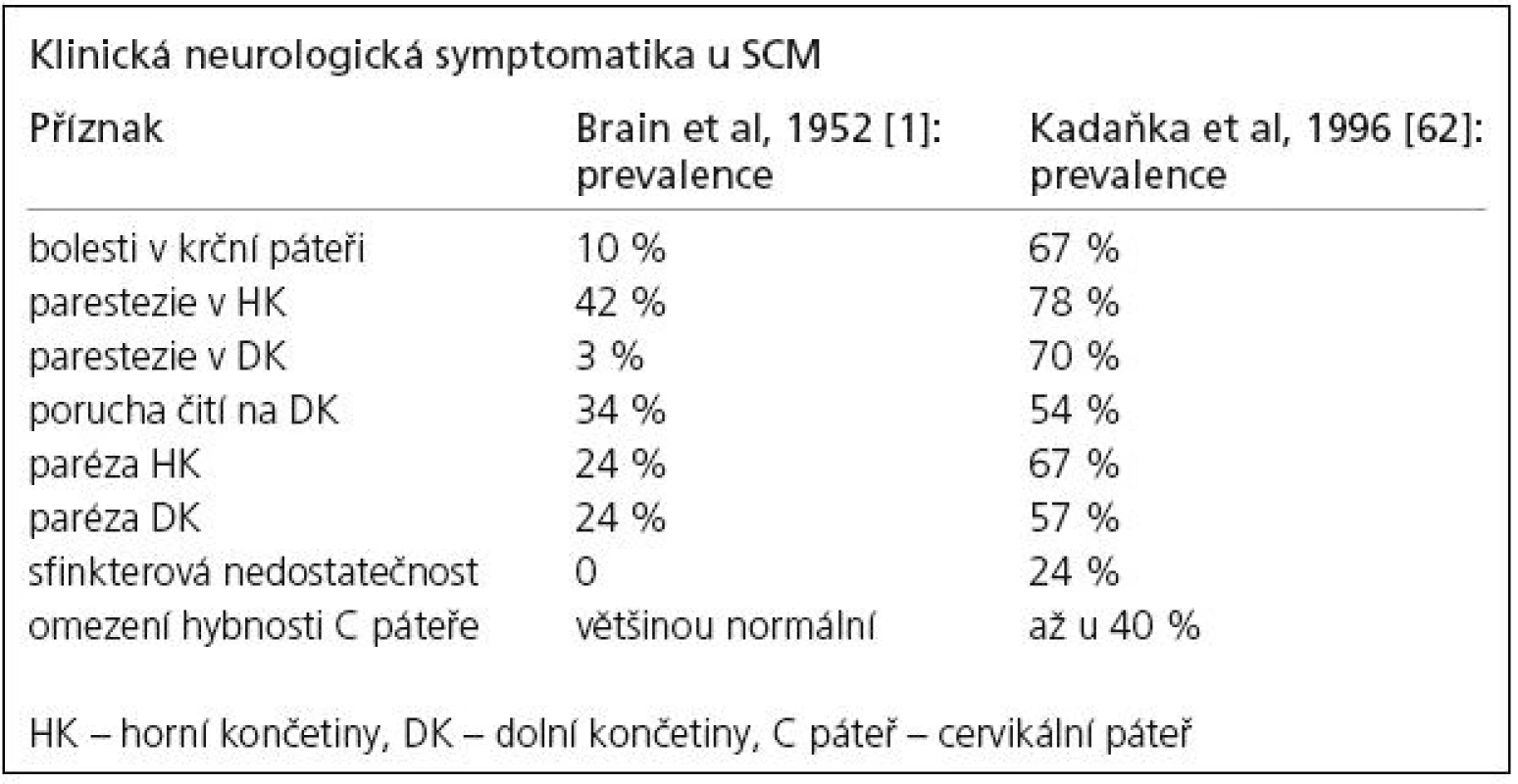
4.4. Neobratná ruka
Brain et al [1] popisují, že nemocní si stěžují na slabost stisku a neobratnost prstů, která je často zvyšována poruchou čití, ale neuvádějí jej jako častý a typický příznak, ani jej nevztahují k lézi v určitém míšním segmentu. Jeho závažnost přisuzují stupni parézy a svalových atrofií. Neobratnost ruky se však může vyskytovat u nemocných s normální svalovou silou ve všech částech horní končetiny.
Good et al [66] prosazovali termín neobratných rukou u nemocných s SCM, u nichž byla zjištěna léze v horní části krční míchy (C3 – 5).
Ono et al [67] popsali skupinu nemocných s SCM s charakteristickým obrazem, který nazvali myelopatická ruka. Projevovala se oslabením addukce, extenze nebo obojího na III. – V. prstu postižené ruky a neschopností rychlé extenze a flexe prstů ruky (sevření a otevření pěsti, což u zdravého jedince je možné provést více než 20krát za 10 s). Je přítomna též hypalgezie na zadní ploše předloktí a 70 % z nich má rovněž hypestezii na zevních plochách dolních končetin. Léze bývá lokalizována v úrovni míšního segmentu C7 nebo nad ním. Obraz myelopatické ruky není však pro SCM specifický.
Ebara et al [68] odlišují amyotrofický a myelopatický typ myelopatické ruky. Amyotrofická ruka se vyznačuje slabostí a atrofiemi svalů, ale bez poruch cítivosti a není spojena s poruchou chůze. Léze se nachází ve výši C7 – Th1 míšních segmentů. Oproti tomu myelopatický typ má podíl spasticity a poruchy cítivosti a lézi lokalizovanou ve vyšších etážích. V naší studii jsme zjistili neobratnost rukou v 84 % případů, sníženou svalovou sílu v horních končetinách v 54 % a slabost jen akrálně (stisk ruky, abdukce a addukce prstů) v 16 %.
4.5. Poruchy chůze
Poruchy chůze jsou velmi častým a zároveň časným příznakem. Chůze je neobratná, nešikovná, nejistá, ataktická, zpočátku jen nenápadně [69]. Projeví se zejména při náročnějších typech chůze (rychlá, v nerovném terénu, při rychlé změně směru) a zejména při běhu, a to již u nemocných bez jasných známek spasticity. V klasických popisech SCM si autoři nevšímají speciálně chůze [1,70]; uvádějí pouze, že většina nemocných je chůze schopna a jen těžké případy s ní mají problémy. Později však většina autorů upozorňuje na ztíženou chůzi, která patří mezi velmi časté příznaky (80 – 100 %) a představuje první klinické projevy [56,60,61,71,72].
4.6. Lhermitteův příznak
Příznak před Lhermitteem (1924) popsali Marie a Chatelin v roce 1917. Je charakterizován pocity elektrických výbojů dolů podél páteře a do končetin po flexi, méně často po extenzi hlavy (proto někdy též označován jako fenomén „holičského křesla“). Jde o lézi zadních provazců krční míchy nebo kaudální části prodloužené míchy. Je velmi specifický pro krční myelopatii (jakékoliv geneze), ale jeho senzitivita u SCM není příliš velká; Crandall a Batzdorf [70] jej našli v 27 %, v naší studii se vyskytl ve 14 %. Při jeho přítomnosti je však podezření na krční myelopatii vysoké.
4.7. Sfinkterová nedostatečnost
Vyskytuje se u menšího počtu nemocných – kolem 20 % [73], v naší studii 24 % (tab. 1); Brain et al (1952) ve své původní práci [1] sfinkterové potíže nepopisují. Vzhledem k tomu, že SCM postihuje především starší muže, sfinkterové potíže bývají imitovány či kombinovány s projevy onemocnění prostaty.
4.8. Jiné příznaky
Nemocní s SCM mívají často bolesti a další potíže rovněž z oblasti bederní páteře [74,75]. V naší skupině nemocných mělo intermitentní bolesti v zádech – v krčním, hrudním nebo bederním úseku 95 % nemocných. Spinální stenóza v krčním úseku bývá provázena v 15 % stenózou v bederním úseku [76], tzv. tandemovou spinální stenózou (TSS). Nemocní s SCM mívají bolesti vyzařující i do dolních končetin a nebývá snadné rozpoznat jejich patogenezi. Zejména po operaci krční páteře je těžké odlišit, zda přetrvávající bolesti v dolních končetinách jsou myelopatického původu nebo souvisejí s přidruženou bederní radikulopatií. Za těchto okolností je nezbytné vyšetřit zobrazovacími technikami celý páteřní kanál, aby symptomy krční myelopatie nezastřely patologii v jiné etáži páteře.
4.9. Souhrn
Klinický obraz SCM můžeme charakterizovat jako zpočátku lehké poruchy chůze, neobratnost rukou při jemné motorice, poruchy čití na jedné nebo několika končetinách, bolest za krkem a krční radikulopatie. Později jako rozvíjející se amyotrofii a spasticitu na horních končetinách, spasticitu na dolních končetinách a prohloubenou poruchu chůze. Pozdní stadia představují těžké para ‑ a kvadruparézy s hyperreflexií a klony, rozsáhlými poruchami čití a sfinkterovou nedostatečností.
5. Přirozený průběh nemoci
Přirozený průběh nemoci nebyl dosud spolehlivě dokumentován [77]. Je určitá tendence ke zhoršování až k těžkým kvadruparézám, ale není známo, jak rychle k tomu dochází, jaké části nemocných tento průběh hrozí; a především se neví, jaké symptomy či nálezy mohou předvídat maligní či benigní průběh nemoci. V některých studiích je průběh hodnocen jako trvale progresivní u všech nemocných [10,64,78], v jiných byla trvalá progrese zaznamenána u 67 % nemocných [79]. Naopak další retrospektivní studie ukazují, že onemocnění je mírné ve většině případů a že prognóza těchto lehce, ale i závažněji postižených je dobrá [80,81]. Jediným nepříznivým prognostickým znakem byl vyšší věk. V jedné velké retrospektivní studii (1 355 nemocných) se při konzervativní léčbě 36 % nemocných zlepšilo a 64 % nikoli. Z těch 64 % se 26 % zhoršilo neurologicky a ostatní zůstali stabilizováni [82]. Vzhledem k tomu, že jde o retrospektivní studie z chirurgických pracovišť, nereprezentují celou skupinu nemocných se spondylogenní míšní kompresí. Můžeme konstatovat:
- přirozený průběh choroby není dosud dobře znám,
- stabilizovaný, trvale progresivní nebo regresivní průběh je asi stejně pravděpodobný,
- dosud neznáme prognostický faktor, který by bylo možno použít u jednotlivého pacienta.
6. Epidemiologie
Prevalence a incidence spondylogenní cer-vikální myelopatie není známa. Chronické degenerativní změny krční páteře jsou však nejčastější příčinou myelopatie po 50. roku [75] a nejčastější příčinou netraumatické krční myelopatie u nemocných nad 15 roků věku [70]. Devadesát procent mužů nad 50 a žen nad 60 roků má degenerativní změny krční páteře prokazatelné zobrazovacími technikami [83]. U nás a na Slovensku bylo v roce 1994 operováno 347 nemocných pro krční spondylózu a z toho 113 pro spondylogenní cervikální myelopatii [84].
7. Diagnostika
Spondylogenní cervikální myelopatie je choroba značně poddiagnostikovaná a nedostatečně léčená [72]. Nedostatečná diagnostika je podmíněna několika faktory:
- Symptomatika SCM je nespecifická a často se přičítá procesu stárnutí mozku, pohybového aparátu a periferního nervového systému (např. neobratnost rukou, nespecifické poruchy chůze, vertigo,pestré parestezie).
- Varovné příznaky, jako např. bolesti páteře, jsou tak frekventním symptomem, že nebývají spojovány s SCM, a navíc 30 – 50 % nemocných s touto chorobou nemá cervikalgie.
- Nález degenerativních změn i značného rozsahu je u jedinců po 40. věku mimořádně častý.
- I hrubé degenerativní změny vedoucí až k míšní kompresi jsou mnohdy klinicky němé.
- Z prostých snímků krční páteře nelze často odhadnout míru míšní komprese.
Nedostatečná léčba vyplývá z nedostatečné diagnostiky, ale rovněž z toho, že dosud panují rozpaky nad tím, jak nemocné léčit, zda konzervativně či chirurgicky.
7.1. Diagnostická rozvaha
7.1.1 Symptomy vzbuzující podezření na SCM
- poruchy chůze centrálního charakteru
- neobratnost rukou
- Lhermitteův příznak
- bolesti krční páteře
7.1.2. Doprovodné příznaky
- parestezie a hypestezie horních i dolních končetin
- paraparéza dolních končetin, hemiparézy, smíšené parézy na horních a spastické na dolních končetinách
- radikulopatie na horních (i dolních) končetinách
- poruchy sfinkterů
7.1.3. Příznaky silně podporující diagnózu
vrozeně úzký spinální kanál (index Pavlovové pod 0,8), sagitální průměr páteřního kanálu pod 11 mm
7.1.4. Příznaky zavádějící od diagnózy
- absence cervikalgií
- současná přítomnost radikulopatií na horních i dolních končetinách
- současná polymorbidita, zvl. mozková ateroskleróza a artrózy nosných kloubů
- vyšší věk
- nemocní obtížně popisují své poruchy chůze
- i pro zkušeného je těžké zachytit počínající poruchu chůze a určit její původ
7.1.5 Příznaky vedoucí k přecenění diagnózy SCM
- přecenění významu intraspinálních osteofytů
- nedocenění periferně neurogenní symptomatologie na dolních končetinách (zvl. fascikulací)
- nedocenění postižení hlavových nervů, poruch řeči a poruch zraku či sluchu
7.1.6. Příznaky zpochybňující diagnózu SCM
- retrobulbární neuritida
- trvalé poruchy polykání
- hojné fascikulace a amyotrofie na dolních končetinách
- normální elektrofyziologické nálezy
- elektrofyziologický obraz axonálního či demyelinizačního postižení na dolních končetinách
7.1.7. Základní diagnostická kritéria
- klinický obraz krční myelopatie
- míšní komprese dle zobrazovacích technik (MR, CT, myelo/ CT, PMG)
- elektrofyziologické známky cervikální myelopatie
- vyloučení roztroušené sklerózy, amyotrofické laterální sklerózy, míšního a moz-kového tumoru, benigní intrakraniální hypertenze, alkoholové encefalopatie, nedostatku vitaminu B12, boreliózy, lues, syringomyelie, hematomyelie, amyotrofické neuralgie brachiálního plexu, výjimečně Guillainova‑Barrého syndromu
Při diagnostice SCM je třeba mít trvale na mysli, že degenerativní změny páteře jsou ubikvitárním nálezem. Všechny výše uvedené nemoci mohou být souběžně přítomny a dokonce mohou vykazovat určitý stupeň míšní komprese. Bývá svízelné zjistit, který patologický proces je zodpovědný za klinický obraz. Protruze cervikálních disků jsou přítomny u 20 % asymptomatických jedinců ve věku 45 – 55 let a u 57 % nemocných po 64 letech. Míšní komprese se vyskytuje u 16 % jedinců pod 64 let a u 26 % nad 64 let [85,86]. Pouhý nález spondylózy i s mírnou míšní kompresí tedy nemůže být vydáván bez pečlivé diferenciální diagnostiky za příčinu pacientových obtíží.
7.1.8. Diferenciální diagnostika
Diferenciálně diagnosticky je nutno posou-dit především nálezy hyperintezit na krční míše, které mohou být způsobeny de-myelinizačními plakami, nejčastěji v rámci roztroušené sklerózy (RS). Ty mohou být zaměňovány za spondylogenní cervikální myelopatii především tehdy, když o postiženém není známo, že by trpěl RS, a když jsou přítomny spondylózní změny, přestože jsou ve vztahu k hyperintenzitě irelevantní. U nemocných se sclerosis multiplex se hyperintenzity na krční míše vyskytují u 40 – 90 % nemocných, u primárně i sekundárně progresivních forem, u benigních forem pouze v 50 % [87]. Demyelinizační plaka může napodobit i míšní tumor a nemocní mohou být zbytečně operováni [88].
V diagnostice neplatí rovněž buď a nebo, může se vyskytovat i kombinace dvou i více chorob, např. SCM se může kombinovat s RS, a i u takových pacientů bylo popsáno zlepšení po operačním odstranění komprese míchy.
Míšní tumory jsou na druhém nebo třetím místě příčiny cervikální myelopatie. Jejich diagnostika nemusí být snadná, protože asi u 10 % intramedulárních nádorů (většinou astrocytomy) nedojde po podání gadolinia k jejich nabarvení [89].
Spinální nádory, zvláště intramedulární, se nejčastěji vyskytují právě v krční oblasti. Jsou sice podstatně méně časté než nádory intrakraniální, ale jejich symptomatika může být závažnější a jejich léčení obtížnější, protože na malém prostoru je soustředěno mnoho důležitých nervových struktur a chirurg zde má velmi limitovaný prostor vzhledem k masivní kostěné schránce, která má důležité funkce statické a dynamické (na rozdíl od kalvy).
Časté jsou také spinální, většinou epidurálně lokalizované metastázy z karcinomů prostaty, prsu, plic, ledvin a žaludku.
Vzácněji se vyskytují v páteřním kanále arachnoidální cysty.
Obtížná je diferenciální diagnostika amyotrofické laterální sklerózy (ALS) a SCM především v počátečních stadiích onemocnění [90]. Z klinických příznaků pro ALS svědčí masivní nález fascikulací difuzně, zejména na dolních končetinách, které se u SCM vyskytují jen raritně, a když jsou přítomny, pak jen ojediněle (ne tak masivně jako u ALS); rovněž normální citlivost svědčí proti SCM. Je nutné však vědět, že až 25 % nemocných s ALS má určité poruchy čití.
Příčinou akutně i chronicky probíhající myelopatie mohou být (i když vzácně) kavernomy, které jsou daleko častější intrakraniálně [91].
Multifokální motorická polyneuropatie (MMN) s kondukčním blokem může klinicky napodobit SCM i ALS především atrofiemi na horních končetinách, ale budou chybět známky centrálních paréz. Rozhodující metodou bude EMG vyšetření, které zjistí kondukční bloky na periferních nervech u MMN a jejich absenci u SCM. Obtížnější může být diferenciace mezi ALS a MMN. Napomůže přítomnost bloků vedení mimo místa fyziologických úžin a nízká četnost abnormální spontánní aktivity v jehlové EMG (MMN) a nález hojné abnormální spontánní aktivity v paraspinálních svalech (ALS).
Cervikální myelopatie může být také způsobena syringomyelií a ta se může navíc kombinovat s RS [92] a SCM.
Odlišení syringomyelie pomocí MR nebude ve většině případů obtížné. Nicméně i tato choroba se může kombinovat se SCM a dekompresní výkon může klinickou symptomatiku zlepšit (jeden případ v našem centru).
Naléhavá a nesnadná diagnostika cer-vikální myelopatie nastává u tzv. akutní transverzní myelitidy (ATM), což je názevpro skupinu heterogenních jednotek mající podobný klinický i paraklinický obraz. V užším slova smyslu zahrnují převážně parainfekční (event. postvakcinační) nebo infekční myelitidy (vč. neurovirů, boreliózy, salmonelózy) nebo jiné zánětlivé jed-notky (vasculitis, sclerosis multiplex, Sjögrenův syndrom, neurosarkoidóza, paraneo-plastická myelitis, nekrotizující myelitidy,venózní kongestivní syndrom – Foixův - Ala-jouanineův aj.).
8. Pomocná vyšetření
8.1. Radiologická a zobrazovací vyšetření
8.1.1. Prosté snímky krční páteře
Provádí se v bočné a předozadní projekci a navíc šikmé a dynamické snímky (maximální předklon a záklon) (obr. 4, 5). Je možno na nich rozeznat osteochondrózu, osteofyty zejména dorzálně směřující, unkovertebrální neartrózu a osteofyty směřující do neuroforamin, postavení a tvar obratlových těl. Dá se změřit i kongenitální šíře páteřního kanálu pomocí indexu Pavlovové, který je důležitým parametrem při vyhodnocování významu kongenitální složky stenózujícího procesu na funkci krční míchy (obr. 1). Jeho hodnota by měla být vždy uvedena při popisu prostých snímků. Dynamické snímky mohou ukázat instabilitu segmentu.
4. Těžké spondylózní měny C páteře. 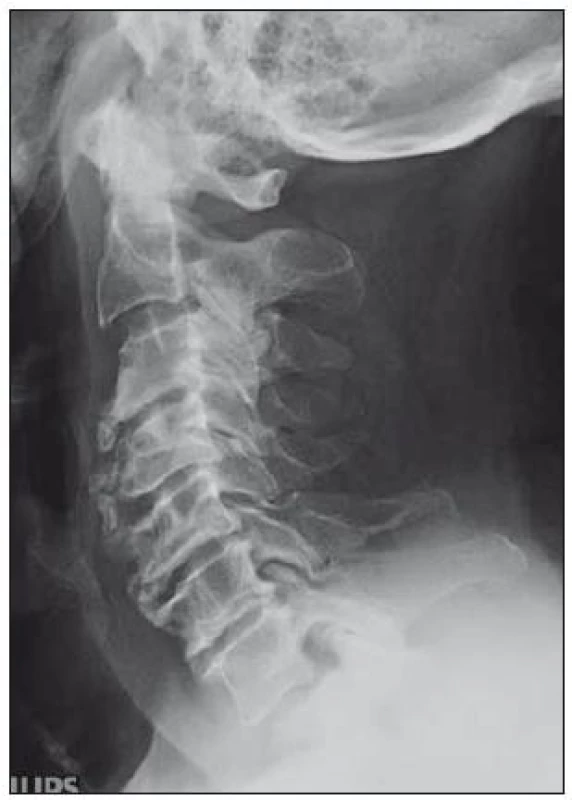
5. Šikmé snímky krční páteře, výrazné spondylózní omezení neuroforamina C5–6 vlevo. 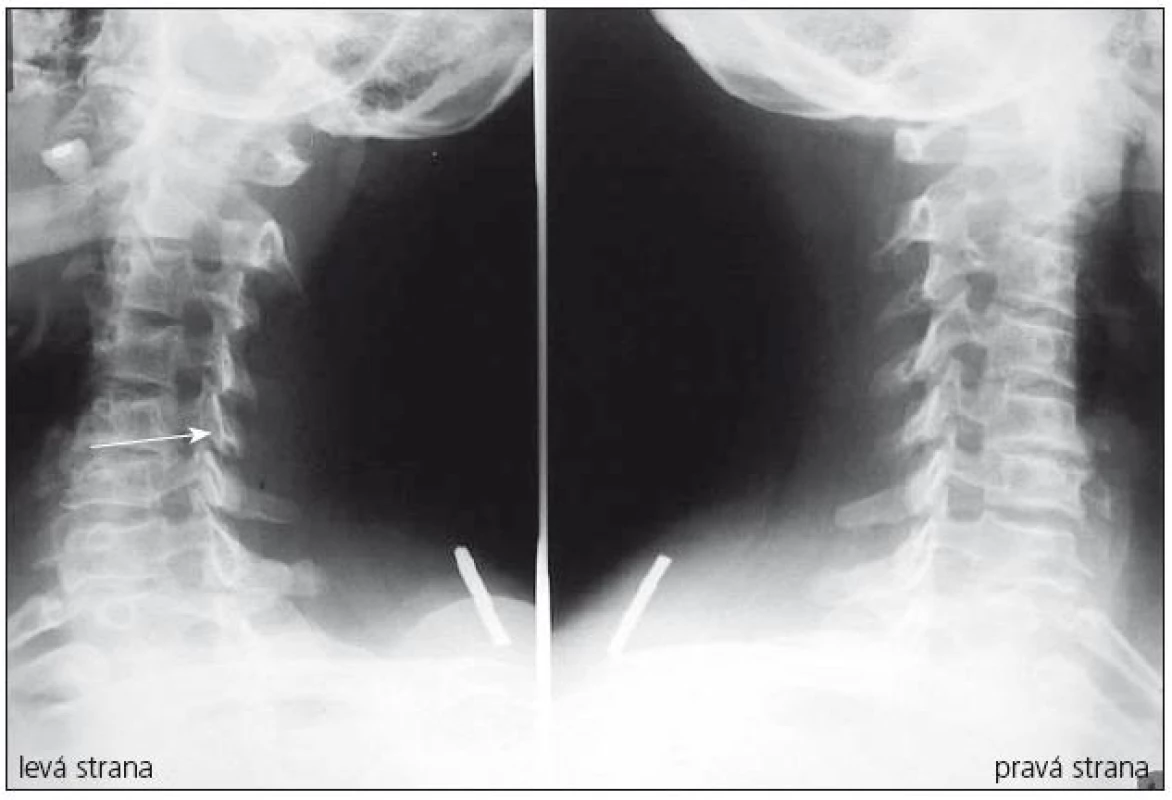
8.1.2. Magnetická rezonance (MR) krční míchy
Je rozhodující pro zhodnocení stavu míchy a měkkých tkání páteře. Provádí se v bočné projekci a v příčných řezech (obr. 6, 7). Na příčných řezech je možno stanovit dva důležité parametry míšní komprese: kompresní poměr a plochu míchy. Kompresní poměr se vypočítá tak, že se vydělí AP (sagitální) průměr míchy průměrem transverzálním v místě největší komprese (obr. 8). Plocha míchy se dá změřit obvykle pomocí speciálního programu (elektronickým kurzorem), kterým jsou MR přístroje vybaveny. Normální příčná plocha míchy ve výši C4 – 5 dosahuje přibližně 86 mm2 [98]. Při měření velikosti míchy na kadaverech jsou hodnoty o 10 – 18 % nižší oproti MR [99]. Kritická hodnota pro vznik klinické symptomatologie je kolem 60 mm2 [100]. Pokud je hodnota kompresního poměru větší než 0,4 po dekompresi a plocha míchy větší než 40 mm2, je prognóza příznivá [93,94]. Jiní autoři však neshledávají průkaz pooperačního rozšíření rozměrů páteřního kanálu jako příznivý prognostický faktor [101]. Na T2 vážených obrazech a gradient echo modu je možno detekovat hyperintenzity ukazující na reverzibilní i ireverzibilní strukturální lézi míchy obvykle v místě maximální komprese (obr. 7). MR vyšetření je nutné rovněž z diferenciálně diagnostických důvodů (ložiska RS, hematomyelie, míšní tumor). Dynamické MR snímky (ve flexi a extenzi) umožní zachytit dynamickou kompresi míchy při instabilitě, ale i bez známek instability páteře, např. dynamickým vyklenováním disku [105]. V případě vyšetření u nemocných s kovovými implantáty je třeba počítat s možnými artefakty (obr. 9).
6. MR obraz masivního výhřezu disku C5–6 s těžkou míšní kompresí. 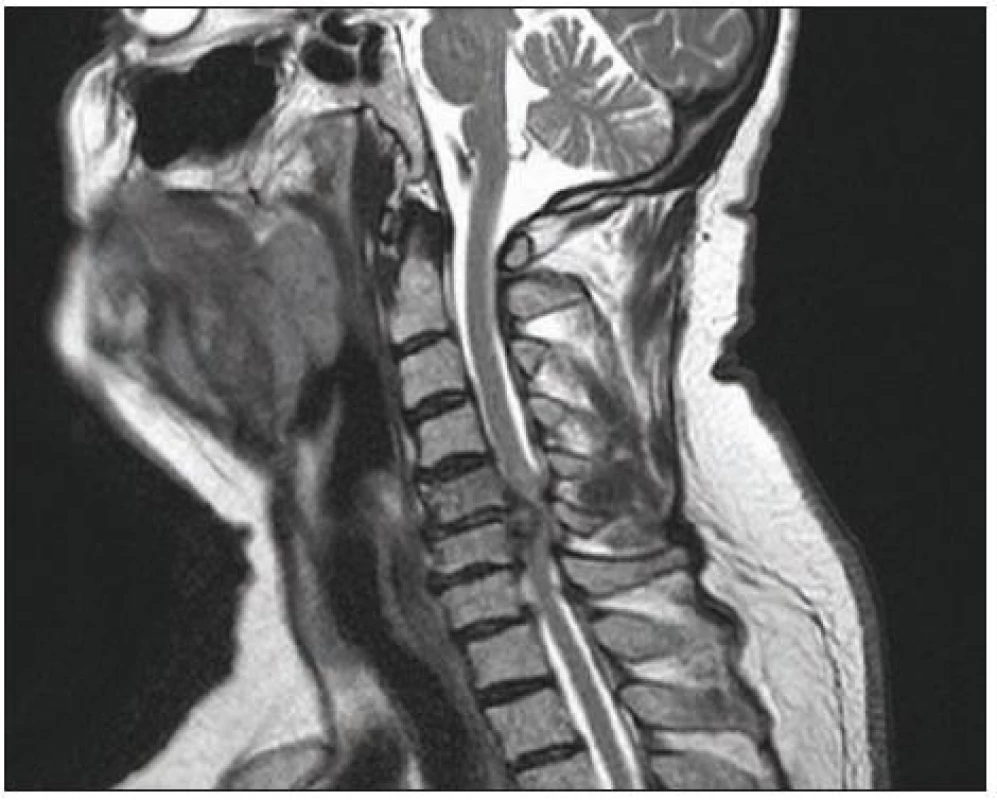
7. MR obraz víceetážové míšní komprese výhřezy disku C3–7. 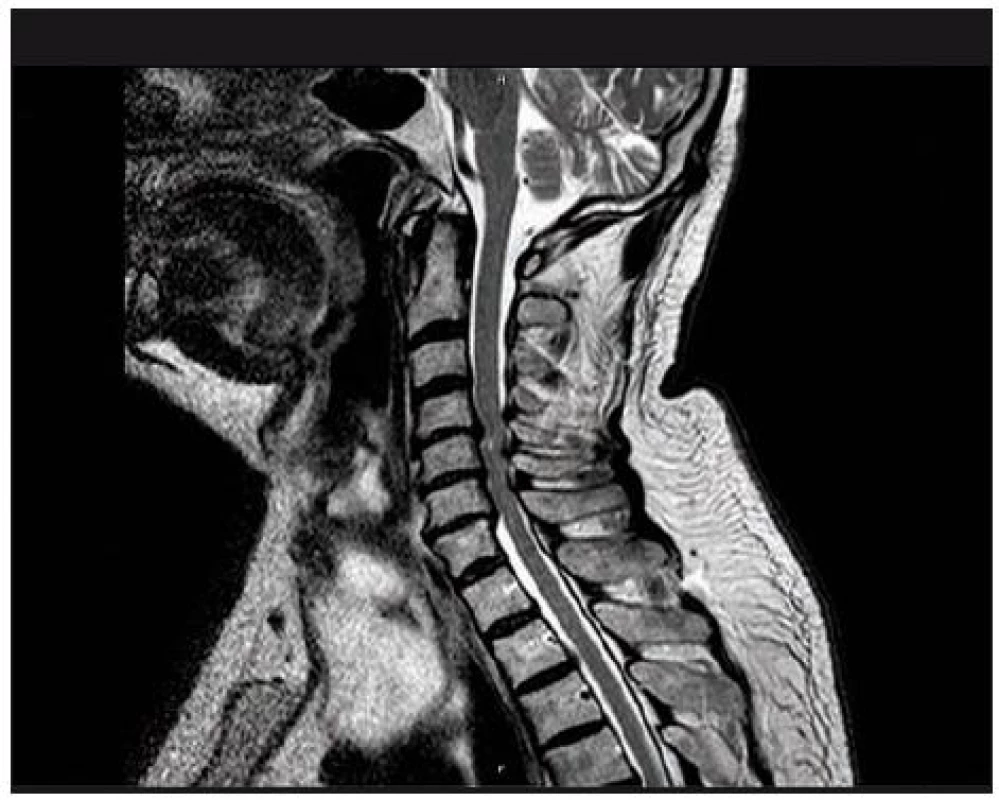
8. Kompresní poměr udává míru míšního stlačení. Je to podíl předozadního a bočného průměru míchy. Normálně dosahuje 0,68; za velmi závažnou míšní kompresi se považuje poměr 0,4 a méně. 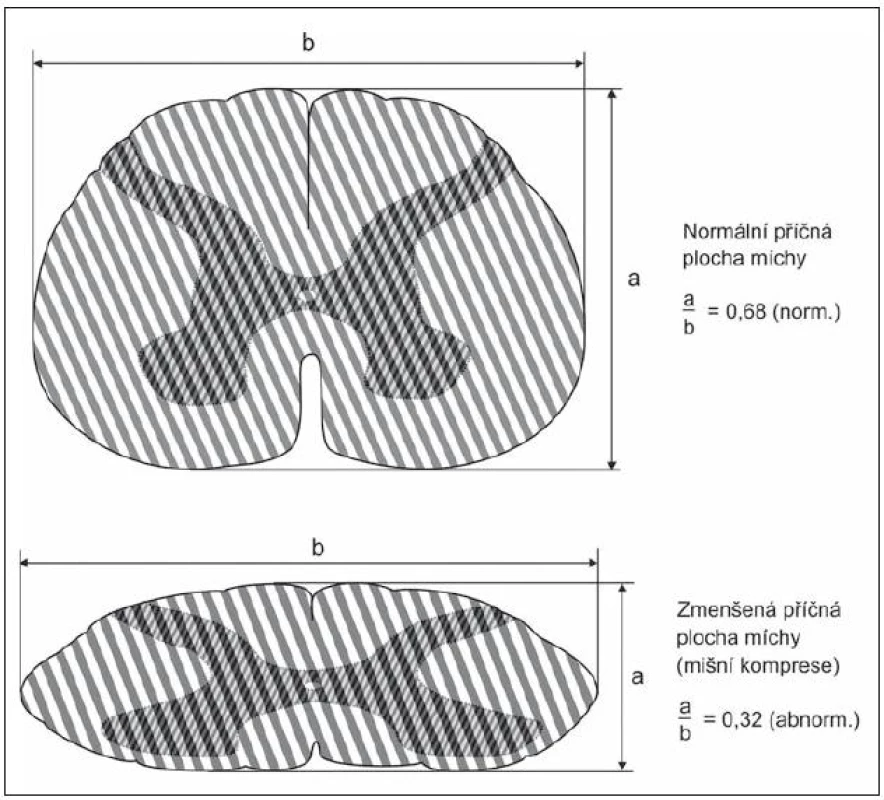
9. MR snímek krční páteře, na kterém jsou zřetelné výrazné artefakty způsobené přítomností kovového instrumentaria (titan), znemožňující posouzení průchodnosti páteřního kanálu. 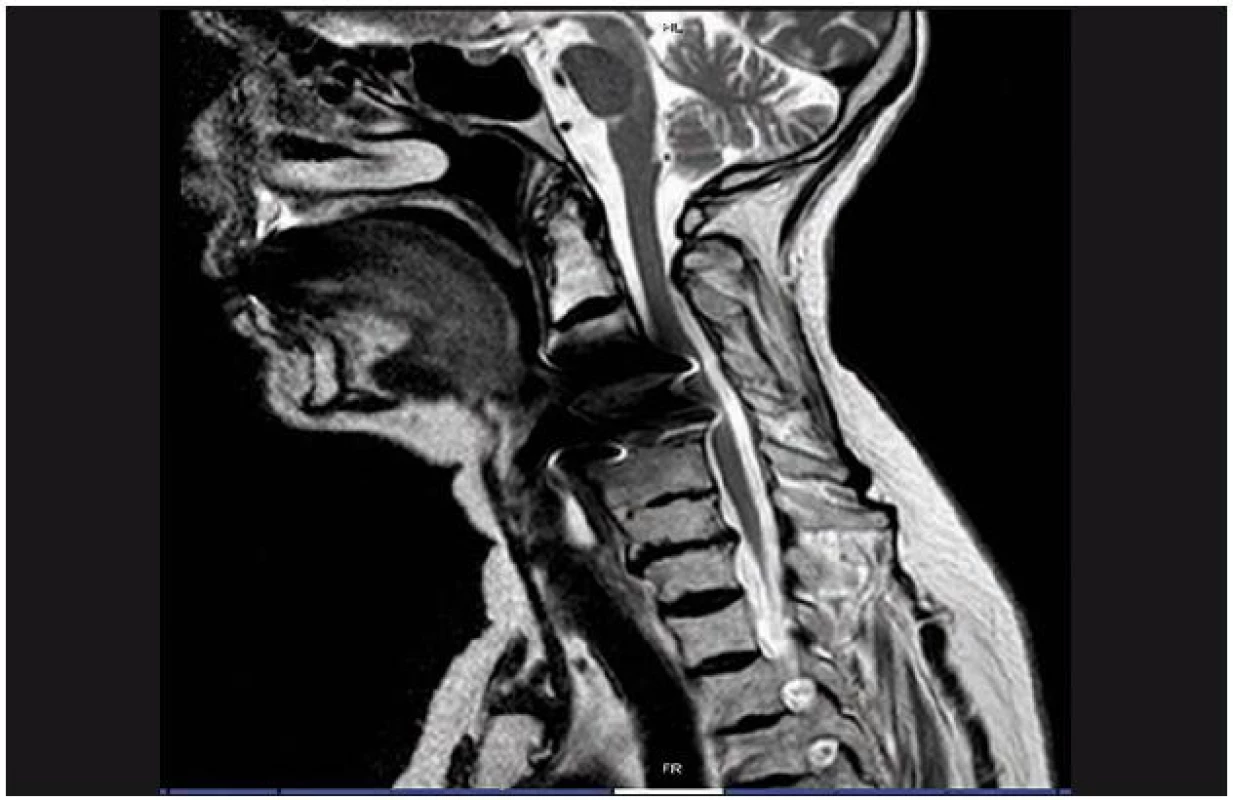
Často je nutno z diferenciálně diagnostických důvodů doplnit vyšetření bederní (i hrudní) páteře a MR mozku.
8.1.3. Hyperintenzity v míše u nemocných s SCM
V roku 1987 Takahashi et al [102] poprvé popsali okrsky zvýšeného signálu na T2 vážených obrazech míchy následkem míšní komprese. Považovali tyto okrsky za obraz myelomalacie, demyelinizace, gliózy a mikrokavit. I další autoři podpořili jejich nálezy [103 – 105]. Intenzivní předoperační signál nejpravděpodobněji odpovídá zánětu a edému: slabší signál chronické glióze. Nicméně klinický význam hyperintenzit zůstává kontroverzní. Některé studie našly negativní korelaci mezi prognózou výsledku chirurgické či konzervativní léčby a výskytem hyperintenzit [98,102,106 – 108], ale v jiných pracích tento vztah potvrzen nebyl [109] či dokonce byl nalezen vztah pozitivní [110]. Jiní nalezli korelaci jako prognosticky důležitou pouze u případů víceetážového postižení [111,112], nebo když se kombinoval nález hypointenzit na T1WI a hyperintenzit na T2WI [113]. V naší studii přítomnost hyperintenzit na míše v místě maximální míšní komprese neměl prognostický vztah k výsledku léčby konzervativní ani chirugické [96].
8.1.4. CT krční páteře (obr. 10)
Toto vyšetření lépe zobrazí kostěné struktury a myelo/ CT (CT provedené po perimyelografii s kontrastní látkou) ukáže velmi přesně vztahy kostěných a fibrokartilaginózních struktur k míše a míšním kořenům. Myelo/ CT je ovšem invazivní vyšetření a rezervujeme je pro případy, kdy nelze provést MR nebo když je na krční páteři kov (dlaha, šrouby), které způsobují artefakty znemožňující vyhodnocení snímků MR nebo CT. Jinou indikaci k provedení myelografie představuje výrazná skolióza páteře.
10. a, b. Pohyblivá náhrada odstraněného meziobratlového disku v předklonu a záklonu. 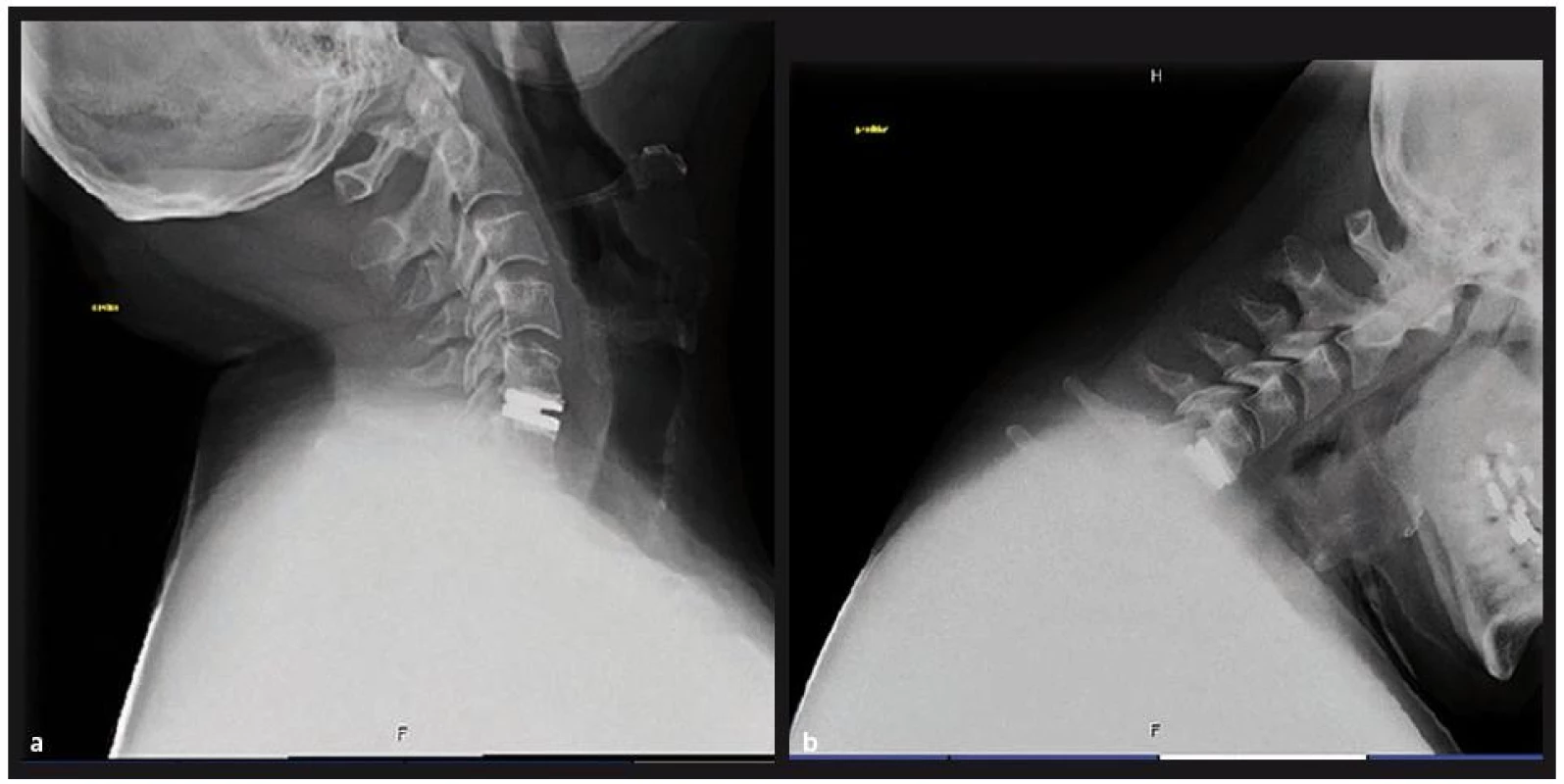
Na CT, a zvl. na myelo/ CT obrazech, je možno dobře měřit anatomické poměry. Anteroposteriorní průměr páteřního kanálu je normálně kolem 17 mm a míchy 10 mm v podaxiální úrovni. Pokud je příčná plocha míchy zmenšena o 30 %, tj. asi na 60 mm2 a méně, pak se začne projevovat klinicky [114], pokud je pod 40 mm2, je prognóza nemoci nepříznivá.
8.1.5. Souhrn
K diagnostice SCM pomocí zobrazovacích technik stačí obvykle prosté rentgenové snímky a MR krční páteře, ve zvláštních případech je vhodné doplnit je CT nebo myelo/ CT (zvl. u nemocných trpících klaustrofobií, s pacemakerem nebo s kovovým materiálem v těle nebo přímo v páteři, u nejasných radikulopatií).
8.2. Elektrofyziologická vyšetření
K potvrzení SCM jsou často nutná následující elektrofyziologická vyšetření.
8.2.1. EMG z horních končetin
Může potvrdit postižení periferního motoneuronu (ať již myelopatii nebo radikulopatii) především pomocí jehlové EMG. Pomůže vyloučit nebo posoudit podíl syndromu karpálního tunelu na klinickém obrazu, protože ten často provází SCM. Dále může EMG napomoci při stanovení podílu polyneuropatie u nemocných s konkomitantním diabetem, abúzem alkoholu apod.
8.2.2. Somatosenzitivní evokovaný potenciál (SEP) n. medianus (ulnaris) a n. tibialis
Ukáže objektivně lézi periferní i centrálníčásti somatosenzitivní dráhy. Izolované chybění vlny N13 při zachování vlny P14 má pravděpodobně příznivý prognostický význam pro operaci SCM [115,116].
8.2.3. MEP k horním i dolním končetinám
Ukáže totéž pro motorickou dráhu. Z diferenciálně diagnostických důvodů (zejména oproti sclerosis multiplex) je indikované provedení zrakových (VEP) a sluchových (BAEP) evokovaných potenciálů. Pokud je klinický obraz jasný, je přínos elektrofyziologických vyšetření nevelký. Nabývají na významu při průkazu subklinických změn, při sledování průběhu nemoci, efektu terapie a při diferenciální diagnostice [116,117].
8.3. Vyšetření mozkomíšního moku
Odběr likvoru k potvrzení SCM nepatří ke standardním vyšetřením. V době, kdy se tato vyšetření ještě prováděla, byl obvykle nález normální nebo se nacházela lehce zvýšená celková bílkovina 0,70 – 0,80 g/ l [54].
9. Vyhodnocení klinického stavu
Ke zhodnocení klinického stavu se používají různé hodnotící škály. V posledních letech se nejčastěji používá škála Japonské ortopedické asociace [118] modifikovaná pro země s evropskou kulturou (škála 1) [119], někdy se používá Nurickova škála (škála 2) a celá řada dalších testů. Na obratnost rukou např. 9 - hole peg test (rychlost zasunutí kolíku do devíti jamek), frekvence otevření a sevření ruky za 10 s, na dolní končetiny rychlost chůze na 10 m a 25 m, triangle test (počet dotyků dolní končetinou na trojúhelník bodů za 10 s), běh na 10 m, chůze po schodech aj.
Škála 1. Škála poruch funkce při spondylogenní cervikální myelopatii. JOA škála modifikovaná Benzelem et al [119] ![Škála 1. Škála poruch funkce při spondylogenní cervikální myelopatii. JOA škála modifikovaná Benzelem et al [119]](https://pl-master.mdcdn.cz/media/image/c1e42ad014ab7ef9e657d76fde42b645.jpg?version=1537796429)
Škála 2. Nurickova škála neschopnosti. 
10. Terapie
Princip přístupu k léčení spondylogenní cervikální myelopatie je stejně jako u jiných degenerativních onemocnění páteře dvojí – konzervativní a chirurgický. Pro rozhodnutí, který z těchto způsobů zvolit, je třeba znát některé faktory, především přirozený průběh choroby a výsledky konzervativní a chirurgické léčby. Žádný z těchto faktorů však není dobře dokumentován, a proto se zatím vychází z empirických znalostí a pravděpodobných hypotéz.
10.1. Konzervativní léčba
Vzhledem k tomu, že jde o onemocnění obvykle s pomalým až stacionárním průběhem, je třeba zvážit nejdříve konzervativní léčbu, jak již doporučovali autoři původně popisující podrobně tuto jednotku [1]. Prvním krokem by měla být úprava životosprávy. K tomu patří zejména odstranění všech rizikových faktorů, které mohou progresi nemoci urychlit:
- vyřazení těžké fyzické námahy,
- vyřazení všech úkonů, které evidentně zvyšují bolesti v páteři a event. zhoršují jiné klinické příznaky.
- úprava lůžka tak, aby krční páteř nedosahovala během spánku krajních poloh,
- omezení takové aktivity, která by mohla vést k poranění páteře (pohyb na kluzkém terénu, na žebříku, práce ve výškách),
- omezení takových aktivit, které zhoršují funkci páteře (jednostranná statická i dynamická zátěž), vibrace (práce s vibračními stroji, dlouhý pobyt v dopravních prostředcích), dlouhodobá fyzická nečinnost, dlouhodobá fixace páteře, prochlazení, vyloučení krajních poloh hlavy (u kadeřníka, při operacích), násilná flexe i extenze hlavy,
- pečlivá kompenzace diabetu,
- zákaz kouření,
- udržování pohybové funkce páteře (především dostatek chůze denně),
- intermitentní fixace krční páteře měkkým límcem v době nezbytné zátěže.
V období period bolesti:
- intermitentní klid na lůžku,
- intermitentní aplikace měkkého límce,
- nesteroidní antiflogistika a svalová myorelaxancia, případně krátkodobé podání kortikoidů,
- epidurální injekce anestetika a kortikoidů, např. 40 – 60 mg triamcinolondiacetátu [120], nejlepší efekt byl ale zaznamenán u nemocných s radikulopatií [121],
- opatrná, jemná trakce za hlavu (její efekt však nebyl v dvojitě slepé, randomizované studii prokázán [122],
- fyzikální terapie, i když její efekt nebyl dostatečně prokázán,
- je kontraindikována manipulace krční páteře [123].
10.2. Chirurgická léčba
Indikace a časování chirurgické léčby nejsou přesně a jednotně stanoveny. Je však všeobecně přijímáno, že by se měli operovat nemocní s progredující formou nemoci, aby se zvrátil nepříznivý průběh. Nevyjasněno zůstává, zda operovat nemocné s mírnou či středně těžkou formou bez zřetelné progrese nebo jen se zcela mírnou progresí. Někteří autoři doporučují časné operace u těchto forem, protože předpokládají většinou progresivní průběh a protože zákrok je prevencí této progrese. Nacházejí také lepší výsledky u nemocných operovaných do 6 – 12 měsíců po začátku myelopatických potíží a u těch, kteří mají mírné formy [41,82]. V naší randomizované prospektivní studii jsme nepotvrdili přednost operačního řešení mírných a středních forem SCM bez progrese nebo jen s mírnou progresí po dobu tříletého sledování.
Je nezbytné zhodnocení celkového zdravotního stavu nemocného před případnou indikací chirurgického výkonu. Nemocní s kardiální dekompenzací, dekompenzovaným nebo komplikovaným diabetem, nedostatečně kompenzovanou arteriální hypertenzí nejsou vhodnými kandidáty této léčby. Zejména u psychickynemocných (deprese!) je třeba operační indikaci vážit velmi pečlivě.
Na sympoziu CSRS (Cervical Spine Research Society) v roce 1988 byla formulována následující doporučení:
- operační řešení předním či zadním přístupem vede k míšní dekompresi a záleží na anatomických poměrech každého nemocného, které metodě dát přednost,
- optimální načasování operace není známo, ale obecně se soudí, že by se mělo operovat v případě progresivního průběhu,
- není jasné, zda pouze přítomnost myelopatie je indikací k operaci, protože není přesně znám přirozený průběh choroby.
Výhřezy disků (tzv. měkké) ať již samostatné nebo s nevýznamným podílem osteofytů, kterých je mezi nemocnými s SCM menšina, postihují především mladé jedince. Mají lepší naději na dobrý operační výsledek než míšní komprese kostěnými strukturami (tzv. tvrdé výhřezy) i bez ohledu na velikost příčné plochy míchy, kompresivní poměr a délku trvání potíží [95]. Avšak i v těchto případech by operační indikace měla být stanovena až po selhání konzervativní terapie nebo při progresi příznaků. Při konzervativním přístupu může dojít ke vstřebání vyhřezlého disku. Nicméně při nálezu významných paretických příznaků je chirurgická intervence naléhavější.
V současné době se k operaci SCM po-užívá přední i zadní přístup.
10.2.1. Operace předním přístupem
Jak již bylo uvedeno výše, přední přístup byl zaveden v 50. letech prakticky současně několika autory [11,12,124,125]. Doporučuje se především v případě, že útlak míchy jde zepředu a je omezen na jednu nebo dvě úrovně. Přední přístup se rovněž volí při kyfotickém postavení krční páteře. Obvykle je dekomprese provázena vložením kostěného štěpu z lopaty kosti kyčelní nebo fibuly nebo jinou náhradou – např. sklokeramickou. Nověji se zkouší náhrady pohyblivé, jejich přínos však musí být teprve ověřen (obr. 10a, b).V současné době se diskutuje o jejich použití pouze při jednoetážových měkkých výhřezech. V roce 1960 byla popsána přední diskektomie bez fúze pro léčení radikulopatií [13]. Zepředu je možno odstranit meziobratlový disk, osteofyty, osifikovaný zadní podélný vaz a mediální části unkovertebrálních spojů. Obtížně se provádí dekomprese neuroforamin pro polohu a. vertebralis, i když je snazší než zezadu, kde je v cestě kořen a je třeba obětovat meziobratlový kloub. Pokud se provádí somatektomie několika obratlů, je nutno takto vytvořený prostor překlenout dlouhým štěpem [126,127]. Segmenty nad fúzovaným úsekem a pod ním jsou vystaveny větší zátěži a dochází v nich k urychlení degenerativního procesu [128]. To spolu s hypertrofií ligamentum flavum může vést asi v 10 % případů k míšní kompresi v nefúzovaných oblastech. Korpektomie podle některých autorů má u SCM lepší návrat poškozených funkcí nervového systému, méně axiálních bolestí a menší incidenci pooperačních poruch postavení páteře v sagitální rovině [129].
10.2.2. Operace zadním přístupem
Obecně se doporučuje u víceetážových kompresí (tři a více segmentů), u vrozeně úzkého spinálního kanálu, při hyperlordotickém postavení krční páteře a u nemocných vyššího věku nebo s vysokým operačním rizikem [130,131]. Obvykle se provádí v etážích C3 – 7, výjimečně i ve vyšších. Laminektomie predisponuje k tvorbě kyfózy, proto by se neměla indikovat u nemocných s kyfotickou deformitou krční páteře. Variací laminektomie je laminoplastika („open - door“), při které se lamina neodstraňuje, ale pouze nadzvedne „en bloc“ v místě, kde se laterálně ztenčí jako závěs u dveří [20]. Zdá se, že obě operace jsou stejně úspěšné v dosažení dekomprese [132]. Víceetážové laminektomie se dříve užívaly na zadní dekompresi, ale nyní jsou buď kombinovány s fúzí, nebo nahrazeny laminoplastikou. Indikace k operaci musí být prováděny s pečlivostí a dekomprese musí být dostatečná, protože operační a pooperační komplikace mohou být devastující. Na druhé straně mimořádná pečlivost ve vyšetřeních s důrazem na každý detail, jemná technika a dostatečné zkušenosti mohou vést k velmi dobrým operačním výsledkům [133]. Dr. Hirabayashi zavedl expanzivní open - door laminoplastiku, pomocí které je možné dosáhnout jak dostatečnou dekompresi, tak i udržet krční stabilitu a současně omezit riziko různých komplikací. Pokud přední dekomprese není dostatečná, bývá s určitým úspěchem doplněna laminoplastikou [134].
Chirurgická léčba dlouhých úseku OPPL (osifikace zadního podélného vazu) se provádí zadní dekompresí pomocí laminoplastiky v rozsahu C1 – 7 nebo C2 – Th1. Uvolní se tím jak páteřní kanál, tak i výstupy kořenů na jednotlivých úrovních prováděné laminoplastiky. Dobré výsledky vydržely až 4,5 roku [135].
V posledních letech byla publikována řada modifikací těchto přístupů, např. somatektomie [136], centrální korpektomie [137], použití kostního štěpu z exstirpovaných obratlových těl [138], mikrochirurgická přední foraminotomie [139], dorzolaterální dekomprese [140], víceetážová šikmá korpektomie bez fúze [141], „skip korpektomie“, při které se provede korpektomie C4 a C6 a na C5 jen osteofytektomie [142], kusabi fixation technique [143].
10.3. Operace ve stáří
Pokud jsou nemocní s SCM v dobrém fyzickém a psychickém stavu, je možno zvážit operační výkon i u nemocných ve vyšším věku s nadějí na dobrý výsledek. Prospektivně byla např. sledována skupina 35 nemocných starších 80 let (80 – 90) operovaných laminoplastikou. JOA skóre se v průměru zlepšilo z 8,6 na 12,6; RR (recovery rate) 45 %. Nevyskytly se žádné velké komplikace, ani žádné úmrtí v souvislosti s operací. Uzavírají, že k dobrým výsledkům je operačně možno dospět i u nemocných starších 80 let, pokud jsou správně vybráni pomocí SEP a MEP [144].
10.4. Operace při tandemové stenóze krční a bederní páteře
Vzhledem k časté kombinované stenóze krční a bederní páteře (u 15 % nemocných s SCM) je třeba někdy řešit chirurgicky obě afekce buď následně po sobě, nebo i v jedné době. V retrospektivní studii byl posuzován efekt jednodobé dekomprese v krčním a bederním úseku u nemocných s tandemovou stenózou s dobou sledování tři roky. 70 % nemocných bylo po třech letech s výsledky operace spokojeno, největší zlepšení nastalo v šestém měsíci po operaci a pak se stav mírně zhoršoval [145].
10.5. Posouzení úrovně vědeckého průkazu efektu chirurgické léčby SCM
Cochranovo centrum, které vyhodnocovalo literaturu týkající se výsledků operační léčby pro SCM (Cochrane Library, 2010), zařadilo z velkého množství publikovaných prací o operacích pro SCM do hodnocení pouze dvě randomizované prospektivní studie s celkovým počtem 149 nemocných. Jeden pokus zahrnoval 81 nemocných, kde se srovnávala chirurgická dekomprese buď s fyzioterapií, nebo imobilizací krčním límcem u nemocných s radikulopatií. Krátkodobé výsledky operace, co se týče bolesti, paréz a poruch čití, byly lepší než konzervativní postup, ale po roce již nebyl rozdíl mezi oběma skupinami. Jedna studie, se 68 nemocnými, srovnávající efekt operace s konzervativní léčbou u mírných a středních neprogredujících forem SCM nenašla rozdíl ani po třech letech. Recentní stanovisko Americké asociace neurologických chirurgů po shrnutí dosavadních relevantních literárních údajů doporučuje u mírných forem SCM léčbu jak chirurgickou, tak i konzervativní, ale nedokáže vydat stanovisko k nemocným, u nichž potíže trvají déle než tři roky. U těžších forem (mJOA skóre pod 12) by se mělo individuálně rozhodnout o chirurgické léčbě [146].
11. Závěr
Spondylogenní cervikální myelopatie je závažné onemocnění míchy, které je relativně časté a zatím silně poddiagnostikované. Jde o nejčastější myelopatii u lidí starších 15 let. Je vyvolána statickými i dynamickými faktory, které zahrnují kostní, fibrózní i kartilaginózní struktury krční páteře a které vedou k útlaku míchy a jejích cév. Klinický obraz i průběh jsou silně variabilní. Z diagnostických prostředků jsou nejlepší MR a myelo/ CT. Přestože není ještě shromážděn dostatek poznatků o optimální léčbě nemoci, je nezbytné její včasné rozpoznání, aby bylo možno konzervativním či chirurgickým postupem zabránit jejímu nepříznivému průběhu.
prof. MUDr. Zdeněk Kadaňka, CSc.
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: zkadan@fnbrno.czPřijato k recenzi: 14. 4. 2010
Přijato do tisku: 25. 5. 2010Recenzenti:
doc. MUDr. Petr Suchomel, Ph.D.
prof. MUDr. Josef Bednařík, CSc.
MUDr. Jan Hromadaprof. MUDr. Zdeněk Kadaňka, CSc.
Prof. MU Dr. Zdeněk Kadaňka, CSc., absolvoval studium na lékařské fakultě v Brně v letech 1960 – 1966. Po promoci pracoval na oddělení neurologie v nemocnici v Novém Městě na Moravě a od roku 1976 nastoupil jako asistent Neurologické kliniky LF UJEP Brno. Byl habilitován v roce 1989 a profesorem neurologie se stal v roce 2000. V letech 1993 – 2007 byl přednostou Neurologické kliniky FN Brno. V současné době pracuje jako profesor na témže pracovišti. Prof. Kadaňka se dlouhodobě věnuje výzkumu spondylogenní cervikální myelopatie. Jeho práce věnované efektu operační léčby tohoto onemocnění jsou citovány Cochranovou knihovnou.
Vědomostní test
1. Zjistíme‑li, že nemocný má klinické příznaky z krční míchy, která z níže uvedených chorob bude jejich příčinou nejčastěji:
a) sclerosis multiplex
b) amyotrofická laterální skleróza
c) míšní nádor
d) spondylogenní cervikální myelopatie
e) avitaminóza B122. Bolesti v krční páteři se vyskytují u spondylogenní cervikální myelopatie
a) prakticky vždy
b) téměř nikdy
c) v 70 %
d) ve 25 %3. Jaké zobrazovací vyšetření je nejvhodnější u nemocných po operaci krční páteře s vloženými kovovými dlažkami či šrouby:
a) magnetická rezonance
b) CT
c) myelografie
d) myelo/ CT
e) scintigrafie
f) PET4. Pro rozhodování o operačním řešení má největší váhu:
a) klinický obraz
b) progrese klinické symptomatiky
c) nález hyperintenzit v T2 vážených MR obrazech
d) velikost příčné plochy míchy v místě komprese
e) velikost příčné plochy míchy a progrese klinické symptomatiky
f) psychický stav pacienta
g) nález hyperintenzit v T2 vážených MR obrazech a psychický stav pacienta5. Pro diagnózu SCM nemá význam přítomnost:
a) Lhermitteova příznaku
b) neobratných rukou
c) poruchy chůze
d) bolesti krční páteře
e) poruchy zadních provazců
f) závratí
g) žádný z výše uvedených6. U SCM není vhodné provádět:
a) lumbální punkci
b) vyšetření oligoklonálních proužků v likvoru
c) vyšetření elektroforézy sérových bílkovin
d) EEG
e) všechny výše uvedené7. Přirozený průběh SCM je typicky:
a) stále progresivní
b) mírně progresivní s dlouhými přestávkami
c) většinou stabilní
d) atakovitý
e) náhle vzniklý a postupně ustupující8. Index Pavlovové je důležitý pro stanovení:
a) průběhu nemoci
b) kongenitální šíře páteřního kanálu
c) prognózy chirurgického zákroku
d) vztahu pacienta k nemoci
e) výpočtu odškodnění za chorobu z povolání9. Nález spondylogenní míšní komprese u asymptomatických jedinců nad 50 let věku se vyskytuje:
a) u méně než 1 %
b) u více než 50 %
c) u více než 20 %
d) u méně než 10 %
e) prakticky nikdy10. Příčná plocha míchy v úrovni C5 – 6 je normálně:
a) více než100 mm2
b) více než 200 mm2
c) méně než 50 mm2
d) méně než 100 mm211. Klinická míšní symptomatika se začne projevovat, když příčná plocha míchy v místě maximální komprese krční míchy klesne pod:
a) 200 mm2
b) 150 mm2
c) 100 mm2
d) 60 mm2
e) 30 mm212. Které nálezy by měly zpochybnit diagnózu SCM:
a) retrobulbární neuritida
b) epileptický záchvat
c) fascikulace na dolních končetinách
d) závratě
e) migréna
f) všechny výše uvedené13. Pro diagnózu krční myelopatie je Lhermitteův příznak:
a) silně specifický
b) středně specifický
c) málo specifický
d) nespecifický14. Vrozeně úzký spinální krční míšní kanál má hodnotu indexu Pavlovové menší než:
a) 0,7
b) 0,8
c) 1,0
d) 1,515. Typický věk, ve kterém se začnou manifestovat příznaky SCM, je:
a) 40 – 45
b) 45 – 49
c) 49 – 54
d) 55 – 60
e) 60 – 7016. Lumbální spinální stenóza se kombinuje s SCM asi v:
a) 5 %
b) 15 %
c) 30 %
d) až ve 40 %17. Dobré operační výsledky je možné dosáhnout do věku maximálně:
a) 60 let
b) 70 let
c) 80 let
d) 90 let
e) není věkem omezeno18. Operační výsledky u SCM jsou mnohem lepší při:
a) předním přístupu
b) zadním přístupu
c) korpektomii
d) není mezi nimi rozdíl19. SCM se třikrát častěji vyskytuje u:
a) mužů
b) žen
c) není rozdíl v pohlaví20. SCM klinickým obrazem napodobuje příznaky:
a) amyotrofické laterální sklerózy
b) roztroušené sklerózy
c) status lacunaris
d) polyartrózy
e) všech výše uvedených
f) žádné z výše uvedenýchSprávná je jedna odpověď.
Za správné vyřešení testu získá řešitel 5 kreditů ČLK. Test můžete vyplnit na: www.csnn.eu
Sources
1. Brain WR, Northfield D, Wilkinson M. The neurological manifestations of cervical spondylosis. Brain 1952; 75(2): 187 – 225.
2. Bailey P, Casamajor L. Osteoarthritis of the spine as cause of compression of the spinal cord and its roots with reports of five cases. J Nerv Ment Dis 1911; 38 : 588 – 609.
3. Stookey B. Compression of the spinal cord due to ventral extradural cervical chondromas: Diagnosis and surgical treatment. Arch Neurol Psychiat 1928; 20 : 275 – 291.
4. Dandy W. Loose cartilage from intervertebral disk simulating tumor of the spinal cord. Arch Surg 1929; 19 : 660 – 672.
5. Peet MM, Echols DH. Herniation of the nucleus pulposus: Cause of compression of spinal cord. Arch Neurol Psychiat 1934; 432 : 924 – 932.
6. Mixter WJ, Barr JS. Rupture of the intervertebral disc with involvement of the spinal canal. N Engl J Med 1934; 211 : 210 – 215.
7. Frykholm R. Cervical nerve root compression resulting from disc degeneration and root ‑ sleeve fibrosis. Acta Chir Scand 1951; 160 : 1 – 147.
8. Mair WG, Druckman R. The pathology of spinal cord lesions and their relation to the cervical features in protrusion of the cervical intervertebral disc. Brain 1953; 76(1): 70 – 91.
9. Taylor AR. Mechanism and treatment of spinal ‑ cord disorders associated with cervical spondylosis. Lancet 1953; 1(6763): 717 – 720.
10. Clark E, Robinson PK. Cervical myelopathy: a complication of cervical spondylosis. Brain 1956; 79 : 483 – 505.
11. Bailey RW, Badgley CE. Stabilization of the cervical spine by anterior fusion. J Bone Joint Surg 1960; 42 : 535 – 624.
12. Robinson RA, Smith GW. Anterolateral cervical disc removal and interbody fusion for cervical disc syndrome. Bull Johns Hopkins Hosp 1955; 96 : 223 – 224.
13. Cloward RB. The anterior approach for removal of ruptured cervical discs. J Neurosurg 1958; 15 : 602 – 617.
14. Hirsch C. Cervical disk rupture: diagnosis and therapy. Acta Orthop Scand 1960; 30 : 172 – 186.
15. Hirabayashi K, Watanabe K, Wakano K, Suzuki N,Satomi K, Ishii Y. Expansive open ‑ door laminoplasty for cervical stenotic myelopathy. Spine 1983; 8 : 693 – 699.
16. Itoh T, Tsuji H. Technical improvement and results of laminoplasty for compressive myelopathy in the cervical spine. Spine 1980; 10 : 729 – 736.
17. Kurokawa T, Tsuyama N, Tanaka H. Enlargement of the spinal canal by the sagittal splitting of the spinous process. Bessatsu Seikeigeka 1982; 2 : 234 – 240.
18. Hosono N, Sakaura H, Mukai Y, Fujii R, Yoshikawa H.C3 – 6 laminoplasty takes over C3 – 7 laminoplasty with significantly lower incidence of axial neck pain. Eur Spine J 2006; 15(9): 1375 – 1379.
19. Scott JE, Bosworth TR, Cribb AM, Taylor JR. The chemical morphology of age‑related changes in human intervertebral disc glucosaminoglycans from cervical, thoracic and lumbar nucleus pulposus and anulus fibrosus. J Anat 1994; 184(1): 73 – 82.
20. Ogata K, Whiteside LA. Nutritional pathways of then intervertebral disc. An experimental study using hydrogen washout technique. Spine 1981; 6 : 211 – 216.
21. Holm S, Nachemson A. Immediate effects of cigarette smoke on the nutrition of the intervertebral disc of the pig. Orthop Trans 1984; 8 : 380.
22. Holm S, Nachemson A. Nutritional changes in the canine intervertebral disc after spinal fusion. Clin Orthop 1982; 169 : 243 – 258.
23. Monier VM, Sell DR, Hochfarmer J, Moskovitz R. Posttranslational protein modification by the Maillard reaction: relevance to aging of the extracellular matrix molecules. In: Buckwalter JA, Goldberg VM, Woo SLY (eds). Musculoskeletal soft tissue aging: impact on mobility. Rosemont: American Academy of Orthopaedic Surgeons 1993 : 49 – 59.
24. Bywaters EGL. The pathological anatomy of idiopathic low back pain. In: White AA III, Gordon SL (eds). American Academy of Orthopaedic Surgeons. St. Louis: CV Mosby 1982 : 144 – 177.
25. Hirabayashi K, Miyakawa J, Satomi K, Maruayama T,Wakano K. Operative results and postoperative progression of ossification among patients with ossification of cervical posterior longitudinal ligament. Spine 1981; 6(4): 354 – 364.
26. Ohtsuka K, Terayama K, Yanagihara M, Wada K, Kasuga K, Machida T et al. An epidemiological survey on ossification of ligaments in the cevical and thoracic spine in individuals over 50 years of age. Nippon Seikeigeka Gakkai Zasshi 1986; 60(11): 1087 – 1098.
27. McAfee PC, Regan JJ, Bohlman HH. Cervical cord compression from ossification of the posterior longitudinal ligament in non‑orientals. J Bone Joint Surg 1987; 69(4): 569 – 575.
28. Epstein NE. The surgical management of ossification of the posterior longitudinal ligament in 43 North Americans. Spine 1994; 19(6): 664 – 672.
29. Videman T, Nurminen M, Troup JD. Lumbar spinal pathology in cadaveric material in relation to history of back pain, occupation, and physical loading. Spine 1990; 15(8): 728 – 740.
30. Heliövaara M, Vanharanta H, Korpi J et al. Herniated lumbar disc syndrome and vertebral canals. In: Heliövaara M (ed). Epidemiology of sciatica and herniated lumbar intervertebral disc. Helsinki: Social Insurance Institution 1988 : 433 – 435.
31. Wolf BS, Khilnani M, Malis LI. The sagittal diameter of bony cervical spinal canal and its significance in cervical spondylosis. J Mt Sinai Hosp 1956; 23(3): 283 – 292.
32. Adams CB, Logue V. Studies in cervical spondylotic myelopathy. II. The movement and contour of the spine in relation to the neural complications of cervical spondylosis. Brain 1971; 94(3): 560 – 586.
33. Epstein BS, Epstein JA, Jones MD. Cervical spinal stenosis. Radiol Clin North Am 1977; 15(2): 215 – 226.
34. Countee RW, Vijayanathan T. Congenital stenosis of the cervical spine: diagnosis and management. J Nat Med Assoc 1979; 71(3): 257 – 264.
35. Pavlov H, Torg JS, Robie B, Jahre C. Cervical spinal stenosis: determination with vertebral body ratio method. Radiology 1987; 164(3): 771 – 775.
36. Taylor AR. Vascular factor in the myelopathy associated with cervical spondylosis. Neurology 1964; 14 : 62 – 68.
37. Doppman JL. The mechanism of ischemia in anteroposterior compression of the spinal cord. Invest Radiol 1990; 25(4): 444 – 452.
38. Bohlman HH, Emery SE. The pathophysiology of cervical spondylosis and myelopathy. Spine 1998; 13(7): 843 – 847.
39. Gooding MR. Pathogenesis of myelopathy in cervical spondylosis. Lancet 1974; 2(7890): 1180 – 1181.
40. Wilkinson M. The morbid anatomy of cervical spondylosis and myelopathy. Brain 1960; 83 : 589 – 617.
41. Brown RH, Schauble JF, Miller NR. Anemia and hypotension as contributors to perioperative loss of vision. Anaesthesiology 1994; 80(1): 222 – 226.
42. Williams EL, Hart WM, Templehoff R. Postoperative optic neuropaty. Anesth Analg 1995; 80(5): 1018 – 1029.
43. Myers MA, Hamilton SR, Bogosian AJ, Smith CH, Wagner TA. Visual loss as a complication of spine surgery. Spine 1997; 22(12): 1325 – 1329.
44. Kawaguchi T, Fujita S, Hosoda K, Shibata Y, Iwakura M, Tamaki N. Rotational occlusion of the vertebral artery by transverse process hyperrotation and unilateral apophyseal point subluxation. Case report. J Neurosurg 1997; 86(6): 1031 – 1035.
45. Oga M, Yuge I, Terada K, Shimizu K, Sugioka Y. Tortuosity of the vertebral Artury in patients with cervical spondylotic myelopathy. Risk factor of vertebral artery injury during anterior cervical decompression. Spine 1996; 21(9): 1085 – 1089.
46. Lesoin F, Bouasakao N, Clarisse J, Rouseaux M, Jomin M. Results of surgical treatment of radiculomyelopathy caused by cervical arthrosis based on 1000 operations. Surg Neurol 1985; 23(4): 350 – 355.
47. Chozick BS, Watson P, Greenblatt SH. Internal carotid artery thrombosis after cervical corpectomy. Spine 1994; 19(19): 2230 – 2232.
48. Taylor AR. The mechanism of injury to the spinal cord in the neck without damane to the vertebral column. J Bone Joint Surg 1951; 33(4): 543 – 547.
49. Waltz TA. Physical factors in the production of the myelopathy of cervical spondylosis. Brain 1967; 90(2): 395 – 404.
50. Kelsey JL. An epidemiological study of the relationship between occupations and acute herniated lumbar intervertebral discs. Int J Epidemiol 1975; 4(3): 197 – 205.
51. Porter RW. Does hard work prevent disc protrusions? Clin Biomech 1987; 2 : 196 – 198.
52. Bigos SJ, Spengler DM, Martin NA, Zeh J, Fisher L, Nachemson A. Back injuries in industry: a retrospective study III. Employee‑related factors. Spine 1986; 11(3): 252 – 256.
53. Magora A. Investigation of the relation between low back pain and occupation. 3. Physical requirements: sitting, standing and weight lifting. IMS Ind Med Surg 1972; 41(12): 5 – 9.
54. Kelsey JL, Hardy RJ. Driving of motor vehicles as a risk factor for acute herniated lumbar intervertebral disc. Am J Epidemiol 1975; 102(1): 63 – 73.
55. Damkot DK, Pope MH, Lord J, Frymoyer JW. The relationship between work history, work environment and low ‑ back pain in men. Spine 1984; 9(4): 395 – 399.
56. Troup JD, Roantree WB, Archibald RM. Survey of causes of lumbar spinal diasability. A methodological study. New Scientist 1970; 8 : 65 – 67.
57. Boden BP, Jarvis CG. Spinal injuries in sports. Neurol Clin 2008; 26(1): 63 – 78.
58. Bigos SJ, Battié MC, Spengler DM, Fisher LD, Fordyce WE, Hansson TH et al. A prospective study of work preceptions and psychosocial factors affecting the report of back injury. Spine 1986; 16(1): 1 – 6.
59. Brain WR, Wilkinson M. Cervical spondylosis and other disorders of the cervical spine. London: William Heinemann 1967 : 232.
60. Gregorius FK, Estrin T, Crandall PH. Cervical spondylotic radiculopathy and myelopathy. Arch Neurol 1976; 33(9): 618 – 625.
61. Sadasivan KK, Reddy RP, Albright JA. The natural history of cervical spondylotic myelopathy. Yale J Biol Med 1993; 66(3): 235 – 242.
62. Kadaňka Z, Bednařík J, Voháňka S, Vlach O. Spondylotic cervical myelopathy: a clinical update. Scripta Medica 1996; 65 : 157 – 172.
63. Simeone FA, Rothman RH. Cervical disc disease. In: Rothman RH, Simeone FA (eds). The Spine. 2nd ed. Philadelphia: WB Saunders 1982 : 440 – 476.
64. Montgomery DM, Brower RS. Cervical spondylotic myelopathy. Clinical syndrome and naural history. Orthop Clin North Am 1992; 23(3): 487 – 493.
65. Moore AP; Blumhardt LD. A prospective survey of the causes of non‑traumatic spastic paraparesis and tetraparesis in 585 patients. Spinal Cord 1997; 35(6): 361 – 367.
66. Good DC, Couch JR, Wacaser L. Numb, clumsy hands and high cervical spondylosis. Surg Neurol 1984; 22(3): 285 – 291.
67. Ono K, Ebera S, Fuji T, Yonenobu K, Fujiwara K, Yamashita K. Myelopathy hand: New clinical signs of cervical cord damage. J Bone Joint Surg 1987; 69(2): 215 – 219.
68. Ebara S, Yonenobu K, Fujivara F, Yamashita K, Ono K. Myelopathy hand characterized by muscle wasting. Spine 1988; 13(7): 785 – 791.
69. Gorter K. Influence of laminectomy on the course of cervical myelopathy. Acta Neurochir 1976; 33(3 – 4): 265 – 281.
70. Crandall PH, Batzdorf U. Cervical spondylotic myelopathy. J Neurosurg 1966; 25(1): 57 – 66.
71. Bernhardt M, Hynes RA, Blume HW, White AA jr. Current concepts review. Cervical spondylotic myelopathy. J Bone Joint Surg 1993; 75(1): 119 – 128.
72. Law MD jr, Bernhardt M, White AA jr. Evaluation and management of cervical spondylotic myelopathy. J Bone Joint Surg 1994; 76A: 1420 – 1433.
73. Epstein N, Epstein J, Carras R. Cervical spondylostenosis and related disorders in patients over 65: current management and diagnostic techniques. Orthotransactions 1987; 11 : 15.
74. Hult L. Cervical, dorsal and lumbar spinal syndromes: a field investigation of a non‑selected material of 1200 workers in different occupations with special reference to disc degeneration and so ‑ called muscular rheumatism.. Acta Orthop Scand 1954; 17 (Suppl): 1 – 102.
75. Horal J. The clinical appearance of low back disorders in the city of Gothenburg, Sweden. Comparison of incapacitated probands with matched controls. Acta Orthop Scand 1969; 118 (Suppl): 1 – 109.
76. Epstein JA. Management of cervical spinal stenosis, spondylosis, and myeloradiculopathy. In: Tindall GT (ed). Contemporary neurosurgery. Baltimore: Williams and Wilkins 1985 : 1 – 6.
77. LaRocca H. Cervical spondylotic myelopathy: natural history. Spine 1988; 13(7): 854 – 855.
78. Epstein JA, Janin Y, Carras R, Lavine IS. A comparative study of the treatment of the cervical spondylotic myelopathy. Experience with 50 cases treated by means of extensive laminectomy, foraminotomy, and excision of osteophytes during the past 10 years. Acta Neurochir 1982; 61(1 – 3): 89 – 104.
79. Symon L, Lavender P. The surgical treatment of cervical spondylotic myelopathy. Neurosurg 1967; 17(2): 117 – 127.
80. Lees F, Turner JW. Natural history and prognosis of cervical spondylosis. Br Med J 1963; 2(5373): 1607 – 1610.
81. Nurick S. The pathogenesis of the spinal cord disorder associated with cervical spondylosis. Brain 1972; 95(1): 87 – 100.
82. Epstein JA, Epstein NE. The surgical management of cervical spinal stenosis, spondylosis, and myeloradiculopathy by means of the posterior approach. In: Cervical Spine Editorial Committee (eds). The Cervical spine. 2nd ed. Philadelphia: LB Lippincott 1989 : 625 – 643.
83. Batzdorf U. Complex cervical myelopathies. In: Frymoyer JW (ed). The adult spine; principles and practice. New York: Raven Press 1991 : 1207 – 1218.
84. Kadanka Z, Bednarík J, Vohánka S, Vlach O. Stav operační terapie spondylogenní cervikální myelopatie v České a Slovenské republice v roce 1994. Rozhl Chir 1996; 75(11): 535 – 540.
85. Teresi LM, Lufkin RB, Reicher MA, Moffit BJ, Vinuela FV, Wilson GM et al. Asymptomatic degenerative disk disease and spondylosis of the cervical spine. MR imaging. Radiology 1987; 164(1): 83 – 88.
86. Modic MT, Ross JS, Masaryk TJ. Imaging of degenerative disease of the cervical spine. Clin Orthop Relat Res 1989; 239 : 109 – 120.
87. Bonek R, Orlicka K, Macijek Z. Demyelinating lesions in the cervical cord in multiplex sclerosis 10 years after onset of the disease. Correlation between MRI parameters and clinical course. Neurol Neurochir Pol 2007; 41(3): 229 – 233.
88. Selviaridis P, Zountsas B, Chatzisotiriou A, Zaraboukas T, Gerdemeli A. Demyelinitating plaque imitates an intramedullary tumour. Clin Neurol Neurosurg 2007; 109(10): 905 – 909.
89. White JB, Miller GM, Lakton KF, Krauss WE. Nonenhancing tumors of the spinal cord. J Neurosurg Spine 2007; 7(4): 403 – 407.
90. Baek WS, Desai NP. ALS: pitfalls in the diagnosis. Pract Neurol 2007; 7(2): 74 – 81.
91. Zevgaridis D, Medele RJ, Hamburger C, Steiger HJ, Reulen HJ. Cavernous hemangiomas of the spinal cord. A review of 117 cases. Acta Neurochir (Wien) 1999; 141(3): 237 – 245.
92. Waziri A, Vonsattel JP, Kaiser MG, Anderson RC. Expansile, enhancing cervical cord lesion with an associated syrinx secondary to demyelination. Case report and review of the literature. J Neurosurg Spine 2007; 6(1): 52 – 56.
93. Epstein NE, Hyman R, Epstein JA, Rosenthal AD. “Dynamic” MRI scanning of the cervical spine. Spine 1988; 13(8): 937 – 938.
94. Fujiwara K, Yonenobu K, Ebara S, Yamashita K, Ono K. The prognosis of surgery for cervical compression myelopathy An analysis of the factors involved. J Bone Joint Surg 1989; 71(3): 393 – 398.
95. Koyanagi T, Hirabayashi K, Satomi K, Toyama V, Fujimura Y. Predicability of operative results of cervical compression myelopathy on preoperative computed tomographic myelography. Spine 1993; 18(14): 1958 – 1963.
96. Kadanka Z, Bednarík J, Vohánka S, Vlach O, Stejskal L, Chaloupka R et al. Conservative treatment vs surgery in spondylotic cervical myelopathy: prospective randomised study. Eur Spine J 2000; 9(6): 538 – 544.
97. Adams C. Cervical spondylotic radiculopathy and myelopathy. Handbook of Clinical Neurology. 26th ed. Amsterdam: North ‑ Holland Publishing 1976 : 97 – 112.
98. Okada Y, Ikata T, Katoh S, Yamada H. Morphologic analysis of the cervical spinal cord, dural tube, and spinal canal by magnetic resonance in normal adults and patients with cervical spondylotic myelopathy. Spine 1994; 19(20): 2331 – 2335.
99. Tsurumi T, Goto N, Shibata M, Goto J, Kamiyama A. A morphological comparison of cervical spondylotic myelopathy. Okajimas Folia Anat Jpn 2005; 81(6): 119 – 122.
100. Kadanka Z, Kerkovsky M, Bednarik J, Jarkovsky J. Cross ‑ sectional transverse area and hyperintensities on MR in relation to the clinical picture in cervical spondylotic myelopathy. Spine 2007; 32(23): 2573 – 2577.
101. Hamburger C, Büttner A, Uhl E. The cross ‑ sectional area of the cervical spinal canal in patients with cervical spondylotic myelopathy. Correlation of preoperative and postoperative area with clinical symptoms. Spine 1997; 22(17): 1990 – 1995.
102. Takahashi M, Sakamoto Y, Miyawaki M, Bussaka H.Increased MR signal intensity secondary to chronic cervical cord compression. Neuroradiology 1987; 29(6): 550 – 556.
103. Mehalic TF, Pezzut RT, Appelbaum BI. Magnetic resonance imaging and cervical spondylotic myelopathy. Neurosurgery 1990; 26(2): 217 – 227.
104. Haupts M, Haan J. Further aspects of MR ‑ signal enhancements in stenosis of the cervical spinal canal. MRI investigations in correlation to clinical and CSF findings. Neuroradiology 1988; 30(6): 545 – 546.
105. Matsuda Y, Miyazaki K, Tada K, Yasuda A, Nakayama T, Murakami H et al. Increased MR signal intensity due to cervical myelopathy. Analysis of 29 surgical cases. J Neurosurg 1991; 74(6): 887 – 892.
106. Yagi M, Ninomiya K, Kihara M, Horiuchi Y. Long‑term surgical outcome and risk factors in patients with cervical myelopathy and change in signal intensity of intramedullary spinal cord on Magnetic Resonance imaging. J Neurosurg Spine 2010; 12(1): 59 – 65.
107. Kohno K, Kumon Y, Oka Y, Matsui S, Ohu S, Sasaki S. Evaluation of prognostic factors following expansive laminoplasty fr cervical stenotic myelopathy. Surg Neurol 1997; 48(3): 237 – 245.
108. Bucciero A, Vizioli L, Carangelo B, Tedeschi G. MR signal enhancement in cervical spondylotic myellopathy. Correlation with surgical results in 35 cases. J Neurochir Sci 1993; 37(4): 217 – 222.
109. Matsumoto M, Toyama Y, Ishikawa M, Chiba K, Suzuki N, Fujimora Y. Increase signal intensity of the spinal cord on magnetic resonance images in cervical compressive myelopathy. Does it predict the outcome of conservative treatment? Spine 2000; 25(6): 677 – 682.
110. Singh A, Crockard HA, Platts A, Stevens J. Clinical and radiological correlates of severity and surgery‑related outcome in cervical spondylosis. J Neruosurg 2001; 94 (Suppl 2): 189 – 198.
111. Chatley A, Kumar R, Jain VK, Behari S, Sahu RN. Effect of spinal cord signal intensity changes on clinical outcome after surgery for cervical spondylotic myelopathy. J Neurosurg Spine 2009; 11(5): 562 – 567.
112. Wada E, Yonenobu K, Suzuki S. Can intramedullary signal change on MRI predict surgical outcome in cervical spondylotic myelopathy? Spine 1999; 24(5): 455 – 461.
113. Morio Y, Teshima R, Nagashima H, Nawata K,Yamasaki D, Nanjo Y. Correlation between operative outcomes of cervical compression myelopathy and MRI of the spinal cord. Spine 2001; 26(11): 1238 – 1245.
114. Penning L, Wilmink JT, Van Woerden HH, Knol E.CT myelographic findings in degenerative disorders of the cervical spine: clinical significance. AJR Am J Neuroradiol 1986; 146(4): 793 – 801.
115. Restuccia D, Di Lazzaro V, Valeriani M, Aulisa L, Galli M, Tonali P et al. The role of upper limb somatosensory evoked potentials in the management of cervical spondylotic myelopathy. Electroencephalogr Clin Neurophysiol 1994; 92(6): 502 – 509.
116. Bednarík J, Kadanka Z, Vohánka S, Stejskal L, Vlach O, Schröder R. The value of somatosensory and motor evoked potentials in predicting and monitoring the effect of the therapy in spondylotic cervical myelopathy. Prospective randomised study. Spine 1999; 24(15): 1593 – 1598.
117. Bednarík J, Kadanka Z, Vohánka S, Novotný O, Surelová D, Filipovicová D et al. The value of smotatosensory and motor evoked potentials in pre‑clinical cervical cord compression. Eur Spine J 1998; 7(6): 493 – 500.
118. Yonenobu K, Okada K, Fuji T, Fujiwara K, Yamashita K, Ono K. Causes of neurologic deterioration following surgical treatment of cervical myelopathy. Spine 1986; 11(8): 818 – 823.
119. Benzel EC, Lancon J, Kesterson L, Hadden T. Cervical laminectomy and dentate ligament section for cervical spondylotic myelopathy. J Spin Disord 1991; 4(3): 286 – 295.
120. Murphy MJ, Lieponis JV. Nonoperative treatment of cervical spine pain. In: Cervical Spine Editorial Committee (eds). The Cervical spine. 2nd ed. Philadelphia: LB Lippincott 1989 : 670 – 677.
121. Wilson SP, Iacobo C, Rocco AG, Ferrante FM, Lipson SJ. Cervical epidural steroid injection (CESI): Clinical classification as predictor of clinical outcome. New Orleans 1989.
122. Sloop PR, Smith DS, Goldenberg E, Dore C. Manipulation for chronic neck pain. Spine 1982; 7(6): 532 – 535.
123. Toto BJ. Cervical spondylitic myelopathy: a case report. J Manipulative Physiol Ther 1986; 9(1): 43 – 46.
124. Smith GW, Robinson RA. The treatment of certain cervical spine disorders by anterior removal of the intervertebral disc and interbody fusion. J Bone Joint Surg 1958; 40(3): 607 – 624.
125. Bailey RW, Badgley CE. Stabilization of the cervical spine by anterior fusion. J Bone Joint Surg 1960; 42A: 565 – 594.
126. Bernard TN jr, Whitecloud TS jr. Cervical spondylotic myelopathy and myeloradiculopathy. Anterior decompression stabilization with autogenous fibula strut graft. Clin Orthop 1987; 221 : 149 – 160.
127. Hanai K, Fujiyoshi F, Kamei K. Subtotal vertebrectomy and spinal vision for cervical spondylotic myelopathy. Spine 1986; 11(4): 310 – 315.
128. Teramoto T, Ohmori K, Takatsu T, Inoure H, Ishida Y, Suzuki K. Long‑term results of the anterior cervical spondylodesis. Neurosurgery 1994; 35(1): 64 – 68.
129. Williams KE, Paul R, Dewan Y. Functional outcome of corpectomy in cervical spondylotic myelopathy. Indian J Orthop 2009; 43(2): 205 – 209.
130. Goto S, Mochizuki M, Kita T, Kobayashi Y, Sodeyama T, Watanabe T et al. Anterior surgery in four consecutive technical phases for cervical spondylotic myelopathy. Spine 1993; 18(14): 1968 – 1973.
131. Cheng SC, Yen CH, Kwok TK, Wong WC, Mak KH. Anterior spinal fusion versus laminoplasty for cervical spondylotic myelopathy: a retrospective review. J Orthop Surg (Hong Kong) 2009; 17(3): 265 – 268.
132. Hukuda S, Ogata M, Mochizuki T, Shichikawa K.Laminectomy versus laminoplasty for cervical myelopathy: brief report. J Bone Joint Surg 1988; 70(2): 325 – 326.
133. Emery SE. Cervical spondylotic myelopathy: diagnosis and treatment. J Am Acad Orthop Surg 2001; 9(6): 376 – 388.
134. Pang CH, Leung HB, Yen CH. Laminoplasty after anterior spinal fusion for cervical spondylotic myelopathy. J Orthop Surg (Hong Kong) 2009; 17(3): 269 – 274.
135. Mochizuki M, Aiba A, Hashimoto M, Fujiyoshi T,Yamazaki M. Cervical myelopathy in patients with ossification of the posterior longitudinal ligament. J Neurorochir Spine 2009; 10(2): 122 – 128.
136. Boni M, Cherubino P, Benazzof J. Multiple subtotal somatectomy. Technique and evaluation in a series of thirty ‑ nine cases. Spine 1984; 9(4): 358 – 362.
137. Saunders RL, Bernini PM, Shirreffs TG, Reeves AG. Central corpectomy for cervical spondylotic myelopathy: a consecutive series with long‑term follow up evaluation. J Neurosurg 1991; 74(2): 163 – 170.
138. Isu T, Minoshima S, Mabuchi S. Anterior decompression and fusuion using bone grafts obtained from cervical vertebral bodies for ossification of the posterior longitudinal ligament of the cervical spine: technical note. Neurosurgery 1997; 40(4): 866 – 870.
139. Jho HD. Spinal cord decompression via microsurgical foraminotomy for spondylotic cervical myelopathy. Minim Invasive Neurosurg 1997; 40(4): 124 – 129.
140. Hidai Y, Ebara S, Kamimura M, Tateiwa Y, Itoh H,Kinoshita T et al. Treatment of cervical compressive myelopathy with a new dorsolateral decompressive procedure. J Neurosurg 1999; 90(2): 178 – 185.
141. George B, Gauthier N, Lot G. Multisegmental cervical spondylotic myelopathy and radiculopathy treated by multilevel oblique corpectomies without fusion. Neurosurgery 1999; 44(1): 81 – 90.
142. Dalbayrak S, Yilmaz M, Naderi S. “Skip” corpectomy in the treatment of multilevel cervical spondylotic myelopathy and ossified posterior longitudinal ligament. J Neurosurg Spine 2010; 12(1): 33 – 38.
143. Tani S, Homma T, Uchikado H, Nagashima H, Isoshima A, Ohhasi H et al. New surgical technique to secure the bone strut during anterior cervical corpectomy and fusion: kusabi fixation technique‑technical note. Neurol Med Chir (Tokyo) 2010; 50(1): 83 – 86.
144. Tanaka N, Nakanishi K, Fujimoto Y, Sasaki H, Kamei N, Hamasaki T et al. Clinical results of cervical myelopathy in patients older than 80 years of age:evaluation of spinal function with motor evoked potentials. J Neurosurg Spine 2009; 11(4): 421 – 426.
145. Kikuike K, Miyamoto K, Hoste H, Shimizu K. One‑staged combined cervical and lumbar decompression for patients with tandem spinal stenosis on cervical and lumbar spine: analyses of clinical outcome with minimum 3 years follow‑up. J Spinal Disord Tech 2009; 22(8): 593 – 601.
146. Matz PG, Anderson PA, Groff MW, Heary RF, Holly LT, Kaiser MG et al. Cervical laminoplasty for the treatment of cervical degenerative myelopathy. J Neurosurg Spine 2009; 11(2): 157 – 169.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 3-
All articles in this issue
- Thoracolumbar Disc Injury – Indication for Anterior Disc Replacement Using Magnetic Resonance Imaging
- Comparison of Aphasia Severity in Dementia and Stroke Using MASTcz, and Aphasia in Relation to Severity of Cognitive Deficit
- Standardization of the Czech Version of The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Changes in Perfusion Computed Tomography after Conventional Extra‑ Intracranial Bypass Surgery
- Fractures of the Fifth Lumbar Vertebra
- Sexual Dysfunction and its Incidence in Patients with Epilepsy
- The Use of Regional Cerebral Oximetry as a Non‑ invasive Method to Monitor Neurointensive Care Patients
- The Assessment of Outcome in Carotid Artery Operations Performed in the Period 1997– 2009
- Surgical Treatment of Neuroepithelial Tumours of the Central Surface of the Sacrum – Case Reports
- Complicated Herpetic Necrotising Meningoencephalitis Requiring Neurosurgical Intervention – a Case Report
- Spondylotic Cervical Myelopathy
- Nuclear Medicine Examination of Cerebrovascular Reserve Capacity and Other Complementary Methods
- Thunderclap Headache
- Complete Hearing Restoration in Vestibular Schwannoma with Repeated Sudden Hearing Loss
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spondylotic Cervical Myelopathy
- Fractures of the Fifth Lumbar Vertebra
- Standardization of the Czech Version of The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Complicated Herpetic Necrotising Meningoencephalitis Requiring Neurosurgical Intervention – a Case Report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career