-
Medical journals
- Career
Efekt imunoterapie u mladého pacienta s mismatch repair deficientním karcinomem rekta – kazuistika
Authors: T. Sokop; R. Obermannová
Authors‘ workplace: Klinika komplexní onkologické péče LF MU a MOÚ Brno
Published in: Klin Onkol 2023; 36(3): 241-245
Category: Case Report
doi: https://doi.org/10.48095/ccko2023241Overview
Východiska: Incidence kolorektálního karcinomu (KRK) ve věkové skupině mladých nemocných roste. KRK je u těchto pacientů častěji histologicky agresivnějším typem nádoru, diagnostikovaným v pozdních klinických stadiích onemocnění. Dalším z charakteristických rysů je vyšší frekvence mismatch repair deficientních (dMMR) karcinomů. V jejich léčbě může být efektivní léčebnou modalitou imunoterapie, kterou lze dosáhnout prodloužení celkového přežití i zlepšení kvality života. Naopak efekt chemoterapie může být nižší. Případ: Prezentujeme případ 35letého pacienta léčeného primární terapií pro lokálně pokročilý dMMR karcinom rekta. Neoadjuvantní chemoradioterapii následovala resekce rekta, kterou doprovázely závažné pooperační komplikace. Navíc se objevil časný lokální relaps onemocnění, rezistentní vůči systémové léčbě chemoterapií. Po progresi onemocnění byla zahájena 2. linie léčby pembrolizumabem. Výsledky: Léčba pembrolizumabem vedla k částečné regresi onemocnění a následně jeho stabilizaci, která trvá již 15 měsíců. Výrazným benefitem je zlepšení kvality pacientova života – např. ustálení krevního obrazu a regrese průjmů. Navíc dosavadní léčba proběhla bez rozvoje závažné toxicity. Závěr: Testování mikrosatelitní instability v rámci managementu lokálně pokročilého i metastatického kolorektálního karcinomu má zásadní význam v nastavení správného léčebného postupu. Do budoucna můžeme očekávat výsledky dalších studií, které se budou snažit prokázat účinek imunoterapie nejen u metastatických onemocnění, ale i resekabilních a potenciálně resekabilních dMMR karcinomů rekta a kolonu v neoadjuvantním režimu.
Klíčová slova:
kolorektální karcinom – imunoterapie – checkpoint inhibitory – pembrolizumab – mladý dospělý
Úvod
Kolorektální karcinom (KRK) je celosvětově třetím nejčastějším nádorovým onemocněním. ČR dlouhodobě patří mezi země s vysokou incidencí, dle statistiky Ústavu zdravotnických informací a statistiky v roce 2018 byla na 14. místě mezi evropskými zeměmi, s mediánem věku diagnózy 70 let [1]. Incidence i mortalita kolorektálního karcinomu ve většině rozvinutých zemí klesá, pravděpodobně z velké části vlivem screeningových programů [2]. Tento trend je ale dle epidemiologických analýz opačný u mladých nemocných [3]. Například v USA vzrostla incidence kolorektálního karcinomu ve věkové skupině 20–49 let z 8,6 na 100 000 obyvatel v roce 1992, na 13,1 na 100 000 v roce 2016, s výraznějším podílem nárůstu u karcinomu rekta [4]. V mezinárodním srovnání je tento nárůst zaznamenán ve většině ekonomicky vyspělých zemí [3], v ČR však podrobná analýza chybí. Předpokládá se, že v roce 2030 bude v USA diagnostikovaných 23 % rektálních karcinomů a 11 % karcinomů kolon u pacientů mladších 50 let [5]. Důvod vzestupu incidence zatím není objasněn. Nádory mladých nemocných mají odlišnou klinicko-patologickou charakteristiku. Podle velké studie publikované Rodriguezem et al. je u pacientů do 40 let častěji postižený levostranný tračník a sigma, onemocnění je diagnostikováno později, s vyšším výskytem lokálně pokročilých či metastatických nádorů a histologicky je charakterizováno agresivnějšími variantami (signet cell karcinom) [6], z molekulárního hlediska vynikají nádory mladých nemocných vyšší mutační náloží [7] a častějším výskytem tumorů s deficiencí mismatch repair systému (dMMR), která vede k mikrosatelitové instabilitě (MSI-H) [8,9]. dMMR/MSI-H tumory jsou v populaci zastoupeny asi u 15–20 % tumorů kolon a 5–10 % tumorů rekta, nicméně s významným rozdílem mezi věkovými skupinami. Například dMMR tumory kolon jsou v některých studiích diagnostikovány až u 25 % pacientů mladších 50 let, oproti 7–10 % u pacientů starších 50 let [10]. Většina dMMR tumorů vzniká na podkladě sporadických mutací [5], menší část má hereditární příčinu. Zastoupení hereditárních syndromů u mladých pacientů je při srovnání věkových skupin vyšší. Celkově 5 % KRK vznikne na podkladě hereditárního syndromu, u pacientů mladších 50 let je Lynchův syndrom (LS) jako nejčastější hereditární predispozice příčinou asi 8 % nádorů kolorekta (vs. 2–4 % v celkové populaci), dalších 8 % časně vzniklých tumorů způsobí jiný hereditární syndrom [11]. Ve skupině pacientů mladších 40 let je prevalence hereditárního KRK až 30 % [12].
Současným standardem léčby lokálně pokročilého karcinomu rekta je neoadjuvantní chemoradioterapie, případně totální neoadjuvantní terapie, a to bez ohledu na mutační stav dMMR [13]. Kurativní léčba však přináší riziko časných ale i pozdních nežádoucích účinků, které z dlouhodobého hlediska negativně ovlivňují kvalitu života vyléčeného pacienta. Jedná se zejména o nežádoucí účinky střevní (amputace rekta, dehiscence anastomózy…), urogenitální (inkontinence) či sexuální dysfunkce (erektilní dysfunkce, dyspareunie) [13]. Pacienti s metastatickým kolorektálním karcinomem jsou léčeni na základě prediktivních markerů kombinací chemoterapie a cílené léčby. dMMR/MSI-H tumory jsou rezistentní vůči standardní systémové léčbě, a naopak senzitivní k imunoterapii checkpoint inhibitory. Dle evropských a českých guidelines je imunoterapie checkpoint inhibitory léčebným standardem dMMR metastatického KRK již v 1. linii [14,15]. Vysoká léčebná odpověď u této skupiny onemocnění vedla ke studiím, které ověřují klinickou účinnost imunoterapie v neoadjuvantním podání. Malá americká akademická studie fáze II dokladuje 100% počet kompletních remisí u dMMR nádorů rekta a nastiňuje možnost kurativní léčby imunoterapií jako orgán záchovného postupu. Podobné pozitivní výsledky byly zaznamenány i u nádorů kolon [16–18]. Nadějné výsledky těchto studií naznačují možnou změnu terapeutického postupu do budoucna.
V následující kazuistice popisujeme případ 35letého pacienta léčeného pro lokálně pokročilý dMMR kolorektální karcinom.
Případ
V prosinci 2019 byl 35letý pacient hospitalizován na interním oddělení okresní nemocnice pro měsíc trvající příměs čerstvé krve ve stolici, intermitentní průjmy s tenesmy a pro celkové zhoršení stavu, především výraznou únavu, námahové palpitace s dušností a nechutenství. Laboratorně byla zjištěna mikrocytární hypochromní anemie G4 s hladinou hemoglobinu 42 g/l, klinicky manifestovaná anemickým syndromem. Pacientův stav byl kompenzován intenzivní hemosubstitucí a bylo zahájeno došetřování etiologie. Kolonoskopické vyšetření odhalilo cirkulární tumor středního rekta ve vzdálenosti 10–19 cm od anu. V lednu 2020 pacient podstoupil stagingová vyšetření – na MR pánve popsán objemný, převážně exofyticky rostoucí tumor rekta v délce 13 cm, přesahující muscularis propria o 17 mm, s patrnou regionální lymfadenopatií (min. 10 zvětšených uzlin), bez infiltrace ostatních orgánů malé pánve (obr. 1, 2). CT plic a břicha neprokázalo vzdálenou diseminaci. TNM klasifikace tumoru byla cT3d N2b M0, klinické stadium IIIC. Histologicky byl tumor popsaný jako low grade adenokarcinom intestinálního typu, prediktivní vyšetření prokázalo defekt ve dvou proteinech MMR systému, šlo tedy o dMMR tumor (následně bez germinálně prokázaného Lynchova syndromu), RAS a BRAF wild type.
Image 1. Lokálně pokročilý karcinom rekta na vstupním stagingovém MR pánve (axiální projekce). 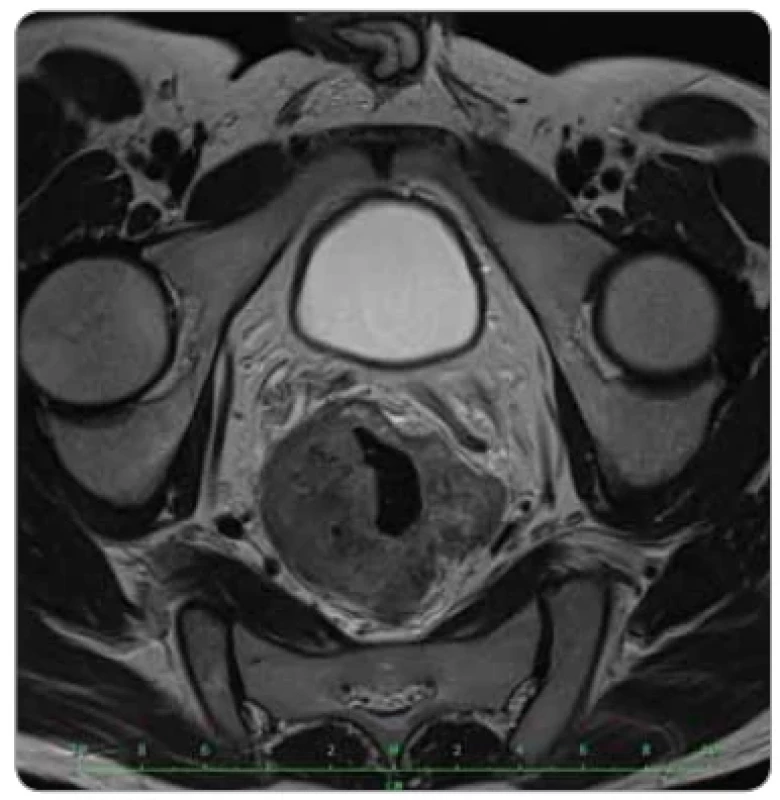
Image 2. Lokálně pokročilý karcinom rekta na vstupním stagingovém MR pánve (sagitální projekce). 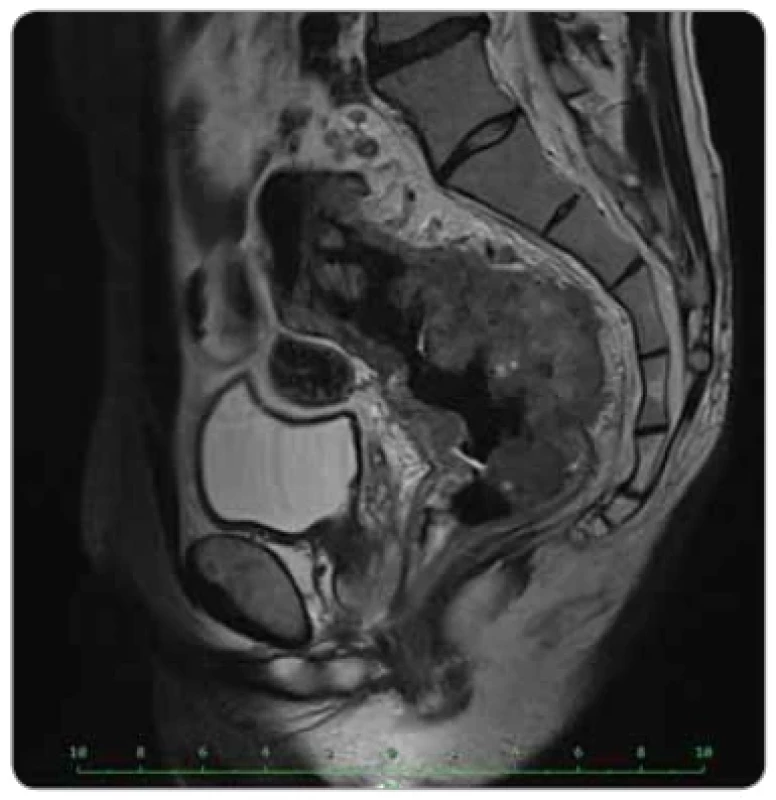
Pacient byl indikován k zahájení neo - adjuvantní terapie, tři cykly chemoterapie v režimu FOLFOX následoval dlouhý kurz chemoradioterapie (CHTRT) v celkové dávce 45 Gy ve 25 frakcích, konkomitantně s 5-fluorouracilem. Neoadjuvantní léčbu pacient absolvoval ve spádovém Komplexním onkologickém centru, s přiměřenou tolerancí – trvala anemizace a intermitentní průjmy. Neoadjuvantní CHTRT byla ukončena v březnu 2020. Na restagingovém vyšetření magnetickou rezonancí v dubnu 2020 byla popsaná výraznější velikostní regrese výše, délky i hloubky propagace tumoru a také velikostní regrese většiny regionálních lymfatických uzlin.
Následně se v květnu přistoupilo k nízké přední resekci rekta, výkon proběhl bez komplikací, resekát rekta byl odeslán k histologickému vyšetření. Sedmý pooperační den ovšem u pacienta došlo ke zhoršení stavu, desaturaci a krátkodobé ztrátě vědomí. Akutní CT vyšetření odhalilo pneumoperitoneum na podkladě dehiscence anastomózy rekta, sterkorální peritonitis, ileozní změny tenkých kliček a bazální pneumonii. Byla indikována akutní reoperace z vitální indikace, při níž byla založena derivační sigmoideostomie a pahýl rekta překryt omentem. Pooperačně byl pacient dále stabilní, intenzivně se řešil trvající katabolismus vyžadující aktivní nutriční podporu. O dalším postupu rozhodovala multioborová indikační komise. Histologické vyšetření resekátu rekta popsalo blíže nespecifikovaný low grade adenokarcinom s mucinózní komponentou, se střední regresí po neoadjuvantní léčbě (TRG grade 2 podle Dworaka), s transperitoneální invazí, distální resekční linie bez dysplazie – ypT4 ypN0 (0/16) M0. S ohledem na celkový stav pacienta, těžké pooperační komplikace a rizikové faktory nebyla komisí indikována adjuvantní terapie. Devět měsíců od operace, v lednu 2021, byla diagnostikována lokální recidiva tumoru rekta s infiltrací mezorektální fascie, m. levator ani a semenných váčků (obr. 3). Indikována operace. Nález byl peroperačně vyhodnocen jako inoperabilní a s ohledem na MMR deficienci bylo u pacienta zažádáno o schválení pembrolizumabu na základě studie Keynote 177. V mezidobí byl pacient řešen urologem pro maligní levostrannou hydronefrózu s nutností zavedení JJ stentu, kvalitu života dále snižoval trvající únik stolice per vias naturales při enterorektální fistulaci a recidiva závažné chronické mikrocytární anemie s výraznou transfuzní dependencí (graf 1). Léčba imunoterapií byla revizním lékařem zamítnuta, proto pacient zahájil 1. linii chemoterapie režimem FOLFIRI. Po šesti cyklech došlo k další progresi, která vyústila v oboustrannou hydronefrózu, řešenou bilaterální punkční nefrostomií.
Image 3. Relaps onemocnění v pánvi na restagingové MR pánve, leden 2021. 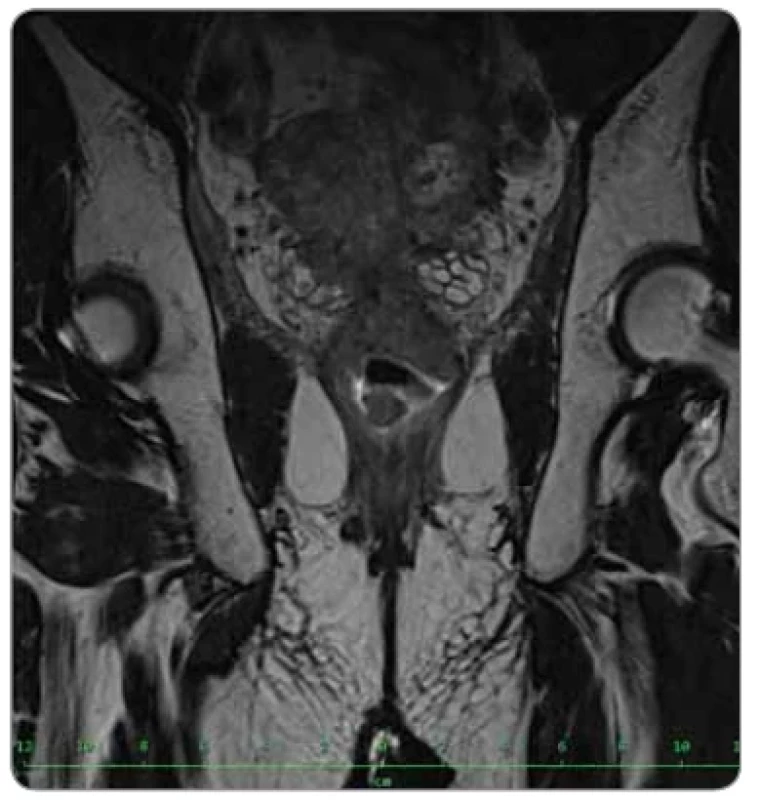
Graph 1. Měřená koncentrace hemoglobinu od prokázaného relapsu onemocnění v březnu 2021 a transfuzní dependence pacienta (celkový počet transfuzí = 51). 
Opakovanou žádost o imunoterapii již pojišťovna schválila, proto pacient od září 2021 zahájil léčbu pembrolizumabem. Léčba pembrolizumabem vedla k dosažení parciální remise onemocnění, dále k výraznému zlepšení kvality života zejména stabilizací krevního obrazu, úpravou astenie, remisí chronických průjmů a intermitentní enterorrhagie. V průběhu terapie nebyla zaznamenána žádná toxicita. V prosinci 2022, po 15 měsících léčby, trvá stabilizace onemocnění (obr. 4).
Image 4. Stabilizace onemocnění, srpen 2022. 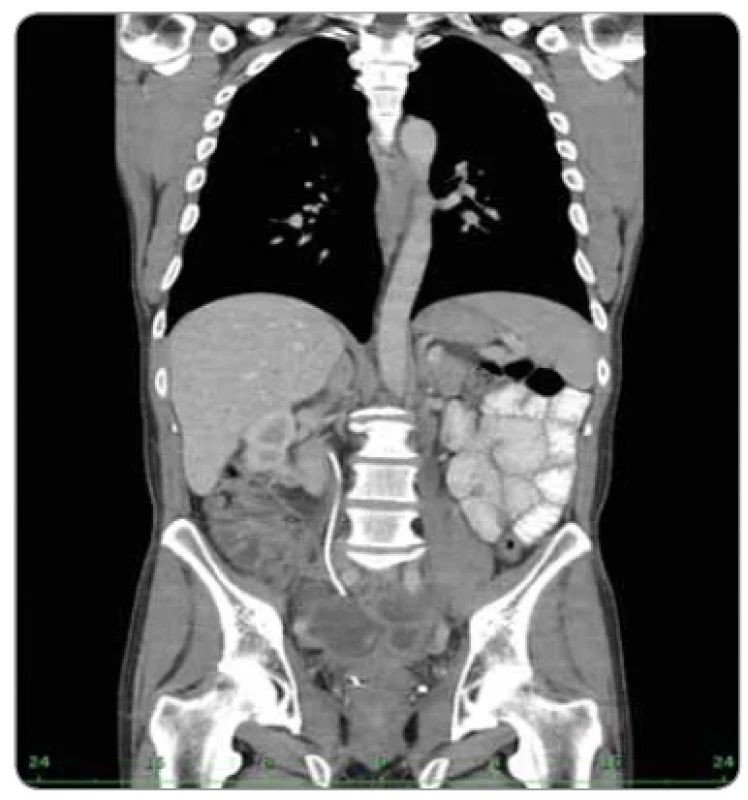
Diskuze
Totální neoadjuvantní terapie je standardním postupem v léčbě lokálně pokročilého karcinomu rekta. Léčba totální neoadjuvantní terapií snižuje riziko lokální recidivy a ve srovnání s dlouhým kurzem chemoradioterapie dosahuje až ve 28 % případů patologické kompletní remise [19]. dMMR karcinom rekta je ovšem biologicky odlišným podtypem, rezistentnějším na léčbu chemoterapií. Cercek et al. popisuje progresi tumoru na indukční chemoterapii až u 29 % pacientů [20]. Efekt chemoterapie u těchto pacientů musí být tedy intenzivněji sledován a v případě špatné odpovědi je ke zvážení rychlejší přístup k chemoradioterapii, zvláště u symptomatických pacientů, event. časnější provedení operačního výkonu. Recentně publikované studie hodnotící přínos imunoterapie u dMMR lokálně pokročilého kolorektálního karcinomu prokázaly vysokou účinnost samostatné imunoterapie, a představují tak nadějnou alternativu léčby této skupiny pacientů. První publikovanou studií byla v roce 2020 studie fáze II NICHE, která hodnotila kombinaci nivolumab/ipilimumab u pacientů s deficientním MMR (dMMR) a proficientním MMR (pMMR) kolorektálním karcinomem stadia I–III. U dMMR tumorů bylo dosaženo ve 100 % patologické odpovědi, ve 12/20 případů se jednalo o kompletní patologickou odpověď [21]. Následně v září 2022 uveřejněná studie NICHE II se 112 zařazenými pacienty potvrdila úspěšnost imunoterapie; u 99 % pacientů byla zaznamenána léčebná odpověď, přičemž 67 % z nich dosáhlo kompletní patologické remise. Podobná studie se zaměřením na lokálně pokročilý karcinom rekta, prozatím s výrazně menší kohortou pacientů, kterou publikovala Cercek et al., hodnotila 6měsíční léčbu dostarlimabem v neoadjuvanci následovanou chemoradioterapií a resekcí v případě nedostatečné odpovědi. Patologické kompletní remise dosáhlo po 6 měsících léčby imunoterapií 100 % pacientů. V souhlasu s protokolem studie byli pacienti, kteří dosáhli kompletní remise, dále pouze sledováni.
Závěr
Imunoterapie v neoadjuvantním podání u této malé skupiny pacientů (dMMR/MSI-H představující cca 12 % pacientů) umožňuje orgán záchovný postup. Na délku léčebné odpovědi v této a dalších probíhajících studiích nicméně zatím čekáme. Testování exprese mismatch repair proteinů a mikrosatelitní instability je důležitým předpokladem ke správnému zvolení léčby nejen u metastatického onemocnění, ale i u lokálně pokročilých karcinomů rekta. Imunoterapie představuje nadějnou léčebnou alternativu, která umožnuje orgán záchovný postup, a tím zlepšení kvality života pacientů s dMMR/MSI-H kolorektálním karcinomem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Tomáš Sokop
Klinika komplexní onkologické péče LF MU a MOÚ Brno
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: tomas.sokop@mou.cz
Obdrženo/Submitted: 2. 2. 2023
Přijato/Accepted: 28. 3. 2023Klin Onkol 2023; 36(3): 241 – 245
Sources
1. ÚZIS. Novotvary 2018 – současné epidemiologické trendy novotvarů v České republice. [online]. Dostupné z: https: //www.uzis.cz/res/f/008352/novotvary2018.pdf.
2. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin 2019; 69 (1): 7–34. doi: 10.3322/caac.21551.
3. Siegel RL, Torre LA, Soerjomataram I et al. Global patterns and trends in colorectal cancer incidence in young adults. Gut 2019; 68 (12): 2179–2185. doi: 10.1136/ gutjnl-2019-319511.
4. Stoffel EM, Murphy CC. Epidemiology and mechanisms of the increasing incidence of colon and rectal cancers in young adults. Gastroenterology 2020; 158 (2): 341–353. doi: 10.1053/j.gastro.2019.07.055.
5. Holowatyj AN, Lewis MA, Pannier ST et al. Clinicopathologic and racial/ethnic differences of colorectal cancer among adolescents and young adults. Clin Transl Gastroenterol 2019; 10 (7): e00059. doi: 10.14309/ctg.0000 000000000059.
6. Rodriguez L, Brennan K, Karim S et al. Disease characteristics, clinical management, and outcomes of young patients with colon cancer: a population-based study. Clin Colorectal Cancer 2018; 17 (4): e651–e661. doi: 10.1016/ j.clcc.2018.06.007.
7. Weinberg BA, Marshall JL. Colon cancer in young adults: trends and their implications. Curr Oncol Rep 2019; 21 (1): 3. doi: 10.1007/s11912-019-0756-8.
8. Tricoli JV, Boardman LA, Patidar R et al. A mutational comparison of adult and adolescent and young adult (AYA) colon cancer. Cancer 2018; 124 (5): 1070–1082. doi: 10.1002/cncr.31136.
9. Cheong C, Oh SY, Kim YB et al. Differences in biological behaviors between young and elderly patients with colorectal cancer. PLoS One 2019; 14 (6): e0218604. doi: 10.1371/journal.pone.0218604.
10. Chang C-C, Lin P-C, Lin C-C et al. Molecular and clinicopathological differences by age at the diagnosis of colorectal cancer. Int J Mol Sci 2017; 18 (7): 1441. doi: 10.3390/ijms18071441.
11. Pearlman R, Frankel WL, Swanson B et al. Prevalence and spectrum of germline cancer susceptibility gene mutations among patients with early-onset colorectal cancer. JAMA Oncol 2017; 3 (4): 464. doi: 10.1001/jamaoncol.2016.5194.
12. Durhuus JA, Therkildsen C, Kallemose T et al. Colorectal cancer in adolescents and young adults with Lynch syndrome: a Danish register-based study. BMJ Open 2021; 11 (12): e053538. doi: 10.1136/bmjopen-2021-053538.
13. Glynne-Jones R, Wyrwicz L, Tiret E et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): iv22–iv40. doi: 10.1093/annonc/mdx224.
14. Cervantes A, Adam R, Roselló S et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34 (1): 10–32. doi: 10.1016/j.annonc.2022.10.003.
15. ČLS JEP. Modrá kniha České onkologické společnosti. 28. aktualizace. Brno: Masarykův onkologický ústav 2022.
16. Chalabi M, Verschoor YL, van den Berg J et al. LBA7 – neoadjuvant immune checkpoint inhibition in locally advanced MMR-deficient colon cancer: the NICHE-2 study. Ann Oncol 2022; 33 (Suppl 7): S808–S869. doi: 10.1016/annonc/annonc1089.
17. Andre T, Amonkar M, Norquist JM et al. Health-related quality of life in patients with microsatellite instability-high or mismatch repair deficient metastatic colorectal cancer treated with first-line pembrolizumab versus chemotherapy (KEYNOTE-177): an open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22 (5): 665–677. doi: 10.1016/S1470-2045 (21) 00064-4.
18. Cercek A, Lumish M, Sinopoli J et al. PD-1 blockade in mismatch repair-deficient, locally advanced rectal cancer. N Engl J Med 2022; 386 (25): 2363–2376. doi: 10.1056/ NEJMoa2201445.
19. NCCN. Rectal Cancer (Version 3.2022). [online]. Available from: https: //www.nccn.org/professionals/physician_gls/pdf/rectal.pdf.
20. Cercek A, Dos Santos Fernandes G, Roxburgh CS et al. Mismatch repair-deficient rectal cancer and resistance to neoadjuvant chemotherapy. Clin Cancer Res 2020; 26 (13): 3271–3279. doi: 10.1158/1078-0432.CCR-19-3728.
21. Chalabi M, Fanchi LF, Dijkstra KK et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020; 26 (4): 566–576. doi: 10.1038/s41591-020-0805-8.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2023 Issue 3-
All articles in this issue
- Waldenströmova makroglobulinemie, monoklonální gamapatie a Dr. Kyle
- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Etnické rozdiely v incidencii zhubných nádorov detí
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Hypoplastická forma myelodysplastické neoplazie
- Kvantitatívne profilovanie génov asociovaných s dráhami vzniku mozgových nádorov
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Efekt imunoterapie u mladého pacienta s mismatch repair deficientním karcinomem rekta – kazuistika
- Nová naděje pro pacienty s metastatickým uveálním melanomem
- Psychologická péče reflektující průběh a specifika virové infekce SARS-CoV-2 u onkologických pacientů s oxygenační poruchou – série kazuistik
- Hepatosplenický T-lymfom s přítomností masivní splenomegalie a pancytopenie – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Hypoplastická forma myelodysplastické neoplazie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

