-
Medical journals
- Career
Přínos masivního paralelního sekvenování pro diagnostiku dědičných forem nádorů ovaria v České republice
Authors: Jana Soukupová 1; Klára Lhotová 1; Petra Zemánková 1; Michal Vočka 2; Markéta Janatová 1; Lenka Stolařová 1; Marianna Borecká 1; Petra Kleiblová 3; Eva Macháčková 4; Lenka Foretová 4; Monika Koudová 5; Filip Lhota 5; Spiros Tavandzis 6; Michal Zikán 7; Viktor Stránecký 8; Kamila Veselá 3; Aleš Panczak 3,9; Jaroslav Kotlas 3; Zdeněk Kleibl 1
Authors‘ workplace: Ústav biochemie a experimentální onkologie, 1. LF UK v Praze 1; Onkologická klinika 1. LF UK a VFN v Praze 2; Ústav biologie a lékařské genetiky, 1. LF UK a VFN v Praze 3; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 4; Centrum lékařské genetiky a reprodukční medicíny GENNET, Praha 5; Oddělení lékařské genetiky, Laboratoře AGEL, Nový Jičín 6; Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 7; Ústav dědičných metabolických poruch, 1. LF UK a VFN v Praze 8; Radioterapeutická a onkologická klinika FN Královské Vinohrady, Praha 9
Published in: Klin Onkol 2019; 32(Supplementum2): 72-78
Category: Original Articles
doi: https://doi.org/10.14735/amko2019S72Overview
Východiska: Karcinom ovaria, závažné nádorové onemocnění s vysokou mortalitou, je v České republice diagnostikováno každým rokem přibližně u 1 000 žen. Riziko vzniku onemocnění je zvýšeno u nosiček mutací v některých nádorových predispozičních genech. S vysokým relativním rizikem (RR > 5) jsou spojeny mutace v genech BRCA1, BRCA2, BRIP1, geny Lynchova syndromu, RAD51C, RAD51D, STK11; s možným zvýšením rizika mutace v genech ATM, CHEK2, NBN, PALB2, BARD1. Cílem práce bylo určit frekvenci mutací v nádorových predispozičních genech v naší populaci.
Metody a výsledky: Celkem 1 057 pacientek s karcinomem ovaria a 617 nenádorových kontrol bylo vyšetřeno pomocí panelového sekvenování nové generace na platformě Illumina. Patogenní mutace ve vysoko rizikových genech, vč. velkých genomových přestaveb, byly v našem souboru zachyceny u 30,6 % pacientek; u neselektovaných pacientek byla frekvence mutací téměř 25 %, u pacientek s negativní rodinnou anamnézou 18 %. Nejčastěji mutovanými predispozičními geny byly BRCA1 a BRCA2, součet frekvence mutací v ostatních ovariálních predispozičních genech odpovídal frekvenci mutací v genu BRCA2. Záchyt mutací u pacientek starších 70 let byl více než třikrát vyšší v porovnání s pacientkami ve věku pod 30 let.
Závěr: Karcinom ovaria je heterogenní onemocnění s vysokým podílem dědičné formy onemocnění. Vzhledem k nedostatku adekvátních screeningových modalit pro včasnou diagnostiku onemocnění je identifikace nosiček mutací v ovariálních predispozičních genech klíčová, s vysokým potenciálem k celkovému snížení mortality z důvodu karcinomu ovaria.
Klíčová slova:
karcinom ovaria – nádorové geny – mutace – masivní paralelní sekvenování – sekvenování nové generace – panel genů
Úvod
Karcinom ovaria patří mezi závažná nádorová onemocnění žen v ČR. Každým rokem je diagnostikován u přibližně 1 000 žen a zhruba 700 žen tomuto onemocnění podlehne [1]. Incidence ovariálního karcinomu stoupá s věkem a nejvyšší prevalence dosahuje mezi 6. a 7. dekádou. Celoživotní riziko rozvoje ovariálního karcinomu v běžné populaci se u žen pohybuje kolem 1,5 %, avšak je významně zvýšeno u nosiček zárodečných mutací v některých nádorových predispozičních genech.
Dědičná forma karcinomu ovaria představuje přibližně 20 % případů, tedy významně více než u jiných běžných typů nádorů. V současné době jsou proto ke genetickému vyšetření indikovány všechny pacientky s karcinomem ovaria (ale i vejcovodů a primárního peritoneálního karcinomu) bez ohledu na věk. Identifikace mutací predisponujících ke vzniku karcinomu ovaria umožňuje nabídnout nosičkám odpovídající léčebnou strategii a genetické poradenství a je podmínkou cílené preventivní péče o asymptomatické osoby s mutací.
Hlavními genetickými faktory dědičné formy karcinomu ovaria jsou, podobně jako u hereditární formy karcinomu prsu, mutace v genech BRCA1 a BRCA2. Celoživotní riziko rozvoje karcinomu ovaria se pohybuje u nosiček mutací v genu BRCA1 mezi 35–60 %, u nosiček mutací v BRCA2 mezi 12–25 % [2,3]. Ačkoliv je klinický význam mutací v BRCA1/2 vysoký, nevysvětluje všechny případy familiárních forem onemocnění. Zvýšené riziko vzniku karcinomu ovaria bylo prokázáno i u nosiček mutací v dalších genech kódujících proteiny, které se podobně jako BRCA1 a BRCA2 podílejí na reparaci dvouřetězcových zlomů DNA cestou homologní rekombinace. V současné době existují klinická doporučení zohledňující zvýšené riziko vzniku karcinomu ovaria u nosiček mutací v 10 genech (BRCA1, BRCA2, BRIP1, EPCAM, MSH2, MLH1, MSH6, RAD51C, RAD51D, STK11) a zvýšené riziko vzniku karcinomu prsu pro 12 genů (ATM, BARD1, BRCA1, BRCA2, CDH1, CHEK2, NBN, NF1, PALB2, PTEN, STK11, TP53) [4].
V porovnání s četností mutací v genech BRCA1/2 je frekvence mutací v dalších predispozičních genech výrazně (často řádově) nižší a významně se liší mezi populacemi. Postupná analýza jednotlivých genů je z důvodu značné finanční a časové náročnosti v praxi nepoužitelná. K dramatické změně možností diagnostiky došlo s rozvojem sekvenování nové generace (next generation sequencing – NGS), jež umožnilo vyšetření většího počtu genů v krátké době při příznivých ekonomických nákladech [5].
Pro diagnostické účely identifikace nádorové predispozice jsme zkonstruovali a validovali univerzální panel CZECANCA (CZEch CAncer paNel for Clinical Application) [6] pro komplexní, rentabilní a rychlou analýzu germinálních mutací vč. velkých přestaveb v hlavních predispozičních genech, ale i v kandidátních genech asociovaných se zvýšeným rizikem vzniku nejčastějších solidních nádorů v naší populaci [7].
Metody
Pomocí panelu CZECANCA v1.0, který obsahuje sondy cílící na kódující sekvence 219 genů, jsme analyzovali 1 057 pacientek s karcinomem ovaria. Analýza probíhala v laboratořích Ústavu biochemie a experimentální onkologie 1. LF UK v Praze, Masarykova onkologického ústavu v Brně, v laboratořích Gennet v Praze a Agel v Novém Jičíně. Medián věku v době diagnózy byl 52,6 roku (14,8–86,2). Klinické charakteristiky pacientek jsou uvedeny v tab. 1.
Table 1. Charakteristika souboru 1 057 pacientek s karcinomem ovaria 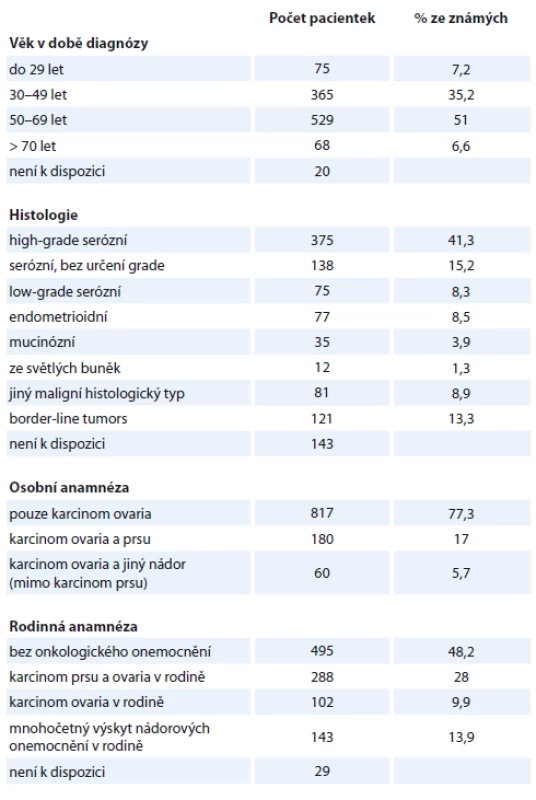
Abychom mohli odlišit vzácné patogenní a populačně specifické mutace, vyšetřili jsme pomocí stejného panelu genů skupinu 617 zdravých kontrol (jedinci starší 60 let bez osobní a rodinné nádorové anamnézy u přímých příbuzných).
Vzorky genomové DNA izolované z leukocytů periferní krve od pacientů indikovaných ke genetickému vyšetření byly analyzovány podle jednotného protokolu, který zahrnoval i následné bioinformatické zpracování dat [6].
Identifikované zárodečné varianty v genech spojených se syndromem dědičného karcinomu prsu a ovaria byly prioritizovány na základě frekvence výskytu varianty u méně než 1 % vzorků v projektu 1 000 Genomes [8] a současně u méně než 1 % vzorků našich populačních kontrol. Zbývající raritní varianty byly klasifikovány do 5 tříd dle IARC (International Agency for Research on Cancer): 1 – benigní, 2 – pravděpodobně benigní, 3 – varianta nejasného významu (variant of unknown signifikance – VUS), 4 – pravděpodobně patogenní, 5 – patogenní. Jako patogenní nebo pravděpodobně patogenní byly dle doporučení ENIGMA (Evidence-based Network for the Interpretation of Germline Mutant Alleles) konsorcia [9] označeny varianty vedoucí k předčasnému zkrácení proteinu (nonsense a posunové mutace, velké genomové přestavby, pokud nejsou klasifikovány jinak), mutace postihující konzervativní sestřihová místa a missense mutace klasifikované jako patogenní v databázi ClinVar [10].
V analyzovaném souboru jsme se zaměřili na hodnocení prokazatelně patogenních alterací v genech, ke kterým v současnosti existují klinická doporučení péče o nosičky mutací zohledňující riziko vzniku karcinomu ovaria (BRCA1, BRCA2, BRIP1, EPCAM, MSH2, MLH1, MSH6, RAD51C, RAD51D, STK11) a prsu (ATM, BARD1, CHEK2, NBN, PALB2) [4].
Výsledky
Mutace v genech predisponujících ke vzniku dědičné formy karcinomu ovaria (BRCA1, BRCA2, BRIP1, EPCAM, MSH2, MLH1, MSH6, RAD51C, RAD51D, STK11)
Patogenní dědičnou mutaci v některém z genů predisponujících ke karcinomu ovaria jsme identifikovali celkem u 323 z 1 057 (30,6 %) analyzovaných pacientek s karcinomem ovaria (tab. 2). Nejvíce patogenních mutací jsme zachytili v hlavních predispozičních genech BRCA1 (210/1 057; 19,9 %) a BRCA2 (75/1 057; 7,1 %). Mutace v genech způsobujících Lynchův syndrom byly nalezeny u 9 z 1 057 (0,9 %) pacientek. Zbývající 3 % nalezených mutací se rovnoměrně rozdělila mezi 29 nosiček mutací v genech RAD51C, RAD51D, BRIP1. Ve skupině kontrol byly v uvedených genech s prokázanou asociací s karcinomem ovaria zachyceny patogenní mutace pouze u 4 z 617 osob (0,7 %; tab. 2).
Table 2. Frekvence patogenních mutací v genech jasně predisponujících ke vzniku dědičné formy karcinomu ovaria. 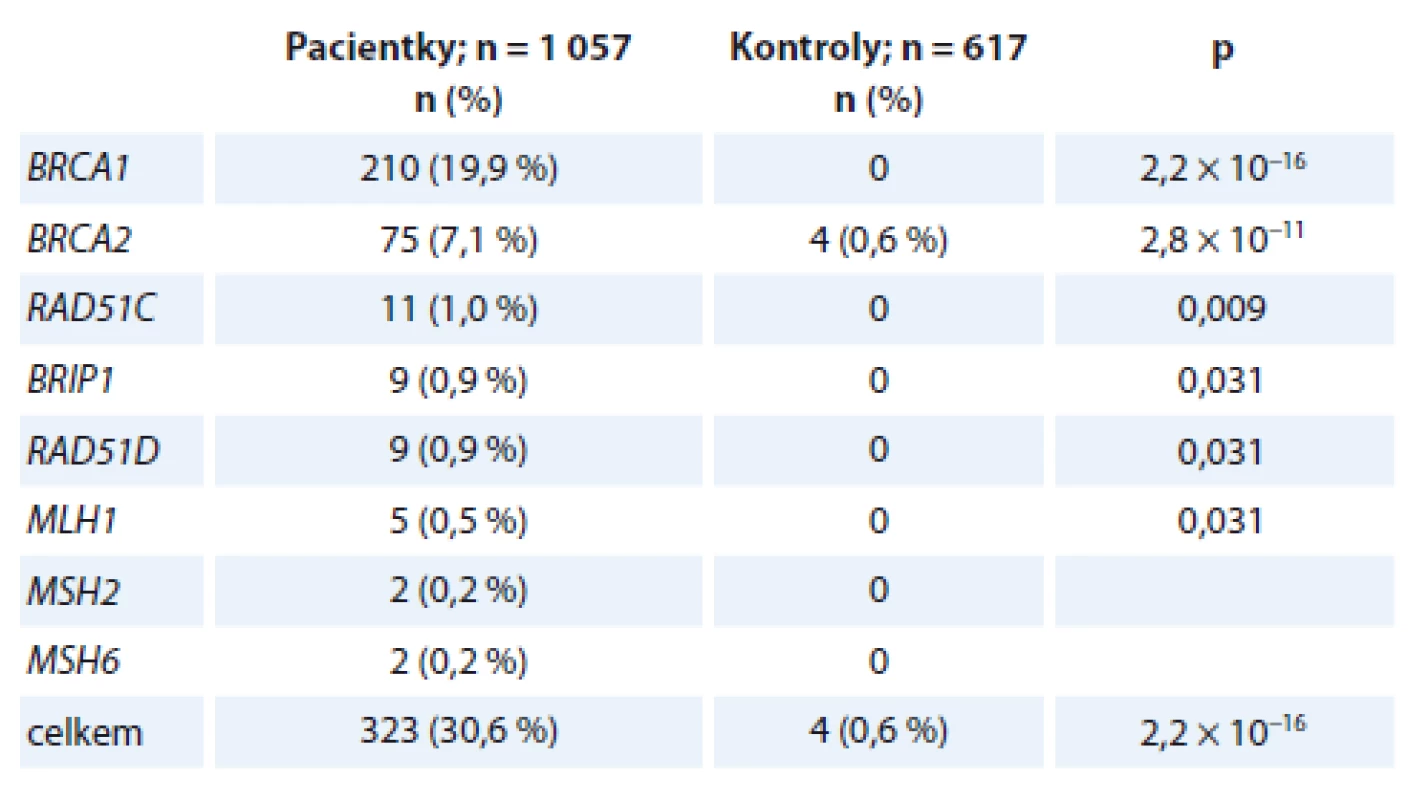
Klinické a histopatologické charakteristiky ovlivňující pravděpodobnost výskytu germinálních mutací
S ohledem na osobní onkologickou anamnézu (tab. 3) je nejvyšší pravděpodobnost výskytu mutací u pacientek s duplicitou karcinomu prsu a ovaria, kde mutaci nacházíme u téměř dvou třetin vyšetřovaných (107/180; 59,4 %). U čtvrtiny vyšetřovaných se dědičné mutace vyskytovaly u pacientek se solitární diagnózou karcinomu ovaria (203/817; 24,8 %) nebo u pacientek, které kromě karcinomu ovaria vyvinuly i jiné nádorové onemocnění (15/60; 25,0 %). Mutace v genech RAD51C, RAD51D a BRIP1 převažovaly u pacientek s diagnózou solitárního ovariálního karcinomu (25/29; 86 %).
Table 3. Výskyt germinálních mutací v genech predisponujících ke vzniku karcinomu ovaria v závislosti na klinických a histopatologických charakteristikách. 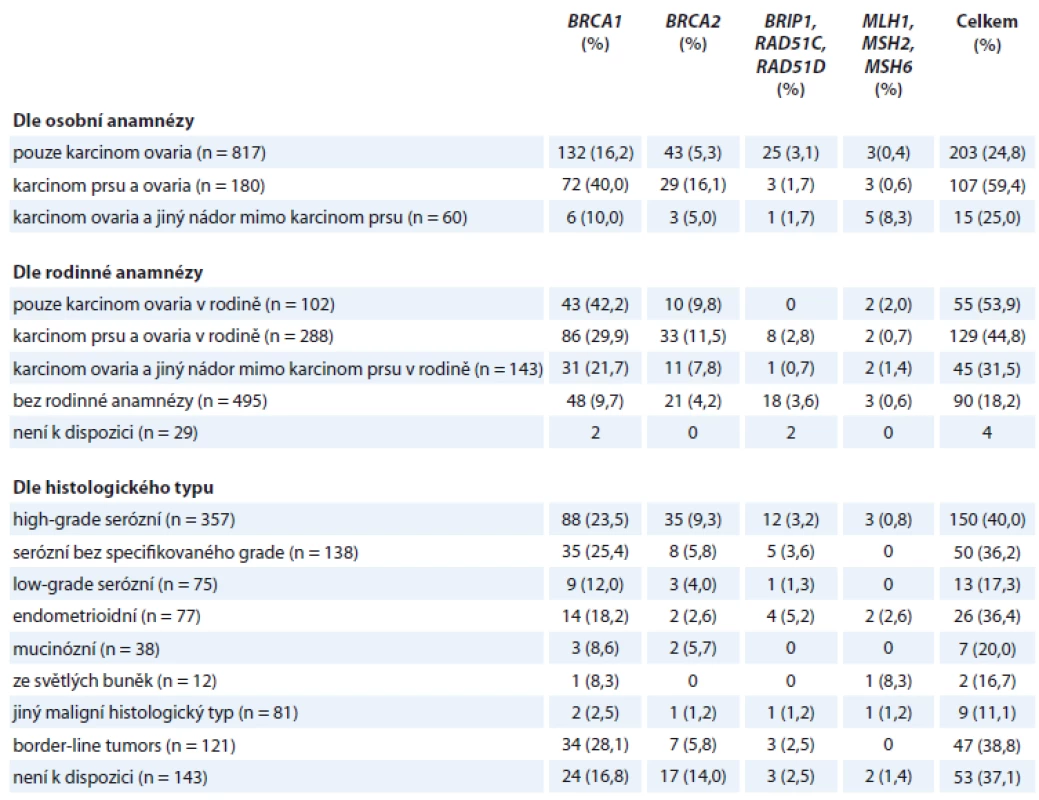
Vzhledem k rodinné anamnéze (tab. 3) jsme nalezli nejvyšší procento mutací u pacientek z rodin, ve kterých se vyskytoval pouze karcinom ovaria (55/102; 53,9 %), přičemž mutace téměř výhradně postihovaly geny BRCA1 (43/55; 78 %) a BRCA2 (10/55; 18 %). Vysoký výskyt mutací v predispozičních genech jsme zaznamenali i u pacientek s rodinným výskytem karcinomu ovaria a prsu (129/288; 44,8 %) a u pacientek s rodinným výskytem karcinomu ovaria a dalších typů nádorů (45/143; 31,5 %). Mutace však byla zachycena i u 18,2 % pacientek s negativní rodinnou anamnézou (90/495), což ve výsledku znamená, že tato skupina zahrnovala více než čtvrtinu nosiček patogenních mutací (90/323; 27,9 %).
Zastoupení histologických typů ovariálních tumorů u nosiček mutací v predispozičních genech ukazuje, že serózní nádory tvoří přibližně dvě třetiny ovariálních karcinomů ve skupinách nosiček s mutacemi v genech predisponujících ke vzniku hereditárního karcinomu ovaria (graf 1). Výjimkou byla malá skupina devíti nosiček mutací v genech Lynchova syndromu, ve které jsme zaznamenali vyšší zastoupení endometroidních nádorů a nádorů ze světlých buněk.
Graph 1. Zastoupení histologických typů u nosiček mutací v predispozičních genech. 
Nejnižší průměrný věk v době diagnózy karcinomu ovaria byl u nosiček vzácných mutací v genu MSH2 (42,2 roku), následovaly geny RAD51C (49,2 roku), MLH1 (49,9 roku), BRCA1 (50,3 roku), RAD51D (53,9 roku), BRIP1 (54,4 roku), BRCA2 (57,6 roku) a MSH6 (62,0 roku). Výskyt patogenních mutací v uvedených genech byl překvapivě více než trojnásobný u pacientek starších 70 let (14/68; 21,0 %) v porovnání s pacientkami mladšími 30 let (4/75; 6,7 %; p = 0,01).
Mutace v genech predisponujících ke vzniku dědičné formy karcinomu prsu (ATM, BARD1, CHEK2, NBN, PALB2)
V dalších genech, jejichž mutace jsou spojeny se zvýšeným rizikem vzniku karcinomu prsu a kde bychom mohli předpokládat rovněž zvýšení rizika rozvoje karcinomu ovaria, jsme zachytili patogenní mutace celkem u 36/1 057 (3,4 %) pacientek a 7/617 (1,1 %) kontrol (celkem p = 0,0037; tab. 4).
Table 4. Záchyt mutací v genech predisponujících ke karcinomu prsu. 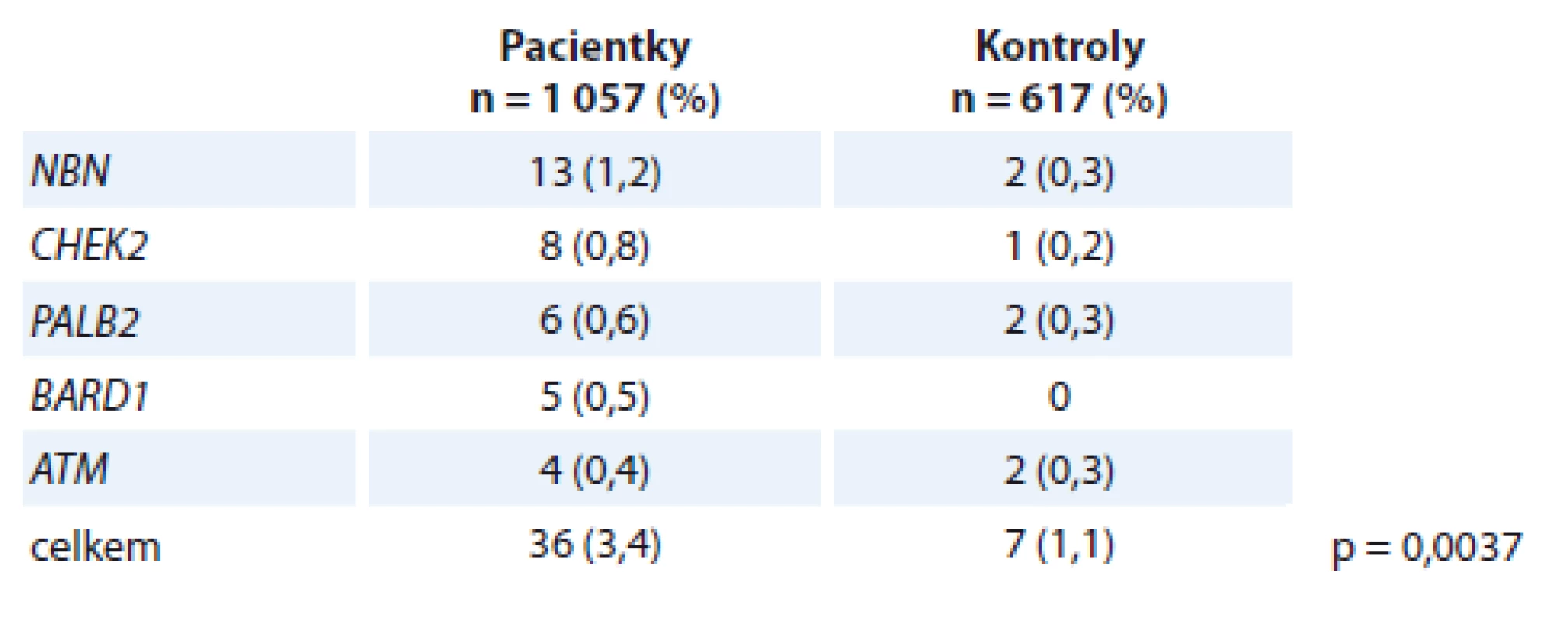
Nejvyšší frekvence mutací v těchto genech jsme nalezli ve skupině pacientek s diagnózou karcinomu prsu a ovaria v osobní anamnéze (11/180; 6,1 %) a u pacientek z rodin s výskytem pouze karcinomu ovaria (6/102; 5,9 %) (tab. 3). Nejnižší věk v době diagnózy karcinomu ovaria byl u pacientek s mutacemi v genu CHEK2 (41,8 roku), následován geny ATM (49,6 roku), NBN (51,1 roku), BARD1 (54,7 roku) a PALB2 (61,4 roku).
V dalších genech spojovaných se syndromem dědičného karcinomu prsu a ovaria – NF1, PTEN, STK11, TP53, CDH1 – jsme v našem souboru nezachytili žádnou patogenní alteraci.
Více než jedna patogenní mutace v genech spojených se syndromem dědičného karcinomu prsu a ovaria byla nalezena u 7 pacientek (0,66 %, což zahrnovalo heterozygotní nosičky mutací v BRCA1 a BRCA2 (2×), BRCA1 a NBN (2×), BRCA1 a CHEK2, BRCA1 a ATM, BRCA1 a MLH1).
Diskuze a závěr
Rozvoj NGS umožňuje paralelní analýzu germinálních mutací řady nádorových predispozičních genů. U karcinomu ovaria jsou s prokázaným vysokým rizikem onemocnění (relativní riziko (RR) > 5) v současné době spojeny mutace v genech BRCA1, BRCA2, BRIP1, RAD51C, RAD51D, STK11, MSH2 a MLH1. Analýza může být provedena zároveň u několika desítek pacientů, což vede ke zrychlení diagnostického procesu. Vyšetření rozsáhlých populací indikovaných pacientů umožňuje získat dostatečné informace o frekvenci výskytu příčinných mutací v populaci, které jsou nezbytným předpokladem k postupnému zpřesňování rizik spojených se vznikem dědičných nádorů u nosičů mutací v nádorových predispozičních genech. Výskyt mutací v některých nově identifikovaných predispozičních genech (BRIP1, RAD51C, RAD51D a geny Lynchova syndromu) je však velmi vzácný a k vyhodnocení jejich podílu na vzniku karcinomu ovaria je nezbytná spolupráce diagnostických týmů v ČR i zahraničí. Na základě takto získaných poznatků se dynamicky vyvíjejí nejen indikační kritéria ke genetickému vyšetření, ale i klinická doporučení péče o nosiče patogenních mutací [11].
Z provedených analýz u pacientek s ovariálním karcinomem v ČR vyplývá, že mezi nosiči příčinných mutací v genech s jasně prokázanou asociací se zvýšeným rizikem vzniku ovariálního karcinomu dominují nosičky mutací BRCA1 a BRCA2 (88 %). Zbývajících nezanedbatelných 12 % případů v naší populaci představují nosičky mutací v dalších ovariálních predispozičních genech (BRIP1, RAD51C, RAD51D a geny Lynchova syndromu). Z výsledků naší analýzy vyplývají určitá populační specifika v zastoupení mutací v těchto nových predispozičních genech v ČR. Zatímco v naší populaci bylo zastoupení mutací v těchto genech rovnoměrné, práce Norquista et al (USA) popisuje dvojnásobnou frekvenci mutací v genu BRIP1 (26/1 915; 1,3 %) v porovnání s četností mutací v genech RAD51C a RAD51D (každý 11/1 915; 0,6 %) [12]. V německé populaci byla popsána frekvence mutací v genu BRIP1 u pacientek s karcinomem ovaria dokonce 2,6 %, přestože v této studii nebyly hodnoceny velké genomové přestavby [13]. Ve skupině genů spojených s Lynchovým syndromem jsme nejvíce mutací nalezli v genu MLH1 (gen PMS2 nebyl vyšetřován), podobně jako je tomu u pacientů s kolorektálním karcinomem, zatímco v některých pracích jsou u pacientek s karcinomem ovaria popisovány mutace především v genu MSH6 a PMS2 [12]. Porovnání výsledků našich analýz s výsledky zahraničních studií však komplikuje skutečnost, že některé studie neanalyzují přítomnost velkých genomových přestaveb v zárodečném genomu, protože jejich identifikace pomocí NGS může být obtížná. V naší práci jsme tyto důležité (a v případě delecí v naprosté většině i patogenní) genetické aberace potvrdili z vyšetření CZECANCA panelem, který byl optimalizován na detekci velkých přestaveb [6], u 3,1 % (33/1 057) pacientek, a to v genech BRCA1 (22), BRIP1 (4), MLH1 (2), CHEK2 (4) a PALB2 (1). V genu BRIP1 představovaly rozsáhlé delece dokonce polovinu všech nalezených mutací. Četnost velkých genomových přestaveb ukazuje, že jejich analýza musí být nepostradatelnou součástí genetického testování nádorových predispozičních genů.
Podíl alterací v dalších kandidátních predispozičních genech s možným podílem na vzniku karcinomu ovaria (ATM, BARD1, CHEK2, NBN, PALB2) je srovnatelný s celkovou frekvencí mutací v genech BRIP1, RAD51C, RAD51D a genů Lynchova syndromu.
Záchyt sedmi vícenásobných nosičů patogenních variant v našem souboru ukazuje důležitost genetické konzultace a v indikovaných případech opodstatňuje nové testování pacientek pomocí NGS (u probandů z rodin se závažnou rodinnou onkologickou anamnézou či u pacientek s nádorovými multiplicitami negativně testovaných dříve použitými metodami). Genetická konzultace a následné vyšetření hlavních predispozičních genů jsou indikovány dle současných kritérií pro každou pacientku s karcinomem ovaria, bez ohledu na věk, osobní či rodinnou anamnézu či histologický typ nádoru. Toto doporučení podporují i výsledky naší práce, která analyzuje 1 057 pacientek s karcinomem ovaria, což přibližně odpovídá roční incidenci tohoto onemocnění v ČR (998 případů v roce 2016). Patogenní mutace v genech s jasným klinickým významem pro karcinom ovaria jsme zachytili u 323/1 057 (30,6 %) vyšetřovaných pacientek. Srovnatelnou frekvenci mutací (24 %) popsal Walsh et al [14], avšak v některých studiích byla nalezená frekvence mutací v ovariálních predispozičních genech značně nižší (např. Carter et al 13 %) [15]. Rozdíly ve frekvenci mutací u pacientek s karcinomem ovaria mezi jednotlivými pracemi ilustrují nejen odlišnosti ve výskytu patogenních mutací mezi populacemi, ale i ve výběru analyzovaných pacientek, vyšetřovaných predispozičních genů či typu hodnocených mutací. Náš soubor byl obohacen o mladé pacientky a pacientky s pozitivní rodinnou anamnézou. Zatímco frekvence mutací u nemocných před rokem 2010 přesahovala 40 %, po rozšíření indikačních kritérií v roce 2015 [16–19] bylo u 334 pacientek analyzovaných na 1. LF UK zachyceno 83 nosiček mutací (25 %). U neselektovaných, prospektivně testovaných vzorků analyzovaných ve spolupracujících laboratořích zahrnutých v našem souboru pacientek byly zachyceny patogenní mutace u 33/156 (21,2 %) nemocných. Lze tedy obecně konstatovat, že přibližně každá čtvrtá pacientka s karcinomem ovaria v naší populaci je nosičkou patogenní mutace v klinicky významném genu s prokázaným vysokým rizikem vzniku ovariálního karcinomu. U pacientek s negativní rodinnou anamnézou je to přibližně každá pátá. Vysoký podíl pacientek s karcinomem ovaria s hereditární formou onemocnění se do budoucna díky identifikaci mutací v dalších genech s predispozicí ke karcinomu ovaria patrně ještě mírně zvýší. Frekvence mutací je u pacientek starších 70 let více než třikrát vyšší v porovnání s velmi mladými pacientkami (s diagnózou ve věku pod 30 let). Nižší frekvenci patogenních mutací u velmi mladých pacientek lze částečně vysvětlit vyšším zastoupením histologických typů, především low-grade serózních a mucinózních karcinomů, pro které je typická nižší frekvence mutací v predisponujících genech, zatímco u pacientek starších 70 let převažovaly high-grade serózní karcinomy. Přesto byla nízká frekvence mutací ve sledovaných predispozičních genech u velmi mladých pacientek překvapivá a ukazuje na možnou úlohu dalších genů při vzniku onemocnění.
Vzhledem k omezeným možnostem časné diagnostiky karcinomu ovaria je pro nosičky mutací v genech spojených s vysokým rizikem onemocnění (RR > 5) doporučena preventivní salpingooforektomie (risk-reducing salpingo-ophorectomy – RRSO). RRSO je spojena s řadou vedlejších účinků, proto je nutné její vhodné načasování, které se odvíjí od průměrného věku v době diagnózy u nosiček mutací či podle věku onemocnění v rodině (tab. 5). S ohledem na frekvenci mutací v genech vysokého rizika u pacientek s ovariálním karcinomem v ČR může racionální indikace RRSO přispět ke snížení mortality z důvodu karcinomu ovaria v ČR.
Table 5. Existující doporučení péče o nosičky patogenních mutací v genech predisponujících ke karcinomu ovaria [4]. ![Existující doporučení péče o nosičky patogenních mutací v genech predisponujících
ke karcinomu ovaria [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7c761559e4170a49c1033493ebd8f88e.png)
*AR sy, **populační riziko 1,3 %
RRSO – riziko redukující salpingooforektomie, RA – rodinná anamnézaSerózní adenokarcinomy představují 60–80 % ze všech histopatologických typů ovariálních tumorů [20]. V našem souboru jsme high-grade serózní karcinom ovaria nalezli u dvou třetin pacientek s identifikovanou zárodečnou mutací v některém z ovariálních predispozičních genů, s výjimkou genů Lynchova syndromu. Frekvence mutací u žen s nádory jiného histologického typu však byla také významná a opodstatňuje genetické testování bez ohledu na histologický typ nádoru.
Se vzrůstajícím množstvím poznatků o nádorové predispozici se rozšiřuje spektrum klinicky relevantních genů. Použití větších panelů genů v rutinní diagnostické praxi umožňuje nejen pružně reagovat na rostoucí požadavky onkologů a klinických genetiků, ale v případě rozšíření počtu genů s klinickou utilitou umožňuje vyhodnotit tyto geny zpětně bez nutnosti nového sekvenování, a tedy dodatečných finančních nákladů. Identifikace hereditárních alterací v genech BRCA1 a BRCA2 (a pravděpodobně i dalších predispozičních genech, jejichž proteinové produkty se spolupodílejí na reparaci genomové DNA) umožňuje využít genetické analýzy jako prognostického ukazatele pro konvenční chemoterapii (genotoxickými chemoterapeutiky) i cílenou a specifickou léčbu (PARP inhibitory) [21].
Tato práce byla podpořena grantem AZV 15-27695A, SVV2019/260367, PROGRES Q28/LF1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Jana Soukupová, Ph.D.
Ústav biochemie a experimentální onkologie
1. LF UK v Praze
U Nemocnice 5
128 53 Praha 2
e-mail: jproko@lf1.cuni.cz
Obdrženo: 7. 3. 2019
Přijato: 24. 4. 2019
Sources
1. uzis.cz. Ústav zdravotnických informací a statistiky ČR. [online]. Dostupný z http: //www.uzis.cz.
2. Pennington KP, Swisher EM. Hereditary ovarian cancer: beyond the usual suspects. Gynecol Oncol 2012; 124 (2): 347–353. doi: 10.1016/j.ygyno.2011.12.415.
3. Antoniou A, Pharoah PD, Narod S et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003; 72 (5): 1117–1130. doi: 10.1086/375033.
4. nccn.org. National Comprehensive Cancer Network; version 3.2019. [online]. Available from: https: //www.nccn.org/professionals/physician_gls/pdf/genetics_screening.pdf.
5. Soukupová J. Úskalí interpretace sekvenačních dat v diagnostice dědičných nádorových syndromů. Labor Aktuell 2016; 20 (4): 4.
6. Soukupová J, Zemánková P, Lhotová K et al. Validation of CZECANCA (CZEch CAncer paNel for Clinical Application) for targeted NGS-based analysis of hereditary cancer syndromes. PLoS One 2018; 13 (4): e0195761. doi: 10.1371/journal.pone.0195761.
7. Soukupová J, Zemánková P, Kleiblová P et al. CZECANCA: CZEch CAncer paNel for Clinical Application – návrh a příprava cíleného sekvenačního panelu pro identifikaci nádorové predispozice u rizikových osob v České republice. Klin Onkol 2016; 29 (Suppl 1): S46–S54. doi: 10.14735/amko2016S46.
8. internationalgenome.org. The 1000 Genomes Browser. [online]. Available from: http: //www.internationalgenome.org/1000-genomes-browsers.
9. enigmaconsortium.org. ENIGMA (Evidence-based Network for the Interpretation of Germline Mutant Alleles). [online]. Available from: https: //enigmaconsortium.org/.
10. ncbi.nlm.nih.gov. ClinVar. [online]. Available from: https: //www.ncbi.nlm.nih.gov/clinvar/.
11. Nielsen SM, Eccles DM, Romero IL et al. Genetic testing and clinical management practices for variants in non-BRCA1/2 breast (and breast/ovarian) cancer susceptibility genes: an international survey by the Evidence-Based Network for the Interpretation of Germline Mutant Alleles (ENIGMA) clinical working group. J Clin Oncol 2018; 36 (2): 1–42.
12. Norquist BM, Harrel MI, Brady MF et al. Inherited mutations in women with ovarian carcinoma. JAMA Oncol 2016; 2 (4): 482–90. doi: 10.1001/jamaoncol.2015.5495.
13. Weber-Lassalle N, Hauke J, Ramser J et al. BRIP1 loss-of-function mutations confer high risk for familial ovarian cancer, but not familial breast cancer. Breast Cancer Res 2018; 20 (1): 7. doi: 10.1186/s13058-018-0935-9.
14. Walsh T, Casadei S, Lee MK et al. Mutations in 12 genes for inherited ovarian, fallopian tube, and peritoneal carcinoma identified by massively parallel sequencing. Proc Natl Acad Sci USA 2011; 108 (44): 18032–18037. doi: 10.1073/pnas.1115052108.
15. Carter NJ, Marshall ML, Susswein LR et al. Germline pathogenic variants identified in women with ovarian tumors. Gynecol Oncol 2018; 151 (3): 481–488. doi: 10.1016/j.ygyno.2018.09.030.
16. Foretová L, Macháčková E, Palácová M et al. Doporučení rozšíření indikačních kriterií ke genetickému testování mutací v genech BRCA1 a BRCA2 u hereditárního syndromu nádorů prsu a ovarií. Klin Onkol 2016; 29 (Suppl 1): S9–S13. doi: 10.14735/amko2016S9.
17. Plevová P, Novotný J, Petráková K et al. Syndrom hereditárního karcinomu prsu a ovarií. Klin onkol 2009; 22 (Suppl 1): S8–S11.
18. Petráková K, Palácová M, Schneiderová M et al. Syndrom hereditárního karcinomu prsu a ovarií. Klin Onkol 2016; 29 (Suppl 1): S14–S21. doi: 10.14735/amko2016 S14.
19. Zikán M. Gynekologická prevence a gynekologické aspekty péče u nosiček mutací genů BRCA1 a BRCA2. Klin Onkol 2016; 29 (Suppl 1): S22–S30. doi: 10.14735/amko2016S22.
20. Levanon K, Crum C, Drapkin R. New insights into the pathogenesis of serous ovarian cancer and its clinical impact. J Clin Oncol 2008; 26 (32): 5284–93. doi: 10.1200/JCO.2008.18.1107.
21. Morgan RD, Clamp AR, Evans DG et al. PARP inhibitors in platinum-sensitive high-grade serous ovarian cancer. Cancer Chemother Pharmacol 2018; 81 (4): 647–658. doi: 10.1007/s00280-018-3532-9.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue Supplementum2-
All articles in this issue
- Doporučení pro sledování žen se vzácnějšími genetickými příčinami nádorů prsu a ovarií
- Rizika solidních nádorů u heterozygotních přenašečů recesivních syndromů
- Karcinom prsu u nosiček mutací v genu BRCA1/2 – léčíme ho jinak? Zaměřeno na systémovou terapii u mutací v genu BRCA1/2
- Zhodnocení účinnosti neoadjuvantní chemoterapie s platinovým derivátem u pacientek se zárodečnou mutací v genech BRCA a BRCA2 – retrospektivní analýza souboru pacientek s karcinomem prsu léčených v MOÚ Brno
- Dědičné mutace v genu CHEK2 jako příčina dispozice k nádorům prsu – typy mutací, jejich biologická a klinická relevance
- Přínos masivního paralelního sekvenování pro diagnostiku dědičných forem nádorů ovaria v České republice
- Vzácné pediatrické ovariální tumory a jejich genetické příčiny
- Polypózy zažívacího traktu a Lynchův syndrom z pohledu patologa
- Nové poznatky o geneticky podmíněných nádorech tlustého střeva a polypózách gastrointestinálního traktu
- Syndrom BAP1 – predispozice k malignímu mezoteliomu, kožnímu a uveálnímu melanomu, renálnímu karcinomu a dalším nádorům
- Syndrom DICER1
- GAPPS – syndrom adenokarcinomu žaludku a mnohočetné polypózy žaludku v 8 rodinách testovaných v Masarykově onkologickém ústavu – prevence vč. profylaktické gastrektomie
- Dvacet let molekulární analýzy genů BRCA1 a BRCA2 v MOÚ – aktuální vývoj v klasifikaci nálezů
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dědičné mutace v genu CHEK2 jako příčina dispozice k nádorům prsu – typy mutací, jejich biologická a klinická relevance
- Rizika solidních nádorů u heterozygotních přenašečů recesivních syndromů
- Doporučení pro sledování žen se vzácnějšími genetickými příčinami nádorů prsu a ovarií
- GAPPS – syndrom adenokarcinomu žaludku a mnohočetné polypózy žaludku v 8 rodinách testovaných v Masarykově onkologickém ústavu – prevence vč. profylaktické gastrektomie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

