-
Medical journals
- Career
Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu
Authors: Sehnal Borek 1; Podlešák Tomáš 2; Kmoníčková Emanuela 3; Nipčová Monika 1; Driák Daniel 1; Sláma Jiří 4; Zikán Michal 1
Authors‘ workplace: Praha 3 Ústav radiační onkologie ; Praha 2 Otorinolaryngologické oddělení, Nemocnice Na Bulovce ; Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze ; Praha 4 Onkogynekologické centrum ; 1. LF UK a Nemocnice Na Bulovce ; Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce 1
Published in: Klin Onkol 2018; 31(2): 103-109
Category: Review
doi: https://doi.org/10.14735/amko2018103Overview
Východiska:
Lidský papilomavirus (human papillomavirus – HPV) může být příčinou karcinomů cervikálních, jiných genitálních, análních a karcinomů hlavy a krku. Incidence orofaryngeálního dlaždicobuněčného karcinomu (oropharyngeal squamous cell carcinoma – OSCC) – malignity hlavy a krku, u které je HPV infekce nejčastěji přítomna, se zvyšuje. Prevalence HPV infekce je výrazně menší v orální než v genitální oblasti, ale infekce v obou lokalitách je silně závislá na sexuálním chování. Ačkoliv přirozený průběh cervikální a orální HPV infekce se příliš neliší, zdá se, že schopnost viru infikovat současně orální a genitální oblast je raritní a neobvyklá. Na druhou stranu, poměr standardizované incidence OSCC je vyšší u pacientek s karcinomem děložního hrdla než u ostatní populace. Navíc ženy s OSCC mají významně zvýšené riziko rozvoje genitálních karcinomů v souvislosti s HPV. Vakcinace proti HPV u obou pohlaví nepochybně dramaticky změní epidemiologii HPV asociovaných karcinomů.Cíl:
Souhrnný přehled literatury a odhad rizika OSCC u žen s HPV anogenitální infekcí.Závěr:
Biologický vztah mezi různými HPV infikovanými lokalitami může být komplexní, ale vyšší prevalence HPV infekce ve vzorcích z dutiny ústní mezi ženami s anogenitální HPV infekcí naznačuje, že tyto infekce nejsou na sobě zcela nezávislé. Sexuální aktivita hraje roli v riziku prevalence souběžné anogenitální a orální koinfekce, ale je také možné, že infekce jedné lokality slouží jako rezervoár, který může zvyšovat riziko autoinokulace v anatomicky vzdálených lokalitách nebo koinfekce může být důsledkem jiných vlivů (např. imunodeficience). Nicméně pacientky s HPV asociovanou malignitou genitálu mají nepochybně vyšší riziko OSCC.Klíčová slova:
lidský papilomavirus – HPV – orální HPV infekce – genitální HPV infekce – orofaryngeální dlaždicobuněčný karcinom – poměr standardizovaných incidencí – karcinom hlavy a krkuÚvod
Infekce lidským papilomavirem (human papillomavirus – HPV) se nejčastěji přenáší při sexuálních aktivitách, postihne alespoň jednou za život asi 80 % sexuálně žijících lidí a je tak považována za nejčastější pohlavně přenosné onemocnění [1]. Předpokládá se, že vysoce rizikové (high-risk – HR) genotypy způsobí přibližně 5 % všech lidských karcinomů a spolu s Helicobacter pylori a viry hepatitidy B a C jsou tak HPV nejčastější infekční příčinou malignit [1,2]. Nejvyšší prevalence HPV (99,7 %) je prokazována u dlaždicobuněčných karcinomů děložního hrdla. Také velká část dlaždicobuněčných prekanceróz a karcinomů anu, vulvy, vaginy, penisu, hlavy a krku je způsobena infekcí HR HPV [1–3].
Orofaryngeální dlaždicobuněčný karcinom
Orofaryngeální dlaždicobuněčný karcinom (oropharyngeal squamous cell carcinoma – OSCC) je nejčastější maligní epiteliální neoplazií dutiny ústní (90 %), tvoří až 5 % všech malignit u mužů a 2 % u žen [4,5]. Incidence OSCC signifikantně roste ve všech zemích o 0,6–6,7 % ročně, celosvětově se jedná o 6. nejčastější malignitu [1,5,6]. Vedle tradičních rizikových faktorů (kouření, žvýkání tabáku, konzumace alkoholu) ovlivňuje maligní proces HPV infekce, která může být i primárním onkogenním faktorem indukujícím kancerogenezi u pacientů bez tradičních rizikových faktorů [1,5]. HPV DNA obsahuje sekvence kódující proteiny s onkogenní kapacitou E6 a E7, které způsobí narušení funkce dvou tumor supresorových genů p53 a pRb, tím utlumí buněčnou apoptózu a umožní nekontrolované buněčné dělení [5].
Některé studie potvrzují zastoupení HPV infekce u OSCC až v 85 %, dříve se udávala asociace výrazně nižší [7,8]. Recentní metaanalýza článků z let 1995–2015 zjistila 39,27% pozitivitu HPV u celkem 1 497 karcinomů dutiny ústní [9]. Jiná metaanalýza uvádí přítomnost HPV u 23–35 % biopsií OSCC s maximem v dutině ústní (45–90 %) a s dominancí HR genotypu HPV 16 (68–90 %) [10]. Původní česká práce v souboru 41 pacientů s nádorem hlavy nebo krku zjistila infekci HPV 16 u 94 % dlaždicobuněčných karcinomů této oblasti a v jednom případě byl detekován HPV 33 [11].
Orální HPV infekce
Hodnoty prevalence orální HPV infekce ve zdravé populaci se liší od prevalence 0,6 % v Japonsku [12] až k záchytu 95,4 % u britské bílé populace [13]. Všechny práce ale potvrzují jasnou dominanci genotypu HPV 16 [3–5,12,14–16]. Recentní metaanalýza 29 studií na celkem 10 124 mužích a 12 623 ženách uvádí orální HPV prevalenci u 2,9 % žen, u 4,7 % heterosexuálních mužů a nejvíce u 12,2 % homosexuálních mužů [15]. Kupodivu, statisticky významná asociace mezi orální HPV infekcí a orálním sexem byla nalezena pouze u mužů a nikoliv u žen. Na druhou stranu, kouření je jednoznačně více rizikovým faktorem orální HPV infekce u žen (OR 2,19; 95% CI 1,26–3,82; p = 0,0058) [15]. V metaanalýze z 18 studií na 4 581 zdravých lidech byla zjištěna prevalence orální HPV infekce ve 4,5 % (95% CI 3,9–5,1) s významně vyšším záchytem v rozvojových zemích [14]. Samostatný výzkum na největším vzorku populace 5 501 jedinců starých 14–69 let byl proveden ve Spojených státech [4]. Prevalence orální HPV infekce byla detekována v průměru u 6,9 % (95% CI 5,7–8,3) populace a byla zjištěna 3× vyšší u mužů než u žen (10,1 vs. 3,6 %; p < 0,001), s průkazem genotypu HPV 16 u 1,0 % lidí zařazených do studie. Nejvyšší prevalence byla prokázána ve věku 30–34 let, signifikantně se zvyšovala s větším počtem sexuálních partnerů a také u silných kuřáků [4]. Většina orálních HPV infekcí je přechodná. Ve Spojených státech se 60,6 % orálních HPV infekcí u žen eradikovalo během 3 měsíců [12] a dalších 20,0 % během následujících 3 měsíců [17]. Také jen necelá polovina (42 %) infekcí nejčastějšími HR HPV genotypy přetrvávala déle než 3 měsíce [12,17]. U HIV – infekce HR genotypy perzistovala 6,9 měsíce, ale genotyp HPV 16 zůstával přítomen v průměru 37,1 měsíce a u HIV+ dokonce až 42,3–48,3 měsíce [17].
Anogenitální HPV infekce jako rizikový faktor OSCC
Prevalence genitální a orální HPV infekce je velmi rozdílná, přirozený průběh genitální a orální HPV infekce se ale příliš neliší v podobné délce perzistence (tzv. clearing time 1,5–2 roky) [18]. Několik studií sledovalo přítomnost genitální HPV infekce nebo HPV asociované genitální léze jako rizikového faktoru pro výskyt orální HPV infekce. Smith et al již v roce 2004 uveřejnili výsledky opakovaného vyšetření na HPV děložního hrdla a dutiny ústní pomocí polymerázové řetězové reakce (polymerase chain reaction – PCR) u 577 těhotných žen a také u 23 jejich partnerů. V děložním hrdle bylo infikováno 35 % jednou a 20 % žen při dvou kontrolách. V této práci nebyl zjištěn statisticky významný genotypový soulad ani mezi dvěma konsekutivními odběry z děložního hrdla, ani mezi odběry z děložního hrdla a dutiny ústní těhotných a ani mezi odběry u žen a jejich partnerů [19].
Velká studie zaměřená na vztah vaginální a orální HPV infekce byla publikována v roce 2016. Celkem 3 463 žen (průměrný věk 37,5 roku) bylo testováno na orální a vaginální HPV infekci. Vaginální HPV infekce se vyskytovala u 1 568 žen (45,2 %) a orální u 141 subjektů (4,1 %). Vaginální infekce bez přítomné orální infekce byla pozorována u 1 461 (42,2 %) a orální bez vaginální u 107 žen (1,0 %). Souběžná infekce v obou lokalitách s odlišnými HPV genotypy byla detekována u 107 (3,1 %) a konkordantní infekce s identickými HPV genotypy u 41 žen (1,1 %). Ačkoliv pouze 6,8 % vaginálně pozitivních mělo duální infekci, 3/4 (75,9 %) orálně pozitivních žen bylo infikováno i v pochvě [18].
Steinau et al zjistili v kohortě 1 812 žen ve věku 18–59 let prevalenci HPV v dutině ústní 3,8 % (95% CI 2,7–4,4) a v cervixu 42,7 % (95% CI 39,3–46,3), v obou lokalitách bylo HPV+ 3 % žen (95% CI 2,1–4,3) [16]. Prevalence souběžné cerviko-orální HPV infekce byla vyšší u žen s více než třemi životními sexuálními partnery. Prevalence orální HPV infekce byla 5× vyšší u žen s pozitivitou v cervixu než bez infekce v hrdle (7,0 vs. 1,4 %, PR 4,9; 95% CI 2,7–8,7). Z žen se souběžnou infekcí v obou orgánech mělo 43,2 % (95% CI 28,3–59,5) nejméně jeden identický genotyp, u 50,4 % (95% CI 34,3–66,4) byly genotypy zcela odlišné a pouze 6,4 % (95% CI 2,3–16,8) mělo zcela shodné genotypy. V této studii HPV infekce nebyla v ústech a děložním hrdle nezávislá, ačkoliv typově specifická shoda byla nízká [16].
V kohortě 174 žen ve věku 15–23 let provedli Du et al odběry na HPV z hrdla dělohy i z dutiny ústní [20]. Cervikální HPV infekce byla přítomna u 74,1 % (129/174) žen. Orální HPV infekce byla téměř 4× častější u mladých žen s cervikální HPV infekcí (17,1 %; 22/129) oproti skupině bez cervikální HPV infekce (4,4 %; 2/45 p = 0,043). Celkem 91,7 % (22/24) žen s přítomnou orální HPV infekcí mělo také cervikální HPV infekci a u 91 % (20/22) z nich byly orální HPV genotypy zcela identické s HPV genotypy v hrdle děložním s jasnou dominancí genotypu HPV 16. Také tato studie naznačila určitou závislost, i když genotypy v hrdle děložním nebyly zcela shodné s HPV genotypy v dutině ústní [20].
Termine et al zpracovali metaanalýzu 10 studií (n = 1 017) a zjistil souběžnou cerviko-orální HPV infekci u 18,1 % žen (95% CI 10,3–25,9) se statisticky signifikantní genotypově konkordantní infekcí u 27,0 % (95% CI 12,3–41,7; p = 0,002) infikovaných žen. Riziko orální HPV infekce a také výskyt identických genotypů zvyšovala jen HIV pozitivita a začátek pohlavního života před 18. rokem života. Ostatní potenciální rizikové a protektivní faktory nebyly statisticky významné [21].
Marques et al na malém vzorku 43 brazilských žen s HPV asociovanou lézí děložního hrdla (těžká cervikální prekanceróza nebo invazivní cervikální karcinom) a 22 jejich sexuálních partnerů detekovali orální infekci jen u jedné ženy (1/43; 2,3 %) a u tří mužů (3/22; 13,6 %) [22]. K podobným výsledkům dospěli Oliveira et al, kteří zjistili pomocí PCR cervikální HPV infekci u 9,2 % žen (7/76) a orální u 5,3 % žen (4/76), pouze jedna žena měla souběžnou genitálně-orální HPV infekci (1,3 %) [23]. Také Meyer et al vyšetřili 129 brazilských žen na přítomnost HPV orální laváží a pomocí kartáčku z tonsil a z děložního hrdla. Celkem 54,3 % (70/129) žen mělo HPV infekci v hrdle a z této subkohorty bylo 5,7 % (4/70) infikováno HPV i v dutině ústní. U 5,1 % (3/59) žen v hrdle negativních byla prokázána HPV infekce jen v orofaryngu [24]. Výsledky těchto prací z Brazílie naznačují, že genitální a orální HPV infekce nejsou izolované, ale vzhledem k malému počtu případů nebyly tyto výsledky statisticky významné.
Brouwer et al analyzovali data ze systému NHANES (National Health and Nutrition Examination Survey, National Center for Health Statistics) ve Spojených státech z let 2003–2012, ve kterém se mimo jiné archivují výsledky HPV vaginálních stěrů žen a výsledky HPV z laváží ústní dutiny mužů a žen [25]. Analýza odhalila u 33 % žen s orální HPV infekcí genotypově konkordantní cerviko-vaginální HPV infekci, ale tento genotypový soulad mezi genitální a orální infekcí se velmi lišil podle věku. Naopak pouze 3 % žen s cerviko-vaginální infekcí bylo infikováno identickými genotypy také v dutině ústní [25].
Cañadas et al odebrali v nemocnici v Oviedo (Španělsko) odběry na genotypizaci HPV u 188 prostitutek z děložního hrdla, pochvy, vulvy, anu a dutiny ústní [26]. Prevalence HPV infekce byla zjištěna ve 27,8 % cervikálních, 26,1 % vaginálních, 22,9 % vulválních, 15 % análních a 7,9 % orálních vzorků. Nejčastěji zastoupeným genotypem ve všech lokalitách byl genotyp HPV 16. Soulad prevalence HPV infekce v hrdle děložním vypočítaný podle koeficientu shody kappa byl pro vaginální HPV infekci 0,932 (p < 0,0001), pro vulvální 0,508 (p < 0,0001), pro anální 0,41 (p < 0,001) a pro orální HPV infekci 0,72 (p = 0,191). Také tato studie tedy nepotvrdila statisticky významnou závislost prevalence orální HPV infekce na přítomnost souběžné cervikální HPV infekce na rozdíl od souběžné HPV infekce v jiných lokalitách [26].
Visalli et al do své studie ve městě Messina (Itálie) zařadili 100 nevakcinovaných žen (věk 22–52 let) s HPV asociovanou cervikální lézí (58 žen s HR HPV infekcí a 42 s low-risk (LR) HPV) a 25 nevakcinovaných žen (věk 20–49 let) bez genitální léze jako kontrolní skupinu [5]. Pomocí PCR zjistil přítomnost HPV DNA ve slinách pacientek u 24 % (24/100) žen s cervikální lézí a u 8 % (2/25) v kontrolní skupině. Nejvíce frekventním genotypem byl HPV 16 následovaný HPV 18 a HPV 45. Nebyla zjištěna statistická závislost u pacientek HPV pozitivních v obou místech v souvislosti s věkem, kouřením, konzumací alkoholu, sexuálními praktikami a sociálními charakteristikami obou skupin. Naopak byla zjištěna závislost detekce HPV 16 a/nebo HPV 18 ve slinách na přítomnost těžké cervikální léze (OR 3,747; 95% CI 1,39–10,09; p = 0,0069) [5].
Možnosti vakcinace proti HPV
Prvním impulzem k úspěšnému vývoji profylaktických vakcín proti infekci HPV byla identifikace příčinného vztahu mezi infekcí genotypy HPV 16 a HPV 18 a etiopatogenezí karcinomu děložního hrdla. V současnosti jsou k dispozici tři komerčně vyráběné profylaktické vakcíny – bivalentní Cervarix® (HPV 16/18), kvadrivalentní Silgard® (HPV 6/11/16/18) a nově také nonavalentní Gardasil 9® (HPV 6/11/16/18/31/33/45/53/58). HPV vakcinace je pro dívky ve věku mezi 13 a 14 lety hrazena v ČR z prostředků zdravotního pojištění, v roce 2015 využilo tuto možnost 65 % dívek registrovaných u VZP [27]. Charakteristiky všech dostupných vakcín proti HPV infekci zobrazuje tab. 1.
Table 1. Základní charakteristiky registrovaných HPV vakcín. 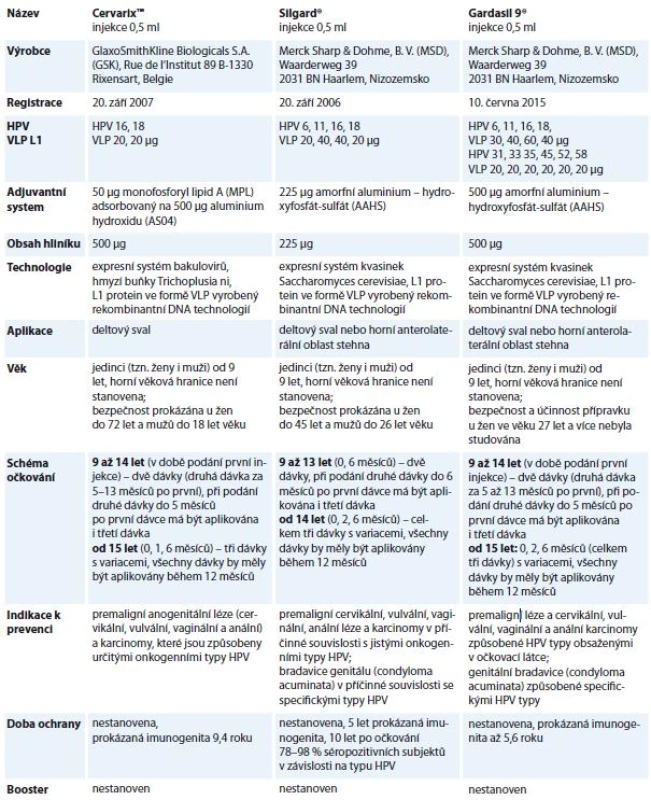
HPV – lidský papilomavirus, VLP – virům podobné částice Když došlo ke schválení nových indikací postupně pro všechny HPV vakcíny v prevenci premaligních análních lézí a análních karcinomů, byla také v ČR zahájena diskuze o možnosti úhrady očkování proti HPV infekci z veřejného zdravotního pojištění pro chlapce ve věku 13–14 let. S ohledem na prozatím nejednotný názor mezi českou odbornou veřejností na zavedení HPV vakcinace chlapců do očkovacího kalendáře Národní imunizační komise zatím pouze doporučila sledovat a vyhodnocovat všechna dostupná data týkající se účinnosti a cost-benefitu plošného očkování chlapců proti HPV ve světě. Česká vakcinologická společnost zaujala v případě plošného očkování chlapců zatím zdrženlivý postoj. Ve svém stanovisku mimo jiné uvádí, že asociace mezi HPV infekcí a karcinomem rekta není tak silná a nejsou dostupná jednoznačná data prokazující dostatečnou účinnost a ekonomickou výhodnost očkování v profylaxi rektálního karcinomu. Naproti tomu Česká společnost otorinolaryngologie a chirurgie hlavy a krku ČSL JEP považuje za potřebné rozšířit úhradu očkování také na chlapce, zejména z důvodu stejné ochrany HPV vakcinace před závažným onemocněním karcinomů orofaryngu a rekurentní papilomatózy u dívek i chlapců.
Přestože by zejména homosexuální muži profitovali z plošné HPV vakcinace, pouze Spojené státy, Kanada, Austrálie, Rakousko, Nový Zéland a Mexiko doporučují plošnou HPV vakcinaci u obou pohlaví [28]. V září 2011 Food and Drug Administration (FDA) sice uvolnila ve Spojených státech kvadrivalentní vakcínu k prevenci genitálních kondylomat, analní intraepiteliální neoplazie (AIN) a análního karcinomu pro chlapce a muže ve věku 9–26 let, nicméně ACIP (Advisory Committee on Immunization Practices) při CDC (Centers for Disease Control) doporučila volnější přístup k HPV vakcinaci mužů na rozdíl od striktního doporučení vakcinovat všechny ženy a dívky. Výjimkou zůstává doporučení pro homosexuální muže, které doporučuje očkovat i muže starší [28].
Základním argumentem proti plošné HPV vakcinaci mužů je finanční nevýhodnost založená na ekonomických modelech. Transmise HPV probíhá prakticky výhradně při sexuálních aktivitách a samotné vysoké pokrytí ženské populace poskytuje výrazný benefit i pro chlapce se signifikantním poklesem výskytu HPV asociovaných onemocnění u obou pohlaví. Podle norské práce by pokrytí vakcinací u 90 % dívek mělo větší účinnost na zdraví celé populace a bylo by levnější než 71% proočkovanost obou pohlaví [29]. V ČR je od 1. 1. 2018 HPV vakcinace hrazena ze zdravotního pojištění také pro chlapce ve věku 13–14 let.
Diskuze
Spojitost mezi HPV infekcí a orofaryngeálním karcinomem je zvažována > 20 let. Většina HPV infekcí vymizí během 1 roku nebo 2 let díky působení přirozených imunitních mechanizmů, některé infekce však mohou perzistovat a způsobit maligní transformaci. Lidé s orální HPV infekcí mají přibližně 50× vyšší riziko rozvoje OSCC asociovaného s HPV [4,5]. Pacienti s HPV+ OSCC jsou v průměru o 10 let mladší, častěji se jedná o nekuřáky a abstinenty [2,7,10]. HPV+ nádory bývají méně diferencovány a jsou diagnostikovány v pozdějších stadiích [8,10]. Pacienti s orofaryngeálním karcinomem asociovaným s HPV infekcí umírají 2–5× častěji než pacienti s tímto karcinomem bez prokázané HPV infekce [9,10]. Podle jiných studií ale pacienti s HPV asociovanými orofaryngeálním karcinomem žijí déle (OS 82,4 vs. 57,1 %; p < 0,001) a vykazují i delší bezpříznakové období (73,7 vs. 43,5 %; p < 0,001) [30]. Zatímco incidence OSCC se u kuřáků snižuje, incidence HPV pozitivních OSCC se neustále zvyšuje. Tento nárůst je přičítán zvyšující se prevalenci orální HPV infekce v souvislosti se změnami sexuálního chování. Například ve Francii se počet žen udávající aktivní praktikování orálního sexu zvýšil z 51 % (1970) na 91 % (2006). Podobně i u mužů byl zaznamenán nárůst praktikování orálního sexu za stejné období z 55 na 94 % [31].
U zdravých jedinců je orální HPV infekce opakovaně detekována podstatně méně často než v oblasti anogenitální [2], což souvisí nejspíše se snadnějším přístupem HPV do anogenitální oblasti, s různou afinitou epitelů a s výskytem protektivních látek (lysozymy, lactoferiny, imunoglobulin A, cytokiny) ve slinách [21]. Zatímco prevalence cervikální HPV infekce klesá se vzrůstajícím věkem, prevalence orální infekce a také souběžné cerviko-orální infekce zůstává v průběhu života stabilní [16]. U žen se souběžnou cerviko-orální HPV infekcí je také doba potřebná k eradikaci orální HPV infekce téměř 2× delší (50,0 měsíce) než u žen bez přítomné cervikální infekce (28,2 měsíce) [17,32]. Prevalence orální HPV infekce je opakovaně nalézána nižší u žen než mužů. Existuje několik hypotéz, proč tomu tak je:
- 1. muži mají více sexuálních partnerů, a tím větší expozici HPV infekce;
- 2. přenos infekce při orálním sexu je snadnější při přenosu z ženských infikovaných sliznic genitálu než z mužského keratinizovaného epitelu penisu;
- 3. ženy mají díky častější cervikální infekci určitý stupeň systémové imunity, která je pravděpodobně může částečně chránit i proti orální HPV infekci, kdežto u mužů nebyla obdobná ochrana pozorována [3]
HPV se nejčastěji přenáší při sexuálních (koitálních i nekoitálních) aktivitách, ale relativně časté jsou i přenosy kontaktem genitál-genitál, anus-genitál a ústa-genitál nebo pomocí sexuálních pomůcek či rukou od jiné osoby i autoinokulací (tzn. přenos mezi anem, genitálem a dutinou ústní vlastní rukou) [3]. Zatímco genito-anální HPV infekce jsou silně provázané [33], souběžná genito-orální HPV infekce je relativně vzácná a genotypově specifická shoda v obou lokalitách je poměrně nízká. Biologický vztah mezi oběma lokalitami může být komplexní, ale vyšší prevalence HPV infekce ve vzorcích z dutiny ústní mezi ženami s cervikální HPV infekcí naznačuje, že určitý stupeň závislosti existuje [16]. Sexuální aktivita hraje roli v riziku prevalence souběžné genitální a orální koinfekce, ale je také možné, že infekce jedné lokality slouží jako rezervoár, který může zvyšovat riziko autoinokulace v anatomicky vzdálených lokalitách [16]. Tato hypotéza je podpořena daty ze Swedish Cancer Registry. Z analýzy 17 556 pacientek s invazivním karcinomem děložního hrdla vyplynulo, že zvláště ženy ve věku ≥ 50 let mají vyšší riziko sekundární HPV asociované malignity [34]. Pacientky s anamnézou karcinomu děložního hrdla měly poměr incidence onemocnění ve vztahu ke standardní incidenci téhož onemocnění v populaci (standardized incidence ratio – SIR) sekundárního karcinomu laryngu odpovídající hodnotě 4,40 (95% CI 1,88–8,72), SIR 4,98 (95% CI 1,57–11,71) pro karcinom hypofaryngu a SIR 2,60 (95% CI 1,18–4,95) pro karcinom dutiny ústní. Na druhou stranu nebyla prokázána statisticky významná vyšší incidence jiných HPV asociovaných malignit (tonsily, kořen jazyka) u těchto žen [34]. K podobným výsledkům dospěli Chaturvedi et al s využitím údajů z 13 onkologických registrů v Dánsku, Norsku, Švédsku, Finsku a Spojených státech u 85 109 pacientek s dlaždicobuněčným karcinomem děložního hrdla. SIR u všech sekundárních HPV asociovaných karcinomů bylo stanoveno na 2,30 (95% CI 2,18–2,43). Podle očekávání nejvyšší SIR 5,00 (95% CI 4,55–5,50) bylo u jiných sekundárních malignit genitálu, ale poměrně vysoké bylo SIR 2,69 (95% CI 2,57–2,83) také pro malignity systému trachea/bronchus/plíce, SIR 2,06 (95% CI 1,53–2,73) pro karcinom faryngu a SIR 2,10 (95% CI 1,55–2,79) pro karcinomy laryngu [6]. Balamurugan et al dohledali u 23 509 pacientek s rakovinou děložního hrdla mírně zvýšené SIR (1,96) pro karcinomy dutiny ústní a vyšší SIR (3,27) u žen s karcinomem plic a bronchů. U pacientek s OSCC byly nejčastěji zastoupeny karcinomy tonsil (55 %) a karcinomy kořene jazyka (25 %) [35].
Tyto práce dokládají vyšší riziko OSCC u žen s HPV asociovanou malignitou genitálu, přestože přítomnost anogenitální HPV infekce nebyla jako rizikový faktor pro orální HPV infekci jednoznačně prokázána. Existují návrhy provádět organizovaný screening onemocnění dutiny ústní u žen s HPV asociovanou cervikální lézí zvláště ve spojitosti s přítomností dalších rizikových faktorů (kouření, genetická predispozice, HIV pozitivita) [5,18]. Detekce HR HPV genotypů v dutině ústní patří k rizikovým faktorům. Pacienti s OSCC asociovaným s LR HPV genotypy a s dalšími nepříznivými aspekty (nízká diferenciace tumoru, extrakapsulární šíření, metastázy v lymfatických uzlinách) žijí o 2 roky déle než pacienti, u kterých byly detekovány HR HPV genotypy [7,9,30].
Závěr
Prevalence HPV infekce je výrazně nižší v dutině ústní než v oblasti anogenitální a liší se i u obou pohlaví. Je ale nutné provést další prospektivní studie k doplnění mezer ve znalostech o průběhu HPV infekce [3]. Vzhledem k nízké prevalenci orální HPV infekce je třeba studií na velkých vzorcích populace ke zhodnocení přirozeného průběhu a možností přenosu HPV infekce. Pravděpodobně existuje určitá závislost v přítomnosti HPV infekce mezi dutinou ústní a genitálem, která ale není příliš silná a může souviset s jinými predispozicemi (např. imunodeficience). Nicméně pacientky s HPV asociovanou malignitou genitálu mají prokazatelně vyšší riziko OSCC. Stále není zcela jasné, jakou účinnost bude mít zavedení plošné HPV vakcinace na incidenci OSCC, některé práce ale dokládají snížení prevalence orální HPV infekce po vakcinaci [36].
Práce byla podpořena projektem UNCE 204065 Karlovy Univerzity.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 26. 8. 2017
Přijato: 4. 1. 2018
MUDr. Borek Sehnal, Ph.D.
Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce
Budínova 67/2 180 81 Praha
e-mail: boreksehnal@seznam.cz
Sources
1. Sehnal B, Vojáčková N, Driák D et al. Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů. Klin Onkol 2014; 27 (4): 239–246. doi: 10.14735/amko2014239.
2. Forman D, de Martel C, Lacey CJ et al. Global burden of human papillomavirus and related diseases. Vaccine 2012; 30 (Suppl 5): F12–F23. doi: 10.1016/j.vaccine.2012.07.055.
3. Giuliano AR, Nyitray AG, Kreimer AR et al. EUROGIN 2014 roadmap: differences in human papillomavirus infection natural history, transmission and human papillomavirus-related cancer incidence by gender and anatomic site of infection. Int J Cancer 2015; 136 (12): 2752–2760. doi: 10.1002/ijc.29082.
4. Gillison ML, Broutian T, Pickard RK et al. Prevalence of oral HPV infection in the United States, 2009–2010. JAMA 2012; 307 (7): 693–703. doi: 10.1001/jama.2012.101.
5. Visalli G, Currò M, Facciolà A et al. Prevalence of human papillomavirus in saliva of women with HPV genital lesions. Infect Agent Cancer 2016; 11 (1): 48. doi: 10.1186/s13027-016-0096-3.
6. Chaturvedi AK, Kleinerman RA, Hildesheim A et al. Second cancers after squamous cell carcinoma and adenocarcinoma of the cervix. J Clin Oncol 2009; 27 (6): 967–973. doi: 10.1200/JCO.2008.18.4549.
7. Kašpírková J, Ondič O, Černá K et al. Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk Patol 2013; 49 (1): 29–34.
8. Näsman A, Attner P, Hammarstedt L et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer 2009; 125 (2): 362–366. doi: 10.1002/ijc.24339.
9. Chaitanya NC, Allam NS, Gandhi DB et al. Systematic meta-analysis on association of human papilloma virus and oral cancer. J Cancer Res Ther 2016; 12 (2): 969–974. doi: 10.4103/0973-1482.179098.
10. Kreimer AR, Clifford GM, Boyle P et al. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005; 14 (2): 467–475. doi: 10.1158/1055-9965.EPI-04-0551.
11. Kašpírková J, Ondič O, Černá K et al. Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk Patol 2013; 49 (1): 29–34.
12. Wood ZC, Bain CJ, Smith DD et al. Oral human papillomavirus infection incidence and clearance: a systematic review of the literature. J Gen Virol 2017; 98 (4): 519–526. doi: 10.1099/jgv.0.000727.
13. Crawford R, Grignon AL, Kitson S et al. High prevalence of HPV in non cervical sites of women with abnormal cervical cytology. BMC Cancer 2011; 11 : 473. doi: 10.1186/1471-2407-11-473.
14. Kreimer AR, Bhatia RK, Messeguer AL et al. Oral human papillomavirus in healthy individuals: a systematic review of the literature. Sex Transm Dis 2010; 37 (6): 386–391. doi: 10.1097/OLQ.0b013e3181c94a3b.
15. Shigeishi H, Sugiyama M. Risk factors for oral human papillomavirus infection in healthy individuals: A systematic review and meta-analysis. J Clin Med Res 2016; 8 (10): 721–729. doi: 10.14740/jocmr2545w.
16. Steinau M, Hariri S, Gillison ML et al. Prevalence of cervical and oral human papillomavirus infections among US women. J Infect Dis 2014; 209 (11): 1739–1743. doi: 10.1093/infdis/jit799.
17. Taylor S, Bunge E, Bakker M et al. The incidence, clearance and persistence of non-cervical human papillomavirus infections: a systematic review of the literature. BMC Infect Dis 2016; 16 : 293. doi: 10.1186/s12879-016-1633-9.
18. Kedarisetty S, Orosco RK, Hecht AS et al. Concordant oral and vaginal human papillomavirus infection in the United States. JAMA Otolaryngol Head Neck Surg 2016; 142 (5): 457–465. doi: 10.1001/jamaoto.2016. 0064.
19. Smith EM, Ritchie JM, Yankowitz J et al. HPV prevalence and concordance in the cervix and oral cavity of pregnant women. Infect Dis Obstet Gynecol 2004; 12 (2): 45–56. doi: 10.1080/10647440400009896.
20. Du J, Nordfors C, Ahrlund-Richter A et al. Prevalence of oral human papillomavirus infection among youth, Sweden. Emerg Infect Dis 2012; 18 (9): 1468–1471. doi: 10.3201/eid1809.111731.
21. Termine N, Giovannelli L, Matranga D et al. Oral human papillomavirus infection in women with cervical HPV infection: new data from an Italian cohort and a meta-analysis of the literature. Oral Oncol 2011; 37 (4): 244–250. doi: 10.1016/j.oraloncology.2011.02.011.
22. Marques AE, Barra GB, de Resende Oyama CN et al. Low rate of oropharyngeal human papillomavirus infection of women with cervical lesions and their partners: new data from Brazilian population. J Oral Pathol Med 2015; 44 (6): 453–458. doi: 10.1111/jop.12252.
23. Oliveira LH, Santos LS, Silva CO et al. Papillomavirus infections in the oral and genital mucosa of asymptomatic women. Braz J Infect Dis 2017; 21 (1): 88–91. doi: 10.1016/j.bjid.2016.08.015.
24. Meyer MF, Huebbers CU, Siefer OG et al. Prevalence and risk factors for oral human papillomavirus infection in 129 women screened for cervical HPV infection. Oral Oncol 2014; 50 (1): 27–31. doi: 10.1016/j.oraloncology.2013.10.009.
25. Brouwer AF, Eisenberg MC, Carey TE et al. Trends in HPV cervical and seroprevalence and associations between oral and genital infection and serum antibodies in NHANES 2003–2012. BMC Infect Dis 2015; 15 : 575. doi: 10.1186/s12879-015-1314-0.
26. Cañadas MP, Bosch FX, Junquera ML et al. Concordance of prevalence of human papillomavirus DNA in anogenital and oral infections in a high-risk population. J Clin Microbiol 2004; 42 (3): 1330–1332.
27. Cabrchonová H. XII. Hradecké vakcinologické dny, 6.–8.října 2016. [Ústní sdělení] Data VZP ČR.
28. Stupiansky NW, Alexander AB, Zimet GD. Human papillomavirus vaccine and men: what are the obstacles and challenges? Curr Opin Infect Dis 2012; 25 (1): 86–91. doi: 10.1097/QCO.0b013e32834ed5be.
29. Burger EA, Sy S, Nygård M et al. Prevention of HPV-related cancers in Norway: cost-effectiveness of expanding the HPV vaccination program to include pre-adolescent boys. PLos One 2014; 9 (3): e89974. doi: 10.1371/journal.pone.0089974.
30. Ang KK, Harris J, Wheeler R et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363 (1): 24–35. doi: 10.1056/NEJMoa0912217.
31. Bajos N, Bozon M, Beltzer N et al. Changes in sexual behaviours: from secular trends to public health policies. AIDS 2010; 24 (8): 1185–1191. doi: 10.1097/QAD.0b013e328336ad52.
32. Louvanto K, Rautava J, Syrjänen K et al. The clearance of oral high-risk human papillomavirus infection is impaired by long-term persistence of cervical human papillomavirus infection. Clin Microbiol Infect 2014; 20 (11): 1167–1172. doi: 10.1111/1469-0691.12700.
33. Sehnal B, Dusek L, Cibula D et al. The relationship between the cervical and anal HPV infection in women with cervical intraepithelial neoplasia. J Clin Virol 2014; 59 (1): 18–23. doi: 10.1016/j.jcv.2013.11.004.
34. Hemminki K, Dong C, Frisch M. Tonsillar and other upper aerodigestive tract cancers among cervical cancer patients and their husbands. Eur J Cancer Prev 2000; 9 (6): 433–437.
35. Balamurugan A, Ahmed F, Saraiya M et al. Potential role of human papillomavirus in the development of subsequent primary in situ and invasive cancers among cervical cancer survivors. Cancer 2008; 113 (Suppl 10): 2919–2925. doi: 10.1002/cncr.23746.
36. Herrero R, Quint W, Hildesheim A et al. Reduced prevalence of oral human papillomavirus (HPV) 4 years after bivalent HPV vaccination in a randomized clinical trial in Costa Rica. PLos One 2013; 8 (7): e68329. doi: 10.1371/journal.pone.0068329.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue 2-
All articles in this issue
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
- Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu
- Úvod do problematiky léčby zhoubných nádorů ledvin
- Nové možnosti testování chemosenzitivity u nádorových onemocnění
- Kvalita života pacientů s častými nádory dutiny ústní léčených pooperační brachyterapií s vysokým dávkovým příkonem pro těsné nebo pozitivní okraje
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Súčasné trendy prežívania pacientov s nádorom testis – Národná populačná štúdia
- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Diagnostická, prognostická a prediktivní imunohistochemie při maligním melanomu kůže
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

