-
Medical journals
- Career
Diagnostický a terapeutický potenciál membránového HSP90
Authors: O. Vacek; M. Pastorek; M. Ďurech; B. Vojtěšek; P. Müller
Authors‘ workplace: RECAMO, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2017; 30(Supplementum1): 191-194
Category: Article
Overview
Východiská:
Heat shock protein 90 (HSP90) je molekulárny chaperone, ktorý pomáha bunke udržiavať proteínovú homeostázu cez moduláciu stability de novo syntetizovaných proteínov. Zvýšená expresia HSP90 je charakteristická pre nádorové bunky s vysokými metabolickými nárokmi, ktoré si vytvorili „závislosť” na chaperónovom systéme. Špecifická inhibícia HSP90 má preto sľubný terapeutický potenciál a niekoľko inhibítorov HSP90 sa už nachádza aj v klinických skúškach. Nedávno bola okrem cytoplazmatickej lokalizácie popísaná aj prítomnosť HSP90 na membráne nádorových buniek, pričom extracelulárne lokalizovaný HSP90 bol u nádorov implikovaný pri zvýšenej invazivite a metastázovaní. Pochopenie vzťahu cytoplazmatickej a na membráne exponovanej formy HSP90 môže mať vďaka jeho prirodzene vyššej hladine v nádorových bunkách význam pri skorej detekcii malignity ako aj prispieť k pochopeniu mechanizmu importu terapeutík cielených na HSP90 do buniek. Preto sme na modeli bunkových línií karcinómu prsníka skúmali závislosť importu fluorescenčne značeného inhibítora HSP90 od hladiny jej membránovej formy a celkovej expresie HSP90.Metódy:
Prietoková cytometria bola použitá na stanovenie importu FITC-Geldanamycin do buniek a hladiny extracelulárnej HSP90, celková expresia HSP90 bola stanovená pomocou SDS-PAGE a Western blottingu. Získané dáta boli podrobené štatistickej analýze možnej korelácie.Výsledky:
Na vybraných bunkových líniách karcinómu prsníka (BT-474, BT-549, BT-20, MCF-7, MDA-MB-468, SK-BR-3 a T-47D) sme analyzovali celkovú hladinu HSP90 a mieru jej expozície na bunkovej membráne a pomocou prietokovej cytometrie sme určili mieru importu fluorescenčne značeného inhibítora HSP90. Získané dáta nám po štatistickej analýze odhalili koreláciu medzi hladinou celkového a membránového HSP90 a takisto importom fluorescenčne značeného inhibítora HSP90 FITC-Geldanamycin.Záver:
Z našich výsledkov vyplýva, že import inhibítorov HSP90 je pravdepodobne závislý od hladiny membránovej formy HSP90 ako aj jej celkovej expresie a môže tak odrážať závislosť nádorových buniek na chaperone HSP90.Kľúčové slová:
karcinóm prsníka – HSP90 – proteíny teplotného šoku – geldanamycinÚvod
HSP90 (heat shock protein 90) je evolučne vysoko konzervovaný chaperone, ktorého expresia v neoplastických bunkách môže dosahovať až 10-násobne vyššiu hladinu oproti zdravým bunkám z tkaniva ich pôvodu [1]. Prirodzene vyššia miera proteotoxického stresu v nádorových bunkách vytvára závislosť na HSP90 ako aj zvýšenej aktivite chaperónového systému [2], vďaka čomu má terapia cielená na HSP90 potenciál doplniť súčasné liečebné modality. V klinických skúškach sa v súčasnosti nachádza niekoľko inhibítorov HSP90, no pre absenciu mutácií HSP90 je pre identifikáciu mechanizmu ich transportu a špecifického účinku nutné pochopiť všeobecné princípy regulácie chaperónov. Okrem vyššej hladiny HSP90 bola oproti zdravým bunkám u nádorových buniek pozorovaná aj ektopická expresia HSP90 na membráne a v extracelulárnom priestore, kde bola jej prítomnosť asociovaná so zvýšenou agresivitou u viacerých typov nádorov. U karcinómu prsníka bol extracelulárny HSP90 (eHSP90) asociovaný s vyššou aktivitou matrix metaloproteináz a tým aj so zvýšenou invazivitou a metastázovaním, kľúčovými procesmi zodpovednými za nádorovú letalitu [3]. Kedže eHSP90 bol preferenčne detekovaný na povrchu nádorových buniek, je možné tento fenomén využiť pomocou látok špecificky sa viažucich na HSP90 na vizualizáciu ako aj terapeutické cielenie nádoru. V našej práci sme sa preto rozhodli skúmať vzťah eHSP90 k celkovej hladine HSP90 v bunke ako aj k miere importu jeho špecifického inhibítora, Geldanamycinu.
Materiál a metódy
Bunkové línie BT-20, BT-474, BT-549, MCF-7, MDA-MB-468, SK-BR-3 a T-47D boli zakúpene z ATCC a kultivované v Dulbecco’s modified Eagle’s medium (DMEM) suplementované 10% fetálnym teľacím sérom (HyClone, Thermo Scientific, USA), 1 mM sodium pyruvate (Sigma Aldrich, USA) a penicillin/streptomycin (HyClone, Thermo Scientific, USA) v CO2 inkubátore pri 37 °C.
Prietoková cytometria bola použitá na stanovenie membránovej hladiny eHSP90 a hladiny do buniek internalizovaného inhibítora FITC-Geldanamycin (Sigma, USA) v 5 µM koncentrácii po 1 hod inkubácie. Po skončení inkubácie boli adherentné bunkové kultúry uvoľnené pomocou roztoku Versene (ThermoFisher Scientific, USA) a viabilné bunky analyzované prietokovým cytometrom FACSVerse (BD Biosciences, USA), dáta boli následne spracované softvérom FCS Express 4.0 (De Novo Software, USA). Membránová eHSP90 bola stanovovaná pomocou primárnej protilátky Anti-HSP90 antibody (AC88) (Abcam, USA) s fluorescenčnou značkou Alexa Fluor® 647 (ThermoFisher Scientific, USA), nekrotická populácia buniek bola odlíšená pozitívnym farbením na Propidium Iodide (Sigma, USA).
Na stanovenie celkovej hladiny HSP90 boli jednotlivé bunkové línie kultivované v hustote 5 × 105 buniek/5 cm Petriho misku lyzované RIPA pufrom s inhibítormi proteáz a následne podrobené SDS-PAGE a Western blottingu. Pomocou vyššie uvedenej primárnej protilátky bola celková hladina HSP90 vypočítaná z kalibračnej krivky purifikovaného proteínu HSP90 a vyjadrená ako percentuálny podiel celkového množstva bunkových proteínov. Signál bol detekovaný prístrojom Typhoon FLA 9500 a data spracované softvérom ImageQuant™ (GE Healthcare, USA).
Výsledky
Na paneli bunkových línií karcinómu prsníka (BT-20, BT-474, BT-549, MCF-7, MDA-MB-468, SK-BR-3 a T-47D), sme najprv pomocou prietokovej cytometrie analyzovali import fluorescenčne značeného inhibítora HSP90, FITC-Geldanamycinu. Väčšina v súčasnosti používaných inhibítorov HSP90 bola odvodená od štruktúry Geldanamycínu, ktorý sa špecificky viaže do ATP-väzobného miesta HSP90. U nádorových buniek bola oproti bunkám zdravého tkaniva pozorovaná zvýšená akumulácia inhibítorov HSP90, ktorej dôvod doposiaľ nie je úplne objasnený [4]. Možným vysvetlením je vyššia frekvencia výskytu HSP90 v heteroproteínových komplexoch u nádorových buniek, zatiaľ čo u zdravých buniek existuje HSP90 dominantne vo forme homodiméru. Ten má oproti heteroproteínovým chaperónovým komplexom až 200-násobne nižšiu afinitu k ATP [5]. Akumuláciu Geldanamycinu sme preto kvantifikovali pomocou prietokovej cytometrie už po 1 hod inkubácie s 5 µM FITC-Geldanamycin a vyhodnotili ako relatívnu zmenu fluorescencie oproti kontrolným vzorkám. Paralelne sme fluorescenčne značenou protilátkou proti HSP90 detekovali hladinu membránovej HSP90 u intaktných buniek (graf 1). Následne sme na porovnanie vzťahu hladiny na membráne exponovaného HSP90 s jeho celkovou hladinou analyzovali jeho expresiu Western blottingom, ktorú sme kvantifikovali pomocou štandardnej krivky a koncentráciu vyjadrili ako percentuálny podiel HSP90 na celkovom množstve bunkových proteínov (obr. 1). Získané dáta sme podrobili štatistickej analýze korelácie pri ktorej sme zistili vzťah medzi importom FITC-Geldanamycinu do buniek a expresiou membránového HSP90 (korelačný koeficient 0,8337) a takisto vzťah medzi celkovou expresiou HSP90 a jej expozíciou na membráne (korelačný koeficient 0,8544) (graf 2).
Graph 1. Relatívna hladina na membráne lokalizovaného HSP90 a importu 5 μM FITC-Geldanamycin po 1 hod inkubácii na bunkových líniách karcinómu prsníka. 
Image 1. Celková hladina HSP90 v bunkových líniách karcinómu prsníka vyjadrená ako procento HSP90 z celkovej hladiny proteínov v bunke. 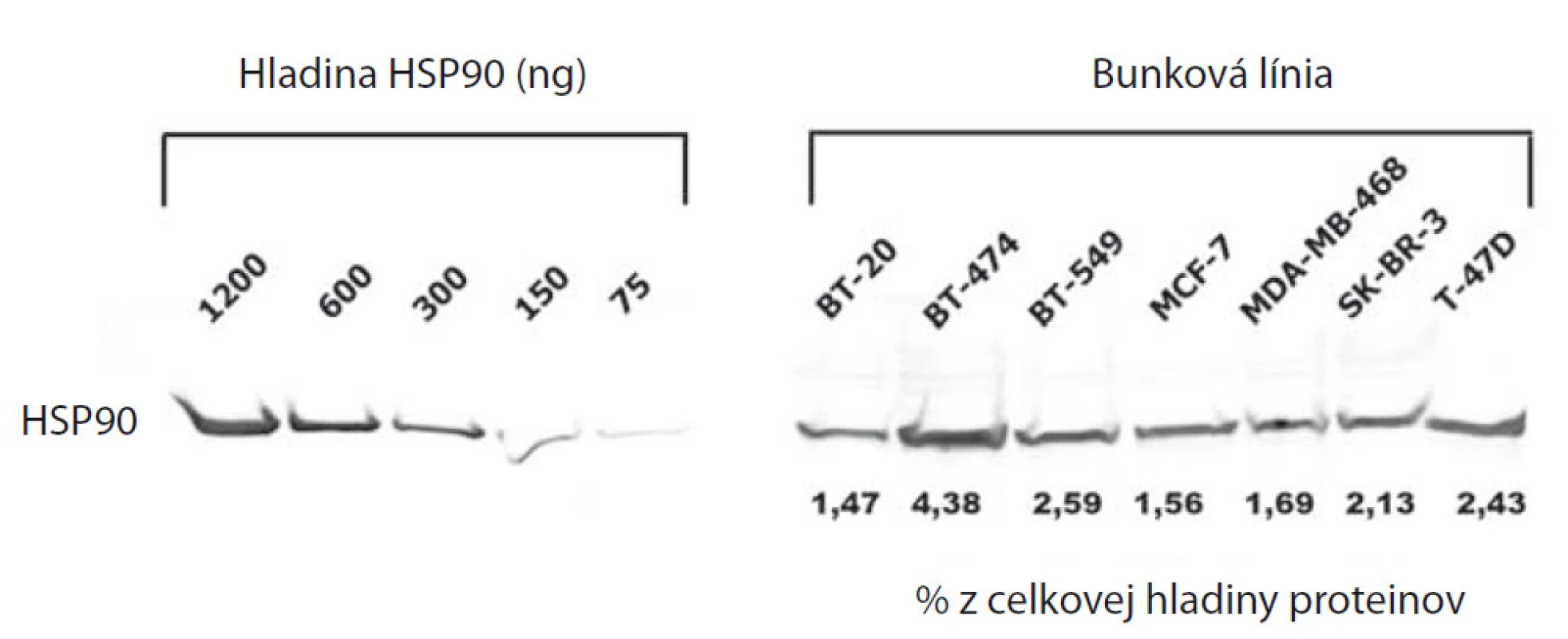
Graph 2. Korelácia membránovej hladiny eHSP90 z celkovou hladinou HSP90 (korelačný koeficient 0,8544) a korelácia membránovej hladiny eHSP90 s importom FITC-Geldanamycin do buniek (korelačný koeficient 0,8337). 
Diskusia
Charakterizácia a pochopenie mechanizmu expozície chaperonu HSP90 na membránu nádorových buniek má možný potenciál z terapeutického ako aj diagnostického hľadiska. Dôležitá úloha, ktorú extracelulárny HSP90 zohráva v invazivite a metastatických procesoch bola dobre doložená pozorovaniami jeho interakcií s membránovými proteínmi ako Her2 alebo Cdc37 a takisto znížením bunkovej migrácie po ovplyvnení anti-HSP90 protilátkami, či špecifickými nepermeabilnými derivátmi inhibítorov HSP90 [6,7]. Zatiaľ však nie je známe, či je transport HSP90 na membránu nádorových buniek riadený špecifickým mechanizmom, pričom poznatky zo súčasnej literatúry na túto tému sú často konfliktné. V tejto práci sme zistili, že hladina extracelulárneho HSP90 reflektuje jeho celkovú expresiu, čo indikuje skôr nešpecifický mechanizmus transportu HSP90 na bunkovú membránu. Na druhej strane výsledky posledných výskumov ukazujú, že fluorescenčne značené formy inhibítorov HSP90 nie sú pravdepodobne do buniek transportované pasívne, ale môžu byť selektívne internalizované vďaka väzbe na ektopicky lokalizovaný HSP90 [8]. Naše výsledky na modeli bunkových línií karcinómu prsníka poukázali na koreláciu medzi hladinou extracelulárneho HSP90 a internalizáciou FITC-Geldanamycinu, čo podporuje teóriu selektívnej internalizácie. Selektívna internalizácia inhibítorov HSP90 by mohla otvoriť nové pole možností v diagnostike, keďže značené inhibitory HSP90 môžu byť potenciálne využiteľné na vizualizáciu nádorových buniek in vivo, ale aj v terapii, kde by mohli slúžiť ako vektory pre iné terapeutiká a tak so súčasným zvýšením selektivity konvenčných chemoterapeutík znížiť ich možné vedľajšie účinky.
Záver
Naša analýza odhalila koreláciu medzi celkovou hladinou HSP90, jeho ektopickou expresiou na membráne nádorových buniek a takisto s importom inhibítora HSP90, FITC-Geldanamycin. Aj keď si možný mechanizmus internalizácie na membráne lokalizovaného HSP90 určite zasluhuje hlbšie skúmanie, výsledky tejto práce poukazujú na možný diagnostický potenciál jeho špecifických inhibítorov.
Práca bola podporená projektom MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Michal Pastorek, Ph.D.
RECAMO
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: michal.pastorel@mou.cz
Obdrženo: 13. 3. 2017
Přijato: 26. 3. 2017
Sources
1. Ferrarini M, Heltai S, Zocchi MR et al. Unusual expression and localization of heat-shock proteins in human tumor cells. Int J Cancer 1992; 51 (4): 613–619.
2. Ruckova E, Muller P, Nenutil R et al. Alterations of the Hsp70/Hsp90 chaperone and the HOP/CHIP co-chaperone system in cancer. Cell Mol Biol Lett 2012; 17 (3): 446–458. doi: 10.2478/s11658-012-0021-8.
3. Devarakonda CV, Kita D, Phoenix K et al. Patient-derived heavy chain antibody targets cell surface HSP90 on breast tumors. BMC Cancer 2015; 15 (1): 614. doi: 10.1186/s12885-015-1608-z.
4. Chiosis G, Neckers L. Tumor selectivity of Hsp90 inhibitors – the explanation remains elusive. ACS Chem Biol 2006; 1 (5): 279–284.
5. Kamal A, Boehm MF, Burrows FJ. Therapeutic and diagnostic implications of Hsp90 activation. Trends Mol Med 2004; 10 (6): 283–290.
6. Tsutsumi S, Scroggins B, Koga F et al. A small molecule cell-impermeant Hsp90 antagonist nhibits tumor cell motility and invasion. Oncogene 2008; 27 (17): 2478–2487.
7. Stellas D, El Hamidieh A, Patsavoudi E. Monoclonal antibody 4C5 prevents activation of MMP2 and MMP9 by disrupting their interaction with extracellular HSP90 and inhibits formation of metastatic breast cancer cell deposits. BMC Cell Biol 2010; 11 : 51. doi: 10.1186/1471-2121-11-51.
8. Barrott JJ, Hughes PF, Osada T et al. Optical and radioiodinated tethered Hsp90 inhibitors reveal selective internalization of ectopic Hsp90 in malignant breast tumor cells. Chem Biol 2013; 20 (9): 1187–1197. doi: 10.1016/j.chembiol.2013.08.004.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue Supplementum1-
All articles in this issue
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

