-
Medical journals
- Career
Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
Authors: J. Trnka 1,2; M. Špaček 3; V. Šírová 1,2; P. Mitáš 3; G. Hodková 3; J. Kubinyi 2; R. Špunda 3; J. Lindner 3
Authors‘ workplace: Oddělení radiační ochrany, VFN v Praze 1; Ústav nukleární medicíny, 1. LF UK a VFN v Praze 2; II. chirurgická klinika kardiovaskulární chirurgie 1. LF UK a VFN v Praze 3
Published in: Klin Onkol 2016; 29(5): 375-379
Category: Short Communication
doi: https://doi.org/10.14735/amko2016375Overview
Východiska:
Hypertermická izolovaná perfuze je metoda léčby končetin postižených neresekovatelnou malignitou. Spočívá v izolaci končetiny od systémového oběhu, zahřátí a následné perfuzi vysokou koncentrací cytostatika. U některých indikací je možné zvýšit účinnost terapie kombinací s tasonerminem (TNF-α). Při užití tasonerminu by případný nadlimitní únik perfuzátu do systémového oběhu mohl způsobit značné zdravotní komplikace. Proto je třeba zajistit spolehlivou metodu monitorování úniku perfuzátu.Metodika:
Princip monitorování spočívá v aplikaci radiofarmaka do systémového oběhu i do oběhu perfundované končetiny a detekce emitovaného záření scintilační sondou nad prekordiem. Nejprve je do systémového oběhu aplikováno malé množství radiofarmaka zajišťující bazální úroveň signálu. Poté je aplikováno řádově větší množství radiofarmaka do perfuzního oběhu. Případný únik perfuzátu se projeví zvýšením měřeného signálu. Matematicky lze snadno odvodit vztah mezi únikem perfuzátu a nárůstem měřeného signálu.Výsledky:
Metoda byla na našem pracovišti nejprve vyzkoušena a optimalizována v rámci izolované perfuze bez aplikace TNF-α. Následně byla získána akreditace pro použití TNF-α. Od té doby byla metoda použita u všech izolovaných perfuzí kombinovaných s TNF-α. Všechny aplikace s TNF-α proběhly bez komplikací. Radiační zátěž je zanedbatelná.Závěr:
Popsaná metoda zajišťuje spolehlivý postup sledování potenciálního průniku perfuzátu do systémového oběhu a stala se rutinní součástí výkonu hypertermické izolované perfuze končetin v kombinaci s TNF-α.Klíčová slova:
perfuze – izolovaná končetina – TNF-α – únik – monitorování – nukleární medicína – radiofarmakaÚvod
Hypertermická izolovaná perfuze (isolated limb perfusion – ILP) je klinicky zavedená metoda léčby končetin postižených neresekovatelným sarkomem měkkých tkání nebo melanomem u vybraných pacientů. Její princip spočívá v oddělení cévního systému končetiny od systémového oběhu, její připojení k přístroji pro mimotělní oběh, zahřátí na teplotu 39 °C, a následné perfuzi izolovaného kompartmentu končetiny mnohonásobně vyšší koncentrací cytostatika, než by bylo možné aplikovat celotělově v rámci systémové chemoterapie. Jako standardní cytostatikum se užívá melfalan, který se ukázal jako optimální na základě dlouholetých zkušeností s prováděním této metody. U senzitivních sarkomů měkkých tkání a v případě tzv. bulky disease u maligního melanomu je možné dále zvýšit účinnost terapie kombinací s tasonerminem (TNF-α). Při léčbě sarkomů měkkých tkání je kombinace hypertermie a melfalanu s tasonerminem základní podmínkou úspěchu. Nicméně samotné použití tasonerminu představuje nezanedbatelné riziko pro pacienta, jelikož případný nadlimitní únik perfuzátu do systémového oběhu by mohl způsobit značné zdravotní komplikace. Proto je třeba zajistit spolehlivou metodu monitorování úniku perfuzátu do systémového oběhu vč. kvalifikovaného odhadu jeho aktuálního množství a trendu během zbytku operace. Během chirurgické kanylace končetinových cév – tepny a žíly jsou hlavní kmeny uzavřeny po dobu perfuze svorkou, kolaterální oběh v měkkých tkáních je minimalizován použitím pneumatického turniketu nebo Esmarchových škrtidel. Peroperační monitoring úniku perfuzátu z izolovaného kompartmentu končetiny do systémového oběhu pacienta je základní podmínkou bezpečnosti prováděného výkonu.
Metodika
Monitorování úniku perfuzátu je prováděno metodami nukleární medicíny. Princip spočívá v aplikaci radiofarmaka na bázi 99mTc – značeného albuminu do systémového oběhu i do oběhu perfundované končetiny a detekci emitovaného záření γ pomocí kolimované scintilační sondy umístěné nad prekordium (obr. 1). Nejprve je do systémového oběhu aplikováno malé množství radiofarmaka zajišťujícího bazální úroveň signálu = měřené četnosti impulzů záření γ nad prekordiem. Poté je aplikováno řádově větší množství radiofarmaka do oběhu perfundované končetiny. Případný únik perfuzátu by se projevil zvýšením měřené četnosti impulzů nad prekordiem. Za předpokladu 10násobného poměru aktivit v perfundované končetině a v systémovém oběhu a zanedbatelného objemu perfuzátu vůči systému představuje 10% únik perfuzátu dvojnásobné zvýšení měřené četnosti impulzů.
Image 1. Mobilní stojan s kolimátorem pro pevné umístění scintilační sondy nad prekordium. 
Podrobný metodický postup je následující:
- Zapojení měřicí aparatury a nasměrování scintilační sondy nad prekordium.
- Měření celkového pozadí (1–2 min).
- Aplikace kontrolního množství aktivity radiofarmaka (5 MBq) do systémového oběhu.
- Čekání na homogenizaci radiofarmaka v krevním oběhu, a tedy na ustálení měřeného signálu (cca 5 min).
- Aplikace řádově vyšší aktivity radiofarmaka (50 MBq) do oběhu perfundované končetiny.
- Sledování měřeného signálu po dobu cca 10 min. Pokud se měřená četnost nezvyšuje, je možno pokračovat dalšími kroky.
- Aplikace tasonerminu.
- Aplikace melfalanu (po 10 min od intraarteriálního podání tasonerminu).
- Hypertermická ILP (60 min), po ce - lou dobu sledování měřeného signálu.
- Ukončení perfuze, proplach, úklid měřicí aparatury.
Z hlediska bezpečnosti pacienta je klíčový krok 6. Pokud by měřená četnost rostla, je to známka průniku perfuzátu do systémového oběhu a je třeba zajistit nápravu izolace končetiny. Jen tehdy, pokud je signál stabilní, je možno aplikovat tasonermin. Situaci může zkomplikovat rozptýlené záření z oběhu perfundované končetiny, které zpravidla ihned po aplikaci skokově zvýší úroveň četnosti impulzů nad prekordiem. Nicméně zvýšení by mělo být pouze jednorázové s rychlou stabilizací signálu. Ale i tak je nanejvýš vhodné směrovat sondu tak, aby kolimace co nejvíce toto rozptýlené záření odstínila.
Monitorování perfuze se provádí po celou dobu výkonu. Během procedury dochází zpravidla k mírnému úniku perfuzátu (1–3 % za hodinu), což je pod bezpečnou mezí, za kterou se považuje 10 %. Pokud by došlo ke zvýšení průběžného úniku s trendem přesahujícím 10 % za hodinu, je třeba, aby byl operatér připraven na předčasné ukončení výkonu.
Samotný signál scintilační sondy (obr. 2A) je zachycen a zpracován amplitudovým analyzátorem (obr. 2B), který poskytuje informaci ve veličině počet impulzů za jednotku času. Tato měřená četnost je přímo úměrná aktivitě radiofarmaka v prekordiu. Pro zajištění dostatečné statistiky a zároveň dostatečně rychlé odezvy se měření provádí v 30sekundových intervalech, tj. každá hodnota je získána na základě půlminutového měření, a tato měření na sebe těsně navazují. Pro větší pohodlí uživatele je možné data z analyzátoru softwarově zpracovat a průběžně vyhodnocovat, popř. vizualizovat (obr. 3).
Image 2. Scintilační sonda NaI(Tl) (A) a amplitudový analyzátor JKA 300 (B). 
Image 3. Snímek obrazovky počítačového programu pro on-line zpracování a vizualizaci signálu ze scintilační sondy a amplitudového analyzátoru. 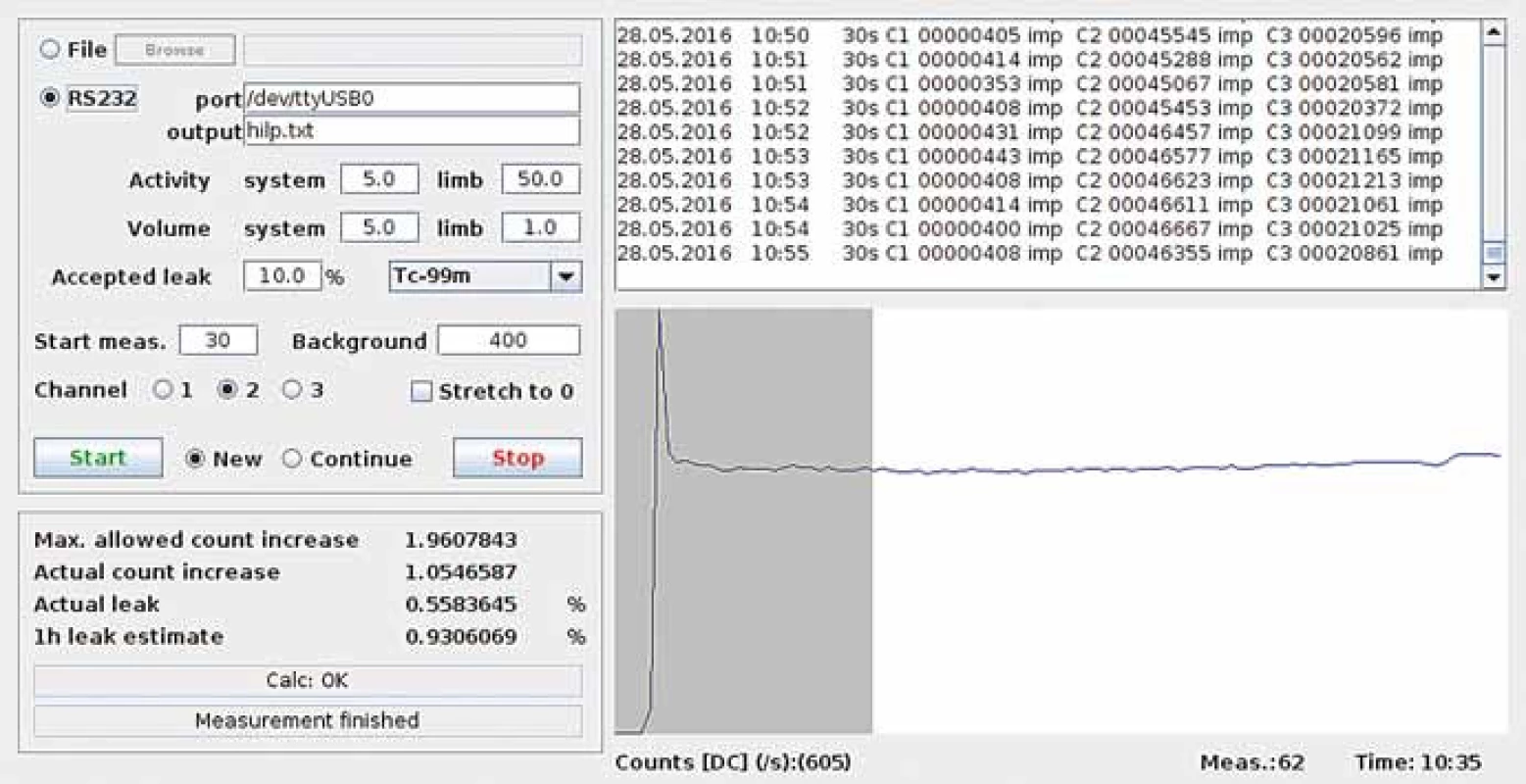
Výsledky
Popsaná metoda byla v roce 2011 na našem pracovišti nejprve vyzkoušena a optimalizována v rámci ILP pouze s použitím melfalanu. První aplikace s tasonerminem proběhla za účasti akreditační komise prof. dr. Angely Märten z německého Ingelheimu a prof. Georga Taegera z Essenu, na jejímž základě bylo pracoviště akreditováno pro použití TNF-α v rámci ILP. Od té doby byla metoda použita u všech ILP kombinovaných s tasonerminem.
Na obr. 4. je znázorněn typický průběh monitorovací křivky, v tomto případě bez komplikací. Po aplikaci kontrolního množství radiofarmaka do systémového oběhu dochází k prudkému nárůstu signálu s následným ustálením díky homogenizaci radiofarmaka v krvi. Po aplikaci radiofarmaka do perfuzního oběhu v tomto případě došlo k mírnému skokovému nárůstu signálu díky pronikání rozptýleného záření do scintilační sondy. V další fázi je již signál stabilní po celý zbytek výkonu.
Image 4. Typický průběh monitorovací křivky bez komplikací. 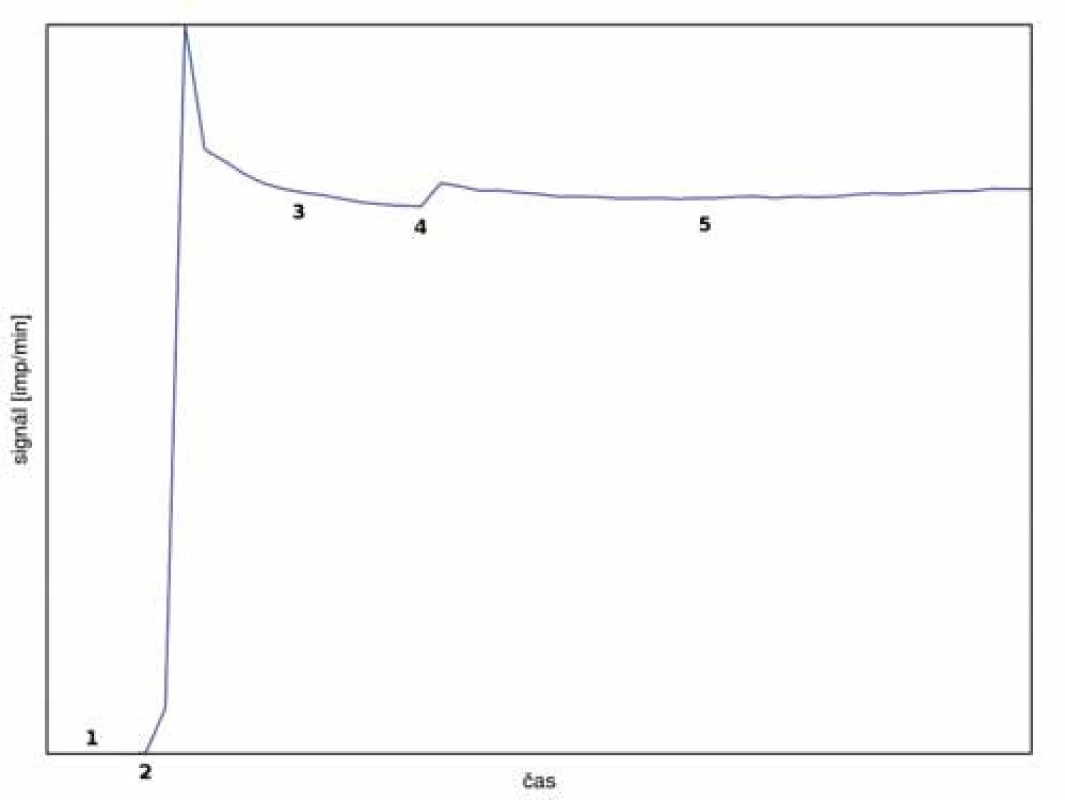
1 – měření pozadí, 2 – aplikace radiofarmaka do systémového oběhu, 3 – homogenizace aktivity v krvi – stabilizace signálu, 4 – aplikace radiofarmaka do perfuzního oběhu – možnost mírného skokového zvýšení signálu, 5 – perfuze při konstantním nebo nepatrně rostoucím signálu Naproti tomu obr. 5 představuje atypický průběh při vyšším úniku perfuzátu do systémového oběhu pacienta. Ihned po aplikaci radiofarmaka do perfuzního oběhu byl zaznamenán prudký nárůst signálu nad prekordiem indikující pronikání perfuzátu do systémového oběhu. Po nápravě izolace končetiny se signál stabilizoval a bylo možné přikročit k aplikaci cytostatika. I poté došlo k mírnému zvýšení signálu, ale po další kontrole kritické oblasti se již signál stabilizoval a zbytek výkonu proběhl bez komplikací. Celkový průnik perfuzátu byl odhadnut na max. 5 %, což by i v případě aplikace tasonerminu bylo akceptovatelné. Tato zkušenost pomohla zlepšit praxi samotné izolace končetiny a ověřila funkčnost a význam metody monitoringu během výkonu.
Image 5. Průběh monitorování s únikem perfuzátu. 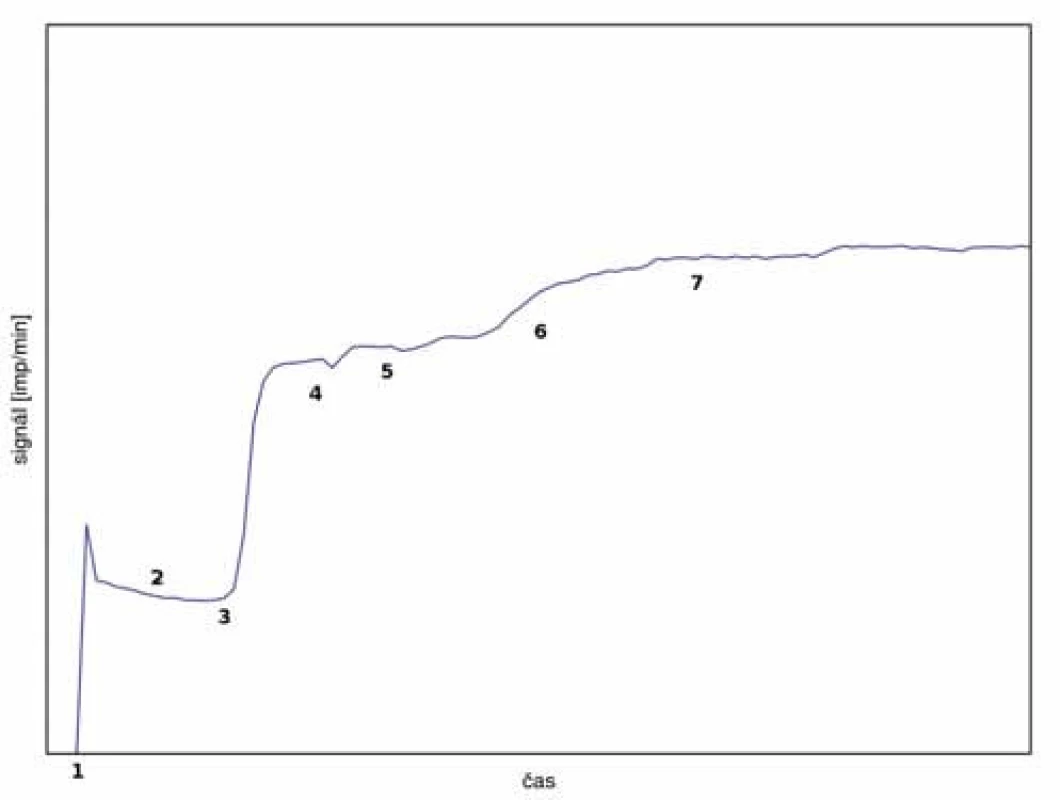
1 – aplikace radiofarmaka do systémového oběhu, 2 – homogenizace aktivity v krvi, 3 – aplikace radiofarmaka do perfuzního oběhu s následným výrazným únikem perfuzátu do systémového oběhu, 4 – náprava izolace končetiny, 5 – aplikace cytostatika, 6 – další mírný růst aktivity v prekordiu – kontrola izolace, 7 – stabilizace signálu a dokončení perfuze Ve všech případech s aplikací tasonerminu proběhla perfuze bez komplikací, jak je znázorněno na obr. 6.
Image 6. Vybrané křivky průběhu perfuze s použitím tasonerminu. 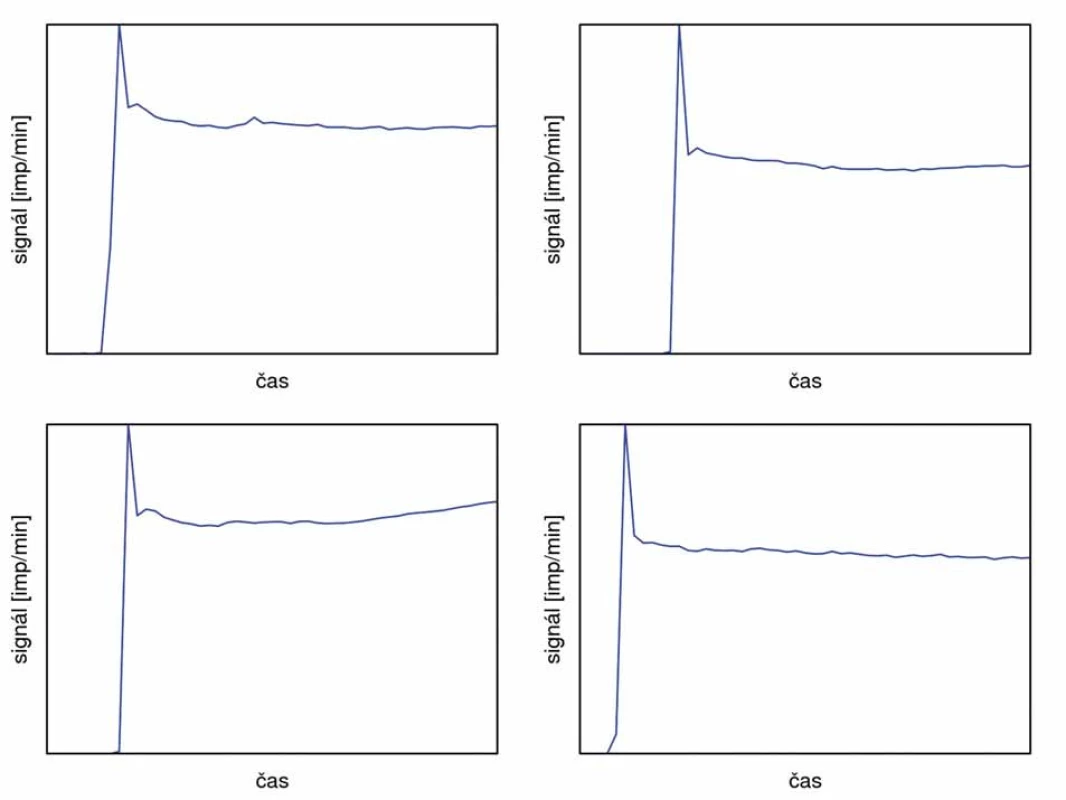
Všechny aplikace proběhly bez komplikací. Během perfuze může dojít k mírnému nárůstu aktivity v prekordiu indikujícímu nepatrný průnik perfuzátu do systémového oběhu (1–3 %). Radiační zátěž
99mTc je nejběžnější radionuklid používaný v nukleární medicíně. Emituje pouze záření γ o energii 140 keV a jeho poločas přeměny je 6 hod. Aplikace jednotek MBq do systému spolu s desítkami MBq do končetiny odpovídá těm nejméně zatěžujícím vyšetřením v nukleární medicíně. Vzhledem k typickému zdravotnímu stavu pacienta se jedná o naprosto zdůvodněné lékařské ozáření se zcela zanedbatelným rizikem.
Vzhledem k malé frekvenci výkonu se i z hlediska personálu jedná v podstatě o zanedbatelnou radiační zátěž. Pouze v případě obsluhy perfuzního okruhu je vhodné tuto funkci zajistit osobou, která byla řádně poučena a může vyloučit graviditu.
Odpad z perfuzního okruhu je vhodné před likvidací uskladnit alespoň na 48 hod, než klesne aktivita pod uvolňovací úroveň. Poté se likviduje jako běžný infekční materiál.
Závěr
Popsaná metoda zajišťuje spolehlivý postup sledování potenciálního průniku perfuzátu do systémového oběhu a stala se rutinní součástí výkonu hypertermické ILP končetin v kombinaci s tasonerminem. Peroperační monitoring úniku perfuzátu z izolovaného kompartmentu končetiny do systémového oběhu pacienta je základní podmínkou bezpečnosti prováděného výkonu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. Jiří Trnka, Ph.D.
Oddělení radiační ochrany VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jiri.trnka@vfn.cz
Obdrženo: 16. 6. 2016
Přijato: 21. 6. 2016
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 5-
All articles in this issue
- Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
- Exprese ABC transportérů Pgp, MRP1 a MRP3 u maligních a benigních změn vaječníků
- Kombinovaná léčba recidivujícího maligního schwannomu
- Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
- Glycin-N-metyltransferáza a nádorová onemocnění prostaty
- Prognostické a prediktivní faktory u adenokarcinomu pankreatu
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
- Sentinel Lymph Node in Thin and Thick Melanoma
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Kombinovaná léčba recidivujícího maligního schwannomu
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

