-
Medical journals
- Career
Prehľad vplyvu polymorfizmov receptora vitamínu D na vznik a progresiu malígneho melanómu
Authors: I. Špaková 1; M. Bilecová‑ rabajdová 1; M. Zábavníková 2; P. Urban 1; M. Mareková 1
Authors‘ workplace: Ústav lekárskej a klinickej biochémie LF UPJŠ a LABMED, a. s., Košice 1; Klinika plastickej, rekonštrukčnej a estetickej chirurgie LF UPJŠ a UN LP Košice 2
Published in: Klin Onkol 2014; 27(3): 173-177
Category: Review
Overview
Východiská:
Malígny melanóm patrí k najzhubnejším nádorovým ochoreniam zo všetkých nádorov kože mužov aj žien. Pravdepodobnosť vzniku malígneho melanómu závisí od vplyvu vonkajších faktorov a vzájomnej deregulácii interakcií genotypu a fenotypu. V súčasnosti sa čoraz väčšia pozornosť venuje štúdiu interakcií aktívnej formy vitamínu D3 s receptorom, ako aj inhibičnému účinku polymorfizmov receptoru vitamínu D3 na viaceré signálne dráhy zapojené do proliferačných a metastatických procesov.Ciele:
Táto prehľadová práca sa zameriava na popísanie vzťahu medzi faktormi, ktoré pôsobia na vznik maligného melanómu ovplyvnením Hedgehog signálnej dráhy (HH). Sumarizuje súčasné poznatky zaoberajúce sa malígnym melanómom v spojení s úlohou aktívnej formy vitamínu D3 pri väzbe na receptor vitamínu D3 (VDR) a vplyvu polymorfizmov VDR na inhibíciu HH. Pochopenie daných mechanizmov a kritické zhodnotenie poznatkov sú dôležité pre aplikáciu primárnej, ako aj sekundárnej prevencie, respektíve pri použití chemoprevenčných látok vhodných pre predchádzanie vzniku malígneho melanómu.Kľúčové slová:
vitamín D3 – Hedgehog signalizácia – melanóm – kalcitriol – rakovina kožeÚvod
Malígne tumory sú v súčasnosti jednou z hlavných príčin úmrtnosti vo svete, pričom onkologické ochorenia kože patria k najbežnejším typom rakoviny v ľudskej populácii [1]. Karcinómy kože môžeme rozdeliť na niekoľko typov podľa pôvodu nádoru, a to na bazocelulárny karcinóm (basal cell carcinoma – BCC), malígny melanóm (malignant melanoma – MM) a spinalióm. Malígny melanóm patrí k najzhubnejším nádorovým ochoreniam zo všetkých nádorov kože mužov aj žien a je zastúpený v 2 % zo všetkých kožných nádorov s potvrdenou 75 – 90% mortalitou [2,3]. Malígny melanóm sa najčastejšie vyskytuje na koži (až 95 % zo všetkých prípadov), ale môže byť klinicky manifestovaný v oku pacienta a v minoritných prípadoch môže byť lokalizovaný na vnútorných slizniciach (napr. sliznica rekta, ústna, vaginálna sliznica) [4 – 6].
Pravdepodobnosť vzniku MM závisí na vplyve vonkajších faktorov a vzájomnej deregulácii interakcií genotypu a fenotypu. Hlavným environmentálnym faktorom vzniku MM je expozícia ultrafialovému žiareniu (UV). Rozoznávame niekoľko typov UV v závislosti od vlnovej dĺžky. Žiarenie UVA, s vlnovou dĺžkou 315 – 400 nm, preniká do hlbokých vrstiev kože, poškodzuje DNA a urýchľuje jej starnutie. Najviac interaguje s melanocytmi, indukuje tvorbu melanínu, stimuluje fotosenzibilné a fototoxické reakcie. Množstvo žiarenia UVA je v priebehu dňa konštantné. Žiarenie UVB s vlnovou dĺžkou 280 – 315 nm, tvorí cca 10 % z celkového slnečného UV žiarenia. Je absorbované pokožkou a pôsobí priamo na DNA, no vo väčšej miere škodí nepriamo, oxidačným stresom cez kyslíkové radikály [5]. Celkový účinok absorbovaného UVA a UVB je kumulatívny [5]. Kombinácia genetickej predispozície, kožného fenotypu a následnej expozície kože tak prirodzenému, ako aj umelému UV žiareniu, je hlavnou príčinou vzniku melanómu [6].
Slnečné žiarenie UVB nielen stimuluje karcinogenézu cez mutagenézu a imunosupresiu, ale tiež zvyšuje hladinu kožného vitamínu D3, ktorý následne blokuje Hedgehog signálnu dráhu (HH) a pravdepodobne inhibuje proliferáciu rakovinových buniek melanocytov. Tento mechanizmus by mohol viesť aspoň k čiastočnému objasneniu priameho vzťahu medzi vystavením sa slnečnému žiareniu a rizikom vzniku MM.
Genetické faktory podmieňujú pozitívnu rodinnú anamnézu, fototyp, hustotu a atypickosť kože, a patria k veľmi významným rizikovým faktorom vývoja melanómu. Konkrétnym genetickým abnormalitám (mutácie DNA opravných génov, polymorfizmy receptora vitamínu D) sa v súčasnosti venuje veľká pozornosť pri skúmaní príčinných súvislostí vzniku MM.
Dôležitú úlohu, pri odhaľovaní malígneho melanómu, dynamiky ochorenia, kontroly účinnosti liečby, respektíve perzistencie či recidívy, zohráva v klinickej praxi predovšetkým včasná diagnostika. Skvalitnenie diagnostiky je nevyhnutné pri pochopení súvislostí medzi faktormi, ktoré pôsobia na vznik MM ovplyvnením Hedgehog signálnej dráhy, a preto sa zameriavame na prehľad súčasných poznatkov zaoberajúcich sa MM v spojení s úlohou aktívnej formy vitamínu D3 pri väzbe na receptor vitamínu D3 (VDR) a vplyvu polymorfizmov VDR na inhibíciu HH. Pochopenie a kritické zhodnotenie poznatkov sú dôležité pre aplikáciu tak primárnej, ako aj sekundárnej prevencie, respektíve pri použití chemoprevenčných látok (napr. vitamín D, C, E, betakaroténu) vhodných pre predchádzanie vzniku MM.
Vitamín D3 a väzba na VDR
Vitamín D, tzv. slnečný vitamín, je dobre známy svojou rozpustnosťou v tukoch. Má pleiotropický efekt na metabolizmus vápnika, fosforu, reguluje bunkový cyklus a apoptózu, stimuluje diferenciáciu rakovinových buniek v tumorových tkanivách, stimuluje angiogenézu, imunomoduláciu, má chemopreventívny účinok a podieľa sa na antibakteriálnej aktivite [7]. V posledných rokoch sa zdôrazňuje jeho vplyv na imunitný systém. Je preukázané, že zvyšuje aktivitu natural killer (NK) buniek, fagocytárnu schopnosť makrofágov a znižuje riziko vzniku viróz. Tieto vlastnosti vitamínu D sú ovplyvňované fotosenzibilitou kože, hladinou 1α,25(OH)2D3 v sére, ako aj funkciou signifikantných polymorfizmov na VDR géne [8].
Aktívna forma vitamínu D (1α,25(OH)2D3, kalcitriol) sa viaže na VDR, ktorý je lokalizovaný v jadre buniek (obr. 1).
Image 1. Porovnanie štruktúry neaktívnej (cholekalciferol) a aktívnej formy vitamínu D<sub>3</sub> (kalcitriol). 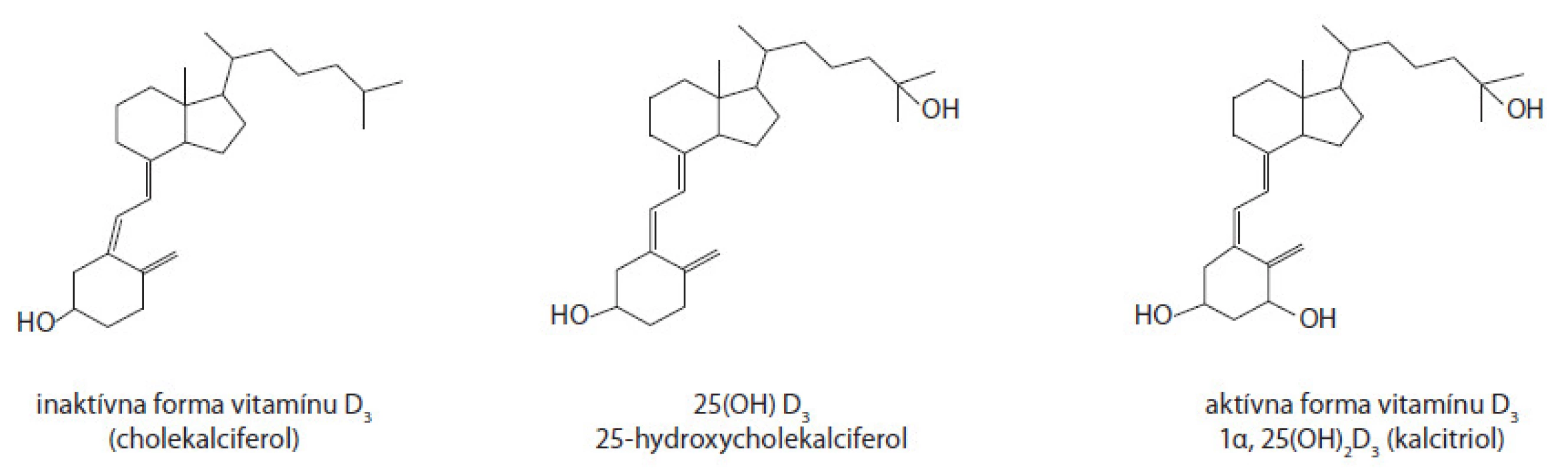
Okrem kostí bol tento receptor potvrdený vo väčšine orgánov (napr. koža, mozog, srdce, obličky, prištítne telieska, tenké a hrubé črevo, NK bunky), čo poukazuje na široké spektrum využitia s cieľom na ovplyvnenia veľkého množstva analytov tak za fyziologických, ako aj patologických stavov organizmu.
Naviazanie vitamínu D3 na VDR vyúsťuje do transkripcie génov, ktoré zohrávajú dôležitú úlohu v inhibícii mitogénom aktivovanej proteín kinázovej (MAPK) signalizácie. Aktivácia MAPK signalizácie indukuje disociáciu extracelulárnym signálom indukovaných kináz 1 a 2(extracellular ‑ signal ‑ regulated kinases – ERK1/ 2) z kinázového komplexu, ktorý následne reguluje expresiu viacerých génov zapojených do bunkovej proliferácie, diferenciácie a prežívania, a to buď priamo, fosforyláciou nukleárnych transkripčných faktorov napr. ELK ‑ 1, MYC [9], alebo nepriamo ovplyvnením intracelulárnych signálnych molekúl napr.p90 - RSK [10]. MAPK tiež ovplyvňuje posttranslačnú fosforyláciu apoptotických regulačných molekúl, napr. BAD, BIM, MCL ‑ 1 a BCL ‑ 2 [11].
Bolo identifikované množstvo VDR polymorfných úsekov v DNA, ktoré sa priamo alebo nepriamo podieľajú na imunodeficientných ochoreniach úzko súvisiacich s hladinou vitamínu D. Vzájomný vzťah VDR polymorfizmov s rakovinou kože je popísaný v súvislosti nielen s iniciáciou karcinogenézy, ale aj ovplyvnením invazivity melanómovej malignity, a tým celej prognózy ochorenia.
Gén pre VDR pozostáva z vyše 1 000 polymérnych častí lokalizovaných na chromozóme 12q12 - 14 [12]. VDR gén zahŕňa dva regióny promótorov, osem proteín kódujúcich exónov (2 – 9) a šesť nepreložených exónov (1a – 1f) [12]. Takto rozsiahly promótorový región má schopnosť generovať mnohopočetné tkanivovo ‑ špecifické transkripty, pričom niektoré z nich majú vplyv aj na vznik melanómov. Najviac preštudované fragmenty polymorfizmov o rozdielnych dĺžkach sú rs10735810 (T > A nukleotidová zámena v FokI reštrikčnom mieste), rs1544410 (G > A v BsmI) a rs731236 (T > C v TaqI). Napríklad výskyt alely rs10735810 A (FokI alela) a rs1544410 A alely (BsmI alela) zvyšuje riziko vzniku malígneho melanómu, zatiaľ čo alela rs731236 C (TaqI alela) bola identifikovaná ako predispozícia zníženého výskytu MM. Alela A rs4516035 (A > G výmena v EcoRV reštrikčnom mieste) je prezentovaná ako alela zvýšeného melanómového rizika. Na druhej strane, nebolo pozorované žiadne prepojenie medzi dĺžkou reštrikčného fragmentu polymorfizmu rs7975232 (G > T zámena v ApaI reštrikčnom mieste), podobne ako rs11568820 (G > A výmena v Cdx2 väzbovom mieste) a rizikom vzniku MM [7].
Prepojená nerovnováha medzi niektorými z VDR polymorfizmov a zvýšeným rizikom vzniku melanómov bola popísaná pre polymorfizmy vitamínu D – TaqI, FokI a BsmI. Reštrikčná oblasť TaqI je silne prepojená s nerovnováhou poly(A) polymorfizmu [7]. Halsall et al [13] identifikovali kombinovaný efekt melanómového rizika A alely v EcoRV (A ‑ 1012G) polymorfizme s alelou vo FokI polymorfizme. Podobne progresia melanómu by mohla byť klasifikovaná detekciou v signalizácií vitamínu D, založenej na znížení expresie VDR [14]. Analýza expresie VDR a polymorfizmov, môže poskytnúť veľmi potrebné informácie ešte pred terapeutickou intervenciou melanómov vitamínom D a jeho analógmi, čím by prispela aj k predikcii a následnému zlepšeniu prognózy ochorenia.
Vzájomná asociácia polymorfizmov receptora aktívnej formy vitamínu D3 (VDR) so vznikom, respektíve stimuláciou vzniku melanómov, nie je v dnešnej dobe popísaná. Veľmi málo opublikovaných vedeckých prác popisuje, že samotný receptor vitamínu D3 bez 1α,25(OH)2D3 ligandu môže mať rovnaký stimulačný účinok na karcinogenézu. VDR bez 1α,25(OH)2D3 ligandu pôsobí cez WNT signalizáciu (wingless‑type signaling pathway), ktorá má dôležitú funkciu v HH signalizačnej dráhe melanocytov [15]. Opačnú úlohu zastáva ligandom 1α,25(OH)2D3 aktivovaný vysokoexprimovaný VDR, na ktorý sa v rakovinových bunkách viaže kalcitriol (aktívny vitamín D3) a tým aktivuje anti‑tumorovú signalizačnú dráhu s dokázanými anti‑proliferatívnymi účinkami na rakovinové bunky [16,17].
Molekulový mechanizmus aktivácie VDR
Hormonálne aktívna forma vitamínu D3 je pomocou vitamín D viažuceho proteínu (DBP) transportovaná do cieľových tkanív s príslušným receptorom. VDR je hlavná štrukturálna doména nukleárneho receptoru s vysoko zachovaným DNA väzbovým regiónom a ligand ‑ väzbovou doménou. Vzniknutá väzba indukuje heterodimerizáciu VDR a retinoidného X receptoru (RXR), čím vplýva na spustenie kaskády, ktorá vedie k zmenám v expresii génov pozostávajúcich z vitamín D citlivých elementov v ich promótore (VDREs).
VDR patrí do superrodiny transaktivačných transkripčných regulačných faktorov, ktoré zahŕňajú steroidné a tyroidné hormonálne receptory. Aktívna forma vitamínu D po väzbe na VDR aktivuje cieľovú génovú expresiu počas transkripcie [18,19]. VDR po aktivácii vytvára viaceré formy homodimérov alebo heterodimérov s jedným z troch retinoidných X receptorov (RXR) – RXRα, RXRβ, RXRγ. Súčasne vzniká VDR homodimérna alebo VDR ‑ RXR heterodimérna väzba (obr. 2) na špecifické zosilňovače expresie, nazývané vitamín ‑ D ‑ citlivé elementy (vitamin D response elements – VDREs).
Image 2. Vplyv VDR receptoru na orgánové systémy. 
Ligandom indukovaná transaktivácia pomocou VDR je nevyhnutná pre formovanie iniciačného transkripčného komplexu s RNApolymerázou II [20]. Kalcitriol tak priamo alebo nepriamo reguluje vyše 200 génov bunkovo ‑ a tkanivovo ‑ špecifickým spôsobom. V súčasnosti sa čoraz väčšia pozornosť venuje štúdiu interakcii aktívnej formy vitamínu D3 s VDR a ich inhibičný vplyv na Hedgehog signálnu dráhu.
Vplyv kalcitriolu na Hedgehog signálnu dráhu
Táto signálna dráha sa podieľa na vzniku a manifestácii niekoľkých typov ľudských tumorov, vrátane karcinómu bazálnych buniek a MM. Z počiatku bola identifikovaná ako základná iniciačná dráha vo vývoji buniek, ale v poslednej dobe je viac vnímaná ako potenciálne zaujímavý stimulátor karcinogenézy. K narušeniu HH signalizácie dochádza v dôsledku mutácií génov kódujúcich komponenty signalizačnej dráhy, alebo zvýšenou produkciou ligandov v tumoroch, ale aj v bunkách väzivového tkaniva [21 – 23].
Bjilsma et al [24] popisujú novú biologickú funkciu kalcitriolu v potláčaní HH signalizácii v in vitro modelovom systéme. Kalcitriol blokuje proliferáciu a HH signalizáciu cez inkorporáciu do mRNA expresiou génu GLI1. Efekt vitamínu D3 na GLI1 expresiu a na bunkovú proliferáciu je porovnateľný s efektom cyklopamínu, ktorý je známym inhibítorom HH dráhy. Tento účinok je špecifický pre aktívnu formu vitamínu D3, pretože jeho prekurzor, cholekalciferol a jeho produkt 25 - hydroxycholekalciferol sú podstatne menej efektívne v inhibícii produkcie mRNA pre GLI1 a tým znižovaní bunkovej proliferácie. V súčasnosti sú terapeutické aplikácie vitamínu D na MM závislé na expresii GLI1 a Ki67.
Najviac študovaným mechanizmom efektov vitamínu D3 je 1α,25(OH)2D3 (kalcitriolom) - indukovaná transkripčná aktivácia VDR, následkom ktorej dochádza k zmenám v bunkovom správaní, ktoré je založené na stimulácií diferenciácie a redukcii proliferácie kožných keratinocytov [25,26]. Bijlsma et al [24] dokázali špecifický spôsob viazania sa kalcitriolu do oblasti SMO (smoothened homolog) v dôsledku čoho nastáva inhibícia expresie GLI [27]. Bijlsma et al [24] taktiež identifikovali anti‑HH efekt kalcitriolu, ktorý je nezávislý na VDR a navrhli nehydroxylovaný vitamín D3 ako možné terapeutikum na inhibíciu karcinogenézy.
Záver
Farmakologické využitie kalcitriolu môže nájsť využitie ako blokátor proliferácie rakovinových buniek in vitro a proliferácie tumorov in vivo. U kalcitriolu a jeho analógov bol popísaný prevenčný a inhibičný účinok na onkologické ochorenia. Aktívna forma vitamínu D3 je jedným z najužitočnejších nástrojov, ktoré máme k dispozícii pre zlepšenie celkového zdravotného stavu, keďže ovplyvňuje vitalitu organizmu v mnohých smeroch. Je nutné mať na zreteli, že príliš vysoká hladina kalcitriolu môže mať aj negatívne účinky so sprievodnou patológiou vzhľadom na vzniknutú hyperkalciémiu a hyperkalciúriu, ktoré tak ohraničujú farmakologické využitie kalcitriolu ako terapeutického prostriedku v limitnej forme.
Táto práca bola podporená grantom DIAGONKO ITMS: 26220220153.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Peter Urban, Ph.D.
Ústav lekárskej a klinickej biochémie LF UPJŠ a LABMED, a. s.Trieda SNP 1
040 01 Košice
e-mail: peter.urban@upjs.sk
Obdrženo: 21. 12. 2013
Přijato: 25. 2. 2014
Sources
1. Grimaldi AM, Cassidy PB, Leachmann S et al. Novel approaches in melanoma prevention and therapy. Cancer Treat Res 2014; 159 : 443 – 455. doi: 10.1007/ 978 - 3 - 642 - 38007 - 5_25.
2. Kappelmann M, Bosserhoff A, Kuphal S. AP ‑ 1/ c ‑ Jun transcription factors: regulation and function in malignant melanoma. Eur J Cell Biol 2014; 93(1 – 2): 76 – 81. doi: 10.1016/ j.ejcb.2013.10.003.
3. Bosserhoff A (ed.). Melanoma development molecular biology, genetics and clinical application. Springer 2011 : 376.
4. Havránková M. Záchyt dermatologických malignít v ambulancií praktického lekára. Via pract 2007; 4(5): 244 – 246.
5. Krajsová I. Melanom. In: Krajsová I (ed.). Melanom. Maxdorf 2006.
6. Polsky D, Cordon ‑ Cardo C, Houghton A. 19. Molecular biology of melanoma in the molecular basis of cancer. 2nd ed. Mendensol J et al. Elsevier Inc 2001.
7. Szyszka P, Zmijewski MA, Slominski AT. New vitamin D analogs as potential therapeutics in melanoma. Expert Review of Anticancer Theraphy 2012; 12(12): 585 – 599. doi: 10.1586/ era.12.40.
8. Gandini S, Raimondi S, Gnagnarella P et al. Vitamin D and skin cancer: a meta‑analysis. Eur J Cancer 2009; 45(4): 634 – 641. doi: 10.1016/ j.ejca.2008.10.003.
9. Madhunapantula SV, Robertson GP. Is B ‑ Raf a good therapeutic target for melanoma and other malignancies? Cancer Res 2008; 68(1): 5 – 8. doi: 10. 1158/ 0008 - 5472.CAN ‑ 07-2038.
10. Gollob JA, Wilhelm S, Carter C et al. Role of Raf kinase in cancer: therapeutic potential of targeting the Raf/ MEK/ ERK signal transduction pathway. Semin Oncol 2006; 33(4): 392 – 406.
11. Russo AE, Torrisi E, Bevelacqua Y et al. Melanoma: molecular pathogenesis and emerging target therapies (review). Int J Oncol 2009; 34(6): 1481 – 1489.
12. Baker AR, McDonnell DP, Hughes M et al. Cloning the expression of full ‑ length cDNA encoding human vitamin D receptor. Proc Nat Acad Sci USA 1988; 85(10): 3294 – 3298.
13. Halsall JA, Osborne JE, Potter L et al. A novel polymorphism in the 1A promoter region of the vitamin D receptor is associated with altered susceptibilty and prognosis in malignant melanoma. Br J Cancer 2004; 91(4): 765 – 770.
14. Essa S, Denzer N, Mahlknecht U et al. VDR microRNA expression and epigenetic silencing of vitamin D signaling in melanoma cells. J Steroid Biochem Mol Biol 2010; 121(1 – 2): 110 – 113. doi: 10.1016/ j.jsbmb.2010.02.003.
15. Palmer HG, Anjos ‑ Afonso F, Carmeliet G et al. The vitamin D receptor is a wnt effector that controls hair follicle differentiation and specifies tumor type in adult epidermis. PLoS One 2008; 3(1): 1483. doi: 10.1371/ journal.pone.0001483.
16. Ishibashi M, Arai M, Tanaka S et al. Antiproliferative and apoptosis ‑ inducing effects of lipophilic vitamins on human melanoma A375 cells in vitro. Biol Pharm Bull 2012; 35(1): 10 – 17.
17. Essa S, Reichrath S, Mahlknecht U et al. Signature of VDR miRNAs and epigenetic modulation of vitamin D signaling in melanoma cell lines. Anticancer Res 2012; 32(1): 383 – 389.
18. Haussler MR, Whitfield GK, Haussle CA et al. The nuclear vitamin D receptor: biological and molecular regulatory properties revealed. J Bone Miner Res 1998; 13(3): 325 – 349.
19. Darwish H, DeLuca HF. Vitamin D ‑ regulated gene expression. Crit Rev Eukaryot Gene Expr 1993; 3(2): 89 – 116.
20. Freedman LP. Increasing the complexity of coactivation in nuclear receptor signalin. Cell 1999; 97(1): 5 – 8.
21. Nolan ‑ Stevaux O, Lau J, Morgan L et al. GLI1 is regulated through Smoothened independent mechanisms in neoplastic pancreatic ducts and mediates PDAC cell survival and transformation. Genes Dev 2009; 23(1): 24 – 36. doi: 10.1101/ gad.1753809.
22. Wang Y, McMahon AP, Allen BL. Shifting paradigms in Hedgehog signaling. Curr Opin Cell Biol 2007; 19(2): 159 – 165.
23. So PL, Fujimoto MA, Epstein EH Jr. Pharmacologic retinoid signaling and physiologic retinoic acid receptor signaling inhibit basal cell carcinoma tumorigenesis. Mol Cancer Ther 2008; 7(5): 1275 – 1284. doi: 10.1158/ 1535 - 7163.MCT ‑ 07 - 2043.
24. Bijlsma MF, Spek CA, Zivkovic D et al. Repression of smoothened by patched ‑ dependent (pro‑)vitamin D3 secretion. Plos Biol 2006; 4(8): e232.
25. Bikle DD. Vitamin D receptor, UVR, and skin cancer: a potential protective mechanism. J Invest Dermatol 2008; 128(10): 2357 – 2361. doi: 10.1038/ jid.2008.249.
26. Holick MF. Calcium plus vitamin D and the risk of colorectal cancer. N Engl J Med 2006; 354(21): 2287 – 2288.
27. Tang JY, Xiao TZ, Oda Y et al. Vitamin D3 inhibits hedgehog signaling and proliferation in basal cell carcinomas. Cancer Prev Res (Phila) 2011; 4(5): 744 – 751. doi: 10.1158/ 1940 - 6207.CAPR ‑ 10 - 0285.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 3-
All articles in this issue
- Velmi pozdní následky radioterapie – limitující faktor současných radioterapeutických technik
- Neoadjuvantní chemoradioterapie karcinomu rekta v kombinaci s inhibitory receptoru pro růstový epidermální faktor
- Prehľad vplyvu polymorfizmov receptora vitamínu D na vznik a progresiu malígneho melanómu
- Molekulárně cytogenetická analýza chromozomových aberací v buňkách nízkostupňových gliomů a její přínos pro klasifikaci nádoru
- Analýza nákladů na radioterapii v lůžkové péči – hledání vhodných prediktorů pro potřeby nového prospektivního úhradového modelu
- Invertovaný papilóm a jeho zriedkavé formy
- Kazuistika pacienta se značně pokročilým a diseminovaným karcinomem žaludku léčeným preparátem S-1
- Nádorová onemocnění ve starším věku
- Analýza celkového přežití a celkového bezpříznakového přežití u pacientek s luminálním karcinomem A v závislosti na TNM stadiu
- Role bevacizumabu ve druhé linii léčby glioblastomu – zmařené naděje?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Velmi pozdní následky radioterapie – limitující faktor současných radioterapeutických technik
- Invertovaný papilóm a jeho zriedkavé formy
- Nádorová onemocnění ve starším věku
- Role bevacizumabu ve druhé linii léčby glioblastomu – zmařené naděje?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

