-
Medical journals
- Career
Nádorová onemocnění ve starším věku
: J. Petera 1; L. Dušek 2
: Klinika onkologie a radioterapie LF UK a FN Hradec Králové 1; Institut biostatistiky a analýz, LF a PřF MU, Brno 2
: Klin Onkol 2014; 27(3): 210-218
: Short Communication
Východiska:
Stárnutí populace a zvyšující se incidence zhoubných nádorů ve vyšších věkových kategoriích se stává aktuálním problémem onkologie v rozvinutých zemích.Cíl:
Cílem sdělení je podat přehled o současném přístupu k onkologickým pacientům vyšších věkových kategorií a o možnostech jeho zlepšení. Starší onkologičtí pacienti jsou obecně podléčeni v porovnání s léčebnými standardy. Starší populace je heterogenní ve smyslu funkčního stavu, tělesného a psychického postižení, komorbidit, fyzických rezerv, socioekonomických podmínek a geriatrických symptomů. Neexistují standardní léčebná doporučení pro starší populaci v důsledku jejího nedostatečného zastoupení v klinických studiích. Vodítkem pro léčebná rozhodnutí a stanovení komplexního plánu péče mají být geriatrická hodnocení, která umožňují rozdělit pacienty na schopné podstoupit standardní léčbu, vyžadující adaptovanou léčbu nebo indikované k paliativnímu přístupu. Chybí však studie potvrzující přínos tohoto postupu v porovnání s rutinní onkologickou praxí.Závěr:
Je urgentně zapotřebí klinických studií zaměřených na onkologické pacienty vyšších věkových kategorií.Klíčová slova:
stáří – nádory – léčba – geriatrické hodnoceníVýchodiska
Populace v rozvinutých zemích se dožívá vyššího věku a podíl vyšších věkových kategorií v populační struktuře narůstá. Nádorová onemocnění u seniorů mají svá specifika a jejich narůstající incidence ve stárnoucí populaci se stává v onkologii aktuální výzvou.
Cíl
Cílem sdělení je podat přehled o současném postoji k onkologickým pacientům vyšších věkových kategorií a o možnostech, jak systematicky přistupovat k jejich léčbě.
V České republice tvořili obyvatelé ve věku nad 70 let 7 % populace v roce 1970,10 % v roce 2009 a očekává se, že v roce 2030 to bude 25 % [1]. Toto zastoupení je srovnatelné s jinými evropskými zeměmi a s USA. V USA se předpokládá, že v roce 2030 budou senioři tvořit 20 % populace [2]. S věkem se dramaticky zvyšuje incidence zhoubných nádorů. Zvyšující se riziko nádorů ve stárnoucí populaci je převážně důsledkem dvou procesů – narůstajícího poškození DNA a progresivního snižování obranyschopnosti stárnoucího organizmu. Poškození DNA je důsledkem kumulativní expozice kancerogenům a kumulativního efektu endogenních procesů, které vedou k tvorbě reaktivních kyslíkových radikálů poškozujících buněčné struktury. Buňky s poškozenou DNA zanikají procesem senescence nebo apoptózy, nicméně poškození kritických genů může způsobit maligní zvrat. Aktivace onkogenů stimuluje nádorový růst, naproti tomu deaktivace tumor supresorových genů umožňuje nekontrolované buněčné dělení. Vyšší věk je spojen s poklesem kapacity mechanizmů zodpovědných za reparaci poškození DNA a imunitní odpovědi na přítomnost nádorových buněk. Poškození mitochondriální DNA má za následek sníženou schopnost apoptózy, což umožňuje perzistenci buněk s poškozenou DNA a maligním potenciálem.
Stárnutí populace vede nevyhnutelně k vzrůstajícímu počtu osob postižených zhoubným nádorem. Grafy na obr. 1 prezentují výskyt nejčastějších nádorů v závislosti na věku v České republice v období mezi lety 2004 – 2008. Riziko těchto onemocnění je nejvyšší u osob starších 65 let. Grafy na obr. 2 ukazují hrubou incidenci nádorů u osob nad 70 let v České republice v uplynulých dekádách. V České republice se 33 – 60 % nových nádorů diagnostikuje u pacientů ve věku nad 70 let a tato populace se ještě vyšší měrou podílí na mortalitě na nádorová onemocnění [3]. V USA se 50 % nádorových onemocnění vyskytuje u lidí nad 65 let věku a předpověď pro rok 2030 je 70 %. Mortalita u starší populace je vyšší a je zodpovědná za 70 % úmrtí na nádory ročně. Nejčastější nádory u seniorů jsou karcinom plic, tlustého střeva a rekta, prostaty, prsu, močového měchýře a pankreatu.
1. Věkově specifická incidence, 10leté věkové kategorie, období 2004–2008. 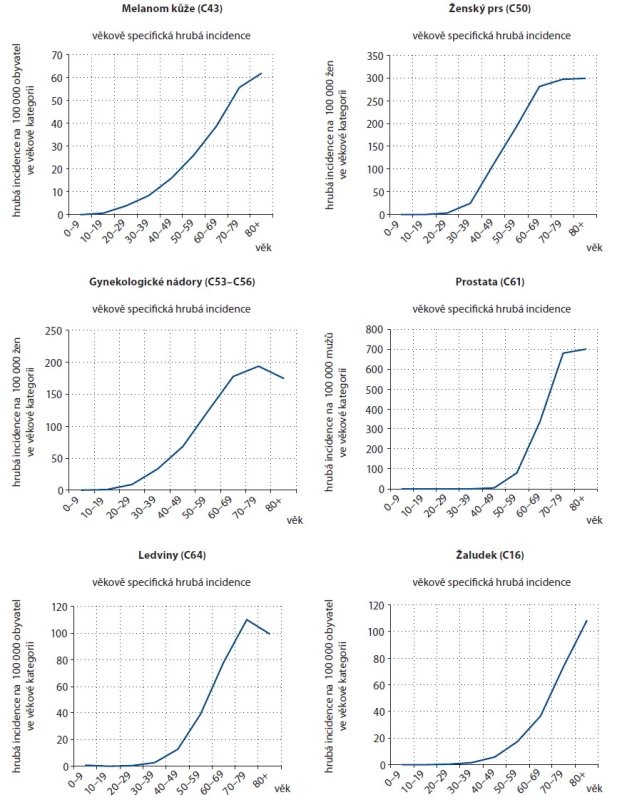
2. Hrubá incidence nejčastějších nádorů u osob nad 70 let v České republice. 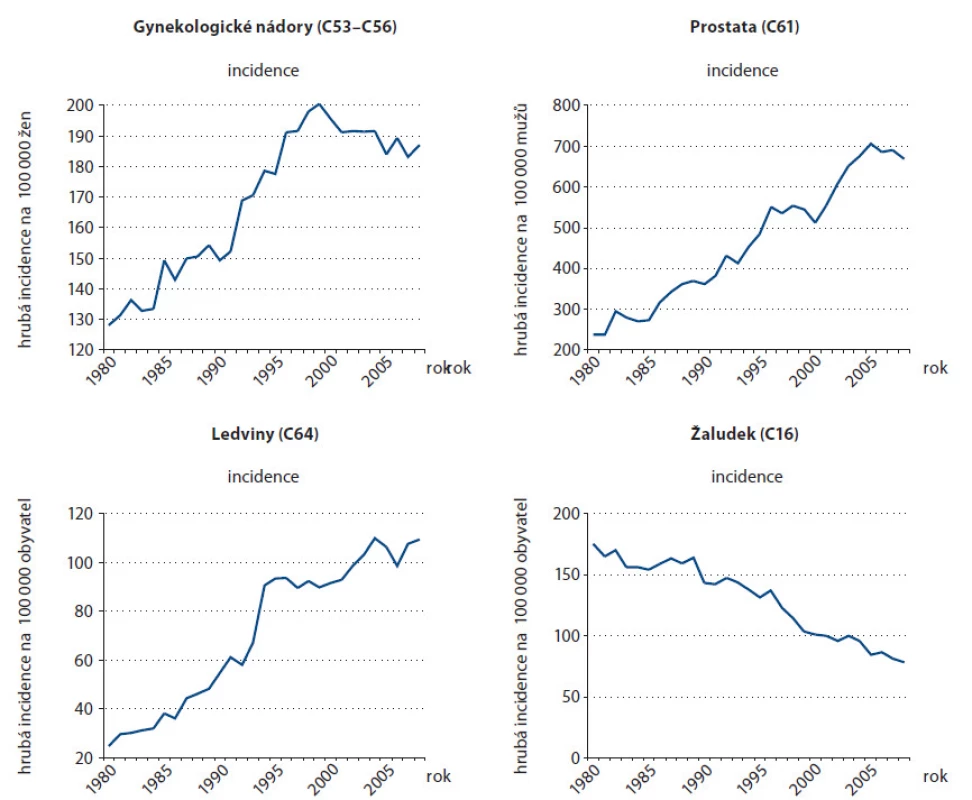
S pokroky v léčbě a delším přežitím pacientů roste rovněž počet sekundárních a terciárních malignit (obr. 3). Stadia nádorových onemocnění u pacientů starších 70 let jsou prezentována na obr. 4. Diagnózy jsou řazeny podle podílu stadia I a II.
3. Výskyt kolorektálního karcinomu jako duplicitního primárního nádoru. 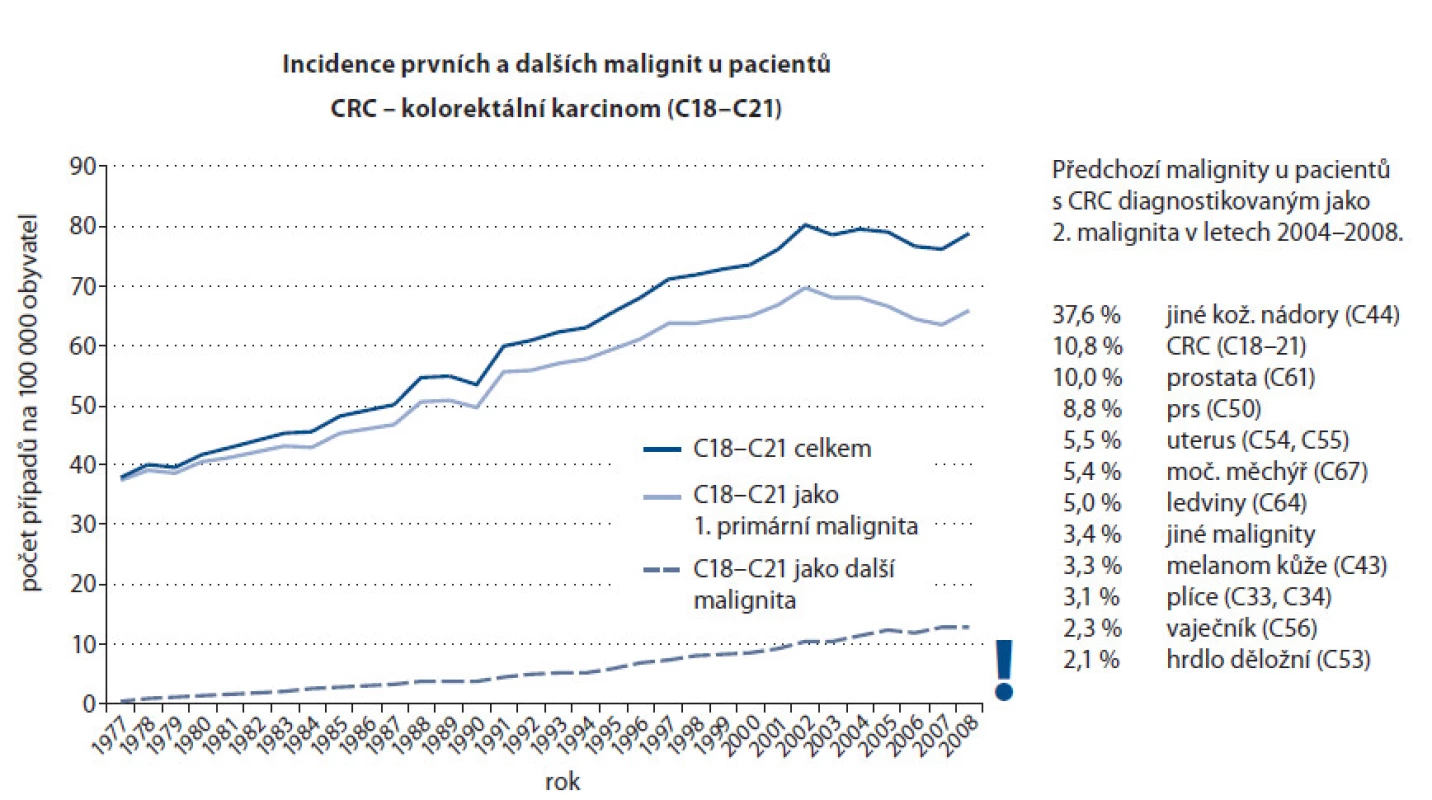
4. Stadia nádorových onemocnění u pacientů starších 70 let v České republice v letech 2004–2008. 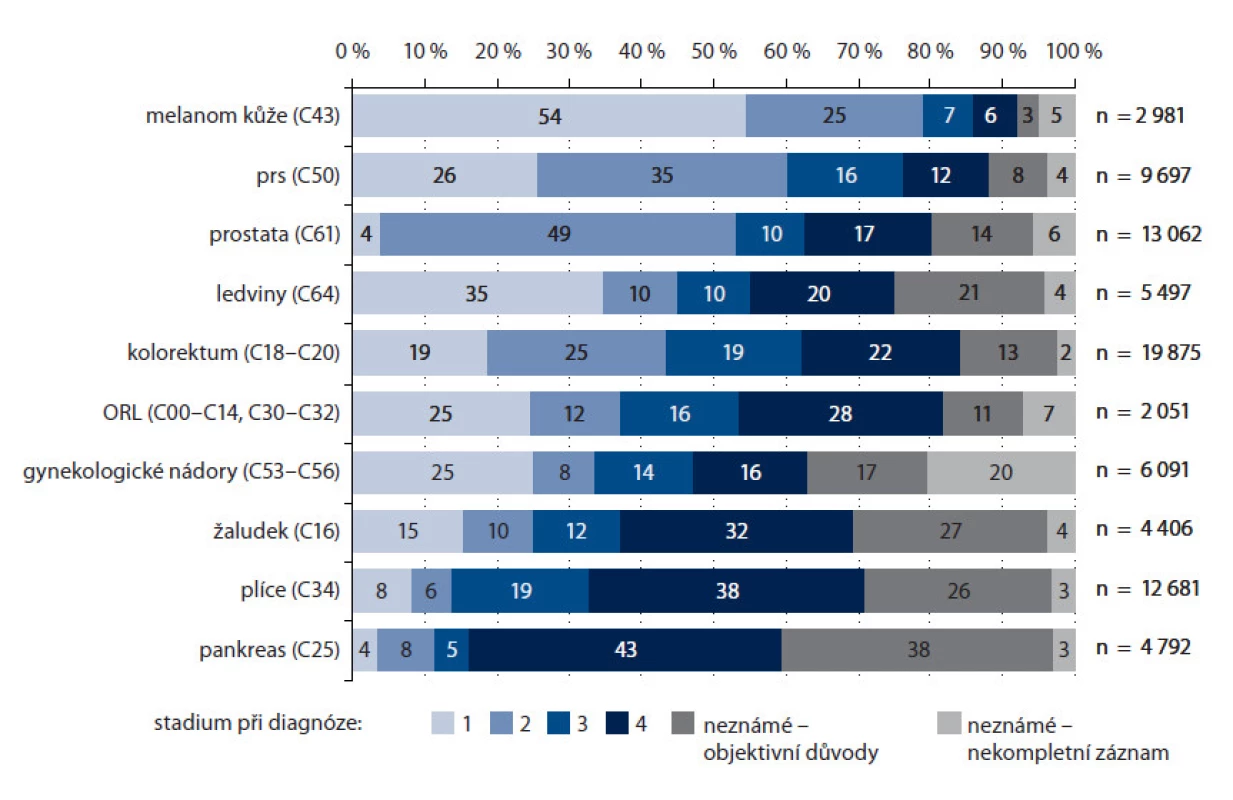
Jak prokazuje řada studií, signifikantní část starších pacientů nepodstoupí kurativní léčbu nebo jejich léčba je méně agresivní než u mladších pacientů. V americké studii založené na databázi Medicare 50 % starších pacientů s karcinomem prostaty s vysokým rizikem neabsolvovalo kurativní terapii v souladu s publikovanými doporučeními [4]. V jiné studii opírající se o SEER Medicare databázi byla specifická mortalita u mužů s karcinomem prostaty T1 – 2 a Gleason skóre 8 – 10 léčených bez prostatektomie nebo radioterapie 26 % [5]. Část starších mužů bez kurativní léčby umírá na lokalizovaný karcinom prostaty s vysokým rizikem předčasně, ačkoliv radikální radioterapie včetně brachyterapie jsou u nich proveditelné s výsledky srovnatelnými s mladšími věkovými kategoriemi [6].
Americká studie opírající se o údaje z National Cancer Database prokázala, že 23 – 50 % pacientů nad 65 let s invazivním karcinomem močového měchýře nebylo vůbec léčeno. U starších pacientů dramaticky klesá počet cystektomií, aniž by odpovídajícím způsobem narůstalo použití radioterapie + chemoterapie [7]. U karcinomu prsu u stadia I a II s věkem narůstá užití parciální mastektomie bez adjuvantní radioterapie a snižuje se využití adjuvantní chemoterapie. Starší pacientky mají vyšší pravděpodobnost úmrtí na karcinom prsu v porovnání s mladšími přes shodné stadium a charakteristiky nádoru, patrně v důsledku méně agresivní léčby. Starší ženy v porovnání s mladšími mívají méně extenzivní operační léčbu (bez axilární disekce či sentinelové biopsie) a menší šanci na léčbu radioterapií či chemoterapií [8]. U pacientů se III. stadiem nádorů tlustého střeva a II. nebo III. stadiem nádorů rekta užití adjuvantní chemoterapie klesá dramaticky s věkem. Řada populačních studií prokázala, že u starších pacientů s karcinomem rekta klesá využití radioterapie [9]. U nádorů ORL oblasti jsou starší pacienti s větší pravděpodobností indikováni k nižším dávkám a kratším režimům radioterapie [10]. Starší pacientky s karcinomem endometria mají nižší šanci podstoupit pooperační radioterapii [11].
Lékaři mají často tendenci indikovat u starších pacientů méně intenzivní léčbu v porovnání se standardními léčebnými postupy. Důvodem je především obava z vyšší toxicity léčby. Pokles fyziologických funkcí spjatý s věkem (zejména kardiovaskulární funkce, ledvinné a jaterní funkce, hematopoetická rezerva) a časté komorbidity u starších pacientů mohou snižovat toleranci k chirurgické léčbě, radioterapii i systémové léčbě. Senioři jsou často postiženi kardiovaskulárními chorobami (infarkt myokardu, ischemická choroba srdeční, redukce ejekční frakce levé komory), onemocněními plic (poruchy ventilace a perfuze, chronické obstruktivní a restriktivní změny), nefrologickými a urologickými komplikacemi, nutričními problémy. Ve studii opírající se o databázi 9 000 pacientek s karcinomem prsu z Holandského onkologického registru byla prevalence komorbidity u pacientek starších 80 let 56 % v porovnání s 9 % u pacientek mladších 50 let [12]. V americké populační studii počet komorbidit vzrůstal s věkem – pro onkologické pacienty ve věku 55 – 64 let byl počet komorbidit 2,9 na jednoho pacienta, ve věku 65 – 74 let 3,6 a nad 75 let 4,2 [13].
Proces stárnutí je individuální. Řada osob si i ve stáří zachová robustní fyzickou i mentální kondici. Na druhé straně jsou lidé křehcí (frail), poznamenaní celkovou slabostí a snížením funkčních rezerv. Fyziologický věk nekoresponduje s věkem kalendářním. Existuje množství důkazů, že kalendářní věk není rozhodujícím parametrem při rozhodování o léčbě a že standardní kurativní léčba může být úspěšně realizována u starších pacientů v dobrém celkovém stavu bez vážných komorbidit. Rovněž kontrola onemocnění a efekt na přežití jsou stejné jako u mladších pacientů. Nicméně starší populace je velmi nehomogenní ve smyslu komorbidit, tělesného a psychického postižení, fyzických rezerv a dalších geriatrických položek. Standardní léčebné postupy aplikovatelné pro heterogenní populaci seniorů neexistují. Hlavním důvodem je skutečnost, že starší věkové kategorie jsou nedostatečně zastoupeny ve většině klinických studií. Pouze 22 % pacientů nad 65 let participuje ve všech klinických onkologických studiích a u pacientů nad 70 let toto procento klesá na 8 %. Od roku 2001 do roku 2010 FDA schválilo 24 nových onkologických léků a pouze 33 % pacientů v registračních studiích bylo ve věku nad 65 let. V téže době tato věková kategorie představovala 59 % všech onkologických pacientů léčených v rutinní praxi [14]. Vzhledem ke specifitě heterogenní skupiny starších pacientů není možné automaticky implementovat výsledky získané u mladších pacientů.
Pro nedostatečné zastoupení starších věkových kategorií v klinických studiích je několik důvodů. Donedávna vstupní kritéria většiny onkologických klinických studií povolovala nejvyšší věk 65 – 70 let. V roce 1989 FDA doporučila nevylučovat starší pacienty z klinických studií, protože věk sám o sobě nelze považovat za hodnoticí kritérium pro účast na nich. Řada studií vylučuje pacienty s poruchou renálních či jaterních funkcí nebo srdeční slabostí, což jsou problémy typické pro vyšší věk. Dalším důvodem vylučování pacientů z klinických studií jsou komorbidity. Avšak informací o tom, jak různá vedlejší onemocnění ovlivňují toleranci léčby, je málo. Řada onemocnění, která negativně ovlivňují funkční stav starého pacienta, nemusí mít negativní vliv na snášenlivost a efekt různých metod onkologické léčby. Polypragmazie bývá další překážkou účasti seniorů v klinických studiích.
Ochota starších pacientů participovat v klinických studiích je dalším důležitým tématem. V přehledu publikovaném Baschem et al [15] přes 40 % starších pacientů nepociťuje žádné překážky bránící účasti ve studiích. Hlavním důvodem váhání s účastí bývají problémy logistické – čas a asistence jiné osoby, nutnost podstoupit léčbu v akademickém centru vzdáleném od místa bydliště, přerušení léčby u primárního onkologa.
Řada dalších faktorů souvisí s postojem ošetřujícího lékaře – obavy z excesivní toxicity, komorbidit, vyšší nároky na podpůrnou péči, problémy s dopravou pacienta, očekávaná horší spolupráce, delší čas strávený vysvětlováním studie staršímu pacientovi, mínění, že vzhledem k omezené očekávané době života není účast seniora v klinické studii smysluplná [16].
Je evidentní, že je zcela zásadní umožnit starším pacientům účast v probíhajících studiích, s detailním a reprodukovatelným hodnocením jejich zdravotního stavu, a ještě větší význam má plánování nových studií zaměřených speciálně na seniory.
Při absenci klinických studií zaměřených na starší populaci s nádorovým onemocněním musí být rozhodování o léčbě seniorů individuální, dle zdravotního stavu každého jednotlivého pacienta, typu a rozsahu nádoru, přítomnosti a závažnosti dalších onemocnění, očekávané době života, funkčního stavu a pacientových preferencí. Toto rozhodování se obvykle opírá o zkušenost příslušného onkologa a je subjektivní. Byla vyvinuta řada nástrojů umožňujících parametrické hodnocení zdravotního stavu starších pacientů, které mohou být při rozhodovacích procesech užitečné.
Podle National Institute on Aging a National Institute of Health, USA, lze starší pacienty klasifikovat do tří kategorií: mladší senioři (65 – 75 let), senioři (76 – 85 let) a nejstarší senioři (starší než 85 let). Nicméně pro medicínské rozhodování je fyziologický věk mnohem důležitější než věk kalendářní. Pro určení fyziologického věku má zásadní význam komplexní geriatrické hodnocení (comprehensive geriatric assessment – CGA). CGA začalo být integrováno v onkologii od poloviny 90. let. CGA je multidisciplinární proces umožňující identifikaci medicínské, sociální a funkční způsobilosti starších dospělých. Tato speciální diagnostická procedura umožňuje detekci a analýzu omezení a problémů pacienta, které zůstávají opominuty při standardním fyzikálním vyšetření a které mohou ovlivnit výsledky onkologické léčby. Nadto umožňuje zhodnocení potřeb pacienta a stanovení komplexního plánu péče [17].
CGA je založeno na zhodnocení funkčního stavu pacienta, komorbidit, polypragmazie, nutričního stavu, kognitivních funkcí, psychologického stavu, socioekonomických aspektů a geriatrických syndromů (tab. 1).
1. Schéma Komplexního geriatrického hodnocení (CGA). 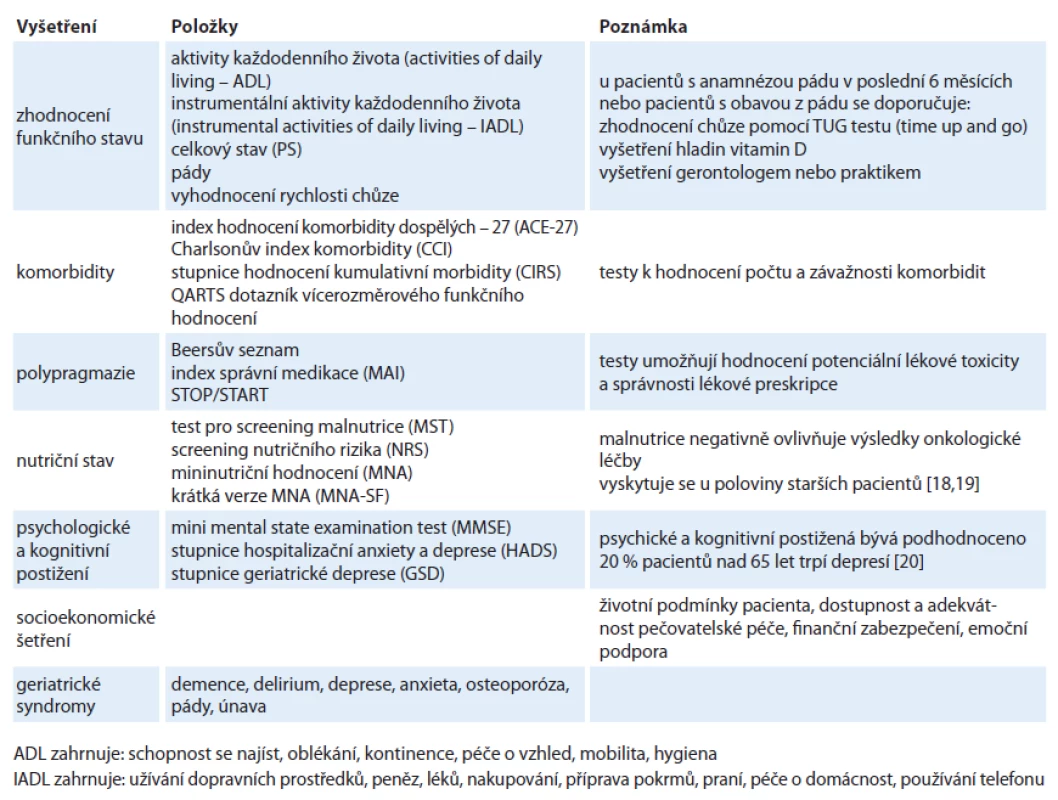
CGA umožňuje lékařům stanovit koordinovaný plán onkologické léčby a nasměrovat intervence podle individuálních potřeb pacienta. CGA je však náročné, a proto je nezbytné vytvořit krátké a jednoduché screeningové testy, které umožní identifikaci těch pacientů, u nichž je zapotřebí kompletní CGA před zahájením léčby. Rychlý screening může být proveden u všech nových pacientů, následně asi polovina z nich bude potřebovat plné CGA. Krátkých screeningových testů bylo vyvinuto několik [21]:
- Abbreviated comprehensive geriatric assessment (aCGA) obsahuje 15 položek: tři dotazy na aktivity každodenního života (ADL), čtyři dotazy na instrumentální aktivity každodenního života (IADL), čtyři otázky z minimental state (MMS) a čtyři otázky z hodnocení geriatrické deprese (GDS).
- G8 zahrnuje osm položek s hodnocením 0 – 18 bodů;
- SAOP2 Sreening tool se skládá z hodnocení funkčního stavu, deprese, kognitivního screeningu a otázek na kvalitu života spojenou se zdravotním stavem, samohodnocením zdraví, pádů, nutrice, spánku, medikace, sociálních otázek (financování léků, dostupnost pečovatelské služby);
- Triase risk screening tool;
- Vulnerable elders survey 13 (VES 13);
- Groeningen frailty index;
- The oncogeriatric screening tool – tento desetipoložkový test rozděluje pacienty na pět kategorií rizika. Klasifikuje pacienty od plně schopných, přes vulnerabilní, po pacienty v křehké kondici (frail).
Koncept „křehkosti“ (frailty)
CGA umožňuje rozdělení pacientů do tří skupin – plně schopní (fit), středně schopní (intermediate) a křehcí (frail) [22]. Křehkost byla obecně definována American Medical Association jako stav přítomný u pacientů s problémy, které zvyšují riziko jejich mortality a hospitalizace. Zhoršení výživy, mobility, síly, energie a fyzické aktivity tvoří pět atributů křehkosti dle Frieda et al [23]. V současné době se k tomu počítá ještě nálada a paměť. Plně schopní geriatričtí pacienti jsou vhodnými kandidáty pro stejné onkologické postupy jako mladší pacienti a mají srovnatelné výsledky v přežití. Křehcí pacienti benefitují hlavně z paliativního přístupu. U pacientů ze střední skupiny je nutné postupovat individuálně.
Nicméně stále není jasné, jakým způsobem údaje z CGA použít v klinické praxi. V roce 2012 byl publikován systematický přehled užití geriatrického hodnocení v onkologii [24]. Autoři identifikovali 83 článků prezentujících 73 studií, u nichž bylo geriatrické vyšetření použito jako součást onkologické léčby. Geriatrické vyšetření se ukázalo jako proveditelné s časovou náročností 10 – 45 minut. Některé položky geriatrického vyšetření korelovaly s výsledkem onkologické léčby, včetně toxicity léčby a mortality. Nejdůležitější faktory asociované s těmito výsledky byly poruchy v aktivitách každodenního života, komorbidity a špatné mentální zdraví. Jako nejčastěji užívané klasifikační schéma se ukázala Balducciho klasifikace fit ‑ vulnerable ‑ frail. U fit pacientů je indikována standardní onkologická léčba, u vulnerabilních adaptovaná a u frail pacientů nejlepší podpůrná léčba nebo léčba paliativní. V řadě studií však u většiny pacientů nemělo geriatrické vyšetření vliv na terapeutické rozhodnutí. Neexistuje randomizovaná studie zaměřená na efektivitu geriatrického hodnocení a rozlišení fit ‑ vulnerable ‑ frail pacientů s adaptací léčby, která by prokázala zlepšení výsledků onkologické léčby u starších pacientů v porovnání se standardní klinickou praxí. Chybí také jasné doporučení, jak implementovat geriatrická vyšetření a jaký typ vyšetření by měl být v rutinní klinické praxi používán.
Další cestou k posouzení biologického věku pacientů je hledání biomarkerů stárnutí. Výzkum se soustředí na několik skupin molekul – proinflamatorní markery, produkty glykace, určování délky telomer u monocytů z periferní krve a proteiny z rodiny sirtuinů, které hrají roli v regulaci procesu stárnutí [25].
Závěr
Zvyšující se incidence nádorových onemocnění u pacientů starších věkových kategorií v souvislosti se stárnutím populace staví onkologii před aktuální problém. Populace seniorů je heterogenní, s plynulou škálou od pacientů plně schopných až po pacienty oslabené. Starší pacienti podstupují obecně méně intenzivní léčbu v porovnání s léčebnými standardy. V důsledku nízkého zastoupení vyšších věkových kategorií v klinických studiích chybí léčebná doporučení pro starší onkologicky nemocné. Geriatrická hodnocení mohou pomoci v rozhodování o léčbě a podpůrné péči, ale jasná vodítka ohledně jejich užití k dispozici nejsou a porovnání jejich přínosu s rutinní onkologickou péčí teprve čeká na důkazy z randomizovaných studií. Je urgentně zapotřebí klinických studií zaměřených speciálně na pacienty ve vyšších věkových kategoriích.
Tato práce byla podpořena programem PRVOUK P37/06.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Jiří Petera, Ph.D.
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: petera@fnhk.cz
Obdrženo: 2. 12. 2013
Přijato: 29. 1. 2014
Sources
1. Ústav zdravotnických informací a statistiky ČR. Novotvary 2009. Praha: ÚZIS ČR 2012.
2. Edwards BK, Howe HL, Ries LA et al. Annual report to the nation on the status of cancer, 1973 – 1999, featuring implications of age and aging on US cancer burden. Cancer 2002; 94(10): 2766 – 2792.
3. Petera J, Dušek L. Cancer in the elderly. Rep Pract Oncol Radiother 2012; 18(1): 1 – 5. doi: 10.1016/ j.rpor.2012.11.001.
4. Chen RC, Bainbridge K, Carpenter WE et al. Racial differences in receipt of guideline ‑ recommended treatment in men with low ‑ , intermediate ‑ , and high‑risk prostate cancor (CaP). A population based study. J Clin Oncol 2010; 28 (Suppl): 15.
5. Lu ‑ Yao GL, Albertsen PC, Moore DF et al. Outcomes of localized prostate cancer following conservative management. JAMA 2009; 302(11): 1202 – 1209. doi: 10.1001/ jama.2009.1348.
6. Soumarová R, Homola L, Perková H. Long term results of HDR brachytehrapy in men older than 75 with localized carcinoma of the prostate. Rep Pract Oncol Radiother 2012; 18(1): 11 – 15. doi: 10.1016/ j.rpor.2012.08.005.
7. Fedeli U, Fedewa SA, Ward EM. Treatment of muscle invasive bladder cancer: evidence from the national cancer database 2003 to 2007. J Urol 2011; 185(1): 72 – 78. doi: 10.1016/ j.juro.2010.09.015.
8. Tesarova P. Brest cancer in the elderly – should it be treated differently? Rep Pract Oncol and Radiother 2012; 18(1): 26 – 33.
9. Wo JY, Hong TS, Lisa AK. Impact of age and comorbidities on the treatment of gastrointestinal malignancies. Semin Radiat Oncol 2012; 22(4): 311 – 320. doi: 10.1016/ j.semradonc.2012.05.008.
10. Gugić J, Strojan P. Squamous cell carcinoma of the head and neck in the elderly. Rep Pract Oncol Radiother 2012; 18(1): 16 – 25.
11. Truong PT, Kader HA, Lacy B et al. The effects of age and comorbidity on treatment and outcomes in women with endometrial cancer. Am J Clin Oncol 2005; 28(2): 157 – 164.
12. Louwman WJ, Janssesn ‑ Heijnen ML, Houiterman S et al.Less extensive treatment and inferior prognosis for brest cancer patient with comorbidity: a population‑based study. Eur J Cancer 2005; 41(5): 779 – 785.
13. Hewitt M, Rolland JH, Yancik R. Cancer survivors in the United States: age, health, and disability. J Gerontol A Biol Sci Med Sci 2003; 58(1): 82 – 91.
14. Scher KS, Hurria A. Under ‑ representation of older adults in cancer registration trials: known problem, little progress. J Clin Oncol 2012; 30(17): 2036 – 2038. doi: 10.1200/ JCO.2012.41.6727.
15. Basche M, Baron AE, Eckhardt SG et al. Barriers to enrolment of elderly adults in early phase cancer clinical trials. J Oncol Pract 2008; 4(4): 162 – 168. doi: 10.1200/ JOP.0842001.
16. Kaźmierska J. Do we protect or discriminate? Representation of senior adults in clinical trials. Rep Pract Oncol Radiother 2013; 18(1): 6 – 10. doi: 10.1016/ j.rpor.2012.08.006.
17. Kaźmierska J. Assessement of health status in elderly patiens with cancer. Rep Pract Oncol Radiother 2012; 18(1): 44 – 48. doi: 10.1016/ j.rpor.2012.07.007.
18. Zadak Z, Ticha A, Hyšpler R. Disease specific substrates in cancer cachexia – reality and anticipation. Rep Pract Oncol Radiother 2012; 18(1): 34 – 43.
19. Cacicedo J, Caquero F, Martinez ‑ Indart L et al. Detection of risk factors that influence weight loss in patiens undergoing radiotherapy. Rep Pract Oncol Radiother 2012; 17(5): 269 – 275.
20. Cieślak K. Professional psychological support and psychotherapy methods for oncology patiens. Basic concepts and issues. Rep Pract Oncol Radiother 2013; 18(3): 121 – 126.
21. Extermann M. Integrating a geriatric evaluation in the clinical setting. Semin Radiat Oncol 2012; 22(4): 272 – 276. doi: 10.1016/ j.semradonc.2012.05.003.
22. Balducci L, Extermann M. Management of cancer in older persons: a practical approach. Oncologist 2000; 5(3): 224 – 237.
23. Fried LP, Tangen CM, Walston J et al. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Med Sci 2001; 56(3): M146 – M156.
24. Hemaker ME, Vos AG, Smorenburg CH et al. The value of geriatric assessments in predicting treatment tolerance and all‑cause mortality in older patiens with cancer. Oncologist 2012; 17(11): 1349 – 1449. doi: 10.1634/ theoncologist.2012 – 0186.
25. Mishra MV, Showalter TN, Dicker AP. Biomarkers of aging and radiation therapy tailored ot the elderly: future of the field. Semin Radiat Oncol 2012, 22(4): 334 – 338. doi: 10.1016/ j.semradonc.2012.05.010.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 3-
All articles in this issue
- Very Late Effects of Radiotherapy – Limiting Factor of Current Radiotherapy Techniques
- The Combination of Neoadjuvant Chemoradiotherapy and Epidermal Growth Factor Receptor Inhibitors in the Treatment of Rectal Adenocarcinoma
- Effect of Vitamin D Receptor Polymorphisms on the Development and Progression of Malignant Melanoma
- Molecular Cytogenetic Analysis of Chromosomal Aberrations in Cells of Low Grade Gliomas and Its Contribution for Tumour Classification
- Cost Analysis of Radiotherapy Provided in Inpatient Setting – Testing Potential Predictors for a New Prospective Payment System
- Inverted Papiloma and Its Rare Forms
- Case Report of a Patient with Advanced and Disseminated Gastric Carcinoma Treated by S-1
- Cancer in Elderly
- Analysis of Disease‑free Survival and Overall Survival in Patients with Luminal A Breast Cancer Stratified According to TNM
- Bevacizumab as Second‑line Treatment of Glioblastoma – Worth the Effort?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Very Late Effects of Radiotherapy – Limiting Factor of Current Radiotherapy Techniques
- Inverted Papiloma and Its Rare Forms
- Cancer in Elderly
- Bevacizumab as Second‑line Treatment of Glioblastoma – Worth the Effort?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



