-
Medical journals
- Career
Prekancerózy žaludku
Authors: Přemysl Falt 1,2; M. Hanousek 1; E. Kundratová 1; O. Urban 1,2
Published in: Klin Onkol 2013; 26(Supplementum): 22-28
Overview
Karcinom žaludku je časté nádorové onemocnění s nepříznivou prognózou v případě záchytu v pozdním stadiu. Nejvýznamnější prekancerózní stav je chronická atrofická gastritida provázená intestinální metaplazií. Způsobuje ji infekce Helicobacter pylori, v jejímž terénu mohou vznikat prekancerózní léze v podobě ložisek dysplazie. Klíčovou roli v diagnostice prekanceróz žaludku hraje endoskopie s histologickým vyšetřením bioptických vzorků sliznice. Hlavní modalita léčby prekancerózních stavů je eradikace Helicobacter pylori a pravidelná endoskopická dispenzarizace v intervalech daných pokročilostí prekancerózních změn. V případě lokalizovatelné prekancerózní léze nebo již časné neoplazie bez rizika lymfatické diseminace jsou metodou volby techniky endoskopické resekce.
Klíčová slova:
karcinom žaludku – prekancerózní stavy – gastritida – Helicobacter pylori – gastroskopieKarcinom žaludku je po karcinomu plic celosvětově druhým nejčastějším nádorovým onemocněním. Jeho výskyt však od 40. let 20. století pozvolna klesá. V ČR je nyní v rámci zhoubných nádorů s incidencí 18,6/ 100 000/ /rok na šestém místě u mužů a s incidencí 13/ 100 000/ rok na devátém místě u žen [1]. Nejvyšší výskyt karcinomu žaludku je v Japonsku (incidence 118,6 u mužů a 55,4 u žen), kde bylo díky screeningovému programu zavedenému v roce 1963 a precizní diagnostice dosaženo úctyhodného záchytu onemocnění ve stadiu časného karcinomu (> 50 %) [2]. Japonsko je také světovým lídrem v endoskopické terapii časných žaludečních neoplazií. V našich podmínkách je ale zatím, na rozdíl od rutinní detekce a endoskopické léčby kolorektálních lézí, diagnostika a endoskopická terapie časných stadií žaludeční karcinogeneze málo častá. Ve stadiu časného karcinomu je na západní polokouli onemocnění detekwováno pouze u 15 – 20 % pacientů [3]. U většiny nemocných je diagnostikováno v pokročilém stadiu s odpovídající nepříznivou prognózou. Vysvětlením by mohlo být dlouhé asymptomatické stadium, ve kterém bývá časný karcinom nalezen náhodně při vyšetření z jiné indikace. Dalším faktorem je často diskrétní endoskopický obraz žaludečních prekanceróz, s nímž většina endoskopistů nemá dostatečné rutinní zkušenosti.
Karcinom žaludku tvoří přes 90 % nádorových onemocnění žaludku. Adenokarcinomy v oblasti kardie jsou nejčastěji asociovány s gastroezofageálním refluxem a Barrettovým jícnem. Jejich výskyt, na rozdíl od karcinomu nekardiální oblasti žaludku, během posledních desetiletí rychle stoupá. Distální adenokarcinomy žaludku se podle Laurenovy klasifikace dělí na intestinální a difuzní typ. Intestinální typ (55 %) vychází z intestinální metaplazie sliznice žaludku, roste spíše povrchově, je častější, bývá lépe diferencován, a tím i prognosticky příznivější. Vyskytuje se zejména u starších mužů a převažuje v zemích s vysokým výskytem karcinomu žaludku. Difuzní typ (35 %) může být díky infiltraci hlubších vrstev stěny žaludku i v pokročilejších stadiích endoskopicky obtížně detekovatelný, bývá nízce diferencován s nepříznivou prognózou, často postihuje mladší věkové skupiny a má rovnoměrné geografické rozložení výskytu. Zvláštní formou je karcinom z prstenčitých buněk s typickým postižením antropylorické části žaludku, u mladších osob s velmi špatnou prognózou. Dalšími neoplaziemi žaludku mohou být karcinoidy, neepiteliální (gastrointestinální stromální tumor, lymfom, leiomyosarkom) a sekundární nádory (metastázy do stěny žaludku) [4].
Hereditární faktory
Jako u každého jiného nádorového onemocnění hraje významnou roli genetické pozadí. Anamnéza výskytu karcinomu žaludku u příbuzného je nezávislým rizikovým faktorem, který zvyšuje riziko výskytu i po adjustaci výskytu Helicobacter pylori. Odhaduje se, že hereditární faktory hrají roli u přibližně třetiny případů karcinomu žaludku.
Při sledování nemocných s některými definovanými genetickými syndromy je třeba mít na paměti zvýšené riziko nádoru žaludku. U nemocných s familiární adenomatózní polypózou (FAP) je prevalence adenomů žaludku udávána mezi 35 a 100 % a riziko karcinomu žaludku je 10krát vyšší než v kontrolní populaci. Karcinomy většinou vznikají z polypů fundických žlázek, které jsou charakteristické pro endoskopický nález u pacientů s FAP. Nemocní s hereditárním nepolypózním karcinomem tračníku (Lynchův syndrom) mají v průběhu života 11% riziko vzniku karcinomu žaludku. Zvýšené riziko je popsáno i u pacientů s juvenilní polypózou a Peutz ‑ Jeghersovým syndromem.
U difuzního karcinomu žaludku je až v 80 % uváděna somatická mutace genu pro E ‑ cadherin (CDH1), jehož snížená exprese zřejmě usnadňuje disociaci a následnou migraci nádorových buněk. Vrozená mutace genu CDH1 byla poprvé popsána na Novém Zélandu a je nejlépe definovaným syndromem hereditárního karcinomu žaludku. Celoživotní riziko karcinomu žaludku je u těchto nemocných odhadováno na 70 %. Často vzniká před 40. rokem věku a současně se zvyšuje i riziko karcinomu prsu. Další studované genetické alterace jsou polymorfizmy genů pro interleukiny 1b, 1RN, 10 a tumor nekrotizující faktor α, které modifikují průběh zánětlivé reakce na infekci Helicobacter pylori, a mohou tak vést k rychlejšímu vzniku atrofie sliznice a vyššímu riziku adenokarcinomu [5].
Faktory zevního prostředí
Nejvýznamnější faktor zevního prostředí je infekce Helicobacter pylori. Ta je podrobně probrána v další části textu. Zdá se, že také vysoký příjem kuchyňské soli je asociován s vyšším rizikem karcinomu žaludku. Dle některých dat může být toto riziko zvyšováno i vysokým příjmem nitrátů a polycyklických aminů. Naopak konzervace potravin chladem spojená s nižším rizikem bakteriální a fungální kontaminace a vyšší příjem ovoce a zeleniny se může podílet na postupném poklesu výskytu karcinomu žaludku. Kouření cigaret je v epidemiologických studiích, na rozdíl od konzumace alkoholu, jednoznačně spojeno s vyšším rizikem onemocnění. Také je dobře známa asociace obezity a zvýšeného rizika karcinomu v oblasti kardie, riziko se však nezdá být vyšší pro ostatní části žaludku [5,6].
Prekancerózní stavy a prekancerózní léze
Prekancerózní stavy jsou charakterizovány chronickými zánětlivými nebo metaplastickými změnami tkáně, které jsou vyvolány dlouhodobou iritací patologickým procesem. Prekancerózní léze mohou vznikat v terénu prekancerózních stavů a jejich tkáň již vykazuje neoplastické rysy. Hlavní klinický dopad přítomnosti prekanceróz je riziko jejich transformace do invazivní malignity [7]. Ilustrativní příklad prekancerózního stavu představuje metaplastická sliznice Barrettova jícnu způsobená chronickým gastroezofageálním refluxem. Prekancerózní léze je potom dysplastické ložisko vzniklé v terénu Barrettova jícnu, jehož další progresí může dojít ke vzniku invazivního adenokarcinomu jícnu. Zlatý standard diagnostiky a v některých případech i terapie prekanceróz jsou metody digestivní endoskopie.
Prekancerózní stavy žaludku
Chronická atrofická gastritida
Většina případů intestinálního typu adenokarcinomu žaludku vzniká na základě kaskády: chronická superficiální gastritida → chronická atrofická gastritida → intestinální metaplazie → dysplazie → adenokarcinom [8]. Během této kaskády dochází ke kumulaci genetických i epigenetických abnormalit tumor ‑ supresorových genů, proonkogenů a mismatch ‑ repair genů.
Chronická atrofická gastritida je charakterizována chronickým zánětlivým infiltrátem sliznice žaludku, který vede v různé míře a v různé lokalizaci k atrofii žaludečních žlázek. V případě izolovaného postižení sliznice antra hovoříme o difuzní antrální gastritidě. Pokud je multifokálně postižena sliznice žaludku včetně fundu, jde o multifokální atrofickou gastritidu (MAG) [9].
Dominantní příčinu chronické superficiální a atrofické gastritidy tvoří infekce Helicobacter pylori, která je v klasifikaci IARC řazena mezi kancerogeny I. třídy a hraje i klíčovou roli při vzniku MALT lymfomu žaludku. Současná prevalence infekce Helicobacter pylori v České republice je odhadována na 35 % [10]. Reakce organizmu na infekci je do značné míry dána genetickou predispozicí, studovány jsou např. genové polymorfizmy pro interleukiny uvedené výše. Někteří infikovaní zůstávají bez větších morfologických změn sliznice žaludku. U některých infekce vede spíše k rozvoji antrální gastritidy s hyperchlorhydrií a rizikem vředové choroby duodena. U dalších pak spíše ke vzniku multifokální atrofické gastritidy s hypochlorhydrií a zvýšeným rizikem vředu a karcinomu žaludku. Dalším faktorem je virulence daného bakteriálního kmene. Nejznámější je skupina bakteriálních genů CagA, jejichž přítomnost bývá asociována s těžší formou zánětu, vyšším stupněm atrofických změn, a tedy i vyšším rizikem adenokarcinomu. Jinými popsanými faktory jsou např. geny VacA a BabA2. Poslední faktor je délka trvání infekce Helicobacter pylori. Riziko rozvoje chronické atrofické gastritidy u infikovaného pacienta se odhaduje na 1 – 3 % ročně [6] a riziko progrese chronické atrofické gastritidy do karcinomu žaludku na 0,5 – 1 % ročně [5].
Při autoimunitně podmíněné difuzní korporální atrofické gastritidě (DCAG) je postiženo tělo a fundus žaludku. Tato gastritida nebývá spojena s infekcí Helicobacter pylori, je charakteristická přítomností protilátek proti parietálním buňkám a vnitřnímu faktoru a bývá asociována s perniciózní anemií. Riziko vzniku karcinomu žaludku u těchto nemocných není ve studiích konzistentní, ale jistě je nižší než při MAG. Důvodem k případné endoskopické dispenzarizaci nemocných může být přítomnost intestinální metaplazie [5,11].
Dalším možným faktorem zvyšujícím riziko karcinomu žaludku při atrofické gastritidě je hypo ‑ až achlorhydrie způsobená atrofií sekrečního epitelu, která vede k bakteriálnímu přerůstání a produkci kancerogenních sloučenin dusíku a též snížené absorpci kyseliny askorbové. Současně dochází zpětnou vazbou k zvýšené produkci gastrinu, který je růstovým faktorem buněk žaludečního epitelu [5,6].
Intestinální metaplazie
Intestinální metaplazie vzniká v terénu chronické atrofické gastritidy v důsledku chronické iritace tkáně a je klasifikována do tří typů. Kompletní metaplazie (typ I, enterální) vykazuje pohárkové, Panethovy a absorpční buňky s kartáčkovým lemem podobné enterocytům s poklesem produkce žaludečního mucinu. Podkladem inkompletní metaplazie (typ II/ IIA, enterokolická a typ III/ IIB, kolonická) jsou pohárkové buňky a neabsorpční kolumnární buňky podobné kolonocytům. Nemocní s inkompletní metaplazií sliznice žaludku (typ II a III) mají až 20násobně zvýšené riziko karcinomu žaludku. Přítomnost kompletní metaplazie (typ I) toto riziko zřejmě nezvyšuje [5,9].
Žaludeční polypy
Polypy žaludku jsou poměrně častý nález při horní endoskopii. Nejčastěji (50 %) jde o polypy z fundických žlázek, nejvíce u pacientů dlouhodobě užívajících inhibitory protonové pumpy. Riziko maligní transformace je velmi nízké a je omezeno na polypy větší než 10 mm. Výjimkou je typický nález těchto polypů u pacientů s familiární adenomatózní polypózou, u nichž se často nalézají ložiska dysplazie. Další typ žaludečních polypů jsou prakticky vždy benigní hyperplastické polypy (40 %), jejichž malignizace bývá výjimečná. V 10 % případů jde o adenomatózní polypy s vysokým rizikem vzniku adenokarcinomu. V případě adenomu ale již nejde o prekancerózní stav, nýbrž o prekancerózní lézi [5].
Stav po resekci žaludku
Více prací udává zvýšené riziko adenokarcinomu žaludku u pacientů po resekci žaludku indikované pro benigní diagnózu. Karcinom vzniká až s dlouhým odstupem od operace (15 – 30 let) a bývá nejčastěji lokalizován na žaludeční straně anatomózy. Resekce dle Billrotha II. typu je spojena se 4násobně vyšším rizikem než I. typ resekce. Za mechanizmus kancerogeneze se považuje enterogastrický biliární reflux, hypochlorhydrie provázená bakteriálním přerůstáním a atrofie sliznice žaludku v důsledku hypogastrinemie při chybění antra [5,6].
Anamnéza vředu žaludku
Velké epidemiologické studie demonstrují zvýšené riziko karcinomu žaludku u pacientů s anamnézou vředu žaludku a snížené riziko u pacientů s anamnézou vředu duodena. Důvodem jsou pravděpodobně rozdílné formy chronické gastritidy u pacientů infikovaných Helicobacter pylori. Zatímco antrální gastritida s výskytem duodenálního vředu není spojena s atrofií, a tedy ani rizikem karcinomu, korporální atrofická gastritida zvyšuje nejen riziko vředu žaludku, ale jedná se i o prekancerózní stav [5,12]. Z praktického hlediska jsou při nálezu vředu žaludku nezbytné odběry biopsie z okraje vředu k vyloučení neoplazie a endoskopická a bioptická kontrola jizvy po přeléčení.
Ménétrierova choroba
Ménétrierova choroba je vzácná klinická jednotka charakterizovaná obrovskými žaludečními řasami na podkladě epiteliální hyperplazie, která vede k exudativní hypoproteinemii. Asi u 15 % ne-mocných je choroba asociována s karcinomem žaludku, v některých případech byl popsán i postupný přechod z dysplazie. Etiologie Ménétrierovy choroby zatím není spolehlivě vysvětlena, některé případy jsou ale nepochybně spojeny s infekcí cytomegalovirem a Helicobacter pylori s dokumentovaným efektem antivirové a antibiotické terapie [4,5,11].
Prekancerózní léze žaludku
Prekancerózní léze sliznice žaludku jsou v různé míře detekovatelná ložiska vyznačující se celulární atypií epitelu označovanou jako dysplazie nebo v Evropě upřednostňovaným termínem intraepiteliální neoplazie (IEN). V současné době se používá WHO klasifikace na IEN nízkého stupně („low-grade dysplasia“), IEN vysokého stupně („high-grade dysplasia“) (obr. 1, 2) a intramukózní karcinom (obr. 3), kde je již prokazatelná invaze neoplastických buněk přes bazální membránu do lamina propria mucosae [13].
Image 1. Gastroskopie v bílém světle – pohled do antra žaludku s bělavými mapovitými plochami intestinální metaplazie, v levé dolní části obrázku je patrné lehce zarudlé ložisko dysplazie vysokého stupně. 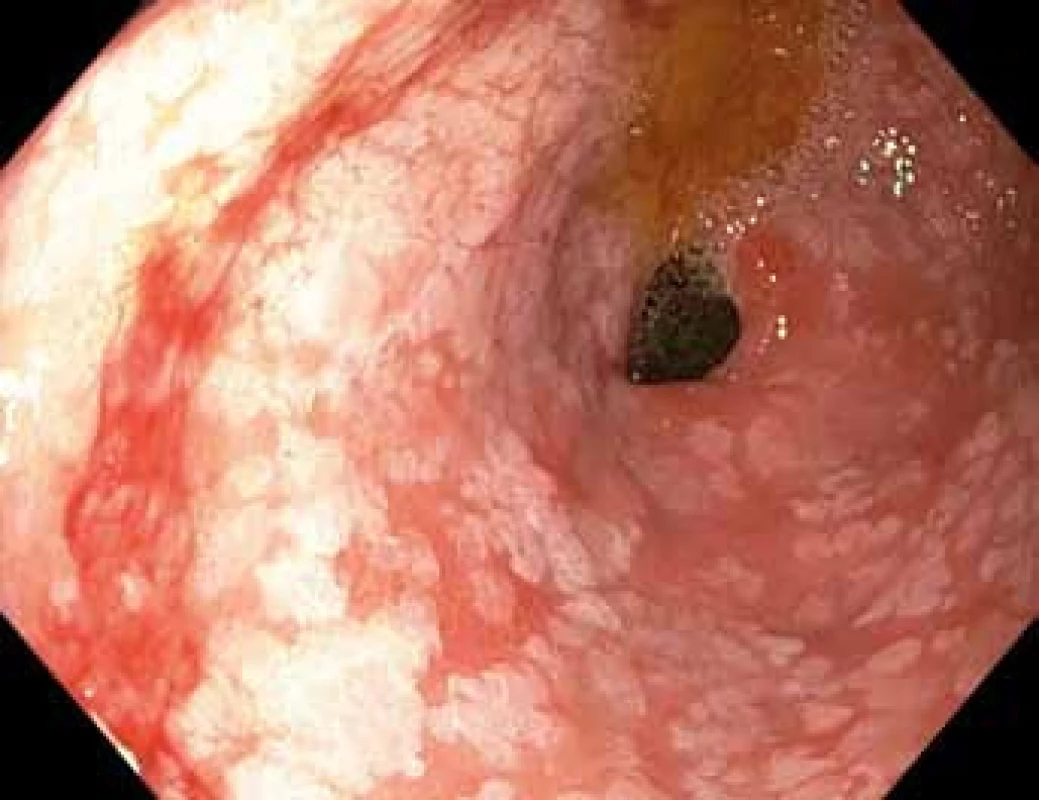
Image 2. Gastroskopie v módu NBI – stejný pohled do antra žaludku s ložisky intestinální metaplazie, v levé dolní části obrázku je ložisko dysplazie vysokého stupně tmavší barvy s nepravidelnou povrchovou strukturou sliznice. 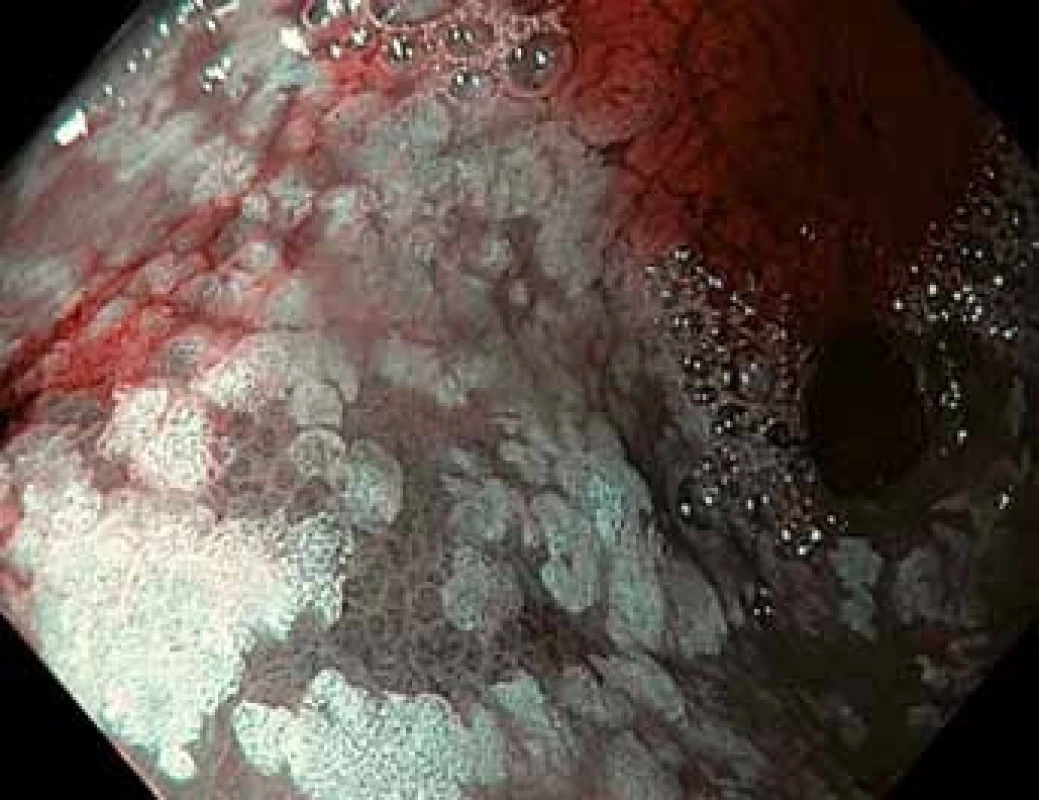
Image 3. Endoskopická submukózní disekce (ESD) intramukózního karcinomu žaludku přední stěny antra žaludku – označení okrajů léze pomocí koagulačních bodů. 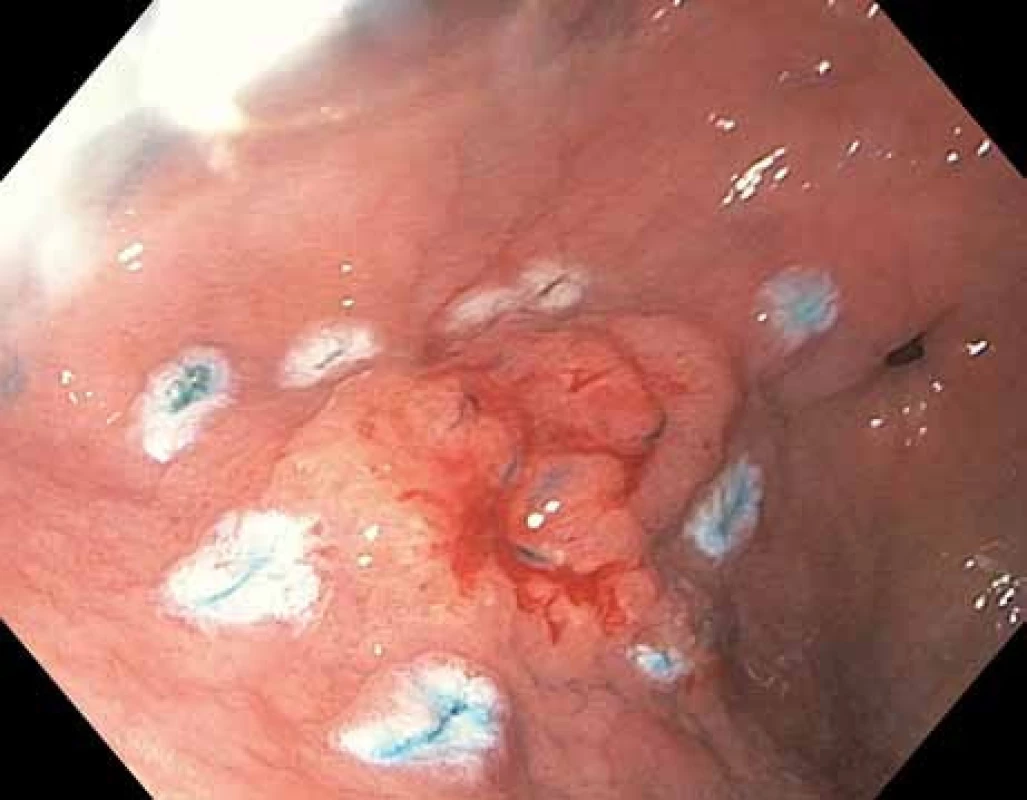
Diagnostika prekanceróz žaludku
Zlatý standard diagnostiky žaludečních prekanceróz je gastroskopie s klešťovou biopsií sliznice žaludku. Korelace mezi endoskopickým a histologickým nálezem není v praxi dostatečná, a správně odebrané bioptické vzorky jsou proto nezbytnou podmínkou diagnózy. V některých případech ale lze již na základě endoskopického obrazu pojmout podezření na přítomnost prekancerózního stavu – typická nodulární sliznice antra žaludku u dětí a některých dospělých při gastritidě v rámci infekce Helicobacter pylori, vyhlazená sliznice žaludku s patrnou cévní kresbou při pokročilé atrofii a drobná bělavá depozita v případě intestinální metaplazie (obr. 1). Kromě standardní endoskopie v bílém světle lze ke zvýšení přesnosti detekce často velmi diskrétních prekancerózních lézí využít endoskopie s vysokým rozlišením, chromodiagnostiky různými barvivy aplikovanými na sliznici (metylenová modř, kyselina octová, indigokarmín), metod elektronické chromoendoskopie (narrow band imaging – NBI, fujinon intelligent chromoendoscopy – FICE, autofluorescence imaging – AFI), zvětšovací endoskopie nebo jejich kombinace [14].
Vzhledem k nerovnoměrné a ložiskové distribuci atrofie a intestinální metaplazie je pro adekvátní diagnózu doporučen odběr vícečetných biopsií – nejméně dvě necílené biopsie z antra a těla žaludku (vždy z malé a velké kurvatury) a samozřejmě cílené léze v případě jakékoliv viditelné léze [9]. Z bioptických vzorků lze s pomocí speciálního barvení (Giemsa, Warthin‑Starry) posoudit i přítomnost Helicobacter pylori. Samostatně odebrané vzorky sliznice se také využívají jako materiál v praxi často užívaného rychlého ureázového testu stanovení přítomnosti Helicobacter pylori. Princip testu je založen na detekci vzestupu pH vlivem amoniaku vzniklého při hydrolýze urey bakteriální ureázou.
Perspektivní, ale zatím nepříliš užívaná neinvazivní metoda k predikci rozsahu atrofické gastritidy je stanovení sérových hladin pepsinogenu. Sérový pepsinogen lze rozdělit do dvou typů. Pepsinogen I (PGI) produkují hlavní buňky sliznice fundu a pepsinogen II (PGII), který vzniká také v pylorických žlázkách a ve sliznici orálního duodena. Aktivní zánět sliznice žaludku vede k vzestupu produkce obou typů, ale většinou více typu PGII, a tím k poklesu poměru PGI/ PGII. Při rozvoji atrofie a ztrátě sekrečních buněk produkce obou typů klesá. Rychlejší je pokles PGI, což dále prohlubuje nepoměr mezi PGI/ PGII. Nízká hladina PGI a nízký poměr PGI/ PGII je proto dobrý indikátor atrofických změn žaludeční sliznice [9].
K detekci infekce Helicobacter pylori se využívají další neinvazivní testy. Dechový test je založen na detekci 13CO2 ve vydechovaném vzduchu po vypití roztoku 13C urey a její hydrolýze bakteriální ureázou, která jinak v žaludku není přítomna. Další možnost je detekce antigenu Helicobacter pylori ve stolici. Oba testy jsou v praxi využívány zejména ke kontrole efektivity eradikační terapie v případě, že není nutná kontrolní endoskopie. Určitým způsobem nadužívaná metoda je stanovení protilátek pro Helicobacter pylori. Tento test má význam k detekci nově infikovaného pacienta, není ale vhodný ke sledování léčeného pacienta, u něhož i po úspěšné léčbě přetrvává sérologická pozitivita. Existují zprávy, že vymizení pozitivity protilátek u pacientů s těžkou atrofií sliznice žaludku dále zvyšuje riziko vzniku dysplazie a adenokarcinomu [9].
Léčba prekanceróz žaludku
Eradikace Helicobacter pylori
Eradikační terapie Helicobacter pylori spočívá v podávání různých antibiotických režimů v kombinaci s inhibitory protonové pumpy. Mezi nejčastěji používaná antibiotika patří amoxicilin, klaritromycin, metronidazol, tetracyklin, bismut subsalicylát, levofloxacin a moxifloxacin. Eradikace helikobakterové infekce může zhojit neatrofickou chronickou gastritidu a způsobit parciální regresi atrofické gastritidy. Stejně tak je eradikace vhodná u pacientů s intestinální metaplazií, u kterých zřejmě nevede k jejímu vymizení, ale předpokládá se zpomalení progrese do dysplazie a karcinomu. Eradikace se také doporučuje u pacientů s anamnézou endoskopické nebo chirurgické léčby neoplazie žaludku z důvodu rizika metachronních lézí [9].
Sledování pacientů s prekancerózou žaludku
Pacienti s extenzivní atrofií a/ nebo intestinální metaplazií by měli být endoskopicky sledováni každé tři roky. V běžné praxi se nedoporučuje rutinní typizace intestinální metaplazie. Pacienti s nálezem nízkého stupně dysplazie mají asi 7% riziko přechodu do invazivního karcinomu a měli by být endoskopicky sledováni v ročních intervalech. Asi 25 % pacientům s nálezem vysokého stupně dysplazie je během jednoho roku diagnostikován karcinom. V případě nálezu vysokého stupně dysplazie z necílené biopsie je vhodné zopakovat gastroskopii zkušeným endoskopistou s použitím nejlepších dostupných endoskopických modalit s extenzivními biopsiemi a poté sledování v intervalech šesti měsíců. Při nálezu makroskopicky viditelné léze je doporučena endoskopická resekce léze s možností detailního histologického vyšetření resekátu [9].
V současné době nelze doporučit užívání selektivních COX‑2 inhibitorů nebo dietních doplňků s antioxidanty (vitamin C, beta‑karoten, vitamin E, selen) ve smyslu chemoprevence s cílem snížit riziko vzniku žaludeční neoplazie [9].
Endoskopická léčba prekanceróz žaludku
Základní a nejobtížnější podmínkou úspěšné léčby časné neoplazie žaludku je její detekce, která může být obtížná i pro zkušené endoskopisty. Časné karcinomy se mohou projevit pouze diskrétní změnou barvy, změnou cévní kresby nebo povrchu sliznice. Zvláště problematická bývá detekce plochých či lehce vkleslých lézí. Některé mohou být mylně považovány za povředovou jizvu nebo traumatickou změnu vzniklou v průběhu vyšetření. K zvýšení přesnosti detekce lze využít moderní metody zobrazení, jako jsou endoskopie s vysokým rozlišením, zvětšující endoskopie, klasická a virtuální chromoendoskopie. Ke stanovení hloubky invaze před endoskopickou léčbou lze využít metody endoskopické ultrasonografie s použitím klasických sond o frekvenci 6 – 12 MHz nebo minisond s frekvencemi 20 – 30 MHz.
K endoskopické léčbě prekanceróz a časného karcinomu žaludku jsou indikovány pouze léze, které lze bezpečně a kompletně odstranit a jež současně nejsou provázeny významnějším rizikem metastazování do endoskopicky nepostižitelných lymfatických uzlin. Riziko lymfatické diseminace závisí na hloubce nádorové invaze, morfologickém a histologickém typu nádoru. Dobře diferencovaný intestinální karcinom bez ulcerace, jenž postihuje pouze mukózu (m1 – 3), je provázen téměř nulovým rizikem postižení lymfatických uzlin. S hloubkou invaze do submukózy toto riziko rychle roste. Většina autorů proto doporučuje endoskopickou léčbu u karcinomů s invazí maximálně do horní třetiny submukózy (sm1) s přijatelným rizikem lymfatického šíření do 2 – 4 % [14].
Techniky terapeutické endoskopie se dají rozdělit na ablační a resekční. Ablace spočívá v řízené a různými principy provedené destrukci patologické tkáně. Její hlavní nevýhodou je nemožnost histologického vyšetření, které je zlatý standard lokálního stagingu a je také klíčové ke stanovení další léčby a sledování pacienta [15]. Proto jsou při léčbě prekanceróz a časného karcinomu žaludku upřednostňovány metody resekční. Endoskopická polypektomie spočívá ve snesení stopkatých polypů v úrovni stopky pomocí kličky a v žaludku se používá zřídka při resekci stopkatých hyperplastických polypů. Při endoskopické slizniční resekci (EMR) se v různých modifikacích kličkou resekují přisedlé nebo ploché léze po jejich elevaci pomocí injekce roztoku do submukózy (tzv. lifting). Tento postup umožňuje en bloc odstranění lézí menších než 20 mm. Větší léze je nutno odstranit po částech, což komplikuje posouzení resekčních okrajů a kurativnost resekce, a proto tento postup není u větších lézí považován za vhodný. Podstatou endoskopické submukózní disekce (ESD) je cirkulární incize zdravé sliznice kolem léze (obr. 3, 4) a postupný řez vedený v submukóze pomocí diatermického nože při opakovaném podpichu roztoku do submukózy (tzv. disekce) (obr. 5 – 7). Výhoda je miniinvazivita výkonu bez nutnosti celkové anestezie, zachování žaludku a možnost en bloc odstranění i rozsáhlejších neoplazií. Nevýhoda je doba trvání (až 180 min) a technická náročnost, která výkon řadí mezi nejobtížnější v digestivní endoskopii. Metoda je navíc standardně dostupná pouze v několika centrech. Endoskopická resekce a disekce je provázena určitým rizikem komplikací, k nimž patří zejména krvácení ze spodiny resekce během výkonu nebo opožděně, a dále perforace stěny žaludku. Velkou část komplikací je možno vyřešit endoskopickou cestou. V případě komplikací neovlivnitelných endoskopicky stejně jako při nemožnosti kurativní endoskopické léčby je nutné přistoupit k chirurgickému řešení [14,15].
Image 4. Endoskopická submukózní disekce (ESD) – cirkulární incize okolní sliznice pomocí diatermického nože. 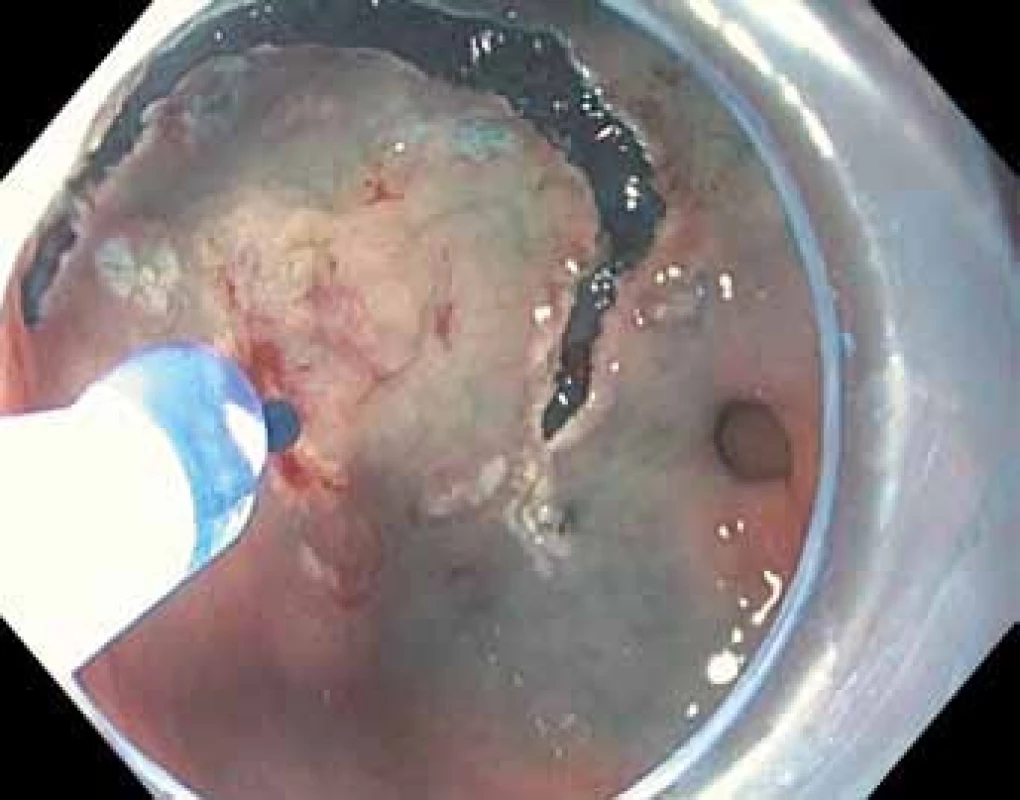
Image 5. Endoskopická submukózní disekce (ESD) – postupná disekce submukózy pod celou lézí. 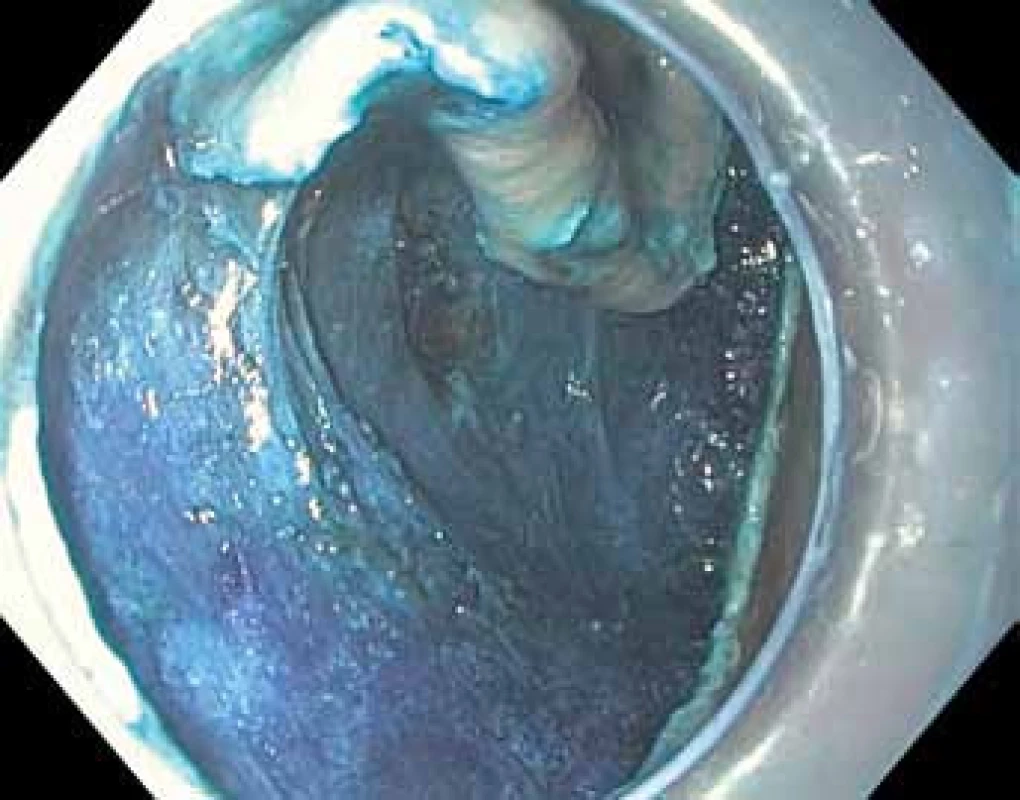
Image 6. Endoskopická submukózní disekce (ESD) – spodina arteficiální ulcerace po ukončení výkonu a extrakci vzorku. 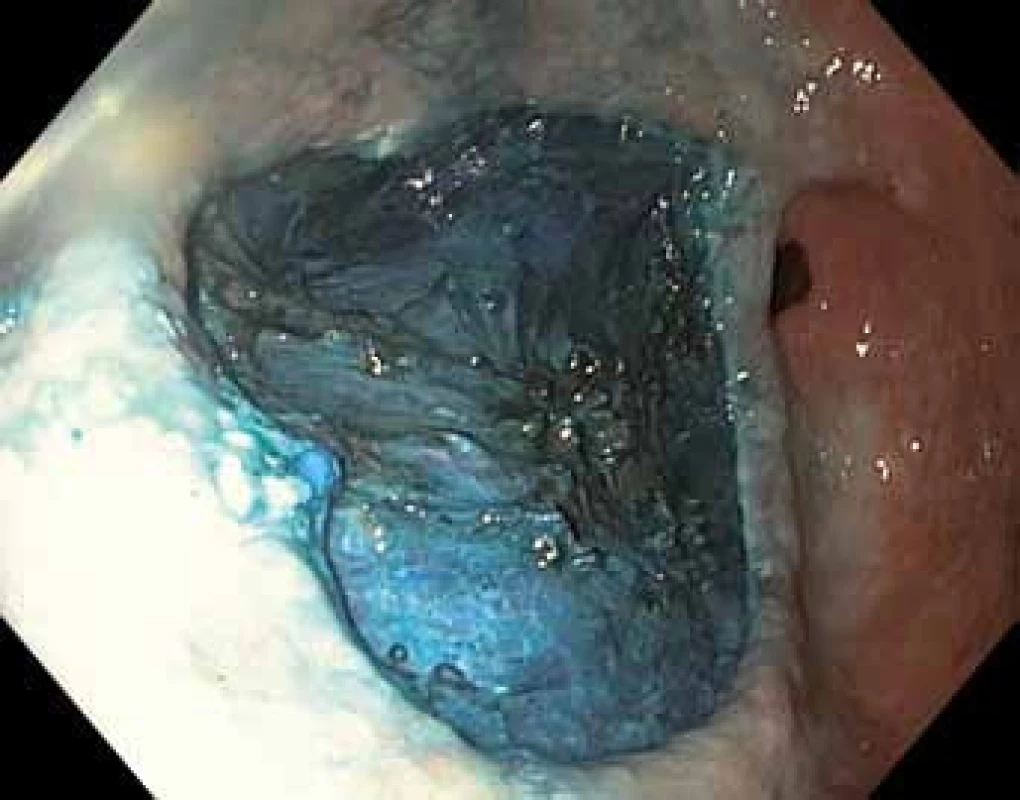
Image 7. Endoskopická submukózní disekce (ESD) – en bloc snesený resekát našpendlený na korkovou podložku, v centru patrná vlastní léze a v okolí dostatečný okraj zdravé tkáně i s koagulačními body. 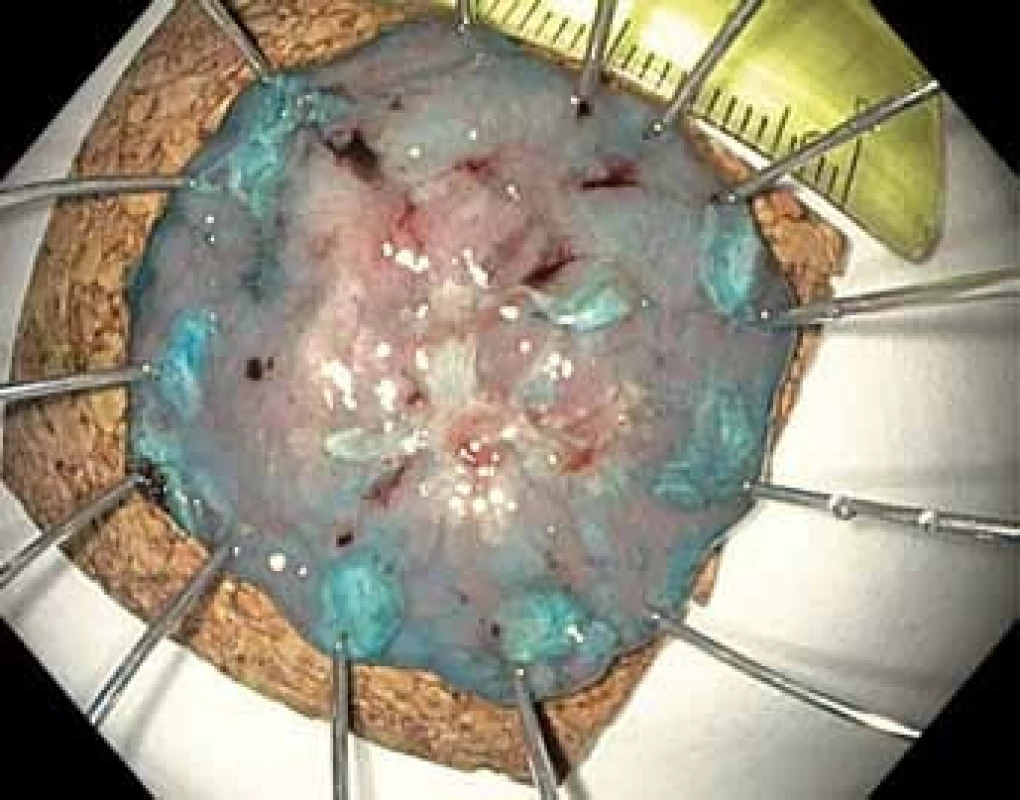
Závěr
Karcinom žaludku je časté nádorové onemocnění gastrointestinálního traktu. Nepříznivá prognóza větší části nemocných je dána zejména záchytem v pozdním stadiu. Nejvýznamnější prekancerózní stav je chronická atrofická gastritida s intestinální metaplazií způsobená infekcí Helicobacter pylori, v jejímž terénu mohou vznikat prekancerózní léze v podobě dysplastických ložisek až časného karcinomu. Nezastupitelnou roli v diagnostice prekanceróz žaludku hraje endoskopie s histologickým vyšetřením bioptických vzorků sliznice. Hlavní modalita léčby prekancerózních stavů je eradikace Helicobacter pylori a pravidelná endoskopická dispenzarizace v intervalech daných pokročilostí prekancerózních změn. V případě lokalizovatelné prekancerózní léze nebo již časné neoplazie bez rizika lymfatické diseminace představuje metodu volby technika endoskopické resekce s následným histologickým vyšetřením resekátu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Přemysl Falt
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zálužanského 1192/15
703 84 Ostrava
e-mail: premysl.falt@nemvitkovice.cz
Obdrženo: 16. 9. 2013
Přijato: 27. 9. 2013
Sources
1. Svod.cz [internetová stránka]. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, Česká republika. Dostupné z: www.svod.cz.
2. Hisachimi S, Sugawara N, Fukao A. Effectiveness of gastric mass screening in Japan. Cancer Detect Prev 1988; 11(3 – 6): 323 – 328.
3. Borchard F. Classification of gastric carcinoma. Hepatogastroenterology 1990; 37(2): 223 – 232.
4. Hrdlička L, Šťovíček J. Diagnostika a symptomy. In: Šimša J et al (eds). Karcinom žaludku: současná diagnostika a léčba. Praha: Maxdorf 2012.
5. Abrams JA, Wang TC. Adenocarcinoma and other tumors of the stomach. In: Feldman M, Friedman LS, Brandt LJ et al (eds). Sleisinger and Fordtrans’s Gastrointestinal and Liver Disease. 9th ed. Philadelphia: Elsevier Saunders 2010.
6. Hrdlička L, Šťovíček J. Etiologické faktory. In: Šimša J et al (eds). Karcinom žaludku: současná diagnostika a léčba. Praha: Maxdorf 2012.
7. Jirásek T. Histomorfologický obraz prekanceróz. In: Černoch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 45 – 74.
8. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process – First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992; 52(24): 6735 – 6740.
9. Dinis ‑ Ribeiro M, Areia M, de Vries AC et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP) and the Sociedade Portuguesa de Endoscopia Digestiva. Endoscopy 2012; 44(1): 74 – 94.
10. Bureš J, Kopáčová M, Rejchrt S. Pokles prevalence infekce Helicobacter pylori v České republice. Čas Lék Čes 2008; 147 : 255 – 257.
11. Lee EL, Feldman M. Gastritis and Gastropathies. In: Feldman M, Friedman LS, Brandt LJ et al (eds). Sleisinger and Fordtrans’s Gastrointestinal and Liver Disease. 9th ed. Philadelphia: Elsevier Saunders 2010.
12. Molloy RM, Sonnenberg A. Relation between gastric cancer and previous peptic ulcer disease. Gut 1997; 40(2): 247 – 252.
13. Lauwers GY, Carneiro F, Graham DY et al. Gastric carcinoma. In: Bosman FT, Carneiro F, Hruban RH et al (eds). WHO Classification of Tumours of the Digestive Systém. 4th ed. Lyon: IARC Press 2010 : 48 – 58.
14. Urban O. Endoskopická léčba časného karcinomu žaludku. In: Šimša J et al (eds). Karcinom žaludku: současná diagnostika a léčba. Praha: Maxdorf 2012.
15. Urban O, Falt P. Endoskopická léčba prekanceróz a časných neoplázií trávicí trubice. In: Černoch J et al (eds). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012 : 151 – 188.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue Supplementum-
All articles in this issue
- Prekurzory karcinomu prsu
- Prekancerózy v ORL oblasti
- Prekancerózy jícnu
- Prekancerózy žaludku
- Prekancerózní stavy a rizikové faktory karcinomu pankreatu a žlučových cest
- Premaligní stavy tenkého střeva
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v gynekologii – pochva
- Prekancerózy v gynekologii – děložní hrdlo
- Prekancerózy v gynekologii – endometrium
- Prekancerózy v gynekologii – ovarium
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prekancerózy žaludku
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v ORL oblasti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

