-
Medical journals
- Career
Biologické účinky oxidu uhelnatého
Authors: J. Šuk; L. Muchová
Authors‘ workplace: Laboratoř pro výzkum nemocí jater a metabolismu hemu, Centrální výzkumné laboratoře, Ústav lékařské, biochemie a laboratorní diagnostiky, 1. lékařská fakulta Univerzity Karlovy, Praha
Published in: Klin. Biochem. Metab., 26, 2018, No. 4, p. 151-156
Overview
Oxid uhelnatý (CO) je znám především jako životu nebezpečný produkt nedokonalého spalování organických látek s vysokou afinitou k hemoglobinu. CO je však ve velmi nízkých koncentracích produkován i endogenně, a to při degradaci hemu. Výzkumy z posledních let jasně ukázaly, že CO, podobně jako oxid dusnatý nebo sirovodík, je významnou signální molekulou podílející se na regulaci řady fyziologických i patofyziologických procesů v organismu a lze jej využít terapeuticky. Inhalační podání CO má své limity, proto je snaha vyvinout alternativní způsob jeho doručení do cílových tkání. Jednou z možností jsou molekuly uvolňující oxid uhelnatý, tzv. CORM (carbon monoxide releasing molecules). Tento souhrnný článek se zaměřuje na možnosti využití CO v terapii zánětu a onemocnění jater.
Klíčová slova:
oxid uhelnatý, zánět, CORM, játra.
Metabolismus oxidu uhelnatého
Oxid uhelnatý (CO), bezbarvý plyn bez chuti a zápachu, byl do 90. let minulého století považován pouze za toxický polutant vznikající nedokonalým spalováním sloučenin na bázi uhlíku (dřevo, uhlí, ropa, tabák atd.). Hlavní příčinou jeho toxicity je silná afinita k hemoglobinu, která je 210 – 250x vyšší než u kyslíku. Po inhalaci CO dochází ke vzniku karbonylhemoglobinu (COHb) a následnému snížení arteriálního obsahu a tkáňového parciálního tlaku kyslíku vedoucímu ke tkáňové hypoxii. Otrava CO však působí i přímé buněčné změny řadou dalších mechanismů, mezi které patří například vazba na intracelulární hemoproteiny, tvorba NO a peroxynitritu, lipoperoxidace, mitochondriální oxidační stres, apoptóza a zánětlivé poškození [1]. Průměrné fyziologické koncentrace COHb v krvi jsou dle WHO 0,5-1,5 %, přičemž by neměly překročit 8 % [2]. Toxicita CO však nezáleží pouze na obsahu CO v cirkulaci, ale také na délce expozice, množství hemoglobinu atd. [1].
Ke změně ve vnímání CO došlo v roce 1993, kdy Verma a spol. objevili, že oxid uhelnatý funguje jako neurotransmiter [3]. CO se tak zařadil do skupiny tzv. gasotransmiterů, malých plynných molekul se specifickými signalizačními účinky v organismu, mezi které patří i oxid dusnatý nebo sirovodík. Fakt, že CO by mohl být produkován endogenně, popsal již v roce 1949 Torgny Sjostrand [4]. O necelých dvacet let později Raimo Tenhunenem z laboratoře Rudi Schmida objevil, že CO vzniká během rozkladu hemu v reakci katalyzované mikrozomální hemoxygenasou (HMOX). HMOX je enzym třídy oxidoreduktas, který katalyzuje první a rychlost limitující krok při degradaci hemu. Štěpením hemu na alfa-methinovém můstku dochází k uvolnění CO, železnatého iontu a biliverdinu, který je následně enzymem biliverdinreduktasou přeměňován na bilirubin [5] (obr. 1). Doposud byly popsány dvě katalyticky funkční izoformy HMOX, a to vysoce inducibilní HMOX1 a konstitutivně exprimovaná HMOX2 [6].
Image 1. Heme degradation pathway: Heme oxygenase catalyzes rate limiting step of heme degradation. Oxidative degradation of heme molecule generates equimolar amount of CO, ferrous ion (Fe2+) and biliverdin. Biliverdin is subsequently reduced by biliverdin reductase to bilirubin. The reaction requires 3 molecules of O2 and NADPH:cytochrome P-450 reductase serves as a source of electrons. 
Recentní studie prokázaly, že CO ovlivňuje prostřednictvím vazby na hemové proteiny, především rozpustnou guanylát cyklasu (sGC), cytochromy p450, cytochrom c oxidasu nebo inducibilní NO synthasu, některé intracelulární signalizační dráhy, které vykazují protizánětlivé, antiapoptotické, antiproliferační a antikoagulační působení. Jedním z mechanismů je aktivace sGC, jež za normálních podmínek reguluje produkci oxidu dusnatého. Vazba CO na sGC vede k přeměně GTP na cGMP, který funguje jako druhý posel hrající důležitou úlohu v řadě fyziologických procesů, jako jsou agregace trombocytů, fibrinolýza, regulace buněčného cyklu nebo neurotransmise [7]. Podobně jako oxid dusnatý a sirovodík působí vasodilatačně a udržuje bazální průtok krve orgány [8]. CO však může ovlivňovat řadu signálních kaskád i přímo, například mitogeny aktivované proteinkinasy (MAPK) podílející se mimo jiné na buněčném růstu a regulaci zánětlivé odpovědi [7] (obr. 2). Dalším z klíčových cílů působení CO jsou např. mitochondrie, buněčné organely zodpovědné za energetický metabolismus buňky. V závislosti na koncentraci může CO měnit mitochondriální membránový potenciál, tvorbu mitochondriálních kyslíkových reaktivních částic, uvolňování prozánětlivých a proapoptotických mediátorů nebo stejně jako oxid dusnatý a při vyšších koncentracích sirovodík inhibovat buněčnou respiraci vazbou na cytochrom c oxidasu [8, 9].
Image 2. CO: mechanism of action and molecular targets. CO, produced endogenously or delivered exogenously, modulates aggregation and apoptotic, inflammatory, proliferative, vasodilatory, and other cellular functions. Proteins with heme moiety as a soluble guanylate cyclase (sGC), cytochromes p450, cytochrome-c-oxidase, inducible NO synthase of NADPH oxidase are primary targets for CO. CO affects also transcription factors (Bach 1, 2; HIF1α) or mitogen-activated protein kinases (MAPK); HIF1α - hypoxia-inducible factor 1-α, Akt - transcription factor, Pl3K - phosphatidylinositol-4,5-bisphosphate 3-kinase, HSF1 – heat shock factor 1, HSP 70 – heat shock protein 70, Nf-κB - nuclear factor kappa-light-chain-enhancer of activated B cells, IL-1β – interleukin 1 β, IL-6 – interleukin 6, IL-10 – interleukin 10, PPARγ - peroxisome proliferator-activated receptor γ, EGR1 - early growth response protein 1 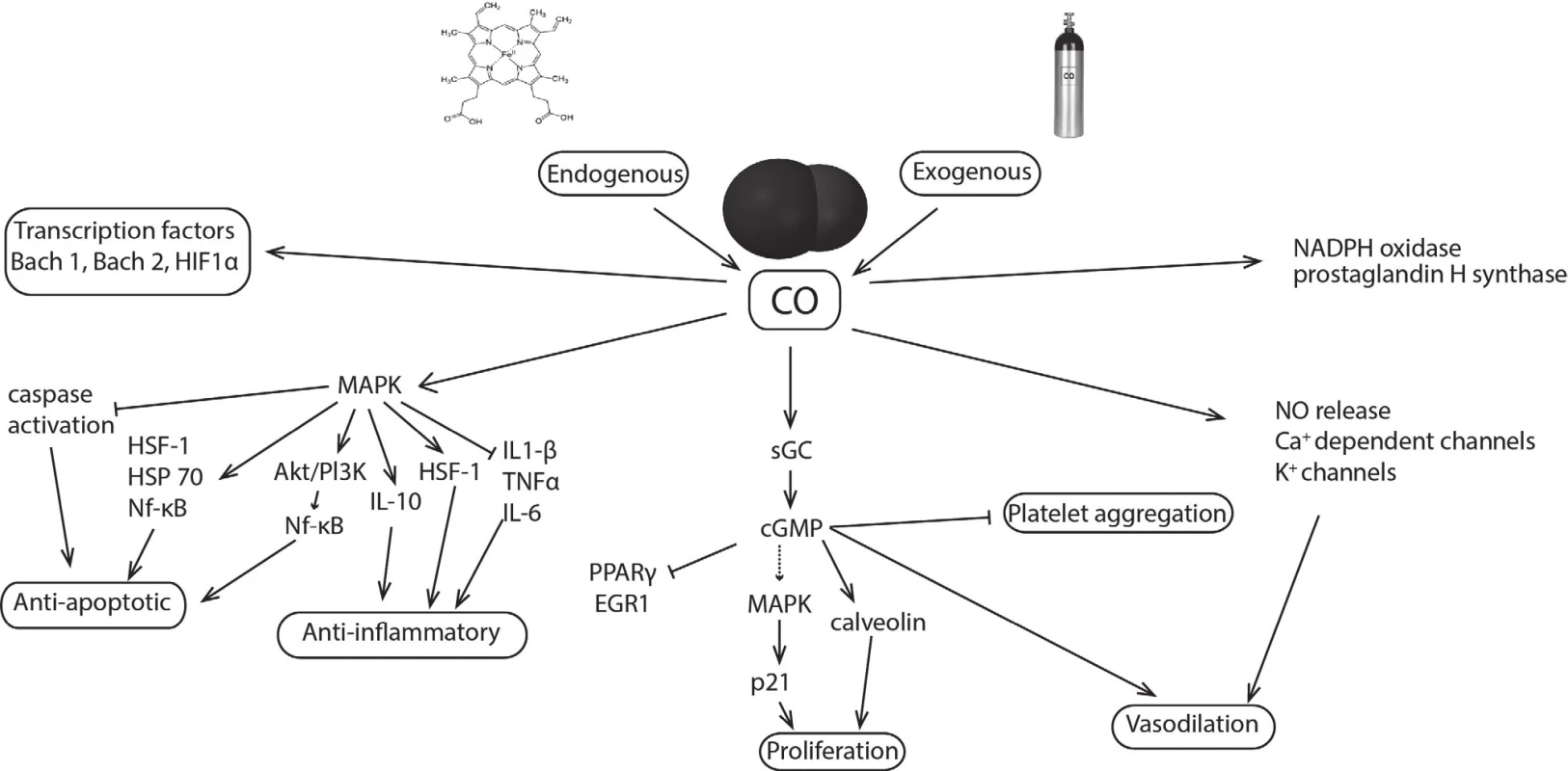
Protizánětlivé účinky CO
Mechanismy doprovázející zánětlivou odpověď zahrnují celou řadu buněčných typů, signalizačních drah a transkripčních faktorů [10]. Důležitou funkci zde hraje i enzym HMOX1. Poprvé popsal roli HMOX1 v zánětu ve své práci Willis et al., který zjistil, že zvýšení exprese HMOX1 vede k potlačení zánětlivé odpovědi, zatímco její inhibice zánětlivou odpověď potencuje [11]. Protizánětlivé účinky byly popsány u produktů HMOX reakce, a to jak biliverdinu a bilirubinu, tak CO. Jeden z mechanismů, kterým se CO podílí na protizánětlivé odpovědi, popsal ve své práci Leo Otterbein na modelu sepse u myších makrofágů [12]. Exogenní podávání CO vedlo k potlačení exprese prozánětlivých cytokinů (TNFα, IL-1β apod.) a zároveň zvýšení exprese protizánětlivého cytokinu IL-10. Tyto účinky byly zprostředkovány přes MAP kinasovou signalizační dráhu, konkrétně přes MKK/p38 MAPK. Přesný mechanismus, kterým CO moduluje tuto dráhu, však dosud není znám. Mezi MAP kinasami doposud nebyl nalezen žádný protein, který by obsahoval hemovou strukturu, na kterou se běžně CO váže [13].
Nepostradatelnou roli v protizánětlivé funkci CO hraje rovněž Nrf2 (nuclear factor erythroid 2 - related factor 2). Jak ukázala čínská studie Qin et al. na Nrf2 deficientních myších, exogenní aplikace CO snížila expresi prozánětlivých cytokinů a mortalitu u LPS-indukované sepse pouze u myší s aktivním Nrf2 faktorem [14].
Výsledky řady studií naznačují, že by CO mohl vykazovat imunomodulační účinky, a to díky schopnosti ovlivňovat funkci CD4+CD25+ regulačních T buněk (Treg). Treg jsou populací CD4+CD25+Foxp3+ T lymfocytů, hrají významnou roli v regulaci imunitní odpovědi a podílejí se na regulaci imunitní homeostázy a prevenci rozvoje autoimunitních reakcí. Vznik, vývoj a správné fungování Treg jsou závislé na expresi transkripčního faktoru Foxp3 [15]. Indukce HMOX1 je spojována se zvýšenou produkcí CD4+CD25+ Treg buněk a zároveň s potlačením zánětlivé odpovědi v dýchacím systému u alergiků [16].
HMOX1/CO dráha rovněž prokazatelně mění rovnováhu exprese prozánětlivých a protizánětlivých cytokinů ve střevě. U modelu chronického střevního zánětu u myší dochází vlivem zvýšených hladin interferonu-γ k poškození střevní sliznice a také ke snížení exprese HMOX1 v makrofázích. Aplikace CO inhibuje produkci interferonu-γ, normalizuje expresi HMOX1 a snižuje závažnost poškození střeva [17].
Hepatoprotektivní účinky CO
CO se významným způsobem podílí na funkci jater a jejich ochraně a hraje důležitou roli jak při fyziologickém jaterním metabolismu, tak i patologických procesech. CO funguje jako regulátor kontraktility žlučových kanálků [18], ovlivňuje jaterní perfuzi [19] a je nezastupitelným faktorem pro udržení rovnováhy mezi sinusoidálním a biliárním transportem v hepatocytu [20]. Zároveň stimuluje MRP2-dependentní exkreci bilirubinu do žluče přímým ovlivněním K+ kanálů [21].
Jednou z hlavních příčin chronických jaterních onemocnění je alkoholové poškození jater. Jeho hlavními znaky jsou zánět a hepatocelulární poškození. CO díky svým protizánětlivým účinkům redukuje produkci prozánětlivých cytokinů na úrovni Kupfferových buněk a zároveň chrání jaterní buňky před apoptózou. Hepatocyty jsou během expozice ethanolu senzitivní na apoptózu indukovanou TNFα. Díky působení CO jsou následky působení alkoholu zmírněny. Jedním z mechanismů je aktivace NF-κB a následná exprese NF-κB dependentních antiapoptotických genů [22].
CO jsou připisovány rovněž anticholestatické účinky. Naše skupina prokázala protektivní účinek CO u cholestázy indukované lipopolysacharidem u potkanů. Inhalace 250 ppm CO po dobu jedné hodiny před aplikací LPS měla za následek snížení sérových cholestatických markerů, snížení exprese prozánětlivého cytokinu TNFα, zvýšení protizánětlivého IL-10 a zároveň zabránila snížení exprese klíčových jaterních transportérů (Slc10a1, Abcb11 a Abcc2) [23].
Jednou z dalších možných aplikací CO u jaterních onemocnění je terapie nealkoholické steatohepatitidy (NASH). Inhalace 250 ppm CO po dobu dvou hodin denně indukovala expresi sestrinu-2, který zvýšil aktivaci autofágů a snížil intrahepatální akumulaci lipidů a stupeň zánětu u myší s NASH [24]. Recentní studie rovněž poukazují na možnou úlohu CO u metabolického syndromu. Ve studii na myších, kterým byla podávána vysokotuková dieta, zvýšila inhalace CO expresi růstového faktoru fibroblastů (FGF21), významného endogenního hormonu, který se podílí na regulaci glukózové homeostázy. Zároveň bylo pozorováno zlepšení stupně jaterní steatózy, snížení inzulinové rezistence a hladiny triacylglycerolů v séru [25].
Molekuly uvolňující oxid uhelnatý
Biologické účinky oxidu uhelnatého jsou studovány od roku 1993 zejména s využitím inhalačního podání plynného CO. Nicméně po inhalaci je většina CO navázána na hemoglobin, což přináší z hlediska terapie značná rizika a zároveň se do cílových tkání dostane pouze zlomek inhalovaného CO [23]. Proto se hledaly cesty, jak dopravovat CO do tkání takovým způsobem, aby se snížila jeho vazba na hemoglobin, a tak se zabránilo tkáňové hypoxii a dalším vedlejším účinkům. Inspirací pro tento výzkum byla plynná molekula oxidu dusnatého a její aplikace ve formě nitroglycerinu. Alternativou pro využití plynného CO jsou tzv. molekuly uvolňující oxid uhelnatý (CO-releasing molecules, CORM) (Tabulka 1), které jsou v posledních letech vyvíjeny jako experimentální terapeutika. Jejich hlavní výhodou je, že dokáží cíleně dopravit CO přímo do tkání, a tím snížit jeho vazbu na hemoglobin.
Table 1. Carbon monoxide releasing molecules (CORMs) 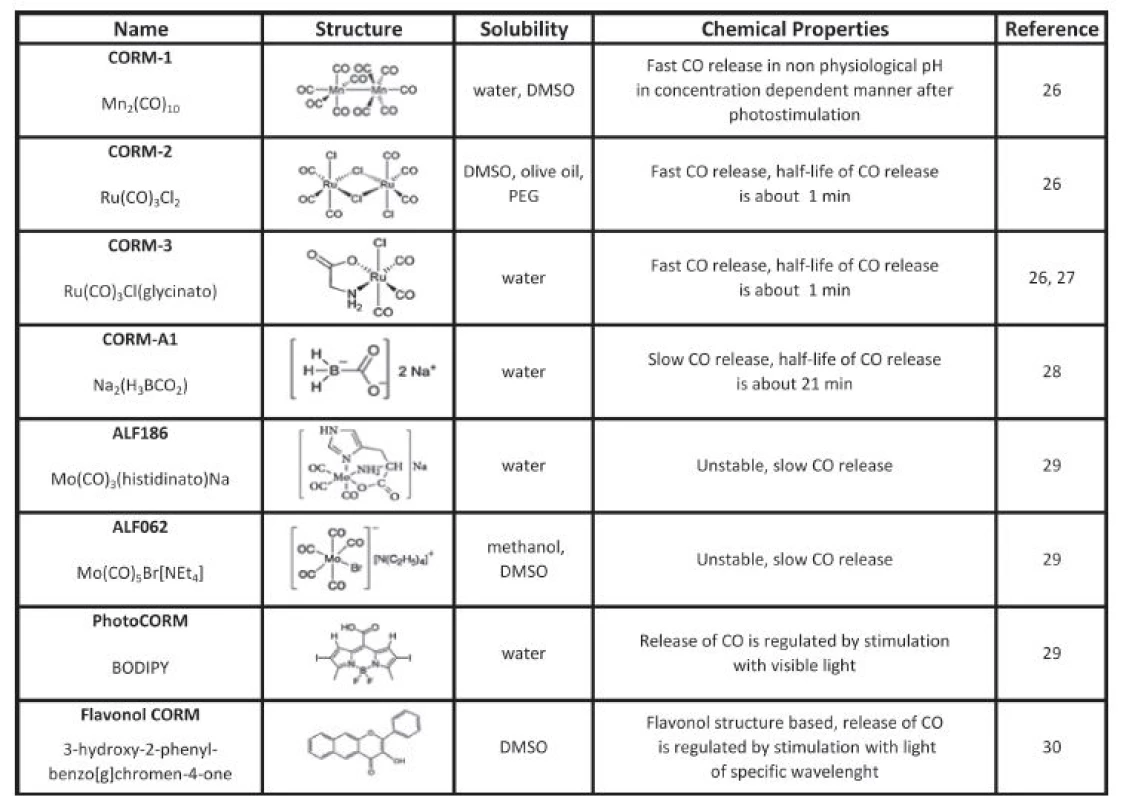
Prvním syntetizovaným CORM byl dekakarbonyl manganatý (CORM-1). Jeho nevýhodou byla ale nutnost stimulace světlem a nefyziologické pH pro uvolnění CO. Prvními CORM uvolňujícími CO při fyziologickém pH byly molekuly na bázi ruthenia, a to CORM-2 a CORM-3 [26, 27]. Zatímco CORM-2 má hydrofobní páteř, CORM-3 je ve vodě rozpustný a uvolňuje CO ve tkáních s poločasem rozpadu do 1 minuty. Později byl vyroben ve vodě rozpustný CORM-A1 na bázi bóru, který uvolňuje CO po změně pH s poločasem 21 minut a částečně tak simuluje inhalační podání [28].
Několik let po prvních sloučeninách byly syntetizovány CORM na bázi molybdenu (ALF186 a ALF 062). Vykazovaly nižší toxicitu a delší poločas v aerobních i anaerobních podmínkách. Nevýhodou byla značná produkce COHb, nerozpustnost ve vodě a nestabilita [29]. Jako velice zajímavá se jeví nová generace CORM bez přechodných kovů, které jsou založeny například na bázi bóru, tzv. BODIPY. Tyto molekuly se aktivují světlem v blízké infračervené oblasti procházejícím biologickými tkáněmi. Fluorescenční povaha těchto molekul umožňuje simultánní in vivo zobrazování pro studium lokalizace působení. Hlavní výhodou těchto BODIPY molekul je možnost ovlivnění jejich fyzikálně chemických vlastností pomocí modifikace struktur, a tím dosažení lepších optických vlastností a rozpustnosti ve vodě a zároveň možnost regulace uvolňování CO pomocí světla [30]. Nedávno publikovala skupina ze Spojených států novou verzi CORM na bázi flavonolu uvolňující CO po aktivaci viditelným světlem [31]. Výhodou flavonoidních sloučenin je jejich schopnost ovlivnit metabolismus bilirubinu a antioxidační působení [32]. Výzkum vlastností této molekuly je sice pouze v začátcích, nicméně molekula, která v sobě kombinuje vlastnosti flavonoidních sloučenin a zároveň uvolňuje CO, bude zcela jistě zajímavým nástrojem pro terapii řady onemocnění asociovaných s oxidačním stresem [31, 32].
Terapeutické využití CO
Přesvědčivé výsledky studií poukazujících na důležitou roli CO v regulaci klíčových intracelulárních signalizačních kaskád vedly vědce k úvahám o možném využití této molekuly v klinické praxi. Jak bylo ukázáno výše, CO prokázal své protektivní vlastnosti zejména při studiu terapie systémového zánětu, jaterních a zánětlivých střevních onemocnění, ale například i u nádorového bujení [8] nebo u ischemicko – reperfúzního poškození tkání a transplantací orgánů [33]. Proto je zde snaha posunout terapeutické využití inhalace CO směrem ke klinické praxi. Předchozí klinické studie prokázaly relativní bezpečnost inhalace nízkých koncentrací CO u lidí. V randomizované, dvojitě zaslepené placebem kontrolované studii byla zdravým dobrovolníkům navozena endotoxemie aplikací 2 ng/kg LPS. Následně inhalovali 500 ppm CO po dobu jedné hodiny. Za těchto podmínek nedošlo k modulaci zánětlivé odpovědi pomocí CO, ovšem nebyly zároveň pozorovány žádné nežádoucí účinky spojené s inhalací CO [34]. Další klinická studie fáze IIa zkoumala bezpečnost inhalace CO u pacientů s chronickou obstrukční plicní nemocí. U této skupiny pacientů nebyly pozorovány žádné vedlejší účinky terapie CO, naopak bylo prokázáno zlepšení odpovědi na léčbu metacholinem a trend redukce eosinofilů ve sputu [35]. Aktuálně probíhá ve Spojených státech studie zaměřená na bezpečnost použití CO pro terapii akutní respirační insuficience (NCT02425579). Obecným výstupem dosud ukončených studií (fáze I a II) je bezpečnost inhalace CO jakožto terapeutického prostředku.
Závěr
CO je významná signální molekula hrající důležitou roli v regulaci řady fyziologických a patofyziologických dějů. Výsledky studií z posledních let ukazují, že nejvyšší potenciál pro využití CO je u terapie zánětu a onemocnění asociovaných s oxidačním stresem. Léčba pomocí CO potlačuje v buňkách prozánětlivou odpověď a zároveň zvyšuje protizánětlivý IL-10. Nezanedbatelná je rovněž jeho hepatoprotektivní úloha. CO se za fyziologických podmínek podílí na regulaci kontraktility žlučových kanálků a jaterní perfuze. Z farmakoterapeu-tického pohledu je aktuálně k dispozici pouze inhalační léčba, ta má ovšem řadu limitací včetně nerovnoměrné distribuce v organismu. Cílené doručení do specifických tkání by signifikantně zvýšilo terapeutický potenciál CO a napomohlo k lepší modulaci patologických stavů. Nové CORM jsou stále ve vývoji a je pouze otázkou času, kdy přijde taková molekula, která bude splňovat přísná kritéria pro možné využití v humánní medicíně.
Střet zájmů: autoři prohlašují, že nejsou ve střetu zájmů.
Práce byla podpořena granty Univerzity Karlovy GAUK 337817 a Grantové agentury České republiky GAČR 16-06008S.
Do redakce došlo: 10. 8. 2018
Adresa pro korespondenci:
MUDr. Lucie Muchová, Ph.D.
Laboratoř pro výzkum nemocí jater a metabolismu hemu
Ústav lékařské biochemie a laboratorní diagnostiky
1. LF UK
Na Bojišti 3
121 08 Praha 2
Sources
1. Ryter, S. W., Otterbein, L. E. Carbon monoxide in bio-logy and medicine. Bioessays, 2004, vol. 26, p. 270–280.
2. WHO | Environmental Health Criteria 213: Carbon Monoxide (second edition). WHO | World Health Organization [online]. Copyright © [cit. 04.07.2018]. Dostupné z: http://www.who.int/ipcs/publications/ehc/ehc_213/en/
3. Verma, A., Hirsch, D. J., Glatt, C. E., Ronnett, G. V., Snyder, S. H. Carbon monoxide: a putative neural messenger. Science, 1993, vol. 259, no. 5093, p. 381–384.
4. Sjöstrand, T. Endogenous Formation of Carbon Mono-xide in Man Under Normal and Pathological Conditions. Scand. J. Clin. Lab. Invest., 1949, vol. 1, no. 3, p. 201–214.
5. Tenhunen, R., Marver, H. S., Schmid, R. The enzymatic conversion of heme to bilirubin by microsomal heme oxygenase. Proc. Natl. Acad. Sci. U.S.A., 1968, vol. 61, no. 2, p. 748–755.
6. Maines, M. D. Heme oxygenase: function, multiplicity, regulatory mechanisms, and clinical applications. FASEB J., 1988, vol. 2, no. 10, p. 2557–2568.
7. Ryter, S. W., Alam, J., Choi, A. M. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications. Physiol. Rev., 2006, vol. 86, no. 2, p. 583–650.
8. Szabo, C. Gasotransmitters in cancer: from pathophysio-logy to experimental therapy. Nat. Rev. Drug Discov., 2016, vol. 15, no. 3, p. 185–203.
9. Chance, B., Erecinska, M., Wagner, M. Mitochondrial responses to carbon monoxide toxicity. Ann. N.Y. Acad. Sci., 1970, vol. 174, no. 1, p. 193–204.
10. Hansson, G. K. Inflammation, atherosclerosis, and coro-nary artery disease. N. Engl. J. Med., 2005, vol. 352, no. 16, p. 1685–1695.
11. Willis, D., Moore, A. R., Frederick, R., Willoughby, D. A. Heme oxygenase: a novel target for the modulation of inflammatory response. Nat. Med., 1996, vol. 2, no. 1, p. 87–91.
12. Otterbein, L. E., Bach, F. H., Alam, J. et al. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway. Nat. Med., 2000, vol. 6, no. 4, p. 422–430.
13. Otterbein, L. E. Carbon monoxide: innovative anti-inflammatory properties of an age-old gas molecule. Antioxid. Redox Signal., 2002, vol. 4, no. 2, p. 309–319.
14. Qin, S., Du, R., Yin, S., Liu, X., Xu, G., Cao, W. Nrf2 is essential for the anti-inflammatory effect of carbon monoxide in LPS-induced inflammation. Inflamm. Res., 2015, vol. 64, no. 7, p. 537–548.
15. Bach, J. F. Regulatory lymphocytes: regulatory T cells under scrutiny. Nat. Rev. Immunol., 2003, vol. 3, no. 3, p. 189–195.
16. Xia, Z. W., Xu, L., Zhong, W. W. et al. Heme oxyge-nase-1 attenuates ovalbumin-induced airway inflammation by up-regulation of Foxp3 T-regulatory cells, interleukin-10, and membrane-bound transforming growth factor-β1. Am. J. Pathol., 2007, vol. 171, no. 6, p. 1904–1914.
17. Sheikh, S. Z., Hegazi, R. A., Kobayashi, T. et al. An anti-inflammatory role for carbon monoxide and heme oxygenase-1 in chronic Th2-mediated murine colitis. J. Immunol., 2011, vol. 186, no. 9, p. 5506–5513.
18. Suematsu, M., Goda, N., Sano, T. et al. Carbon mo-noxide: an endogenous modulator of sinusoidal tone in the perfused rat liver. J. Clin. Invest., 1995, vol. 96, no. 5, p. 2431–2437.
19. Suematsu, M., Kashiwagi, S., Sano, T., Goda, N., Shinoda, Y., Ishimura, Y. Carbon monoxide as an endogenous modulator of hepatic vascular perfusion. Biochem. Biophys. Res. Commun., 1994, vol. 205, no. 2, p. 1333–1337.
20. Suematsu, M., Ishimura, Y. The heme oxygenase–carbon monoxide system: u regulator of hepatobiliary function. Hepatology, 2000, vol. 31, no. 1, p. 3–6.
21. Norimizu, S., Kudo, A., Kajimura, M. et al. Carbon monoxide stimulates mrp2-dependent excretion of bilirubin-IXα into bile in the perfused rat liver. Antioxid. Redox Signal., 2003, vol. 5, no. 4, p. 449–456.
22. Bilzer, M., Roggel, F., Gerbes, A. L. Role of Kupffer cells in host defense and liver disease. Liver Int., 2006, vol. 26, no. 10, p. 117–1186.
23. Vanova, K., Suk, J., Petr, T. et al. Protective effects of inhaled carbon monoxide in endotoxin-induced cholestasis is dependent on its kinetics. Biochimie, 2014, vol. 97, p. 173–180.
24. Kim, H. J., Joe, Y., Kim, S. K. et al. Carbon monoxide protects against hepatic steatosis in mice by inducing sestrin-2 via the PERK-eIF2α-ATF4 pathway. Free Radic. Biol. Med., 2017, vol. 110, p. 81–91.
25. Joe, Y., Kim, S. K., Kim, H. J. et al. FGF21 induced by carbon monoxide mediates metabolic homeostasis via the PERK/ATF4 pathway. FASEB J., 2018, vol. 32, no. 5, p. 2630–2643.
26. Motterlini, R., Clark, J. E., ForesiI, R., Sarathchandra, P., Mann, B. E., Grenn, C. J. Carbon monoxide-releasing molecules: characterization of biochemical and vascular activities. Circ. Res., 2002, vol. 90, p. 17–24.
27. Clark, J. E., Naughton, P., Shurey, S. et al. Cardioprotective actions by a water soluble carbon monoxide-releasing molecule. Circ. Res., 2003, vol. 93, p. 2–8.
28. Motterlini, R., Sawle, P., Hammad, J. et al. CORM A1: a new pharmacologically active carbon monoxide-releasing molecule. FASEB J., 2005, vol. 19, p. 284–286.
29. Bannenberg, G. L., Vieira, H. L. Therapeutic applications of the gaseous mediators carbon monoxide and hydrogen sulfide. Expert Opin. Ther. Pat., 2009, vol. 19, p. 663–682.
30. Palao, E., Slanina, T., Muchová, L., Šolomek, T., Vítek, L., Klán P. Transition-metal-free CO-releasing BODIPY derivatives activatable by visible to NIR light as promising bioactive molecules. J. Am. Chem. Soc., 2015, vol. 138, no. 1, p. 126–133.
31. Popova, M., Soboleva, T., Arif, A. M., Berreau, L. M. Properties of a flavonol-based photoCORM in aqueous buffered solutions: influence of metal ions, surfactants and proteins on visible light-induced CO release. RSC Advances, 2017, vol. 7, no. 36, p. 21997–22007.
32. Suk, J., Jasprova, J., Bidermann, D. et al. Milk thistle natural polyphenols increase systemic as well as hepatic concentrations of bilirubin and decrease hepatic lipope-roxidation in mice. In Hepatology, 68th Annual Meeting of the American-Association-for-the-Study-of-Liver-Disea-ses (AASLD) / Liver Meeting; Ed.; 2017; pp 231A–231A.
33. Nakao, A., Choi, A. M., Murase, N.Protective effect of carbon monoxide in transplantation. J. Cell. Mol. Med., 2006, vol. 10, no. 3, p. 650–671.
34. Mayr, F. B., Spiel, A., Leitner, J. et al. Effects of carbon monoxide inhalation during experimental endotoxemia in humans. Am. J. Respir. Crit. Care Med., 2006, vol. 171, p. 354–360.
35. Bathoorn, E., Slebos, D. J., Postma, D. S. et al. Anti-inflammatory effects of inhaled carbon monoxide in 799 patients with COPD: a pilot study. Eur. Respir. J., 2007, vol. 30, p. 1131–1137.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2018 Issue 4-
All articles in this issue
- Biologické účinky oxidu uhelnatého
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Ověření referenčního rozmezí volného trijodtyroninu v séru na analyzátoru Architect ci 16200
- Urolitiáza - efekt terapie indapamidem – kazuistika
- Realimentační syndrom po paleodietě
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Realimentační syndrom po paleodietě
- Urolitiáza - efekt terapie indapamidem – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

