-
Medical journals
- Career
Stanovení železa a mědi v jaterní bioptické tkáni pacientů s různou jaterní patologií: diagnostický význam a vztah k sérovým parametrům železa a mědi.
Authors: M. Dastych 1; M. Číhalová 3; M. Dastych, jr. 2
Authors‘ workplace: Oddělení klinické biochemie FN Brno a Katedra laboratorních metod LF MU 1; Interní gastroenterologická klinika FN Brno a LF MU 2; Ústav patologie FN Brno a LF MU 3
Published in: Klin. Biochem. Metab., 22 (43), 2014, No. 4, p. 184-188
Overview
Cílem naší práce bylo vyhodnotit výsledky kvantitativního stanovení obsahu železa a mědi metodou AAS ve vzorcích jaterní tkáně získaných perkutánní jaterní biopsií v rámci diferenciální diagnostiky nejasných klinických a laboratorních případů hepatopatie, případně pro potvrzení diagnózy hemochromatózy a Wilsonovy choroby.
Pacienti:
Soubor 83 pacientů byl podle histologického nálezu rozdělen do čtyř skupin. Skupina I (normální histologický obraz; n=31), skupina II (chronická hepatitida; n=33), skupina III (cirhóza; n=9), skupina IV (hemochromatóza; n=10) a tři případy Wilsonovy choroby.Výsledky:
Podle očekávání jsme zjistili ve skupině IV (hemochromatóza) signifikantně zvýšený obsah železa v jaterní tkáni (3,73 ± 1,93 mg/g) a koncentraci feritinu v séru (966 ± 560 µg/l); (p < 0,001) spolu se zvýšenou hodnotou saturace transferinu (0,66 ±0,20); (p < 0,05) proti skupině I. Zjistili jsme statisticky významnou korelaci (Pearson) mezi obsahem železa v jaterní tkáni a sérovou koncentrací feritinu (r = 0,6573; p < 0,001) a saturací transferinu (r = 0,6878; p < 0,001).
Obsah mědi v játrech se ve skupině I, II a IV signifikantně nelišil. Signifikantně zvýšenou hodnotu jaterní mědi stejně jako mědi v séru (p < 0,001) jsme zjistili ve skupině pacientů s jaterní cirhózou (skupina III). U tří případů Wilsonovy choroby jsme zjistili typické hodnoty všech sledovaných parametrů. V souvislosti s nálezem zvýšeného obsahu mědi ve skupině III (cirhóza) jsme zaznamenali také signifikantně zvýšenou aktivitu ALP (p < 0,05).Závěr:
Ze sérových parametrů metabolismu železa, které vykazují korelaci s jeho obsahem v játrech, má největší použitelnost feritin a saturace transferinu. Indikaci stanovení obsahu mědi v jaterní tkáni tvoří jednoznačně diagnostika Wilsonovy choroby. Tento postup není nahraditelný histochemickým průkazem mědi v bioptickém vzorku jaterní tkáně. Hodnoty kolem 250 µg/g suché jaterní tkáně je však třeba hodnotit opatrně a myslet i na možné jiné příčiny.Klíčová slova:
železo, měď, jaterní biopsie, feritin, saturace transferinu.Úvod
Železo a měď patří mezi životně důležité esenciální stopové prvky, které plní nesčetné funkce na orgánové, tkáňové, buněčné a molekulární úrovni v organismu. V klinické praxi se setkáváme jak s projevy jejich deficitu, tak i s toxickým působením při jejich nadbytku. Mechanismus toxicity nadbytku železa a mědi při vzniku orgánové dysfunkce spočívá v účinku nadprodukce reaktivních kyslíkových radikálů [1-3].
Kvantitativní stanovení obsahu mědi v sušině jaterní tkáně patří do souboru diagnostických laboratorních markerů Wilsonovy choroby, vedle sérové mědi, ceruloplasminu, vylučování mědi močí a průkazu přítomnosti mutace genu ATP7B na 13. chromozomu [4-9].
Stavy spojené s akumulací železa v jaterní tkáni z různých příčin jsou indikací rovněž k jeho kvantitativnímu stanovení vzhledem ke známému vztahu jeho zvýšeného obsahu k procesu fibrotizace jaterního parenchymu, který často přechází do stadia cirhotické přestavby [10-13].
Jedná se především o různé typy hemochromatózy, ale i o stavy spojené s kumulací železa v organismu z jiných příčin. Mezi nimi dominují hematologické stavy inefektivní hematopoézy a zvláště nutné opakované transfuze krve při onemocnění talasémie major. Přínos stanovení je nejenom diagnostický, ale i prognostický pro odhad rizika vzniku rozvoje jaterní cirhózy [14-16].
I když je většinou považováno kvantitativní stanovení mědi a železa v sušině bioptické jaterní tkáně za „zlatý standard“, jsou zmiňovány i slabiny (invazivnost, bolest, možnost krvácení, reprodukovatelnost hodnot odebraných z různých míst atd.). V této souvislosti jsou zkoumány další méně invazivní diagnostické postupy, jako např. sérové hodnoty parametrů metabolismu mědi a železa nebo kvantifikace obsahu železa v různých orgánech pomocí speciální magnetické rezonance [17-20].
V naší práci uvádíme výsledky rutinního stanovení obsahu mědi a železa ve vzorcích bioptické jaterní tkáně odebrané v rámci diagnostiky nejasných klinických a laboratorních případů hepatopatie, případně pro potvrzení diagnózy v rámci diferenciálně diagnostického procesu.
Vedle histologické klasifikace jsou k dispozici rovněž sérové hodnoty mědi, ceruloplasminu, železa, feritinu a saturace transferinu.
Pacienti, materiál a metody
V předložené práci jsou zpracovány biologické vzorky (bioptická jaterní tkáň a krevní sérum) 38 mužů ve věku 20-60 let a 45 žen ve věku 21-65 let, u kterých byla v letech 2012-2013 provedena diagnostická necílená perkutánní jaterní biopsie s následnou histologickou klasifikací a kvantitativním stanovením obsahu železa a mědi v sušině jaterní tkáně.
Podle histologického nálezu soubor tvořilo 27 pa-cientů (normální histologický obraz; skupina I), 33 pa-cientů (chronická hepatitida; skupina II), 10 pacientů (cirhóza; skupina III); na základě ostatních klinických, laboratorních a genetických vyšetření byla u 10 případů diagnostikována hemochromatóza; skupina IV a u tří případů Wilsonova choroba.
Perkutánní necílená jaterní biopsie pro histologické vyšetření byla provedena standardně setem Hepafix (17G/1,4 mm), B. Braun Germany po znecitlivění kůže v pátém mezižebří. Přibližně 0,5-1,0 cm získaného vzorku jaterní tkáně byl přenesen do předem zvážené skleněné zkumavky připravené pro stopovou analýzu prvků.
Zkumavka s bioptickým vzorkem k vysušení byla zahřáta na 110 °C po dobu 2 hodin a bezprostředně po vychladnutí opět zvážena. Hmotnost vysušeného bioptického vzorku se pohybovala mezi 1,0-3,0 mg. Vzorky s hmotností menší než 1,0 mg nebyly na obsah železa a mědi analyzovány.
K vysušenému vzorku jaterní tkáně bylo přidáno 0,5 ml koncentrované kyseliny dusičné. Mineralizace probíhala 12 hodin při teplotě 60 °C v temperovaném kovovém bloku.
Čirý mineralizát byl před analýzou naředěn 10x pro železo a 3x pro měď ultračistou vodou.
K analýze stopových prvků byla použita metoda atomové absorpční spektrometrie s elektrotermickou atomizací v grafitové kyvetě se Zeemanovou korekcí pozadí (Cu) a s použitím plamenové techniky acetylén/vzduch (Fe) na přístroji AAS SOLAAR, Thermo Elemental. S použitím stejného přístroje byla stanovena koncentrace mědi v séru (AAS; grafitová kyveta).
Správnost stanovení železa a mědi v mineralizovaném bioptickém jaterním vzorku byla ověřena certifikovaným kontrolním materiálem bovinních jater (Standard Reference Material SRM 1577b; bovine liver; National Institute of Standards&Technology).
Pro cílové hodnoty při stanovení mědi 160 µg/g a železa 184 µg/l bylo recovery 98 % a 103 %.
Ceruloplasmin v séru byl stanoven imunonefelometricky na přístroji Immage Beckmann za použití originálního setu Beckman.
Prováděné kontrolní analýzy splňovaly u všech stanovovaných parametrů kriteria interní i externí kontroly kvality platné pro Oddělení klinické biochemie FN Brno, akreditované podle normy ISO 15189; 2013 Českým institutem pro akreditaci.
Studie byla projednána a schválena etickou komisí FN Brno.
Statistické metody
Ke zjištění normality rozložení naměřených hodnot byl použit Kolmogorov-Smirnovův test.
Pro zjištění statistické významnosti (p<0,05) rozdílu průměrů naměřených hodnot v jednotlivých skupinách byl použit Studentův t test.
Korelace hodnot měřených parametrů byla testována pomocí Pearsonovy korelační analýzy.
Statistické testy byly provedeny pomocí statistického softwaru MedCalc verze 12.2.00.
Výsledky
Zjištěné hodnoty obsahu železa a mědi v sušině bioptické jaterní tkáně včetně souvisejících sérových parametrů pacientů skupiny I – IV a tří případů Wilsonovy choroby jsou uvedeny v Tabulce 1.
Table 1. The iron and copper values recorded in the dry bioptic liver tissue plus the associated serum parameters in patients from groups I to IV and the three cases of Wilson disease 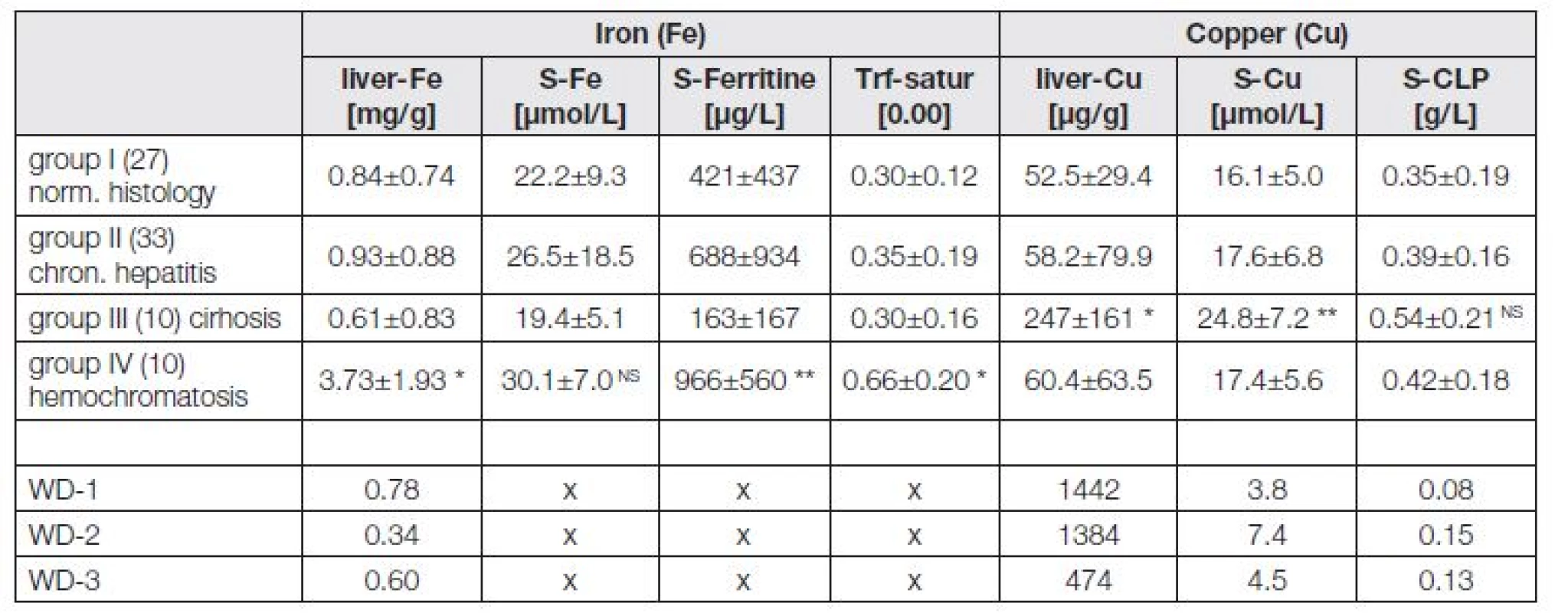
Data are expressed as mean ± SD NS not significant * P<0.001 versus group I * * P<0.05 versus group I WD Wilson´s disease; patiens 1,2,3 CLP ceruloplasmine, Trf-satur Transferin saturation Podle očekávání jsme zjistili ve skupině IV (hemochromatóza) signifikantně zvýšený obsah železa v jaterní tkáni a koncentraci feritinu v séru (p<0,001) spolu se zvýšenou hodnotou saturace transferinu (p<0,05). Koncentrace sérového železa byla u pacientů s hemochromatózou zvýšená pouze nesignifikantně.
Zjistili jsme statisticky významnou korelaci (Pearson) mezi obsahem železa v játerní tkáni a sérovou koncentrací feritinu (r=0,6573; p<0,001) a saturací transferinu (r=0,6878; p<0,001).
Obsah mědi v játrech se ve skupině I, II a IV signifikantně nelišil. Signifikantně zvýšenou hodnotu jaterní mědi, stejně jako mědi v séru (p<0,001), jsme zjistili ve skupině pacientů s jaterní cirhózou (skupina III). Koncentrace ceruloplasminu byla v této skupině zvýšená pouze nesignifikantně.
U tří případů Wilsonovy choroby jsme zjistili typické hodnoty všech sledovaných parametrů. Obsah železa v jaterní tkáni se nelišil od hodnot zjištěných ve skupině I-III. Ostatní hodnoty, související s metabolismem železa, jsme u těchto pacientů neměli k dispozici.
V souvislosti s nálezem zvýšeného obsahu mědi ve skupině III (cirhóza) jsme zaznamenali také signifikantně zvýšenou aktivitu ALP (p<0,05). Nález by mohl dokreslovat proces akumulace mědi v jaterní tkáni pacientů s cirhózou při možné cholestáze.
Diskuse
Histologické vyšetření bioptického vzorku jaterní tkáně získané necílenou jaterní biopsií může přinést cenné informace v diferenciální diagnostice jaterních chorob, zvláště v posouzení přítomnosti a stupně chronické zánětlivé reakce a fibrotického procesu.
Histochemické Pearlsovo barvení na železo poskytuje solidní semikvantitativní informaci o obsahu železa v jaterní tkáni, navíc se schopností určení jeho predilekční lokalizace v hepatocytech, což je typické pro hemochromatózu nebo v Kupferových buňkách např. po opakovaných krevních transfuzích. Mnohem méně spolehlivý je histochemický průkaz mědi v jaterní tkáni [21].
Pro diagnostické a prognosticky cenné kvantitativní stanovení obsahu železa v jaterní tkáni při hemochromatóze a jiných stavech spojených s ukládáním železa v játrech a pro diagnostiku Wilsonovy choroby je vhodné „obětovat“ část získaného bioptického vzorku pro kvantitativní stopovou analýzu těchto prvků [22]. Metoda AAS je použitelná a dostatečně citlivá pro stanovení obsahu železa a mědi, je-li k dispozici alespoň 1 mg vysušené jaterní tkáně.
V literatuře se uvádí, že hodnoty železa v jaterní tkáni přesahující 7 mg/g suché tkáně při hemochromatóze nebo talasémii s opakovanými krevními transfuzemi, jsou spojeny s vysokým rizikem rozvoje fibrotického procesu a vznikem jaterní cirhózy [23].
U žádného našeho pacienta s hemochromatózou a obsahem železa v játrech v rozsahu 2,2-6,3 mg/g suché tkáně nebyly zjištěny známky fibrotické přestavby jaterního parenchymu.
Přestože se při nadbytku železa v organismu jeho největší část ukládá v játrech, existují kritické názory v literatuře o spolehlivosti výpovědi kvantitativního stanovení jeho obsahu v játrech vzhledem k ostatním orgánům např. myokardu, pankreatu apod. Tyto studie vycházejí z použití speciální metody magnetické rezonance, která v mnohých publikacích dokládá použitelné, reprodukovatelné stanovení obsahu železa v různých orgánech těla, které někdy není v plném souladu s hodnotami přímého stanovení železa v bioptickém vzorku [24].
Znalost slabin a možných komplikací relativně invazivní metody perkutánní jaterní biopsie akcentuje snahu o posouzení přínosu a možného klinického využití sérových hodnot parametrů metabolismu železa k odhadu jeho obsahu v játrech [25].
Ze sérových parametrů dominuje feritin, saturace transferinu a v poslední době také tzv. volné, na transferin nevázané, železo (non-transferin-bound iron) [26].
Stanovení feritinu v souvislosti s diagnostikou a monitorováním různých patologických stavů spojených s kumulací železa v organismu, respektive v játrech, je v odborné literatuře věnována značná pozornost. Při jeho interpretaci je však třeba počítat s možností jeho zvýšení nejen v souvislosti s nadbytkem železa v organismu, ale i při chronickém alkoholismu, zánětech, infekcích, malignitě apod. Přesto je považován, zvláště při opakovaném stanovení v čase, za užitečný parametr ukazující na zásoby železa v organismu, diagnostiku a monitorování úspěšnosti léčby různých chorobných stavů spojených se střádáním železa v těle [15-19, 24].
Stanovení obsahu mědi v bioptickém vzorku jaterní tkáně zásadním způsobem doplňuje charakteristický pokles koncentrace ceruloplasminu a zvýšení exkrece mědi močí v kontextu rodinné a osobní anamnézy a ostatních diagnostických projevů různých forem Wilsonovy choroby. I když se hodnoty obsahu mědi v játrech u Wilsonovy choroby pohybují ve stovkách mikrogramů a více, u našich tří pacientů v rozmezí 440-1440 µg/g suché tkáně, může být užívaná cut-off hodnota pro Wilsonovu chorobu >250 µg/g suché tkáně zjištěna i u jiných jaterních patologií spojených s cholestázou [19].
Závěry
Správně indikovaná a lege artis provedená perkutánní jaterní biopsie skýtá možnost kvantitativního stanovení obsahu železa a mědi v jaterní tkáni. Metoda atomové absorpční spektrometrie přináší při zachování všech kautel nutných pro zabezpečení kvality stopové analýzy validní výsledky. Pro spolehlivou analýzu je potřeba minimálně 1 mg suché jaterní tkáně. Histochemické Pearlsovo barvení na železo je pouze semikvantitativní metodou, poskytuje však také informaci o lokalizaci železa v jaterní tkáni (hepatocyty, Kupferovy bb).
Stanovení obsahu železa má diagnostický a prognostický význam zvláště u hemochromatózy a ostatních chorobných stavů spojených s ukládáním železa v játrech (talasémie major, neefektivní hematopoéza, hemolytické stavy, potřeba opakovaných transfuzí krve). Prognóza spočívá v odhadu rizika rozvoje fibrotického procesu při vysokém obsahu železa.
Ze sérových parametrů metabolismu železa, které vykazují korelaci s jeho obsahem v játrech, má největší použitelnost feritin a saturace transferinu.
Indikaci stanovení obsahu mědi v jaterní tkáni tvoří jednoznačně diagnostika Wilsonovy choroby. Tento postup není nahraditelný histochemickým průkazem mědi v bioptickém vzorku jaterní tkáně. Hodnoty kolem 250 µg/g suché jaterní tkáně je však třeba hodnotit opatrně a myslet i na možné jiné příčiny.
Do redakce došlo 13. 6. 2014
Adresa pro korespondenci:
Doc. MUDr. Milan Dastych, CSc., MBA
Odd. klinické biochemie
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: mdast@fnbrno.cz
Sources
1. Britton, R. S. Metal-induced hepatotoxicity. Semin Liver Dis, 1996, 16, p. 3-12
2. Valko, M., Morris, H., Cronin, M. T. Metals, toxicity and oxidative stress. Curr Med Chem, 2005, 12, p. 1161-1208
3. Leterier, M. E., Sánchez-Jofré, S., Peredo-Silva, L., Cortés-Troncoso, J., Aracena-Parks, P. Mechanisms underlying iron and copper ions toxicity in biological systems: Pro-oxidant activity and protein-binding effects. Chem Biol Interact, 2010, 188, p. 220-227
4. Maier, K. P. Rare, but important chronic liver diseases. Praxis (Bern 1994), 2002, 91, p. 2077-2085
5. Smolka, V., Frysák, Z., Kozák, L., Mathonová, J., Jezdinská, V., Novák, Z. et al. The hepatic formo f Wilson´s disease in young patients. Vnitr Lek, 2000, 46, p. 24-29
6. Vrábelová, S., Vánová, P., Kopecková, L., Trunecka, P., Smolka, V., Procházková, D. et al. Molecular analysis of Wilson disease. Cas lek ces, 2002, 141, p. 642-5
7. Prochazkova, D., Pouchla, S., Mejzlík, V., Konecna, P., Michalek, J., Barzosova, D. et al. Wilson´s disease: monocentric experiences over a period of 10 years [corrected]. Klin Pediatr, 2009, 221, p. 419-24
8. El-Youssef, M. Wilson disease. Mayo Clin Proc, 2003, 78, p. 1126-1136
9. Medici, V., Rossaro, L., Sturniolo, G. C. Wilson di-sease - a principal approuch to diagnosis, treatment and folow-up. Dig Liver Dis, 2007; 39, p. 601-609
10. Kanwar, P., Kowdley, K. V. Metal storage disorders: Wilson disease and hemochromatosis. Med Clin North Am 2014, 98, p. 87-102
11. Bassett, M. L., Halliday, J. W., Powell, L. W. Value of hepatic iron measurements in early hemochromatosis and determination of the critical iron level associated with fibrosis. Hepatology, 1986, 6, p.24-29
12. Beutler, E., Hoffbrand, V., Cook, J. D. Iron Deficiency and Overload. Hematology Am Soc Hematol Educ program, 2003, p. 40-61
13. Batts, K. P. Iron overload syndromes and the liver. Mod Pathol, 2007, 20 Suppl 1, p. 31-39
14. Vermylen. Ch. What is new in iron overload?. Eur J Pediatr, 2008; 167, p. 377-381
15. Whittington, C. A., Kowdley, K. V. Review article: haemochromatosis. Aliment Pharmacol Ther, 2002, 16, p. 1963-75
16. Nielsen, P., Bruemmendorf, T. H., Grosse, R., et al. Iron stores in patients with myelodysplasia and aplastic anemia. Blood, 2006, 108, p. 3726
17. Musallam, K. M., Cappellini, M. D., Wood, J. C., et al. Elevated liver iron concentration is a marker of increased morbidity in patients with beta thalassemia intermedia. Haematologica, 2011, 96, p. 1605-1612
18. Kohgo, Y., Ikuta, K., Ohtake, T., Torimoto, Y., Kato, J. Body iron metabolism and pathophysiology of iron overload. Int J Hematol, 2008, 88, p. 7-15
19. Telfer, P. T., Prestcott, E., Holden, S., Walker, M., Hoffbrand, A. V., Wonke, B. Hepatic iron concentration combined with long-term monitoring of serum ferritin to predict complications of iron overload in thalassaemia major. Br J Haematol, 2000, 110, p. 971-977
20. Kolnagou, A., Natsiopoulos, K., Kleanthous, M., Ioannou, A., Kontoghiorghes, G.J. Liver iron and serum ferritin levels are misleading for estimating cardiac, pancreatic, splenic and total body iron load in thalassemia patiens: factors influencing the heterogenic distribution of excess storage iron in organs as identified by MRI T2*. Toxicol Mech Methods, 2013, 23, p. 48-56
21. Kolnagou, A., Yazman, D., Economides, C., Eracleous, E., Kontoghiorghes, G. J. Uses and limitations of serum ferritin, magnetic resonance imaging T2 and T2* in the diagnosis of iron overload and in the ferrikinetics of normalization of the iron stores in thalassemia using the international Committee on Chelation deferiprone/deferoxamine combination protocol. Hemoglobin, 2009, 33, p. 312-322
22. Schwabe, U., Friedrich, K. Significance of the iron and copper content of the liver for the differential dia-gnosis of chronic liver disease. Z Gastroenterol, 1990; 28, p. 353-357
23. Angelucci, E., Muretto, P., Nicolucci, et al. Effects of iron overload and hepatitis C virus positivity in determining progression of liver fibrosis in thalassemia following bone marrow transplantation. Blood, 2002, 100, p. 17-21
24. Kim, M-J., Mitchel, D. G., Ito, K., Hann, H-W. L., Park, Y. N., Kim, P. N. Hepatic iron deposition on MR imaging in patiens with chronic liver disease: correlation with serial serum ferritin concentration. Abdon Imaging, 2001, 26, p. 149-156
25. Van Leeuwen, D. J., Balabaud, C., Crawford, J. M., Bioulac-Sage, P., Dhillon A. A clinical and histopathologic perspective on evolving noninvasive and invasive alternatives for liver biopsy. Clin Gastroenterol Hepatol, 2008, 6, p. 491-496
26. Jakeman, A., Thompson, T., McHattie, J., Lehotay, D. C. Sensitive method for nontransferrin-bound iron quantification by graphite furnace atomic absorption spectrometry. Clin Biochem, 2001, 34, p. 43-47
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2014 Issue 4-
All articles in this issue
- Realimentační syndrom – patobiochemie, iontové dysbalance a jejich korekce
- Harmonizace, standardizace, metrologická návaznost v roce 2014. Princip, význam, data.
- Stanovení železa a mědi v jaterní bioptické tkáni pacientů s různou jaterní patologií: diagnostický význam a vztah k sérovým parametrům železa a mědi.
- Oxidační stres u Alzheimerovy choroby a jeho důsledky
- Chromatografická charakterizace aminokyselinových profilů vzorků moči pacientů s karcinomem prostaty
- Využití proteinových biočipů v diagnostice ischemického poškození myokardu
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Realimentační syndrom – patobiochemie, iontové dysbalance a jejich korekce
- Oxidační stres u Alzheimerovy choroby a jeho důsledky
- Stanovení železa a mědi v jaterní bioptické tkáni pacientů s různou jaterní patologií: diagnostický význam a vztah k sérovým parametrům železa a mědi.
- Harmonizace, standardizace, metrologická návaznost v roce 2014. Princip, význam, data.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

