-
Medical journals
- Career
Management pacientů s asymptomatickými arytmiemi – zkrácený a komentovaný konsenzus Evropské asociace pro srdeční rytmus (EHRA)
Authors: Heinc P.; Hudec Š.; Aiglová R.; Vícha M.; Jelínek L.; Rec L.
Authors‘ workplace: I. interní klinika – kardiologická LF UP a FN Olomouc
Published in: Kardiol Rev Int Med 2019, 21(4): 199-208
Overview
Asymptomatické srdeční arytmie mohou mít reálně horší důsledky než symptomatické arytmie, protože jsou často zjištěny až při závažných zdravotních komplikacích souvisejících s nepoznanou arytmií. V klinické praxi je výskyt asymptomatických arytmií poměrně častý, přitom tyto svým způsobem specifické stavy nemají žádné doporučené postupy pro jejich řešení. Tento přehled shrnuje současné důkazy potřebné k optimálnímu řešení asymptomatických arytmií, pokud tyto existují, a/ nebo uvádí odborný konsensus Evropské asociace srdečního rytmu (EHRA) pro řešení této problematiky, pokud důkazy jsou insuficientní nebo protichůdné.
Klíčová slova:
asymptomatické arytmie – tachykardií indukovaná kardiomyopatie – ektopie – preexcitace – fibrilace síní – bradykardie
Úvod
S výskytem asymptomatických arytmií se v klinické praxi setkáváme poměrně často, přitom studie, které by se specificky zabývaly těmito asymptomatickými arytmiemi, chybí. Určitá část takto náhodně zjištěných arytmií vyžaduje podrobnější diagnostické a prognostické vyhodnocení, event. i léčbu, aby se zabránilo závažnějším komplikacím, jako je cévní mozková příhoda (CMP), systémová embolizace, srdeční selhání (SS) nebo náhlá srdeční smrt (NSS). Asymptomatická fibrilace síní (FS) může vést k CMP, asymptomatické komorové arytmie mohou vést k NSS a všechny formy setrvalejších či recidivujících tachyarytmií, jakéhokoli původu, mohou vést ke zhoršení funkce levé komory (LK).
Vzhledem k tomu, že pohled na asymptomatické arytmie není jasný, iniciovala Evropská asociace srdečního rytmu (European Heart Rhythm Association – EHRA) revizi klinického managementu asymptomatických arytmií. Cílem bylo zrevidovat důkazy pro stratifikaci rizika, farmakologickou a nefarmakologickou léčbu s aproximací důkazů pro asymptomatické arytmie. I přes tuto snahu konečné rozhodnutí o opatřeních, týkajících se asymptomatických arytmií, musí být projednáno s pacientem, s přihlédnutím k jeho individuálním faktorům, preferencím i k potenciálnímu riziku. Toto sdělení EHRA [1] přehledně shrnuje důkazy potřebné ke správnému řešení asymptomatických arytmií, pokud tyto existují, a/ nebo se pokouší dosáhnout odborného konsenzu pro řešení této problematiky, pokud důkazy jsou insuficientní nebo protichůdné. Hodnocení v tomto sdělení není totožné s hodnocením v oficiálních „Doporučeních“, nicméně konsenzuální prohlášení označené jako zelené srdce znamená „mělo by být“ – tedy indikovaný postup nebo léčba jsou založeny alespoň na jedné randomizované studii nebo jsou podloženy silnými observačními důkazy, že takový postup je prospěšný a efektivní. Symbol žlutého srdíčka znamená „může být“ – tedy indikovaný postup nebo léčba jsou podpořeny randomizovanou studií s menším počtem pacientů, nebo výsledky, které nejsou optimální k celoplošnému použití. Symbol červeného srdíčka znamená restrikci či zákaz daného postupu/ léčby na základě vědeckých důkazů o možném poškození pacienta (tab. 1).
Table 1. Vědecké zdůvodnění doporučení vyjádřených barevnou škálou ve tvaru srdce. 
Arytmie a symptomy
Vnímání abnormalit srdečního rytmu je vysoce variabilní. Pokud je arytmie vnímána, pak nejčastějším vjemem jsou palpitace, někteří pacienti však mohou dokumentované arytmie vnímat jako únavu, zkrácení dechu, dušnost, hrudní dyskomfort, závratě nebo synkopu. Pro praxi je důležité zjištění, že u stejného pacienta může být tatáž arytmie za určitých okolností symptomatická, zatímco v ostatním čase je asymptomatická, a opačně jsou důkazy, že v době vnímaných palpitací není přítomna žádná skutečná arytmie [2]. Interindividuálně je zřejmé, že jakýkoli typ arytmie může být u některých pacientů asymptomatický, zatímco u jiných je stejný typ arytmie výrazně symptomatický [3]. Patofyziologický základ rozdílné vnímavosti arytmických příznaků není znám, stejně jako není známo, zda v rozdílné vnímavosti arytmií hrají nějakou roli genetické faktory. Také souvislost mezi symptomy a arytmiemi není zcela jasná. Toto je dáno několika faktory – mnoha studiím chybí systematické hodnocení symptomů, některým studiím chybí přesné hodnocení vztahu symptomů s arytmiemi a placebo efekt či terapeutický efekt není často hodnocen ve vztahu k symptomům, ale pouze k arytmiím. Na vnímání symptomů v přítomnosti arytmie má vliv řada faktorů – typ a místo vzniku arytmie, přítomnost/ nepřítomnost dalších kardiovaskulárních (KV) poruch vedoucích k systolické nebo diastolické dysfunkci. Neexistují však žádná data, která by naznačovala, že síňové tachyarytmie způsobují méně palpitací nebo méně symptomatické palpitace než komorové tachyarytmie, i když komorové tachyarytmie mohou mít větší vliv na krevní tlak (TK) a mohou vést k závažnějším symptomům, jako jsou závratě nebo synkopa. Ke snížení TK a k symptomům přispívá při tachyarytmii zkrácená doba plnění komor v diastole, proto hemodynamika je nejvíce ovlivněna rychlostí arytmie, cirkulujícím objemem krve v době arytmie, funkcí LK a přítomností souběžných komorbidit. Symptomatiku v neposlední řadě ovlivňují i léky, které řada pacientů užívá pro koincidující KV onemocnění a toto lékové ovlivnění symptomatiky může být negativní i pozitivní.
Autonomní nervový systém ovlivňuje rychlost, perzistenci i hemodynamické důsledky arytmie a prostřednictvím těchto mechanizmů rovněž může ovlivnit intenzitu vnímání. Autonomní nervový systém může svými mechanizmy usnadnit vznik poruchy srdečního rytmu [4], proto se sympatická denervace používá k prevenci život ohrožujících tachyarytmií [5].
Co se týká bradyarytmií, tak všeobecně se uznává, že k vyvolání závažných relevantních příznaků jako je synkopa, je třeba sinusové zástavy nebo atrioventrikulární (AV) blokády trvající nejméně 6 – 7 s [6].
Předčasné síňové stahy a nesetrvalé síňové tachyarytmie
Přestože jsou předčasné síňové stahy (PSS) běžné, často nezpůsobují žádné symptomy. Není jasný ani vztah mezi počtem PSS a vnímanými symptomy, nicméně podstatný je význam PSS, ať již jsou symptomatické či ne. Dnes se všeobecně uznává, že přítomnost častých PSS nebo krátkých běhů PSS může být nezávislým prediktorem vývoje síňové tachykardie a/ nebo FS [7 – 10]. Hodnocením rizika výskytu FS, CMP a smrti ve vztahu k četnosti PSS se zabývala studie Biniciho (Copenhagen Holter Study) [7]. V této studii se u jednotlivců středního věku (55 – 75 let) bez známého KV onemocnění vyskytoval nadměrný počet PSS u 15 % jedinců, přitom za nadměrný počet bylo považováno ≥ 30 PSS za hod. Ve sledovaném období (6,3 let) byl nadměrný počet PSS spojen se zvýšeným rizikem úmrtí nebo CMP (p < 0,036) i se zvýšeným počtem hospitalizací pro FS (p < 0,033). Ze stejné studie, ale při delším sledovaném období (14,4 let) [10] vyplynulo, že nadměrný počet PSS byl spojen s 2násobným zvýšením rizika CMP, přitom méně než 15 % pacientů s nadměrným počtem PSS a s CMP mělo diagnostikovánu FS před vznikem CMP. Kromě toho studie zjistila, že roční riziko CMP u pacientů s nadměrným počtem PSS v kombinaci s CHA2DS2 VASc skóre > 2 bylo 2,4 % ročně, což je v podobném rozsahu jako u pacientů s FS a stejným CHA2DS2VASc skóre. Toto podporuje názor, že nadměrný počet PSS může být ve skutečnosti možným náhradním ukazatelem rizika tromboembolizmu. Další studie [9] zjistila, že zdvojnásobení hodinového počtu PSS bylo spojeno se 17% zvýšením rizika FS a s 6% zvýšením celkové úmrtnosti. S těmito zjištěními vyvstává řada dalších otázek. Jednou z nich je, zda pacienty s nadměrným počtem PSS léčit antiarytmicky a/ nebo pomocí katetrové ablace, což by mělo snížit riziko vzniku FS, CMP i úmrtnosti. Další otázkou je, jakou hranici nadměrného počtu PSS pokládat za abnormální, jaká je definice normální každodenní variability PSS a co by mělo být optimálním screeningem. V současné době je zlatým standardem pro hodnocení PSS EKG monitorace po dobu 24 hod (Holter) a za excesivní ektopickou síňovou aktivitu se pokládá > 500 PSS/ 24 hod. Práce Gladstoneho ukázala, že pravděpodobnost FS se zvyšuje s počtem PSS – u pacientů s PSS < 100/ 24 hod činí < 9 %, u pacientů s PSS > 1 500/ 24 hod dosahuje na > 40 %. Další otázkou k řešení je antikoagulační léčba ve smyslu, od jakého počtu PSS by pacient profitoval z této léčby. Management pacientů s asymptomatickými PSS ukazuje tab. 2.
Table 2. Souhlasné prohlášení k problematice asymptomatických síňových předčasných stahů. 
FS – fibrilace síní; SPS – síňové předčasné stahy; KV – kardiovaskulární Asymptomatická komorová preexcitace
Prevalence komorové preexcitace, někdy také označované jako delta vlny na elektrokardiogramu, se odhaduje na 0,1 – 0,3 % [11]. Celoživotní riziko NSS u symptomatického Wolff – Parkinson – White (WPW) syndromu se odhaduje na 3 – 4 % [12], proto symptomatické preexcitace jsou primárně jednoznačně indikovány k elektrofyziologickému vyšetření (EFV) a katetrové ablaci přídatné dráhy. Jedinci s asymptomatickou preexcitací však mají celoživotní riziko NSS 0 – 0,6 % [12,13], proto přístup k těmto jedincům není jasně vyhraněn.
První otázkou je, zda by se mělo primárně stanovit riziko NSS pomocí EFV a u jedinců se zvýšeným rizikem NSS odstranit přídatnou dráhu radiofrekvenční ablací. Metaanalýza, která zahrnovala 20 studií [14], kde bylo 1 869 pacientů s komorovou preexcitací průměrného věku 7 – 43 let, stanovila celkové riziko NSS na 1,25/ 1 000 osoboroků, přitom děti měly riziko NSS vyšší (1,93 vs. 0,86/ 1 000 osoboroků; p = 0,07). Práce, která sledovala pozitivní prediktivní hodnotu EFV zjistila, že tato hodnota je u asymptomatických pacientů velmi nízká [15]. Vzhledem k nízkému výskytu NSS a nízké pozitivní prediktivní hodnotě EFV u asymptomatickým jedinců s komorovou preexcitací je zastáván všeobecný konsenzus proti rutinnímu provádění EFV. Na druhou stranu, vzhledem k velmi nízkému riziku závažných komplikací při provádění ablací přídatných drah, nejnovější pokyny EHRA z roku 2017 říkají, že rizikovou stratifikaci jedinců s asymptomatickou preexcitací pomocí EFV lze zvážit [16]. Je také třeba mít na paměti, že přítomnost asymptomatické preexcitace vylučuje/ limituje provozování vrcholového sportu či některá povolání (piloti, řidiči hromadných dopravních prostředků, hasiči, ozbrojené složky aj.).
Primární hodnocení pacienta se záchytem asymptomatické preexcitace by mělo zahrnovat zátěžový test a 24hod monitoraci EKG, kde se sleduje chování preexcitace. Pokud preexcitace mizí se zvyšující se frekvencí při zátěži, nebo je intermitentní při ambulantní monitoraci, svědčí to o dlouhé efektivní refrakterní periodě (ERP) přídatné dráhy a takový pacient má velmi nízké riziko NSS. Na druhou stranu, vysoké riziko NSS mají pacienti s komorovou preexcitací, kteří jsou mladého věku, u nichž je vyvolatelná AV reentry tachykardie (AVRT) při EFV, u nichž byla při EFV zjištěna krátká antegrádní ERP přídatné dráhy (≤ 250 ms) a/ nebo je při EFV zjištěno více přídatných drah [17,18]. Management pacientů s asymptomatickou komorovou preexcitací ukazuje tab. 3.
Table 3. Souhlasné prohlášení k problematice asymptomatické komorové preexcitace. 
FS – fibrilace síní; AVRT – atrioventrikulární reentry tachykardie; EFV – elektrofyziologické vyšetření; ERP – efektivní refrakterní perioda. Fibrilace síní a flutter síní
Za asymptomatickou FS se pokládá náhodně zjištěná FS na povrchovém EKG, trvající > 30 s [19,20]. Podezření na asymptomatickou FS vzniká nejčastěji při náhodném klinickém vyšetření, při screeningu nebo z výpisu implantovaných přístrojů, které poskytují nepřetržité monitorování EKG [21] a pozoruje se častěji u neparoxysmálních forem, ve vyšším věku a u mužského pohlaví [22]. Je třeba vědět, že symptomatičtí pacienti s FS mají také asymptomatické epizody, což se týká často pacientů po provedené ablaci FS [23]. Dostupná data také ukazují, že asymptomatická FS vede k méně příznivé prognóze s větší morbiditou a mortalitou než symptomatická FS [22], což je dáno tromboembolickým rizikem s pozdějším terapeutickým zásahem. Vzrůstající arytmická zátěž (od paroxysmální k permanentní) v důsledku FS je spojena se zvýšeným rizikem CMP, SS, zhoršení kognitivních funkcí i mortality, přitom asymptomatická FS je nezávisle spojena s větší progresí těchto rizik než symptomatická FS [24,25]. Při sledování paroxysmální/ perzistentní formy asymptomatické FS, tato přejde do 10 let od detekce do permanentní formy u 50 % pacientů [25]. S větší dostupností monitorovacích a screeningových metod narůstá záchyt paroxysmálních forem FS u asymptomatických jedinců [19], kteří tak mohou ze správného managementu výrazně profitovat.
Léčba asymptomatických pacientů s FS by tedy měla být přinejmenším stejná jako u symptomatických pacientů [20]. Antikoagulační léčba se musí přísně řídit stanovením rizika tromboembolizmu na základě CHA2DS2 VASc skóre, stejně tak maximální léčebná pozornost musí být věnována k KV i dalším komorbiditám, aby komplexní léčba vedla k maximálnímu snížení arytmické zátěže, a tím k minimalizaci rizika rozvoje tachykardické kardiomyopatie. Úspěšná ablace FS snižuje KV riziko i mortalitu, nicméně i přesto se nedoporučuje, aby ablace FS byla indikována z důvodu možného vysazení dlouhodobé antikoagulační léčby [20]. Po provedené ablaci FS se doporučuje pokračovat v antikoagulační léčbě dle rizikové stratifikace dle CHA2DS2VASc skóre právě proto, že asymptomatické epizody FS bývají po ablaci velmi časté [26].
Zda asymptomatičtí pacienti s FS mohou profitovat z ablace FS, event. v jaké míře, bude třeba teprve stanovit. Sdělení informace o náhodně zjištěné FS může u vnímavých pacientů vyvolat příznaky z povědomí o ne zcela fyziologickém srdečním stavu [27] a dokonce i nezdařená ablace FS může mít negativní účinek ve smyslu placebo efektu s vnímáním nových symptomů, které před ablací nebyly [28]. Úspěšná elektrická kardioverze může demaskovat pseudoasymptomatické pacienty, kteří se podvědomě adaptovali na FS omezením jejich životního stylu [27]. U těchto pacientů, event. i v řadě dalších, skutečně asymptomatických případů, lze po úspěšné kardioverzi zvážit antiarytmickou medikaci s udržením sinusového rytmu před primární indikací ablace. Pseudoasymptomatičtí pacienti mohou vnímat symptomatické zlepšení po úspěšné ablaci FS, ale neúspěšná ablace FS může změnit skutečně asymptomatické pacienty na symptomatické v důsledku vzniku síňových tachyarytmií způsobených vlastním intervenčním zákrokem (cca 30 %) [28]. Při indikaci ablace FS u asymptomatických pacientů se musí zvažovat nejen potenciální přínos ablace a riziko závažných komplikací souvisejících s výkonem (≤ 4 %), ale také léčebné preference pacienta po podrobné edukaci. Ablace FS u asymptomatických pacientů se zvažuje především u mladších pacientů s paroxysmální nebo perzistentní formou. Stejný management jako u FS se doporučuje také u asymptomatického flutteru síní II. typu, vč. antikoagulační léčby i když riziko tromboembolizace se uvádí o něco nižší [26]. Management pacientů s asymptomatickou FS ukazuje tab. 4.
Table 4. Souhlasné prohlášení k problematice asymptomatické fibrilace síní. 
FS – fibrilace síní; AV – atrioventrikulární; CMP – cévní mozková příhoda Epizody tachykardií s vysokou síňovou frekvencí
Epizody tachykardií s vysokou síňovou frekvencí (atrial high-rate episodes – AHRE) se někdy nazývají subklinické FS, ale od symptomatických nebo asymptomatických FS se zásadně liší. AHRE byly definovány jako epizody síňové frekvence > 180/ min, trvající alespoň 5 min, detekované nepřetržitým sledováním pomocí srdečních implantabilních elektronických přístrojů (CIED) [6], zatímco FS je definována jako epizoda trvající alespoň 30 s, s nepravidelnými intervaly R-R („absolutní arytmie“), bez rozpoznatelných, morfologicky odlišných P vln na 12svodovém EKG [20]. Asymptomatická FS může být tedy diagnostikována na základě jakéhokoli záznamového EKG dokumentu, zatímco AHRE jsou diagnostikovány pouze u pacientů s CIED.
U pacientů s AHRE je riziko rozvoje zjevné FS 5,6× vyšší a riziko tromboembolizace 2,5× vyšší než u pacientů bez AHRE [29], přitom epizody AHRE delší jak 24 hod byly spojeny s vyšším rizikem tromboembolizace. Na druhou stranu toto zvýšené tromboembolizační riziko, stratifikované dle CHADS2 skóre, je menší než u pacientů se srovnatelným CHADS2 skóre při zjevné FS. V jediné studii hodnotící antikoagulační léčbu u pacientů s AHRE se ukázalo, že časné zahájení a přerušení antikoagulační léčby na podkladě dálkové monitorace CIED nemá žádný vliv na výskyt embolizačních příhod, krvácivých příhod a ani na mortalitu [30]. Z dosavadních studií není zatím zřejmé, do jaké míry lze AHRE považovat za časnou fázi FS a neexistují zatím žádná data, která by naznačovala, zda antikoagulace u krátkých AHRE je prospěšná nebo ne. Bude třeba dalších studií, které by stanovily přesnou míru arytmické zátěže detekované implantabilními přístroji pro indikaci antitrombotické terapie v prevenci CMP. Asymptomatičtí pacienti s AHRE rovněž nejsou indikováni k žádné antiarytmické strategii kontroly rytmu (antiarytmika či ablace). Management pacientů s asymptomatickými AHRE ukazuje tab. 5.
Table 5. Souhlasné prohlášení k problematice AHRE. 
AHRE – epizody tachykardií s vysokou síňovou frekvencí; FS – fibrilace síní; AV – atrioventrikulární; CMP – cévní mozková příhoda Předčasné komorové stahy
Izolované komorové předčasné stahy (KPS) se vyskytují v určitém množství u většiny zdravých mladých jedinců. Většinou jsou výsledkem fokální aktivity, méně často jsou způsobeny tzv. mikro re-entry mechanizmem. Vyšší množství KPS však může být známkou přítomnosti abnormálního srdečního substrátu, který je výsledkem základní elektrické, ischemické nebo strukturální změny, vedoucí k zvýšené automacii (např. v chronicky ischemické tkáni) a tato dále spouští ektopickou aktivitu nebo mikro re-entry mechanizmy. U asymptomatických pacientů s KPS je základní srdeční onemocnění prognosticky nepříznivým markerem. Závažnější charakteristika KPS, jako je větší četnost, komplexicita (kuplety, triplety, nesetrvalé běhy), multifokální původ a/ nebo zvýšená četnost při zátěži, by měla být varovným signálem pro potenciální možnost elektrického, ischemického nebo strukturálního poškození, které může vést ke vzniku maligních komorových arytmií a/ nebo k NSS (tab. 6) [31,32]. I v nepřítomnosti základního srdečního onemocnění je závažnější charakteristika KPS ukazatelem celkové i KV úmrtnosti, proto při nálezu četnější ektopie by měla být provedena další vyšetření k vyloučení strukturálního onemocnění srdce (SOS), aniž by existovala nějaká hodnota počtu KPS, která by indikovala tato vyšetření.
Table 6. Faktory, které mohou ukazovat na horší prognózu pacientů s KPS. 
KPS – komorové předčasné stahy; NSKT – nesetrvalá komorová tachykardie; KT – komorová tachykardie Důležitou roli hraje morfologie KPS, kde při monofokální morfologii je původ ektopie často ve výtokovém traktu pravé komory nebo LK (inferiorní osa s vysokou voltáží ve svodech z dolních končetin – obvykle součet amplitud QRS komplexů ze svodů II, III a aVF > 4,5 mV). Tato komorová ektopie je považována za benigní i když v ojedinělých případech může být podkladem arytmogenní pravokomorová kardiomyopatie (arrhytmogenic right ventricular cardiomyopathy – ARVC) [33]. Jiná, méně obvyklá místa vzniku benigních unifokálních KPS jsou lokalizována kolem mitrálního nebo trikuspidálního prstence. Tyto KPS mají striktně superiorní osu s obrazem QRS tvaru blokády levého nebo pravého Tawarova raménka. Unifokální morfologie KPS v nepřítomnosti SOS ukazuje na benigní formu KPS. SOS můžeme vyloučit echokardiografickým vyšetřením a magnetickou rezonancí.
V ojedinělých případech mohou sice tyto „benigní“ KPS vyvolat maligní polymorfní komorovou tachykardii (KT) nebo fibrilaci komor (FK), ale k této situaci většinou dochází, pokud KPS mají krátký vazebný interval, takže nasedají na T vlnu a současně je přítomna ischemie, elektrolytová dysbalance a/ nebo dlouhý či krátký QT interval.
Četné asymptomatické KPS (obvykle definované jako > 10 – 15 % z celkového počtu srdečních stahů za 24 hod) mohou zhoršit funkci LK, nicméně toto zhoršení bývá reverzibilní, pokud dojde k ovlivnění četné ektopie farmakoterapií a/ nebo katetrizační ablací [34]. Zdaleka ne u všech pacientů však dojde ke zhoršení funkce LK. Faktory, které mohou ovlivnit funkci LK v důsledku četné komorové ektopie, je delší trvání KPS (širší QRS komplex), retrográdní aktivace síní po KPS, epikardiální KPS a interpolované KPS [34]. Faktory, které vedou k horší prognóze u pacientů s KPS ukazuje tab. 6.
U asymptomatických pacientů studie naznačují, že zvýšené riziko vývoje indukované kardiomyopatie je, pokud četnost KPS je > 10 %, nicméně indukované kardiomyopatie se vyskytly i u asymptomatických jedinců s četností KPS < 10 % [35]. Počet KPS je však výrazně ovlivněn délkou monitorace a principiálně ani u asymptomatických pacientů není jasné, zda kardiomyopatie je důsledek komorové ektopie, nebo zda komorová ektopie je důsledkem kardiomyopatie. Studie ukazují, že s četností komorové ektopie (> 20 %) roste pravděpodobnost vzniku dysfunkce LK, ale k tomuto snížení ejekční frakce (EF) LK (o > 6 %) dochází pomalu během několika let [36]. Lehkou dysfunkci LK lze pozorovat již od četnosti KPS > 8 %, nicméně u drtivé většiny asymptomatických pacientů s četnými KPS (> 10 %) se kardiomyopatie nerozvíjí [37]. V případě, že u asymptomatických pacientů s četnou komorovou ektopií je vyloučeno SOS, žádné léčby není třeba. V případě, že četnost KPS je > 10 %, pak by měla být pravidelně sledována funkce LK (1× ročně). U pacientů, kteří začnou být symptomatičtí, nebo u nich dochází ke snížení funkce LK, je třeba zahájit antiarytmickou farmakoterapii, nebo indikovat katetrizační ablaci. Management pacientů s asymptomatickými KPS ukazuje tab. 7.
Table 7. Souhlasné prohlášení k problematice asymptomatických KPS. 
KPS – komorové předčasné stahy Komorové tachykardie
Definice nesetrvalé komorové tachykardie (NSKT) je dána třemi nebo více po sobě jdoucími komorovými stahy o frekvenci > 100/ min, v délce trvání < 30 s. Při dlouhodobé EKG monitoraci je tento typ arytmie relativně častý u pacientů s ischemickou chorobou srdeční (30 – 80 %), kde často bývá asymptomatický [7]. Zatímco NSKT je často asymptomatická, setrvalá KT je mnohem častěji symptomatická. Pokud je setrvalá KT pomalá (obvykle < 150/ min), může být rovněž asymptomatická, ale pokud trvá hodiny/ dny, může se stát symptomatickou z důvodu nasedajícího srdečního selhávání. KT může být detekována různými způsoby, nicméně je třeba se snažit zachytit tachykardii na 12svodovém EKG. Řešení asymptomatických komorových arytmií záleží hlavně na tom, zda je, či není přítomno SOS. Vyšetření 1. linie zahrnuje klinické hodnocení spojené s 12svodovým EKG, ambulantním monitorováním EKG (24 hod), echokardiografickým vyšetřením, zátěžovým testem a laboratorním vyšetřením. Vyšetření 2. linie zahrnují koronarografii, magnetickou rezonanci/ počítačovou tomografii (MRI/ CT) srdce k vyloučení specifického srdečního onemocnění. Pokud je podezření na geneticky podmíněnou arytmickou poruchu (Brugadův syndrom) a zmíněná vyšetření jsou negativní, pak je indikováno farmakologické testování pomocí ajmalinového testu.
U jedinců bez SOS bývají obvykle NSKT a/ nebo idiopatické repetitivní KT adenozin sensitivní a častěji se vyskytují při zátěži nebo při emočním stresu. Pocházejí obvykle z pravého výtokového traktu, nebo z levého výtokového traktu i když existují výjimky. Ojediněle se může vyskytnout verapamil-senzitivní fascikulární KT, která se prezentuje nesetrvalými salvami komorových extrasystol. Tyto komorové arytmie se pokládají za benigní a ojedinělá NSS u těchto jedinců se přikládá na vrub nepoznané kardiomyopatie nebo kanálopatie. NSKT u asymptomatického pacienta s EF LK > 40 % obvykle nevyžaduje žádnou specifickou antiarytmickou léčbu, ale pouze optimalizaci léčby základního srdečního onemocnění. V případě, že u těchto asymptomatických pacientů jsou NSKT velmi časté, může se u nich časem vyvinout tachykardií indukovaná kardiomyopatie, proto je nezbytně nutné tyto pacienty pečlivě sledovat, zvláště pokud doposud nevyžadovali žádnou specifickou terapii.
U pacientů se SOS je přítomnost asymptomatických komorových arytmií obvykle prognosticky závažnou známkou. Žádná antiarytmika s výjimkou betablokátorů nesnižují u těchto asymptomatických pacientů mortalitu. Optimální metodou první volby je v tomto případě medikace betablokátorů, inhibitorů angiotenzin konvertujícího enzymu (ACEI) a antagonistů mineralokortikoidních receptorů. Po vyloučení akutního koronárního syndromu je v případě setrvalých KT v nepřítomnosti reverzibilní příčiny u pacientů s EF LK < 35 % indikována implantace kardioverter-defibrilátoru (ICD). Navzdory vysokému riziku náhlého úmrtí po infarktu myokardu (IM) u pacientů s nízkou EF LK, ICD nejsou obecně indikovány v prvních 40 – 90 dnech po IM. U pacientů s levokomorovými srdečními podporami je KT běžná a může být díky srdeční podpoře dobře tolerována. Nicméně časté epizody KT jsou spojeny s vyšší úmrtností, proto v těchto případech lze uvažovat o ablačním ovlivnění epizod [38]. Management asymptomatických pacientů s kanálopatiemi a s vrozenými srdečními vadami přesahuje rámec tohoto sdělení a je podrobně uveden v doporučeních ESC pro péči o pacienty s komorovými arytmiemi a prevenci NSS z roku 2015 [7]. Z praktického hlediska lze jen shrnout EKG změny, které vedou k podezření na kanálopatii u asymptomatických pacientů s KT. Tyto změny na 12svodovém EKG zahrnují prolongovaný nebo frakcionovaný QRS komplex, prodloužení nebo zkrácení QT intervalu, elevace bodu J, sedlovitý typ elevace ST segmentu ve svodech V1 – V3, časná repolarizace, přítomnost vlny epsilon, nebo inverze T vln anteriorně, laterálně nebo inferiorně.
Asymptomatická KT u těhotných žen bez SOS nevyžaduje specifickou terapii a může být jen monitorována. V případě asymptomatických KT v důsledku těhotenské kardiomyopatie lze uvažovat o dočasném používání kardioverteru-defibrilátoru ve formě záchranné vesty.
Asymptomatický akcelerovaný idioventrikulární rytmus u pacientů bez SOS nepředstavuje žádné zvýšené riziko NSS, proto nevyžaduje žádnou terapii či monitoraci [39].
U pacientů s lehkým SOS s EF LK > 40 % a s dobře tolerovanou KT se nabízí provedení radiofrekvenční ablace KT, pokud jde o ischemickou kardiomyopatii [40] nebo o ARVC [41].
Prognostická hodnota EFV u pacientů s ischemickou kardiomyopatií a EF LK > 40 % není v současné době jasně stanovena. Management pacientů s asymptomatickými komorovými tachykardiemi ukazuje tab. 8.
Table 8. Souhlasné prohlášení k problematice asymptomatických KT. 
KT – komorová tachykardie; ICD – implantabilní kardioverter-defibrilátor; EF LK – ejekční frakce levé komory; NSKT – nesetrvalá komorová tachykardie Tachykardií indukovaná kardiomyopatie
K tachykardií indukované kardiomyopatii (TIKMP) mohou vést supraventrikulární i KT, které lze rozdělit na dva typy:
- čistý typ, kde tachykardie je jediným mechanizmem zhoršování funkce LK a
- smíšený typ, kde tachykardie zhoršuje již existující kardiomyopatii jiné etiologie.
Vzhledem k tomu, že tzv. čistý typ tachykardie, která má stejný původ s podobnou frekvencí a stejnou dobou trvání, má u jednotlivých pacientů rozdílnou incidenci a vede k rozdílné závažnosti TIKMP, lze předpokládat, že primární příčinou TIKMP je přítomnost latentní kardiomyopatie nebo rozdílná základní citlivost myokardu na tachykardii.
Pro diagnostiku TIKMP neexistují žádná pevná kritéria. U pacientů s nově diagnostikovanou dysfunkcí LK a zachycenou chronickou nebo recidivující tachykardií (srdeční frekvence > 100/ min), diagnózu TIKMP lze předpokládat na základě zjištění uvedených v tab. 9, kdy jde především o vyloučení dalších příčin komorové dysfunkce a o reakci na léčbu. Primárně je nezbytné vyloučení ischemické etiologie komorové dysfunkce pomocí neinvazivních vyšetřovacích metod nebo invazivně za pomoci koronární angiografie.
Table 9. Faktory nutné pro diagnostiku tachykardií indukovanou kardiomyopatii. 
LK – levá komora; EF LK – ejekční frakce levé komory U dospělých je považována za nejčastější příčinu TIKMP FS [42], zatímco u dětí to je permanentní junkční reentry tachykardie [43]. Pacienti s paroxysmální tachykardií s rychlou frekvencí komor bývají více symptomatičtí a diagnostika u nich je časnější než u pacientů, kteří mají tachykardii s pomalejší frekvencí komor, ale běžící nepřetržitě (tab. 10) [35].
Table 10. Možné prediktory nebo faktory spojené s vývojem TIKMP. 
FS – fibrilace síní; KPS – komorové předčasné stahy; TIKMP – tachykardií indukovaná kardiomyopatie Pro léčbu TIKMP platí stejná pravidla jako pro léčbu SS při snížené EF LK. Léčba antiarytmická je stejná jako u symptomatických nemocných, nicméně u asymptomatických pacientů s TIKMP by měla být léčba intenzivnější s preferencí radiofrekvenční ablace. Uvažování o ablaci jako o strategickém řešení u asymptomatických pacientů musí být individuální s přihlédnutím k preferenci pacienta, ke zkušenostem každého centra a ke klinické závažnosti samotné tachyarytmie. Antiarytmická farmakoterapie je sice u asymptomatických pacientů stejná jako u symptomatických, nicméně podávání propafenonu nebo sotalolu je kontraindikované při závažném SS, resp. propafenon je kontraindikován při snížené EF LK < 35 %, což však zřejmě již nebude asymptomatické okno. Management pacientů s asymptomatickými KT ukazuje tab. 11.
Table 11. Souhlasné prohlášení k problematice TIKMP. 
FS – fibrilace síní; TIKMP – tachykardií indukovaná kardiomyopatie; SS – srdeční selhání Asymptomatické bradykardie
Asymptomatické bradyarytmie, jako je dysfunkce sinusového uzlu nebo porucha AV převodu, bývají běžně zaznamenávány při rutinních vyšetřeních v rámci diagnostických postupů pro symptomatiku, která nemá kardiální podklad. Implantace kardiostimulátoru je přitom indikována pouze pro symptomatickou bradykardii, kde je shledána korelace mezi bradykardií a symptomy, nebo mohou být dokumentované objektivní nálezy, které nevedly k nějaké symptomatice, ale mohly by v závažnou symptomatiku, jakou je synkopální stav, vyústit. K indikaci implantace kardiostimulátoru je důležitá délka dokumentované pauzy při EKG monitoraci. Komorové pauzy v délce 3 s nebo i déle obvykle nezpůsobují příznaky a přítomnost těchto pauz nemusí nutně vést ke špatné prognóze, proto u asymptomatických pacientů většinou nejsou indikací pro trvalou kardiostimulaci [44].
U pacientů s asymptomatickou intermitentní noční bradykardií (sinusová bradykardie nebo AV blokáda) je třeba uvažovat, že příčinou může být spánková apnoe. Mechanizmem vedoucím k bradykardii je v tomto případě nadměrná vagální aktivace způsobená hypoxií při apnoi. Léčba první volby by v tomto případě měla být oxygenoterapie, která brání vzniku bradykardie u 80 – 90 % těchto pacientů.
Asymptomatická bradykardie je běžná a pauzy do 3 s nevyžadují žádnou intervenci ani omezení [44]. U pacientů s FS můžeme často vidět pauzy mezi 3 a 5 s, což lze pokládat za normální jev a pokud jsou tyto pauzy asymptomatické, žádnou léčbu nevyžadují. V případě AV blokády je zásadní rozlišení mezi nodální a infranodální lokalizací, jelikož infranodální blokáda vyžaduje implantaci kardiostimulátoru i pokud je asymptomatická (AV blokáda II. stupně – Mobitz II a AV blok III. st.). O infranodální blokádě je třeba uvažovat i v případě širokých QRS komplexů při AV blokádě II. stupně Mobitz I (Wenckebachovy periody). Zpomalení sinusové frekvence v době AV blokády bývá při blokádě lokalizované v AV uzlu, zatímco blokáda v His-Purkyňově systému (infranodální) bývá závislá na tachykardii. Management pacientů s asymptomatickými bradykardiemi ukazuje tab. 12.
Table 12. Souhlasné prohlášení k problematice asymptomatických bradykardií. 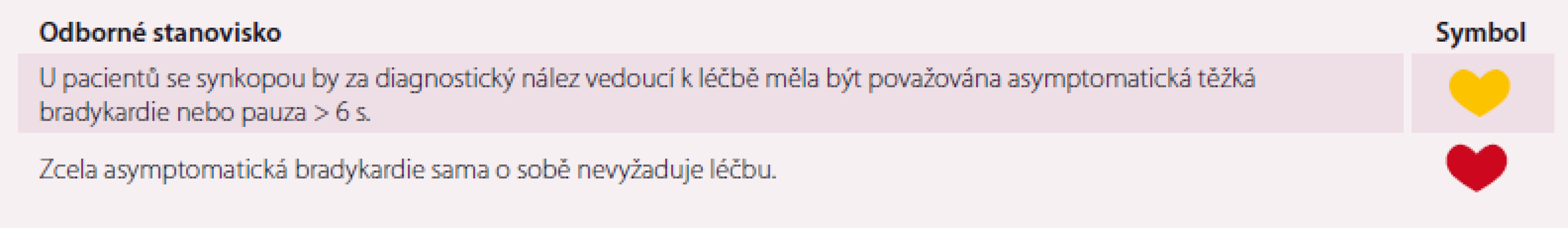
Budoucnost a perspektivy pacientů s asymptomatickými arytmiemi
Ve skutečnosti asymptomatická srdeční arytmie může mít horší následky než symptomatická, protože arytmie je často zjištěna až při první hospitalizaci pro závažné onemocnění související s arytmií, jako např. CMP při FS, oběhová zástava při komorových arytmiích nebo TIKMP. Při řešení asymptomatických arytmií je nezbytné, aby bez ohledu na typ arytmie byli pacienti plně informováni o jejich aktuálním zdravotním stavu, vč. jeho možného vývoje. Je třeba také vyhodnotit obavy pacientů z diagnostikované arytmie, bez ohledu na přítomnost nebo nepřítomnost příznaků, jelikož úzkost může ovlivnit adherenci pacienta k léčbě a/ nebo snížit kvalitu života jako takovou. Prudký rozvoj spotřebitelské elektroniky (Smartphone, Smartwatch) umožňuje hodnotit srdeční frekvenci i identifikovat nepravidelný nebo variabilní srdeční rytmus. Aplikace těchto komerčních i lékařských měřicích zařízení má potenciál pro zvýšení záchytu poruch srdečního rytmu a zvýšení prevalence asymptomatických tachyarytmií či bradyarytmií, které jsou preferenčně indikovány ke komplexnímu řešení. Toto bude vyžadovat další přístrojovou precizaci hodnocení arytmií a jasnější instrukce, jak a kdy intervenovat zachycené asymptomatické arytmie. Nedílnou součástí úspěšného managementu pacientů s asymptomatickými arytmiemi bude vždy komunikace lékař – pacient (tab. 13).
Table 13. Souhlasné prohlášení ke komunikaci lékař–pacient. 
Doručeno do redakce: 6. 11. 2019
Přijato po recenzi: 13. 11. 2019
doc. MU Dr. Petr Heinc, Ph.D.
Sources
1. Arnar DO, Mairesse GH, Calkins H et al. Management of asymptomatic arrhythmias: a European Heart Rhythm Association (EHRA) consensus document, endorsed by the Heart Failure Association (HFA), Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin America Heart Rhythm Society (LAHRS). Europace 2019. pii: euz046. doi: 10.1093/ europace/ euz046.
2. Weber BE, Kapoor WN. Evaluation and outcomes of patients with palpitations. Am J Med 1996; 100(2): 138 – 148. doi: 10.1016/ s0002-9343(97)89451-x.
3. Strickberger SA, Ip J, Saksena S et al. Relationship between atrial tachyarrhythmias and symptoms. Heart Rhythm 2005; 2(2): 125 – 131. doi: 10.1016/ j.hrthm.2004.10.042.
4. Shen MJ, Zipes DP. Role of the autonomic nervous system in modulating cardiac arrhythmias. Circ Res 2014; 114(6): 1004 – 1021. doi: 10.1161/ CIRCRESAHA.113.302549.
5. Schwartz PJ. Cardiac sympathetic denervation to prevent life-threatening arrhythmias. Nat Rev Cardiol 2014; 11(6): 346 – 353. doi: 10.1038/ nrcardio.2014.19.
6. Wieling W, Thijs RD, van Dijk N et al. Symptoms and signs of syncope: a review of the link between physiology and clinical clues. Brain 2009; 132 (Pt 10): 2630 – 2642. doi: 10.1093/ brain/ awp179.
7. Binici Z, Intzilakis T, Nielsen OW et al. Excessive supraventricular ectopic activity and increased risk of atrial fibrillation and stroke. Circulation 2010; 121(17): 1904 – 1911. doi: 10.1161/ CIRCULATIONAHA.109.874982.
8. Suzuki S, Sagara K, Otsuka T et al. Usefulness of frequent supraventricular extrasystoles and a high CHADS2 score to predict first-time appearance of atrial fibrillation. Am J Cardiol 2013; 111(11): 1602 – 1607. doi: 10.1016/ j.amjcard.2013.01.335.
9. Dewland TA, Vittinghoff E, Mandyam MC et al. Atrial ectopy as a predictor of incident atrial fibrillation: a cohort study. Ann Intern Med 2013; 159(11): 721 – 728. doi: 10.7326/ 0003-4819-159-11-2013120 30-00004.
10. Larsen BS, Kumarathurai P, Falkenberg J et al. Excessive atrial ectopy and short atrial runs increase the risk of stroke beyond incident atrial fibrillation. J Am Coll Cardiol 2015; 66(3): 232 – 241. doi: 10.1016/ j.jacc.2015.05.018.
11. Davidoff R, Schamroth CL, Myburgh DP. The Wolff-Parkinson-White pattern in health aircrew. Aviat Space Environ Med 1981; 52(9): 554 – 558.
12. Munger TM, Packer DL, Hammill SC et al. A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County, Minnesota, 1953 – 1989. Circulation 1993; 87(3): 866 – 873. doi: 10.1161/ 01.cir.87.3.866.
13. Leitch JW, Klein GJ, Yee R et al. Prognostic value of electrophysiology testing in asymptomatic patients with Wolff-Parkinson-White pattern. Circulation 1990; 82(5): 1718 – 1723. doi: 10.1161/ 01.cir.82.5.1718.
14. Obeyesekere MN, Leong-Sit P, Massel D et al. Risk of arrhythmia and sudden death in patients with asymptomatic preexcitation: a meta-analysis. Circulation 2012; 125(19): 2308 – 2315. doi: 10.1161/ CIRCULATIONAHA.111.055350.
15. Blomström-Lundqvist C, Scheinman MM, Aliot EMet al. ACC/ AHA/ ESC guidelines for the management of patients with supraventricular arrhythmias – exe-cutive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias). Circulation 2003; 108(15): 1871 – 1909. doi: 10.1161/ 01.CIR.0000091380.04100.84.
16. Katritsis DG, Boriani G, Cosio FG et al. European Heart Rhythm Association (EHRA) consensus document on the management of supraventricular arrhythmias, endorsed by Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017; 19(3): 465 – 511. doi: 10.1093/ europace/ euw301.
17. Santinelli V, Radinovic A, Manguso F et al. The natural history of asymptomatic ventricular pre-excitation a long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol 2009; 53(3): 275 – 280. doi: 10.1016/ j.jacc.2008.09.037.
18. Kubuš P, Vít P, Gebauer RA et al. Electrophysiologic profile and results of invasive risk stratification in asymptomatic children and adolescents with the Wolff-Parkinson-White electrocardiographic pattern. Circ Arrhythm Electrophysiol 2014; 7(2): 218 – 223. doi: 10.1161/ CIRCEP.113.000930.
19. Mairesse GH, Moran P, Van Gelder IC et al. Screening for atrial fibrillation: a European Heart Rhythm Association (EHRA) consensus document endorsed by the Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017; 19(10): 1589 – 1623. doi: 10.1093/ europace/ eux177.
20. Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace 2016; 18(11): 1609 – 1678. doi: 10.1093/ europace/ euw295.
21. Gorenek BC, Bax J, Boriani G et al. Device detected subclinical atrial tachyarrhythmias: definition, implications and management – an European Heart Rhythm Association (EHRA) consensus document, endorsed by Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017; 19(9): 1556 – 1578. doi: 10.1093/ europace/ eux163.
22. Esato M, Chun YH, An Y et al. Clinical impact of asymptomatic presentation status in patients with paroxysmal and sustained atrial fibrillation: the Fushimi AF registry. Chest 2017; 152(6): 1266 – 1275. doi: 10.1016/ j.chest.2017.08.004.
23. Hindricks G, Piorkowski C, Tanner H et al. Perception of atrial fibrillation before and after radiofrequency catheter ablation: relevance of asymptomatic arrhythmia recurrence. Circulation 2005; 112(3): 307 – 313. doi: 10.1161/ CIRCULATIONAHA.104.518837.
24. Ganesan AN, Chew DP, Hartshorne T et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. Eur Heart J 2016; 37(20): 1591 – 1602. doi: 10.1093/ eurheartj/ ehw007.
25. Potpara TS, Polovina MM, Marinkovic JM et al. A comparison of clinical characteristics and long-term prognosis in asymptomatic and symptomatic patients with first-diagnosed atrial fibrillation: the Belgrade Atrial Fibrillation Study. Int J Cardiol 2013; 168(5): 4744 – 4749. doi: 10.1016/ j.ijcard.2013.07.234.
26. Calkins H, Hindricks G, Cappato R et al. HRS/ EHRA/ ECAS/ APHRS/ SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2017; 20(1): e1 – e160. doi: 10.1093/ europace/ eux274.
27. Kalman JM, Sanders P, Rosso R et al. Should we perform catheter ablativ for asymptomatic atrial fibrillation? Circulation 2017; 136(5): 490 – 499. doi: 10.1161/ CIRCULATIONAHA.116.024926.
28. Wu L, Lu Y, Zheng L et al. Comparison of radiofrequency catheter ablation between asymptomatic and symptomatic persistent atrial fibrillation: a propensity score matched analysis. J Cardiovasc Electrophysiol 2016; 27(5): 531 – 535. doi: 10.1111/ jce.12930.
29. Healey JS, Connolly SJ, Gold MR et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012; 366(2): 120 – 129. doi: 10.1056/ NEJMoa1105575.
30. Martin DT, Bersohn MM, Waldo AL et al. Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices. Eur Heart J 2015; 36(26): 1660 – 1668. doi: 10.1093/ eurheartj/ ehv115.
31. Lee V, Perera D, Lambiase P. Prognostic significance of exercise-induced premature ventricular complexes: a systematic review and meta-analysis of observational studies. Heart Asia 2017; 9(1): 14 – 24. doi: 10.1136/ heartasia-2016-01085.
32. Lin CY, Chang SL, Chung FP et al. Long-term outcome of non-sustained ventricular tachycardia in structurally normal hearts. PLoS One 2016; 11(8): e0160181. doi: 10.1371/ journal.pone.0160181. eCollection 2016.
33. Novak J, Zorzi A, Castelletti S et al. Electrocardiographic differentiation of idiopathic right ventricular outflow tract ectopy from early arrhythmogenic right ventricular cardiomyopathy. Europace 2017; 19(4): 622 – 628. doi: 10.1093/ europace/ euw018.
34. Al-Khatib SM, Stevenson WG, Ackerman MJ et al. AHA/ ACC/ HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation 2018; 138(13): e272 – e391. doi: 10.1161/ CIR.0000000000000549.
35. Del Carpio Munoz F, Syed FF, Noheria A et al. Characteristics of premature ventricular complexes as correlates of reduced left ventricular systolic function: study of the burden, duration, coupling interval, morphology and site of origin of PVCs. J Cardiovasc Electrophysiol 2011; 22(7): 791 – 798. doi: 10.1111/ j.1540-8167.2011.02021.x.
36. Dukes JW, Dewland TA, Vittinghoff E et al. Ventricular ectopy as a predictor of heart failure and death. J Am Coll Cardiol 2015; 66(2): 101 – 109. doi: 10.1016/ j.jacc.2015.04.062.
37. Hasdemir C, Ulucan C, Yavuzgil O et al. Tachycardia-induced cardiomyopathy in patients with idiopathic ventricular arrhythmias: the incidence, clinical and electrophysiologic characteristics, and the predictors. J Cardiovasc Electrophysiol 2011; 22(6): 663 – 668. doi: 10.1111/ j.1540-8167.2010.01986.x.
38. Nakahara S, Chien C, Gelow J et al. Ventricular arrhythmias after left ventricular assist device. Circ Arrhythm Electrophysiol 2013; 6(3): 648 – 654. doi: 10.1161/ CIRCEP.113.000113.
39. MacLellan-Tobert SG, Porter CJ. Accelerated idioventricular rhythm: a benign arrhythmia in childhood. Pediatrics 1995; 96(1 Pt 1): 122 – 125.
40. Maury P, Baratto F, Zeppenfeld K et al. Radiofrequency ablation as primary management of well-tolerated sustained monomorphic ventricular tachycardia in patients with structural heart disease and left ventricular ejection fraction over 30%. Eur Heart J 2014; 35(22): 1479 – 1485. doi: 10.1093/ eurheartj/ ehu040.
41. Corrado D, Wichter T, Link MS et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/ dysplasia: an International Task Force Consensus Statement. Circulation 2015; 132(5): 441 – 453. doi: 10.1161/ CIRCULATIONAHA.115.017944.
42. Donghua Z, Jian P, Zhongbo X et al. Reversal of cardiomyopathy in patients with congestive heart failure secondary to tachycardia. J Interv Card Electrophysiol 2013; 36(1): 27 – 32: discussion 32. doi: 10.1007/ s10840-012-9727-9.
43. Kang KT, Potts JE, Radbill AE et al. Permanent junctional reciprocating tachycardia in children: a multicenter experience. Heart Rhythm 2014; 11(8): 1426 – 1432. doi: 10.1016/ j.hrthm.2014.04.033.
44. Hilgard J, Ezri MD, Denes P. Significance of ventricular pauses of three seconds or more detected on twenty-four-hour Holter recordings. Am J Cardiol 1985; 55(8): 1005 – 1008. doi: 10.1016/ 0002-9149(85)90735-0
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2019 Issue 4-
All articles in this issue
- Novinky v léčbě dyslipidemie
- Studie CAROLINA a její dopad pro klinickou praxi
- Management pacientů s asymptomatickými arytmiemi – zkrácený a komentovaný konsenzus Evropské asociace pro srdeční rytmus (EHRA)
- Indapamid není jen diuretikum
- Nitrendipin – moderní blokátor vápníkových kanálů
- Propafenon
- SGLT2 aneb když metformin nestačí – kazuistika
- Balónková kontrapulzace, ECMO a transplantace srdce v průběhu 24 hodin u pacienta v kardiogenním šoku
- Vzpomínka na prof. MU Dr. Vladislava Krutu, DrSc. dlouholetého přednostu Fyziologického ústavu MU Brno
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Indapamid není jen diuretikum
- Propafenon
- Novinky v léčbě dyslipidemie
- Management pacientů s asymptomatickými arytmiemi – zkrácený a komentovaný konsenzus Evropské asociace pro srdeční rytmus (EHRA)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

