-
Medical journals
- Career
Význam nových parametrů kontraktility a tepové práce pro hodnocení srdeční funkce a prognózy
Authors: M. Tesák 1,2; J. Pařenica 1
Authors‘ workplace: Interní kardiologická klinika LF MU a FN Brno 1; Interní oddělení, Nemocnice Třebíč 2
Published in: Kardiol Rev Int Med 2017, 19(4): 261-265
Overview
Hodnocení srdeční funkce je klíčový prvek pro odhad prognózy srdečních onemocnění. Posouzení srdeční funkce in vivo je však ovlivněno mnoha faktory, univerzální parametr, který by definoval status „mechanicky zdravého srdce“, proto neexistuje. V přehledu jsou nové i stávající ukazatele srdeční funkce rozděleny podle toho, zda vyjadřují kontraktilitu nebo mechanickou energii srdeční činnosti. Je diskutována jejich role v hodnocení srdeční fyziologie, způsoby stanovení, možné klinické využití i nevýhody.
Klíčová slova:
srdce – funkce komor – srdeční selhání – ejekční frakce – systolická elastance – tepová práce – srdeční výkon – preload recruitable stroke workÚvod
Hodnocení srdeční funkce je klíčovou determinantou ke stanovení prognózy kardiologických pacientů. Na rozdíl od stanovení mechanické funkce – ontraktility – ednoho svalového vlákna v laboratorních podmínkách je posouzení funkce celého srdce in vivo ovlivněno mnoha faktory [1]. Ty lze rozdělit na orgánové a systémové. K těm orgánovým patří jednak trojrozměrnost srdečních struktur, jejich anatomický tvar, jejich počet a vzájemný vztah, mikroskopické uspořádání svalových vláken, posloupnost kontrakce svalových vláken, dále pak vlastnosti vazivového intersticia myokardu a mechanické vlastnosti perikardu a chlopenního aparátu. Systémové vlivy zahrnují vlastnosti cévního stromu malého i velkého oběhu (především impedance a elasticita), dále objem krve, její reologické vlastnosti a konečně neurohumorální vlivy.
Je zřejmé, že nalézt in vivo jediný parametr srdeční funkce, který by přesně definoval status „mechanicky zdravého srdce“ není možné. Dosavadní výzkum i klinická praxe dávají přednost ukazatelům s prokázaným prognostickým významem, které jsou snadno měřitelné.
Matematicky i fyzikálně je srdeční funkce nejlépe vyjádřena křivkou srdečního cyklu v PV diagramu (plocha křivky – závislost tlaku na objemu). Význam i limitace jednotlivých užívaných i nových parametrů ukážeme na něm (obr. 1). Na PV diagramu je vyjádřen srdeční cyklus křivkou, která má pro naše účely přibližně obdélníkový tvar. V praxi je plocha obdélníku ohraničena endsystolickým (endsystolic volume – SV) a enddiastolickým (enddiastolic volume – DV) objemem a středním ejekčním tlakem (mean ejection pressure – MEP) a enddiastolickým tlakem (enddiastolic pressure – DP). Šíře opsaného obdélníku odpovídá tepovému objemu (stroke volume – V). Plocha obdélníku je odrazem srdeční práce vykonané v průběhu jednoho srdečního cyklu, nazývané tepová práce (stroke work – W). Je zřejmé, že při nárůstu systolického tlaku při SW musí klesnout SV. Chceme-li funkci srdce hodnotit dle SV, musíme tak zohlednit skutečnost, že SV je výrazně afterload dependentní. Afterload (neboli dotížení) odpovídá systolickému tlaku v aortě, k překonání vyššího tlaku v aortě zbývá méně energie na vypuzení krve, SV tak klesá při zachování SW. Současně při pohledu na PV diagram je zřejmé, že zvýšení EDV vede k nárůstu SV, a tedy že SV je výrazně preload dependentní (neboli závislý na předtížení). Tedy při zvýšeném plnění levé komory (LK) dojde v důsledku Frank-Starligova principu ke zvýšení SV.
Image 1. Znázornění tepové práce v PV diagramu. Plocha ohraničená červenou křivkou odpovídá SW. V praxi je počítána jako plocha obdélníku ohraničeného ESV a EDV a MEP s EDP. 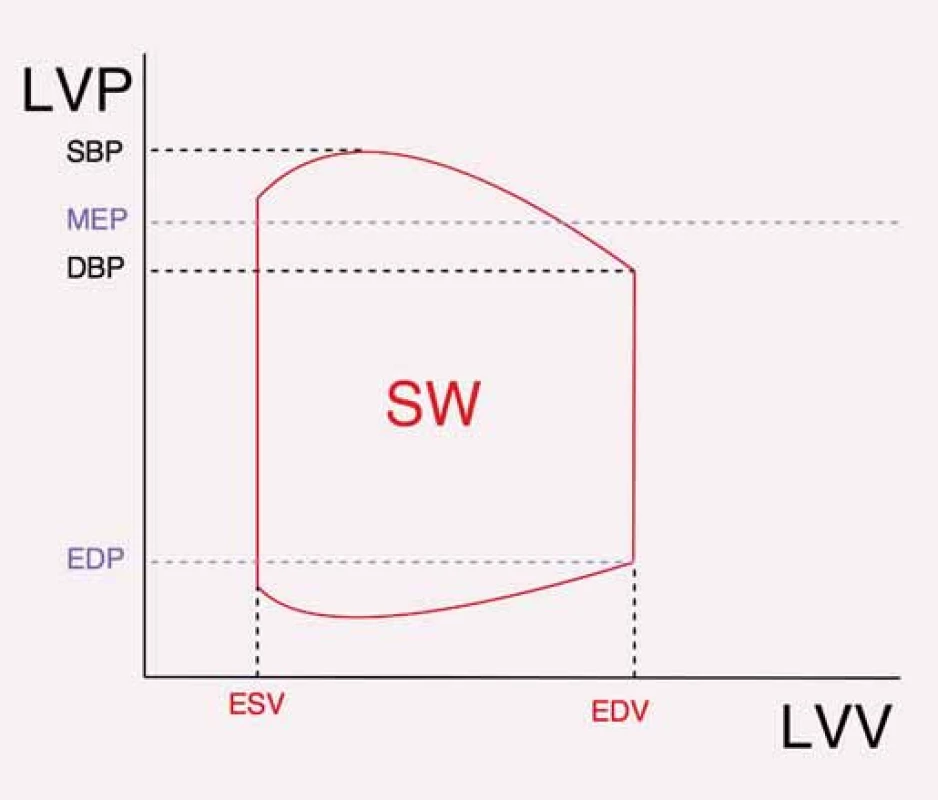
LVP – tlak v levé komoře, LVV – objem levé komory, SW – tepová práce (stroke work), DBP – diastolický krevní tlak, SBP – systolický krevní tlak, MEP – střední ejekční tlak, EDP – enddiastolický tlak v levé komoře, ESV – endsystolický objem levé komory, EDV – enddiastolický objem levé komory. Parametry kontraktility
Ejekční frakce
Výraznou závislost SV na preloadu částečně eliminuje základní parametr mechanické srdeční funkce, ejekční frakce (EF). Je definována jako podíl SV a EDV komory [1,2]. Pokud vzroste EDV, naroste i SV a relativní změna jejich poměru je pak menší než relativní změna samotného SV. Například pokud bude SV 70 ml a EDV 140 ml, EF má hodnotu 0,5. Pokud dojde k nárůstu EDV na 170 ml a k nárůstu SV například na 100 ml (tedy nárůst SV o 42 %), naroste EF na 0,58, tedy „jen“ o 16 %. Podobně, pokud v důsledku nárůstu afterloadu klesne SV, EF se změní méně výrazně – změna SV se totiž dělí EDV.
Po rozšíření echokardiografie se EF, resp. její přibližný odhad s využitím aproximativních vzorců, stala díky svému prognostickému významu a snadné stanovitelnosti kritériem pro indikaci celé řady farmakologických i chirurgických terapeutických intervencí – od farmakoterapie srdečního selhání přes srdeční resynchronizační léčbu až po indikace ke kardiochirurgickým operacím [3 – 5]. Jak ale vyplývá právě z PV diagramu, jedná se o jed-norozměrnou veličinu, která při popisu srdeční funkce vůbec nezohledňuje tlakové poměry v srdečních oddílech a vykonanou srdeční práci. EF má při posuzování srdeční kontraktility především tyto limitace:
- Relativitu parametru – podíl SV a EDV. To způsobuje, že patologicky hypertrofická LK s malou dutinou bude mít malý SV, malý minutový výdej srdeční, a přesto díky malému EDV normální nebo dokonce vysokou EF. Příkladem jsou pacienti s těžkou hypertrofickou kardiomyopatií, syndromem nízkého minutového výdeje, a přesto EF často nad 70 %. Uvedené může představovat obtíže např. při kvantifikaci chlopenních vad [6].
- Závislost EF na preloadu a afterloadu není zanedbatelná [7–9]. V klinické praxi EF nejvíce selhává u pacientů s regurgitačními chlopenními vadami, zejména mitrální regurgitací, při níž si LK v systole „odlehčí“ regurgitací krve do „nízkotlaké“ levé síně. EF je „falešně“ vyšší, což ozřejmí její pokles po korekci regurgitační vady v důsledku nárůstu afterloadu po korekci vady. Celý vztah je ještě složitější a přesahuje rámec tohoto přehledu, odkazujeme na literaturu v referencích [10]. Dalším příkladem nedostatečnosti EF jako parametru pro hodnocení srdeční funkce je tzv. afterload mismatch při kritické aortální stenóze, kdy vysoký afterload vede k významnému poklesu EF.
Z uvedených důvodů EF LK není jako samostatný parametr použitelná jako kritérium k zavedení mimotělních oběhových podpor u pacientů s akutním selháním LK v kardiogenním šoku, k ukončení oběhové podpory, ale ani jako indikační kritérium k ortotopické transplantaci srdce (OTS) [11]. Uvedené limitace a uvedené nové léčebné postupy vedly k hledání nových parametrů globální srdeční funkce a kontraktility. Mezi intenzivně zkoumané ukazatele patří endsystolická elastance (end-systolic elastance), tepová práce (stroke work – SW) a PRSWR nebo také zkráceně Mw (slope of preload recruitable stroke work a cardiac power output).
Endsystolická elastance
Pokud by byla teoreticky v průběhu celé systoly uzavřena aortální chlopeň, bude veškerá srdeční energie v průběhu systoly vynaložená jen do zvýšení krevního tlaku v komoře. Spojíme-li na PV diagramu průsečík maximálního tlaku dosaženého při této čistě izovolumické kontrakci (Pmax) a daného EDV s průsečíkem endsystolického tlaku (ESP) a ESV v průběhu běžného srdečního cyklu, získáme přímku vyjadřující vztah mezi ESP a ESV (end-systolic pressure volume relationship – ESPVR). Sklon této křivky se nazývá slope of ESPVR neboli endsystolická elastance (obr. 2) [12]. Tento parametr je dobrým ukazatelem srdeční kontraktility. Sklon křivky ESPVR (neboli endsystolická elastance) se změní vlivem pozitivně inotropního podnětu (např. podáním dobutaminu nebo při zátěži) [13]. Přesto vykazuje jistou míru preload dependence, a to i při reálném použití během srdeční katetrizace [14]. Z toho důvodu je nyní v experimentu více k hodnocení kontraktility využíván slope of preload recruitable stroke work relationship, viz dále. Byla vyvinuta metodika k neinvazivnímu stanovení endsystolické elastance, vyžaduje však stanovení celé řady parametrů, a jeví se tak poměrně pracná [13].
Image 2. Znázornění endsystolické elastance. End-systolic pressure volume relationship (ESPVR) je zjednodušeně (v podobě tzv. lineárního vyjádření) spojnicí maximálního tlaku dosažitelného při čistě izovolumické kontrakci (Pmax) a průsečíku ESP a ESV v průběhu běžného srdečního cyklu. I při různé náplni levé komory se přímka významněji (nikoli ale vůbec) nemění – znázorněny jsou 2 různé cykly. Sklon křivky ESPVR (tg a) se pak nazývá slope of ESPVR. 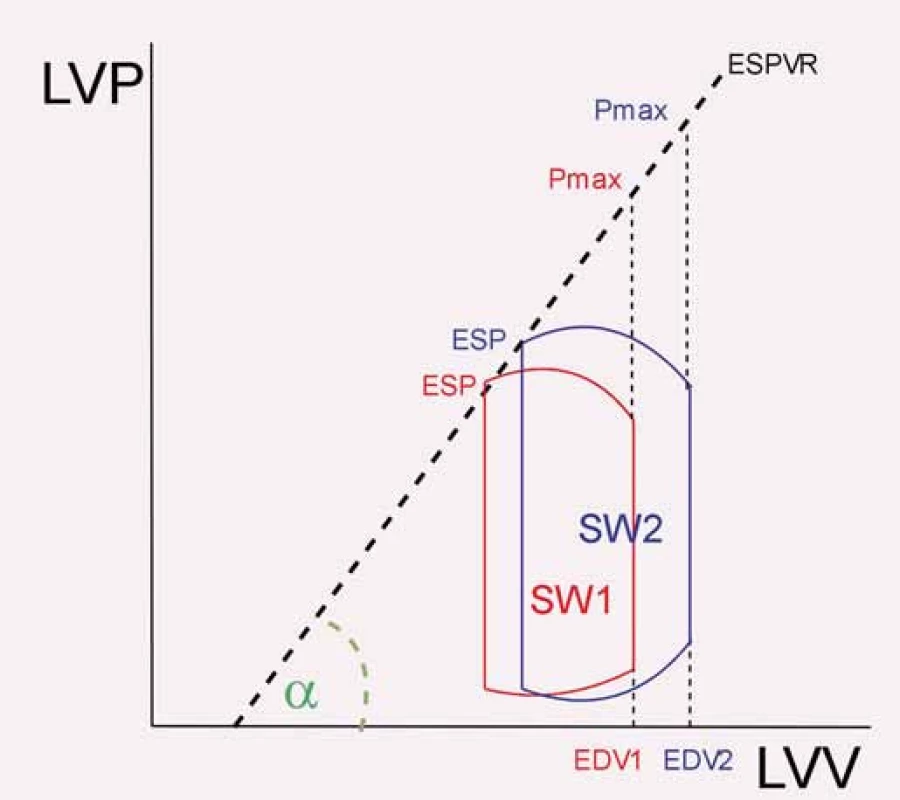
LVV – objem levé komory, ESP – endsystolický tlak, EDV – enddiastolický objem levé komory, ESV – endsystolický objem, SW – tepová práce Slope of preload recruitable stroke work relationship (slope of PRSWR nebo také zkráceně Mw)
Tepová práce LK je energie vynaložená srdcem na vypuzení SV krve do aorty v průběhu systoly a odpovídá ploše ohraničené křivkou vykreslenou na diagramu závislosti tlaku na objemu LK (PV diagram) v průběhu jednoho srdečního cyklu (obr. 1).
Zjednodušeně ji lze vyjádřit vztahem [11,15,16]:
SW ≈ (MEP – EDP) × SV
přičemž SV = EDV – ESV
Na rozdíl od EF je SW nezávislá na afterloadu. S narůstajícím afterloadem totiž sice klesá SV (plocha opsaná křivkou se ve směru osy x zužuje), ale roste tlak (nárůst plochy ve směru osy y).
Podle Frank-Starlingova principu je SW závislá jen na preloadu a tento vztah je považován za lineární [11,16,17]. Linearita tohoto vztahu byla předložena v roce 1985 Glowerem et al [18]. Autoři měřili u psů celkový objem LK (včetně myokardu) a posléze stanovili i objem myokardu LK (po usmrcení psů), z rozdílu počítali EDV. Dále byl při experimentu sledován průtok krve a tlak krve v aortě a transmurální tlak LK. SW počítali jednak jako součin rozdílu MEP – EDP a tepového objemu v aortě (viz vzorec výše) a jednak jako integrál křivky transmurálního tlaku a objemu LK (PV diagram – plocha křivky). Hodnoty SW z pěti srdečních cyklů při různém EDV navozeném experimentálně byly zaznamenány do diagramu závislosti SW na EDV LK. Tento vztah je v angličtině označovaném jako „preload recruitable stroke work“. Závislost vykazovala jasnou linearitu, sklon přímky je pak označován v angličtině jako „slope of preload recruitable stroke work – Mw“, průsečík přímky s osou x je označován jako volume intercept (Vw) (obr. 3). Pro SW pak platí lineární vztah:
SW = Mw (EDV – Vw)
Image 3. Způsob stanovení preload recruitable stroke work (PRSW) a význam sklonu křivky PRSW (Mw). Na obrázku vlevo je znázorněna křivka PV diagramu a změna tepové práce při různém enddiastolickém objemu, na obrázku vpravo je znázorněn způsob odečtu přímky PRSW a vztah Mw a kontraktility. 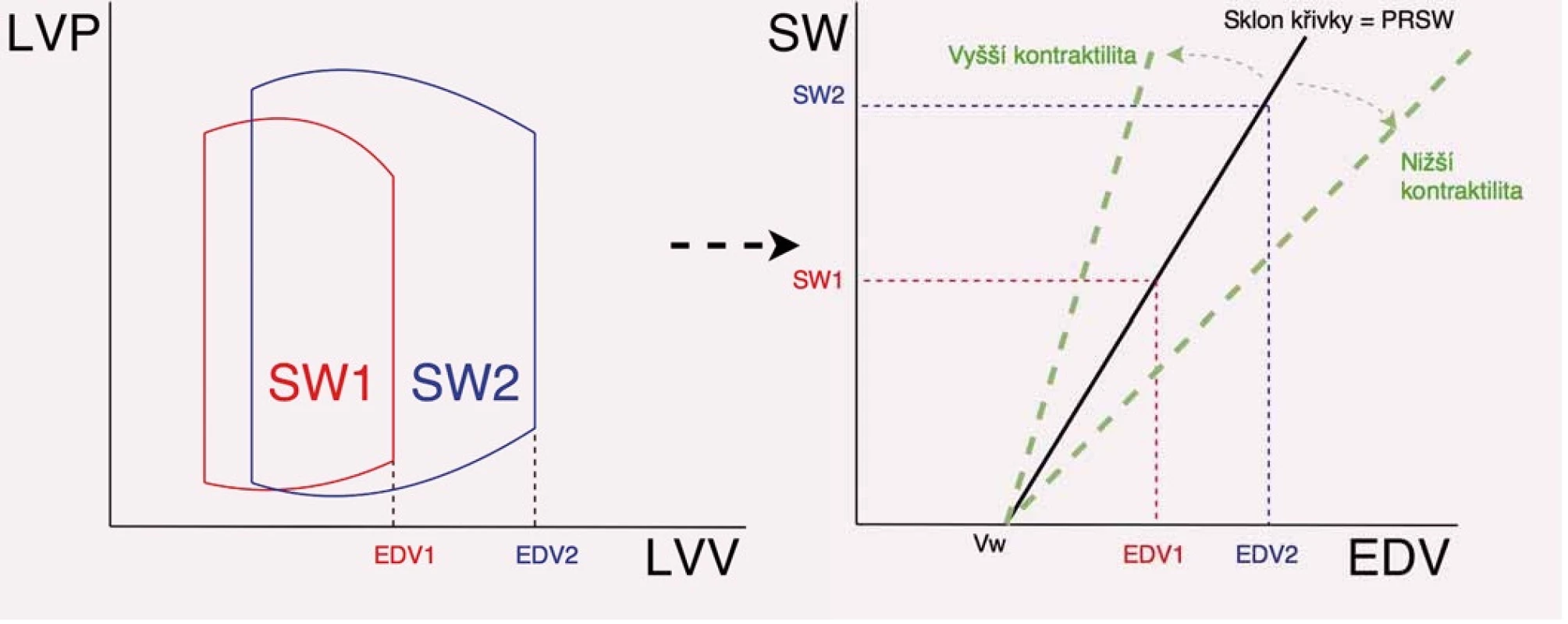
LVP – tlak v levé komoře, LVV – objem levé komory, EDV – enddiastolický objem, SW – tepová práce, Vw – průsečík křivky s osou x Hodnota Mw odráží kontraktilitu myokardu. Nižší hodnota Mw odpovídá nižší kontraktilitě, vyšší hodnota Mw pak odráží vyšší kontraktilitu srdečního myokardu. Glower et al prokázali nezávislost parametru Mw na venodilatačních i vazokonstrikčních podnětech (tedy na preloadu a afterloadu) a naopak jeho závislost na inotropních podnětech; podání pozitivně inotropních látek vedlo k vzestupu Mw [18].
V experimentu je pro stanovení PRSW výše uvedeným postupem dosahováno změny EDV částečnou okluzí dolní duté žíly, což v klinické praxi nelze. Protože je hodnota Vw u jednotlivce poměrně konstantní, lze při znalosti echokardiograficky/ ventrikulograficky změřených objemů LK, srdeční masy, tlaku v aortě a EDV v LK stanovit Mw z jednoho srdečního cyklu při srdeční katetrizaci [19]. Mw je tedy v klinické praxi stanovitelný s využitím levostranné srdeční katetrizace.
Význam nových parametrů kontraktility
V klinickém výzkumu se Mw stal uznávaným referenčním ukazatelem kontraktility, se kterým jsou porovnávány jiné zavedené nebo klinicky snadněji využitelné metody, např. echokardiograficky stanovený strain a strain rate [20 – 22].
Shingu et al demonstrovali prognostický význam Mw u operace mitrální chlopně pro regurgitaci [23]. PRSW není zatížen fenoménem afterload mismatch, a může tak být přínosný k odlišení pseudostenózy a kritické aortální stenózy s nízkou EF, ale zachovanou kontraktilitou.
PRSW je považován za dobrý parametr pro hodnocení důsledků akutní ischemie myokardu, a stal se proto frekventně využívaným v experimentu [24 – 28] na zvířecích modelech. Metodika je však pro rutinní klinickou praxi poměrně pracná.
Zjednodušením vzorce pro Mw lze získat parametr, který [29] odpovídá hodnotě SW/ EDV a který je zároveň silným prognostickým markerem v akutní fázi infarktu myokardu a lze jej stanovit pouze z hodnot EF LK, EDP LK a systolického krevního tlaku v aortě.
Limitace nových parametrů kontraktility při odhadu prognózy nemocných
V současnosti nejsou k dispozici rozsáhlejší práce dokumentující dobře prognostický význam kontraktility myokardu na širší populaci. Problémem může být skutečnost, že kontraktilita myokardu se v čase u zdravého i nemocného srdce mění a je ovlivněna pozitivně a negativně inotropními léky (katecholaminy, anestetika apod.) [30]. Uvedený problém se však týká i v současnosti užívaných prognostických markerů, jako je EF, dP/ dt apod. Roli hraje i změna kontraktility ve fyziologickém rozmezí vlivem endogenní aktivace sympatiku např. při zátěži apod. Řešením je stanovení myokardiální rezervy pomocí PRSW relationship nebo SW [31]. Opět ale narážíme na pracnost, a tak omezenou použitelnost v klinické praxi. U pacientů na mimotělní oběhové podpoře je měření vztahu PRSW zkresleno, přičemž právě u této skupiny by hodnocení kontraktility mohlo pomoci při rozhodování o ukončení oběhové podpory [32].
Parametry práce a výkonu
SW LK (left ventricular stroke work, stroke work)
Byla popsána výše.
Srdeční výkon
Srdeční výkon (cardiac power output – CPO) je ukazatelem intenzity srdeční práce či přesněji rychlosti, s jakou je srdeční práce vykonávána (tepovou frekvenci – R). CPO je tedy podobně jako SW závislý na preloadu a kontraktilitě a navíc i srdeční frekvenci. Je vyjádřením minutového výdeje a krevního tlaku [33]:
CPO = MAP × SV × HR = MAP × CO
(MAP – třední hodnota krevního tlaku, mean arterial pressure, CO – srdeční výdej)
Z uvedeného vyplývá, že CPO není SW LK × HR, protože nezohledňuje diastolický tlak v LK. Terminologie je v literatuře značně měnlivá a nepřesná, parametry SW a CPO/ HR bývají zaměňovány [34]. Tato skutečnost je velmi podstatná zejména u regurgitačních vad, kdy roste preload (diastolický tlak v komoře) a jeho zohlednění je pro hodnocení srdeční funkce nezbytné [10], což využití CPO v těchto případech (pro odhad vývoje srdeční funkce po operaci vady) teoreticky kompromituje. Na druhou stranu, podobně jako v případě SW není CPO afterload dependentní a netrpí fenoménem tzv. afterload mismatch. Protože je CPO na kontraktilitě závislý, je rovněž ovlivněn inotropními faktory.
Význam a limitace parametrů práce a výkonu
Hodnota SW i CPO v klidu je závislá na kontraktilitě i preloadu. Pro odhad prognózy trpí stejnými limitacemi jako parametry kontraktility. Na rozdíl od nich je ale CPO snáze stanovitelný, a proto i snáze měřitelný při zátěži. Spiroergometrie u chronického srdečního selhání opakovaně prokázala svůj přínos, přičemž vrcholová spotřeba kyslíku koreluje s vrcholovým srdečním výkonem [35]. Zatímco měření kontraktilní rezervy je vzhledem k náročnosti stanovení srdeční kontraktility (viz výše) poměrně složité, zhodnocení peak CPO (vrcholového srdečního výkonu při fyzické nebo farmakologické zátěži) se jeví jednodušší. Jedná se v podstatě o srdeční rezervu vyjádřenou pomocí CPO. Chomsky et al ve své práci prokázali, že odpověď CPO na zátěž je silným prognostickým markerem 1ročního přežití pacientů s chronickým srdečním selháním [35]. Dle Tana mají pacienti s CPO při stimulaci dobutaminem nižším než 1 W, což odpovídá normální klidové hodnotě CPO u zdravého člověka, velmi špatnou prognózu [36].
U pacientů s akutním koronárním syndromem v kardiogenním šoku je kontraktilní rezerva zcela vyčerpána. U této skupiny pacientů stanovení srdeční rezervy nemá smysl a samotný aktuální CPO je nejsilnějším prediktorem hospitalizační mortality, převyšuje všechny ostatní zkoumané hemodynamické ukazatele (PRSW jako přesný parametr kontraktility nebyl v této souvislosti dosud v žádné práci hodnocen). Spolu s tepovou prací se ukázal být nezávislým prediktorem i v multivariantní analýze [34]. Důležité je rovněž zjištění, že CPO si zachoval svůj prediktivní význam i v případě užití intraaortální balonkové kontrapulzace (IABP). Tato práce však nezahrnovala pacienty s izolovaným selháním pravé komory srdeční.
Zajímavým příkladem dlouhodobě využívaného hodnocení CPO (aniž by bylo takto označováno) je stanovení kontraktilní rezervy myokardu u těsné aortální stenózy s dysfunkcí LK pomocí dobutaminové echokardiografie. V průběhu vyšetření hodnotíme SV a srdeční frekvenci (minutový výdej), krevní tlak a gradient na aortální chlopni, dohromady tak v podstatě posuzujeme CPO a jeho vývoj při farmakologické zátěži. Vzestup gradientu na aortální chlopni se vzestupem minutového výdeje při neklesajícím systémovém krevním tlaku (tedy v podstatě vzestup CPO) je pokládán za průkaz kontraktilní rezervy a prognosticky příznivou známku podporující indikaci k operačnímu řešení vady.
Závěr
EF neodráží přesně srdeční kontraktilitu, je částečně preload i afterload dependentní a v některých situacích se o ni nelze opírat při rozhodování o další léčbě – apř. při indikaci k operaci chlopenní vady nebo indikaci k OTS. Nové parametry hodnocení srdeční funkce se staly užitečnými v klinickém výzkumu a díky tomu mohou najít uplatnění i v klinické praxi. Jejich největší limitací pro rutinní užití je pracnost jejich stanovení. V určitých situacích (chlopenní vady, kardiogenní šok) však nemají alternativu. Lze shrnout, že parametry kontraktility jako endsystolická elastance a PRSW relationship našly svůj význam především jako referenční ukazatele srdeční stažlivosti ve výzkumu a klinicky mohou být přínosné v situacích, kde je preload či afterload výrazně patologicky změněný a EF nelze pro hodnocení srdeční funkce použít. Tyto situace zahrnují především zmíněné regurgitační vady, jako je akutní ischemická mitrální regurgitace a také stenotické vady s afterload mismatch. Oproti tomu ukazatele srdeční práce a výkonu – W index a CPO – jsou snadněji stanovitelné, měřitelné tak i při zátěži, a především jejich vrcholové hodnoty (tedy srdeční rezerva) jsou silným prognostickým markerem pacientů se srdečním selháním nezávisle na hodnotě EF. V případě kardiogenního šoku je srdeční rezerva vyčerpána a vztah mezi CPO a prognózou je přímý.
Doručeno do redakce: 24. 9. 2017
Přijato po recenzi: 2. 10. 2017
MUDr. Martin Tesák
www.nem-tr.cz
mtesak@nem-tr.cz
Sources
1. Sonnenblick EH. Correlation of myocardial ultrastructure and function. Circulation 1968; 38(1): 29 – 44.
2. Kennedy JW, Baxley WA, Figley MM et al. Quantitative Angiocardiography. Circulation 1966; 34(2): 272. doi: 10.1161/ 01.CIR.34.2.272.
3. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129 – 2200. doi: 10.1093/ eurheartj/ ehw128.
4. Brignole M, Auricchio A, Baron-Esquivias G et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34(29): 2281 – 2329. doi: 10.1093/ eurheartj/ eht150.
5. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33(19): 2451 – 2496. doi: 10.1093/ eurheartj/ ehs109.
6. Clavel MA, Côté N, Mathieu P et al. Paradoxical low-flow, low-gradient aortic stenosis despite preserved left ventricular ejection fraction: new insights from weights of operatively excised aortic valves. Eur Heart J 2014; 35(38): 2655 – 2662. 10.1093/ eurheartj/ ehu152.
7. Ejection Fraction Revisited: Anesthesiology. Available at: http:/ / journals.lww.com/ anesthesiology/ Fulltext/ 1991/ 01000/ Ejection_Fraction_Revisited_.26.aspx.
8. Krayenbuhl HP, Bussmann WD, Turina M et al. Is the ejection fraction an index of myocardial contractility? Cardiologia 1968; 53(1):1 – 10.
9. Davidson BP, Giraud GD. Left ventricular function and the systemic arterial vasculature: remembering what we have learned. J Am Soc Echocardiogr 2012; 25(8): 891 – 894. doi: 10.1016/ j.echo.2012.06.020.
10. Shingu Y, Matsui Y. Did we misunderstand how to calculate total stroke work in mitral regurgitation by echocardiography? Circ J 2012; 76(6): 1533 – 1534. doi: 10.1253/ circj.CJ-12-0319.
11. Lainchbury JG, Richards AM. Exercise testing in the assessment of chronic congestive heart failure. Heart 2002; 88(5): 538 – 543. doi: 10.1136/ heart.88.5.538
12. Sagawa K. The end-systolic pressure-volume relation of the ventricle: definition, modifications and clinical use. Circulation 1981; 63(6): 1223 – 1227. doi: 10.1161/ 01.CIR.63.6.1223
13. Chen CH, Fetics B, Nevo E et al. Noninvasive single-beat determination of left ventricular end-systolic elastance in humans. J Am Coll Cardiol 2001; 38(7): 2028 – 2034. doi: 10.1016/ S0735-1097(01)01651-5.
14. Feneley MP, Skelton TN, Kisslo KB et al. Comparison of preload recruitable stroke work, end-systolic pressure-volume and dPdtmax-end-diastolic volume relations as indexes of left ventricular contractile performance in patients undergoing routine cardiac catheterization. J Am Coll Cardiol 1992; 19(7): 1522 – 1530. doi: 10.1016/ 0735-1097(92)90613-R.
15. Frank FO. Zur Dynamik des Herzniuskels. Z Biol 1895; 32 : 370 – 447.
16. Patterson SW, Starling EH. On the mechanical factors which determine the output of the ventricles. J Physiol 1914; 48(5): 357 – 379.
17. Sarnoff SJ, Berglund E. Ventricular function. Circulation 1954; 9(5): 706 – 718. doi: 10.1161/ 01.CIR.9.5.706.
18. Glower DD, Spratt JA, Snow ND et al. Linearity of the Frank-Starling relationship in the intact heart: the concept of preload recruitable stroke work. Circulation 1985; 71(5): 994. doi: 10.1161/ 01.CIR.71.5.994.
19. Lee WS, Huang WP, Yu WC et al. Estimation of preload recruitable stroke work relationship by a single-beat technique in humans. Am J Physiol Heart Circ Physiol 2003; 284(2): 744 – 750. doi: 10.1152/ ajpheart.00455.2002.
20. Kovács A, Oláh A, Lux Á et al. Strain and strain rate by speckle-tracking echocardiography correlate with pressure-volume loop-derived contractility indices in a rat model of athlete’s heart. Am J Physiol Heart Circ Physiol 2015; 308(7): 743 – 748. doi: 10.1152/ ajpheart.00828.2014.
21. Pagel PS, Kampine JP, Schmeling WT et al. Comparison of end-systolic pressure-length relations and preload recruitable stroke work as indices of myocardial contractility in the conscious and anesthetized, chronically instrumented dog. Anesthesiology 1990; 73(2): 278 – 290.
22. Toombs CF, Vinten-Johansen J, Yokoyama H et al. Nonlinearity of indexes of left ventricular performance: effects on estimation of slope and diameter axis intercepts. Am J Physiol Heart Circ Physiol 1991; 260(6): 1802 – 1809.
23. Shingu Y, Kubota S, Wakasa S et al. Slope in preload recruitable stroke work relationship predicts survival after left ventriculoplasty and mitral repair in patients with idiopathic cardiomyopathy. J Cardiol 2015; 65(2): 157 – 163. doi: 10.1016/ j.jjcc.2014.04.010.
24. Glower DD, Spratt JA, Kabas JS et al. Quantification of regional myocardial dysfunction after acute ischemic injury. Am J Physiol 1988; 255(1): 85 – 93.
25. Kristo G, Yoshimura Y, Keith BJ et al. Adenosine A1/ A2a receptor agonist AMP-579 induces acute and delayed preconditioning against in vivo myocardial stunning. Am J Physiol 2004; 287(6): 2746 – 2753. doi: 10.1152/ ajpheart.00493.2004.
26. Kristo G, Yoshimura Y, Niu J et al. The intermediary metabolite pyruvate attenuates stunning and reduces infarct size in in vivo porcine myocardium. Am J Physiol 2004; 286(2): 517 – 524. doi: 10.1152/ ajpheart.00777.2003.
27. Schmidt MR, Smerup M, Konstantinov IE et al. Intermittent peripheral tissue ischemia during coronary ischemia reduces myocardial infarction through a KATP-dependent mechanism: first demonstration of remote ischemic perconditioning. Am J Physiol 2007; 292(4): 1883 – 1890. doi: 10.1152/ ajpheart.00617.2006.
28. Landymore RW, Bayes AJ, Murphy JT et al. Preconditioning prevents myocardial stunning after cardiac transplantation. Ann Thorac Surg 1998; 66(6): 1953 – 1957. doi: 10.1016/ S0003-4975(98)00902-3.
29. Tesak M, Kala P, Jarkovsky J et al. The value of novel invasive hemodynamic parameters added to the TIMI risk score for short-term prognosis assessment in patients with ST segment elevation myocardial infarction. Int J Cardiol 2016; 214 : 235 – 240. doi: 10.1016/ j.ijcard.2016.03.073.
30. Pagel PS, Kampine JP, Schmeling WT et al. Effects of nitrous oxide on myocardial contractility as evaluated by the preload recruitable stroke work relationship in chronically instrumented dogs. Anesthesiology 1990; 73(6): 1148 – 1157.
31. Metra M, Faggiano P, D’Aloia A et al. Use of cardiopulmonary exercise testing with hemodynamic monitoring in the prognostic assessment of ambulatory patients with chronic heart failure. J Am Coll Cardiol 1999; 33(4): 943 – 950. doi: 10.1016/ S0735-1097(98)00672-X.
32. Sugai TK, Tanaka A, Yoshizawa M et al. Influence of rotary blood pumps over preload recruitable stroke work. Conf Proc IEEE Eng Med Biol Soc 2010; 2010 : 2367 – 2370. doi: 10.1109/ IEMBS.2010.5627916.
33. Cotter G, Williams SG, Vered Z et al. Role of cardiac power in heart failure. Curr Opin Cardiol 2003; 18(3): 215 – 222.
34. Fincke R, Hochman JS, Lowe AM et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. J Am Coll Cardiol 2004; 44(2): 340 – 348. doi: 10.1016/ j.jacc.2004.03.060.
35. Chomsky DB, Lang CC, Rayos GH et al. Hemodynamic exercise testing. Circulation 1996; 94(12): 3176 – 3183. doi: 10.1161/ 01.CIR.94.12.3176.
36. Tan LB. Cardiac pumping capability and prognosis in heart failure. The Lancet 1986; 328(8520): 1360 – 1363. doi: 10.1016/ S0140-6736(86)92006-4.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 4-
All articles in this issue
- Antiarytmická léčba u fibrilace síní
- Upstream terapie u fibrilace síní, co nového?
- Úloha intrakardiální echokardiografie při katetrizační ablaci poruch srdečního rytmu
- Moderní pohled na elektrickou kardioverzi fibrilace síní
- Náhlá srdeční smrt a její diagnostika
- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Význam nových parametrů kontraktility a tepové práce pro hodnocení srdeční funkce a prognózy
- Kvalita života pacientů s dlouhodobou mechanickou srdeční podporou
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Revmatoidní artritida pro kardiologa
- Akutní selhání ledvin
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Akutní selhání ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

