-
Medical journals
- Career
Úloha intrakardiální echokardiografie při katetrizační ablaci poruch srdečního rytmu
Authors: T. Skála; M. Táborský
Authors‘ workplace: I. interní klinika – kardiologická LF UP a FN Olomouc
Published in: Kardiol Rev Int Med 2017, 19(4): 237-242
Overview
Katetrizační ablace je zavedená metoda léčby poruch srdečního rytmu. Se vzrůstajícím počtem ablací je stále více zapotřebí minimalizovat riziko a maximalizovat efekt této léčby. Intrakardiální echokardiografie (ICE) je obraz získaný z třísla intravaskulárně do srdce zavedeného řiditelného katetru. ICE dokáže přesně zobrazit veškeré srdeční struktury a do srdce zavedený materiál včetně diagnostických a ablačních katetrů. ICE zvyšuje bezpečnost i účinnost ablace monitorací polohy katetrů, tvorby ablační léze, blízkosti jícnu, přítomnosti trombů, polohy jehly před transseptální punkcí a obecně přesnou definicí oblasti ideální pro ablaci v síních i komorách. Díky ICE operatér v reálném čase přesně vidí, kde je a co dělá, což z ICE činí jednoho z nejdůležitějších pomocníků v rukou elektrofyziologa.
Klíčová slova:
intrakardiální echokardiografie – katetrizační ablace – bezpečnost – účinnostÚvod
Intravaskulární zavedení ultrazvukové sondy (ICE) umožnila její miniaturizace a umístění do hrotu řiditelného katetru. Po zavedení ICE sondy do srdce lze přímo vizualizovat anatomické struktury srdce, a tak kontrolovat veškeré intrakardiální výkony včetně katetrizační ablace [1]. Přímá vizuální kontrola výrazně zvyšuje přesnost i bezpečnost ablace [2]. ICE nejenže zobrazí veškeré části srdce, ale viditelný je i veškerý zavedený materiál, vč. diagnostických a ablačních katetrů. V ČR je ICE rutinně používán u většiny komplexních ablací síňových i komorových arytmií.
V našich podmínkách je nejčastěji používáno ICE zobrazení s využitím 64 ultrazvukových měničů zabudovaných v hrotu sondy sloužících k vysílání i přijímání ultrazvuku (tzv. phased-array sondy) [3]. Na našem pracovišti používáme 10F ICE sondy AcuNav (Biosense Webster Inc., USA) připojené k přenosnému echokardiografickému přístroji Vivid-i (GE Healthcare, Inc., USA) (obr. 1). Tento ICE katetr je řiditelný v pravolevé a předozadní rovině.
Image 1. Přenosný echokardiografický přístroj Vivid-i (GE Healthcare, Inc., USA). 
Ultrazvukový katetr se do srdce zavádí přes femorální žílu, optimálně přes 11F sheath (obr. 2). Katetr se přes dolní dutou žílu zavádí do pravé síně. ICE snímá 90° obraz orientovaný v dlouhé ose katetru. Díky řiditelnosti katetru je sondu možné zavést do různých částí srdce a změnou sklonu zobrazit prakticky všechny srdeční struktury.
Image 2. Ultrazvukový katetr zavedený do srdce přes femorální žílu (11F sheath). 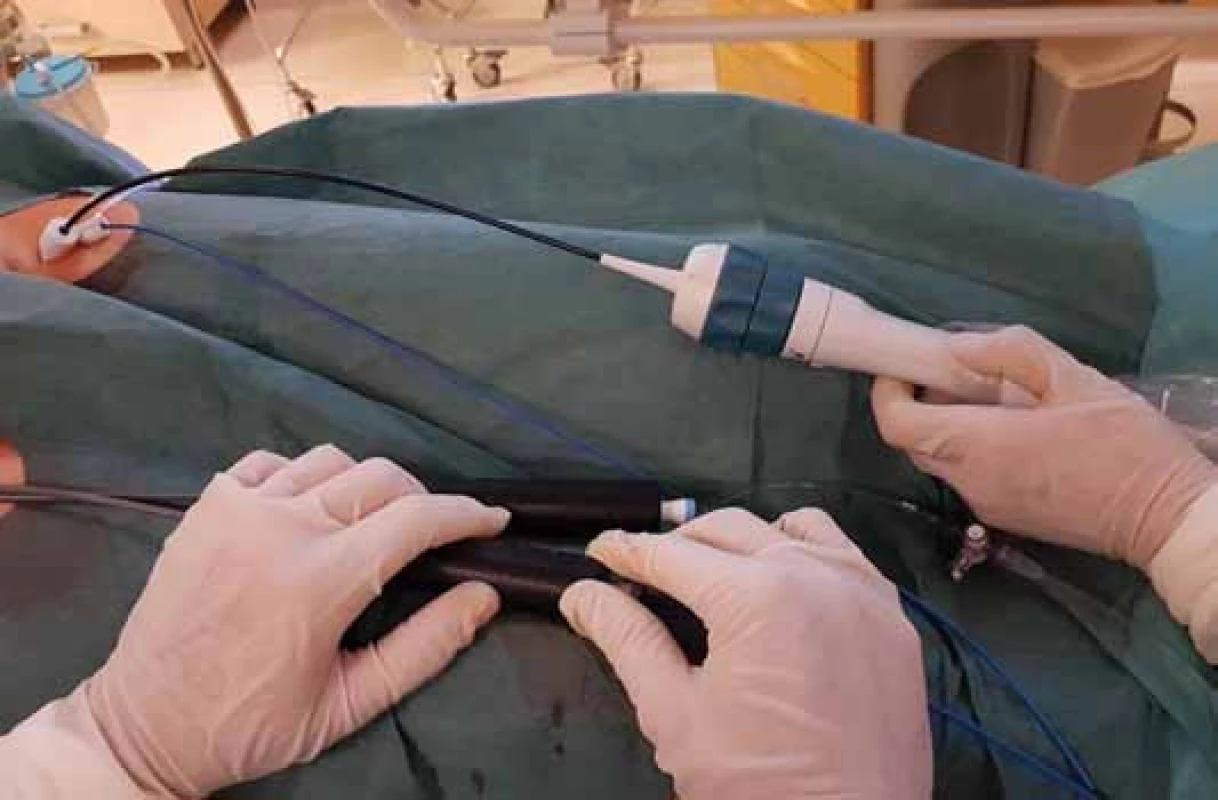
Nejznámější důvod využití ICE v elektrofyziologii je možnost přímé vizuální kontroly při provádění transseptální (TS) punkce. Díky obrovskému nárůstu počtu ablačních výkonů v levostranných srdečních oddílech je nezbytné eliminovat jakékoli riziko při provádění TS punkce. Využití ICE toto riziko snižuje prakticky k nule. S tím je spojena i možnost provedení TS punkce již za plné antikoagulace, což výrazně snižuje pravděpodobnost tromboembolických komplikací [4].
Dnes je tak již standardem podání plné heparinizace ještě před TS punkcí. Přímé zobrazení sheathu nám krom prosté vizualizace mezisíňového (IA) septa (obr. 3) umožňuje aktivní výběr přesného místa punkce, které je pro jednotlivé výkony různé. V případě různých anomálií, jako je například zavedený okluder v septu (obr. 4), je možnost přímého zobrazení septa k nezaplacení. TS punkci lze samozřejmě provést i bez ICE kontroly, nicméně v řadě případů je pozice síňového septa atypická a TS punkce pouze pod skiaskopickou kontrolou je spojena s výrazným rizikem komplikací. Při využití ICE se z dříve obávané TS punkce stal zcela bezpečný a jednoduchý výkon [5]. V průběhu ablace fibrilace síní (FS) je často nezbytné vrátit se ablačním katetrem z levé síně (LS) zpět do síně pravé (PS), ať již pro ablaci v síni či v koronárním sinu. Při následném návratu zpět do LS je nezbytné najít původní místo vstupu. Hledat drobnou dírku v IA septu bez ICE je velmi obtížné a spíše věcí náhody, s ICE je nejen jasné přibližné místo vstupu, ale často i patrna drobná dírka v septu (obr. 5), a protože je stejně dobře vidět i katetr, je jeho zavedení zpět do LS otázkou jen několika sekund.
Image 3. Řiditelný transseptální sheath (Agilis, St. Jude Medical) zavedený z pravé síně do levé síně punkcí mezisíňového septa. 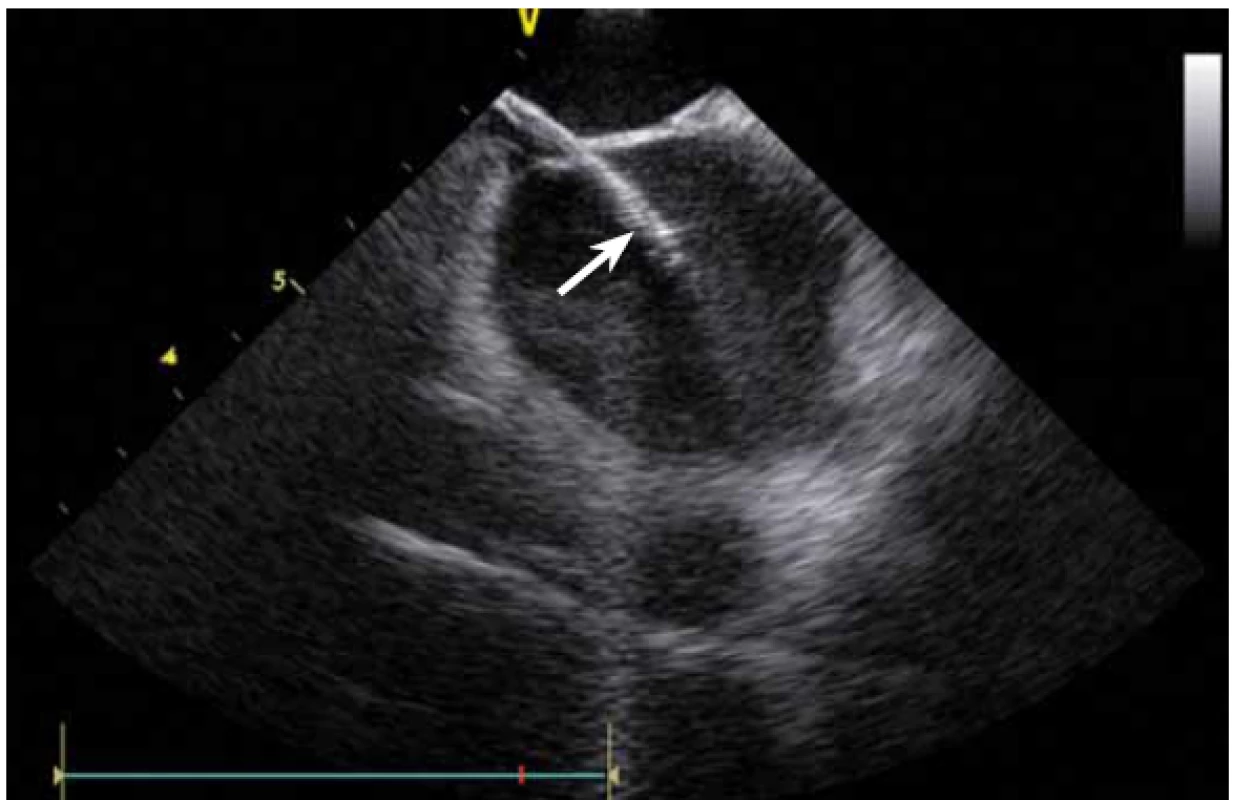
Image 4. Okluder po uzávěru defektu v mezisíňovém septu výrazně omezující místo pro možnou transseptální punkci. 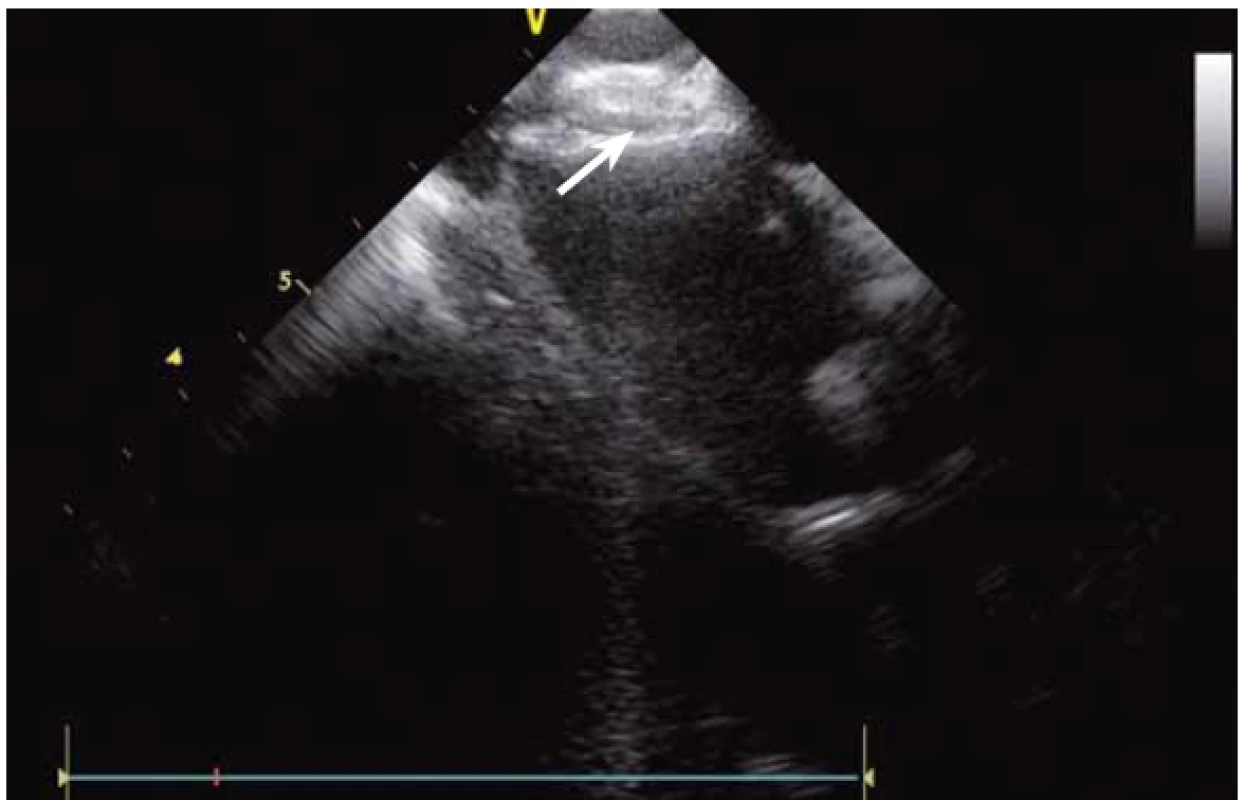
Image 5. Drobná dírka v mezisíňovém septu po vytaženém sheathu po transseptální punkci. 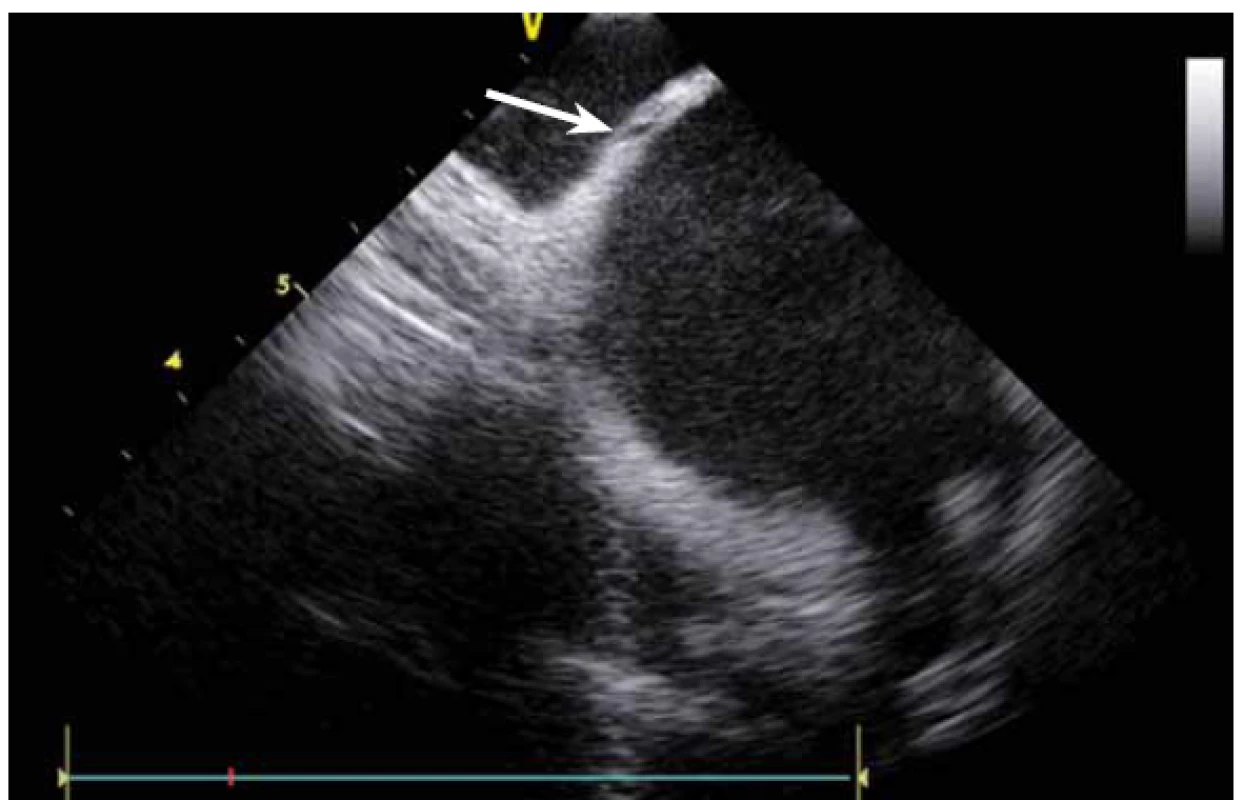
Základem ablace FS je izolace plicních žil (pulmonary vein – PV). PV lze za použití větší dávky RTG záření a kontrastní látky vizualizovat přímo, s ICE není angiografie nutná. ICE umožňuje přímé zobrazení ústí plicních žil [2]. Anatomie PV může být velmi nestandardní (obr. 6 a, b, c) a při absenci CT modelu LS, jehož akvizice je spojena s nezanedbatelnou radiační zátěží, je bez ICE více než pravděpodobné, že ablace nebude cílena zcela přesně.
Obr. 6 a, b, c. 3D elektroanatomické modely levé síně ukazující rozdílné anatomie odstupů plicních žil. Pohled na levou síň zezadu (vlevo levostranné plicní žíly, vpravo pravostranné plicní žíly). Červené body – místa aplikace radiofrekvenční energie při ablaci z endokardu (izolace plicních žil). Zelené body – místa aplikace radiofrekvenční energie při ablaci z epikardu (z koronárního sinu). 
Jako při všech ablacích jde i u ablace FS jak o bezpečnost, tak i o účinnost. Účinnost je samozřejmě vyšší v případě lepšího kontaktu katetru s myokardem [6]. Ablační katetr je na ICE přímo vidět, a tak lze při nedostatečném kontaktu polohu katetru v reálném čase upravovat (obr. 7). Dobře je i vidět sheath, s kterým je tak možno jednoduše manévrovat bez skiaskopie. Při neadekvátně vysoké síle kontaktu je možné srdce perforovat se vznikem srdeční tamponády, což je potenciálně fatální komplikace. Nedostatečný kontakt je ale na druhou stranu spojen s nedostatečně provedenou ablací. Místo transmurální nekrózy dosáhneme pouze vzniku lokálního edému tkáně, který stejně jako nekróza s budoucím vývojem v jizvu nevede elektrické vzruchy. S odstupem času nicméně v případě edému dojde k jeho opadnutí, což je spojeno s návratem elektrické vodivosti a recidivou arytmie. Kontakt katetru je tak s ohledem na maximalizaci úspěšnosti ablace dobré přímo sledovat, a to nejen u izolace plicních žil, ale obecně u jakékoli ablace (obr. 8).
Image 6. Poloha katetru při ablaci. Hrot ablačního katetru na dolním okraji antra levé dolní plicní žíly. Druhý, diagnostický, katetr zavedený do ústí levé horní plicní žíly. 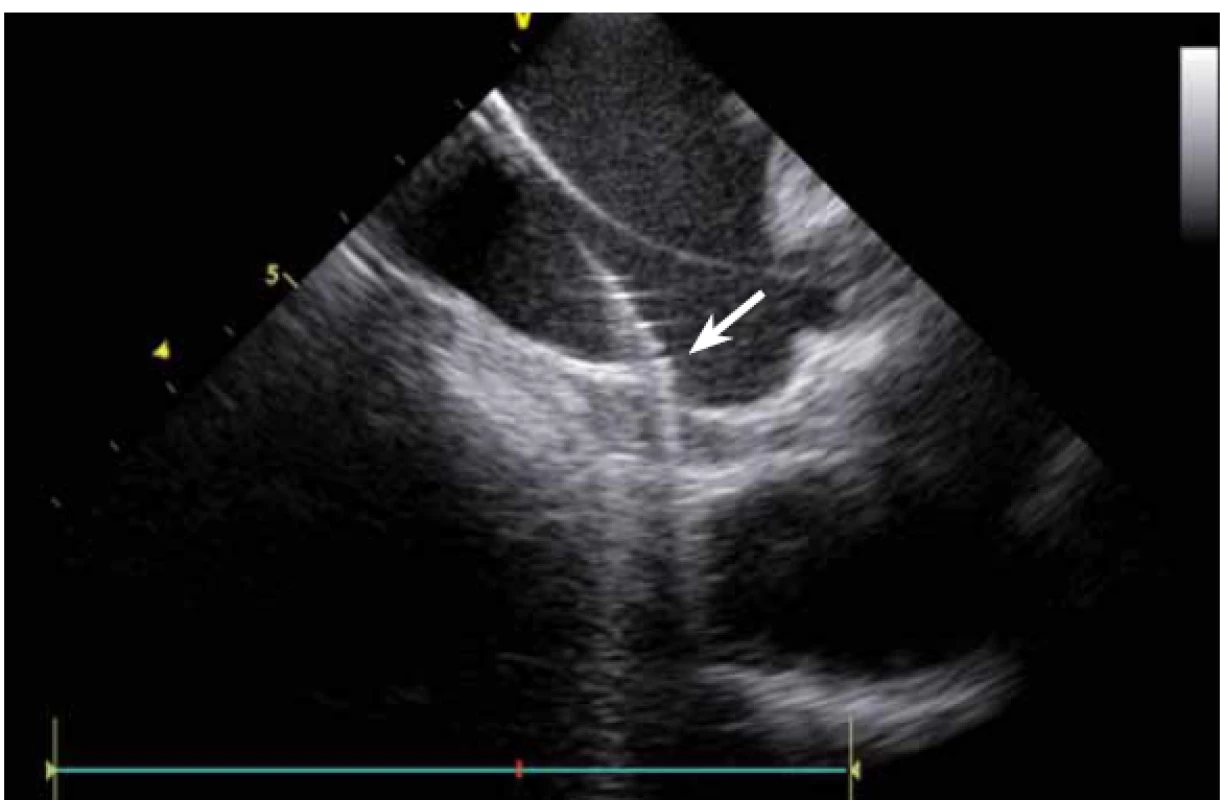
Image 7. Poloha katetru při ablaci v místě stropní linie v levé síni (spojnice mezi levou horní a pravou horní plicní žílou). 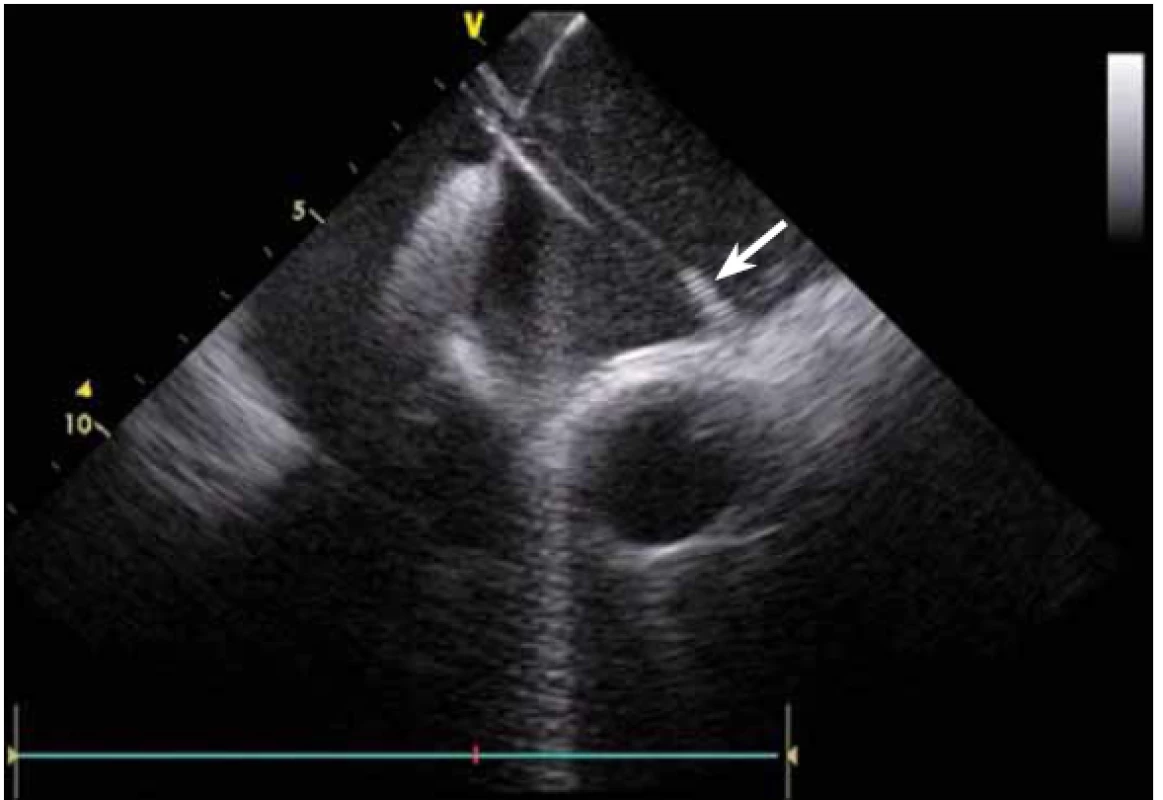
ICE je ale hlavně zcela zásadní pomůcka pro co největší bezpečnost ablace. Krom již zmíněné TS punkce lze na začátku výkonu prohlédnout ouško LS, a vyloučit tak v něm přítomný trombus (obr. 9). Pokud ouško LS není dobře viditelné z PS, lze ICE sondu zasunout až do plicní arterie, odkud je ouško přehledné vždy, a to dokonce i lépe než z jícnové echokardiografie [7]. V případě poklesu krevního tlaku se lze okamžitě podívat na perikard, a v případně nově vzniklé významnější separace tak neprodleně zahájit řešení srdeční tamponády (obr. 10). Již bylo zmíněno, že pro udržení stabilního, optimálního kontaktu ablačního katetru je vhodné neustálé kontinuální sledování hrotu katetru na ICE. V případě náhlého lokálního přehřátí tkáně při ablaci tak lze okamžitě spatřit mikrobublinky tryskající z místa kontaktu ablačního katetru s myokardem. Pečlivé sledování ICE obrazu umožní okamžité zastavení ablace. Pokud by se v ablaci pokračovalo, došlo by během několika sekund k mohutné erupci vodních par (tzv. steam-pop) s lokálním roztržením myokardu, potenciálně s perforací srdce a srdeční tamponádou. Náhlé lokální zbělení tkáně (obr. 11) je odrazem vysoké teploty blízko 100 °C díky mikrokavitacím v buňkách a musí rovněž vést k okamžitému zastavení ablace [8]. Fatální komplikací ablace v LS je atrioezofageální fistula [9]. Zadní stěna LS je velmi tenká a těsně naléhá na jícen. Není tak vyloučeno, že bez kontroly polohy jícnu lze aplikovat větší množství radiofrekvenční energie, než je nutné a bezpečné. Poloha jícnu se během výkonu mění, předoperační zobrazení tak nemá větší smysl. ICE dokáže jícen zobrazit přímo (obr. 12), a operatér tak v místě ablace přilehlé k jícnu může snížit množství energie či zkrátit dobu její aplikace. Je také samozřejmě možné ablaci provést o kus dál, tak aby se možnost poškození jícnu minimalizovala. Zvláště u pacientů v celkové anestezii, kteří na ablaci v blízkosti jícnu nemohou zareagovat bolestivě, je nezbytná buď vizualizace jícnu na ICE, či zavedení sondy měřící teplotu v jícnu.
Image 8. Ouško levé síně, bez patrného trombu. 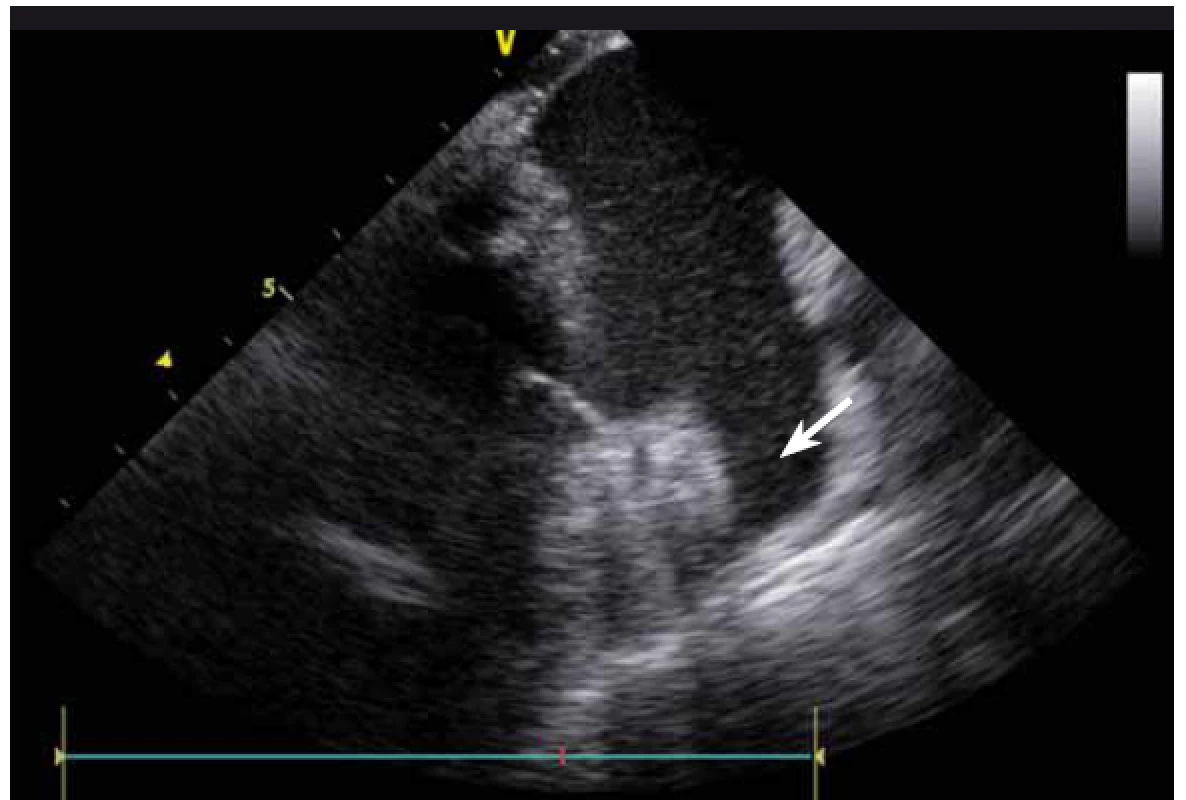
Image 9. Levá komora srdeční, patrna výrazná separace v perikardu. 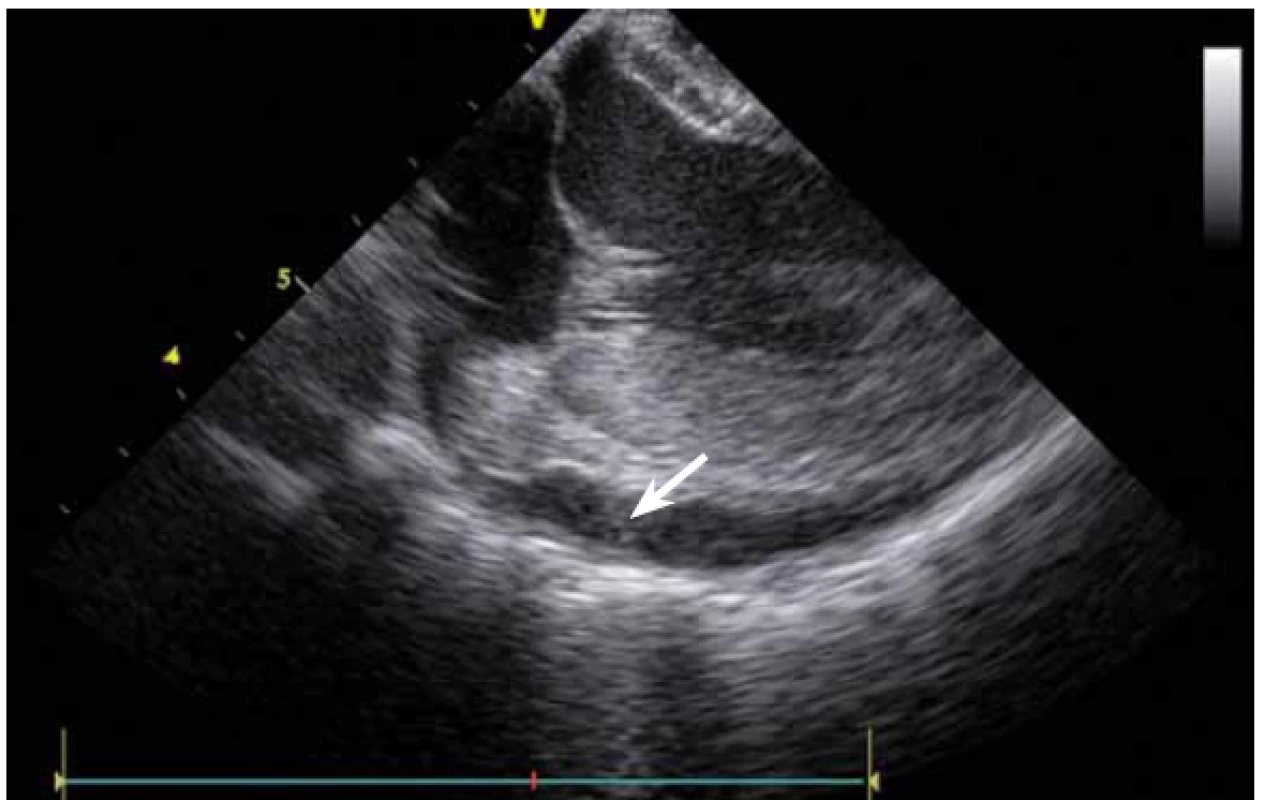
Image 10. Ablační katetr v místě náhlého lokálního zbělení myokardu v místě lokálně vysoké teploty blízko 100°C. 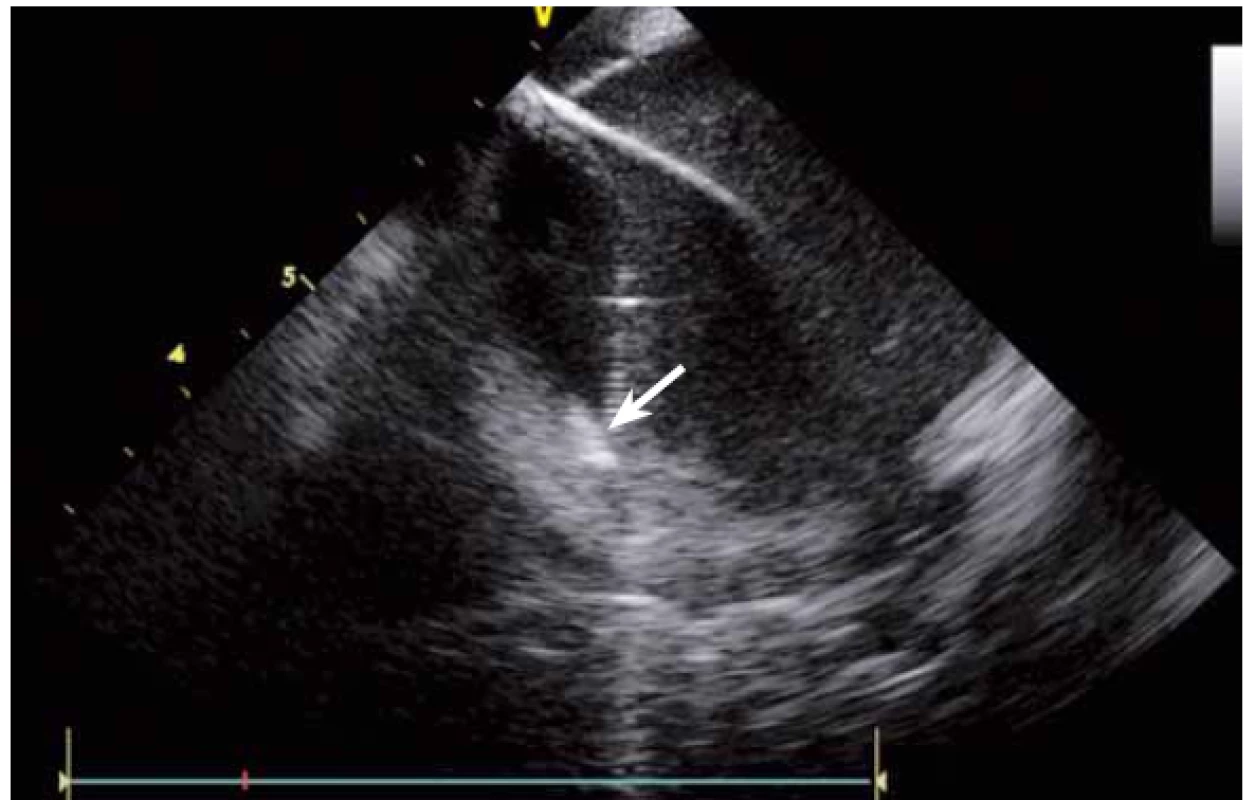
Image 11. Jícen v těsné blízkosti u zadní stěny levé síně, patrný nalevo pod ablačním katetrem. 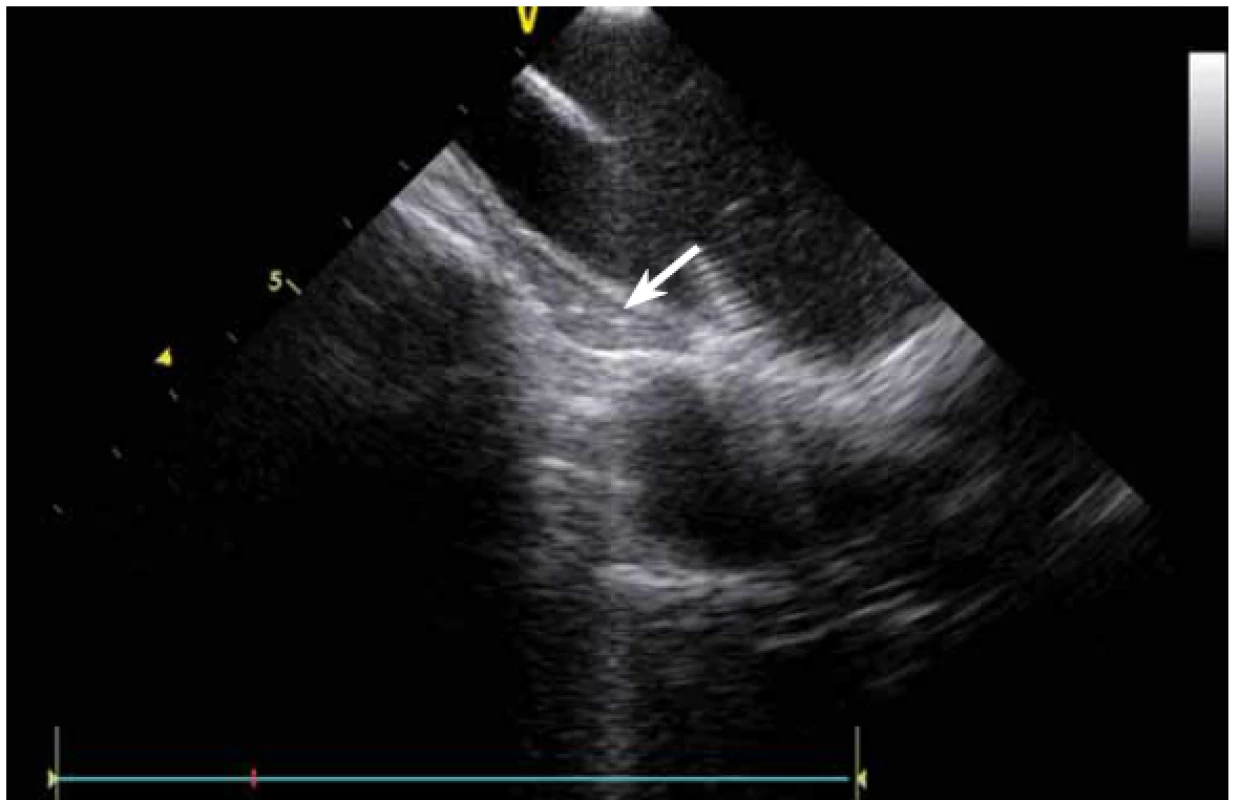
Jednou z nejčastějších arytmií, které se řeší katetrizační ablací, je typický flutter síní. Při ablaci této arytmie se provádí lineární ablace od trikuspidální chlopně k ústí dolní duté žíly. Standardně jde o jeden z nejjednodušších výkonů, nicméně v případě složitější anatomie kavotrikuspidálního můstku (CTI) se i tento výkon může stát velmi složitým. ICE dokáže přímo vizualizovat CTI (obr. 13), a tak umožní vybrat optimální přístup při různých anatomiích, zvolit proplachovaný katetr v případě výrazného pouche (obr. 14), použít řiditelný sheath či backloop manévr při isthmu tvaru písmene C (resp. prominentní Eustachově řase) (obr. 15), přesunout navigaci při výrazné Chiariho síťce atd. [10]. Samozřejmě díky ICE lze sledovat aplikaci energie v reálném čase, a tak je možné včas vypnout ablaci při lokálním přehřátí tkáně. Díky ICE při ablaci typického flutteru síní prakticky vymizely dříve poměrně dost časté steam-popy.
Image 12. Kavotrikuspidální isthmus (místo ablace typického flutteru síní), hrot ablačního katetru v distální části isthmu u trikuspidální chlopně. 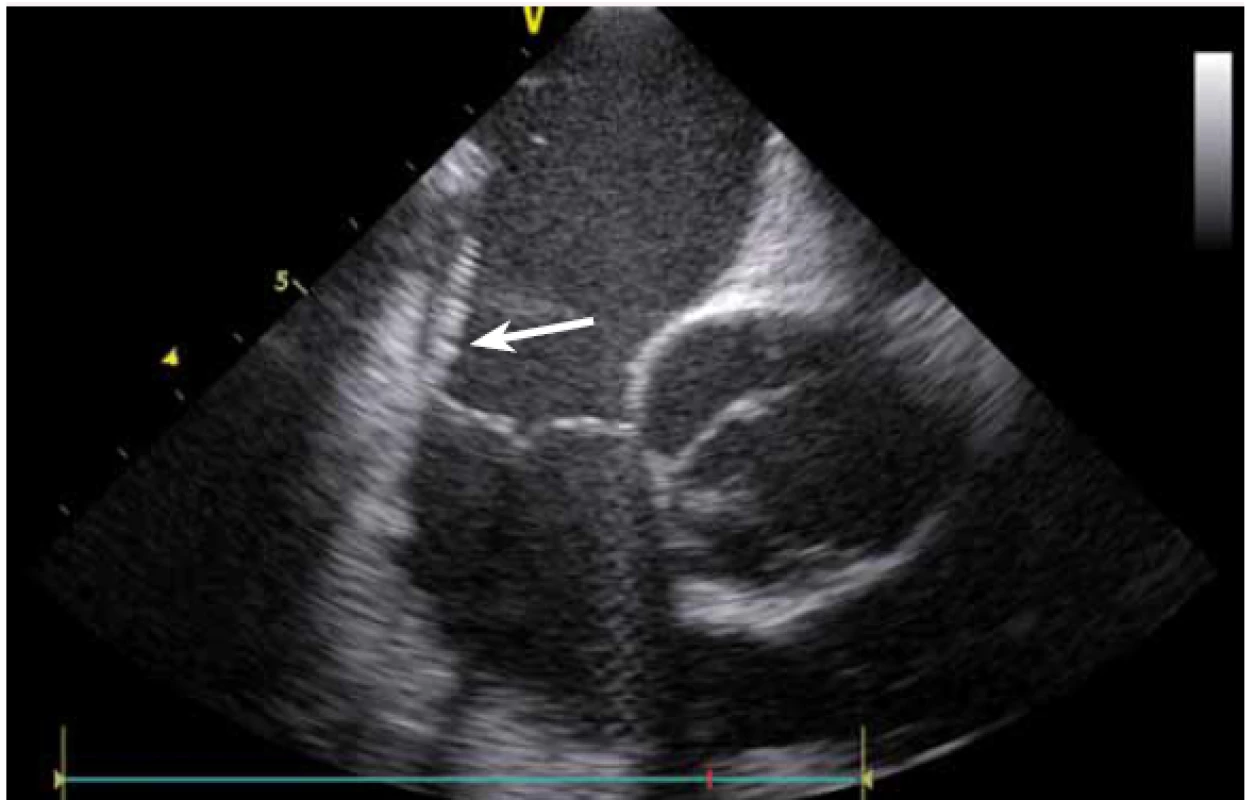
Image 13. Kavotrikuspidální isthmus, hrot ablačního katetru ve střední části isthmu v hlubokém pouchi, ablace nad pouchem byla bez efektu. Intrakardiální echokardiografie (ICE) zobrazení umožnilo ablaci chlazeným katetrem v hloubce pouche a dokončení blokády na isthmu. 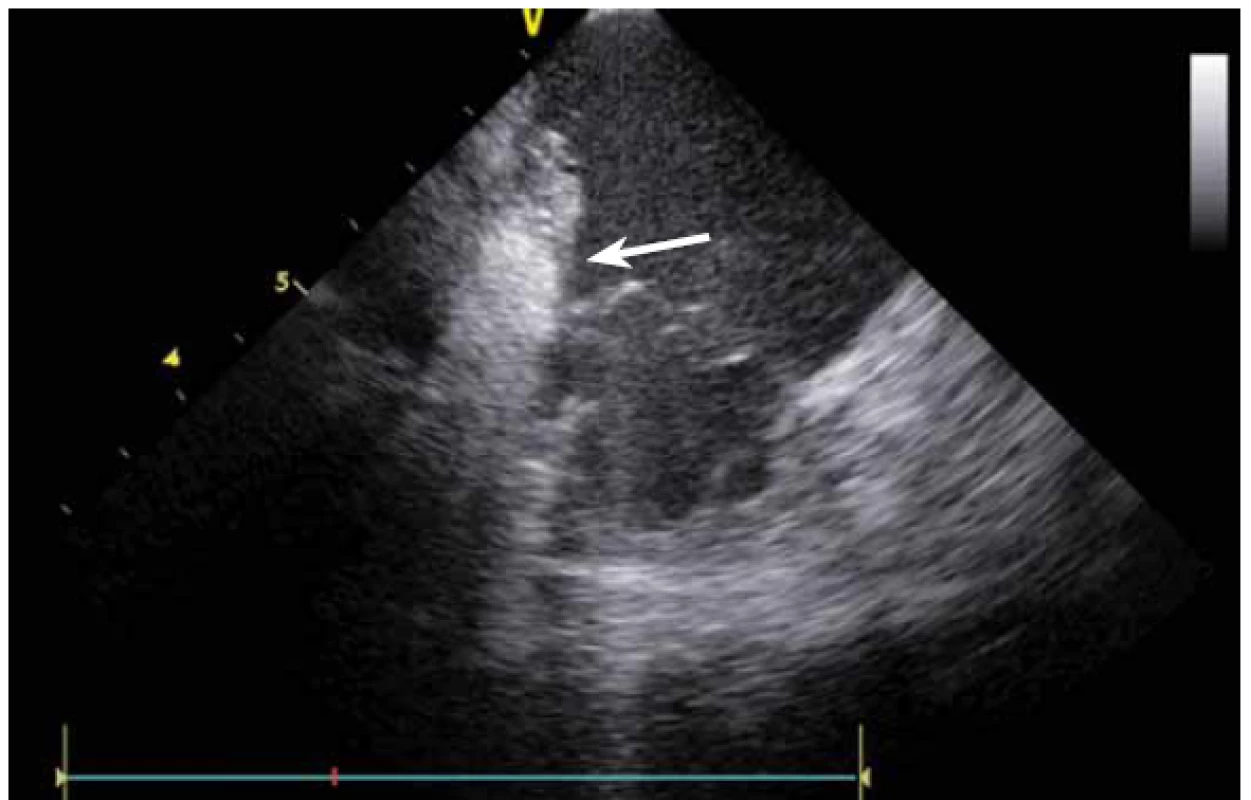
Image 14. Kavotrikuspidální isthmus, hrot ablačního katetru v proximální části isthmu v místě prominující Eustachovy řasy. Standardním zavedením katetru napřímo prakticky nelze dosáhnout kontaktu s isthmem, to je možné loopingem katetru o 180°. 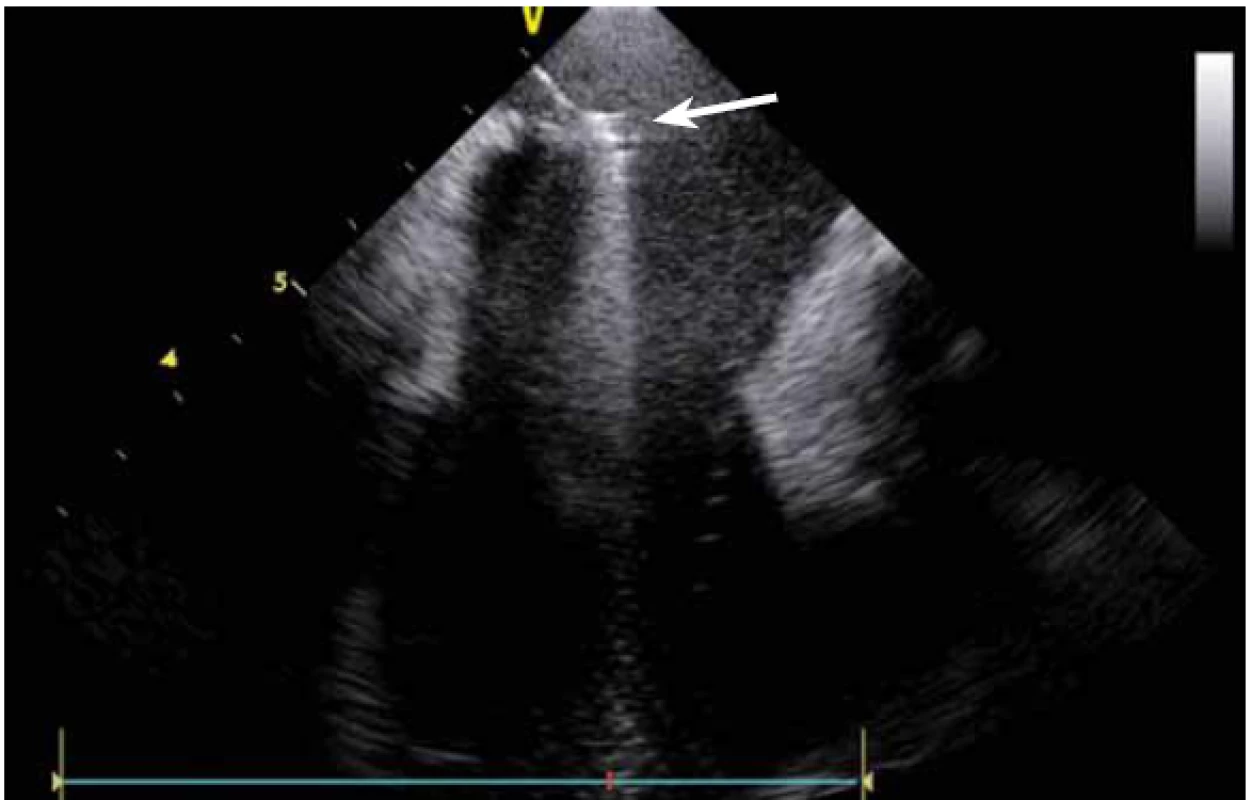
Stejně jako u síňových tachykardií se ICE využívá i u ablace komorových tachykardií (KT). Komorové tachykardie se vyskytují jak u pacientů se strukturálním srdečním onemocněním, kde je často na ICE patrný patologický substrát, tak i u pacientů bez makroskopicky nemocného srdce. U pacientů po infarktu myokardu (IM) vznikají většinou arytmie z jizevnaté tkáně, která je na ICE viditelně ztenčena, s jasnou poruchou kinetiky. Fakt, že je jizva po IM vidět, umožňuje jednoznačně cílit ablaci KT do patologické tkáně (obr. 16), a vyhnout se tak poškození normálního myokardu [11].
Image 15. Ablace komorové tachykardie při arytmické bouři. Hrot katetru v rozsáhlém inferobazálním aneuryzmatu levé komory s patrným ztenčeným myokardem. 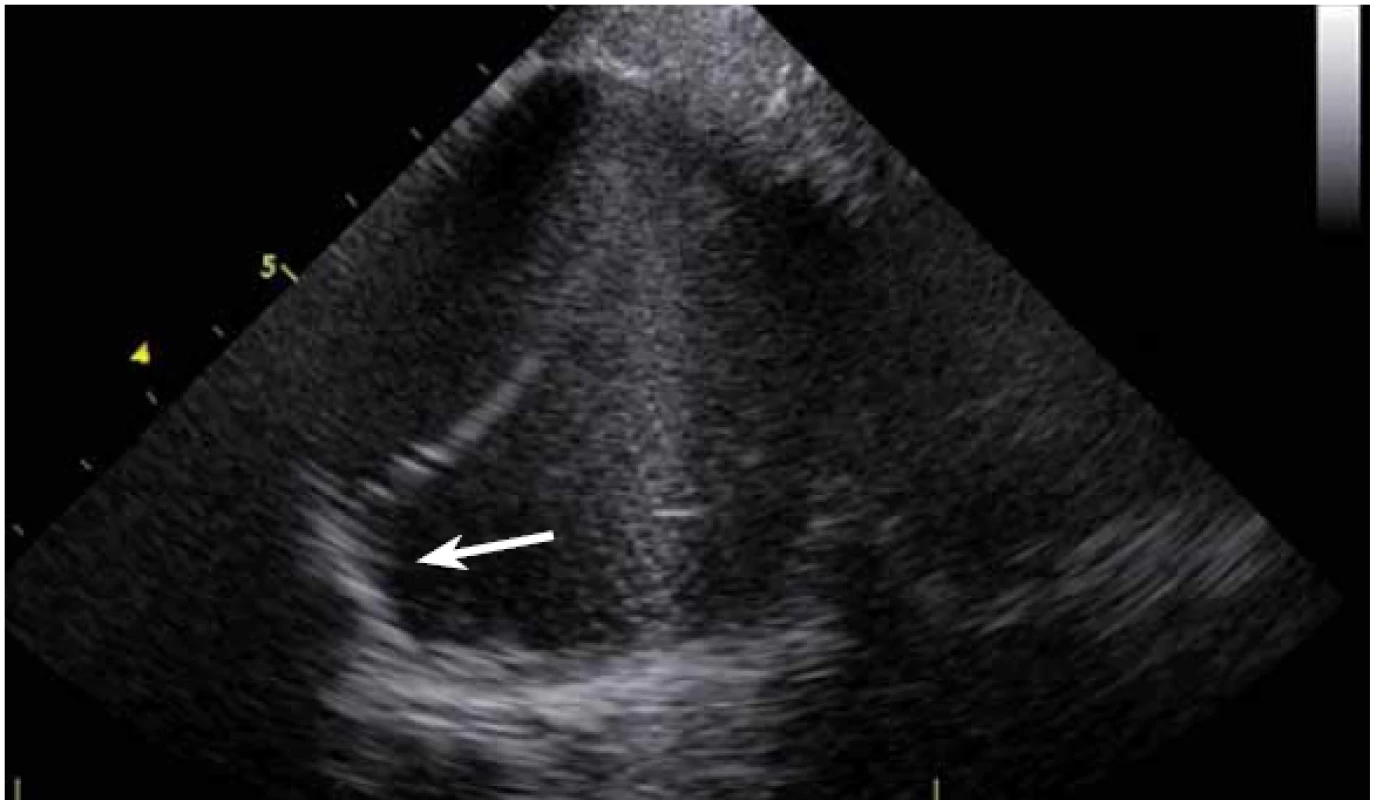
Nejčastější skupinou KT, resp. komorové extrasystolie (KES) u pacientů bez strukturálního srdečního onemocnění jsou KT z výtokových traktů obou srdečních komor (RVOT, LVOT) (obr. 17). Vzhledem k tomu, že KT z této složité anatomické oblasti mohou vycházet z výtokových traktů obou komor, plicnice i aortálních kapsiček, je možnost jejich přesného zobrazení neocenitelná (obr. 18, 19) [12]. Nejenže je v RVOT jasně patrný kontakt katetru s tkání, ale je rovněž v reálném čase jasně viditelné, jestli je katetr ještě v RVOT či již nad plicnicí, jeho orientace ve všech směrech bez ohledu na rotaci srdce. Při retrográdním přístupu do aorty je na ICE vidět, v které konkrétní aortální kapsičce se hrot katetru nachází, a ty tak jdou milimetr po milimetru vcelku snadno mapovat. Pro bezpečnost ablace v aortálních kapsičkách je zcela zásadní vzdálenost hrotu katetru při ablaci od ústí věnčitých tepen. Není tak nutná angiografie aorty i přesto, že ablace v ústí věnčité tepny může být fatální.
Image 16. Ablace komorové tachykardie z výtokového traktu pravé komory, hrot katetru na volné stěně pravé komory těsně pod pulmonální chlopní. 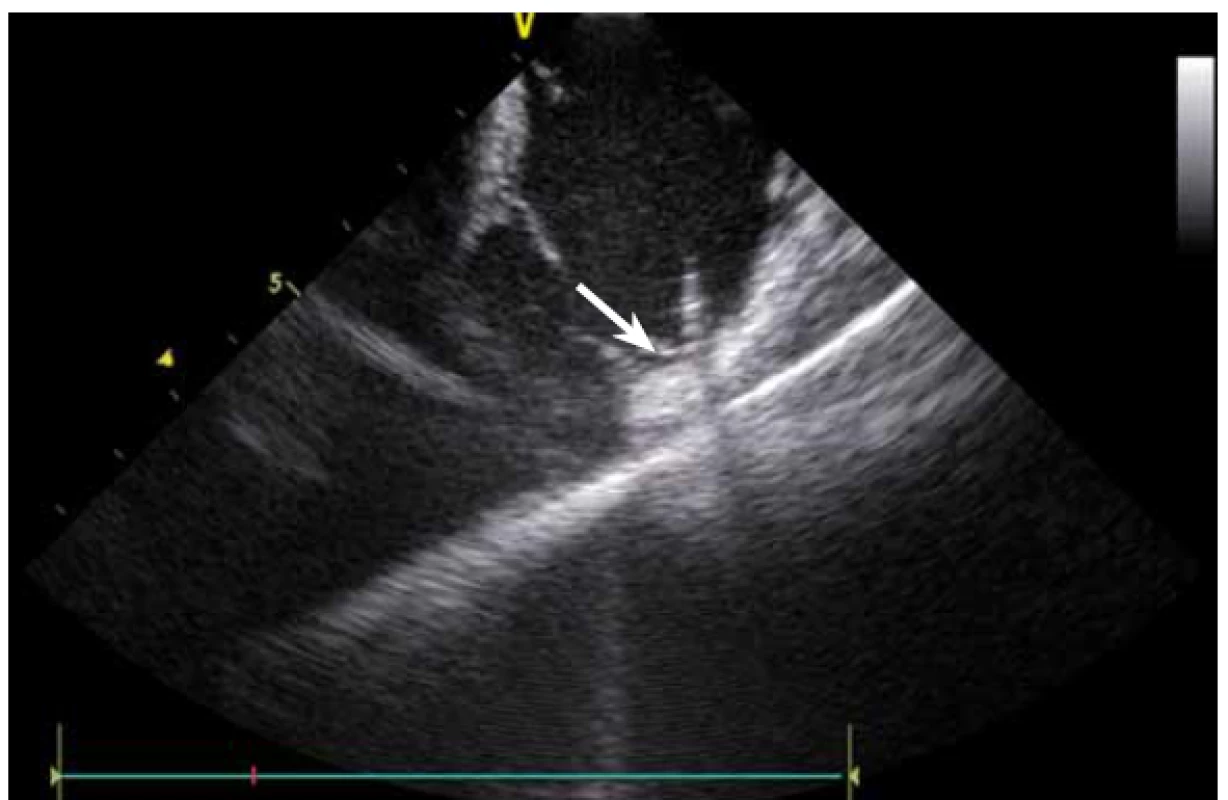
Image 17. Ablace komorové extrasystolie z oblasti komisury levé a pravé koronární kapsičky aorty, hrot katetru zavedený retrográdně napřímo do oblasti komisury. 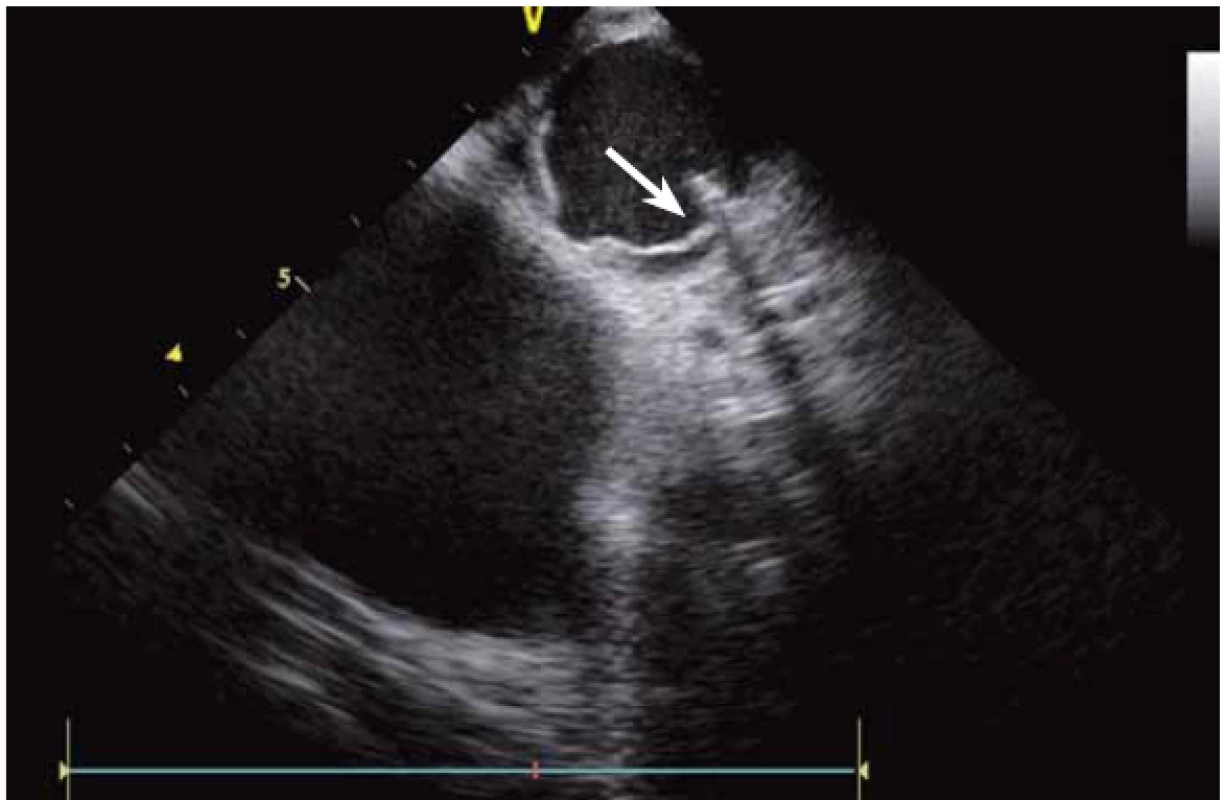
Image 18. Ablace komorové extrasystolie z oblasti komisury levé a pravé koronární kapsičky aorty, hrot katetru zavedený retrográdně přes aortální chlopeň do levé komory a následně back-loopem do oblasti komisury ze strany levé komory. 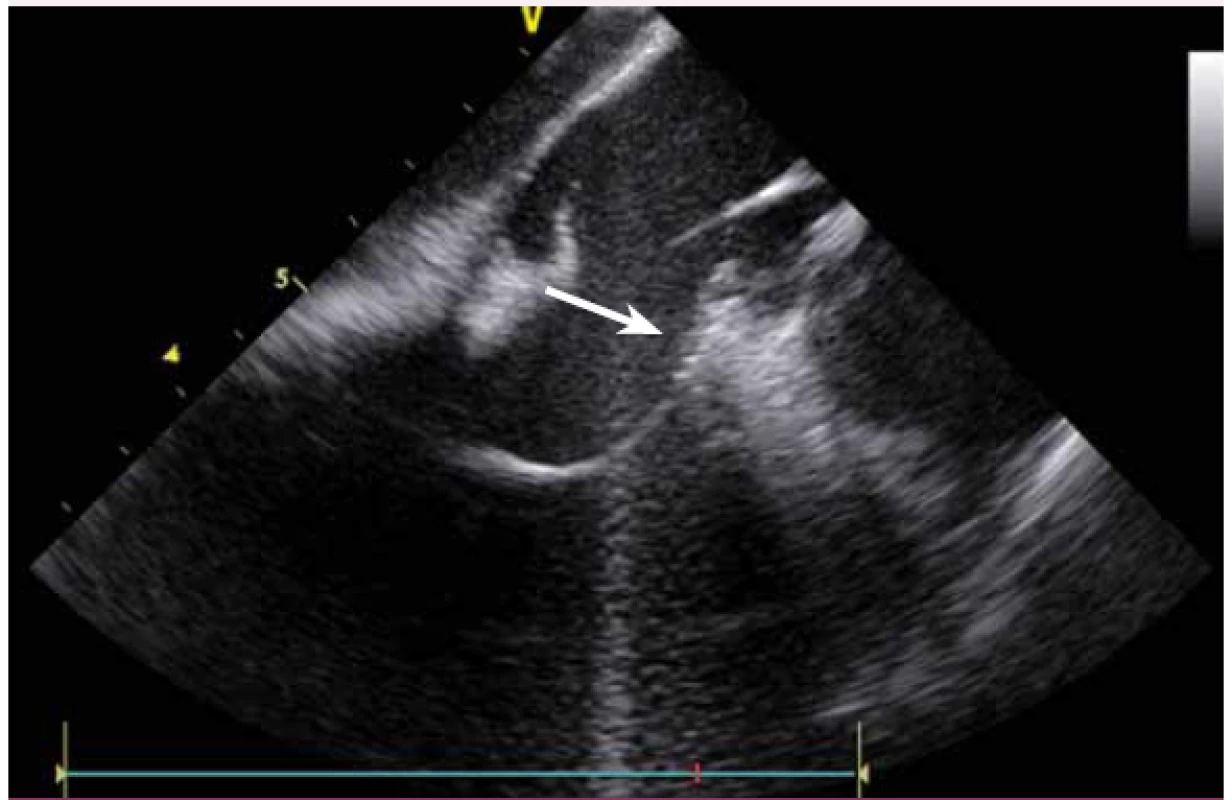
Image 19. Ablace komorové extrasystolie z oblasti papilárního svalu. Bublinky proplachu z hrotu chlazeného ablačního katetru. 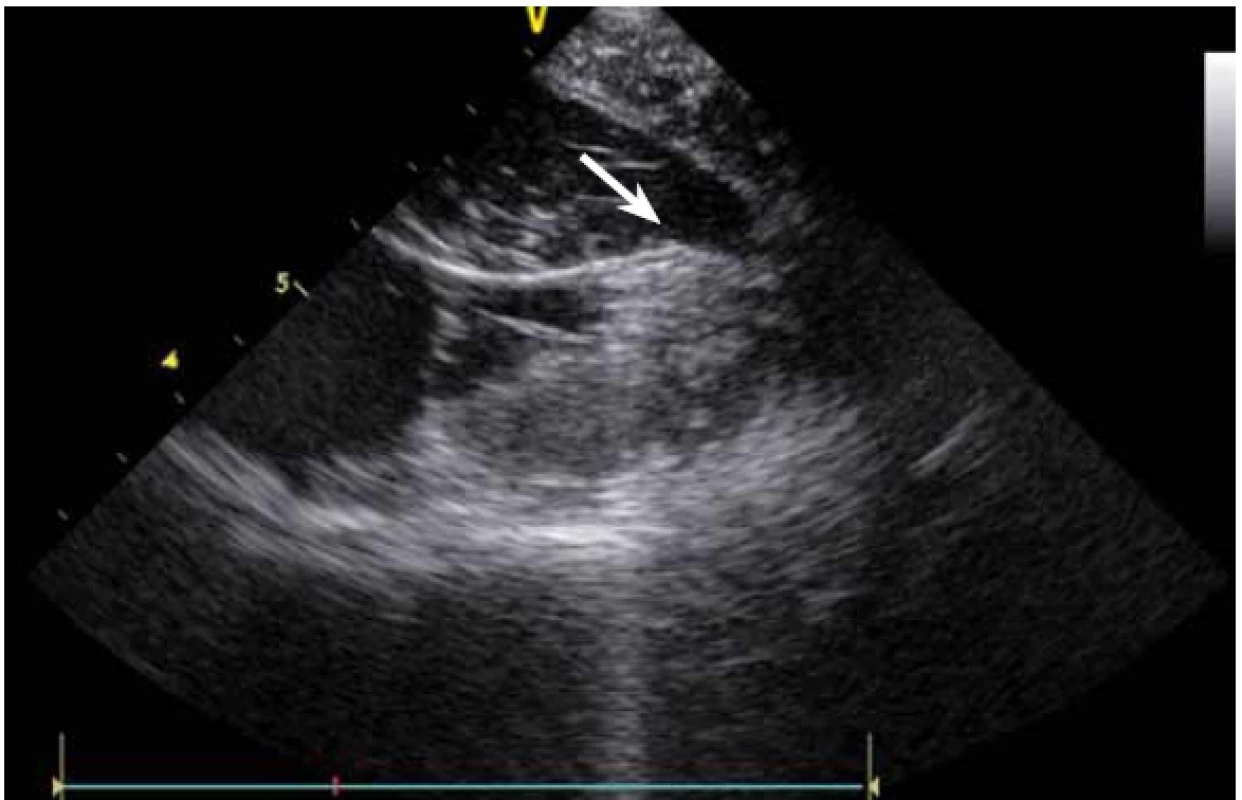
KT mohou vycházet nejen z oblasti výtokových traktů komor, ale v podstatě z kteréhokoli místa. Velmi časté jsou KT z papilárních svalů, zejména z LK. Ablace KT z těchto prostorově komplexních struktur je při použití skiaskopie téměř nemožná a při použití pouze elektroanatomického mapovacího systému velmi obtížná. KT totiž pocházejí většinou ne z baze, ale ze špičky papilárních svalů, a bez ICE a přímého vizuálního zobrazení se tyto struktury prakticky nedají zmapovat [13]. Navíc v případě ablace a s ní často spojené bouře KES umožní ICE udržet hrot katetru na správném místě.
Závěr
Intrakardiální echokardiografie dokáže přesně zobrazit veškeré srdeční struktury a do srdce zavedený materiál včetně diagnostických a ablačních katetrů. Přímé zobrazení zvyšuje bezpečnost i účinnost ablace monitorací polohy katetrů, tvorby ablační léze, blízkosti jícnu, přítomnosti trombů, polohy jehly před TS punkcí, přesnou definicí oblasti ideální pro ablaci v síních i komorách. Díky intrakardiální echokardiografii operatér v reálném čase přesně vidí, kde je a co dělá, což z ní činí zcela zásadního pomocníka v rukou elektrofyziologa.
Doručeno do redakce: 6. 11. 2017
Přijato po recenzi: 14. 11. 2017
MUDr. Tomáš Skála, Ph.D., FESC
www.fnol.cz
tomasskala@gmail.com
Sources
1. Bulava A a kol. Intrakardiální echokardiografie v elektrofyziologii. Praha: Grada Publishing 2016.
2. Marrouche NF, Martin DO, Wazni O et al. Phased-array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with atrial fibrillation. Circulation 2003; 107(21): 2710 – 2716. doi: 10.1161/ 01.CIR.0000070541.83326.15.
3. Packer DL, Stevens CL, Curley MG et al. Intracardiac phased-array imaging: methods and initial clinical experience with high resolution, under blood visualization. J Am Coll Cardiol 2002; 39(3): 509 – 516. doi: 10.1016/ S0735-1097(01)01764-8.
4. Nairooz R, Sardar P, Pino M et al. Meta-analysis of risk of stroke and thrombo-embolism with rivaroxaban versus vitamin K antagonists in ablation and cardioversion of atrial fibrillation. Int J Cardiol 2015; 187 : 345 – 353. doi: 10.1016/ j.ijcard.2015.03.323.
5. Santangeli P, Di Biase L, Burkhardt JD et al. Transseptal access and atrial fibrillation ablation guided by intracardiac echocardiography in patients with atrial septal closure devices. Heart Rhythm 2011; 8(11): 1669 – 1675. doi: 10.1016/ j.hrthm.2011.06.023.
6. Reddy VY, Shah D, Kautzner J et al. The relationship between contact force and clinical outcome during radiofrequency catheter ablation of atrial fibrillation in the TOCCATA study. Heart Rhythm 2012; 9(11): 1789 – 1795. doi: 10.1016/ j.hrthm.2012.07.016.
7. Anter E, Silverstein J, Tschabrunn CM et al. Comparison of intracardiac echocardiography and transesophageal echocardiography for imaging of the right and left atrial appendages. Heart Rhythm 2014; 11(11): 1890 – 1897. doi: 10.1016/ j.hrthm.2014.07.015.
8. Kautzner J, Peichl P. The role of imaging to support catheter ablation of atrial fibrillation. CorVasa 2012; 54(6): e375 – e385. doi: 10.1016/ j.crvasa.2012.11.009.
9. Ghi KK, Chugh A, Good E et al. A nationwide survey on the prevalence of atrioesophageal fistula after left atrial radiofrequency catheter ablation. J Interv Card Electrophysiol 2009; 24(1): 33 – 36. doi: 10.1007/ s10840-008-9307-1.
10. Morton JB, Sanders P, Davidson NC et al. Phased-array intracardiac echocardiography for defining cavotricuspid isthmus anatomy during radiofrequency ablation of typical atrial flutter. J Cardiovasc Electrophysiol 2003; 14(6): 591 – 597. doi: 10.1046/ j.1540-8167.2003.02152.x.
11. Jongbloed MR, Bax JJ, van der Burg AE et al. Radiofrequency catheter ablation of ventricular tachycardia guided by intracardiac echocardiography. Eur J Echocardiogr 2004; 5(1): 34 – 40. doi: 10.1016/ S1525-2167(03)00051-9.
12. Kanagaratnam L, Tomassoni G, Schweikert Ret al. Ventricular tachycardias arising from the aortic sinus of valsalva: an under-recognized variant of left outflow tract ventricular tachycardia. J Am Coll Cardiol 2001; 37(5): 1408 – 1414. doi: 10.1016/ S0735-1097(01)01127-5.
13. Peichl P, Baran J, Wichterle D et al. The tip of the muscle is a dominant location of ventricular ectopy originating from papillary muscles in the left ventricle. J Cardiovasc Electrophysiol 2017. [Epub ahead of print] doi: 10.1111/ jce.13338.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 4-
All articles in this issue
- Antiarytmická léčba u fibrilace síní
- Upstream terapie u fibrilace síní, co nového?
- Úloha intrakardiální echokardiografie při katetrizační ablaci poruch srdečního rytmu
- Moderní pohled na elektrickou kardioverzi fibrilace síní
- Náhlá srdeční smrt a její diagnostika
- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Význam nových parametrů kontraktility a tepové práce pro hodnocení srdeční funkce a prognózy
- Kvalita života pacientů s dlouhodobou mechanickou srdeční podporou
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Revmatoidní artritida pro kardiologa
- Akutní selhání ledvin
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ischemie a infarkt myokardu při poruchách nitrokomorového vedení na elektrokardiogramu
- Súčasné fixné antihypertenzné liekové dvojkombinácie v Slovenskej republike
- Moderní farmakologická léčba diabetes mellitus 2. typu
- Akutní selhání ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

