-
Medical journals
- Career
Význam periprocedurálního poklesu tlakového gradientu ve výtokovém traktu levé komory po alkoholové septální ablaci u pacientů s hypertrofickou obstrukční kardiomyopatií
Authors: T. Honěk 1,2; J. Krejčí 1,2; J. Máchal 3,4; L. Groch 1,4; J. Sitár 1,4; J. Meluzín 1,2,4; L. Špinarová 1,2
Authors‘ workplace: I. interní kardioangiologická klinika FN u sv. Anny v Brně 1; Lékařská fakulta MU, Brno 2; Ústav patologické fyziologie, LF MU, Brno 3; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 4
Published in: Kardiol Rev Int Med 2016, 18(3): 208-213
Overview
Úvod:
Alkoholová septální ablace (ASA) je jednou z možností nefarmakologické léčby vysoce symptomatických pacientů s hypertrofickou obstrukční kardiomyopatií rezistentních na farmakoterapii.Cíl:
Cílem práce bylo zhodnotit vztah intraprocedurálního poklesu gradientu ve výtokovém traktu levé komory (LVOTG) měřeného invazivně v průběhu výkonu na vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA.Soubor a metodika:
Soubor zahrnul 32 pacientů průměrného věku 58,6 ± 12,6 let, kteří podstoupili ASA pro farmakorezistentní limitující symptomy. Sledované parametry byly následující – hodnota klidového LVOTG, tloušťka mezikomorového septa a zadní stěny levé komory, enddiastolický rozměr levé komory, velikost levé síně, ejekční frakce levé komory a třída NYHA klasifikace – hodnocené ve 3. a 12. měsíci po výkonu.Výsledky:
Intraprocedurální změna LVOTG (iLVOTG) korelovala se změnou echokardiograficky měřeného LVOTG v období 0–3 měsíců (r = 0,56; p < 0,001) a 0–12 měsíců (r = 0,40; p < 0,05). Korelace mezi změnou iLVOTG a změnou ostatních echokardiografických parametrů a funkčního stavu nebyla nalezena, s výjimkou změny enddiastolického rozměru levé komory v období 0–12 měsíců (r = –0,39; p < 0,05) a 3–12 měsíců (r = –0,41; p < 0,05).Závěr:
Invazivně hodnocený intraprocedurální pokles LVOTG predikuje pozdější vývoj LVOTG. Hodnotu LVOTG dosaženou ve 3. měsíci již můžeme použít pro odhad dlouhodobého efektu ASA.Klíčová slova:
hypertrofická obstrukční kardiomyopatie – alkoholová septální ablace – echokardiografieÚvod
Hypertrofická kardiomyopatie (HKMP) je charakterizována hypertrofií myokardu nedilatované levé komory srdeční (LK) bez vysvětlujících hemodynamických příčin (např. hypertenze či chlopenní vady) schopných způsobit danou míru hypertrofie [1,2]. Jedná se o nejčastější geneticky podmíněné onemocnění srdce s prevalencí 1 : 500 v dospělé populaci [1–3]. Na podkladě přítomnosti obstrukce ve výtokovém traktu levé komory (LVOT) rozlišujeme obstrukční a neobstrukční typ HKMP. Obstrukční typ, charakterizovaný hodnotou maximálního gradientu v LVOT ≥ 30 mm Hg, se vyskytuje přibližně u dvou třetin pacientů, z nichž polovina má přítomnu obstrukci v klidu (klidová obstrukce) a druhá polovina po zátěži (latentní obstrukce) [2] (obr. 1). Obstrukce v LVOT je často spojena s přítomností systolického dopředného pohybu předního cípu mitrální chlopně, tzv. SAM (systolic anterior motion) (obr. 2). Klinická diagnóza HKMP je založena na detekci typického fenotypu nejčastěji pomocí echokardiografie, s obrazem hypertrofie stěn LK (nejčastěji mezikomorového septa) a nedilatované dutiny LK [4]. Nitrokomorová obstrukce, způsobená hypertrofií mezikomorového septa (IVS), elongovanými cípy mitrální chlopně a abnormalitami papilárních svalů, je jednou z hlavních příčin klinických potíží pacientů, kterými jsou dušnost, stenokardie, palpitace, zátěží indukovaná synkopa či náhlá srdeční smrt [5–7]. Podle závažnosti symptomů a také podle přítomnosti či absence gradientu v LVOT je volena příslušná farmakoterapie. Základem léčby jsou farmaka s negativně inotropním efektem, která snižují spotřebu kyslíku v myokardu a prodlužují fázi diastolického plnění LK [5]. Léky první volby u pacientů s hypertrofickou obstrukční kardiomyopatií (HOKMP) jsou betablokátory snižující především zátěží indukovaný gradient ve výtokovém traktu levé komory (LVOTG) [8]. Lékem druhé volby je verapamil, non-dihydropyridinový antagonista kalciových kanálů, který obvykle snižuje klidový LVOTG [3], ale vzhledem k jeho vazodilatačnímu efektu může dojít v některých případech k nárůstu gradientu v LVOT. Proto je při jeho podání nutná opatrnost, zejména u jedinců s vysokým LVOTG [9]. U obou skupin léků bylo popsáno zlepšení klinické symptomatologie nemocných. U obstrukčních typů HKMP při přetrvávající symptomatologii i přes maximálně tolerovanou farmakologickou léčbu je možné použít některou z intervenčních metod redukce LVOTG. Vedle chirurgické myektomie [1,2,10,11] a implantace dvoudutinového kardiostimulátoru či defibrilátoru (PM/ICD DDD) s apikální preexcitací [12–14] je při vhodné koronární anatomii možné indikovat alkoholovou septální ablaci (ASA). ASA byla poprvé provedena Ulrichem Sigwartem v roce 1994, jde tedy o „nejmladší“ metodu nefarmakologické léčby HOKMP [15]. Jedná se o intervenčně kardiologickou metodu, při které je nejčastěji do první septální větve zásobující bazální část IVS aplikován absolutní alkohol, čímž je vyvolána nekróza v daném povodí. To má za následek vytvoření jizvy se ztenčením hypertrofického IVS (obr. 3a, b) vedoucí k rozšíření výtokového traktu, snížení gradientu v LVOT, poklesu nitrokomorového tlaku a zlepšení klinického stavu. Dále dochází k remodelaci LK s regresí její hypertrofie, a to i mimo intervenované segmenty LK [3,4,6].
Image 1. Maximální gradient ve výtokovém traktu levé komory měřený echokardiograficky pomocí kontinuální dopplerovské echokardiografie. 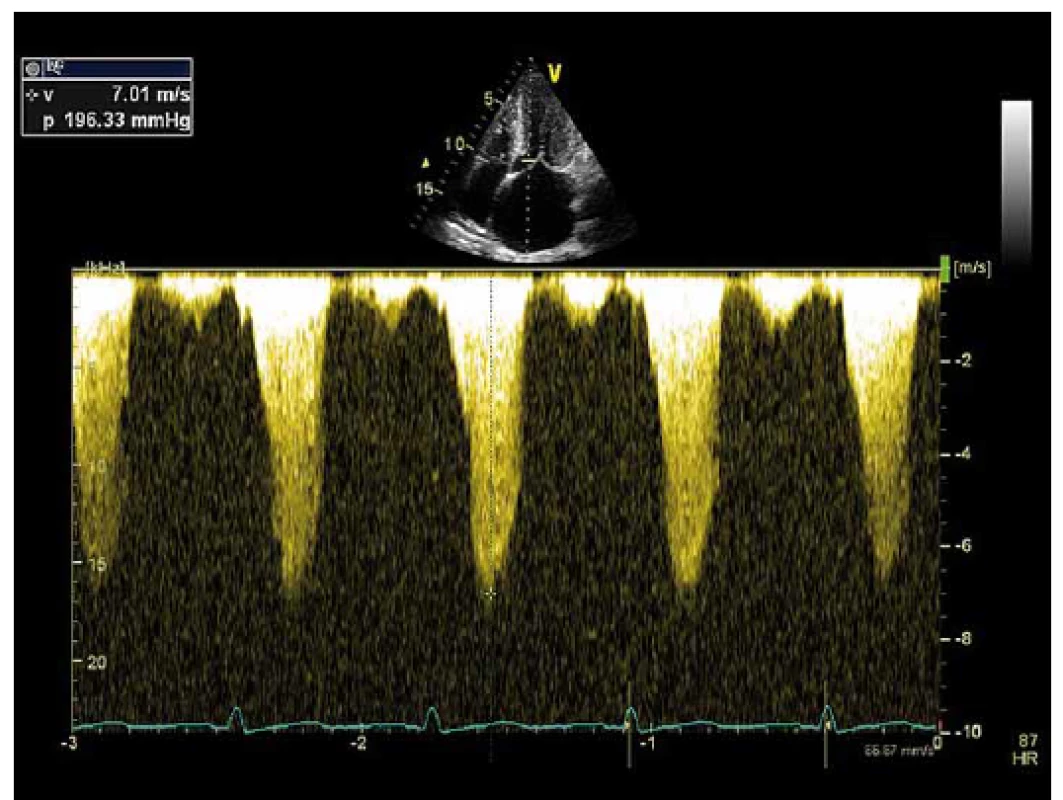
Image 2. „Systolic anterior motion“ předního cípu mitrální chlopně (šipka) s dotykem mezikomorového septa. 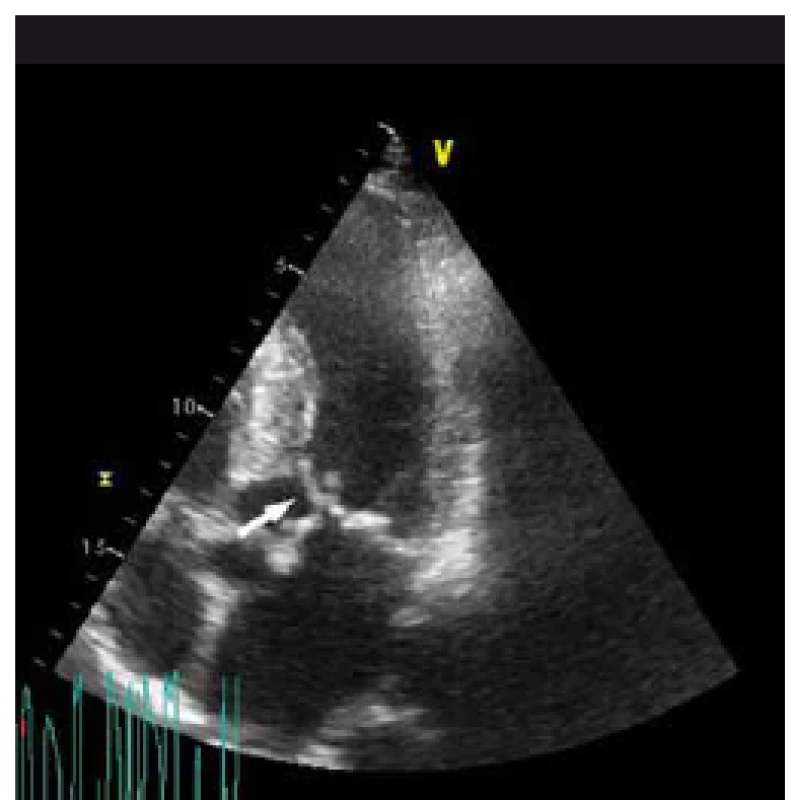
Image 3. a) Hypertrofie bazální části mezikomorového septa podílející se na nitrokomorové obstrukci před alkoholovou septální ablací; b) jizva v bazální části mezikomorového septa s rozšířením výtokového traktu levé komory po septální ablaci. 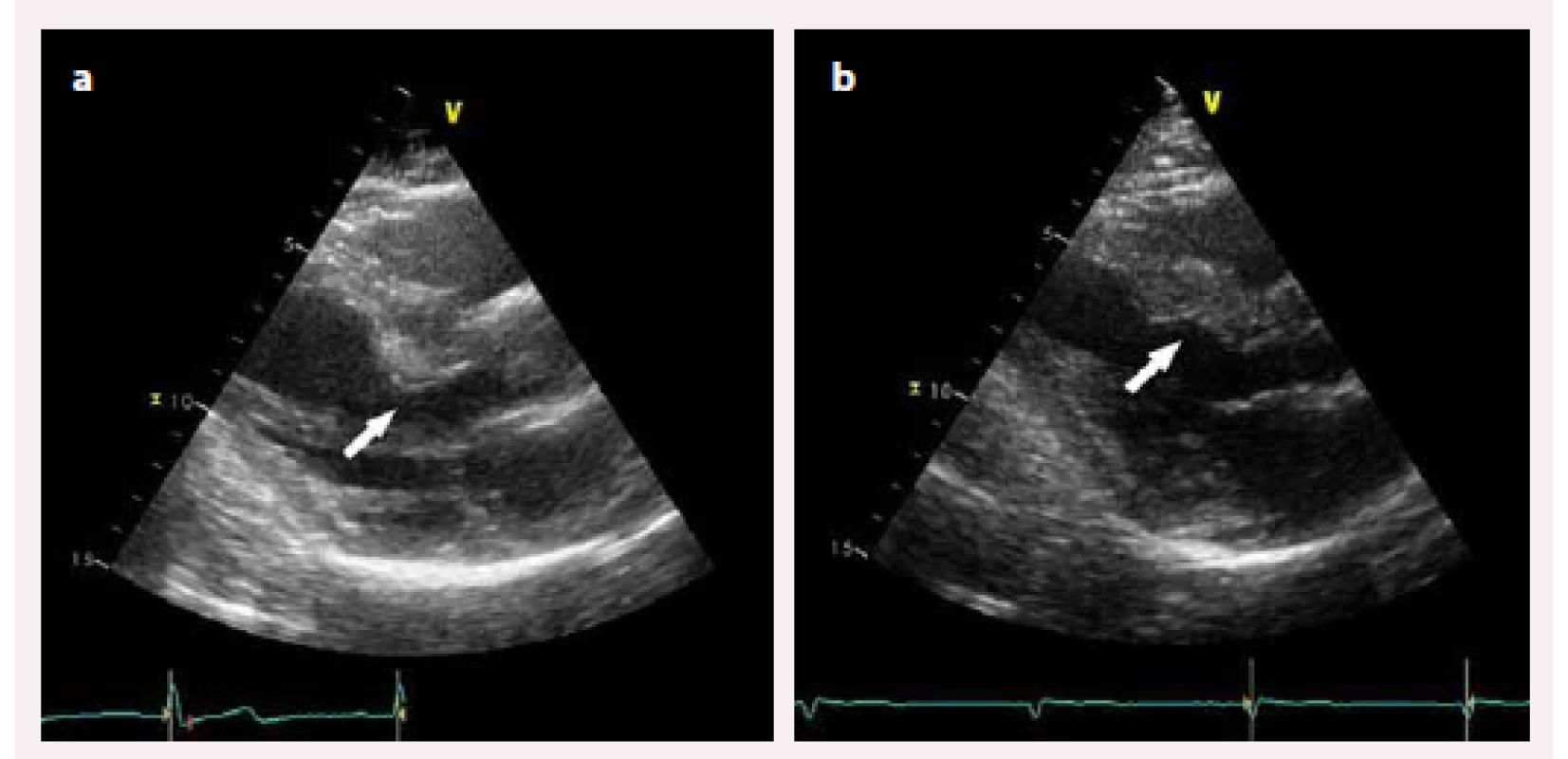
Cíl
Cílem naší práce bylo zjistit, zda intraprocedurální pokles gradientu v LVOT predikuje další vývoj LVOTG, a zhodnotit jeho vliv na další vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA.
Metodika
Soubor pacientů a hodnocené parametry
K vyhodnocení byla použita data z monocentrického registru nemocných s HOKMP léčených pomocí ASA v letech 2001–2013 na I. interní kardioangiologické klinice, FN u sv. Anny v Brně.
Do souboru byli zařazeni pacienti po ASA splňující následující kritéria:
- echokardiografický obraz HOKMP s ejekční frakcí LK ≥ 55 %,
- invazivně měřený klidový LVOTG ≥ 30 mm Hg,
- třída NYHA klasifikace > 2,
- provedené echokardiografické a klinické vyšetření ve 3. a 12. měsíci.
Vyloučeni byli pacienti s přítomností:
- prokázaného střádavého či infiltrativního onemocnění myokardu,
- implantovaného PM/ICD DDD pre - či postprocedurálně,
- provedené chirurgické myektomie.
Soubor zahrnul 32 pacientů (21 mužů a 11 žen) průměrného věku 58,6 ± 12,6 let, kteří podstoupili ASA pro přetrvávající limitující symptomy i přes maximální tolerovanou farmakoterapii. Sledovány byly následující parametry: echokardiograficky měřený maximální klidový LVOTG, tloušťka IVS, tloušťka zadní stěny (ZS) LK, enddiastolický rozměr (Dd) LK, velikost levé síně (LS), ejekční frakce (EF) LK a třída funkční klasifikace NYHA.
Statistika
Změny sledovaných parametrů byly hodnoceny Friedmanovým testem a Nemenyiho post hoc testem (LVOTG, třída NYHA) nebo u parametrů s normálním rozložením analýzou rozptylu (ANOVA) pro opakovaná měření a Tukeyovým post hoc testem (IVS, ZS, Dd, LS, EF). Ke zhodnocení vlivu intraprocedurálního poklesu LVOTG na jeho další vývoj byl vzhledem k rozložení dat použit Spearmanův koeficient pořadové korelace, stejně jako k vyjádření vztahu intraprocedurálního poklesu LVOTG ke změnám ostatních parametrů. Spearmanův korelační koeficient byl rovněž použit ke zhodnocení vlivu dávky alkoholu na sledované parametry. Vliv změny LVOTG a množství použitého alkoholu na výskyt bradyarytmií byl hodnocen Mann-Whitneyovým U-testem. Pro všechny analýzy byla použita hladina statistické významnosti α = 0,05. Statistické analýzy byly provedeny za pomoci programu STATISTICA (StatSoft, verze 12).
Alkoholová septální ablace
Před samotným výkonem byla zavedena dočasná kardiostimulace (DKS) v rámci prevence případných periprocedurálních poruch síňokomorového převodu. Poté byl transfemorálním přístupem proveden selektivní nástřik levé koronární tepny k posouzení anatomie jejich větví. Pigtail katetrem zavedeným do LK byl změřen tlakový gradient mezi hrotem a výtokovým traktem LK (subvalvulární oblastí) v klidu a po provokaci komorovou extrasystolou či Valsalvovým manévrem (obr. 4a), méně často aplikací nitrátů. Poté byl do septální větve zásobující oblast podílející se na zúžení LVOT (nejčastěji bazální IVS) zaveden speciální over-the-wire balonkový katetr uzavírající lumen této cévy a následně byla aplikována echokontrastní látka s echokardiografickým posouzením rozsahu a lokalizace perfuzní oblasti vybrané septální větve [16]. Po identifikaci vhodné septální větve byl do ní aplikován 96% alkohol. Množství aplikovaného alkoholu bylo zvoleno na základě kalibru septální větve a velikosti jí zásobovaného povodí (přibližně 1,0 ml na 10 mm tloušťky IVS). Po 10 min byl balon desuflován, změřen reziduální tlakový gradient mezi hrotem LK a LVOT v klidu a po výše uvedených provokačních manévrech (obr. 4b) a na závěr byl proveden selektivní nástřik levé věnčité tepny k potvrzení ablace septální větve a vyloučení případného ústřiku alkoholu do jiné části koronárního řečiště se vznikem no-reflow fenoménu [5,6]. Elektroda DKS byla ponechána min. 24 hod, v případě bradyarytmií i déle. Pacient zůstával při nekomplikovaném průběhu observován 24–48 hod na koronární jednotce a následně na standardním oddělení do celkové délky alespoň pěti dnů za kontinuální monitorace srdečního rytmu [17].
Image 4. a) Invazivně měřený gradient ve výtokovém traktu levé komory (rozdíl tlakových křivek v hrotu levé komory (horní šipka) a výtokovém traktu (dolní šipka) před septální ablací; b) vymizení gradientu po septální ablaci. 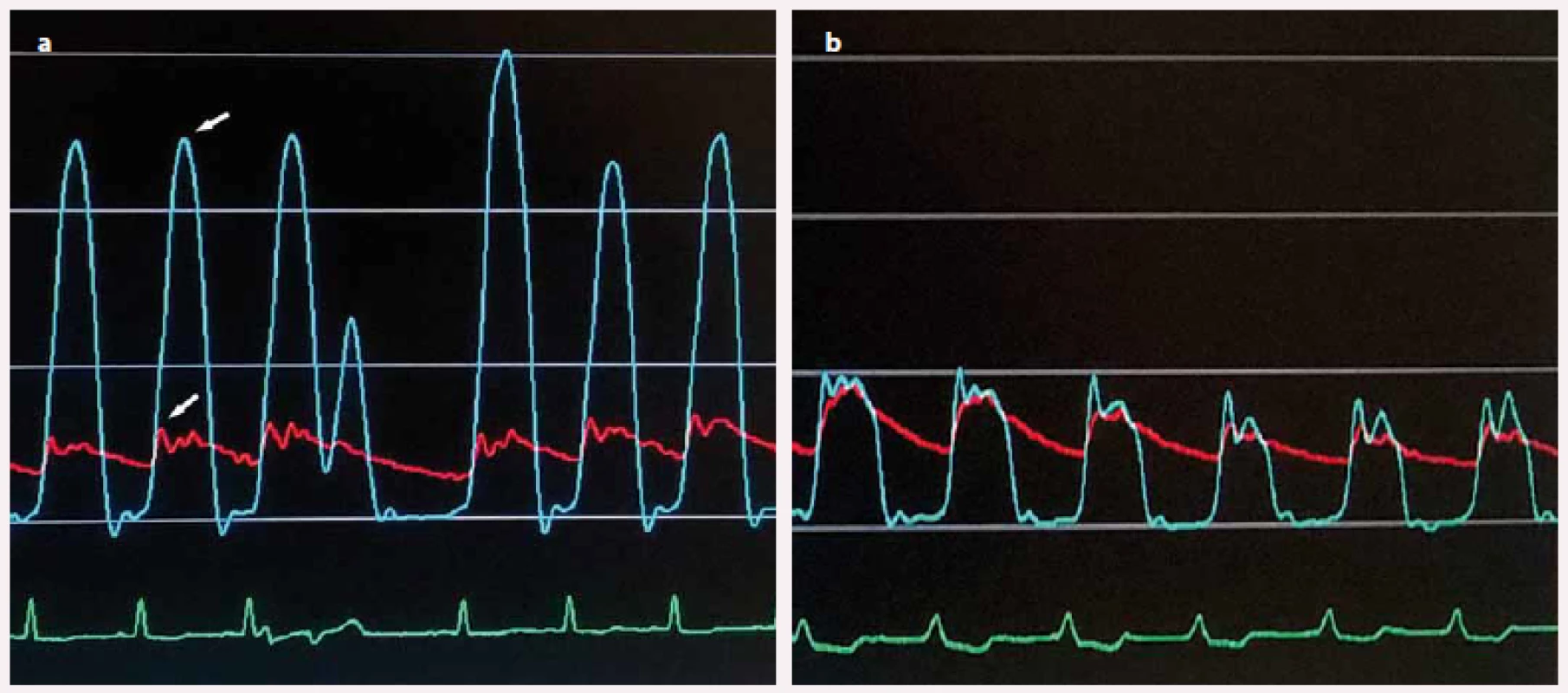
Výsledky
Změna invazivně měřeného intraprocedurálního LVOTG (iLVOTG) korelovala se změnou echokardiograficky měřeného LVOTG v období 0–3 měsíce (r = 0,56; p < 0,001) a 0–12 měsíců (r = 0,40; p < 0,05). Korelace mezi změnou iLVOTG a změnou ostatních echokardiografických parametrů a funkčního stavu nebyla nalezena, s výjimkou změny Dd v období 0–12 měsíců (r = –0,39; p < 0,05) a 3–12 měsíců (r = –0,41; p < 0,05). Kompletní data jsou uvedena v tab. 1.
Table 1. Korelace intraprocedurální změny LVOTG se změnami vybraných echokardiografických a klinických parametrů. 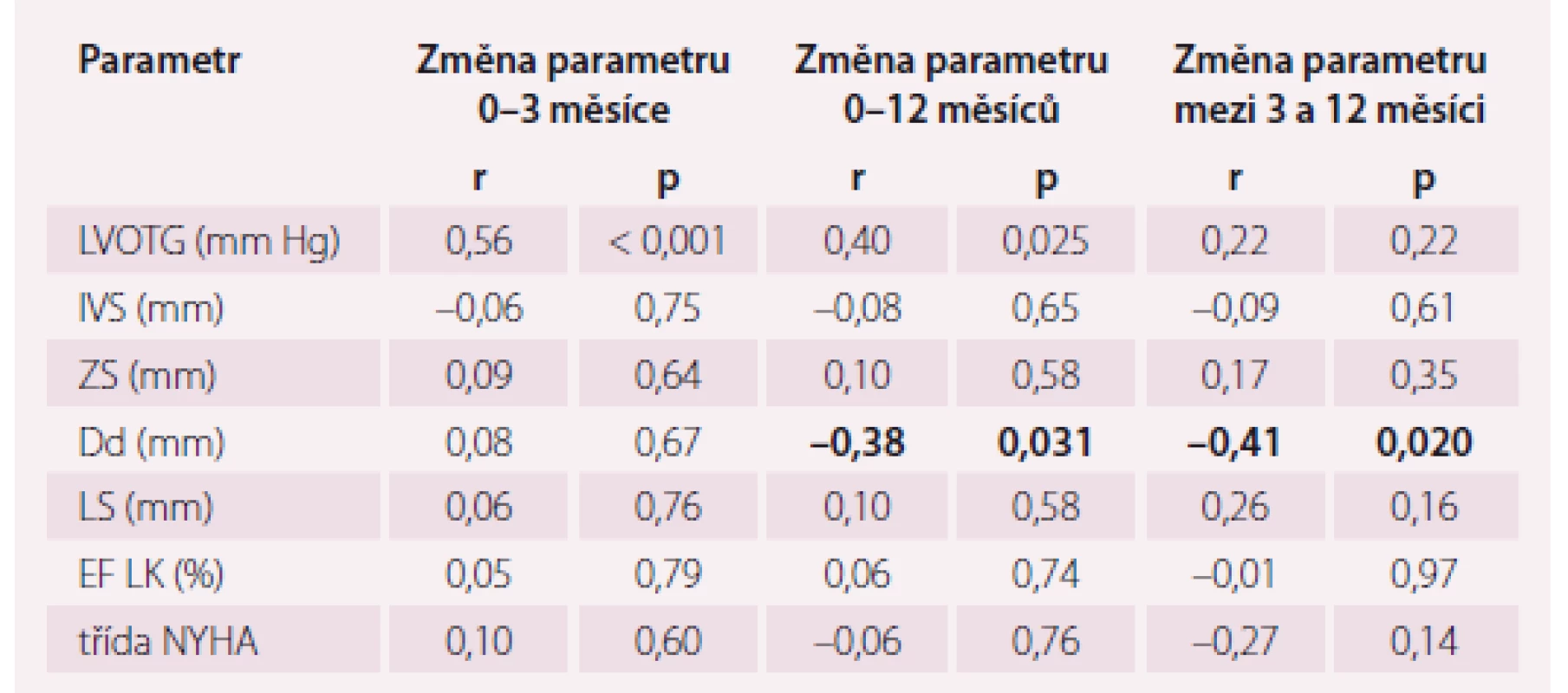
LVOTG – gradient ve výtokovém traktu levé komory, IVS – mezikomorové septum, ZS – zadní stěna levé komory, Dd – enddiastolický rozměr levé komory, LS – levá síň, EF LK – ejekční frakce levé komory, NYHA – New York Heart Association, r – korelační koeficient Po ASA došlo k poklesu LVOTG z 85,7 ± ± 40,8 mm Hg na 31,3 ± 28,3 mm Hg ve 3. měsíci (p < 0,001), resp. na 27,4 ± 19,3 mm Hg ve 12. měsíci (p < 0,001), zlepšení třídy NYHA z 2,9 ± 0,2 na 1,8 ± 0,5 ve 3. měsíci (p < 0,001), resp. na 1,9 ± 0,5 ve 12. měsíci (p < 0,001) a ztenčení IVS z 21,3 ± 2,9 mm na 17,7 ± 3,5 mm ve 3. měsíci (p < 0,001), resp. na 16,7 ± 3,2 mm ve 12. měsíci (p < 0,001). Srovnání změn výše uvedených parametrů mezi 3. a 12. měsícem nebylo statisticky významné (p = ns). Vývoj všech sledovaných echokardiografických parametrů a funkčního stavu je uveden v tab. 2.
Table 2. Vývoj sledovaných echokardiografických a klinických parametrů. 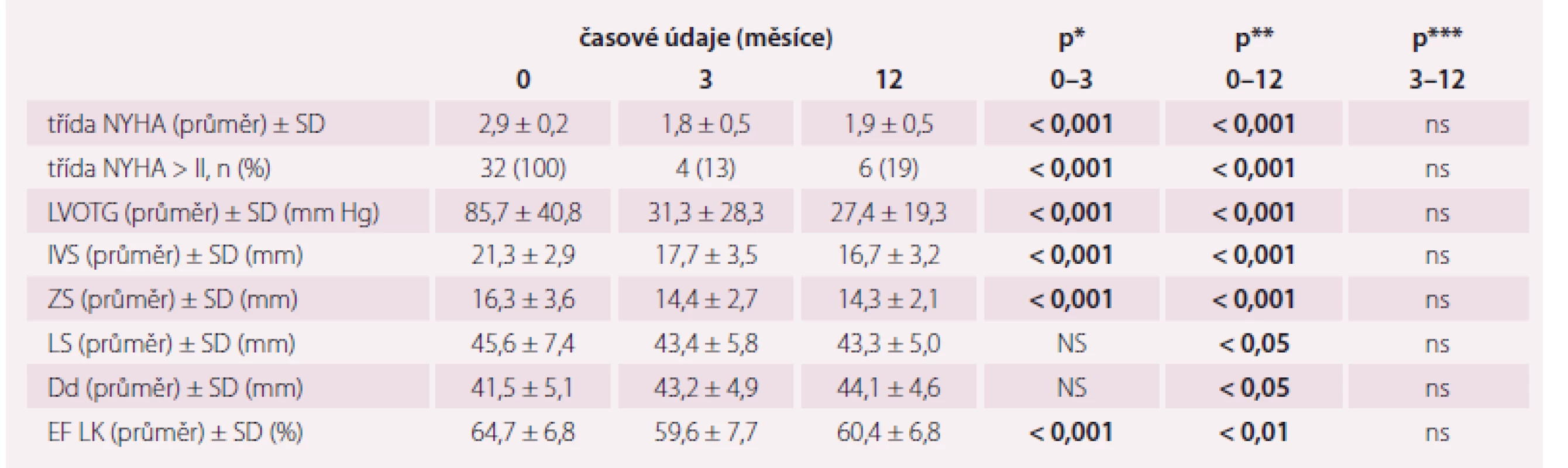
p* – statistická významnost změn parametrů mezi 0 a 3 měsíci, p** – statistická významnost změn parametrů mezi 0 a 12 měsíci, p*** – statistická významnost změn parametrů mezi 3 a 12 měsíci LVOTG – gradient ve výtokovém traktu levé komory, IVS – mezikomorové septum, ZS – zadní stěna, Dd – enddiastolický rozměr levé komory, LS – levá síň, EF LK – ejekční frakce levé komory, NYHA – New York Heart Association, SD – směrodatná odchylka, ns – nesignifikantní Korelace změn echokardiografických parametrů a NYHA třídy v období před výkonem a 3. měsícem po výkonu a mezi obdobím před výkonem a 12. měsícem po výkonu byla prokázána u všech sledovaných veličin (r > 0,6; p < 0,001). Naproti tomu korelace změn parametrů v období 0–3 měsíců a 3–12 měsíců byla zjištěna pouze u ZS (r = 0,46; p < 0,05) a Dd (r = 0,45; p < 0,05).
Průměrná dávka alkoholu v celém souboru byla 2,3 ± 0,7 ml. U pacientů s výskytem jakýchkoli bradyarytmií po ASA byla průměrná dávka 2,0 ± 0,8 ml, u pacientů bez dokumentovaných bradykardických poruch rytmu 2,4 ± 0,7 ml; p < 0,05. Množství použitého alkoholu nekorelovalo se změnami sledovaných parametrů (p = ns). Kompletní data jsou uvedena v tab. 3.
Table 3. Korelace použité dávky alkoholu se změnami vybraných echokardiografických a klinických parametrů. 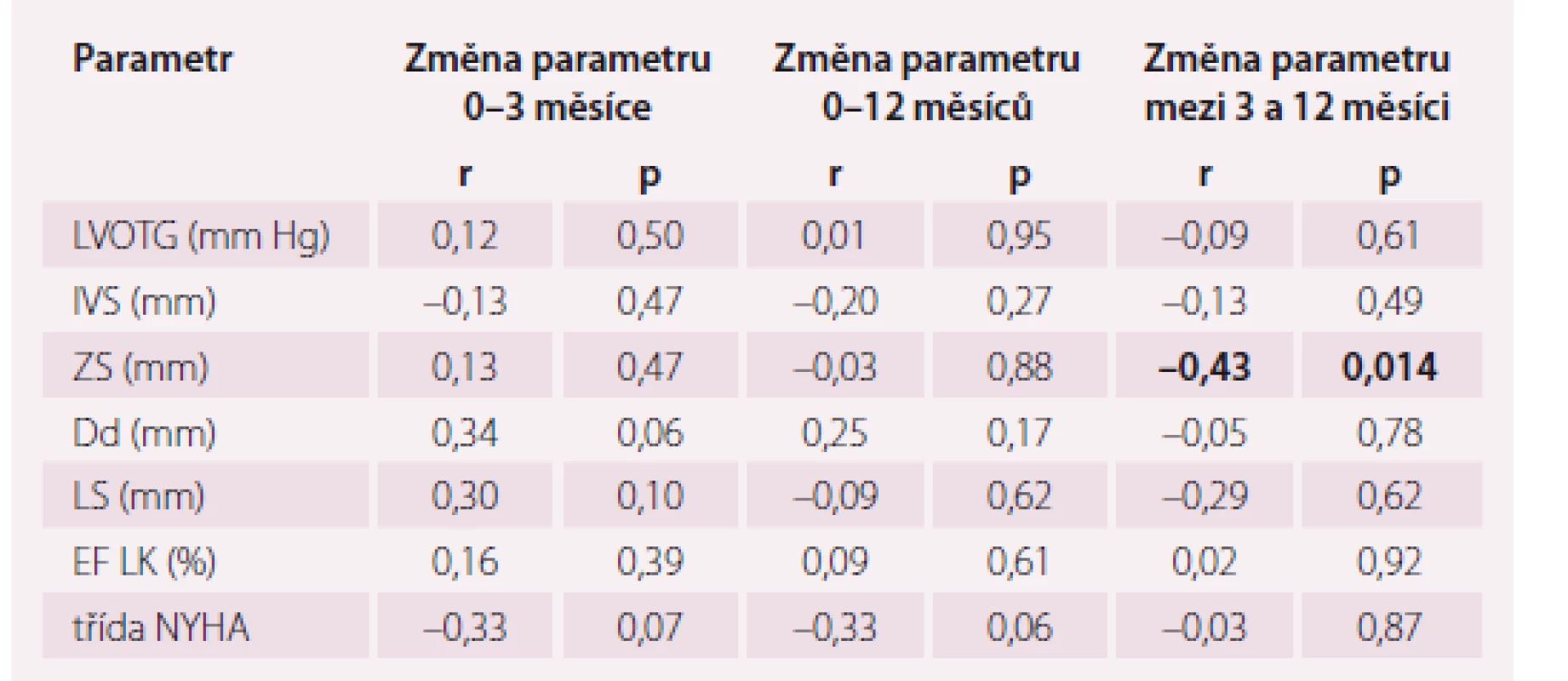
LVOTG – gradient ve výtokovém traktu levé komory, IVS – mezikomorové septum, ZS – zadní stěna levé komory, Dd – enddiastolický rozměr levé komory, LS – levá síň, EF LK – ejekční frakce levé komory, NYHA – New York Heart Association, r – korelační koeficient Diskuze
Pokles LVOTG, zlepšení klinického stavu a remodelace LK jsou hlavními ukazateli, které sledujeme po ASA a které určují úspěšnost této metody. Literární prameny dokládají příznivý vliv ASA na krátkodobý i dlouhodobý vývoj echokardiografických parametrů, klinický stav pacienta a pokles LVOTG [18–21]. Méně jasné je, zda intraprocedurální pokles LVOTG predikuje další vývoj echokardiografických a klinických ukazatelů. V naší práci jsme se proto zaměřili především na zhodnocení vztahu intraprocedurálního poklesu gradientu v LVOT měřeného invazivně v průběhu výkonu a na vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA s cílem predikce pozdějšího efektu již při samotném výkonu.
Zlepšení parametrů ve smyslu poklesu LVOTG a třídy NYHA bylo pozorováno v našem souboru pacientů v časném období s přetrvávajícím zlepšením i v jednoročním sledování. Vyjma zlepšení třídy NYHA došlo po ASA rovněž k vyššímu zastoupení pacientů ve skupině s mírnými symptomy (NYHA ≤ 2), a to v 87 % (3. měsíc), resp. 81 % (12. měsíc) v porovnání se vstupními daty, kde byli všichni pacienti ve skupině s těžkými symptomy (NYHA > 2). V rámci remodelace LK po ASA došlo současně se ztenčením IVS a s tím spojeným rozšířením LVOT s následným poklesem gradientu také ke statisticky signifikantnímu ztenčení ZS v obou sledovaných obdobích. To potvrzuje hypotézu, že dochází k celkové regresi hypertrofie stěn LK i mimo intervenované segmenty LK, nejspíše v důsledku poklesu afterloadu vyplývajícího z odstranění či snížení míry obstrukce v LVOT. V rámci remodelace LK se ztenčením stěn (IVS a ZS) dochází také k nárůstu rozměru její dutiny. Pro pacienty s HKMP je typická normální až supranormální EF LK, diastolická funkce však bývá u těchto pacientů často porušená, což je také příčinou klinických obtíží. Z důvodu nedostupnosti nálezů měření transmitrálního toku a tkáňově dopplerovského zobrazení u všech našich pacientů jsme jako marker odrážející diastolickou funkci zvolili velikost LS [22,23]. Zvětšená LS, stejně jako porucha diastolické funkce, je častým nálezem u pacientů s HOKMP. Příčinou jejího zvětšení může být jednak zmiňovaná diastolická dysfunkce spojená s dlouhodobě zvýšenými plnicími tlaky LK, další možností zejména u obstrukčních typů je přítomnost mitrální regurgitace v důsledku SAM. Velikost LS také koreluje se závažností symptomů, výskytem fibrilace síní, závažností LVOTG a především mortality [24]. Dilatovaná LS byla přítomna také v našem souboru na počátku sledování a během 12měsíčního období po ASA došlo ke statisticky významnému zmenšení jejího diametru. Z výše uvedených výsledků je patrné, že většina sledovaných parametrů zaznamenala statistickou změnu již časně po ASA, která přetrvávala také na konci sledování. Avšak přes pokračující příznivý vývoj parametrů nebyly změny v období 3–12 měsíců již statisticky významné. Převážná část hodnocených parametrů zaznamenala největší změnu během prvních tří měsíců, což je, jak se zdá, již dostatečná doba k posouzení dlouhodobého efektu ASA. Navíc pokles hodnoty parametru, který byl významný ve třetím měsíci, zůstal signifikantní také ve 12. měsíci. Pro indikaci případné reintervence v případě suboptimálního efektu primárního zákroku by měly být tři měsíce dobou, kdy by tato mohla začít být zvažována. V řadě prací, vč. tohoto našeho sledování, dochází po ASA k poklesu EF LK [20,25]. Přestože je tento statisticky významný, zachovalá EF LK na konci sledování dokladuje bezpečnost této metody, a její pokles po ASA tedy nepokládáme za klinicky významný. V naší studii k poklesu EF LK jistě přispěla bezprostřední technická komplikace samotného výkonu u jednoho pacienta, u kterého došlo k pravděpodobnému ústřiku alkoholu do distální části ramus interventricularis anterior s navozením no-reflow fenoménu a vytvořením infarktového ložiska v oblasti hrotu a přilehlé části přední stěny s poklesem EF LK na 40 %. Nicméně i u tohoto nemocného s takto závažnou komplikací bylo zaznamenáno klinické zlepšení.
Periprocedurální pokles invazivně měřeného LVOTG koreloval s poklesem echokardiograficky měřeného LVOTG ve 3. i 12. měsíci, ale již nekoreloval se změnou LVOTG mezi 3. a 12. měsícem. Výraznější periprocedurální pokles LVOTG znamenal větší pokles LVOTG během dalšího sledování, a proto, na rozdíl od některých názorů, naše výsledky naznačují, že má smysl snažit se o co nejvýraznější snížení gradientu již na katetrizačním sále. Nicméně u ostatních echokardiografických parametrů či klinického stavu korelace prokázány nebyly. Výjimkou byl enddiastolický rozměr LK, jehož změna v období 0–12 měsíců a 3–12 měsíců vykázala sice méně těsnou, ale statisticky významnou korelaci.
V současné době je hodně diskutováno optimální množství podaného alkoholu, neboť řada prací potvrzuje spojitost vyšší dávky alkoholu s vyšším počtem síňokomorových blokád vyššího stupně s nutností implantace trvalé kardiostimulace. V současné době je trendem snižovat dávku alkoholu pod 2 ml na ablaci jedné septální větve [26–28]. V našem souboru jsme se proto zaměřili také na výskyt bradykardických poruch rytmu (síňokomorové blokády vyššího stupně či junkční rytmus) a překvapivě jsme pozorovali, že u pacientů s bradyarytmiemi byla nižší průměrná spotřeba alkoholu než u pacientů bez dokumentovaných poruch rytmu. Korelace mezi množstvím podaného alkoholu a změnami sledovaných echokardiografických parametrů a funkčního stavu nebyla prokázána. Větší množství podaného alkoholu nemělo tedy v tomto souboru nemocných vliv na případný výraznější efekt ASA. Nicméně, na hranici statistické významnosti byl pozorován jistý trend výraznějšího zlepšení ve funkční třídě NYHA u pacientů, kteří obdrželi vyšší dávku alkoholu; tento poznatek bude jistě do budoucna nutné verifikovat na větším vzorku pacientů.
Limitace
Hlavní limitací naší studie je fakt, že se jedná o monocentrickou, retrospektivní, nerandomizovanou studii s malým počtem pacientů. Další výraznou limitací je nepřímé posuzování diastolické funkce pomocí velikosti LS, kterou jsme si zvolili jako její korelát i s vědomím jisté nepřesnosti takového postupu, protože u pacientů z počátečního období této studie nebyly vždy k dispozici spolehlivě doložené hodnoty z měření transmitrálního toku či dokonce tkáňově dopplerovské parametry, které používáme v posledních letech. Velikost souboru byla negativně ovlivněna tím, že jsme vyřadili nemocné (celkově sedm), kterým byl implantován dvoudutinový PM/ICD z důvodu poruchy síňokomorového převodu, a byla jim tak navozena apikální preexcitace, která modifikuje další vývoj echokardiografických parametrů nad rámec změn vyvolaných samotnou ASA.
Závěr
Alkoholová septální ablace je efektivní a bezpečná metoda léčby symptomatických pacientů rezistentních na farmakoterapii. Vede k významnému a setrvalému poklesu LVOTG a třídy NYHA klasifikace, stejně jako k příznivé remodelaci LK. Periprocedurální pokles invazivně měřeného LVOTG predikuje pozdější vývoj LVOTG. Hodnotu LVOTG dosaženou ve třetím měsíci již můžeme použít pro odhad dlouhodobého efektu ASA, byť k další remodelaci LK dochází i po tomto časovém období.
Podpořeno Grantem na podporu projektů specifického výzkumu MUNI/A/1270/2015 a projektem číslo LQ1605 z Národního programu udržitelnosti II (MŠMT) a projektem FNUSA-ICRC číslo CZ.1.05/1.1.00/02.0123 (OP VaVpI).
Doručeno do redakce: 30. 5. 2016
Přijato po recenzi: 1. 7. 2016
MUDr. Tomáš Honek
www.fnusa.cz
tomas.honek@fnusa.cz
Sources
1. Gersh BJ, Maron BJ, Bonow RO et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 124: e783–e831. doi: 10.1161/CIR.0b013e318223e2bd.
2. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35 : 2733–2779. doi: 10.1093/eurheartj/ehu284.
3. Enriquez AD, Goldman ME. Management of hypertrophic cardiomyopathy. Ann Glob Health 2014; 80 : 35–45. doi: 10.1016/j.aogh.2013.12.004.
4. Maron BJ, Ommen SR, Semsarian C et al. Hypertrophic cardiomyopathy: present and future, with translation into contemporary cardiovascular medicine. J Am Coll Cardiol 2014; 64 : 83–99. doi: 10.1016/j.jacc.2014.05.003.
5. Veselka J. Twenty years of alcohol septal ablation document more than a history of a single interventional procedure. Cor et Vasa 2015; 57: e16–e27.
6. Seggewiss H. Medical therapy versus interventional therapy in hypertrophic obstructive cardiomyopathy. Curr Control Trials Cardiovasc Med 2000; 1 : 115–119.
7. Zemánek D. Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie. Kardiol Rev Int Med 2015; 17 : 7–10.
8. Harrison DC, Braunwald E, Glick G et al. Effects of beta adrenergic blockade on the circulation, with particular reference to observations in patients with hypertrophic subaortic stenosis. Circulation 1964; 29 : 84–98.
9. Epstein SE, Rosing DR. Verapamil: its potential for causing serious complications in patients with hypertrophic cardiomyopathy. Circulation 1981; 64 : 437–441.
10. Agarwal S, Tuzcu EM, Desai MY et al. Updated meta-analysis of septal alcohol ablation versus myectomy for hypertrophic cardiomyopathy. J Am Coll Cardiol 2010; 55 : 823–834. doi: 10.1016/j.jacc.2009.09.047.
11. Ommen SR, Maron BJ, Olivotto I et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2005; 46 : 470–476.
12. Krejci J, Gregor P, Zemanek D et al. Comparison of long-term effect of dual-chamber pacing and alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. Scientific World Journal 2013; 2013 : 629–650. doi: 10.1155/2013/ /629650.
13. Kappenberger L, Linde C, Daubert C et al. Pacing in hypertrophic obstructive cardiomyopathy. A randomized crossover study. PIC Study Group. Eur Heart J 1997; 18 : 1249–1256.
14. Maron BJ, Nishimura RA, McKenna WJ et al. Assessment of permanent dual-chamber pacing as a treatment for drug - refractory symptomatic patients with obstructive hypertrophic cardiomyopathy: a randomized, double-blind, crossover study (M-PATHY). Circulation 1999; 99 : 2927–2933.
15. Sigwart U. Non-surgical myocardial reduction for hypertrophic obstructive myocardial infarction. Lancet 1995; 346 : 211–214.
16. Popescu BA, Rosca M, Schwammenthal E et al. Dynamic obstruction in hypertrophic cardiomyopathy. Curr Opin Cardiol 2015; 30 : 468–474. doi: 10.1097/HCO.0000000000000199.
17. Veselka J, Lawrenz T, Stellbrink C et al. Low incidence of procedure-related major adverse cardiac events after alcohol septal ablation for symptomatic hypertrophic obstructive cardiomyopathy. Can J Cardiol 2013; 29 : 1415–1421. doi: 10.1016/j.cjca.2013.04.027.
18. Jensen MK, Almaas VM, Jacobsson L et al. Long-term outcome of percutaneous transluminal septal myocardial ablation in hypertrophic obstructive cardiomyopathy: a Scandinavian multicenter study. Circ Cardiovasc Interv 2011; 4 : 256–265. doi: 10.1161/CIRCINTERVENTIONS.110.959718.
19. Seggewiss H, Gleichmann U, Faber L et al. Percutaneous transluminal septal myocardial ablation in hypertrophic obstructive cardiomyopathy: acute results and 3-month follow-up in 25 patients. J Am Coll Cardiol 1998; 31 : 252–258.
20. Moss TJ, Krantz MJ, Zipse MM et al. Left ventricular systolic function following alcohol septal ablation for symptomatic hypertrophic cardiomyopathy. Am J Cardiol 2014; 113 : 1401–1404. doi: 10.1016/j.amjcard.2014.01.417.
21. Veselka J, Lawrenz T, Stellbrink C et al. Early outcomes of alcohol septal ablation for hypertrophic obstructive cardiomyopathy: a European multicenter and multinational study. Catheter Cardiovasc Interv 2014; 84 : 101–107. doi: 10.1002/ccd.25 236.
22. Jassal DS, Neilan TG, Fifer MA et al. Sustained improvement in left ventricular diastolic function after alcohol septal ablation for hypertrophic obstructive cardiomyopathy. Eur Heart J 2006; 27 : 1805–1810.
23. Sorajja P, Nishimura RA, Ommen SR et al. Effect of septal ablation on myocardial relaxation and left atrial pressure in hypertrophic cardiomyopathy an invasive hemodynamic study. JACC Cardiovasc Interv 2008; 1 : 552–560. doi: 10.1016/j.jcin.2008.07.004.
24. Nistri S, Olivotto I, Betocchi S et al. Prognostic significance of left atrial size in patients with hypertrophic cardiomyopathy (from the Italian Registry for Hypertrophic Cardiomyopathy). Am J Cardiol 2006; 98 : 960–965.
25. Steendijk P, Meliga E, Valgimigli M et al. Acute effects of alcohol septal ablation on systolic and diastolic left ventricular function in patients with hypertrophic obstructive cardiomyopathy. Heart 2008; 94 : 1318–1322. doi: 10.1136/hrt.2007.139535.
26. Veselka J, Tomašov P, Zemánek D. Long-term effects of varying alcohol dosing in percutaneous septal ablation for obstructive hypertrophic cardiomyopathy: a randomized study with a follow-up up to 11 years. Can J Cardiol 2011; 27 : 763–767. doi: 10.1016/j.cjca.2011.09.001.
27. Aqel R, Hage FG, AlJaroudi W et al. How much alcohol should we infuse in the coronary artery of hypertrophic cardiomyopathy patients? J Invasive Cardiol 2010; 22 : 22–26.
28. Kuhn H, Lawrenz T, Lieder F et al. Survival after transcoronary ablation of septal hypertrophy in hypertrophic obstructive cardiomyopathy (TASH): a 10 year experience. Clin Res Cardiol 2008; 97 : 234–243.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2016 Issue 3-
All articles in this issue
- Komplexní endovaskulární revaskularizace aterotrombotického uzávěru popliteální tepny a bércových tepen u polymorbidního pacienta – kazuistika
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Projekt MedPed – pacienti s familiární hypercholesterolemií ve středu pozornosti
- Význam periprocedurálního poklesu tlakového gradientu ve výtokovém traktu levé komory po alkoholové septální ablaci u pacientů s hypertrofickou obstrukční kardiomyopatií
- Endovaskulární léčba ischemické cévní mozkové příhody
- Organizace karotického programu a výsledky endovaskulární léčby karotické stenózy ve Vítkovické nemocnici
- Endovaskulární léčba disekce aorty typ B a ischemických komplikací provázejících aortální disekce
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Organizace podiatrické péče u pacientů s kritickou končetinovou ischemií
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

