-
Medical journals
- Career
Série komplikací po srdeční transplantaci – kazuistika
Authors: T. Honěk 1,2; J. Krejčí 1,2; P. Němec 2,3; Z. Adam 4; V. Žampachová 5; V. Feitová 6; L. Špinarová 1
Authors‘ workplace: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2; Centrum kardiovaskulární a transplantační chirurgie, Brno 3; Interní hematologická a onkologická klinika LF MU a FN Brno 4; I. patologicko-anatomický ústav, LF MU a FN u sv. Anny v Brně 5; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 6
Published in: Kardiol Rev Int Med 2014, 16(6): 476-480
Category: Cardiology Review
Overview
Ortotopická transplantace srdce je zavedenou metodou léčby pacientů v terminálním stadiu srdečního selhání, která zlepšuje přežívání těchto pacientů. Cenou za podávání imunosupresivní léčby je řada potenciálních rizik, jedněmi z nejzávažnějších jsou infekční komplikace. Kazuistika popisuje případ pacientky se srdečním selháním na podkladě primární amyloidózy, která podstoupila srdeční transplantaci. Po transplantaci byla v plánu kurativní hematoonkologická léčba, která však vzhledem ke kompletní remisi základního onemocnění nebyla uskutečněna. V časném potransplantačním období pacientka prodělala řadu komplikací, z nichž nejzávažnější byla invazivní plicní aspergilóza. Tato infekce byla úspěšně zaléčena vorikonazolem a pacientka je nyní 28 měsíců po srdeční transplantaci ve velmi dobrém klinickém stavu bez známek aktivní infekce.
Klíčová slova:
ortotopická transplantace srdce – primární amyloidóza – endomyokardiální biopsie – invazivní plicní aspergilózaÚvod
Ortotopická transplantace srdce (OTS) je v současnosti rutinně užívanou metodou léčby pacientů v terminálním stadiu srdečního selhání, u kterých je doba přežití kratší než 1 rok. Transplantace srdce, navzdory zlepšení přežívání těchto pacientů (poločas přežití pacientů po OTS je v současné době více než 11 let), s sebou přináší četné komplikace. Časně po transplantaci jsou to primární dysfunkce štěpu, akutní rejekce a infekce. V pozdějším období pacienty nejvíce ohrožuje koronární nemoc štěpu, malignity a metabolické komplikace. Tyto komplikace výrazně přispívají k morbiditě a následně mortalitě transplantovaných pacientů. V následující kazuistice popisujeme komplikace, které se objevily v prvních dvou letech po transplantaci u nemocné s raritní příčinou srdečního selhání – primární (AL) amyloidózou. V takových případech bývá obvykle srdeční transplantace prvním krokem v léčbě tohoto závažného hematologického onemocnění, neboť autologní transplantace kmenových buněk je v případě přítomnosti závažnějšího srdečního selhání kontraindikovaná.
Popis případu
Popisujeme případ ženy narozené roku 1949, která podstoupila srdeční transplantaci v květnu 2012. V předchorobí prodělala plicní sarkoidózu, která byla na terapii kortikoidy v dlouhodobé remisi. V říjnu 2011 bylo diagnostikováno srdeční selhání, jako prvotní příčina bylo na základě výsledku magnetické rezonance srdce (MRI) vysloveno podezření na infiltrativní postižení myokardu, konkrétně na srdeční amyloidózu. V rámci došetření byla provedena biopsie kostní dřeně s nálezem 8 – 10 % plazmocytů s dominantní expresí volných lehkých řetězců (FLC) lambda nesplňující kritéria mnohočetného myelomu. Biopsie jazyka, rekta a aspirace podkožního tuku neprokázala multisystémové postižení amyloidem. K potvrzení definitivní diagnózy a další kardiologické léčbě byla pacientka referována na naše pracoviště. V lednu 2012 jsme provedli endomyokardiální biopsii (EMB) s průkazem amyloidu v myokardu (obr. 1 a – c). Při echokardiografickém vyšetření jsme potvrdili typické znaky pro pokročilou fázi tohoto onemocnění – koncentrickou hypertrofii (obr. 2 a, b) nezvětšené levé komory (LK) s depresí systolické funkce, ejekční frakce (EF) LK 30 %, diastolickou dysfunkci charakteru restrikčního plnění LK (obr. 3) s disproporční poruchou longitudinální kontraktility (obr. 4) a dilataci obou síní a pravé komory. Na vstupním EKG byla přítomna nízká voltáž QRS komplexů kontrastující s hypertrofií srdečních stěn (obr. 5). Tento „mismatch“ je velmi typickým znakem infiltrace srdce amyloidem. Současně vedle imunofixace moči a séra byly kvantitativně stanoveny sérové hladiny FLC (kappa 8,5 mg/ l, lambda 87,1 mg/ l, kappa/ lambda ratio 0,10). Na základě hod-not FLC, NT pro‑BNP a Troponinu T byla pacientka dle skórovacího systému zařazena do skupiny s nejkratším mediánem přežití, a to šest měsíců bez kurativní hematoonkologické léčby (tab. 1). Při MRI vyšetření byl po aplikaci gadolinia přítomen typický difuzní late ‑ enhancement v subendokardu (obr. 6 a, b). Na základě našich dřívějších pozitivních zkušeností byla pacientka vyšetřena před OTS a následně zařazena na waiting list vzhledem k rychle progredujícímu srdečnímu selhání v urgentním pořadí. OTS podstoupila dne 14. 5. 2012 s bezproblémovým bezprostředním pooperačním průběhem. S odstupem pěti měsíců od operace byla plánována hematoonkologická léčba (stimulace a odběr periferních kmenových buněk, poté podání myeloablativní dávky mefalanu s následnou transplantací periferních kmenových buněk). K tomuto výkonu byla pacientka přijata na hematoonkologickou kliniku, kde byla v rámci kontrolních vyšetření provedena trepanobiopsie kostní dřeně s překvapivým nálezem pouhých 2 – 3 % klonálních plazmocytů, dále imunofixace moči a séra, které byly negativní. Sérové hladiny FLC byly rovněž v normálním rozmezí. Pacientka dosáhla kompletní remise i bez myeloablativní léčby.
Image 1. Histologický vzorek myokardu z endomyokardiální biopsie ukazující depozita amyloidu (šipky) v barvení hematoxylin – a) eosin, b) kongo červeň, c) kongo červeň v polarizovaném světle. 
Image 2. Koncentrická hypertrofi e stěn levé komory v a) parasternální projekci, b) apikální projekci. 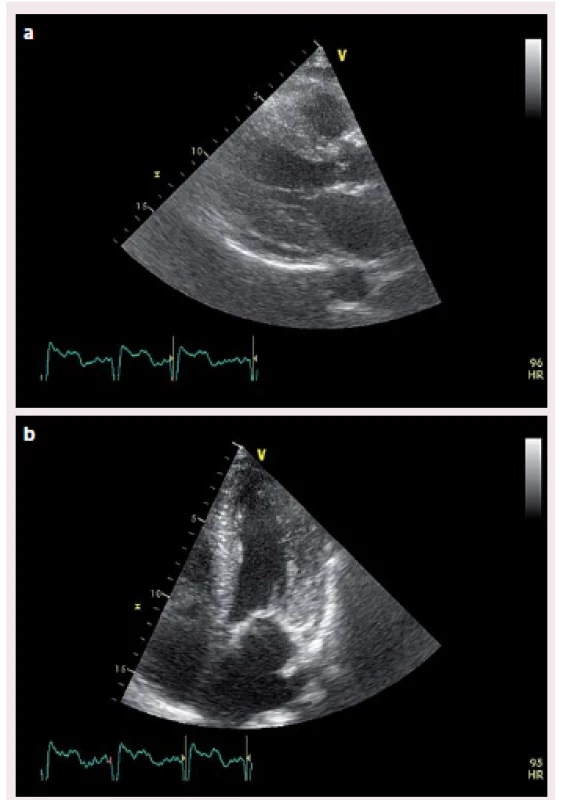
Image 3. Restrikční typ plnění levé komory při pulzně dopplerovském vyšetření. 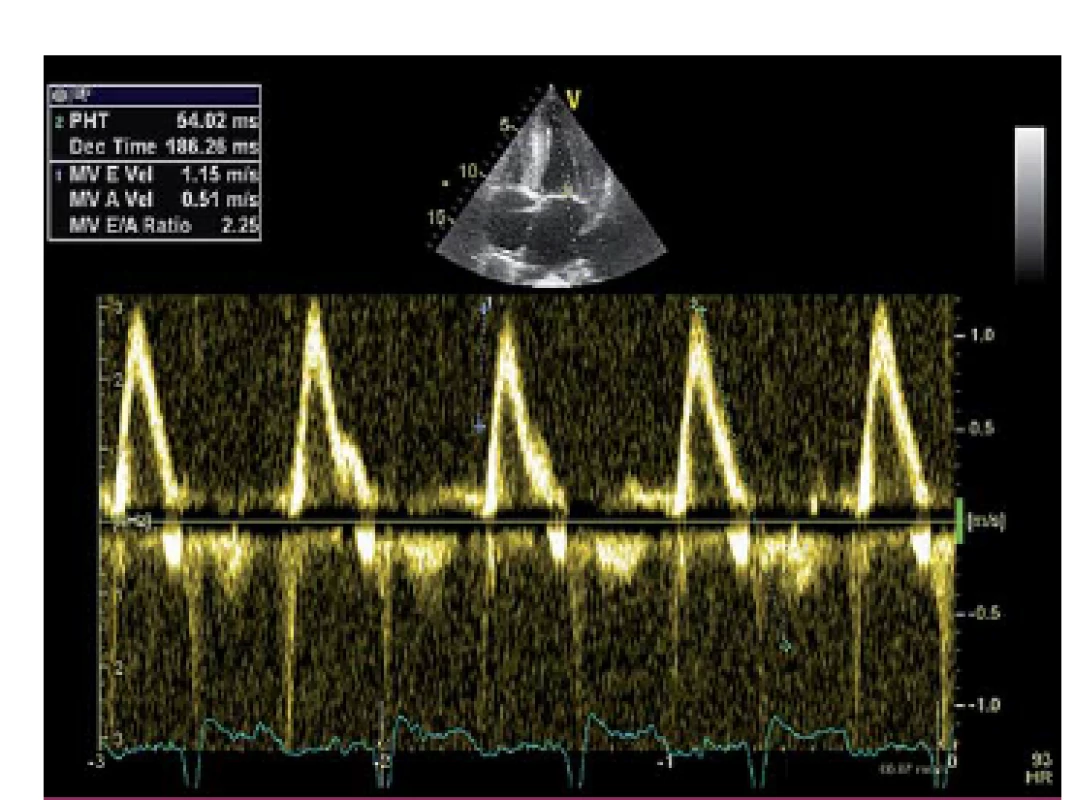
Image 4. Porucha longitudinální kontraktility levé komory při tkáňově dopplerovském zobrazení. 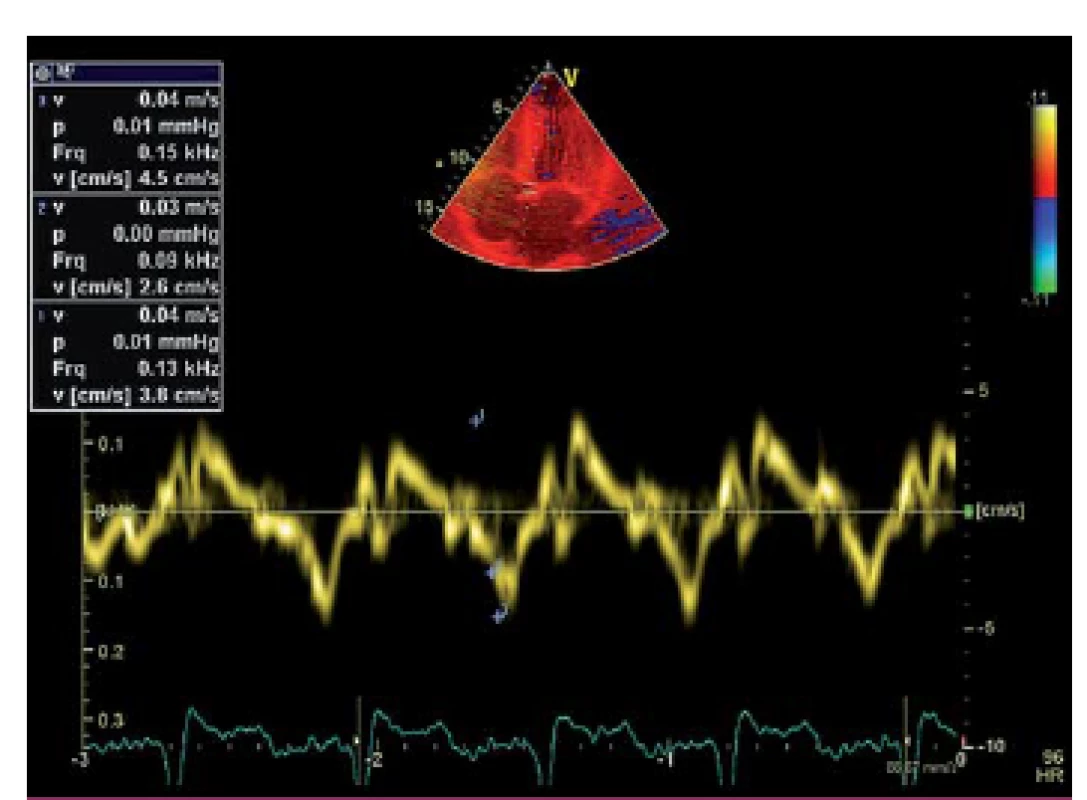
Image 5. Elektrokardiogram ukazující nízkou voltáž QRS komplexů v končetinových svodech. 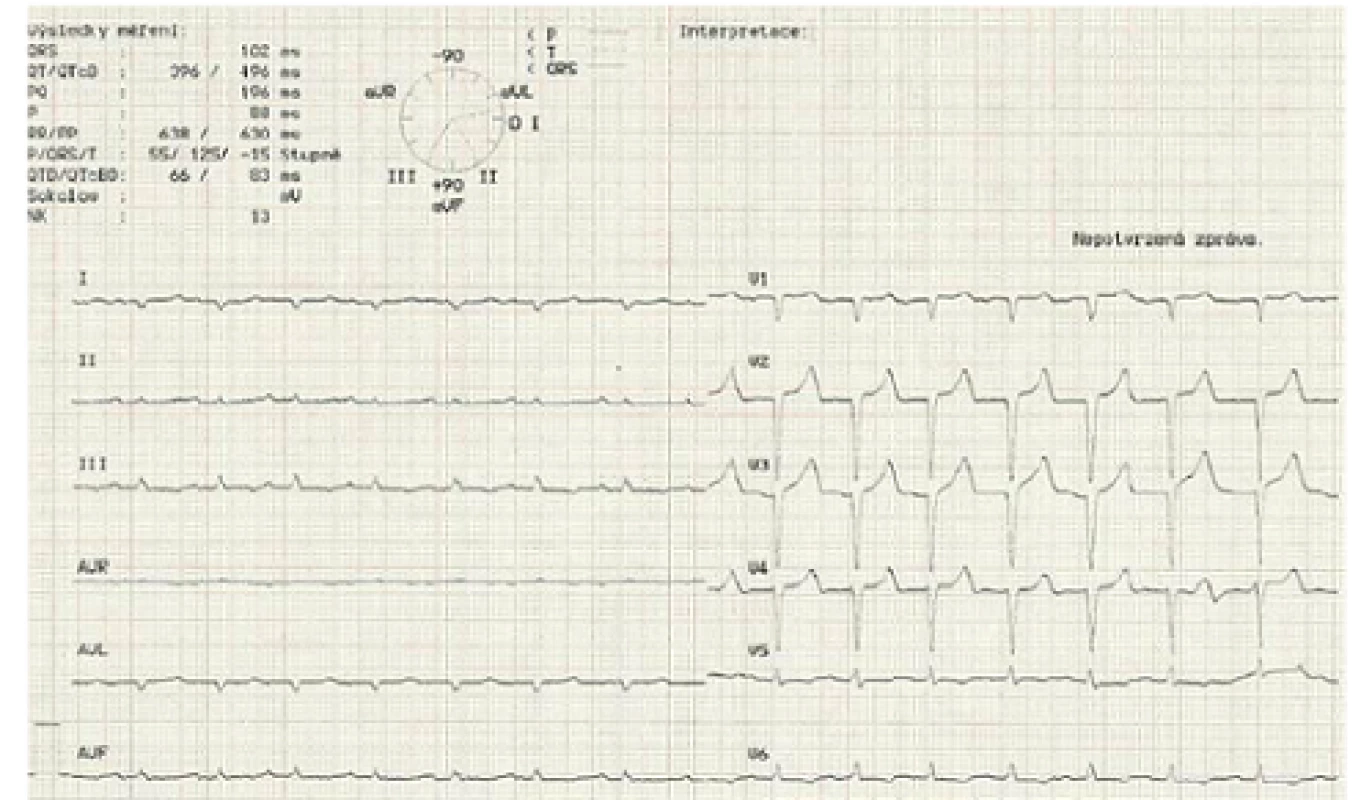
Image 6. Difuzní gadoliniový late-enhancement v subendokardiální vrstvě v a) dvoudutinové projekci, b) v krátké ose při vyšetření magnetickou rezonancí. 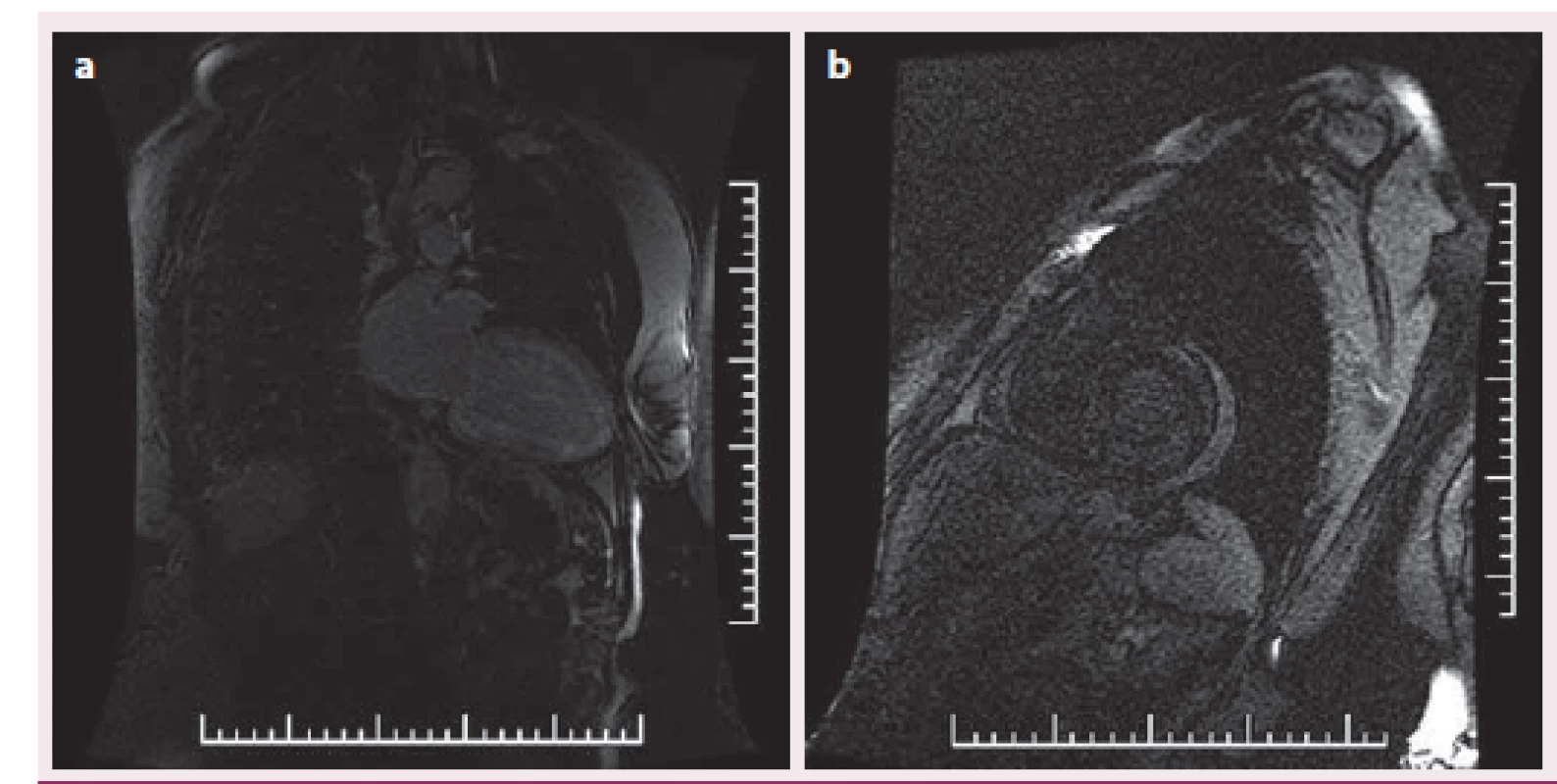
Table 1. Klinická stadia s mediánem přežití na základě rizikových faktorů u pacientů s AL amyloidózou a srdečním postižením (adaptováno z [11]). ![Klinická stadia s mediánem přežití na základě rizikových faktorů u pacientů s AL amyloidózou a srdečním postižením (adaptováno z [11]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/815b567ca117d0b2ae15c00c1c4e7ad8.png)
V říjnu 2012 byla při protokolární EMB zjištěna celulární rejekce grade 1R (odpovídající IB ‑ II dle Banffské klasifikace) (obr. 7) s poklesem EF LK na 40 %. Dále byla zachycena dilatace pravostranných srdečních oddílů a vzhledem k přetrvávající dušnosti přes antirejekční léčbu kortikoidy (kontrolní EMB grade 0R) byla provedena CT angiografie plicnice s nálezem bilaterální plicní embolie. Na současně provedených HRCT skenech plic (high resolution computed tomography – HRCT) byly nalezeny bronchiektázie, v pravém dolním laloku obraz charakteru denzit mléčného skla (obr. 8 a, b), nejspíše na podkladě zánětlivých změn. Na tento nález jsme reagovali přeléčením antibiotiky. Při kontrolním PET/ CT plic v lednu 2013 došlo k progresi mediastinální lymfadenopatie, proto se pomýšlelo na možný relaps sarkoidózy, který byl vyloučen pomocí markeru sarkoidózy, tzv. sérového angiotenzin‑konvertujícího enzymu (S ‑ ACE). Odběry na tuberkulózu byly také negativní. V kontextu nejasného plicního nálezu byla provedena videoasistovaná torakoskopie s odběrem vzorků. Histologický nález koreloval s invazivní nekrotizující mykotickou infekcí a po doplnění PCR byla potvrzena invazivní plicní aspergilóza. Pacientce byla nasazena antimykotická léčba vorikonazolem. Začátkem dubna 2013, necelý rok po transplantaci, přichází pacientka ke kontrolní hospitalizaci. Při přijetí byl diagnostikován herpes zoster na levé horní končetině, který byl přeléčen aciklovirem. Na HRCT plic přetrvává stacionární nález. Pro výraznou elevaci jaterních testů musel být vorikonazol nahrazen amfotericinem B s postupnou úpravou nálezu. V průběhu hospitalizace došlo k rozvoji septického šoku s přidruženou pancytopenií, etiologicky potvrzena Escherichia coli z urotraktu, současně se objevila flegmona gluteální a infraumbilikální oblasti. Klinický stav se i přes plnou farmakologickou terapii nadále progresivně zhoršoval. Multioborovým konziliárním vyšetřením bylo rozhodnuto o pokračování v maximální, ekonomicky vysoce náročné, léčbě. Současně byla minimalizována imunosupresivní terapie jen na parenterální kortikoidy. Během jednoho měsíce došlo ke zlepšení klinického stavu, příjmu stravy a postupné obnově svalové síly. Bylo provedeno kontrolní HRCT plic se stacionárním nálezem. Vzhledem k úpravě jaterních testů byl do medikace vrácen vorikonazol, který umožňoval přechod na perorální léčbu. Před dimisí byla provedena výroční EMB bez záchytu rejekce či přítomnosti amyloidu, dále koronarografie s intrakoronárním ultrazvukem, které neprokázaly vaskulopatii štěpu. Pacientka byla přeložena na rehabilitační oddělení. Při další hospitalizaci v srpnu 2013 bylo provedeno kontrolní HRCT plic s nálezem solitárního ložiska velikosti cca 25 mm vpravo v segmentu S10 (vs aspergilom), jinak ostatní obraz stacionární. Biopsie ložiska po domluvě s pneumologem a chirurgy nebyla indikována, nadále jsme pokračovali v terapii vorikonazolem. Při následujících plánovaných hospitalizacích na naší klinice nebyla nikdy zachycena rejekce štěpu či přítomnost amyloidu a na HRCT skenech plic se sledované ložisko vpravo jevilo ohraničenější a v mírné regresi. Vzhledem k příznivému CT nálezu bylo v červnu 2014 podávání vorikonazolu po 15 měsících ukončeno. Kontrolní hladiny FLC zůstávaly nadále v normálním rozmezí (kappa 10,3 mg/ l, lambda 12,9 mg/ l, kappa/ lambda ratio 0,80). Poslední kontrola u nás byla v září 2014, tj. 28 měsíců od OTS. I při vysazeném vorikonazolu nedošlo k progresi CT nálezu, naopak jevil mírné regresivní změny. Pacientka byla plně mobilní, soběstačná, v celkově velmi dobrém fyzickém i psychickém stavu.
Image 7. Histologický vzorek myokardu s disperzními proužky rejekční celulizace (rejekce grade 1R) v barvení hematoxylin – eosin. 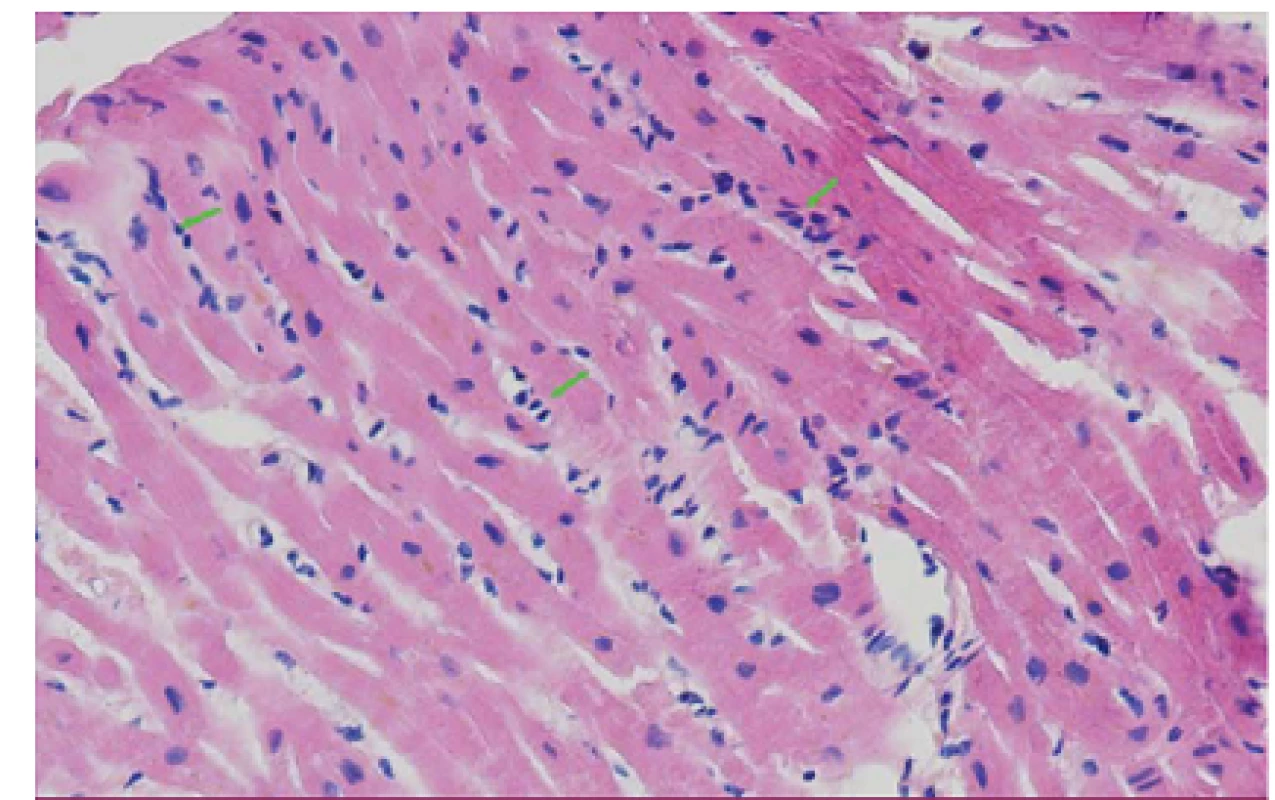
Image 8. CT/HRCT plic (plicní okno) ukazující zánětlivé změny charakteru mléčného skla v dolním laloku pravé plíce. 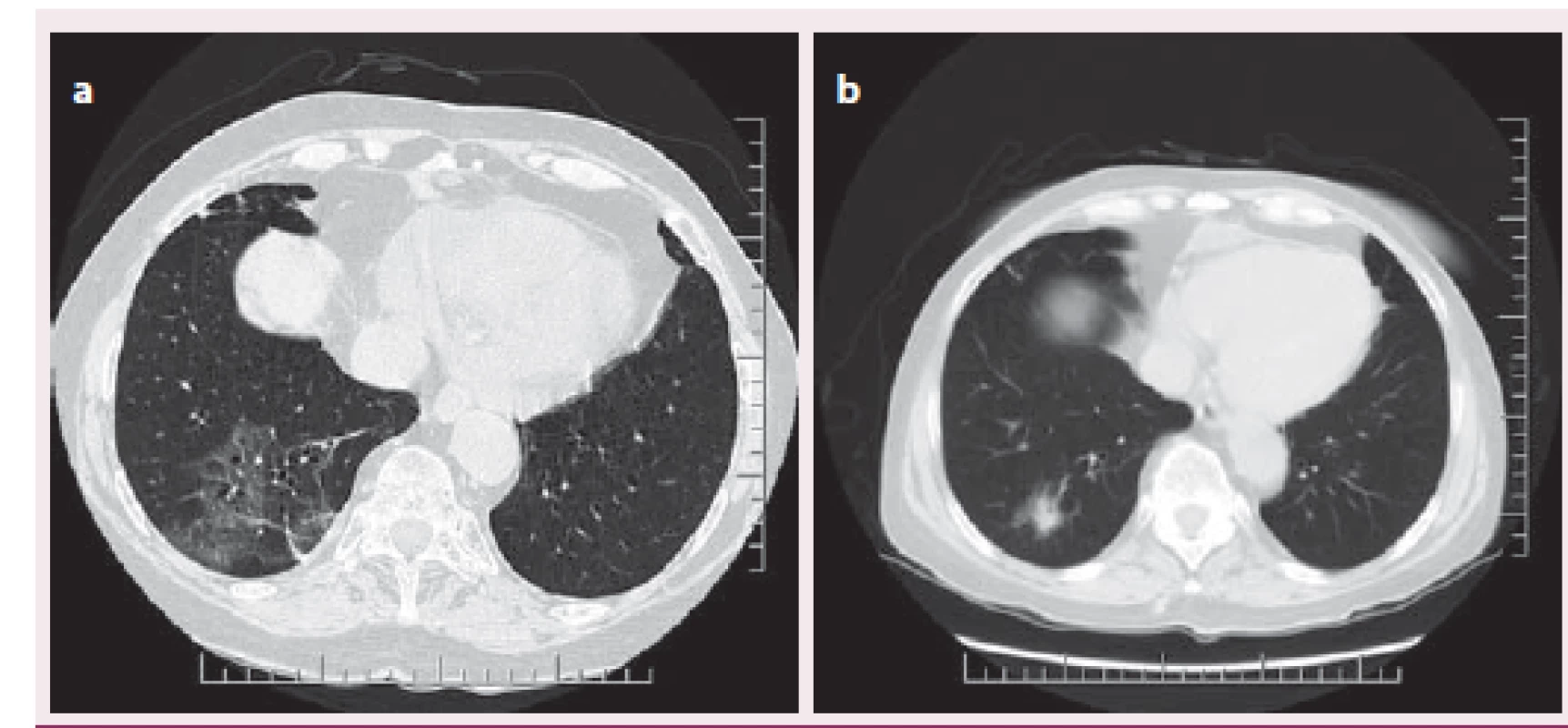
Diskuze
Srdeční transplantace je v současnosti zavedenou rutinní metodou léčby pacientů v terminálním stadiu srdečního selhání refrakterního na konvenční léčbu. Pacienti musí splňovat indikační kritéria a nemít postižení vylučující transplantaci. Amyloidóza je vzácné onemocnění s incidencí 8 – 10 případů na 1 milion obyvatel, avšak s velmi závažnou prognózou. Ještě v nedávné době byla amyloidóza považována za kontraindikaci srdeční transplantace [1]. V posledních dvou dekádách se v zahraniční literatuře objevují jednotlivé kazuistiky i malé soubory pacientů popisující srdeční transplantaci pro kardiální postižení u tohoto onemocnění. Pacienti se závažnější systolickou dysfunkcí LK nemohou podstoupit kurativní hematoonkologickou léčbu, proto je u nich nutné po vyloučení multiorgánového postižení amyloidem indikovat OTS a až po jejím provedení indikovat plnou hematologickou léčbu vysokodávkovaným melfalanem (HD MEL) s následnou autologní transplantací periferních kmenových buněk (ASCT) [2,3]. Dostupná data ukazují, že tříleté přežívání pacientů po OTS, kteří podstoupili kurativní hematoonkologickou léčbu, se neliší od přežívání pacientů transplantovaných pro jinou diagnózu (83 % v obou skupinách), obdobná data dokonce se sedmiletým sledováním publikovali autoři z Bostonu. Uvádějí srovnatelné procentuální přežití pacientů transplantovaných pro amyloidovou kardiomyopatii oproti ostatním diagnózám (60 vs 64 %) [4,5]. V námi prezentované kazuistice však nebyla tato kurativní hematologická léčba z důvodu dosažení kompletní remise potřebná. Tento neočekávaný případ kompletní onkologické remise se vyskytl pouze u této pacientky, předpokládáme, že se na ní mohla podílet i konkomitantně podávaná imunosupresivní léčba. U dalších tří nemocných s touto diagnózou transplantovaných v našem centru byla však ASCT nezbytná, u jednoho z nich byla dokonce nutná re‑ASCT pro rekurenci hematologického onemocnění.
Jak již bylo zmíněno, imunosuprimovaní pacienti jsou v prvních letech po transplantaci ohroženi převážně infekčními komplikacemi. Z infekcí jsou to zejm. komunitní respirační nákazy, ovšem jejich průběh je vzhledem k supresi imunity závažnější a komplikovanější. Původci mohou být často oportunní patogeny, tedy takové, které u běžných lidí infekce nezpůsobují. Z doporučení organizace ISHLT (International Society for Heart and Lung Transplantation) plyne, že při podezření z počínající infekce u pacienta po OTS je nutné co nejdříve nasadit empiricky antibiotickou terapii a v případě nebakteriální infekce též antivirotickou či antimykotickou léčbu [6]. Další terapie se upravuje dle zachyceného agens či naopak vysazuje, pokud se infekt neprokáže.
V naší kazuistice dokumentujeme situaci s obrazem infiltrativních změn na CT plic, bez přesvědčivých klinických i laboratorních známek svědčících pro akutní infekci, kdy jsme nasadili empiricky antibiotickou léčbu, abychom předešli pozdějším komplikacím, zejm. rozvoji septického stavu. Vyjma virových a běžných bakteriálních infekcí jsme u naší pacientky byli konfrontováni s prognosticky nesmírně závažnou mykotickou infekcí, jejíž incidence v běžné populaci je nízká, ovšem u transplantovaných či jinak imunokompromitovaných pacientů je její výskyt mnohonásobně vyšší. Touto infekcí byla invazivní plicní aspergilóza, jejímž patogenem je nejčastěji Aspergillus fumigatus. Diagnostika je založena jednak na charakteristickém CT obraze, kde můžeme vidět vícečetné plicní infiltráty (uzly), v jejich okolí často nacházíme okrsky opacit mléčného skla, které odpovídají mírnému prokrvácení a edému intersticia v okolí uzlů, tzv. „halo sign“, event. dutinu, tzv. aspergilom. Při konfirmaci této závažné diagnózy nám pomůže PCR diagnostika aspergilového antigenu z bronchoalveolární laváže a nález pozitivity sérového galaktomananu [7]. Léčba je primárně farmakologická a měla by být zahájena co nejdříve, neboť mortalita neléčené aspergilózy je 80 – 90 %. Lékem první volby je vorikonazol, v případě intolerance můžeme podávat amfotericin B, k čemuž bylo nezbytné sáhnout i u naší pacientky [8 – 10]. Vorikonazol, na rozdíl od amfotericinu B, má také perorální formu umožňující ambulantní léčbu. V případě nálezu aspergilomu je na místě zvážení chirurgické léčby. Délka podávání vorikonazolu záleží nejen na klinické symptomatologii, ale především na vývoji CT obrazu, a není striktně ohraničená, každopádně je vždy dlouhodobá, trvající několik měsíců. V našem případě jsme léčbu řídili po domluvě s pneumologem, celková doba podávání vorikonazolu, včetně přechodného užívání amfotericinu B, byla 15 měsíců. Vysazením léčby ale nelze pokládat aspergilózu za definitivně zvládnutou, protože může dojít k její rekurenci. Součástí následné péče je provádění CT kontrol a pneumologická dispenzarizace.
Závěr
Touto kazuistikou jsme chtěli poukázat na některé možné komplikace u pacientů po srdeční transplantaci, které přes svou závažnost mohou být úspěšně zvládnuty. U transplantovaných pacientů je důležité pomýšlet na původce infekcí také mezi oportunními patogeny a tomu přizpůsobit diagnostiku a zejm. terapii, která je zpočátku vždy empirická, aby byla posléze zacílena na zachycené agens. Léčba je zpravidla dlouhodobá, často finančně náročná s četnými lékovými interakcemi ovlivňujícími hladiny imunosupresiv, proto by také měla být vedena v transplantačních centrech. Mimoto za povšimnutí stojí raritní příčina srdečního selhání u naší pacientky, kdy nám současné léčebné metody umožňují u vybraných nemocných s izolovaným postižením myokardu při AL amyloidóze uvažovat o srdeční transplantaci v kombinaci s následnou hematologickou léčbou.
Podpořeno projektem European Regional Development Fund – Project FNUSA ‑ ICRC(No. CZ.1.05/ 1.1.00/ 02.0123).
Doručeno do redakce: 23. 10. 2014
Přijato po recenzi: 10. 11. 2014
MU Dr. Tomáš Honek
www.fnusa.cz
tomas.honek@fnusa.cz
Sources
1. Fikrle M, Paleček T, Kuchynka P et al. Cardiac amyloidosis: A comprehensive review. Cor et Vasa 2013; 55 : 60 – 75.
2. Dubrey SW, Comenzo RL. Amyloid diseases of the heart: current and future therapies. QJM 2012; 105 : 617 – 631. doi: 10.1093/ qjmed/ hcr259.
3. Krejčí J. Heart failure in AL amyloidosis – Are we still helpless? Cor et Vasa 2013; 55 : 330 – 332.
4. Kristen AV, Sack FU, Schonland SO et al. Staged heart transplantation and chemotherapy as a treatment option in patients with severe cardiac light‑chain amyloidosis. Eur J Heart Fail 2009; 11 : 1014 – 1020. doi: 10.1093/ eurjhf/ hfp121.
5. Dey BR, Chung SS, Spitzer TR et al. Cardiac transplantation followed by dose‑intensive melphalan and autologous stem ‑ cell transplantation for light chain amyloidosis and heart failure. Transplantation 2010; 90 : 905 – 911. doi: 10.1097/ TP.0b013e3181f10edb.
6. Husain S, Mooney ML, Danziger ‑ Isakov L et al. A 2010 Working formulation for the standardization of definitions of infections in cardiothoracic transplant recipients. J Heart Lung Transplant 2011; 30 : 361 – 374. doi: 10.1016/ j.healun.2011.01.701.
7. Desoubeaux G, Bailly É, Chandenier J. Diagnosis of invasive pulmonary aspergillosis: updates and recommendations. Med Mal Infect 2014; 44 : 89 – 101. doi: 10.1016/ j.medmal.2013.11.006.
8. Walsh TJ, Anaissie EJ, Denning DW et al. Treatment of Aspergillosis: Clinical Practice Guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008; 46 : 327 – 360. doi: 10.1086/ 525258.
9. Ráčil Z, Mayer J, Kocmanová I et al. Léčba invazivní aspergilózy – doporučení odborných společností. Vnitř Lék 2008; 54 : 1187 – 1194.
10. Šajgalík P, Špinarová L, Hude P et al. Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy. Kardiol Rev 2012; 14 : 130 – 132.
11. Kumar S, Dispenzieri A, Lacy MQ et al. Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol 2012; 30 : 989–995. doi: 10.1200/JCO.2011.38.5724.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 6-
All articles in this issue
- Kombinační léčba hypertenze s přihlédnutím k fixním kombinacím
- Trojkombinace v léčbě hypertenze
- Kombinační léčba perorálními antidiabetiky
- Kombinační hypolipidemická léčba
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Kombinační imunosupresivní léčba
- Série komplikací po srdeční transplantaci – kazuistika
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
- Monoklonální protilátky proti PCSK9 v léčbě dyslipidemií
- Improve IT změní guidelines
- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Genotypově‑fenotypové korelace a stratifikace rizika náhlé srdeční smrti u familiární hypertrofické kardiomyopatie – kazuistika
- Kardiovaskulární rehabilitace u pacientů po akutní koronární příhodě
- Penetrující poranění srdce – přehled
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Trojkombinace v léčbě hypertenze
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

