-
Medical journals
- Career
Kombinační hypolipidemická léčba
Authors: M. Vráblík
Authors‘ workplace: Centrum preventivní kardiologie, 3. interní klinika 1. LF UK a VFN v Praze
Published in: Kardiol Rev Int Med 2014, 16(6): 458-463
Category: Cardiology Review
Overview
Současné podávání více než jednoho léčiva k ovlivnění kardiovaskulárního rizika zásahem do metabolizmu sérových lipoproteinů není ve srovnání s postupy v léčbě arteriální hypertenze či diabetu zdaleka tak často využíváno. Základem hypolipidemické léčby je ve velké převaze případů statin, k němuž bude v případě nutnosti dalšího snížení LDL cholesterolu možná kombinace s ezetimibem nebo sekvestranty žlučových kyselin – pryskyřicemi. U smíšené dyslipidemie zejména v kontextu diabetu 2. typu lze využít kombinace statinu s fibrátem případně farmakologickými dávkami omega ‑ 3 mastných kyselin. Naproti tomu výsledky posledních klinických studií ukázaly, že niacin své místo v hypolipidemické léčbě nadále nenajde. Velmi zajímavé a slibné jsou výsledky probíhajících studií s některými novými hypolipidemiky – především monoklonální protilátky proti PCSK9 nabízejí dosud nevídané možnosti ovlivnění lipidogramu. I jejich místo bude především v kombinačních farmakologických režimech. Troj ‑ a více kombinace hypolipidemik sice nemají oporu v datech z klinických studií, ale je vhodné na ně v individuálních případech myslet.
Klíčová slova:
kardiovaskulární riziko – dyslipidemie – kombinace hypolipidemik – statiny – fibráty – ezetimib – pryskyřice – PSCK9 inhibitory
Kombinování hypolipidemických léčiv se jeví jako vhodná cesta ke snižování tzv. reziduálního kardiovaskulárního rizika. Přestože bychom tváří v tvář množství důkazů pro účinnost statinů ve většině klinických situací mohli nabýt dojmu, že správně vysoká dávka monoterapie statinem představuje dostatečnou„lipidovou“ intervenci, existuje řada nemocných, kteří i při správně vedené monoterapii statinem nedosahují primárního léčebného cíle, tedy cílové hodnoty LDL cholesterolu (LDL‑c). A pravděpodobně ještě více je těch, u nichž se nedaří při statinové léčbě dostatečně ovlivnit hladiny dalších aterogenních a antiaterogenních lipoproteinů, jejichž abnormální množství či kvalitu naznačují změny triglyceridemie, HDL cholesterolemie či nedostatečná kontrola non‑HDL cholesterolu.
Proč užít kombinační hypolipidemickou léčbu?
Základním smyslem indikace hypolipidemik zůstává v monoterapii stejně jako v kombinaci snížení rizika aterotrombotických vaskulárních příhod. Shodný je tedy i hlavní důvod pro volbu kombinace hypolipidemik – snížení kardio ‑ (nebo i cerebro‑) vaskulárního rizika nad rámec dosažitelný monoterapií. Strategie umožňující dosažení cílové hodnoty LDL-c za současné optimalizace hladin triglyceridů a HDL cholesterolu (HDL‑c) částečně tento úkol splňují. Metaanalýza dat sledujících vliv současného snižování LDL‑c a zvyšování HDL‑c poukázala na fakt, že kombinace hypolipidemik působící na více složek plazmatického lipidového spektra najednou snižuje riziko cévních komplikací až dvojnásobně ve srovnání s monoterapií (obr. 1) [1].
Image 1. % vzestupu HDL cholesterolu + % poklesu LDL cholesterolu dosažené terapií = % snížení rizika vaskulárních příhod. 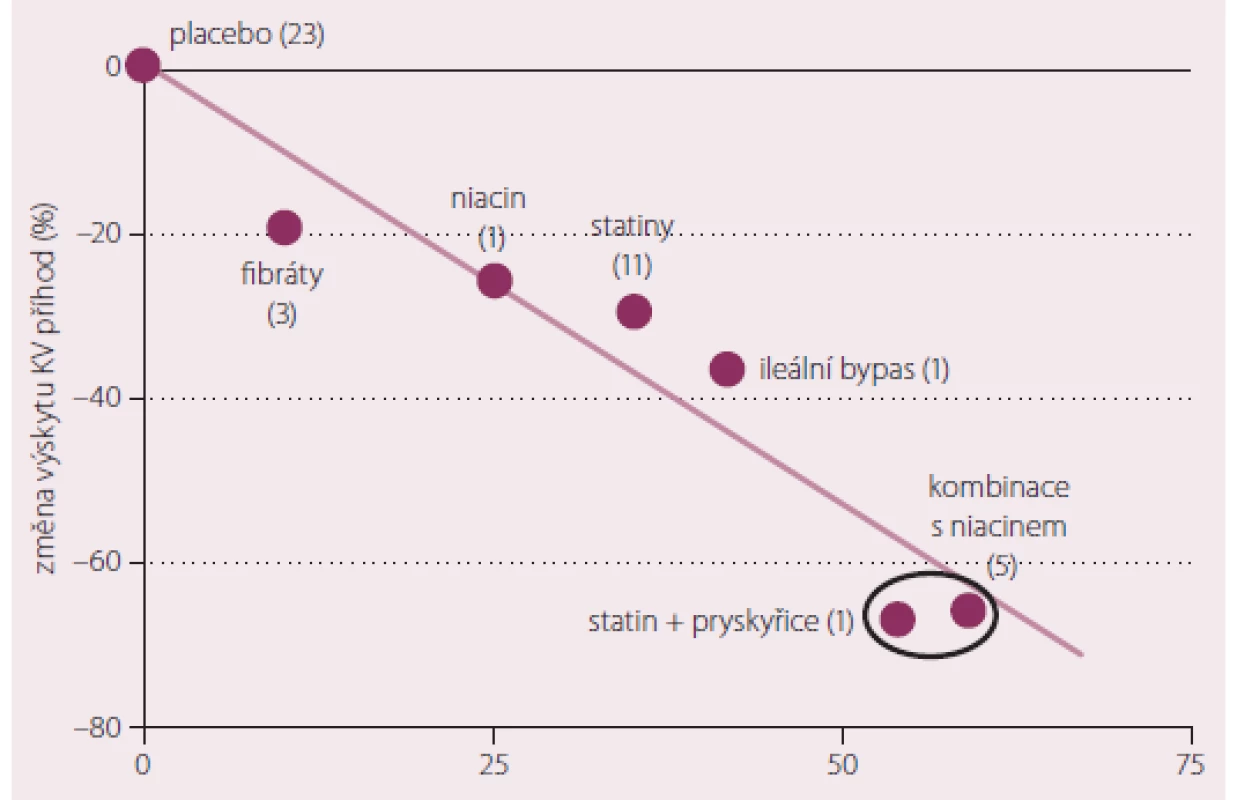
Na druhé straně si připomeňme, že základním (krátkodobým) cílem terapie zůstává dosažení doporučené hodnoty LDL‑c pro danou kategorii rizika. Z uvedeného vyplývá první důvod pro použití kombinačního hypolipidemického režimu: nedosažení cílové hodnoty LDL‑c při maximální tolerované dávce statinu. U části nemocných taková situace nastane v důsledku velmi vysokých iniciálních hodnot lipidů před léčbou. Za příklad slouží typicky pacienti s familiární hypercholesterolemií, jejichž LDL cholesterolemie před léčbou nezřídka dosahují hodnot 8 i více mmol/ l. Vezmeme‑li v úvahu maximální efekt statinové léčby (přibližně 50% pokles LDL‑c), nelze u těchto nemocných dosažení cílové hodnoty LDL‑c při monoterapii očekávat [2]. Druhou, možná ještě četnější skupinou léčených, u nichž k potřebnému snížení LDL‑c potřebujeme kombinaci, jsou pacienti s intolerancí dostatečné dávky statinu. Víme nejen z vlastní praxe, ale i z klinických studií, že nemocní nedosahují ambiciózních cílových hodnot LDL‑c vcelku běžně. V rozsáhlém sledování českých pacientů ATRACTIV bylo k cílové hladině LDL‑c léčeno iniciálně méně než 5 % účastníků. Při hodnocení s ročním odstupem byl sice dokumentován výrazný nárůst počtu nemocných s požadovanou koncentrací LDL‑c (více než jedna třetina), přesto je zřejmé, že s takovou kontrolou dyslipidemie nemůžeme být spokojeni [3].
Dalším důvodem pro kombinaci hypolipidemik je snaha o komplexní ovlivnění všech složek plazmatického lipoproteinového spektra. Víme, že právě triglyceridemie a koncentrace HDL‑c při léčbě statiny rozhoduje o prognóze léčených. Jinými slovy nemocný dosahující velmi nízké hladiny LDL‑c (< 1,8 mmol/ l) má při trvající hypertriglyceridemii o polovinu vyšší riziko ve srovnání s pacientem s triacylglycerolem (TG) v normálním rozmezí (obr. 2) [4].
Image 2. TG a HDL-c a KV riziko při terapii statinem [4]. ![TG a HDL-c a KV riziko při terapii statinem [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/83c0ea848d673a9a74f59420f024da7e.png)
Právě nedostatečné ovlivnění TG a HDL‑c představují nejpravděpodobnější důvody, proč i osoby léčené statinem mají trvající tzv. reziduální kardiovaskulární riziko na úrovni 65 – 75 % neléčené populace – tedy pokles relativního rizika při léčbě v rozmezí 25 – 35 % [5]. V současnosti asi nejméně běžný, ale jistě možný důvod pro kombinaci hypolipidemik představuje využití pleiotropních, mimolipidových účinků jednotlivých léčiv. Příkladem takové indikace může být přidání fibrátu ke statinu u diabetika s mikrovaskulárními komplikacemi [6]. Je pravdou, že v současnosti není tato indikace běžně používána ani schválena, ale představuje možnost, kterou můžeme využívat v individuálních případech.
Důvodů pro kombinaci hypolipidemik existuje tedy celá řada. Dříve než se podíváme na možné kombinace hypolipidemik, zastavíme se u „základního kamene“ kombinací.
Statiny: základ kombinací (téměř) v každé situaci
S ohledem na komplexní důkazy o prospěchu statinů v léčbě dyslipidemie napříč kategoriemi KV rizika i charakteristikami jednotlivce nás nepřekvapí, že statiny představují základ kombinačních režimů. Při volbě vhodného statinu do kombinace se můžeme řídit farmakologickými vlastnostmi jednotlivých molekul určujícími jejich potenciál k lékovým interakcím. Nejdůležitější zdroj informací o kombinovatelnosti hypolipidemik nalezneme ale v klinických studiích a v nich dominují ty založené – možná překvapivě – na simvastatinu, který má větší potenciál pro vznik interakcí ve srovnání s novějšími molekulami. Můžeme tedy říci, že při pečlivé volbě kandidátů pro hypolipidemickou kombinaci a jejich náležitém monitorování (což bývá v klinických hodnoceních pravidlem) není bezpečnost kombinací problém. Pojďme se nyní podívat na jednotlivé běžně užívané dvojice hypolipidemik a jejich základní přínosy.
Statin a ezetimib
Jedna z nejběžnějších kombinací pro intenzivnější snižování LDL-c. Využitím komplementárního mechanizmu účinku (blokáda endogenní syntézy cholesterolu a snížení absorpce exogenního cholesterolu z potravy) se prohlubuje LDL snižující efekt kteréhokoli statinu o dalších 20 % [7]. Ezetimib se sice vstřebává do portální krve, ale podléhá významnému enterohepatálnímu oběhu, takže systémová expozice účinné látce není vyšší než 5 %. I proto není bezpečnost této kombinace problémem.
Zatím nejdůležitější údaje o významu podávání kombinace statin + ezetimib přinesla studie SHARP [8]. Ta testovala vliv kombinace simvastatin + ezetimib na vaskulární prognózu nemocných s renálním onemocněním. Kromě toho, že šlo o vůbec největší studii sledující vliv hypolipidemické intervence v této skupině pacientů, se také poprvé podařilo dosáhnout významného snížení výskytu cévních příhod v aktivně léčené skupině účastníků o více než 15 %. Ezetimib dlouho čekal na definitivní „verdikt“ o svém působení měřeném počtem zabráněných infarktů, cévních mozkových příhod nebo úmrtí [9]. Dne 17. listopadu 2014 byly prezentovány výsledky studie IMPROVE ‑ IT, která se poprvé v randomizovaném uspořádání zaměřila na testování hypotézy, zdali ezetimib podávaný společně se statinem zlepší prognózu nemocných po prodělaném akutním koronárním syndromu více, než léčba statinem samotným. Studie sledovala více než 18 000 nemocných randomizovaných k léčbě simvastatinem v dávce 40 mg denně nebo ke kombinaci simvastatin 40 mg + ezetimib 10 mg denně. Nemocní, kteří nedosáhli při této léčbě hladin LDL‑c < 2,0 mmol/ l byli titrováni k dávce simvastatinu 80 mg denně. Průměrná hladina LDL‑c dosažená na konci studie u léčených samotným simvastatinem byla 1,8 mmol/ l a u pacientů léčených kombinací 1,38 mmol/ l.
Primárním sledovaným ukazatelem byla kombinace úmrtí z kardiovaskulárních příčin, infarktu myokardu, nestabilní anginy pectoris, koronární revaskularizace a cévní mozkové příhody. Ve skupině léčené monoterapií bylo zaznamenáno o 170 příhod více, než mezi pacienty léčenými kombinací (34,7 vs 32,7 %; p = 0,016), což odpovídá poklesu rizika o 6,4 % ve prospěch kombinace simvastatin + ezetimib. Celková mortalita ve studii nebyla ovlivněna. K zabránění jedné příhodě (NNT) bylo nutno léčit 50 pacientů po dobu šesti let, což byl medián sledování ve studii. První prezentace studie jednoznačně zapadá do kontextu předchozích výsledků dosažených v klinických studiích s hypolipidemickou léčbou a odpovídá také dosaženému rozdílu v průměrných koncentracích LDL‑c mezi léčebnými rameny.
Bylo tak potvrzeno místo ezetimibu u nemocných nedosahujících cílové hodnoty LDL‑c při maximální nebo maximálně tolerované dávce statinu.
Statin a pryskyřice (sekvestranty žlučových kyselin)
Pryskyřice vazbou žlučových kyselin ve střevním lumen omezují jejich enterohepatální oběh, a tak vzrůstá jejich fekální exkrece. Zatímco za fyziologických podmínek se vylučování žlučových kyselin pohybuje v rozmezí 300 – 500 mg denně, při užívání pryskyřic toto množství vzrůstá až šestinásobně. Navíc dochází k omezení vstřebávání cholesterolu přijatého potravou. Kromě toho pokles intracelulární koncentrace cholesterolu v hepatocytu stimuluje zmnožení LDL receptorů na povrchu hepatocytu. Tímto mechanizmem dochází k poklesu hladin LDL‑c o 10 – 30 %. Stimulace tvorby endogenního cholesterolu však zvyšuje produkci VLDL částic, což se projeví vzestupem plazmatických triglyceridů. Toto zvýšení triglyceridů se u většiny pacientů vrací za několik týdnů k normě [10]. Kromě příznivého vlivu na lipidogram víme o pozitivním působení pryskyřic na glukózovou homeostázu [11]. Hlavním problémem použití pryskyřic představují nežádoucí účinky – především úporná obstipace a nepříjemná chuť zejména u práškových lékových forem. Tyto nedostatky překonává zčásti vysoce polymerní přípravek colesevelam umožňující snížení objemu medikace na desetinu, avšak jeho použití limituje výrazně vyšší cena.
Obecně je místo pryskyřic typicky v kombinačních hypolipidemických režimech. Kombinace malé dávky statinu s pryskyřicí může vést ke srovnatelným výsledkům jako užití střední dávky statinu. S ohledem na aktuálně žhavé téma diabetogenního efektu statinů se jako atraktivní jeví kombinace statin + pryskyřice u pacientů s prediabetem. Teoretické předpoklady vyrovnání nepříznivého působení statinu žádoucími účinky pryskyřic a možnost použití nižších dávek statinu jsou lákavé. Na druhé straně se v těchto úvahách pohybujeme v rovině neprokázaných spekulací a zůstává otázkou, zda někdy budeme mít k dispozici údaje ověřující praktickou účinnost takové léčebné možnosti.
Statin a fibrát
Poslední výzkumy posunuly těžiště indikace fibrátů také do kombinace se statiny, byť fibráty zůstávají důležité i pro monoterapii dyslipidemie (DLP) s převažující hypertriglyceridemií. Nejpoužívanější u nás je dlouhodobě fenofibrát, který disponuje i nejrozsáhlejší dokumentací z klinických studií včetně údajů o kombinaci se statiny.
Díky agonizaci nitrojaderných receptorů PPAR alfa je účinek fibrátů komplexní. Klinicky se řada těchto vlivů projeví poklesem triglyceridemie provázeným mírným vzestupem koncentrací HDL‑c. Fibráty navíc snižují podíl nejaterogennějších malých denzních LDL částic až o 50 % [12].
Význam podávání fibrátů v prevenci makrovaskulárních cévních příhod je stále předmětem debat. Zdá se, že na rozdíl od statinů, od nichž lze očekávat prospěch napříč spektrem populace se zvýšeným kardio ‑ a cerebrovaskulárním rizikem, je třeba kandidáty pro terapii fibráty pečlivěji vybírat. Ve všech fibrátových sledováních profitovali nejvíce nemocní se vstupně nižší hladinou HDL‑c a zvýšením triglyceridů [13]. U těchto pacientů s typickou smíšenou „aterogenní“ dyslipidemií se ovlivnění rizika jakékoli kardiovaskulární příhody jeví významné nejen statisticky (p < 0,05), ale i klinicky (obr. 3).
Image 3. Vliv podávání fi brátů na výskyt vaskulárních příhod u osob se smíšenou DLP (A) a osob bez DLP (B). 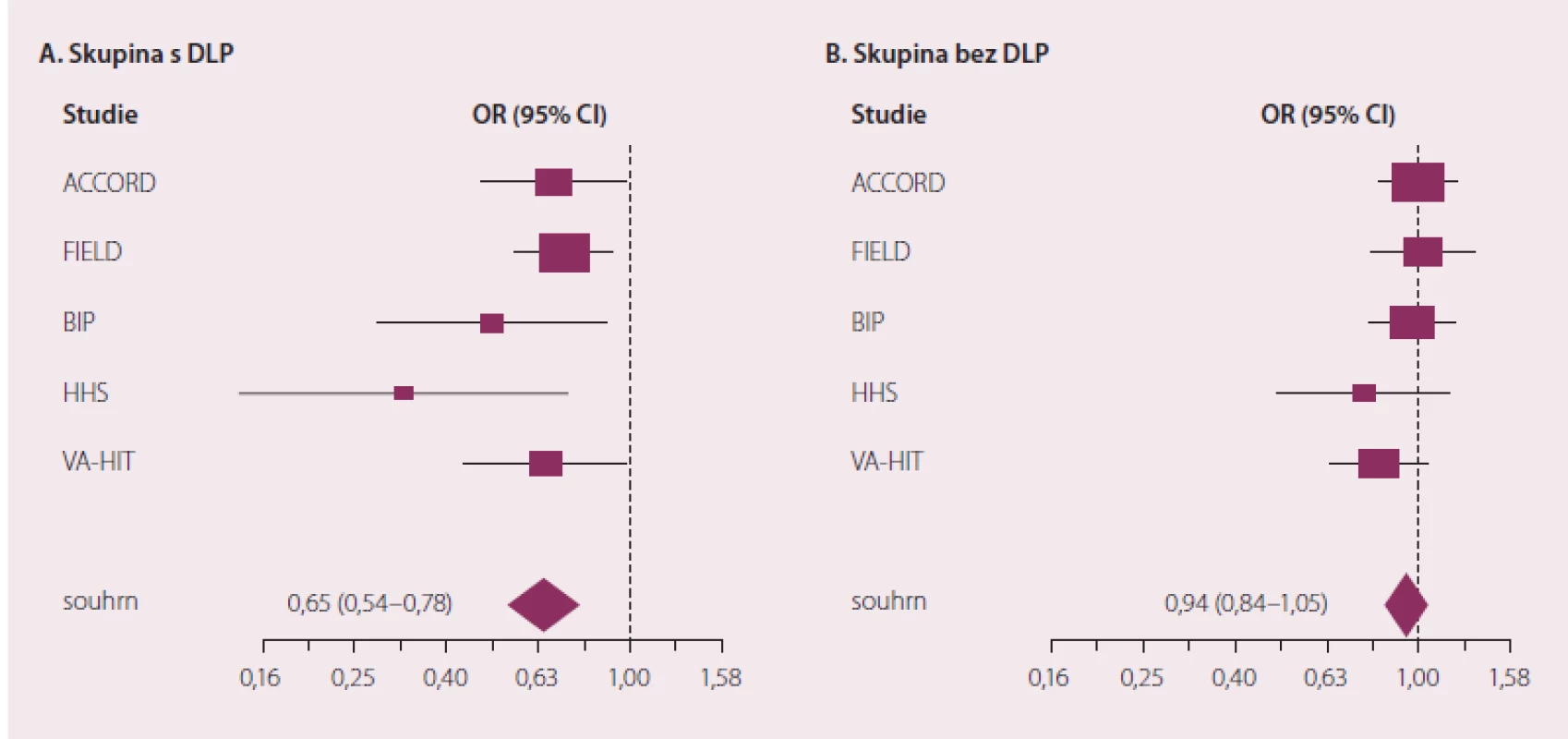
První a poslední dlouhodobou randomizovanou studií s kombinací statinu s fibrátem bylo lipidové rameno studie ACCORD, která zasluhuje větší komentář [14]. U více než 10 tisíc sledovaných diabetiků 2. typu vedla kombinační léčba simvastatinem a fenofibrátem k významnému snížení hladin triglyceridů a celkového cholesterolu za současného statisticky signifikantního vzestupu HDL‑c při srovnání s placebem. Hladiny LDL‑c se ve fenofibrátové větvi nelišily od hodnot u nemocných na placebu (všichni byli léčeni simvastatinem v průměrné denní dávce 22,3 mg). Přidání fenofibrátu k léčbě simvastatinem snížilo výskyt primárního sledovaného cíle i jeho jednotlivých komponent nevýznamně.
U podskupiny nemocných s významnou hypertriglyceridemií a nízkou hladinou HDL‑c (tzv. aterogenní dyslipidemie) ale výsledky ukázaly podobně jako v případě ostatních fibrátů něco jiného. Do této subanalýzy bylo zařazeno 941 účastníků studie, kteří měli při vstupním vyšetření koncentrace TG ≥ 2,3 mmol/ l a HDL‑c ≤ 0,9 mmol/ l. Primární sledovaný cíl se v podskupině s aterogenní dyslipidemií vyskytl u 12,4 % léčených fenofibrátem a u 17,3 % pacientů na placebu, což odpovídá poklesu relativního rizika o 30 %. U pacientů bez významné dyslipidemie se výskyt nelišil a byl v obou léčebných ramenech 10,1 %. Velmi důležitá byla bezpečnostní data. Léčba byla dobře tolerována a nebylo zaznamenáno významně častější zhoršení renálních funkcí (stejně jako v minulých studiích s fenofibrátem byl dokumentován vzestup koncentrace sérového kreatininu bez zvýšení výskytu renálního selhání nebo poklesu glomerulární filtrace). Riziko vzniku svalových nežádoucích účinků bylo stejné při užívání kombinační hypolipidemické léčby jako při monoterapii statinem (v obou větvích studie se vyskytly čtyři případy myotoxicity). Kombinace hypolipidemik nebyla spojena s nárůstem rizika zhoršení jaterních funkcí (méně než 2 % účastníků v obou srovnávaných léčebných ramenech). Všechny uvedené výsledky studie ACCORD Lipid položily základ pro přípravu první fixní kombinace simvastatinu s fenofibrátem, která se dostává do klinické praxe právě v těchto dnech.
Mikrovaskulární účinky fenofibrátu – další důvod pro kombinační léčbu?
Extrémně zajímavá data poskytnutá fenofibrátovými studiemi FIELD a ACCORD se týkala mikrovaskulárních komplikací diabetu (zejm. diabetické retinopatie a nefropatie) [15]. Fenofibrát se ukázal jako účinný v prevenci a zpomalení progrese diabetické retinopatie a významně snižoval potřebu prvního i opakovaného laserového ošetření retiny. Přestože elevace triglyceridů a snížení hladiny HDL‑c jsou známými rizikovými faktory spojenými s vyšší incidencí makulárního edému a progresí diabetické retinopatie, nelze výsledky roční podstudie ACCORD vysvětlit změnami hladin sérových lipidů. Experimentální práce dokumentovaly několik mechanizmů, které mohou příznivý vliv fenofibrátu na mikrocirkulaci vysvětlit a jsou heslovitě shrnuty v tab. 1.
Table 1. Mechanizmy ovlivnění mikrovaskulárních komplikací diabetu fenofibrátem. 
Když nelze použít statin
V každodenní praxi se setkáváme s nemocnými, kteří mají dyslipidemii, vysoké kardiovaskulární riziko a přitom statin nelze použít pro intoleranci. V takovém případě můžeme zvážit podávání kombinace hypolipidemik, která se statinům vyhne. Musíme si v tomto kontextu připomenout, že takové kombinace nebyly testovány v řádně provedených dvojitě slepých klinických studiích, a vycházíme tedy pouze z informací o působení na koncentrace sérových lipoproteinů. Kombinace ezetimibu s fenofibrátem zlepší zejm. kontrolu smíšené DLP a dovede více nemocných k cílové hodnotě LDL‑c i non‑HDL‑c, jak dokumentovala např. studie francouzských autorů hodnotící více než 600 nemocných randomizovaných k léčbě placebem/ fenofibrátem/ ezetimibem/ kombinací fenofibrátu a ezetimibu [16]. Kombinace pryskyřic s ezetimibem dává smysl u nemocných s hypercholesterolemií opět za podmínky, že netolerují statin. Kombinace pryskyřic a fibrátů byly také testovány a podle očekávání přinesla kombinační léčba lepší kontrolu LDL‑c za cenu mírného vzestupu triglyceridemie (viz výše popsaný účinek pryskyřic); hladiny HDL‑c se při této terapii měnily nekonstantně [17].
Kombinace více než dvou hypolipidemik
Tato kombinace přichází v úvahu ve speciálních případech. Uvažujeme o ní zejm. u nemocných netolerujících dostatečné dávky statinů, kde kombinace s ezetimibem a pryskyřicí poskytuje lepší šanci na dosažení cílové hodnoty LDL‑c i při použití nízké dávky statinu. I u těch léčených dvojkombinací statin + ezetimib přináší přidání pryskyřice dodatečný pokles LDL‑c o 10 – 15 %. Jinou možností, která se nabízí, je kombinace statin + ezetimib + fenofibrát. Její podávání ke snížení tzv. reziduálního rizika smíšené DLP vychází z předpokladů získaných ve sledování dvojkombinací, případně jednotlivých složek této kombinace v monoterapii. Statin s ezetimibem mohou snížit LDL‑c až o 60 % a fenofibrát posílí tento efekt o dalších 5 – 10 % za současného zlepšení kontroly hypertriglyceridemie, posunu spektra LDL částic směrem k větším a méně denzním a navíc s výše uvedeným příznivým působením na mikrocirkulaci [18].
Do třetice k terapii statinem a fenofibrátem lze zvážit i podání farmakologických (3 – 4 g denně) dávek omega ‑ 3 mastných kyselin. Ty mají pomocný efekt při zvládání významné hypertriglyceridemie. Přestože suplementaci omega ‑ 3 mastnými kyselinami testovala v minulosti pozitivně řada studií, v poslední době zaznamenáváme jistý odklon od jejich indikace v rámci prevence aterosklerózy. V kombinaci s dalšími hypolipidemiky však i nadále zůstávají prostředkem, jak posílit TG snižující účinek o dalších 20 – 30 % podle závažnosti elevace triglyceridů [19].
Zítřky hypolipidemických kombinací
Zkušenosti z minulosti určitě představují důležitý zdroj informací. Ale podívejme se na budoucnost hypolipidemických kombinací. Z hlediska kombinací se statinem snižující LDL‑c bude určitě nejvíce novinek v oblasti dynamicky se rozvíjející biologické léčby dyslipidemie. Nejpokročilejší v tomto směru je vývoj monoklonálních protilátek proti pro‑protein‑konvertáze subtilisin/ kexin 9 (PCSK9). Jde o protein, který interakcí s LDL receptorem zvyšuje jeho degradaci. Zablokování této interakce zvyšuje množství funkčních LDL receptorů na povrchu buněk. Tyto nové subkutánně podávané lékové formy podávané 1× za 2 – 4 týdny jsou nyní extenzivně zkoumány. Dostupné výsledky jsou povzbudivé, neboť snížení LDL‑c dosahuje 50 – 80 % za současného příznivého ovlivnění ostatních lipidových tříd (pokles TG a mírný vzestup HDL, snížení Lp(a)) (obr. 4).
Image 4. Změny LDL-c při podávání evolocumabu za 12 a 52 týdnů ve studii DESCARTES. 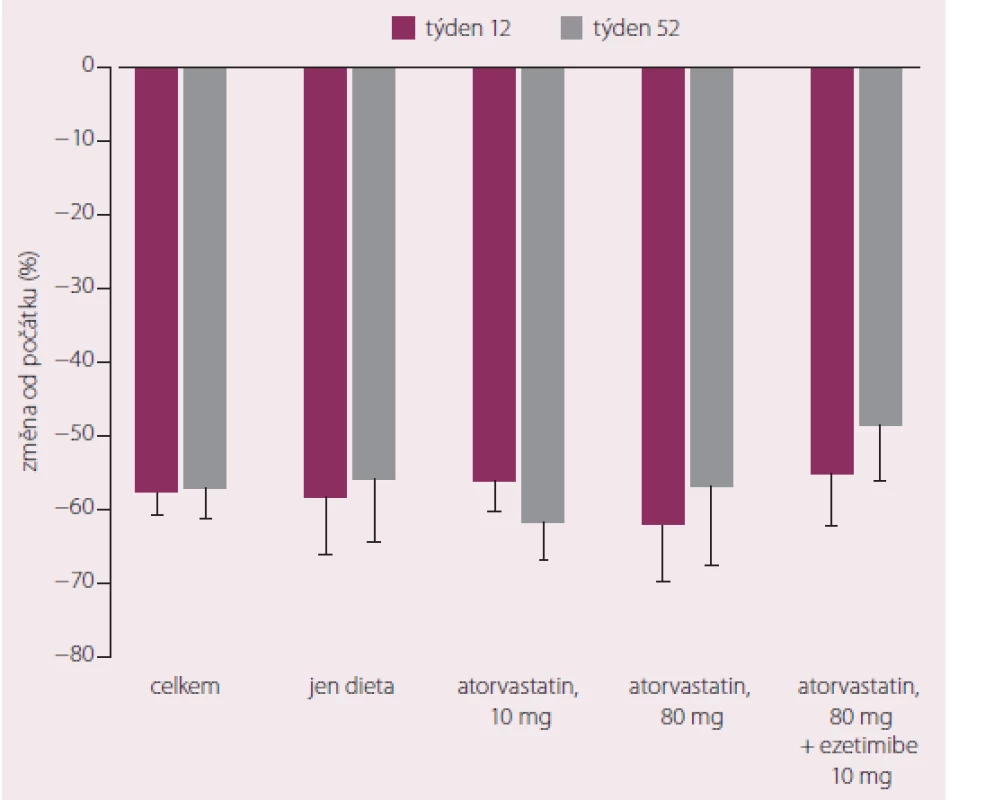
Všechny PCSK9 inhibitory jsou testovány v rozsáhlých programech klinických studií (evolocumab – program PROFICIO, alirocumab – program ODYSSEY, bococizumab – program SPIRE), každý z nich zahrnuje různé populace pacientů a celkový počet zařazených osob v nich přesahuje 70 000 [20].
Budoucnost patří kombinaci?
V úvodu článku jsme použili pro srovnání přístupů ke kombinační léčbě dyslipidemie paralelu s arteriální hypertenzí, kde jsme kombinace zvyklí široce využívat. Příklady studií kombinující statin s fenofibrátem nebo ezetimibem ale ukázaly na podstatný rozdíl. Zatímco o úspěchu antihypertenzivní strategie rozhoduje hlavně dosažená úroveň krevního tlaku (o níž se navíc můžeme velmi snadno neinvazivně přesvědčit), při kombinaci hypolipidemik neznamená pokles hladin aterogenních lipidů vždy další snížení rizika. Kombinační hypolipidemickou léčbu je třeba volit s ohledem na důkazy z klinických studií a individuální potřebu konkrétního nemocného. Indikace kombinací nebude jistě tak jednoduchá a univerzální jako v případě indikace statinů (všichni nemocní s manifestní aterosklerózou apod.), ale bylo by chybou ji nepodat tam, kde je prospěch evidentní. Vedení nemocného léčeného kombinační hypolipidemickou léčbou tak může být „pracnější“, ale u mnoha pacientů bude naše zvýšené úsilí odměněno úspěchem prevence aterotrombotických komplikací.
Částečně podpořeno grantem IGA MZ ČR NT 12217 - 5.
Doručeno do redakce: 7. 11. 2014
Přijato po recenzi: 21. 11. 2014
doc. MU Dr. Michal Vrablík, Ph.D.
www.vfn.cz
vrablikm@seznam.cz
Sources
1. Brown GB, Zhao XQ. Nicotinic acid, alone and in combinations, for reduction of cardiovascular risk. Am J Cardiol 2008; 101 : 58B – 62B. doi: 10.1016/ j.amjcard.2008.02.039.
2. Law MR, Wald NJ, Rudnicka AR. Quantifying effect of statins on low density lipoprotein cholesterol, ischaemic heart disease, and stroke: systematic review and meta‑analysis. BMJ 2003; 326 : 1423 – 1430.
3. Vrablík M, Freiberger T, Lánská V et al. Projekt Atractiv: zlepšení kardiovaskulární prevence v podmínkách primární péče v České republice. Vnitř Lék 2008; 54 : 1131 – 1139.
4. Barter P, Gotto AM, LaRosa JC et al. HDL cholesterol, very low levels of LDL cholesterol and cardiovascular events. N Engl J Med 2007; 357 : 1301 – 1310.
5. Vrablík M. Reziduální riziko kardiovaskulárních příhod. Medicína po promoci 2009; 10 : 60 – 64.
6. Chew EY, Ambrosius WT, Davis MD et al. The ACCORD Study Group and ACCORD Eye Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 363 : 233 – 244. doi: 10.1056/ NEJMoa1001288.
7. Davidson MH, Ballantyne CM, Kerzner B et al. Efficacy and safety of ezetimibe coadministered with statins: randomised, placebo ‑ controlled, blinded experience in 2382 patients with primary hypercholesterolemia. Int J Clin Pract 2004; 58 : 746 – 755.
8. Sharp Collaborative Group. Study of Heart and Renal Protection (SHARP): randomized trial to assess the effects of lowering low ‑ density lipoprotein cholesterol among 9,438 patients with chronic kidney disease. Am Heart J 2010; 160 : 785 – 794. doi: 10.1016/ j.ahj.2010.08.012.
9. Califf RM, Lokhnygina Y, Cannon CP et al. An update on the Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE ‑ IT) design. Am Heart J 2010; 159 : 705 – 709. doi: 10.1016/ j.ahj.2010.03.004.
10. Bays HE, Goldberg RB. The 'forgotten' bile acid sequestrants: is now a good time to remember? Am J Ther 2007; 14 : 567 – 580.
11. Handelsman Y. Role of bile acid sequestrants in the treatment of type 2 diabetes. Diabetes Care 2011; 34 (Suppl 2): S244 – S250. doi: 10.2337/ dc11 ‑ s237.
12. Vrablík M. Farmakoterapie dyslipidemií. Praha: Maxdorf 2012.
13. Jun M, Foote C, Lv J et al. Effects of fibrates on cardiovascular outcomes: review and meta‑analysis. Lancet 2010; 375 : 1875 – 1884. doi: 10.1016/ S0140 ‑ 6736(10)60656 ‑ 3.
14. Ginsberg HN, Elam MB, Lovato LC et al. ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1563 – 1574. doi: 10.1056/ NEJMoa1001282.
15. Rajamani K, Colman PG, Li LP et al. FIELD study investigators. Effect of fenofibrate on amputation events in people with type 2 diabetes mellitus (FIELD study): a prespecified analysis of a randomised controlled trial. Lancet 2009; 373 : 1780 – 1788. doi: 10.1016/ S0140 ‑ 6736(09)60698 ‑ X.
16. Farnier M, Freeman MW, Macdonell G et al. Efficacy and safety of the coadministration of ezetimibe with fenofibrate in patients with mixed hyperlipidemia. Eur Heart J 2005; 26 : 897 – 905.
17. Agouridis AP, Filippatos TD, Derdemezis CS et al. Combination of fenofibrate with non‑statin drug regimens. Curr Pharm Des 2010; 16 : 3401 – 3416.
18. Farnier M, Taggart W, Dong Q et al. Influence of simvastatin, fenofibrate and/ or ezetimibe on correlation of low ‑ density lipoprotein and nonhigh‑density lipoprotein cholesterol with apolipoprotein B in mixed dyslipidemic patients. J Clin Lipidol 2011; 5 : 179 – 187. doi: 10.1016/ j.jacl.2011.02.009.
19. Davidson MH, Stein EA, Bays HE et al. COMBination of prescription Omega ‑ 3 with Simvastatin (COMBOS) Investigators. Efficacy and tolerability of adding prescription omega ‑ 3 fatty acids 4 g/ d to simvastatin 40 mg/ d in hypertriglyceridemic patients: an 8‑week, randomized, double‑blind, placebo controlled study. Clin Ther 2007; 29 : 1354 – 1367.
20. Stein EA, Wasserman SM, Dias C et al. AMG ‑ 145. Drugs of the Future 2013; 38 : 451 – 459.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 6-
All articles in this issue
- Kombinační léčba hypertenze s přihlédnutím k fixním kombinacím
- Trojkombinace v léčbě hypertenze
- Kombinační léčba perorálními antidiabetiky
- Kombinační hypolipidemická léčba
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Kombinační imunosupresivní léčba
- Série komplikací po srdeční transplantaci – kazuistika
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
- Monoklonální protilátky proti PCSK9 v léčbě dyslipidemií
- Improve IT změní guidelines
- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Genotypově‑fenotypové korelace a stratifikace rizika náhlé srdeční smrti u familiární hypertrofické kardiomyopatie – kazuistika
- Kardiovaskulární rehabilitace u pacientů po akutní koronární příhodě
- Penetrující poranění srdce – přehled
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Trojkombinace v léčbě hypertenze
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

