-
Medical journals
- Career
Screening kolorektálního karcinomu
Authors: G. Vojtěchová 1; Š. Suchánek 1; T. Grega 1; O. Májek 2; L. Dušek 2; M. Zavoral 1
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN Praha 1; Institut biostatistiky a analýz, LF a PřF MU, Brno 2
Published in: Kardiol Rev Int Med 2014, 16(3): 235-239
Category: Internal Medicine
Overview
Kolorektální karcinom (KRK) je druhým nejčastějším zhoubným onemocněním v České republice. Většinu KRK tvoří tzv. sporadická forma a pouze 14 – 19 % vzniká na základě vrozené predispozice. Vzhledem k relativně dlouhému času kancerogeneze je možné v rámci screeningu detekovat a včas odstranit premaligní léze, a zabránit tak vzniku KRK. Screening kolorektálního karcinomu v České republice prochází kontinuálním vývojem a jeho základními nástroji jsou aktuálně imunochemické testy na okultní krvácení do stolice s kolonoskopií v případě jejich pozitivity a primární screeningová kolonoskopie. Od ledna 2014 došlo k zavedení adresného zvaní občanů mladších 70 let k účasti na programu. Jedinci s vyšším rizikem kolorektální neoplázie jsou sledováni v rámci dispenzárních programů.
Klíčová slova:
kolorektální karcinom – screening – kolonoskopie – TOKS – adresné zvaníÚvod
Kolorektální karcinom (KRK) je genetické onemocnění vycházející z epitelových buněk tlustého střeva. Proces kancerogeneze, změna normální sliznice přes adenom na karcinom, trvá cca 10 let a poskytuje nám dostatek času k odvrácení nepříznivé prognózy. V rámci screeningu lze premaligní léze detekovat (obr. 1 a 2), odstranit (obr. 2 a 3), a zabránit tak vzniku zhoubného onemocnění nebo zachytit KRK v časném, snáze léčitelném stadiu. Jedná se tedy o preventabilní nádorové onemocnění.
Epidemiologie KRK
Kolorektální karcinom je druhou nejčastější malignitou v ČR (bez nádorů kůže) i druhou nejčastější příčinou úmrtí na zhoubný novotvar. V obou případech se nachází hned za karcinomem prostaty u mužů a karcinomem mammy u žen [1]. ČR zaujímá pátou, respektive třetí příčku ve světové incidenci a mortalitě kolorektálního karcinomu. Ročně je v ČR karcinom kolorekta diagnostikován u 7 800 – 8 200 pacientů a 3 800 – 4 200 jich na toto zhoubné onemocnění zemře. V roce 2010 žilo na území ČR 50 828 pacientů s KRK.
Typický věk českého pacienta s kolorektálním karcinomem leží v intervalu 63 – 77 let. Téměř čtvrtina jedinců je však v době diagnózy mladší 60 let. Přes zahájení screeningového programu je pouze 47 % nádorů kolorekta diagnostikováno v časném, snáze léčitelném stadiu (I a II).
Formy KRK
Screening kolorektálního karcinomu je zaměřený především na záchyt tzv. sporadického kolorektálního karcinomu, který tvoří cca 80 – 85 % všech KRK a nemá familiární ani hereditární charakter. Po ostatních formách kolorektálního karcinomu je cíleně pátráno v rámci dispenzarizace vysokorizikových skupin. Hereditární formy KRK tvoří dobře definované genetické syndromy, jako např. hereditární nepolypózní kolorektální karcinom (HNPCC, 5 %) a familiární adenomatózní polypóza (FAP, 1 %). U 10 % nemocných s výskytem KRK v rodině neodhalíme přesnou genetickou etiologii a hovoříme o tzv. familiárním kolorektálním karcinomu. Cca v 1 % je KRK pozdní komplikací idiopatického střevního zánětu. Mezi jedince s vysokým rizikem KRK patří mj. i pacienti s osobní anamnézou adenomu či karcinomu kolorekta.
Sporadický KRK
Nejvýznamnějším rizikovým faktorem sporadického KRK je neovlivnitelný endogenní faktor – věk. Celoživotní riziko vzniku KRK začíná významně stoupat na začátku šestého decennia. Mezi ovlivnitelné rizikové faktory patří denní konzumace červeného masa, úprava potravin smažením, pečením a grilováním, vyšší podíl živočišných tuků v potravě, kouření cigaret a zvýšená konzumace alkoholu [2]. Dalším faktorem, který zvyšuje riziko KRK, je abdominální obezita a diabetes mellitus 2. typu [3 – 5]. Výše uvedené příklady nevhodné životosprávy jsou zároveň faktory zvyšující kardiovaskulární morbiditu a mortalitu. V ČR probíhá od roku 2012 multicentrická prospektivní studie, jejímž cílem je zjistit, zda jsou osoby se zvýšeným kardiovaskulárním rizikem (SCORE > 10 %) zároveň nositeli vyššího rizika kolorektální neoplázie.
Naopak mezi protektivní faktory patří pravidelná konzumace rybího masa a tuku, příprava pokrmů vařením, dostatečný příjem kalcia a vitaminu D v potravě. Zařazení vyššího podílu ovoce, zeleniny a vlákniny do jídelníčku prokazatelně nesníží riziko KRK. Jejich příznivý vliv lze z hlediska prevence KRK shledat jen v suplementaci folátu. Farmakologická profylaxe bez významných nežádoucích účinků nebyla dosud vyvinuta, a proto ji nelze rutinně doporučit.
Prevence KRK
Primární prevencí rozumíme předcházení vzniku onemocnění eliminací výše uvedených nepříznivých vlivů zevního prostředí. Sekundární prevence zahrnuje dvě pracovní metody: screening (depistáž), tj. časnou diagnostiku choroby u bezpříznakových jedinců s běžným rizikem KRK, a dispenzarizaci (follow‑up, surveillance), tj. dlouhodobé sledování vysokorizikových skupin.
Sekundární prevence – screening
Cílem screeningu KRK je zvýšení četnosti záchytu zhoubných nádorů kolorekta a tzv. pokročilého adenomu (velikost > 10 mm, tubulovilózní nebo vilózní charakter polypu a/ nebo přítomnost dysplastických změn vysokého stupně) a dále zvýšení podílu časných stadií KRK na úkor stadií pokročilých. Očekávaným výstupem je redukce incidence a mortality KRK.
V současné době jsou k dispozici tři typy screeningových metod (tab. 1). V rámci screeningového programu v ČR je využíván test na okultní krvácení do stolice (TOKS) a kolonoskopie. TOKS je neinvazivní vyšetření, které detekuje pouhým okem neviditelné stopy krve ve stolici. Adenomové polypy krvácejí sporadicky a polypy menší než 15 mm nekrvácejí prakticky vůbec. K detekci signifikantní kolorektální neoplázie je tedy nezbytné pravidelné opakování vyšetření TOKS. Existují dva hlavní typy TOKS:
Table 1. Typy screeningových metod. 
Guajakový test (gTOKS) je založen na peroxidázové reakci, která je zatížena falešnou pozitivitou (např. po pozření červeného masa) i falešně negativními výsledky (např. po užití vyšší dávky antioxidantu – vitaminu C). Vyšetření tedy musí předcházet dieta s omezením určitých potravin. U gTOKS bylo v rozsáhlých randomizovaných studiích prokázáno snížení mortality na KRK o 15 – 21 % při dvouletém a o 33 % při ročním intervalu [6].
Imunochemické TOKS (FIT – fecal immunochemical test) jsou založené na přímé detekci lidského hemoglobinu a nemocní se před vyšetřením nemusí dietně omezovat. Imunochemické testy mají oproti gTOKS vyšší analytickou i klinickou senzitivitu a specificitu, jejich měření může být automatizováno a je možné nastavit tzv. cut off. Jsou proto považovány za metodu volby.
Kolonoskopie, zlatý standard vyšetření tlustého střeva, je ve screeningu kolorektálního karcinomu využívána jako jediná screeningová metoda (tzv. primární screeningová kolonoskopie, PSK) nebo následuje po pozitivním výsledku primárního screeningového vyšetření (screeningová kolonoskopie, TOKS + kolonoskopie). Vlastní kolonoskopii předchází čištění střeva projímadly. Špatná střevní příprava výrazně zvyšuje riziko přehlédnutí kolorektální neoplázie a nutnost opakování výkonu. Bohužel až 25 % pacientů, kteří podstoupí kolonoskopii, má neadekvátně připravené tlusté střevo [7]. Screeningovou kolonoskopii se špatnou či velmi špatnou střevní přípravou nelze považovat za konkluzivní [8]. Většině pacientů můžeme doporučit přípravu polyethylen glykolem (PEG) pro jeho dobrý efekt při minimu nežádoucích účinků. Upřednostňujeme rozdělení přípravy do dvou dávek. Druhá dávka by měla být dopita nejdříve osm hodin a nejpozději 3 – 4 hodiny před začátkem vyšetření [9 – 11].
Screening KRK v ČR
Screening KRK má v ČR letitou tradici a prochází kontinuálním vývojem [12,13]. Již v roce 2000, v pořadí druhý na světě, byl v ČR zahájen národní program screeningu KRK u asymptomatických jedinců. Vychází z premisy, že věk je jedním z hlavních rizikových faktorů sporadického KRK. Bezpříznakovým jedincům od 50 let věku byl nabídnut guajakový test na okultní krvácení ve stolici následovaný kolonoskopií v případě jeho pozitivity. Počátkem roku 2009 došlo k zásadní úpravě programu zavedením screeningové kolonoskopie a imunochemických testů na okultní krvácení do stolice (FIT). Asymptomatickým jedincům ve věku od 50 do 54 let je nabízen TOKS v jednoročním intervalu. V případě pozitivity tohoto testu je indikována screeningová kolonoskopie. Od věku 55 let si může každý občan zvolit mezi opakovaným TOKS ve dvouletém intervalu a primární screeningovou kolonoskopií v desetiletém intervalu. Kromě praktických lékařů a gynekologů jsou do screeningu od roku 2009 zapojeni také ambulantní gynekologové. Od roku 2013 dochází, v souladu s nejnovějšími poznatky, k útlumu gTOKS a postupnému přechodu na FIT.
Zavedením FIT, primární screeningové kolonoskopie, a zapojením ambulantních gynekologů došlo k nárůstu pokrytí cílové populace, která v ČR čítá 3,8 milionu jedinců, na 25 %. Nicméně pro signifikantní změnu incidence a mortality na toto zhoubné onemocnění je nezbytná účast 50 %, optimálně až 65 % cílové populace. V lednu 2014 proto došlo ke změně oportunního programu na populační zavedení státem organizovaného adresného zvaní. Občané mladší 70 let, kteří se preventivních programů dlouhodobě neúčastní, jsou svými zdravotními pojišťovnami korespondenčně vyzýváni k participaci na screeningu kolorektálního karcinomu, na screeningu karcinomu mammy a děložního čípku u žen. Program zvaní je koordinován Ministerstvem zdravotnictví ČR ve spolupráci s plátci zdravotní péče a s odbornými lékařskými společnostmi.
Výsledky screeningu KRK v ČR
Od zavedení on‑line sběru individuálních dat v roce 2006 do dubna 2014 bylo v rámci screeningu KRK provedeno (resp. dosud do on‑line databáze zadáno) 135 605 kolonoskopií, z nich bylo 114 997 screeningových, následujících po pozitivním TOKS, a 20 608 tzv. primárních screeningových kolonoskopií. Adenomové polypy (obr. 1 – 4) byly diagnostikovány u 45 638 jedinců (33,7 %). Adenoma detection rate, podíl pacientů, u kterých byl diagnostikován adenomový polyp, je jedním z indikátorů kvality kolonoskopie a neměl by být nižší než 20 % [14]. Karcinom byl v rámci screeningového programu nalezen u 5 138 osob (3,8 %) (obr. 5). V detekci karcinomů, na rozdíl od adenomů, je patrný sestupný trend. Dochází ke snížení podílu pacientů s KRK z 6,3 % v roce 2006 na 3,7 % v roce 2013 (tab. 2).
Image 1. Přisedlý polyp transverza – standardní zobrazení v bílém světle. 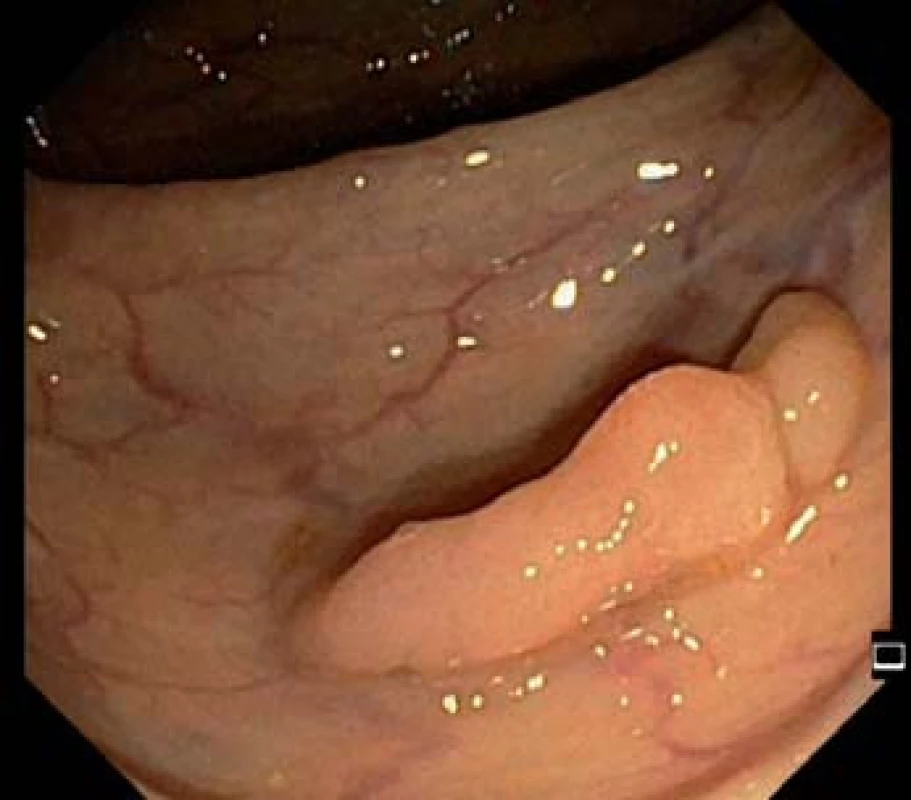
Image 2. Přisedlý polyp transverza – zobrazení narrow band imaging (NBI). 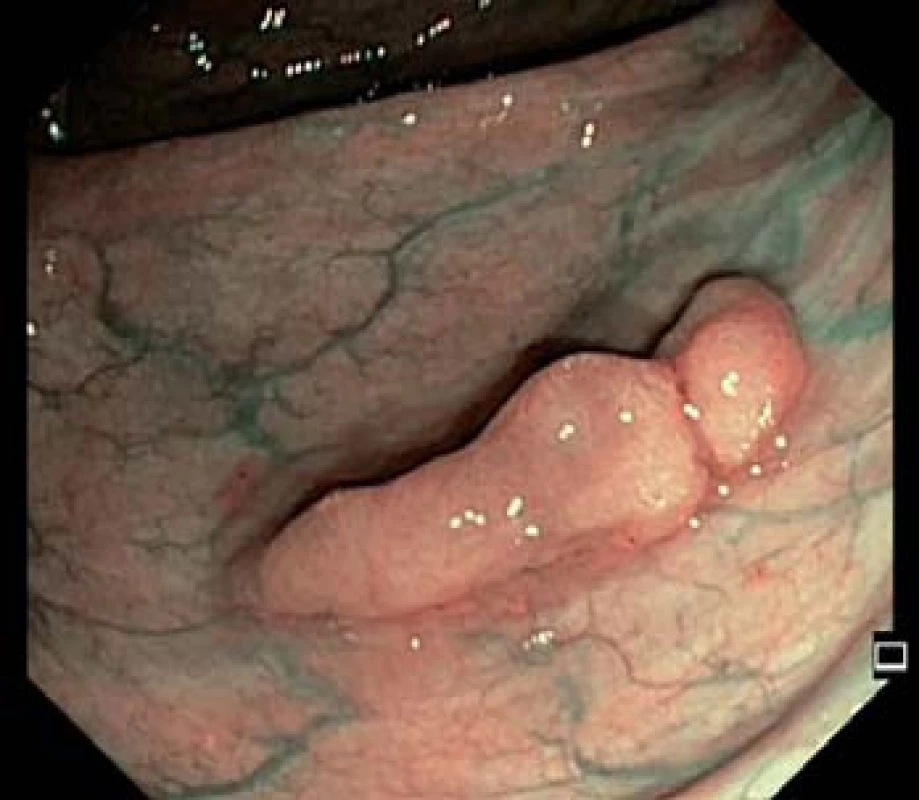
Image 3. Spodina po odstranění polypu (endoskopická mukozální resekce). 
Image 4. Spodina po endoskopické mukozální resekci, zajištěna hemoklipy. 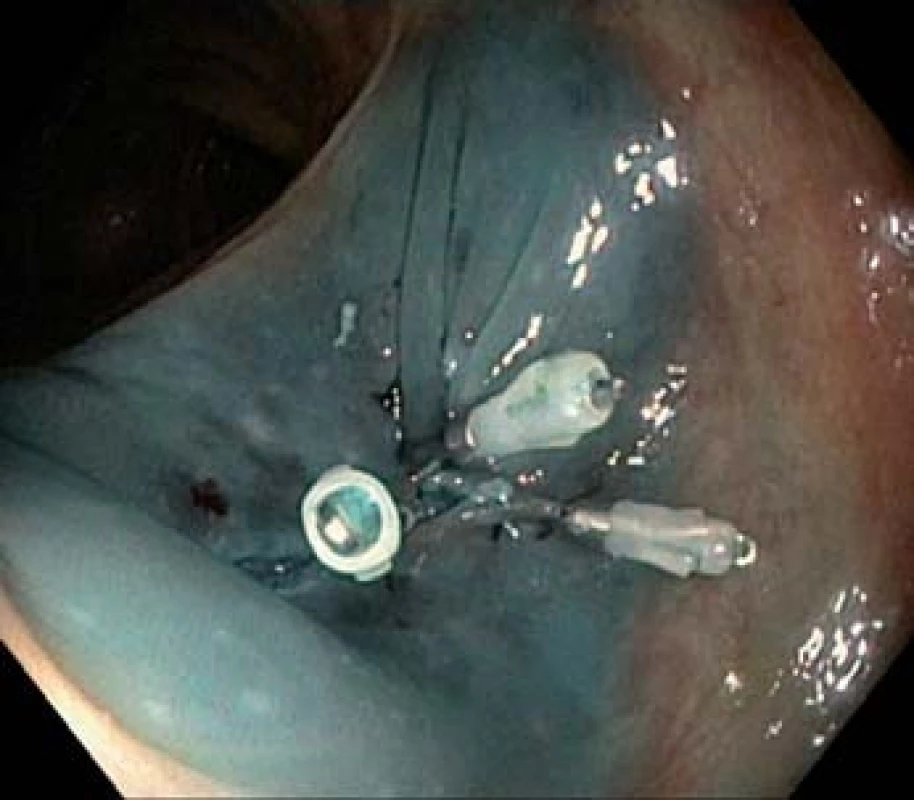
Image 5. Cirkulární stenozující karcinom ascendens. 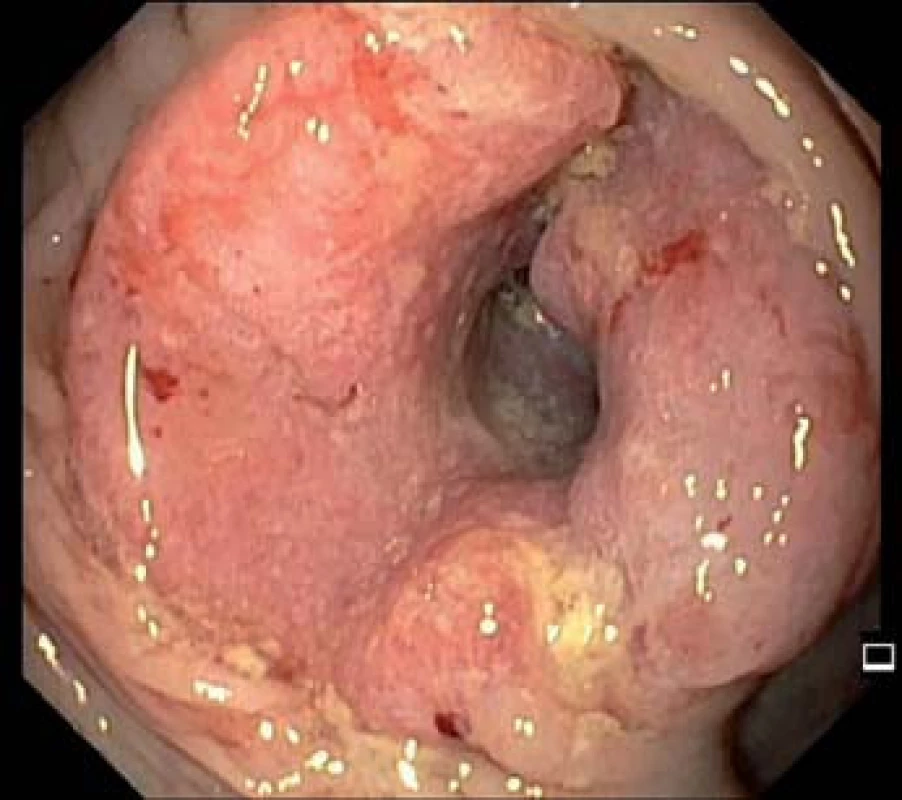
Table 2. Výsledky kolonoskopických vyšetření v ČR dle indikace. 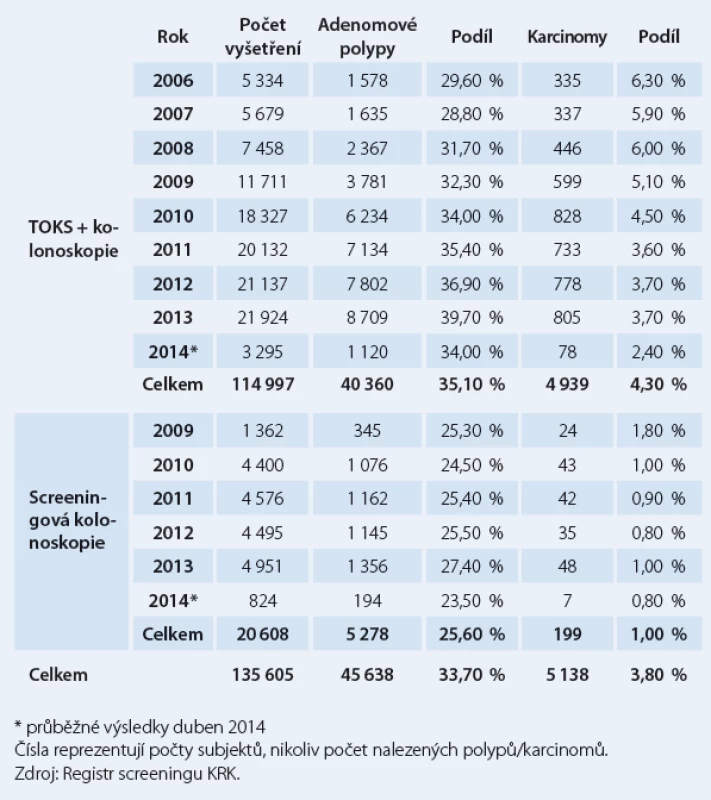
Vliv screeningového programu na populační data je pro relativně nízkou účast cílové populace sporný. Incidence KRK stále mírně stoupá (vliv stárnoucí populace) a mortalita na KRK má mírně klesající trend, který může ovlivňovat screening, ale i dostupnější a kvalitnější léčba. Dalším indikátorem dlouhodobého dopadu screeningového programu je záchyt časných stadií KRK. Podíl klinického stadia I v době stanovení diagnózy za poslední dekádu vzrostl z 19 % na 25 % všech diagnostikovaných KRK známého stadia. Zde lze připustit příznivý vliv screeningu.
Hodnocení kvality kolonoskopie
Sledování indikátorů kvality kolonoskopie, jakými jsou již zmíněný adenoma detection rate (ADR), procento kompletních kolonoskopií (caecal intubation rate, CIR), čas extrakce přístroje a stupeň střevní přípravy, je základním nástrojem ke zlepšení kvality prováděných kolonoskopií. Dalším důležitým parametrem je podíl komplikací terapeutických kolonoskopií. V letech 2006 – 2013 byla endoskopická polypektomie (EPE) provedená v rámci programu screeningu KRK komplikována krvácením v 0,73 % případů. Perforace se vyskytuje u 0,04 – 2,1 % všech terapeutických výkonů a byla zaznamenána u 0,12 % EPE provedených v rámci screeningového programu v ČR. Dle těchto ukazatelů je kvalita screeningové kolonoskopie v ČR na vysoké úrovni.
Dispenzární kolonoskopie
Po absolvování screeningové kolonoskopie jsou jedinci bez záchytu kolorektální neoplázie či s 1 – 2 drobnými nízkorizikovými adenomovými polypy navráceni do screeningového programu. Ostatní, pro riziko vzniku další kolorektální neoplázie, podstupují dispenzární kolonoskopii (schema 1). Pravděpodobnost záchytu pokročilého adenomu či karcinomu při kontrolní kolonoskopii záleží na kvalitě prvotní (bazální) kolonoskopie (stupeň střevní přípravy, dosažení céka, doba vytahování přístroje), počtu a charakteru odstraněných polypů (velikost, stupeň neoplázie, histologický charakter) a rizikových faktorech nemocného (věk, rodinná a osobní anamnéza) [15].
Schema 1. Dispenzarizace po odstranění adenomového polypu. Adaptováno z Atkin W et al [15]. ![Schema 1. Dispenzarizace po odstranění adenomového polypu. Adaptováno z Atkin W et al [15].](https://pl-master.mdcdn.cz/media/image/7b7c78116b24238c318762b20e0c5073.jpg?version=1537794771)
Závěr
Kolorektální karcinom je závažné nádorové onemocnění, které však lze ovlivnit jak primární, tak sekundární prevencí. Podmínkou efektivního screeningového programu je mj. pravidelné hodnocení kvality programu a vysoká účast cílové populace. Vliv recentně zavedeného institutu adresného zvaní na demografické ukazatele budeme moci hodnotit až s odstupem let.
Podpořeno grantem IGA MZ: NT 13673.
Doručeno do redakce: 15. 5. 2014
Přijato po recenzi: 13. 6. 2014
MUDr. Gabriela Vojtěchová
www.uvn.cz
gabriela.vojtechova@uvn.cz
Sources
1. Dušek L, Abrahámová J, Bortlíček Z et al. Epidemiologie, prevence a léčba kolorektálního karcinomu dle dostupných českých a mezinárodních dat. Praha: FN v Motole 2012.
2. Chan AT, Giovannucci EL. Primary prevention of colorectal cancer. Gastroenterology 2010; 138 : 2029 – 2043. doi: 10.1053/ j.gastro.2010.01.057.
3. Shoelson SE, Herrero L, Naaz A. Obesity, inflammation, and insulin resistance. Gastroenterology 2007; 132 : 2169 – 2180.
4. Larsson SC, Orsini N, Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta‑analysis. J Natl Cancer Inst 2005; 97 : 1679 – 1687.
5. Will JC, Galuska DA, Vinicor F et al. Colorectal cancer: Another complication of diabetes mellitus? Am J Epidemiol 1998; 147 : 816 – 825.
6. Heresbach D, Manfredi S, D'halluin PN et al. Review in depth and meta‑analysis of controlled trials on colorectal cancer screening by faecal occult blood test. Eur J Gastroenterol Hepatol 2006; 18 : 427 – 433.
7. Seeff LC, Nadel MR, Klabunde CN et al. Patterns and predictors of colorectal cancer test use in the adult U. S. population. Cancer 2004; 100 : 2093 – 2103.
8. Vepřeková G, Suchánek Š, Martínek J et al. Příprava střeva ke kolonoskopii. Gastroent Hepatol 2012; 66 : 57 – 62.
9. Wexner SD, Beck DE, Baron TH et al. A consensus document on bowel preparation before colonoscopy: prepared by a task force from the American Society of Colon and Rectal Surgeons (ASCRS), the American Society for Gastrointestinal Endoscopy (ASGE), and the Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Surg Endosc 2006; 20 : 1147 – 1160.
10. Church JM. Effectiveness of polyethylene glycol antegrade gut lavage bowel preparation for colonoscopy ‑ timing is the key! Dis Colon Rectum 1998; 41 : 1223 – 1225.
11. Hendry PO, Jenkins JT, Diament RH. The impact of poor bowel preparation on colonoscopy: a prospective single centre study of 10 571 colonoscopies. Colorectal Dis 2007; 9 : 745 – 748.
12. Suchanek S, Majek O, Vojtechova G et al. Colorectal cancer prevention in the Czech Republic: time trends in performance indicators and current situation after 10 years of screening. Eur J Cancer Prev 2014; 23 : 18–26. doi: 10.1097/CEJ.0b013e328364f203.
13. Zavoral M, Suchanek S, Majek O et al. Colorectal cancer screening: 20 years of development and recent progress. World J Gastroenterol 2014; 20 : 3825–3834. doi: 10.3748/wjg.v20.i14.3825.
14. Kaminski MF, Regula J, Kraszewska E et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362 : 1795 – 1803. doi: 10.1056/ NEJMoa0907667.
15. Atkin WS, Valori R, Kuipers EJ et al. European guidelines for quality assurance in colorectal cancer screening and diagnosis. First Edition ‑ Colonoscopic surveillance following adenoma removal. In: Segnan N, Patnick J, von Karsa L. (EDS) European Union 2010 : 274 – 297. doi: 10.2772/ 1458.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 3-
All articles in this issue
- Dráždivý tračník – diagnostika a léčba
- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Screening kolorektálního karcinomu
- Idiopatické střevní záněty
- Chronická pankreatitida
- Léčba akutního srdečního selhání
- Pravidelné supraventrikulární tachykardie – diagnóza, léčba a zkušenosti vysokoobjemového kardiocentra
- Moderní trendy v léčbě dlouhodobé perzistující fibrilace síní
- Standardizace ošetřovatelské péče k dekanylaci sheathu na intervenčních pracovištích v České republice
- Perorální endoskopická myotomie (POEM) – nová endoskopická možnost léčby achalázie jícnu
- Refluxní nemoc jícnu
- Léčba inhibitory protonové pumpy
- Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Dráždivý tračník – diagnostika a léčba
- Chronická pankreatitida
- Léčba inhibitory protonové pumpy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

