-
Medical journals
- Career
Léčba akutního srdečního selhání
Authors: J. Špinar 1; J. Pařenica 1; L. Špinarová 2; J. Vítovec 2
Authors‘ workplace: Interní kardiologická klinika LF MU a FN Brno 1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 2
Published in: Kardiol Rev Int Med 2014, 16(3): 171-177
Category: Cardiology Review
Overview
Léčba akutního srdečního selhání je náročná a hospitalizační mortalita zůstává vysoká – až 10 %. Základem jsou stále diuretika, především kličková, a léčba komplikací, jako jsou infekce, léčba diabetes mellitus a další. Další medikaci můžeme obecně rozdělit na vazodilatační léky a pozitivně inotropní léky. Vazodilatační léky jsou vhodné především u nemocných s TKs > 100 mm Hg, lépe více než 115 mm Hg, a používají se nitráty a nitroprusid sodný. Nesiritid neprokázal snížení mortality a ve výzkumu je ularitid a serelaxin. Z pozitivně inotropních léků se užívá dopamin, dobutamin a inhibitory fosfodiesterázy 5, ani jedna léková skupina ale nemá průkaz na snížení mortality ve velké klinické mortalitní studii. Slibný se jeví omecantiv mecarbil, ale první mortalitní studie ATOMIC taktéž neprokázala snížení mortality. Levosimendan je zástupce kalciových senzitizerů, se kterým bylo provedeno několik velkých klinických studií s neutrálním či mírně pozitivním výsledkem. Objevují se i první informace o možnosti opakovaného podání levosimendanu. Součástí léčby je samozřejmě i analgosedace, antiagregační a antikoagulační léčba, kyslík a nefarmakologické postupy.
Klíčová slova:
akutní srdeční selhání – diuretika – vazodilatancia – inotropika – levosimendanLéčbu akutního srdečního selhání můžeme rozdělit na [1 – 3]:
- všeobecná doporučení,
- farmakologická léčba,
- nefarmakologická léčba (chirurgická a přístrojová).
Všeobecná doporučení
Pacienti s akutním srdečním selháním mají sklon k infekčním komplikacím. Nejčastěji se setkáváme s respiračními infekcemi, infekcemi močových cest, sepsí a nozokomiálními nákazami. Z diagnostiky je nejdůležitější záchyt agens z hemokultur, případně ze sputa či moči, a rychlé zahájení antibiotické léčby dle citlivosti. Kontrola stavu pomocí CRP je nezbytná.
Akutní srdeční selhání bývá doprovázeno poruchou metabolizmu, nejčastěji je pozorována hyperglykemie (dále poruchy iontů jako hyponatremie, hypo ‑ i hyperkalemie atd.). Perorální hypoglykemická medikace (perorální antidiabetika) vysazujeme a zahajujeme léčbu krátkodobě působícím inzulinem, nejlépe v kontinuální nitrožilní infuzi. Dávky opatrně titrujeme k dosažení cílových glykemií pod 6,0 mmol/ l. Glykemii je třeba stanovovat často, obvykle po 2 – 4 hodinách. Normoglykemie je spojena s lepší prognózou i u akutního srdečního selhání, jasné důkazy na toto ale nemáme a často se spokojíme s glykemií do 10 mmol/ l.
Nemocní se často dostávají do katabolického stavu, mají negativní kalorickou a negativní dusíkatou bilanci. Příčinou je nedostatečný příjem kalorií, částečně i vlivem nedostatečné resorpce ze střeva. K monitoraci nutričního stavu je vhodné pravidelné stanovování plazmatické hladiny albuminu, prealbuminu, cholinesterázy a dusíkatých látek. Monitorace renálních funkcí je naprostou samozřejmostí včetně přesného měření diurézy. Pro odhad renálních funkcí je plně dostačující výpočet např. Cocroft Gaulta či MDRD [4]. Zamora et al v roce 2012 doporučili pro akutní srdeční selhání především vzorec podle Cocroft Gaulta [5]. V našem registru AHEAD se jako kritická jevila hodnota kreatininu 130 mmol/ l (graf 1) [6]. Zachování prokrvení ledvin a diurézy je základním předpokladem úspěchu léčby. Při rozvoji akutního selhání ledvin je třeba včas indikovat hemoeliminační metodu podle obvyklých indikací.
Saturace kyslíku (SaO2) by měla být v mezích normy, tedy 95 – 98 %, což zabezpečuje dostatečnou dodávku kyslíku do tkání a zabraňuje multiorgánovému poškození. Podávání kyslíku je všeobecně doporučováno, avšak důkazy z velkých klinických studií chybí. V případě přetrvávající závažné hypoxemie je indikována tracheální intubace.
Umělá plicní ventilace (UPV) je soubor postupů, které podporují nebo do určité míry nahrazují činnost některých složek respiračního systému (plic, hrudní stěny a dýchacího svalstva) funkčně spojených s výměnou plynů v plicích. Hlavní cíle UPV v intenzívní péči jsou: podpora výměny plynů v plicích, zvýšení plicního objemu a snížení dechové práce.
Jako neinvazivní ventilaci označujeme každou podporu ventilace bez nutnosti invazivního zajištění dýchacích cest, tedy bez nutnosti tracheální intubace. Rozvoj této metody souvisí s rozvojem ventilace pozitivním přetlakem. V současné době jsou doporučovány u kardiogenního plicního edému dvě techniky neinvazivní ventilace – spontánní ventilace s kontinuálním pozitivním přetlakem v dýchacích cestách (continuous positive airway pressure – CPAP) a neinvazivní ventilace s pozitivní tlakovou podporou (noninvasive positive ‑ pressure ventilation – NIPPV). Oba režimy vyžadují dostatečnou spontánní ventilační aktivitu nemocných.
Farmakologická léčba
Mezi základní lékové skupiny v léčbě akutního srdečního selhání patří:
- diuretika,
- vazodilatancia,
- pozitivně inotropní látky,
- levosimendan (pozitivně inotropní látka s vazodilatačním a diuretickým účinkem),
- antiagregační a anitikoagulační látky,
- analgezie a sedace,
- další.
Na rozdíl od chronického srdečního selhání nejsou u akutního žádné velké mortalitní studie, proto je léčba založena především na klinických zkušenostech, empirii a ovlivnění tzv. náhradních cílů (zvýšení diurézy, pokles krevního tlaku, pokles tlaku v zaklínění atd.) [3,7]. Snaha o provedení větších mortalitních studií v minulosti vždy skončila neúspěchem. V současné době (rok 2014) probíhá několik velkých mortalitních studií především s vazodilatačními léky jako ularitid (TRUE HF) či serelaxin (RELAX) a pozitivně inotropními léky jako omecantiv mecarbil (COSMIC HF).
Diuretika
Diuretika jsou pro jasné klinické účinky v léčbě akutního srdečního selhání obecně akceptována a běžně používána. Proto nejsou k dispozici žádné randomizované studie o jejich vlivu na symptomatologii i prognózu. Podle klinických zkušeností však dochází u většiny případů po podání diuretik ke zmírnění obtíží a k ústupu známek městnání. Diuretika jsou indikována u pacientů s akutním srdečním selháním, kteří mají známky retence tekutin.
Objemové přetížení je u akutního srdečního selhání časté. Diuretika zvyšují exkreci vody i minerálů v renálních tubulech. Tím se zvyšuje objem moči a snižuje se objem plazmy a extracelulární tekutiny i celkové množství vody a sodíku v organizmu. Velmi důležité jsou však také hemodynamické účinky kličkových diuretik. Po podání furosemidu dochází k vazodilataci v žilním řečišti, klesají plnicí tlaky pravé i levé srdeční komory a snižuje se městnání v periferii i v malém oběhu. Dochází i ke snížení plicní cévní rezistence.
Z uvedených důvodů proto u většiny nemocných vede diuretická léčba k rychlé symptomatické úlevě, k ústupu dušnosti a otoků. Diuretika jsou méně vhodná u pacientů, kteří jsou dehydratováni, mají symptomatickou hypotenzi nebo jsou dokonce v kardiogenním šoku. Hypotenze navozená nadměrnou diurézou může vést k progresi ischemie myokardu u nemocných s akutní koronární příhodou.
Vysoké dávky diuretik u chronického srdečního selhání mohou negativně ovlivňovat prognózu navozením přílišné neurohumorální aktivace a zvýšením rizika hypokalemie a arytmií. Zlepšení hemodynamických parametrů po podání diuretik u akutního srdečního selhání může naopak způsobit snížení nadměrné neurohumorální reakce. Oslabení diuretické odpovědi a potřeba zvyšujících se dávek má negativní prognostický význam.
Intravenózní podání furosemidu je preferováno v léčbě akutního srdečního selhání pro jeho rychlý a silný klinický účinek. Nemocní s akutní dekompenzací chronického srdečního selhání vyžadují kvůli aktivaci renálních kompenzačních mechanizmů obvykle značně vyšší dávky furosemidu. Kontinuální infuze furosemidu v dávce 5 – 20 mg/ hod může mít větší efekt než bolusové podání. Klinické studie ukazují, že při kontinuální infuzi je potřeba menší dávky furosemidu než při bolusovém podání. Kombinace nižších dávek různých diuretik je často účinnější a přitom bezpečnější než vysoké dávky jednoho léku. Výhodná je zejména kombinace furosemidu s thiazidovými diuretiky nebo se spironolaktonem. Vyššího diuretického efektu s menším výskytem nežádoucích účinků je možno dosáhnout při kombinaci diuretické léčby s nitráty či dopaminem nebo dobutaminem.
Kličková diuretika – souhrn
Mechanizmus účinku
- inhibice Na+/ K+/ 2Cl ‑ transportu na Henleho kličce
- Klinický prospěch
- rychlá úprava symptomů
- snížení objemového přetížení
Klinické nevýhody
- zvýšení neurohumorální aktivity
- elektrolytová dysbalance a/ nebo arytmie
- zhoršení renálních funkcí
Vazodilatační léčba
Vazodilatační léčba je u většiny nemocných s akutním srdečním selháním indikována jako léčba první volby, používají se nitráty, nitroprusid sodný a natriuretické peptidy.
Nitráty ovlivňují příznivě projevy plicního městnání. Charakteristickým hemodynamickým účinkem je pokles tlaku v malém oběhu beze změny srdečního výdeje. Spotřeba kyslíku v myokardu ani riziko poruch rytmu se nezvyšuje. V nízkých dávkách převládá dilatace žilní, se zvyšující se dávkou nitrátu dochází k rozšíření tepen včetně tepen koronárních. U akutního plicního edému se nitráty (isosorbide dinitrate) ukázaly účinnější než furosemid. Nejčastějším vedlejším účinkem je bolest hlavy a hypotenze, při kontinuálním podávání je nutné počítat s rozvojem tolerance, zvláště u vyšších dávek. Po 16 – 24 hodinách je již efekt léčby výrazně oslaben.
Nitráty je možné podávat perorálně nebo inhalačně, u plicního edému je však nejúčinnější aplikace intravenózní. Doporučená dávka nitroglycerinu je 20 – 200 µg/ kg/ min, isosorbid dinitrátu 1 – 10 mg/ hod. Titrace dávky za kontrol krevního tlaku je nezbytná.
Nitroprusid sodný je indikován především u levostranného selhání při hypertenzi. Aplikuje se formou kontinuální infuze, dávka se titruje od 0,3 µg/ kg/ min do 5 µg/ kg/ min. Podání nitroprusidu sodného vyžaduje pečlivou, často invazivní monitoraci krevního tlaku. Infuzi je nutno omezit na nezbytně nutnou dobu, neboť prodloužené podávání může být spojeno s tvorbou toxických metabolitů, zvláště u nemocných s renálním a jaterním postižením. U akutních koronárních syndromů je nitroprusid sodný nevhodný pro riziko steal fenoménu, v této indikaci je nutno dát přednost podávání nitrátů.
Nitráty – souhrn
Mechanizmus účinku
- cGMP zprostředkovaná veno a arterio dilatace
- Klinický prospěch
- snížení tlaku v zaklínění (PCWP)
- rychlé klinické zlepšení
Klinické nevýhody
- minimální přímý účinek na srdeční výdej
- hypotenze, bolesti hlavy
- tolerance, tachyphylaxe
- nutnost invazivní monitorace
Natriuretické peptidy (nesiritide, ularitide) nejsou v České republice registrovány. Nesiritid je rekombinantní lidský natriuretický peptid (BNP), který působí cestou cyklického guanosinfosfátu výraznou vazodilataci, natriurézu a diurézu (obr. 1). Studie ASCEND s nesiritidem neprokázala příznivý účinek této látky a nesiritid není povolen v žádné zemi Evropské unie, je však často předepisován v USA. Studie s ularitidem probíhá (TRUE HF).
Image 1. Nesiritid – mechanizmus účinku. 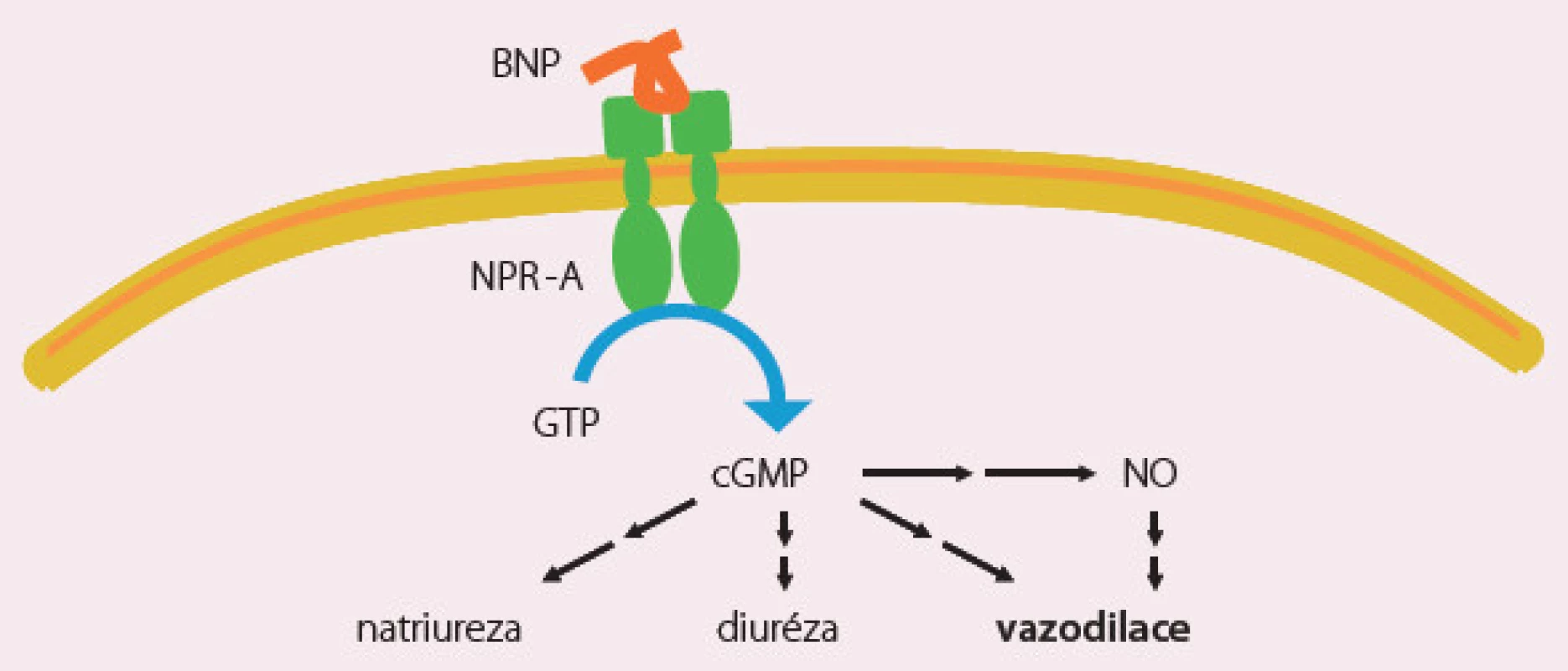
Pozitivně inotropní látky
Jako pozitivně inotropní léky označujeme látky, které zvyšují srdeční výdej zvětšením tepového objemu v důsledku posílení kontrakce myokardu. Mechanizmem účinku nejčastěji používaných léků – dopamin, dobutamin a milrinon – je zvýšení koncentrace nitrobuněčných vápníkových iontů v důsledku zvýšení hladin cyklického adenosinmonofosfátu (cAMP) buď zvýšením jeho produkce (agonisté β ‑ receptorů – dopamin, dobutamin), nebo inhibicí jeho degradace (inhibitory fosfodiesterázy III – milrinon). Výsledkem zvýšené nabídky vápníkových iontů troponinu C je posílená kontrakce srdečního svalu.
Indikací pozitivně inotropních léků je obecně přítomnost periferní hypoperfuze (systémová hypotenze, snížené renální funkce) s projevy městnání nebo plicního edému nebo bez nich a nedostatečná odpověď na vazodilatační a diuretickou léčbu. V závažných situacích pak může být nasazení pozitivně inotropních léků prospěšné a někdy život zachraňující. Je nutné si vždy uvědomit, že jejich nasazení může vést ke vzniku arytmií, ischemie myokardu, apoptóze kardiomyocytů, neurohormonální aktivaci a prohloubení energetické krize s důsledky na progresi myokardiální dysfunkce a ovlivnění dlouhodobé prognózy. Jejich aplikace by měla být vždy pečlivě zvážena a použita pouze k překlenutí kritického období.
Dopamin působí v nízkých dávkách (< 2 µg/ kg/ min) pouze na periferní dopaminergní receptory a k takto navozené vazodilataci dochází především ve splanchnické a renální oblasti. V těchto dávkách se používá nejčastěji právě ke zlepšení průtoku krve ledvinami s cílem zvýšit glomerulární filtraci, diurézu a vylučování sodíku u nemocných s počínající renální dysfunkcí. U nemocných v kritickém stavu bez srdečního selhání se však toto v randomizované studii nepotvrdilo, a proto použití nízkých dávek dopaminu s cílem léčby či prevence akutního selhávání ledvin u nemocných v kritickém stavu není oprávněné.
Ve středních dávkách (2 – 5 µg/ kg/ min) dopamin stimuluje přímo i nepřímo β‑adrenergní receptory s následným zvýšením kontraktility myokardu a srdečního výdeje. Ve vyšších dávkách (> 5 µg/ kg/ min) působí dopamin na alfaadrenergní receptory, což vede ke zvýšení periferního cévního odporu a indikací těchto dávek je pouze systémová hypotenze neřešitelná jiným postupem, neboť zároveň dochází i ke zvýšení plicního cévního odporu a dotížení levé komory.
Dobutamin je látka s pozitivně inotropním a chronotropním účinkem s následným reflexním poklesem sympatického tonu, a tím cévního odporu. Efekt je zprostředkován stimulací β1 a β2 receptorů a je na dávce závislý. Významnou roli hraje vápník a cyklický adenosinmonofosfát (obr. 2). V nižších dávkách převažuje efekt mírné arteriální vazodilatace a zvýšení tepového objemu snížením afterloadu, ve vyšších dávkách působí vazokonstrikci a zvýšení srdeční frekvence. Dobutamin je v současné době indikován při známkách nízkého srdečního výdeje s periferní hypoperfuzí a při normálních nebo zvýšených plnicích tlacích srdečních komor. Počáteční dávka kontinuální infuze je obvykle 2 – 3 µg/ kg/ min bez úvodního bolusu. Rychlost infuze je nutné rychle modifikovat dle reakce na léčbu, zejména ovlivnění symptomů, diuretickou a hemodynamickou odpověď. Dávky vyšší než 15 – 20 µg/ kg/ min jsou obvykle spojeny s tachykardií, a tím zvýšenou spotřebou kyslíku myokardem, a doporučují se pouze u nemocných léčených do té doby β‑blokátory. Trvání infuze s dobutaminem nad 48 hod je spojeno s tolerancí a částečnou ztrátou hemodynamického efektu. Doporučuje se postupné vysazování dobutaminu s ohledem na jeho rychlou eliminaci a při přechodu na perorální aplikaci léků je někdy nutné tolerovat přechodnou mírnou hypotenzi. Aplikace dobutaminu je spojena se zvýšeným výskytem jak síňových, tak komorových arytmií a pečlivá kontrola normálních hladin kalia je nezbytná. Retrospektivní metaanalýza studií s použitím dobutaminu u nemocných s ASS ukázala, že i akutní hemodynamické zlepšení nepřináší dlouhodobé ovlivnění mortality a tato léčba nemusí být bezpečná.
Image 2. Dobutamine – mechanizmus účinku. 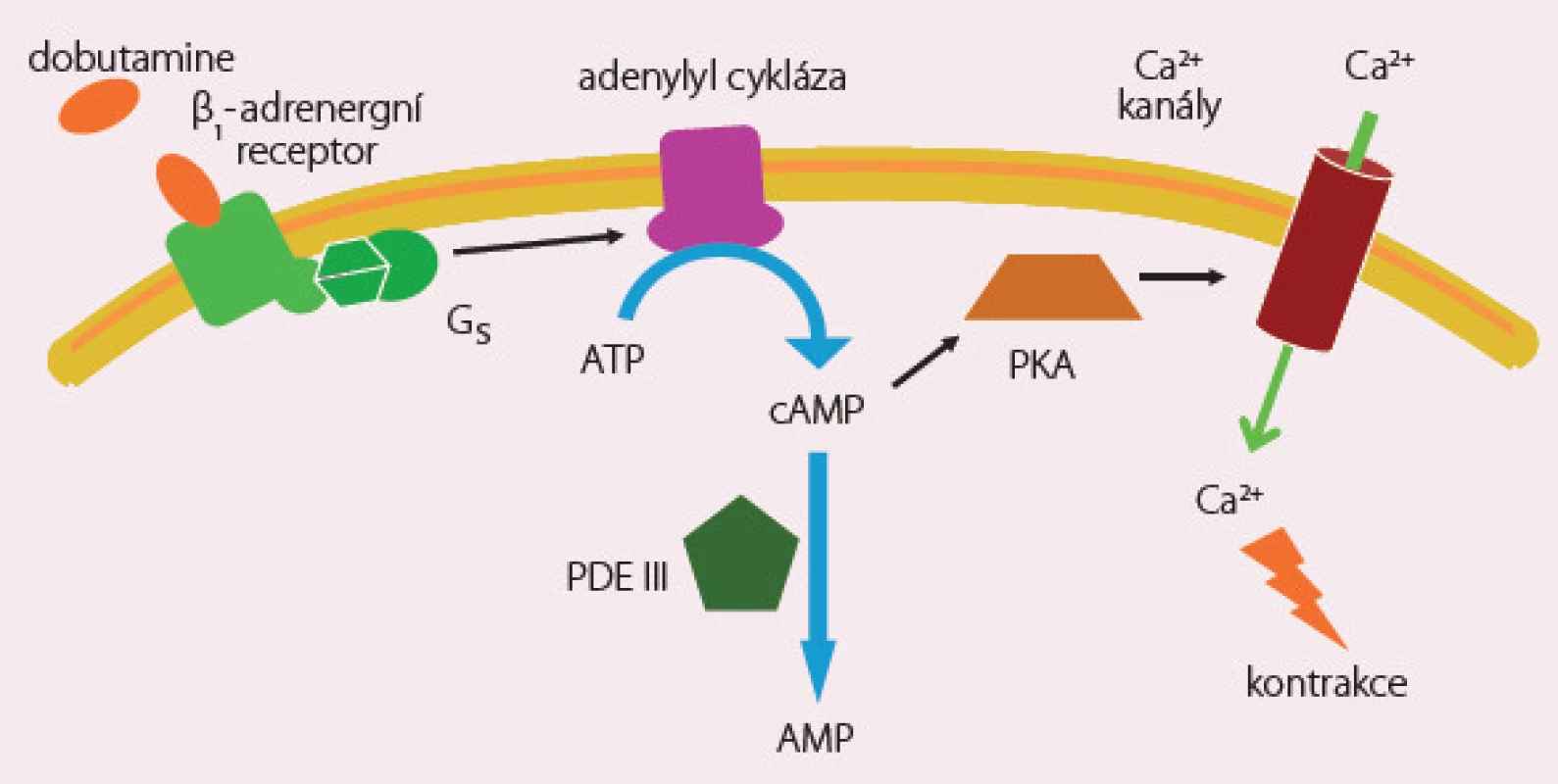
Adrenalin je katecholamin s vysokou afinitou k β1, β2 a alfa receptorům. Je používán obvykle v kontinuální infuzi v dávkách 0,05 – 0,5 µg/ kg/ min v případě nedostatečného efektu pozitivně inotropních léků (dobutamin) a přetrvávající významné systémové hypotenze. V těchto případech je doporučováno monitorovat arteriální krevní tlak přímou metodou a prospěšná jsou i další hemodynamická data k optimalizaci plnících tlaků srdečních oddílů a měření srdečního výdeje spolu s kalkulací cévních rezistencí. V praxi se adrenalin využívá nejčastěji při kardiopulmonální resuscitaci.
Noradrenalin je katecholamin s vysokou afinitou k alfa receptorům a jeho použití je indikováno u stavů s nutností zvýšit systémovou cévní rezistenci. Zvýšení srdeční frekvence je při obdobném ovlivnění cévní rezistence obvykle nižší než u adrenalinu, a proto bývá u uvedené indikace dávána přednost noradrenalinu. Dávky při kontinuální intravenózní infuzi jsou obvykle v rozmezí 0,2 – 1,0 µg/ kg/ min, ale výše aktuální dávky se řídí často podle odpovědi krevního tlaku na léčbu. Je upřednostňován u stavů s výrazně sníženou systémovou rezistencí, jako je např. septický šok. V důsledku vazokonstrikce může snížit perfuzi orgánů a jeho aplikace by měla být vždy omezena na nezbytně nutnou dobu. Může být kombinován s inhibitory fosfodiesterázy III (PDE III) nebo levosimendanem ke korekci systémového krevního tlaku při průkazu zvýšeného srdečního výdeje.
Inhibitory fosfodiesterázy III zabraňují odbourávání cAMP s následným zvýšením jeho hladiny (obr. 3). V klinické praxi jsou používány milrinon, amrinon a enoximon. Mají významný inotropní, lusitropní a periferní vazodilatační efekt vedoucí ke zvýšení tepového objemu a srdečního výdeje a současně ke snížení plnicích tlaků, tlaků v plicním i systémovém řečišti. Jejich plný účinek je zachován i u nemocných léčených β‑blokátory. Standardní dávkování milrinonu je podání bolusu 25 µg/ kg během 10 – 25 min s následnou kontinuální infuzí 0,375 – 0,75 µg/ kg/ min.
Image 3. Milrinon – mechanizmus účinku. 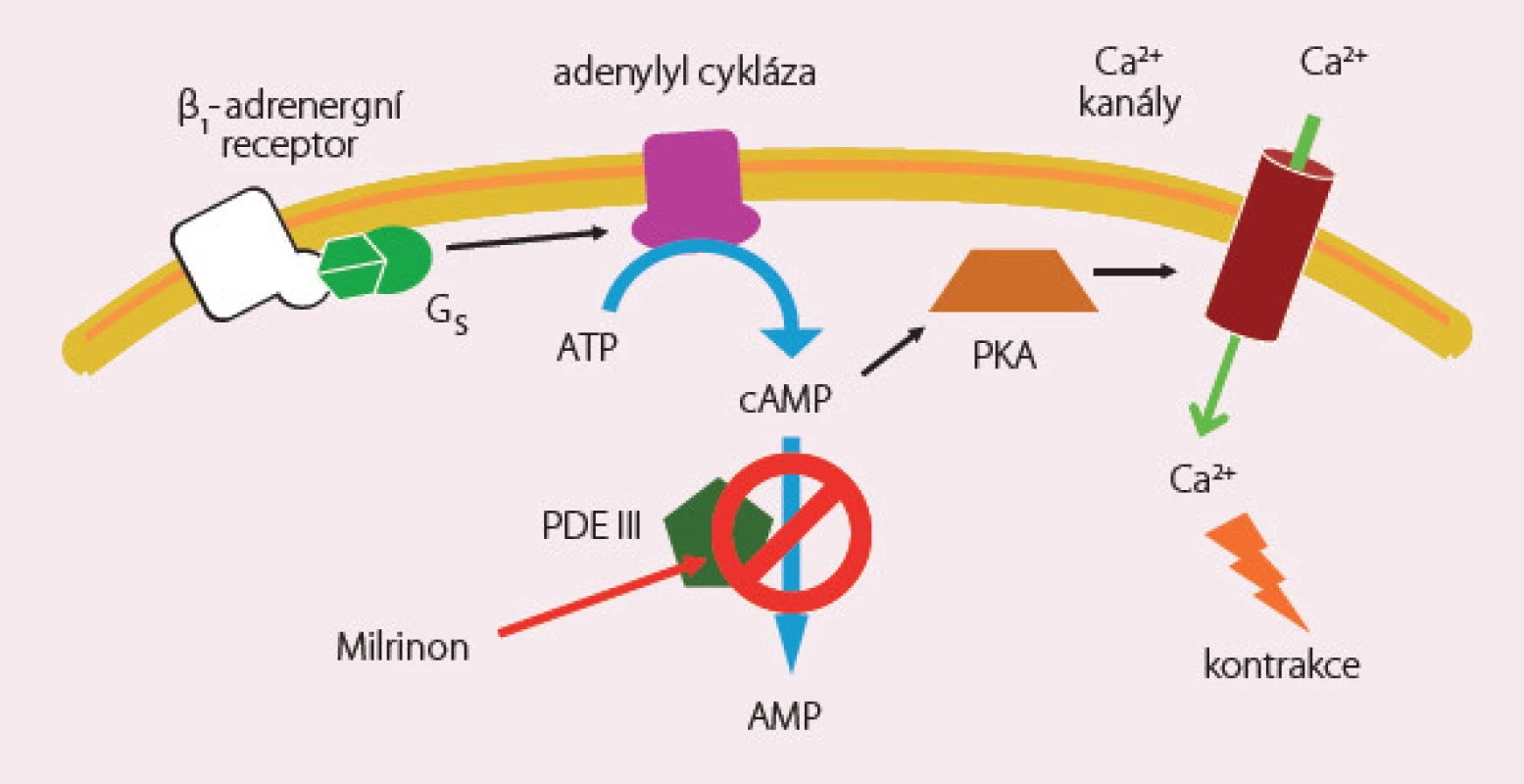
PDE ‑ III inhibitory jsou indikovány v případě průkazu periferní hypoperfuze, která je refrakterní na vazodilatační a diuretickou léčbu, a když není přítomna hypotenze. Ve výjimečných případech, kdy nasazení PDE ‑ III inhibitorů vede k průkaznému zvýšení srdečního výdeje a zároveň k poklesu systémového tlaku, lze toto korigovat malými dávkami noradrenalinu po nezbytně nutnou dobu.
Srdeční glykosidy inhibují myokardiální Na/ K ATP, a druhotně tak vedou ke zvýšení nitrobuněčného vápníku. U ASS produkují srdeční glykosidy slabý inotropní efekt i redukci plnicích tlaků. Při kombinaci ASS a fibrilace síní s rychlou komorovou odpovědí je digoxin doporučován, není‑li kontraindikace.
Pozitivně inotropní léky – souhrn
Mechanizmus účinku
- vápníkové kanály, cyklický adenosinmonofosfát
Klinický prospěch
- zvýšení srdečního výdeje
- snížení tlaku v zaklínění
- snížení vaskulární rezistence
- zlepšení hemodynamiky
Klinické nevýhody
- zvýšení arytmií
- zvýšení mortality při dlouhodobém podávání
- zvýšení spotřeby kyslíku
Senzitizéry vápníku (levosimendan)
Pozitivně inotropní účinek mají léky ze skupiny vápníkových (Ca2+) senzitizérů. Nezvyšují intracelulární koncentraci vápníku, ale zvyšují citlivost troponinu C (TnC) k vápníku. Po vytvoření komplexu Ca2+:TnC dochází k aktivaci troponinu I. Vazba léku je závislá na koncentraci vápníkových iontů, proto dochází k interakci s TnC pouze v době systoly a během diastoly lék nezhoršuje diastolickou funkci.
Některé léky z této skupiny (vesnarinon) byly opuštěny pro vzestup úmrtnosti. U levosimendanu zhoršení prognózy pozorováno nebylo a je zaveden pro akutní srdeční selhání. Levosimendan je jediným vápníkovým senzibilizátorem užívaným v Evropě i u nás k léčbě akutního srdečního selhání či chronického, akutně dekompenzovaného selhání. Vazbou na TnC významně stabilizuje komplex Ca2+:TnC, a patří tak do skupiny senzibilizátorů I. třídy. Tímto mechanizmem je vysvětlován inotropní efekt. Levosimendan nezvyšuje intracelulární hladinu cAMP, a tudíž ani spotřebu kyslíku myokardem. Významný je vazodilatační účinek levosimendanu, který je zprostředkován otevřením draslíkového kanálu (KATP) v hladké svalovině cévní stěny, v klinické praxi může vést k hypotenzi. Při vyšších koncentracích může působit i jako inhibitor fosfodiesterázy (PDE). Klinický efekt levosimendanu byl dokumentován v řadě rozsáhlých klinických studií. Studie LIDO srovnávala především hemodynamický efekt levosimendanu v dávce 0,1 – 0,2 µ/ kg/ min s dobutaminem. Primárního hemodynamického end‑pointu (vzestup srdečního výdeje o 30 % a pokles tlaku v zaklínění v plicnici – PCWP o 15 %) bylo dosaženo častěji ve skupině léčené levosimendanem (28 % vs 15 %; p = 0,022). Zároveň byl sledován trend k nižší 180denní mortalitě při terapii levosimendanem ve srovnání s dobutaminem. Studie RUSSLAN srovnávala léčbu různými dávkami levosimendanu oproti placebu u nemocných s akutním srdečním infarktem komplikovaným srdečním selháním. Studie naznačila bezpečnost a účinnost užití levosimendanu u pacientů s akutním srdečním selháním (graf 2) [8]. Studie CASINO, která srovnávala účinnost a bezpečnost levosimendanu s dobutaminem a placebem ve skupině pacientů s akutní dekompenzací srdečního selhání a EF < 35 %, byla předčasně zastavena pro nižší mortalitu pacientů léčených levosimendanem. Bohužel pro předčasné ukončení nedosáhly výsledky studie statistické významnosti a nikdy nebyly publikovány. Studie REVIVE I + II prokázala lepší efekt levosimendanu ve srovnání s placebem na zlepšení klinického stavu, podání levosimendanu však bylo provázeno častější hypotenzí a arytmiemi a nesignifikantně vyšší mortalitou po 90 dnech. Určitým zklamáním byly výsledky mortalitní studie SURVIVE, která srovnávala léčbu levosimendanu s dobutaminem ve skupině pacientů hospitalizovaných pro akutní dekompenzaci srdečního selhání. Přestože léčba založená na levosimendanu vedla k významnějšímu poklesu BNP za 24 hod, který přetrvával pět dnů, nebyl prokázán pokles 180denní mortality ani dalších klinických end‑pointů (graf 3) [9]. Subanalýza studie SURVIVE prokázala možnou výhodu levosimendanu oproti dobutaminu u pacientů léčených β‑blokátory a u pacientů s akutní dekompenzací předchozího chronického srdečního selhání oproti pacientům s de ‑ novo akutním srdečním selháním. Recentně provedená nezávislá metaanalýza randomizovaných studií naznačila pozitivní efekt na snížení mortality ve srovnání s placebem i dobutaminem.
Graph 2. RUSSLAN – celková mortalita. 
Graph 3. SURVIVE – celková mortalita. 
Klinický a hemodynamický efekt levosimendanu ukazuje tab. 1.
Table 1. Klinický a hemodynamický efekt levosimendanu. 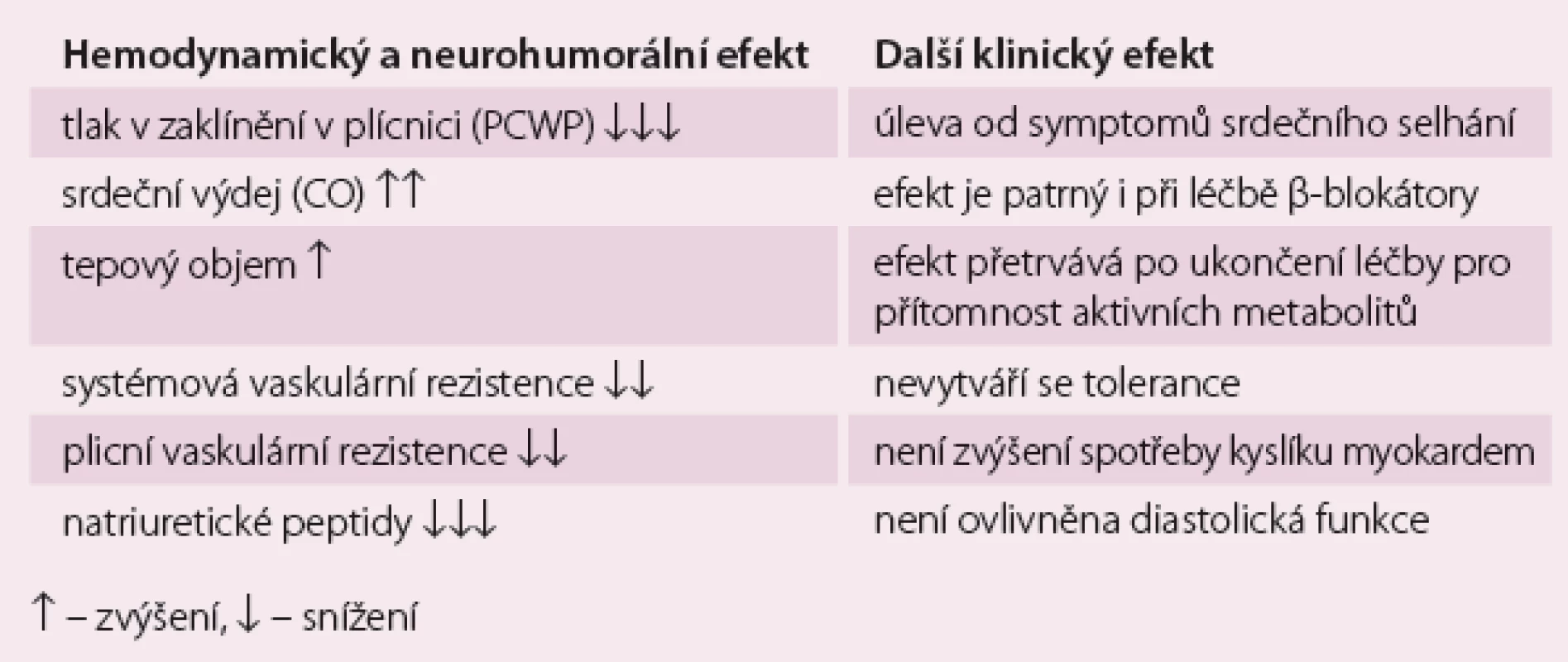
Současné indikace levosimendanu:
- u akutního srdečního selhání u nemocného se známým chronickým srdečním selháním a/ nebo dysfunkcí levé komory,
- výhodné je, pokud je nemocný „předléčen“ β‑blokátory, které nevysazujeme, můžeme ale snížit jejich dávku,
- u srdečního selhání se sníženou systolickou a/ nebo diastolickou funkcí.
Hlavní kontraindikace levosimendanu:
- u nemocných s TKs < 100 mm Hg je třeba podávat velmi opatrně a bez bonusu,
- u nemocných s renální insuficiencí (kreatinin > 150 umol/ l) je třeba podávat levosimendan opatrně a redukovat dávky.
Bolus levosimendanu není v současné době doporučován. Infuze podáváme v dávce 0,05 – 0,1 µg/ kg/ min po dobu 24 hod až několik dnů. Nejčastější komplikace jsou arytmie – především fibrilace síní a hypotenze. Již jsou zkušenosti s opakovaným podáním levosimendanu, jasná doporučení však nemáme. Levosimendan je široce užíván v Evropě a není schválen v USA.
Dávkování pozitivně inotropních látek ukazuje tab. 2.
Table 2. Dávkování pozitivně inotropních látek. 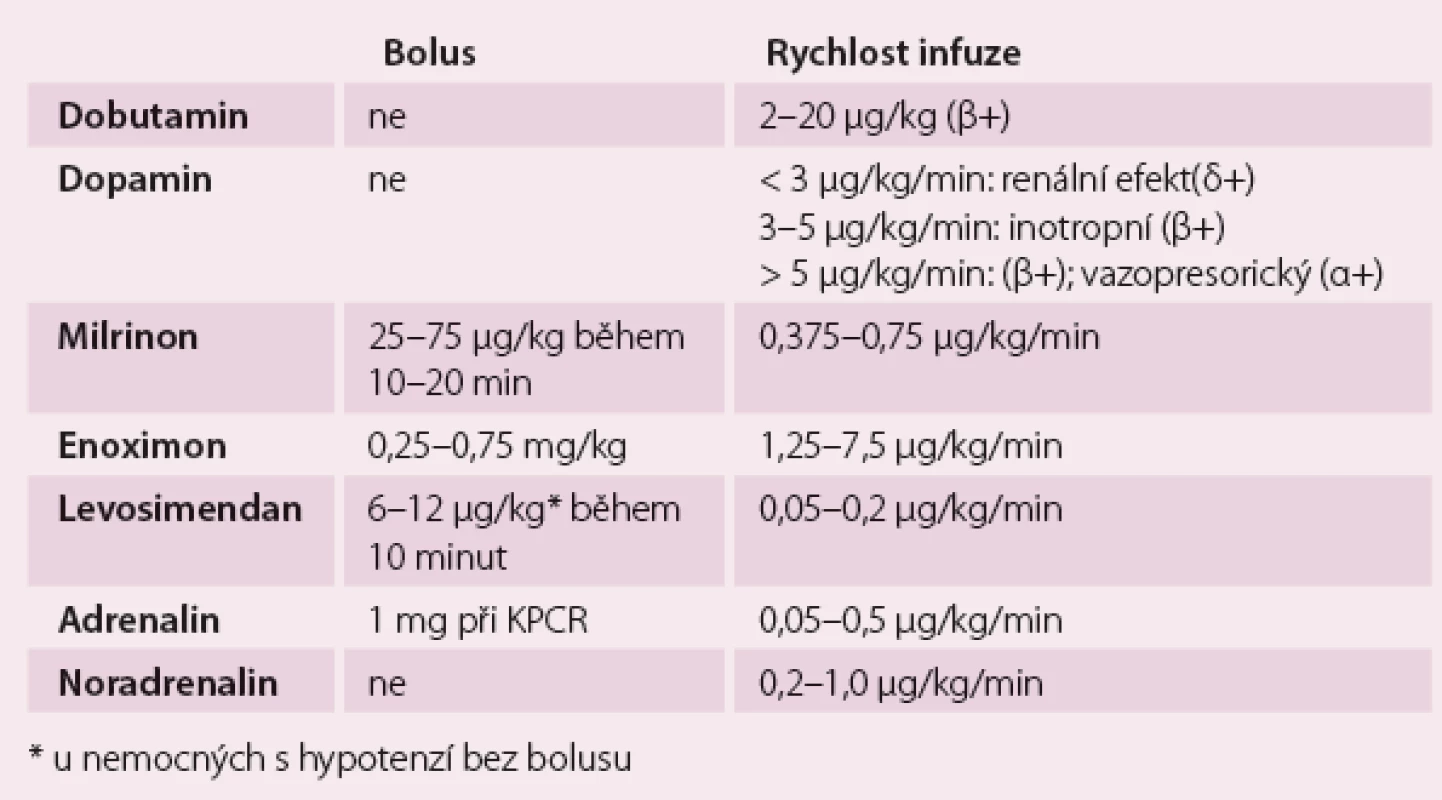
Antiagregační a antikoagulační léčba
Antiagregační léčba u akutního srdečního selhání při akutním koronárním syndromu se řídí zásadami léčby akutního koronárního syndromu. Léčba nízkomolekulárním heparinem vede k redukci výskytu tromboembolických komplikací u akutně nemocných interních pacientů. Nejsou k dispozici žádné randomizované studie srovnávající nefrakcionovaný heparin s nízkomolekulárními hepariny u akutního srdečního selhání.
Antikoagulační terapie je indikována, dojde‑li k akutnímu srdečnímu selhání na podkladě plicní embolie, chlopenní vady nebo je‑li přítomna fibrilace síní. Zkušenosti s novými antikoagulancii jako dabigatran, rivaroxaban nebo apixaban nejsou. Rivaroxaban je schválen u plicní embolie.
Užití trombolýzy je dnes již prakticky jen u plicní embolie.
U řady pacientů je srdeční selhání spojeno s poruchou funkce jater, která může vést k hypokoagulačnímu stavu. Proto je kontrola koagulačních parametrů standardní součástí laboratorního vyšetření.
Analgezie a sedace
Morfin je doporučován nemocným v kritickém stavu s akutním srdečním selháním a těžkým nedostatkem dechu. Morfin způsobuje venodilataci, mírnou arteriodilataci a snižuje tepovou frekvenci. Morfin podáváme až po zajištění nemocného venózní linkou a dávka může být opakována.
Zklidnění a relaxace pacienta s akutním srdečním selháním je nedílnou součástí léčby, především u nemocných s umělou plicní ventilací.
Další léčba
Podávání dalších léků, především ACE inhibitorů, β‑blokátorů, antiarytmik a dalších, jsou uvedena v národních i evropských doporučeních.
ACE inhibitory nepatří mezi léky volby pro léčbu ASS, nasazujeme je však co nejdříve po stabilizaci stavu. U akutní dekompenzace chronického srdečního selhání se snažíme tuto medikaci zachovat (doporučuje se přechodně snížit dávky) popřípadě zahájit po kompenzaci stavu.
Akutní srdeční selhání je považováno za kontraindikaci podání β‑blokátorů. β‑blokátory byly opakovaně testovány u akutního infarktu myokardu, nález chrůpků na plicích nebo hypotenze však byly vylučovacím kritériem pro zařazení nemocného. Výjimkou může být ASS s tachykardií, např. tachyfibrilací síní. β‑blokátory nasazujeme co nejdříve po kompenzaci stavu v malé dávce s postupnou titrací.
Poděkování
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno) a European Regional Development Fund – Project FNUSA ‑ ICRC (No. CZ.1.05/ 1.1.00/ 02.0123).
Doručeno do redakce: 1. 6. 2014
Přijato po recenzi: 16. 6. 2014
prof. MUDr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
jspinar@fnbrno.cz
Sources
1. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787 – 1847. doi: 10.1093/ eurheartj/ ehs104.
2. Nieminen MS, Boehm M, Cowie MR et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J 2005; 26 : 383 – 416.
3. Špinar J, Janský P, Kettner J et al. Doporučení pro diagnostiku a léčbu akutního srdečního selhání. Cor et Vasa 2006; 48: K3 – K31.
4. Špinar J, Vítovec J, Hradec J. Co je nového v evropských doporučeních pro diagnostiku a léčbu srdečního selhání. Kardiol Rev 2012; 14 : 211 – 212.
5. Zamora E, Lupón J, Vila J et al. Estimated glomerular filtration rate and prognosis in heart failure: Value of the Modification of Diet in Renal Disease study ‑ 4, Chronic Kidney Disease Epidemiology Collaboration, and Cockroft ‑ Gault formulas. J Am Coll Cardiol 2012; 59 : 1709 – 1715. doi: 10.1016/ j.jacc.2011.11.066.
6. Spinar J, Parenica J, Vitovec J et al. Baseline characteristics and hospital mortality in the Acute Heart Failure Database (AHEAD) Main registry. Crit Care 2011; 15: R291. doi: 10.1186/ cc10584.
7. Špinar J, Vítovec J, Hradec J et al. Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011. Cor Vasa 2012; 54 : 161 – 182
8. Moiseyev VS, Põder P, Andrejevs N et al. RUSSLAN Study Investigators. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo ‑ controlled, double‑blind study (RUSSLAN). Eur Heart J 2002; 23 : 1422 – 1432.
9. Mebazaa A, Nieminen MS, Packer M et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE Randomized Trial. JAMA 2007; 297 : 1883 – 1891.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 3-
All articles in this issue
- Dráždivý tračník – diagnostika a léčba
- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Screening kolorektálního karcinomu
- Idiopatické střevní záněty
- Chronická pankreatitida
- Léčba akutního srdečního selhání
- Pravidelné supraventrikulární tachykardie – diagnóza, léčba a zkušenosti vysokoobjemového kardiocentra
- Moderní trendy v léčbě dlouhodobé perzistující fibrilace síní
- Standardizace ošetřovatelské péče k dekanylaci sheathu na intervenčních pracovištích v České republice
- Perorální endoskopická myotomie (POEM) – nová endoskopická možnost léčby achalázie jícnu
- Refluxní nemoc jícnu
- Léčba inhibitory protonové pumpy
- Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Dráždivý tračník – diagnostika a léčba
- Chronická pankreatitida
- Léčba inhibitory protonové pumpy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


