-
Medical journals
- Career
Náhlá smrt v kardiologii
Authors: L. Křivan
Published in: Kardiol Rev Int Med 2012, 14(3): 176-181
Category:
Overview
I přes pokroky v diagnostice a léčbě srdečních onemocnění zůstává náhlá smrt stále aktuálním problémem. Implantabilní kardiovertery-defibrilátory (ICD) jsou v prevenci náhlé smrti úspěšně užívány již třetí dekádu. Za posledních deset let však došlo k významnému obratu. Počty sekundárně preventivních implantací ICD jsou téměř stabilní, zatímco počty nositelů ICD z primárně preventivních důvodů stále rostou. Se zvětšujícím se procentem populace indikovaným k implantaci klesá efektivita a roste nákladnost léčby ICD. Sdělení shrnuje indikace k implantaci ICD v kontextu velkých multicentrických studií a snaží se definovat profil pacientů, kteří z ICD implantace neprofitují, přestože splňují kritéria primární prevence.
Klíčová slova:
implantabilní kardioverter-defibrilátor – náhlá srdeční smrt – chronické srdeční selhání – primárně preventivní implantace ICDÚvod
Náhlá srdeční smrt je v Evropě odpovědná za zhruba 2 500 úmrtí denně. I když je nejčastější u pacientů s organickým onemocněním srdce, je individuálně nepředvídatelná. Hlavním mechanizmem náhlého úmrtí jsou maligní arytmie. Téměř 3/4 náhlých úmrtí nastávají doma a u 2/3 takových úmrtí jsou přítomni svědkové. Nejčastější příčinou maligní arytmie je organické srdeční onemocnění jako ischemická choroba srdeční (ICHS) a dilatující kardiomyopatie (DKMP). Ve snaze redukovat výskyt maligních arytmií, a tak zabránit náhlé srdeční smrti (NSS), byla v klinických studiích testována různá antiarytmika, která ovšem s výjimkou betablokátorů nevedla k žádnému, nebo vedla jen k velmi nepatrnému, snížení mortality. V současné době neznáme lepší a spolehlivější terapii maligních arytmií než implantabilní kardioverter-defibrilátor (ICD) (obr. 1). Od prvního užití ICD u člověka již uplynulo 32 let [1]. Původními kandidáty implantace byli nemocní, kteří prodělali maligní arytmii a většinou byli resuscitováni pro zástavu oběhu. Od roku 1996, kdy byla publikována data primárně preventivní studie MADIT, se začal zvyšovat počet primárně preventivních (PP) indikací, kdy byl defibrilátor implantován i nemocným, kteří dosud maligní arytmii neprodělali. Podle dat z USA tvořil počet PP implantací v roce 2006 celých 79 % ze všech implantací ICD [2]. Cílem následujícího textu je popsat současné možnosti prevence náhlé srdeční smrti (NSS).
Image 1. Záznam intrakardiálního EKG z paměti ICD. Epizoda fibrilace komor terminovaná ICD výbojem. 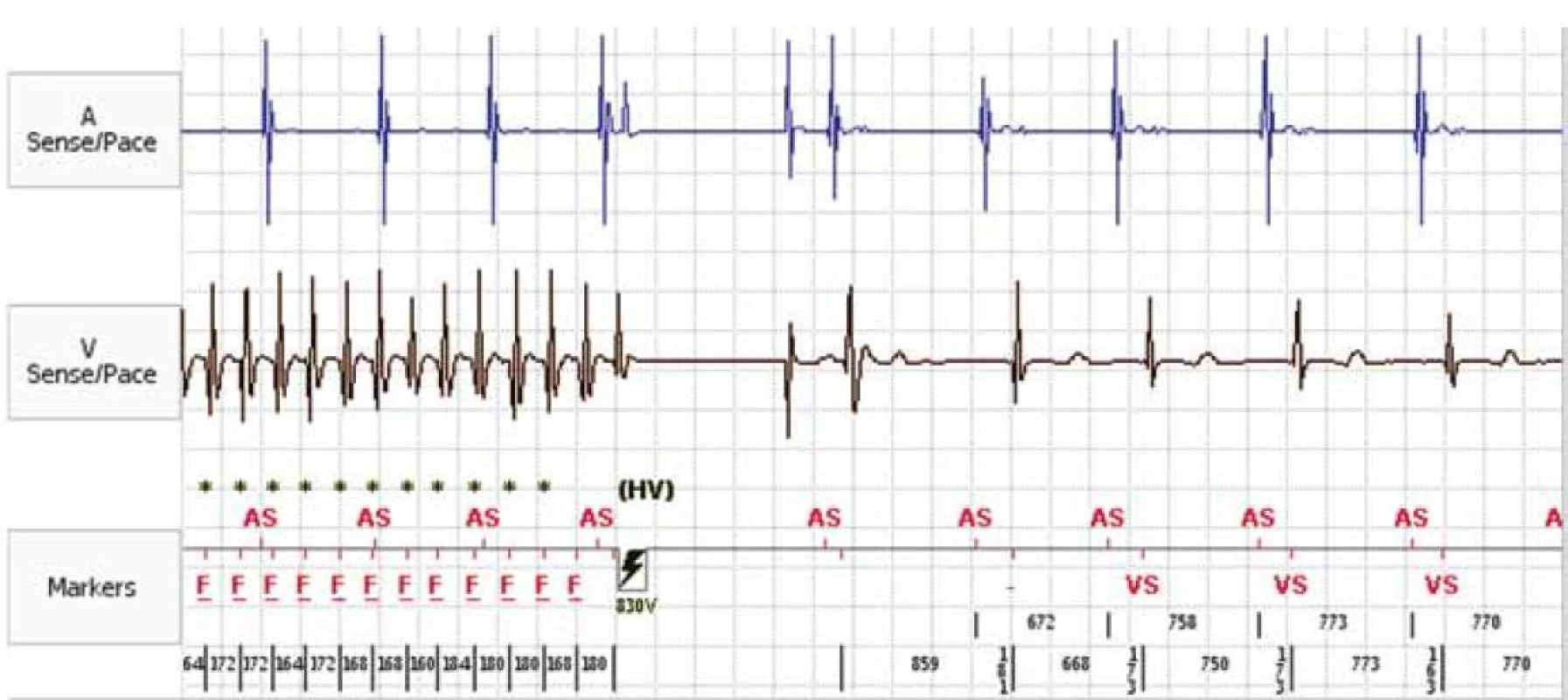
AS – atrium sensed, VS – ventricle sensed, F – fibrilace komor, HV – high voltage (shock) Studie, které vedly k postupnému rozšíření implantací ICD
Nové terapeutické přístupy jsou vždy nejdříve testovány u nejrizikovější populace pacientů. Jako hlavní pilíře, o které se opírá indikace k implantaci ICD v sekundární prevenci (u pacientů, kteří již maligní arytmii prodělali), jsou uváděny tři studie: AVID, CASH a CIDS [3–5]. Všechny tři porovnávaly u pacientů po prodělané maligní arytmii konvenční léčbu antiarytmiky s implantací ICD. Studie AVID prokázala 31% redukci celkové mortality ve prospěch ICD. Studie CASH a CIDS vedly sice k nesignifikantnímu snížení relativního rizika celkové mortality 23 % a 19,7 %, nicméně metaanalýza všech tří studií prokázala, že léčba pomocí ICD v sekundární prevenci vede k významnému poklesu arytmické smrti (HR 0,50) i celkové mortality (HR 0,72). Nejlepší poměr cena/prospěch měli v těchto studiích pacienti resuscitovaní pro fibrilaci komor s ejekční frakcí levé komory (EF LK) < 35 % [6]. Vzhledem k tomu, že pacienti po prodělané maligní arytmii jsou ohroženi vysoce pravděpodobnou recidivou této arytmie a jiná účinná léčba nalezena nebyla, stala se implantace ICD v sekundární prevenci všeobecně akceptovanou metodou léčby. Tuto indikaci lze též považovat za uzavřenou, protože počty úspěšně zresuscitovaných pacientů jsou malé a v jednotlivých letech po sobě konstantní.
Za posledních 15 let proběhlo celkem deset randomizovaných primárně preventivních studií, jejichž cílem bylo prokázat prospěch nemocných ve zvýšeném riziku NSS z léčby ICD oproti konvenční farmakoterapii. U pacientů s ICHS to byly studie MADIT a MADIT II, CABG-Patch, MUSTT a DINAMIT. U nemocných s DKMP studie AMIOVIRT, CAT a DEFINITE. Pacienty z obou skupin etiologického spektra srdečního postižení pak zařazovaly studie SCD-HeFT a COMPANION [7]. Zatímco ve studii MADIT [8] byli zařazeni nemocní po IM s ejekční frakcí levé komory (EFLK) < 35 %, kteří měli dokumentovanou přítomnost nesetrvalých komorových tachykardií (NSKT) a inducibilní maligní arytmii při programované stimulaci komor (PSK), ve studii MADIT II [9] již postačila k implantaci ICD pouze přítomnost jizvy po IM a EF LK < 30 % a ve studii SCD-HeFT [10] dokonce stačilo, aby pacienti se srdečním selháním měli EFLK < 35 %. Ejekční frakce se tak stala hlavním a někdy dokonce jediným stratifikačním znakem rizika NSS. Zatímco studie MADIT byla cílená na úzce vyselektovanou skupinu pacientů s vysokým rizikem NSS, studie MADIT II a SCD-HeFT pracovaly s mnohem větší částí populace. Se snižujícím se množstvím stratifikačních znaků však klesá absolutní redukce rizika (ARR) a stoupá počet léčených k záchraně jednoho života (NNT). Absolutní redukce rizika byla 46 % a NNT 2,2 u MADIT proti ARR 16 % a NNT 6,3 u MADIT II, nebo ARR 8 % a NNT 12,5 u SCD-HeFT (čísla jsou uváděna pro pětileté sledování [7]). Mezi studie, které neprokázaly redukci celkové mortality, patří CAT a AMIOVIRT [11,12], obě s poměrně malým počtem pacientů (104 a 103 oproti 2 521 ve SCD-HeFT). U pacientů s ICHS to byly CABG-Patch a DINAMIT [13,14]. U prvně jmenované byli pacienti randomizováni k léčbě ICD po kardiochirurgické revaskularizaci myokardu při patologickém nálezu pozdních potenciálů na EKG. Efektivita ICD byla nízká pro malý výskyt NSS u úspěšně revaskularizovaných nemocných. Ve studii DINAMIT byli léčeni pomocí ICD pacienti s nedávno proběhlým IM (6–40 dní) a EF LK < 30 % s nálezem nízké variability srdeční frekvence. Redukce náhlé smrti o 58 % pomocí ICD byla bohužel negativně vyvážena vzestupem „nearytmické“ smrti v ICD větvi. S výjimkou těchto výsledků většina studií v PP prokázala signifikantní redukci celkové mortality ve prospěch ICD. Relativní redukce se pohybovala mezi 20 a 30 % a absolutní redukce mortality byla 1,5–3 % ročně. Výsledky studií vedly k vytvoření doporučených postupů pro implantace ICD v primární prevenci. Jako hlavní znaky rizika zde slouží nízká ejekční frakce levé komory (EF LK < 35–40 %) a přítomnost chronického srdečního selhání (CHSS) třídy NYHA II a III [15,16].
Skutečné počty pacientů a „cost/effectivness“ ICD v PP
Graf 1 ukazuje vzestupný trend počtů imo--implantací ICD v České republice za posledních 10 let. Graf 2 potom poměr primárně a sekundárně preventivních implantací v roce 2011. Zatímco počty sekundárně preventivních implantací se příliš nemění, výrazně narůstá počet PP implantací. V roce 2009 bylo celosvětově implantováno okolo 280 000 ICD (v USA 434/1 milion obyvatel). Odhadované roční výdaje na ICD v Evropě přesahují 1,2 mld eur, zatímco léčba pomocí CABG se pohybuje okolo 2,12 mld eur a PTCA okolo 2,70 mld eur [2]. Obavy, že pacienti po IM s EF LK < 30 % indikovaní k ICD v souladu s výsledky MADIT II budou znamenat enormní nárůst implantací, se zcela nepotvrdily. Ukazuje se, že díky moderním metodám revaskularizace a optimální farmakoterapii se počet takto profilovaných pacientů pohybuje okolo 13 % všech nemocných po prodělaném akutním IM [17]. Daleko větší skupinu potenciálních ICD nositelů představují pacienti s chronickým srdečním selháním. Prevalence CHSS se v celkové populaci dnes odhaduje na 2 %. Čím větší část těchto nemocných bude indikována k profylaktické ICD terapii (SCD-HeFT), tím vyšší bude i počet přístrojů, které musíme implantovat zbytečně, abychom zabránili jednomu arytmickému úmrtí. Dle posledních výsledků studií se odhaduje, že až 80 % nositelů ICD v PP tuto nákladnou léčbu nevyužije. Proto se i ve vyspělejších ekonomikách než je ta naše objevují snahy o bližší stratifikaci rizikových skupin, a tím efektivnější využití ICD. Nutnost takové stratifikace ukazují i výsledky retrospektivní studie Al-Khatiba et al [18], která zjistila, že ze 111 707 ICD implantovaných v USA v letech 2006–2009 nesplnilo indikační kritéria podle guidelines více než 22 %. I když toto číslo vychází z údajů v registru, které vždy nemusí plně odpovídat realitě a ve skutečnosti bude patrně nižší, podporuje argumentaci o nadužívání ICD ve vyspělých zemích.
Graph 1. Počty primoimplantací a reimplantací ICD v ČR v letech 2001–2011 (data z Registru PM a ICD ČR). 
Graph 2. Procentuální vyjádření počtu primárně preventivních (PP) a sekundárně preventivních (SP) primoimplantací ICD v ČR v roce 2011(Data z Registru PM a ICD ČR). 
Riziková stratifikace
Po celou éru primárně preventivních implantací ICD se lékaři snaží nalézt rizikové znaky, které by dobře identifikovaly nemocné s vysokým rizikem náhlé smrti. Postupně se na různých populacích pacientů s ICHS a většinou retrospektivně testovaly znaky autonomní dysbalance: variabilita srdečního rytmu (HRV), senzitivita baroreflexu (BRS), turbulence srdečního rytmu (HRT), heterogenity myokardu: QT disperze, přítomnost pozdních potenciálů (SAECG), přítomnost arytmogenního substrátu: výskyt komorových extrasystol, inducibilita maligní arytmie při elektrofyziologii. Žádná z těchto metod ani jejich kombinace však neměly dostatečnou prediktivní sílu, aby mohly jasně vyprofilovat pacienty vhodné k implantaci ICD. Výskyt komorových extrasystol není kvalitním prediktorem maligní arytmie u pacientů s neischemickou kardiomyopatií. Význam přítomnosti pozdních potenciálů je v době moderní revaskularizace velmi sporný. U pacientů bez těžké dysfunkce LK, kteří jsou léčení betablokátory, významně klesá výpovědní hodnota baroreflexní senzitivity nebo variability srdečního rytmu. V provedených prospektivních studiích se jako nadějná ukazuje HRT a zejména jeden z parametrů – decelerační kapacita (DC), jejíž patologické hodnoty jsou lepším prediktorem celkové mortality než nízká ejekční frakce, vztah k arytmické mortalitě však nebyl pro nízkou incidenci NSS vyjádřen [19]. Zatímco pro získání ideálního záznamu HRV a BRS je třeba sinusový rytmus bez KES, pro získání hodnot HRT jsou nutné komorové extrasystoly v EKG záznamu. Výskyt příliš frekventních extrasystol, nebo naopak jejich absence jsou důvodem, proč nelze vždy získat výsledky všech autonomních parametrů. Nehledě na tyto limitace je opět užití autonomních rizikových znaků spojeno především s predikcí rizika u ICHS a ne u neischemické kardiomyopatie. Neinvazivní metody nepřinesly očekávané výsledky samostatně ani v různých kombinacích. Protože spolu s výsledky nových PP ICD studií došlo k významnému uvolnění indikačních doporučení a k implantaci je indikován takřka každý pacient s dysfunkcí levé komory a známkami srdečního selhání, došlo k obratu od pozitivní predikce NSS k negativní. Tedy snahou již není označovat jedince s vysokým rizikem NSS v populaci, ale pacienty s nízkým rizikem, u nichž případná implantace ICD nepovede k redukci mortality, a tudíž není potřebná.
Pacienti a jejich prospěch z primárně preventivní implantace ICD
Pohlaví a věk
Ve všech primárně preventivních ICD studiích bylo zařazeno výrazně více mužů než žen. Metaanalýza pěti největších studií [20] ukazuje, že muži s ICD měli signifikantní redukci mortality, zatímco ženy se pohybovaly na hranici statistické významnosti (26 % vs 19 %). Při vyřazení dat studie COMPANION (ICD spojené s resynchronizací) došlo k poklesu redukce rizika u žen na 12 %, zatímco prospěch mužů zůstal nezměněn. V substudii MADIT je patrný vyšší výskyt maligních arytmií u mužů v průběhu sledování, i když výsledná mortalita se mezi pohlavími nelišila. Ženy umíraly častěji nearytmickou smrtí. Ve studii SCD-HeFT měly ženy v kontrolní skupině (bez ICD) dokonce nižší mortalitu než muži léčení defibrilátorem [21].
Ačkoliv vysoký věk nebyl důvodem neúčasti v randomizovaných studiích a ani v doporučeních nemáme věkové omezení pro implantaci ICD, objevilo se několik prací zabývajících se profitem starších pacientů. Ve studii MOST [22] bylo retrospektivně hodnoceno 1 100 pacientů se známou EFLK a implantovaným kardiostimulátorem. Průměrný věk byl 74 let (o 15 let starší než populace SCD-HeFT). Pacieti s EFLK < 35 % měli desetinásobné riziko úmrtí na srdeční selhání a jen čtyřnásobné riziko úmrtí na NSS oproti těm se zachovalou systolickou funkcí. Roční výskyt NSS byl 3,9 % (jen lehce vyšší než v SCD-HeFT – 2,6 %), ale celková mortalita byla dvojnásobná. Odhaduje se, že asi 85 % všech úmrtí by v této věkové skupině ICD neodvrátil. Překročení hranice 65–70 let věku vede i podle dalších prací k významné redukci efektivity ICD v primární prevenci NSS [23–25].
Přidružená onemocnění
Další neméně významnou limitací efektu ICD jsou přidružená onemocnění, která zvyšují pravděpodobnost nearytmického úmrtí. Relativní redukce mortality ve studii MADIT II byla 31 %, ve studii SCD-HeFT 23 %. Největším prediktorem celkové mortality byla renální insuficience. Pacienti s ureou > 18 mmol/l nebo sérovým kreatininem > 220 µmol/l měli mortalitu 48 % a žádný profit z ICD [26,27]. Při dlouhodobém sledování pacientů s implantovaným ICD na našem pracovišti jsme prokázali, že přítomnost renální insuficience zvyšuje riziko nearytmického úmrtí více než pětinásobně [28].
Pacienti s pokročilým selháním ledvin tvoří nezanedbatelnou část populace MADIT II.
NYHA klasifikace
NYHA klasifikace je i přes významné subjektivní zkreslení hodnotícího i pacienta důležitým prognostickým údajem. Ve studii MADIT II, kde v zařazení NYHA nehrála roli, profitovali nejvíce nemocní ve funkční třídě II a méně ve třídě III. Naproti tomu ve studii SCD-HeFT byla NYHA jedním z indikačních kritérií. Zde profitovali z léčby ICD pouze pacienti NYHA II, nikoliv však III [7,29]. Změny rizika náhlé arytmické smrti při přechodu z jedné třídy NYHA do jiné může způsobit vedle účelné farmakoterapie i resynchronizační léčba. Studie COMPANION, která využívala resynchronizaci spojenou s ICD, měla velmi podobné vstupní podmínky jako SCD-HeFT. V pětiletém sledování má COMPANION 34% absolutní redukci rizika při NNT 2,9, zatímco SCD-HeFT pouze 8% absolutní redukci rizika při NNT 12,5 [7,30]. Přitom lze tvrdit, že pacienti zařazovaní do prvně zmíněné studie jsou rizikovější.
Ejekční frakce levé komory
Ačkoli většina primárně preventivních studií měla jako vstupní kritérium EF LK ≤ 30–40 % (průměr 36 %), skutečná EF LK se výrazně lišila směrem dolů (průměr 28 %) [31]. EF LK je také jediným kritériem, které spojuje rozmanité populace pacientů v PP studiích. Z metaanalýzy PP studií vyplývá, že pětiletá celková mortalita u pacientů s EF LK nad 35 % byla 10 %, při EF < 35 % tvořila 35,4 % a při EF LK < 20 % byla dokonce 54 % [32]. Echokardiografické měření je nejčastější metodou určování EF LK. Je bohužel prokázáno, že takto získaná EF LK v průběhu týdnů kolísá až o 8,5 % nad a pod průměrnou hodnotu stanovenou opakovanými měřeními [30]. Tyto údaje podtrhují nutnost pečlivé farmakoterapie srdečního selhání a zejména u pacientů s neischemickou kardiomypatií opakované zhodnocení stavu s odstupem a stanovení EF LK před případnou PP indikací ICD. I přesto však zůstává ejekční frakce levé komory nadále hlavním stratifikačním znakem.
Šířka QRS komplexu
Šířka QRS lineárně souvisí s rizikem mortality v dlouhodobém sledování rizikových pacientů. Nemocní s QRS > 120 ms mají vyšší mortalitu než pacienti s QRS < 120 ms [33,34]. Ve studii MADIT II byl u ICD pacientů QRS > 120 ms spojen s 63% relativní redukcí rizika a 10,7% absolutní roční redukcí rizika oproti kontrolní skupině. Kombinovaná data MADIT II a SCD-HeFT prokázala čtyřnásobnou redukci mortality pro nositele ICD s QRS > 120 ms proti pacientům se štíhlým QRS komplexem [2].
Mikro-volt alternans T vlny
Mikro-volt TWA představuje velmi diskrétní změny ST-úseku a je patrné až při zpracování EKG záznamu spektrální analýzou. Jeho přítomnost je odrazem nehomogenity repolarizace myokardu. Výsledky MTWA podle některých studií dosahují vysoké negativní prediktivní hodnoty. Riziko NSS u pacientů s negativním výsledkem MTWA je malé i u nemocných s EF LK < 30 %. Na rozdíl od historických rizikových znaků jako senzitivita baroreflexu nebo variabilita srdečního rytmu, které byly testovány na populacích pacientů po trombolýze, se zdá, že negativní predikce MTWA je spolehlivá i u současných nemocných léčených moderními metodami a také u pacientů s neischemickou dysfunkcí levé komory [35–37]. Technické problémy a limitace vyšetření brání jeho použití v široké praxi.
Tab. 1 shrnuje charakteristiku pacientů, u kterých bychom měli PP implantaci ICD pečlivě zvážit, přestože podle „doporučení“ mohou být vyhovujícími kandidáty.
Table 1. Faktory ovlivňující prospěch z PP implantace ICD. 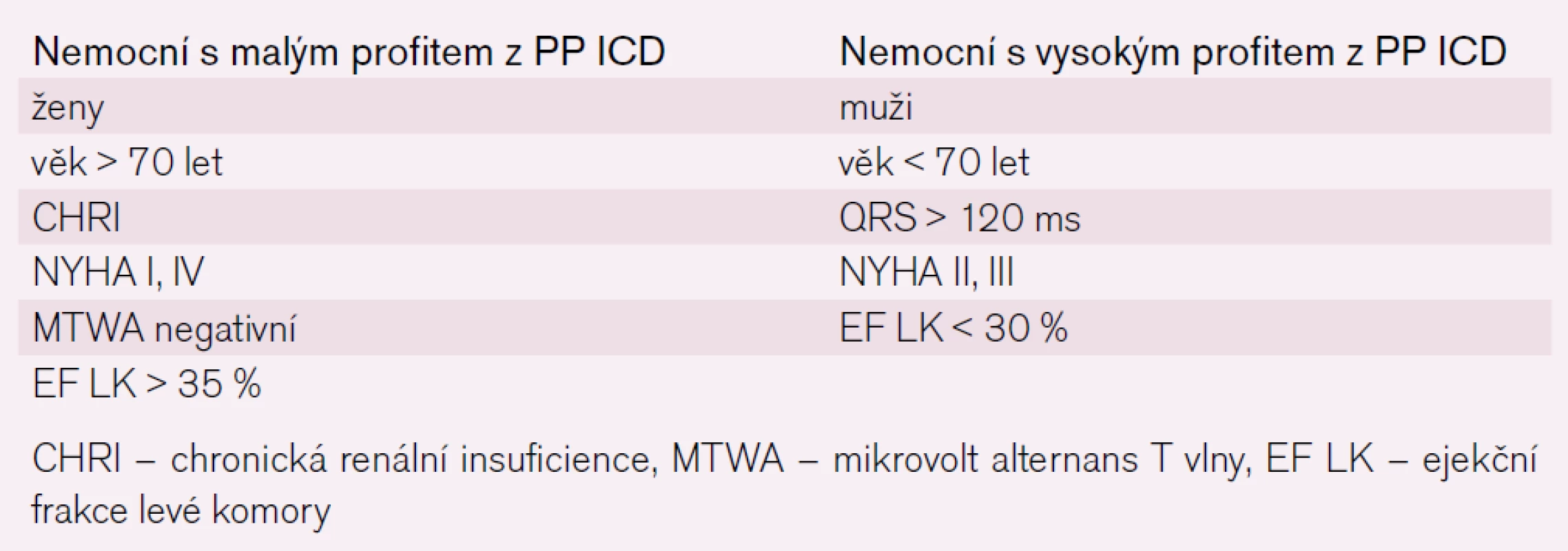
Trendy
Přes prokázanou efektivitu ICD v primární prevenci náhlé smrti platí, že nejlepší prevencí maligních arytmií je důsledná prevence a léčba ICHS a srdečního selhání.
Farmakoterapie
Lékem s nejvyšší prokázanou účinností v prevenci NSS jsou betablokátory (BB). Dosud byly testovány ve více než 50 randomizovaných studiích s 55 000 pacienty. Relativní redukce rizika proti placebu je u BB 30–50 %. Zdá se, že nejvyšší efekt v potlačení maligních arytmií mají lipofilní betablokátory jako timolol, metoprolol, propranolol, bisoprolol a karvedilol. Z pokusů na zvířatech je známo, že CNS hraje významnou roli v náhlé srdeční smrti, a patrně proto mají lipofilní BB vyšší efekt na její potlačení. Platí, že všichni pacienti s ICHS a CHSS by měli být léčeni BB v co nejvyšší tolerované dávce [38].
Dalším z nepostradatelných léků jsou ACE inhibitory. Není zde sice prokázán přímý vliv na arytmickou smrt jako u BB, výrazně však redukují progresi srdečního selhání a celkovou mortalitu. Platí, že čím těžší formou CHSS pacienti trpí, tím je pozitivní efekt ACEI větší [39]. Antagonisté aldosteronových receptorů vedou v kombinaci s ACEI k další redukci mortality i NSS. Zvyšují hladinu sérového draslíku, zlepšují odpověď myokardu na stimulaci norepinefrinem a zpomalují fibrózu myokardu. Ve studii EPHESUS u pacientů s dysfunkcí LK po infarktu vedlo podávání eplerenonu k signifikantní redukci celkové mortality o 15 % a arytmické mortality o 21 %. Ve skupině nemocných s EF LK < 30 % byla redukce NSS dokonce 33 % [39].
Resynchronizační terapie
V nefarmakologické léčbě CHSS hraje významnou roli i resynchronizační léčba (SRL). Ta vede k redukci mortality sama o sobě a ještě výrazněji pak v kombinaci s ICD. Dalším efektem SRL je redukce počtu rehospitalizací pro srdeční selhání. Jestliže 75 % současných výdajů léčby CHSS v evropských státech tvoří právě opakované hospitalizace, může využití kombinace SRL a ICD toto číslo významně snížit a poměr cena/užitek bude příznivější ve prospěch ICD [40].
Revaskularizace myokardu u pacientů s ICHS
V akutní fázi IM dochází k ischemií indukovaným maligním arytmiím. Naopak v poinfarktovém období závisí vznik maligních arytmií na rozsahu postižení myokardu, trvající ischemii a stupni revaskularizace. Jizva po IM představuje arytmogenní substrát pro vznik re-entry. Dále se na arytmiích podílí progrese dysfunkce levé komory a její remodelace. Z provedených studií je zřejmé, že funguje rovněž přímá úměra mezi počtem postižených koronárních tepen a rizikem maligní arytmie. Role revaskularizace je zcela zásadní. V substudii MADIT II bylo vyšetřeno 951 pacientů, kteří prodělali revaskularizaci (koronární angioplastika nebo CABG). U pacientů, u kterých byla revaskularizace provedena méně než šest měsíců před implantací ICD, nebyla prokázána žádná redukce NSS. Se zvyšujícím se intervalem od revaskularizace (6–60 měsíců a > 60 měsíců) významně narůstala efektivita implantovaného ICD (HR 0,27, resp. 0,40). Příčinou byla progrese ischemického postižení koronárních tepen [41].
ICD technologie
V současnosti je průměrná životnost ICD pět let. V prodlouženém sledování pacientů ve studii MADIT II je patrný stoupající prospěch z implantace ICD s délkou follow-upu [17]. Prodloužení životnosti přístrojů by tak vedlo k zlepšení poměru cena/užitek. V současné době je referováno zhruba 20krát více malfunkcí ICD a elektrodového systému než u kardiostimulátorů [1]. Tyto poruchy mohou vést k proarytmii a negativním jevům, které ovlivňují mortalitu pacientů v neprospěch ICD. Tato výzva stojí především před firmami vyvíjejícími kardiostimulační techniku.
Závěr
Implantace ICD byly rozšířeny na rozsáhlou populaci pacientů s dysfunkcí levé komory bez ohledu na etiologii. Staly se plnohodnotným doplňkem komplexní léčby srdečního selhání spolu s terapií farmakologickou, intervenční a operační. Výzvou pro další výzkum na poli prevence náhlé smrti je přesnější definice pacientů, u nichž není implantace ICD přínosná, zlepšení terapie CHSS a technologický pokrok v oblasti aktivních implantátů.
Doručeno do redakce 18. 6. 2012
Přijato po recenzi 9. 7. 2012
doc. MUDr. Lubomír Křivan, Ph.D.
Interní kardiologická klinika LF MU a FN Brno
lkrivan@fnbrno.cz
Sources
1. Passman R, Kadish A. Sudden death prevention with implantable devices. Circulation 2007; 116 : 561–571.
2. Zimerman LI. Cardioverter-defibrillator in the primary prevention of sudden death: for all or for a few? Arq Bras Cardiol 2008; 1 : 63–64.
3. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. N Engl J Med 1997; 337 : 1576–1583.
4. Kuck KH, Cappato R, Siebels J et al. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study of Hamburg (CASH). Circulation 2000; 102 : 748–754.
5. Connolly SJ, Gent M, Roberts RS et al. Canadian Implantable Defibrillator Study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 101 : 1297–1302.
6. Leyva F, Fernandez Lozano I, Morgan J. Cardioverter-defibrillators: a cost or an investment? Europace 2011; 13 (Suppl 2): ii25–ii31.
7. Dorian P, Talajic M, Tang A. Implantable cardioverter defibrillators for the prevention of sudden death. Can J Cardiol 2005; 21 (Suppl A): 31A–36A.
8. Moss AJ, Hall WJ, Cannom DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 1996; 335 : 1933–1940.
9. Moss AJ, Zareba W, Hall WJ et al. Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346 : 877–883.
10. Bardy GH, Lee KL, Mark DB et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter--defibrillator for congestive heart failure. N Engl J Med 2005; 352 : 225–237.
11. Bänsch D, Antz M, Boczor S et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation 2002; 105 : 1453–1458.
12. Wijetunga M, Strickberger SA. Amiodarone Versus Imlapntable Defibrillator Randomized Trial (AMIOVIRT): background, rationale, design, methods, results and implications. Card Electrophysiol Rev 2003; 7 : 452–456.
13. Bigger JT Jr. Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. Coronary Artery Bypass Graft (CABG) Patch Trial Investigators. N Engl J Med 1997; 337 : 1569–1575.
14. Connolly SJ, Dorian P. DINAMIT investigators. Randomized trial of ICD After recent acute myocardial infarction: DINAMIT. Can J Cardiol 2004; 20 (Suppl D): 146D.
15. Táborský M. Arytmie a trvalá kardiostimulace. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a systémů pro srdeční resynchronizační léčbu 2009. Cor Vasa 2009; 51 : 602–614.
16. Křivan L. Primární prevence náhlé srdeční smrti – ICD pro všechny s dysfunkcí srdeční komory? Cor Vasa 2010; 52 : 35–35.
17. Carrim ZI, Khan AA, Aslam S. Primary prevention of fatal ventricular arrhythmias with implantable cardioverter-defibrillator therapy – an analysis of implications based on MADIT II criteria. Mcgill J M 2006; 9 : 14–18.
18. Al-Khatib SL, Hellkamp A, Curtis J et al. Non--evidence-based ICD implantation in the United States. JAMA 2011; 305 : 43–49.
19. Ding L, Hua W, Niu H et al. Primary prevention of sudden cardiac death using implantable cardioverter defibrillators. Europace 2008; 10 : 1034–1041.
20. Henyan NH, White CM, Gillespie EL et al. The impact of gender on survival amongst patients with implantable cardioverter defibrillators for primary prevention against sudden cardiac death. J Intern Med 2006; 260 : 467–473.
21. Russo AM, Poole JE, Mark DB et al. Primary prevention with defibrillator therapy in women: results from the Sudden Cardiac Death in Heart Failure Trial. J Cardiovasc Electrophysiol 2008; 19 : 720–724.
22. Sweeney MO, Hellkamp AS, Ellenbogen KA et al. Reduced ejection fraction, sudden cardiac death, and heart failure death in the Mode Selection Trial (MOST): implications for device selection in elderly patients with sinus node disease. J Cardiovasc Electrophysiol 2008; 19 : 1160–1166.
23. Setoguchi S, Nohria A, Rassen JA et al. Maximum potential benefit of implantable defibrillators in preventing sudden death after hospital admission because heart failure. CMAJ 2009; 180 : 611–616.
24. Boriani G. Cardioverter defibrillators in primary prevention of sudden cardiac death: a cost or an investment? Value Health 2007; 10 : 1–2.
25. Huang DT, Sesselberg HW, McNitt S et al. Improved survival associated with prophylactic implantable defibrillators in elderly patients with prior myocardial infarction and depressed ventricular function: a MADIT-II substudy. J Cardiovasc Electrophysiol 2007; 18 : 833–838.
26. Goldenberg I, Vyas AK, Hall WJ et al. Risk stratification for primary implantation of a cardioverter-defibrillator in patients with ischemic left ventricular dysfunction. J Am Coll Cardiol 2008; 51 : 288–296.
27. Tung R, Swerdlow CD. Refining patient selection for primary prevention implantable cardioverter-defibrillator therapy: reeling in a net cast too widely. Circulation 2009; 120 : 825–827.
28. Křivan L, Kozák M, Sepši M et al. Analýza a srovnání souborů nositelů implantabilního kardioverteru-defibrilátoru v primární a sekundární prevenci. Vnitř Lék 2010; 56 : 99–105.
29. Moss AJ. Implantable cardioverter defibrillator therapy: the sickest patients benefit the most. Circulation 2000; 101 : 1638–1640.
30. Dorian P. Effective and efficient use of implantable defibrillators: sometimes it’s over when it’s over. CMAJ 2009; 180 : 599–600.
31. Jolly S, Dorian P, Alter DA. The impact of implantable cardiac defibrillators for primary prophylaxis in the community: baseline risk and clinically meaningful benefits. J Eval Clin Pract 2006; 12 : 190–195.
32. Gehi A, Haas D, Fuster V. Primary prophylaxis with the implantable cardioverter-defibrillator: the need for improved risk stratification. JAMA 2005; 294 : 958–960.
33. Barthel P, Bauer A, Schneider R et al. Prolonged QRS duration is an independent risk predictor after acute myocardial infarction. PACE 2003; 26 : 943.
34. Kalahasti V, Nambi V, Martin DO et al. QRS duration and prediction of mortality in patients undergoing risk stratification for ventricular arrhythmias. Am J Cardiol 2003; 92 : 798–803.
35. Zipes PD, Camm AJ, Borggrefe M et al. ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). J Am Coll Cardiol 2006; 48: e247–e346.
36. Bloomfield DM, Bigger JT, Steinman RC et al. Microvolt T-wave alternans and the risk of death or sustained ventricular arrhythmias in patients with left ventricular dysfunction. J Am Coll Cardiol 2006; 47 : 456–463.
37. Chan PS, Stein K, Chow T et al. Cost-effectiveness of a microvolt T-wave alternans screening strategy for implantable cardioverter-defibrillator placement in the MADIT-II-eligible population. J Am Coll Cardiol 2006; 48 : 112–121.
38. Hjalmarson A. Prevention of sudden cardiac death with beta blockers. Clin Cardiol 1999; 22 (Suppl 5): V11–V15.
39. Lane ER, Cowie MR, Chow AW. Prediction and prevention of sudden cardiac death in heart failure. Heart 2005; 91 : 674–680.
40. Bundkirchen A, Schwinger RH. Epidemiology and economic burden of chronic heart failure. Eur Heart J 2004; 6 (Suppl D): D57–D60.
41. Bunch JT, Hohnloser SH, Gersh BJ. Mechanisms of sudden cardiac death in myocardial infarction survivors: insights from the randomized trials of implantable cardioverter-defibrillators. Circulation 2007; 115 : 2451–2457.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 3-
All articles in this issue
- Antidiabetika a kardiovaskulární riziko – dříve a nyní
- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Reziduální vaskulární riziko a možnosti jeho ovlivnění
- Zítřky lipidy modifikující terapie – jaké budou?
- Náhlá smrt v kardiologii
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
- Léčba levosimendanem: up-date 2012
- Ticagrelor u pacientů s akutním koronárním syndromem
-
Antitrombotica v prevenci cévní mozkové příhody
1. část – Význam protidestičkové léčby - Renální denervace a její postavení v léčbě rezistentní hypertenze
- Mitrální stenóza v terminální fázi – kazuistika
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Ticagrelor u pacientů s akutním koronárním syndromem
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

