-
Medical journals
- Career
Antitrombotica v prevenci cévní mozkové příhody
1. část – Význam protidestičkové léčby
Authors: J. Bultas; D. Karetová
Published in: Kardiol Rev Int Med 2012, 14(3): 200-206
Category:
Overview
Profylaxe cévních mozkových příhod je postavena na třech pilířích – životosprávě, úpravě rizikových faktorů aterogeneze a antitrombotické léčbě. U nemocných léčených v rámci sekundární prevence kardiovaskulárních příhod, tedy v profylaxi aterotrombózy, hraje dominující úlohu primární hemostáza, léčbu tak cílíme na úpravu destičkových funkcí. Naopak při fibrilaci či flutteru síní se na prvním místě účastní stagnace krve s aktivací koagulace, na místě jsou antikoagulancia. Při koincidenci obou stavů výhodně kombinujeme obě léčebné strategie. V profylaxi cévních příhod u nemocného po překonané mozkové příhodě volíme k úpravě funkce hyperaktivovaných trombocytů v první řadě kyselinu acetylsalicylovou, alternativou při nemožnosti podat acetylsalicylovou kyselinu je clopidogrel se srovnatelným efektem i srovnatelným rizikem krvácivých komplikací. Třetí možností volby je aplikace fixní kombinace malé dávky kyseliny acetylsalicylové s dipyridamolem. Tato léčba je v účinnosti i bezpečnosti rovna clopidogrelu, je účinnější než subterapeutická dávka 25 mg kyseliny acetylsalicylové, není však účinnější než dávky ASA obvyklé (30–325 mg). Výhledově je možno očekávat zavedení nových léčiv, zejména cilostazolu, jehož dostupnost v ČR je možno v nejbližších letech očekávat, a dále dle výsledků probíhajících studií i potvrzení efektu nových blokátorů ADP receptorů ticagreloru a prasugrelu.
Klíčová slova:
cévní mozková příhoda – sekundární prevence – protidestičková léčba – kyselina acetylsalicylová – clopidogrel – dipyridamol – cilostazolÚvod
Aterotrombotické a tromboembolické příhody – ať již jsou v různé lokalizaci, tj. cerebrovaskulárním, koronárním či v periferním systémovém řečišti – mají společného jmenovatele – trombózu. Je-li etiopatogenetickým momentem nestabilní plát či jiné poškození cévní stěny, hraje prim aktivace primární, tedy destičkové hemostázy, a sekundární hemostáza je zapojena významně až sekundárně. Léčebně tak využíváme především protidestičkové léky, nicméně antikoagulancia jsou rovněž velmi důležitá. Naopak při oblenění průtoku, například při stagnaci krve v oušcích srdečních předsíní u fibrilace síní, je aktivována sekundární hemostáza (hemokoagulace), primární hemostáza se prakticky neuplatní. Rozhodující úlohu má tak antikoagulační léčba, protidestičková se uplatní jen velmi málo.
V etiopatogenezi aterotrombotických příhod hrají významnou úlohu tři „nestabilní“ faktory: nestabilní plát s obnaženými vysoce trombogenními kolagenními vlákny, nestabilní céva s dysfunkčním endotelem s potlačenou schopností kontrolovat aktivovanou hemostázu a nestabilní, tj. aktivovaný trombocyt při vychýlení hemostatické rovnováhy (např. v rámci stresové situace, cukrovky, aktivace zánětu či navozeném vykouřenou cigaretou). Zásah na kterékoli etáži snižuje riziko příhody – první dva mechanizmy trombogeneze nejlépe ovlivníme úpravou rizikových faktorů vzniku endoteliální dysfunkce, aterogeneze a destabilizace plátu, tj. léčbou dyslipidemie, hypertenze, abstinencí kouření, kontrolou diabetu apod., dopad třetího faktoru, tj. protrombotického stavu snížíme antitrombotickou léčbou.
Podíváme-li se na význam jednotlivých strategií, pak antitrombotická léčba – protidestičková i antikoagulační se nejvýznamněji uplatní u akutních stavů vzniklých na trombotickém či tromboembolickém podkladě, zejména u nestabilní anginy či infarktu myokardu, u akutní ischemické mozkové příhody a event. u akutní kritické končetinové ischemie. V takovýchto případech vede optimální antitrombotická léčba k nejvýraznějšímu zlepšení morbidity a mortality. V řadě situací může duální protidestičková léčba, zpravidla v kombinaci s léčbou antikoagulační, zlepšit prognózu až o 50 %. Riziko krvácení při takovéto agresivní léčbě je pak vysoké. Nicméně, vzhledem k omezené době podávání, přínos této strategie výrazně převažuje.
U stabilizovaných, chronických stavů obdobné etiologie je benefit antitrombotické léčby menší, významným faktorem prognózy není jen terminální uzávěr tepny trombem, ale též vlastní progrese aterosklerotického procesu a další komplikující stavy. Zlepšení prognózy (pokles mortality/morbidity) při aplikaci protidestičkové či antikoagulační léčby se pohybuje kolem 20 relativních procent, pokles absolutního procenta závisí na relativním riziku příhody. S délkou léčby a s intenzitou antitrombotické léčby narůstá riziko krvácení, roční incidence závažného krvácení se s každým antitrombotikem zvyšuje asi o jedno procento (absolutní). Není přitom výrazný rozdíl mezi jednotlivými léky, výskyt krvácení při užití kyseliny acetylsalicylové (ASA) je srovnatelný s jeho výskytem při blokátorech ADP receptorů či s antikoagulancii. V každé situaci bychom měli zvažovat intenzitu léčby, její potenciální přínos vzhledem k riziku krvácivých komplikací. Obecně lze odvodit, že při 20% snížení rizika příhody a zvýšení výskytu závažného krvácení kolem 1 % ročně, by riziko závažné aterotrombotické příhody mělo být větší než 5 % ročně – při respektování požadavku výraznějšího přínosu v poměru k riziku. V rámci sekundární prevence po překonané aterotrombotické příhodě se u stabilizovaného nemocného pohybujeme kolem 8–10 % ročního rizika recidivy příhody. Teoretické podmínky pro dlouhodobou indikaci antitrombotické léčby jedním lékem jsou tak u sekundární prevence splněny, klinické studie vhodnost léčby v této indikaci potvrdily.
Jiná je situace pro aplikaci duální protidestičkové léčby, např. kombinací ASA s clopidogrelem. Zde je přínos léčby doložen jen u nemocných po překonaném infarktu myokardu v prvním roce po příhodě, tedy v době, kdy riziko trombotické komplikace přesahuje kritických 10 %. Jasný doklad o přínosu duální léčby výše uvedenou kombinací u nemocných po trombotickém iktu chybí. Druhou možností je kombinace ASA s dipyridamolem, zde je situace komplikovanější a bude diskutována později, jednoznačnou odpověď nemáme.
Cerebrovaskulární příhody jsou jednou z nejvážnějších příčin mortality a morbidity, roční incidence iktů se pohybuje kolem 200 příhod na 100 tisíc obyvatel. Variabilita mezi zeměmi je velká i v rámci Evropy – existuje západo-východní a severo-jižní gradient. Od severozápadní Evropy, kde se incidence pohybuje kolem 100–150 případů, na jihovýchod vzrůstá výskyt na více než 400 příhod. Příčinou rozdílu je kontrola ovlivnitelných rizikových faktorů mozkových příhod, regionální rozdíly ve zdravotní péči, zejména však diference v důslednosti indikace antitrombotik. Vzhledem k tomu, že v ČR je situace v oblasti kontroly cévních mozkových příhod (CMP) neuspokojivá – dle údaje ÚZIS jsme v incidenci i v mortalitě na mozkové příhody vysoko nad průměrem EU –, je potřeba tento stav zlepšit. Jednou z možností je důslednější prevence trombotických komplikací na podkladě aterosklerotického postižení tepenného řečiště či tromboembolických příhod vycházejících ze srdečních oddílů. Strategie využití antitrombotik je úspěšná, u velké většiny mozkových příhod hraje úlohu trombotická či tromboembolizační etiologie, hemoragických příhod je méně než pětina. Většina cévních mozkových příhod je ischemických (asi 85 %), z nich asi tři čtvrtiny jsou trombotické a čtvrtina embolizační. V profylaxi trombotické okluze tepenného zásobení mozku hraje rozhodující úlohu blokáda primární hemostázy, tedy podáváme protidestičkové léky. Hemokoagulace se podílí menší měrou a účastní se až ve fázi stabilizace trombu – proto v léčebné strategii trombotických příhod hraje antikoagulační léčba jen méně významnou, byť nezanedbatelnou úlohu. Při vyšším riziku je možno protidestičkovou a antikoagulační léčbu kombinovat. Naopak kardioembolické příhody při fibrilaci síní probíhají pod taktovkou sekundární hemostázy, klíčovou úlohu hraje stagnace krve v oušcích srdečních síní. V léčebné strategii proto dominují antikoagulancia – jak klasický warfarin, tak novější skupina přímých inhibitorů trombinu (gatranů) či faktoru Xa (xabanů). Při léčbě nemocného po mozkové příhodě indikujeme antitrombotickou léčbu i z důvodů zvýšeného rizika příhody také v povodí ostatních systémů, zejména v koronárním řečišti. Riziko úmrtí z kardiovaskulárních příčin je u nemocných po cerebrovaskulární příhodě zvýšeno několikanásobně, nemocný umírá častěji na novou příhodu kardiovaskulární než na novou cerebrovaskulární, strategie profylaxe je přitom stejná.
Protidestičková léčba v prevenci ischemického iktu
Inhibovat primární hemostázu má význam pouze při její hyperaktivaci. S tou se setkáváme za situace, kdy je trombocyt vystaven kontaktu s trombogenním povrchem, konkrétně s dysfunkcí endotelu a zejména se subendoteliálními strukturami, zvláště pak s kolagenem. Paralelně bývá trombocyt hyperaktivován např. při cukrovce, infekcích či po expozici cigaretovému kouři. K tomu, abychom docílili klinického účinku, tj. dosáhli poklesu aterotrombotických komplikací, musíme vyřadit z funkce nejméně 60 % trombocytů. Vyřadíme-li však více než 80–90 %, narůstá prudce riziko krvácení. Terapeutickým cílem je proto funkční blokáda 60–80 % trombocytů (obr. 1). Výraznější odchylky ve farmakologickém účinku protidestičkových léků – ať již na podkladě resorpce, bioaktivace či bioeliminace – se pak mohou projevit buď selháním účinku, nebo krvácením. Proto je správné vedení léčby právě v této oblasti tolik důležité.
Image 1. Terapeutické okno protidestičkových léků – léčebná strategie je dána inhibicí funkce 60–80 % trombocytů. Nižší inhibice je spojena s nadměrnou reaktivitou (high on-treatment platelet reactivity) a rizikem trombózy, naopak vyšší inhibice (high on-treatment platelet inhibition) zvyšuje riziko krvácení. 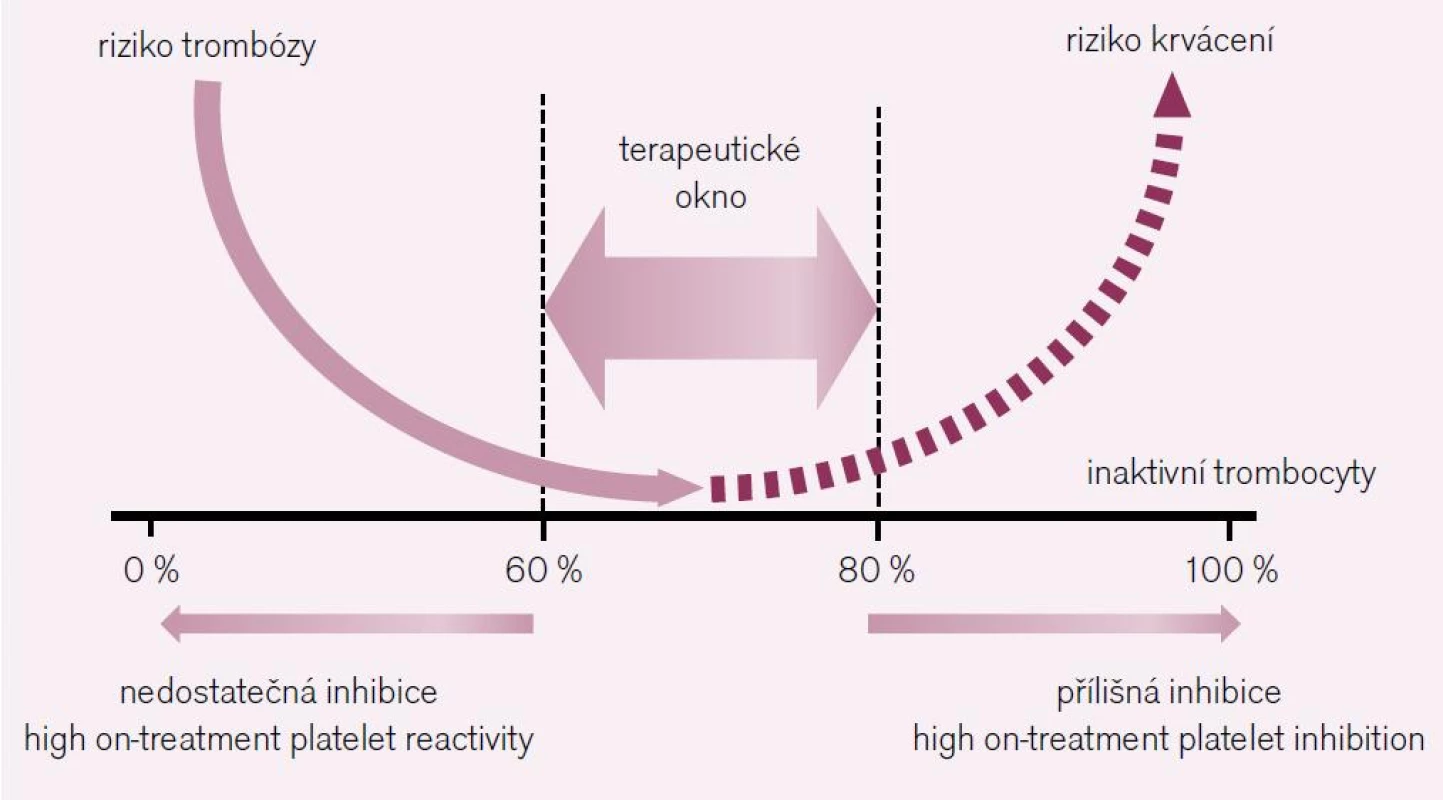
Protidestičková léčba se uplatní v sekundární prevenci vzniku cévních mozkových příhod non-embolizační etiologie a tranzitorních ischemických atak (TIA) v akutní, subakutní i chronické fázi příhody. Strategií, kterými můžeme tlumit primární hemostázu, je řada (obr. 2). Jen několik strategií však má doklad o účinnosti a bezpečnosti v dané indikaci. Na úrovni aktivace trombocytů inhibujeme dvě klíčové cesty – tromboxanovou (např. ASA) čiaktivaci trombocytu receptory pro adenozin difosfát (ADP) typu P2Y12 (clopidogrelem či ticlopidinem). Také dipyridamol a cilostazol, jak bude dále ukázáno, působí v kaskádě aktivace trombocytu receptory pro ADP. Pro účinnost a bezpečnost ovlivnění destičkových funkcí v rámci profylaxe mozkových příhod jiným způsobem (např. blokátory vazných glykoproteinových receptorů IIb/IIIa) nejsou doklady.
Image 2. Možnosti inhibice primární hemostázy – vzhledem k řadě možností aktivace trombocytů, máme i řadu léčebných strategií. Tučně jsou uvedeny již zavedené léky, slabě léky ve vývoji či u nás nedostupné (vysvětlivky: COX – cyklo-oxygenáza, 5HT – serotonin, PAR-1 – proteázou aktivované receptory 1 neboli receptory trombinové, ADP – adenozin difosfát, AC – adenylát-cykláza, PDE-3 – fosfodiesteráza 3). 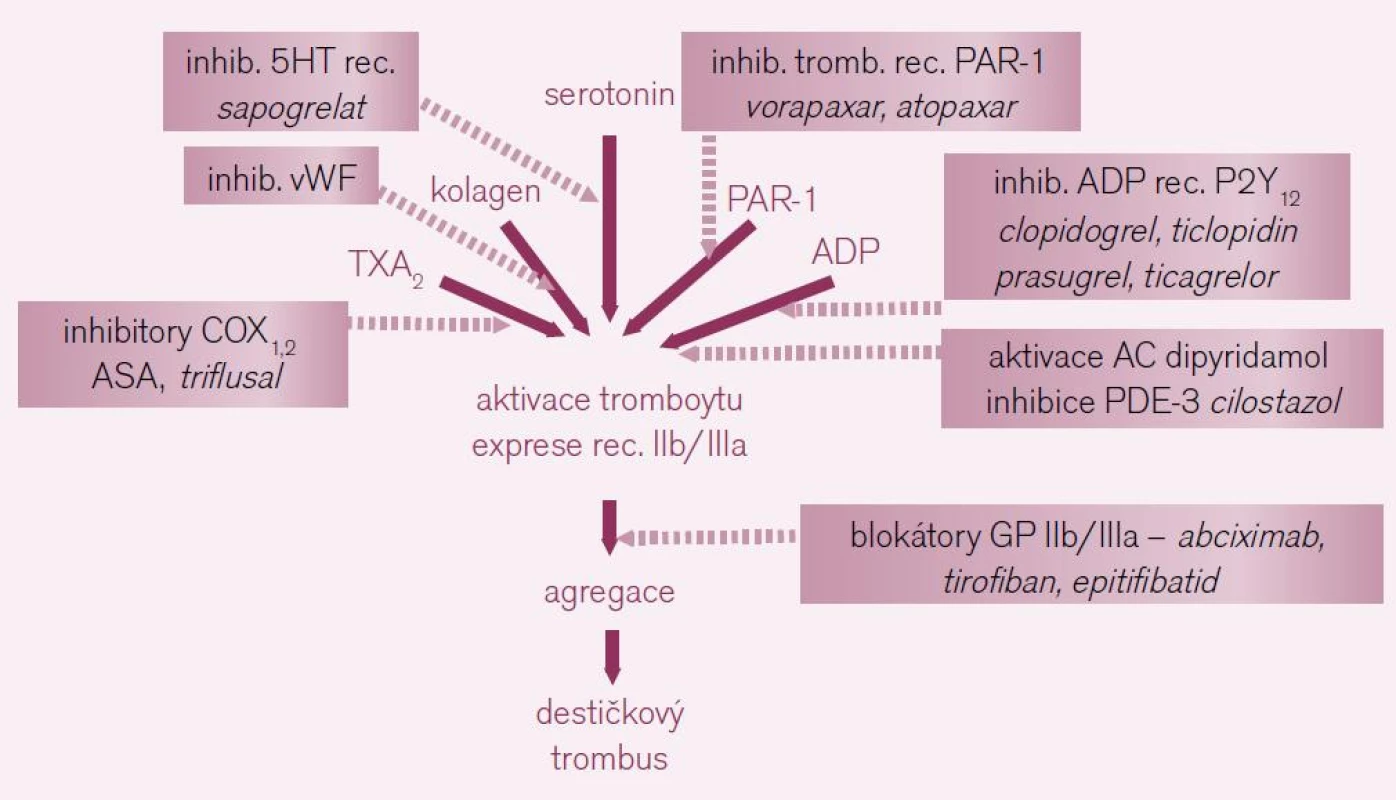
Inhibice tromboxanové cesty aktivace destiček
Blokáda syntézy vazokonstrikčního a destičky aktivujícího tromboxanu A2 (TXA2) patří k nejdéle užívaným strategiím tlumení primární hemostázy. V současné době užíváme pouze inhibitory syntézy TXA2 – čili blokátory cyklo-oxygenázy (COX). Receptorové blokátory TXA2 se neosvědčily. Ireverzibilní inhibicí syntézy na úrovni COX (preferenčně izoenzymu COX-1) působí ASA, v bezjaderném trombocytu nedochází k resyntéze nové COX-1. Farmakologický účinek nevratné blokády COX tak trvá na úrovni trombocytu po dobu jeho cirkulace, tj. asi týden. Při obnově asi 15 % destiček denně a při potřebě inhibovat více než 60 % trombocytů můžeme předpokládat, že protektivní účinek přetrvává asi dva dny, dávkovat ASA proto můžeme i obden. Pouze u stavů se zrychlenou výměnou trombocytů, např. při cukrovce, je třeba dodržet denní cyklus.
Nevýhodou ASA je inhibice COX jak v trombocytech, tak v endoteliích. Kvůli rychlé resyntéze COX-1 v endoteliích je tvorba prostacyklinu tangována jen krátce. Proto by hladina ASA měla přetrvávat v terapeutické hladině jen po krátkou dobu. Takové expozice je dosaženo při resorpci ASA v žaludku a proximálním duodenu, naopak pomalu se uvolňující tablety jsou méně výhodné. Aplikace malých dávek opakovaně či pomalu se resorbujících tablet není vhodná, prostacyklin je inhibován dlouho a snižuje se jeho vazoprotektivní funkce.
Druhým úskalím je resorpce ASA. Slabá hydrofilní kyselina, jakou je ASA, se resorbuje jen v nedisociovaném stavu, tj. při pH pod 3,5. Z těchto důvodů je aplikace enterosolventních tablet nevýhodná, doložena je nespolehlivá dostupnost a nedostatečná inhibice TXA2 u enterosolventních tablet různých výrobců [1]. Na druhé straně není doložen efekt enterosolventních tablet na pokles mortality//morbidity.
Podobně je problematické podávání ASA spolu s inhibitory protonové pumpy (IPP). Kvůli vzestupu pH nad 3,5 dochází k disociaci molekuly a resorpce je velmi nespolehlivá. Retrospektivní analýza dánského registru 20 tisíc nemocných léčených ASA (bez clopidogrelu) v rámci sekundární prevence ukázala, že u nemocných léčených IPP byl eliminován účinek ASA a výskyt KV mortality, iktu či infarktu myokardu se zvýšil o 46 %, HR 1,46 (1,33–1,61), p < 0,001 [2]. Nález bude nutno ověřit prospektivní kontrolovanou studií, nicméně naléhavé podezření nevhodnosti této kombinace existuje již nyní. Za snížení rizika krvácení do zažívacího traktu pravděpodobně platíme příliš vysokou daň – významnou ztrátu efektu.
Sekundární prevence, tj. podávání protidestičkové léčby u osob s přítomností choroby na bázi aterotrombózy, je hlavní doménou ASA. Tato indikace je podložena plejádou studií. Nejvýznamnější je poslední metaanalýza ATC, která zahrnula celkem 287 studií se 135 tisíci nemocných [3]. Protidestičková léčba (ve většině studií šlo o ASA) vedla ke snížení vaskulárních příhod o čtvrtinu, z toho výskyt nefatálních myokardiálních infarktů byl redukován o třetinu, nefatální cévní mozkové příhody více než o čtvrtinu a vaskulární mortalita klesla o šestinu. V podskupině nemocných zařazených na základě předchozí cerebrovaskulární příhody (CMP nebo TIA) snížila protidestičková léčba riziko recidivy iktu, infarktu myokardu nebo úmrtí z vaskulární příčiny o 22 % (obr. 3). Přínos léčby vyjádřený počtem léčených potřebných k zabránění příhody (number needed to treat – NNT) se v případě prevence iktu pohyboval kolem 55 léčených v průběhu roku léčby. Tento účinek byl nezávislý na pohlaví, věku, přítomnosti cukrovky nebo hypertenze. Námitky, že řada studií byla staršího data, a nesplňovaly tak dnešní nároky na kvalitu, řešila metaanalýza 16 novějších studií kontrolovaných placebem z roku 2009, která byla provedena stejnými pracovníky. Kyselina acetylsalicylová snížila riziko jakékoliv vaskulární příhody asi o pětinu (o 19 % redukovala riziko závažné cerebro - či kardiovaskulární příhody a o 22 % riziko ischemického iktu) [3,4]. Kromě pozitivního snížení rizika recidivy iktu je nesporný vliv ASA i na pokles ostatních kardiovaskulárních příhod.
Image 3. Pokles výskytu KV příhod při ASA podle ATC analýzy. 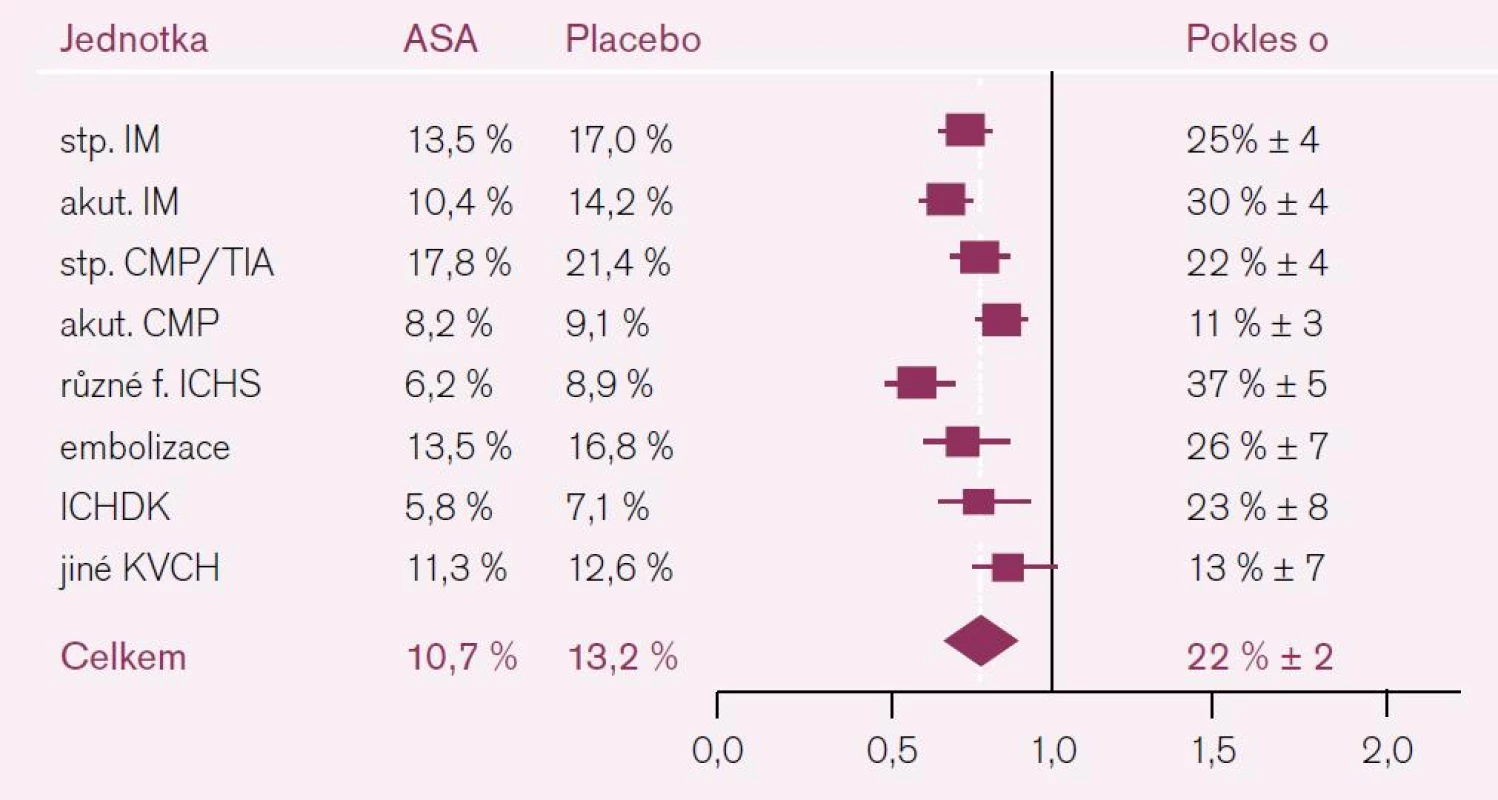
Obdobně působící triflusal, rovněž inhibitor COX-1, má proti ASA dvě výhody. První je slabší blokáda COX-1 v endoteliích. Druhou je skutečnost, že jeho efekt není snížen současným podáním IPP. Triflusal, který má rovněž dostatek dokladů o efektu v rámci sekundární prevence iktu, je užíván v řadě zemí Evropy a v USA [5]. Při srovnatelné účinnosti byl ve srovnání s ASA bezpečnější.
Účinek kyseliny acetylsalicylové byl též prověřován u nemocných s fibrilací či flutterem síní a s kontraindikací antikoagulační léčby, tedy jako alternativní postup. Efekt byl prověřován jak v monoterapii, tak v kombinaci ASA s clopidogrelem. Velké metaanalýzy i výsledky kontrolovaných studií doložily, že antikoagulační léčba je jednoznačně výhodnější. Pozorováno bylo snížení výskytu iktů při antikoagulační léčbě warfarinem téměř o polovinu proti léčbě protidestičkové ASA [6]. Větší efekt antikoagulační léčby je logický. Riziko tromboembolické příhody komplikující fibrilaci síní vychází z oblenění krevního proudu. Stagnace, společně s často přítomnou aktivací hemostázy, vyústí v aktivaci hemokoagulace, tedy sekundární hemostázy. Primární, destičková hemostáza se uplatňuje v procesu jen okrajově. Z těchto důvodů má podávání ASA malý význam a její přínos je spíše ve snížení výskytu příhod trombotických, nikoli iktů na podkladě embolizace. Vlastní riziko tromboembolické mozkové příhody se zvyšuje při přítomnosti faktorů zvyšujících trombogenní pohotovost – tedy s anamnézou již proběhlé mozkové příhody, s hypertenzí, s ischemickou chorobou srdeční, se srdečním selháním. Rovněž každá věková dekáda nad 60 let zvyšuje riziko asi o polovinu. K protidestičkové léčbě jsou pak indikováni pouze nemocní s fibrilací síní s žádným či pouze jedním z uvedených rizikových faktorů. Po proběhlé mozkové příhodě nebo při přítomnosti dvou či více faktorů má být preferována lege artis vedená léčba antikoagulační, optimálně novými perorálně účinnými antikoagulancii ze skupiny gatranů či xabanů.
U rizikových osob, kdy nelze podat antikoagulační léčbu (warfarinem či gatrany nebo xabany), můžeme monoterapii ASA nahradit duální léčbou – kombinací ASA s clopidogrelem. Při srovnání s warfarinem byla sice duální léčba o 42 % méně účinná (studie ACTIVE W), byla však o čtvrtinu – HR 0,72 (95% CI 0,62–0,83) – účinnější než monoterapie ASA (ACTIVE A) [7].
Shrneme-li, pak profylaxe vaskulárních příhod u nemocných po CMP je účinně redukována (asi o čtvrtinu) podáním acetylsalicylové kyseliny. Daní za pokles mortality/morbidity je mírný nárůst závažných krvácivých příhod, který se pohybuje kolem 1 % ročně. K léčbě volíme optimálně dávku ASA v rozmezí 75–100 mg denně ve formě tablet rozpustných v žaludku. Enterosolventní tablety jsou z farmakologického hlediska i z hlediska „medicíny založené na důkazech“ méně vhodné. V indikaci profylaxe tromboembolického iktu u nemocných s fibrilací síní a současně s vyšším rizikem příhody (CHADS2 skóre > 1) je léčba ASA (i v kombinaci s clopidogrelem) méně účinná než léčba antikoagulační.
Inhibice ADP cesty aktivace destiček
Receptory pro ADP typu P2Y12 na membráně trombocytu jsou důležitou cestou regulace aktivity primární hemostázy. Přirozeným antagonistou ADP, stejně jako tromboxanu A2,je prostacyklin (PGI2). Poměr ADP/PGI2 rozhoduje o aktivaci adenylát-cyklázy a tvorbě cyklického adenozin-monofosfátu (cAMP), klíčové signální molekuly inhibující expresi vazných receptorů IIb/IIIa (obr. 4). Stimulace receptorů P2Y12 aktivitu adenylát-cyklázy brzdí a nabídka cAMP stimuluje expresi výše zmíněných receptorů IIb/IIIa a umožňuje vlastní agregaci. Paralelně vede stimulace P2Y12 též k degranulaci destiček. Působením blokátorů ADP receptorů na dvou úrovních jim zajišťuje potenci v profylaxi aterotrombotických příhod. Klíčové místo – tj. stabilizující molekuly cAMP – můžeme ovlivnit též stimulací adenylát-cyklázy zvyšující její syntézu (dipyridamol) či zpomalením degradace cAMP inhibicí fosfodiesterázy-3 (cilostazol). Efekt obou léků v profylaxi CMP bude probrán samostatně.
Image 4. Místa působení protidestičkových léků tlumících aktivaci trombocytu zprostředkovanou ADP. 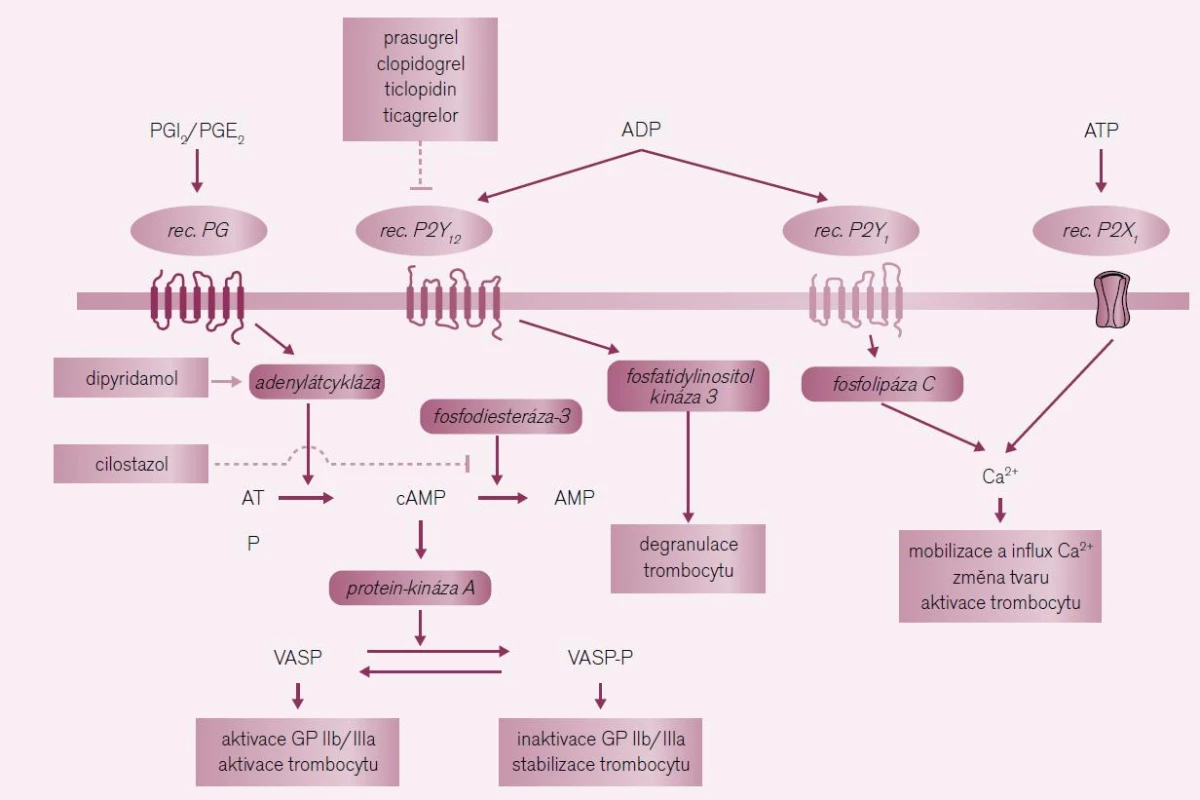
Inhibitorů receptorů P2Y12 pro ADP máme sice více, k profylaxi recidivy vaskulárních příhod u nemocných po aterotrombotické ischemické mozkové příhodě je však uvolněn pouze clopidogrel a ticlopidin jako alternativa acetylsalicylové kyseliny. Při fibrilaci síní k profylaxi tromboembolické mozkové příhody při nemožnosti aplikovat antikoagulační léčbu máme data o příznivém efektu též pro clopidogrel v kombinaci s ASA. Ireverzibilní blokátor ADP receptorů s výhodnější farmakokinetikou – prasugrel či reverzibilní inhibitor ticagrelor – k sekundární prevenci iktů indikovány zatím nejsou. Vzhledem k tomu, že od užívání ticlopidinu je zřetelný ústup pro jeho nižší bezpečnost, zůstává jako hlavní představitel skupiny clopidogrel. Účinek tohoto ireverzibilního blokátoru ADP receptorů byl v indikaci profylaxe mozkových příhod prověřován jak v monoterapii proti ASA, tak v kombinaci s ASA.
Největší studií prověřující efekt monoterapie clopidogrelem proti ASA byla studie CAPRIE v indikaci sekundární prevence [8]. Ve třech podskupinách po téměř osmi tisících nemocných po infarktu myokardu, po iktu či s ICHDK byl prověřován efekt obou antiagregancií na pokles KV mortality a morbidity. V podskupinách po iktu či infarktu byl efekt léčby obou léčiv srovnatelný, u nejrizikovější skupiny, tj. s periferní aterosklerózou, byl efekt clopidogrelu větší. Clopidogrel je tak v profylaxi trombotických komplikací po překonané mozkové příhodě stejně účinný a stejně bezpečný jako ASA, může být proto s výhodou užit při nesnášenlivosti či kontraindikaci kyseliny acetylsalicylové. Vzhledem k srovnatelnému riziku krvácivých komplikací ASA a clopidogrelu, není indikací vyšší hemoragické riziko či anamnéza krvácení či vředové choroby. Při možnosti podat ASA je clopidogrel vzhledem k vyšším nákladům na léčbu méně výhodný, účinnost a bezpečnost jsou stejné.
Ve studii CAPRIE byla porovnávána dvojí strategie protidestičkové léčby v monoterapii. Jaké však je postavení duální protidestičkové léčby, tedy kombinace ASA s clopidogrelem v sekundární prevenci mozkových příhod? Na základě výsledku studie MATCH provedené s kombinací clopidogrel s ASA proti monoterapii ASA u rizikových nemocných po překonané mozkové příhodě bylo snížení rizika vzniku významné vaskulární příhody (o absolutní 1 %) zcela eliminováno stejným nárůstem závažných krvácivých příhod [9]. Nález byl ověřen též výsledkem studie CHARISMA, kde v podskupině nemocných po cerebrovaskulární příhodě nebyl doložen pozitivní účinek na pokles aterotrombotických příhod, absolutní pokles byl dokonce jen 0,5 %. Také zde nárůst krvácivých, zejména non-cerebrálních příhod převýšil přínos léčby [10]. Třetí studií z této řady, která byla recentně publikována, je studie SPS3 [22]. V ní byl porovnáván efekt ASA a duální léčby ASA s clopidogrelem v indikaci profylaxe recidivy iktu u nemocných s dokumentovaným lakunárním iktem při postižení drobných mozkových tepen. Ani v této studii se neukázala duální léčba přinosem: nepoklesl výskyt recidiv všech mozkových příhod, ischemických či závažných příhod, naopak zdvojnásobil se výskyt významných krvácivých příhod (absolutní nárůst o 1,1 %). Na základě těchto studií můžeme konstatovat, že duální protidestičková léčba zmíněnou kombinací u nemocných po překonaném iktu či tranzitorní ischemii indikována není.
Podobně jako při léčbě ASA, též u clopidogrelu se setkáváme s interindividuálními rozdíly v účinku, v případě clopidogrelu je však diference větší. Čtvrtina až třetina nemocných nereaguje na clopidogrel optimálně, či je dokonce k léčbě rezistentní. Naopak menší část léčených reaguje nadměrně. U první skupiny je zvýšeno riziko trombózy, u druhé se naopak setkáme s častějším krvácením. Podkladem rozdílů je variabilita resorpce clopidogrelu při polymorfizmu efluxní pumpy glykoproteinu P a variabilita bioaktivace zejména při farmakogenetických rozdílech na úrovni izoenzymu CYP2C19. Farmakologický efekt též snižuje inhibice oxidázy CYP2C19, např. při komedikaci s inhibitory protonové pumpy. Tyto nevýhody, stejně jako relativně pomalý nástup účinku, vedly k vývoji spolehlivějšího ireverzibilního blokátoru – prasugrelu; potřeba rychlejší obnovy destičkových funkcí pak k vývoji reverzibilního blokátoru – ticagreloru.
Shrneme-li, pak v sekundární prevenci iktu či v prevenci mozkové příhody u nemocných s kardiovaskulárním postižením zůstává monoterapie clopidogrelem pro případ, že nelze podat kyselinu acetylsalicylovou. Duální protidestičková léčba kombinací ASA s clopidogrelem indikována není pro relativně nevelký přídatný efekt druhého antitrombotica, který je převýšen nárůstem závažných hemoragických příhod. Nové a účinnější inhibitory trombocytárních ADP receptorů – prasugrel a ticagrelor – nemají v indikaci profylaxe mozkových příhod ještě data, řada studií sledujících efekt za různých terapeutických podmínek však běží a dá se předpokládat, že i v této indikaci najdou uplatnění.
Stabilizace destiček zvýšením nabídky cAMP a cGMP
Zvýšení nabídky cAMP a cGMP v trombocytu snižuje odpověď na stimulaci různými podněty, tedy dochází ke stabilizaci destiček. Zvýšení nabídky cyklického adenozin-monofosfátu (cAMP) a cyklického guanozin-monofosfátu (cGMP) můžeme dosáhnout různými způsoby – jak stimulací syntézy, tak inhibicí degradace (obr. 4). Přirozeným aktivátorem syntézy je prostacyklin, ten nejen blokuje efekt ADP, ale také TXA2. Zvýšená nabídka cAMP tlumí expresi vazebných receptorů IIb/IIIa, zatímco vyšší koncentrace cGMP v trombocytu inhibuje aktivitu tromboxan-syntázy se snížením tvorby proagregačně působícího tromboxanu A2. Stimulaci cGMP farmakologicky prakticky nevyužíváme, byť jsou doklady, že donátor NO – molsihexal – nabídku cGMP zvyšuje. Klinický efekt je nejasný. Naopak zvýšení nabídky cAMP využíváme terapeuticky často, účinku blokátorů ADP receptorů byla věnována předchozí stať. Aktivaci adenylát-cyklázy zvyšuje dipyridamol, starší hypotéza, že efekt je zprostředkován inhibicí degradujícího enzymu – fosfodiesterázy, se nepotvrdila. Naopak účinným blokátorem destičkového izoenzymu fosfodiesterázy-3 je cilostazol. Oba léky mají doložený příznivý efekt v sekundární prevenci mozkových příhod.
Efekt dipyridamolu v indikaci sekundární prevence iktu byl prověřován ve studii ESPS-2 [11]. Tato studie provedená u nemocných s recentní TIA nebo CMP porovnávala efekt fixní kombinace dvakrát denně aplikovaných 200 mg dipyridamolu s 25 mg ASA a jednotlivých složek zvlášť, vše proti placebu. Významné snížení rizika rekurence CMP bylo pozorováno u obou monoterapií (pokles o 18 % při ASA, o 16 % při dipyridamolu), ale ještě významněji (pokles o 37 %) při jejich kombinaci, proti placebu. Závěry této studie však nejsou validní, účinek dávky 25 mg ASA, byť podávané dvakrát denně, je nespolehlivý, řada studií dokumentuje nedostatečnou inhibici TXA2 při aplikaci dávek 30 mg a nižších [12].
Vzhledem k tomu, že ke studii byla vznesena řada výhrad, zejména týkajících se nestandardní dávky ASA, byl efekt ověřován v obdobné studii – ESPRIT [13]. V této studii byly již užity pro srovnání nízké i vyšší dávky ASA, medián byl 75 mg. Vlastní efekt výše uvedené fixní kombinace dipyridamolu/ASA po téměř čtyřleté léčbě doložil signifikantní pokles kombinovaného ukazatele (mortality z vaskulárních příčin, nefatálních iktů a infarktů myokardu a většího krvácení) o 19 % proti monoterapii ASA (13 % proti 16 %), efekt se objevil po dvou letech léčby. Překvapivě největší podíl na poklesu tohoto kombinovaného ukazatele měl nižší výskyt závažného krvácení ve skupině léčené ASA. Jednotlivé ukazatele efektu – celková mortalita, KV mortalita, velké KV příhody (MACE), veškeré cévní příhody – nebyly významně ovlivněny. Slabinou studie byl její otevřený charakter a velké procento, tj. více než třetina nemocných, kteří léčbu fixní kombinací přerušili. Nelze tak brát závěry studie za jednoznačné, rozhodně studie nepotvrzuje jednoznačnou výhodnost fixní kombinace dipyridamol/ASA dokonce ani v situacích, kdy by teoreticky měl být efekt největší, tj. v sekundární prevenci po tranzitorních ischemiích [14].
Vzhledem k nejistotě dané rozpornými výsledky několika desítek studií s dipyridamolem v indikaci prevence mozkových příhod, byl proveden Cochraneovým institutem rozbor dostupných dat. Do analýzy bylo zařazeno 29 studií provedených u 23 tisíc účastníků v kontrolovaných studiích srovnávajících efekt dipyridamolu, efekt ASA a efekt jejich kombinace. Při sledování kardiovaskulární mortality nebyl pozorován žádný účinek dipyridamolu (samotného či přidaného do kombinace s ASA), efekt nebyl ovlivněn ani typem základního aterosklerotického postižení ani dávkou dipyridamolu. Při analýze účinku na cévní komplikace však byl doložen významný pokles výskytu všech závažných cerebroi kardiovaskulárních příhod o 12 %, při analýze typů příhod se ukázalo, že jediným významným přínosem byl snížený výskyt iktu a tranzitorních atak [15]. Metaanalýza tak doložila významný pokles cerebrovaskulárních příhod, nikoli však ischemických komplikací v jiné lokalizaci.
K podání uceleného obrazu o významu dipyridamolu ve fixní kombinaci s ASA (200 mg + 25 mg) v sekundární prevenci mozkových příhod je nutno uvést také jeho srovnání s clopidogrelem. Jak bylo ukázáno na výsledcích studie CAPRIE, monoterapie clopidogrelem je stejně účinná v prevenci recidivy iktu jako lege artis podávaná kyselina acetylsalicylová. Srovnání fixní kombinace dipyridamolu/ASA (ve výše uvedeném dávkování) s obvyklou dávkou clopidogrelu v sekundární prevenci mozkových příhod se věnovala studie PRoFESS, jedna z největších studií sekundární prevence CMP (> 20 tisíc nemocných) dosud. Nebyl nalezen jakýkoliv rozdíl v obou léčebných větvích ve výskytu fatálních nebo nefatálních iktů ani v sekundárních ukazatelích. Rekurence iktu se vyskytla u 9 % nemocných na kombinaci protidestičkových léků proti 8,8 % při monoterapii clopidogrelem. Nemocní léčení fixní kombinací dipyridamol//ASA měli více velkých hemoragických komplikací (4,1 % proti 3,6 %) i mozkových krvácení [16,17]. Studie tak doložila, že fixní kombinace dipyridamol s ASA je v sekundární prevenci stejně účinná jako monoterapie clopidogrelem, je však zatížena mírně vyšší incidencí významných krvácivých příhod.
Dalším lékem s protidestičkovým působením na bázi zvýšení nabídky cAMP je inhibitor fosfodiesterázy-3 cilostazol. Tento lék, primárně užívaný k léčbě klaudikací, bohužel není dostupný v ČR, nicméně jsou zprávy, že jeho zavedení připravuje již několik firem. Indikace cilostazolu v sekundární prevenci iktů je postavena na studii CSPS u japonských nemocných, kde redukoval riziko recidivy příhody o 42 % oproti placebu [18]. I v následné studii CSPS II u nemocných s recentním non-embolickým iktem byla prokázána non-inferiorita cilostazolu ve srovnání s ASA (rekurence iktů po 29 měsících 2,7 % a 3,7 %) [19]. V čínské studii CASISP sice došlo také ke snížení počtu iktů oproti ASA (3,3 % proti 5,6 %), nebylo však dosaženo statistické významnosti [20]. Studie s užitím duální protidestičkové léčby, kdy by jedna složka byla cilostazol, zatím nemáme.
Blokáda primární hemostázy v prevenci cévních mozkových příhod – srovnání strategií
Souhrnně lze konstatovat, že v prevenci ischemických neembolizačních mozkových příhod je doložena srovnatelná účinnost jak acetylsalicylové kyseliny, tak clopidogrelu, od monoterapie jedním z obou léků lze očekávat snížení příhody o 20–25 %.
O něco účinnější než monoterapie nízkou dávkou ASA – pouze však v prevenci recidivy příhody – je pravděpodobně kombinace ASA s dipyridamolem. Proti podávání nízké dávky ASA lze při fixní kombinaci (dvakrát denně ASA 25 mg a dipyridamol 200 mg denně) očekávat snížení příhod o dalších 10–20 %. Srovnání účinku kombinace se standardní dávkou ASA lze jen obtížně interpretovat, jediná studie (ESPRIT) byla otevřená a neúměrně velká ztráta nemocných z léčby činí závěry nespolehlivými. Na druhé straně nebyl prokázán rozdíl v efektu mezi clopidogrelem a výše uvedenou fixní kombinací ASA a dipyridamolu. Máme tak paradox – stejný efekt kombinace dipyridamol/ASA s clopidogrelem, stejný efekt clopidogrelu se standardní dávkou ASA a větší efekt kombinace dipyridamol/ASA proti nízké dávce ASA a ne zcela jednoznačný nález většího účinku této kombinace proti standardní dávce ASA. Chybí jen srovnání účinku malé (pravděpodobně subterapeutické dávky ASA) a standardní dávky ASA. Definitivní místo fixní kombinace dipyridamol/ASA bude nutno ještě ověřit.
Volba mezi těmito třemi léčebnými přístupy sekundární prevence cévních mozkových příhod závisí zejména na toleranci nemocného, kontraindikacích a ekonomických možnostech. V léčbě kyselinou acetylsalicylovou je optimální podávání udržovací dávky 75–100 mg denně, resp. při snížené toleranci a nižším riziku obden (se zahajovací dávkou u akutní příhody 150–200 mg), u clopidogrelu je doporučena udržovací dávka 75 mg denně (a zahajovací u akutní příhody 300–600 mg), pro kombinaci ASA s dipyridamolem je dávka dána jejich množstvím v přípravku Aggrenox (25 mg ASA a 200 mg dipyridamolu), aplikuje se dvakrát denně. Zda je dávka 25 mg ASA dostatečná v sekundární prevenci příhod kardiovaskulárních, není doloženo. Uvědomíme-li si, že aterosklerotické postižení v mozkové oblasti bývá zpravidla provázeno též postižením v jiném povodí, pak nelze než doporučit doplnit léčbu Aggrenoxem u nemocných (např. s ICHS či s ICHDK) o ASA ve standardní dávce 75–100 mg. Cilostazol zatím v ČR dostupný není, nicméně po jeho zavedení bude jedním z léků volby. Dále lze očekávat výsledky studií s novými blokátory ADP receptorů se spolehlivějším účinkem – ticagrelorem a prasugrelem.
V současné době máme doklady o tom, že od sekundární prevence u jednoho tisíce nemocných po mozkové příhodě lze při léčbě standardními dávkami ASA po dobu dvou let očekávat zabránění pěti úmrtím, 25 mozkovým příhodám a šesti infarktům. Daní bude nárůst významných krvácivých příhod o sedm u stejného počtu léčených po stejnou dobu [21]. Alternativní léčba kombinací nízké dávky ASA s dipyridamolem přinese ve srovnání s léčbou suboptimální dávkou ASA navíc zabránění 24 mozkovým příhodám, mortalita ani výskyt kardiovaskulárních příhod ovlivněny nebudou. Od léčby clopidogrelem lze očekávat stejný efekt jako od léčby optimální dávkou ASA či kombinací nízké dávky ASA s dipyridamolem.
Doručeno do redakce 7. 8. 2012
Přijato po recenzi 29. 8. 2012
prof. MUDr. Jan Bultas, CSc.1
doc. MUDr. Debora Karetová, CSc.2
1 Farmakologický ústav 3. LF UK v Praze
2 II. interní klinika kardiologie a angiologie 1. LF UK a VFN Praha
jan.bultas@lf3.cuni.cz
Sources
1. Cox D, Maree AO, Dooley M et al. Effect of enteric coating on antiplatelet activity of low-dose aspirin in healthy volunteers. Stroke 2006; 37 : 2153–2158.
2. Charlot M, Grove EL, Hansen PR et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690.
3. Baigent C, Blackwell L, Collins R et al. Antithrombotic Trialists‘ (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373 : 1849–1860.
4. Gubitz G, Counsell C, Sandercock P et al. Anticoagulants for acute ischaemic stroke. Cochrane Database Syst Rev 2000; (2): CD000024.
5. Costa J, Ferro JM, Matias-Guiu J et al. Triflusal for preventing serious vascular events in people at high risk. Cochrane Database Syst Rev 2005; 3: CD004296.
6. Hart RC, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146 : 857–867.
7. Connolly S, Pogue J, Hart R et al. ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367 : 1903–1912.
8. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348 : 1329–1339.
9. Diener HC, Bogousslavsky J, Brass LM et al. MATCH Investigators. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo--controlled trial. Lancet 2004; 364 : 331–337.
10. Bhatt DL, Fox KA, Hacke W et al. CHARISMA Investigators. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354 : 1706–1717.
11. Diener HC, Cunha L, Forbes C et al. European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143 : 1–13.
12. Rocca B, Petrucci G. Variability in the responsiveness to low-dose aspirin: pharmacological and disease-related mechanisms. Thrombosis 2012; 2012 : 376721.
13. Halkes PH, van Gijn J, Kappelle LJ et al. ESPRIT Study Group. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367 : 1665–1673.
14. Tirschwell D. Aspirin plus dipyridamole was more effective than aspirin alone for preventing vascular events after minor cerebral ischemia. ACP J Club 2006; 145 : 57.
15. De Schryver EL, Algra A, van Gijn J. Dipyridamole for preventing stroke and other vascular events in patients with vascular disease. Cochrane Database Syst Rev 2007; 3: CD001820.
16. Sacco RL, Diener HC, Yusuf S et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008; 359 : 1238–1251.
17. Schneck MJ. Understanding the PRoFESS Study for Secondary Stroke Prevention. Curr Treat Options Cardiovasc Med 2009; 11 : 221–231.
18. Matsumoto M. Cilostazol in secondary prevention of stroke: impact of the Cilostazol Stroke Prevention Study. Atheroscler Suppl 2005; 6 : 33–40.
19. Shinohara Y, Katayama Y, Uchiyama S et al. Cilostazol for prevention of secondary stroke (CSPS 2): an aspirin-controlled, double-blind, randomised non-inferiority trial. Lancet Neurol 2010; 9 : 959–968.
20. Huang Y, Cheng Y, Wu J et al. Cilostazol as an alternative to aspirin after ischaemic stroke: a randomised, double-blind, pilot study. Lancet Neurol 2008; 7 : 494–499.
21. Lansberg MG, O’Donnell MJ, Khatri P et al. Antithrombotic and thrombolytic therapy for ischemic stroke: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2): e601S–e636S.
22. SPS3 Investigators. Benavente OR, Hart RG, McClure LA et al. Effects of clopidogrel added to aspirin in patients with recent lacunar stroke. N Engl J Med 2012; 367 : 817–825.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 3-
All articles in this issue
- Antidiabetika a kardiovaskulární riziko – dříve a nyní
- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Reziduální vaskulární riziko a možnosti jeho ovlivnění
- Zítřky lipidy modifikující terapie – jaké budou?
- Náhlá smrt v kardiologii
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
- Léčba levosimendanem: up-date 2012
- Ticagrelor u pacientů s akutním koronárním syndromem
-
Antitrombotica v prevenci cévní mozkové příhody
1. část – Význam protidestičkové léčby - Renální denervace a její postavení v léčbě rezistentní hypertenze
- Mitrální stenóza v terminální fázi – kazuistika
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Ticagrelor u pacientů s akutním koronárním syndromem
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

