-
Medical journals
- Career
Rehabilitace nemocných s ischemickou chorobou srdeční
: V. Chaloupka
: IKK FN Brno-Bohunice
: Kardiol Rev Int Med 2009, 11(2): 58-62
Rehabilitace představuje neoddělitelnou součást komplexní léčby nemocných s ischemickou chorobou srdeční. Jedním z hlavních cílů rehabilitace je umožnit nemocným návrat k pracovním a rekreačním aktivitám v maximálním rozsahu, jak jen je to možné. Základem pohybové aktivity je aerobní trénink, ale běžnou součástí tréninku je i rezistenční cvičení. Zpočátku se zájem koncentroval na pacienty po IM a revaskularizačních zákrocích. Rehabilitace u těchto osob se v řadě zemí stala nedílnou součástí komplexní péče. Nedávná meta‑analýza ukázala významné 27% snížení celkové a 31% snížení kardiovaskulární mortality. Postupně se ale zájem koncentruje i na ostatní skupiny nemocných: starší nemocné s řadou dalších patologií, což je vzhledem ke stárnutí populace velice důležité, na nemocné po operaci srdečních vad a také na vysoce rizikové skupiny včetně nemocných se srdečním selháním. Jsou to právě tito pacienti, kteří mohou nejvíce profitovat ze zlepšení zátěžové tolerance a zlepšení aerobní kapacity. Mechanizmy, kterými fyzická aktivita a zdatnost snižují mortalitu, nejsou zcela jasné. Jsou samozřejmě spojené s redukcí rizikových faktorů. Efekt fyzické zátěže se ale uplatňuje jako nezávislý faktor snížení mortality.
Klíčová slova:
rehabilitace – ischemická choroba srdeční – srdeční selhání – infarkt myokardu – kardiovaskulární mortalitaÚvod
Moderní koncepci rehabilitace vytyčili Hellerstein a Ford, kteří definovali základní fáze rehabilitace – hospitalizační, časnou posthospitalizační, zotavení a návratu do práce. Současně poukázali na nutnost komplexního přístupu k nemocnému. Postupně přibývalo důkazů o prospěšnosti a bezpečnosti časné mobilizace nemocných s infarktem myokardu (IM). I když s obtížemi, moderní názory se prosazovaly [1].
Časná mobilizace nemocných s IM představuje sice základní, ale pouze první část složitého procesu rehabilitace. Po ukončení hospitalizace je optimální pokračovat v rehabilitaci co nejdříve po propuštění. Tato fáze je považována za rozhodující pro navození potřebných změn životního stylu a dodržování zásad sekundární prevence.
V roce 1993 definovala Světová zdravotnická organizace (World Health Organization – WHO) srdeční rehabilitaci jako „Souhrn aktivit, pomocí kterých se u nemocných se srdečními chorobami snažíme navrátit a udržovat jejich optimální fyzický, psychický a sociální stav.“ Nemocní se srdečními chorobami tak mohou „vlastním úsilím znovu získat svoji pozici ve společnosti a vést aktivní život“ [2].
Jedná se o komplexní přístup k nemocnému, který nezahrnuje pouze fyzickou aktivitu, ale jehož součástí je i prosazování zásad sekundární prevence a ostatních složek změny životního stylu. Stále větší důraz se klade na individuální přístup s přihlédnutím k pacientovým potřebám a jeho rodinnému zázemí.
Cílová populace
Zpočátku se zájem koncentroval na pacienty po IM a revaskularizačních zákrocích. Rehabilitace u těchto osob se v řadě zemí stala nedílnou součástí komplexní péče. Nedávná meta analýza ukázala významné 27% snížení celkové a 31% snížení kardiovaskulární mortality [3]. Postupně se ale zájem koncentruje i na ostatní skupiny nemocných: starší nemocné s řadou dalších patologií, což je vzhledem ke stárnutí populace velice důležité, na nemocné po operaci srdečních vad a také na vysoce rizikové skupiny včetně nemocných se srdečním selháním. Jsou to právě tito pacienti, kteří mohou nejvíce profitovat ze zlepšení zátěžové tolerance a zlepšení aerobní kapacity.
Problematice rehabilitace se v poslední době věnuje i u nás velká pozornost, bohužel často pouze na teoretické bázi. Pracovní skupina (PS) kardiovaskulární rehabilitace České kardiologické společnosti vypracovala první doporučené postupy krátce po svém vzniku v roce 1997. Věnovala se pouze nemocným po infarktu myokardu a lázeňské léčbě. V roce 2006 se výbor PS rozhodl guidelines inovovat a také rozšířit o další skupiny s kardiovaskulárním onemocněním, včetně nemocných se srdečním selháním [4].
Cvičení a jeho vliv na rizikové faktory
Mechanizmy, kterými fyzická aktivita a zdatnost snižují mortalitu, nejsou stále zcela jasné. Jsou samozřejmě spojené s redukcí rizikových faktorů. Efekt fyzické zátěže však nemůže být vysvětlován pouze redukcí rizikových faktorů, protože se uplatňuje jako nezávislý faktor snížení mortality [5].
Fyzická aktivita omezuje riziko vzniku hypertenze. U nemocných s lehkou hypertenzí snižuje dynamická aktivita krevní tlak na 8–12 hod po cvičení a průměrný tlak je nižší ve dnech cvičení než ve dnech bez cvičení [6].
Pozitivní vliv tréninku byl pozorován též na sacharidový metabolizmus. Zahrnuje zvýšenou senzitivitu k inzulinu, sníženou produkci glukózy v játrech, větší počet buněk utilizujících glukózu a redukci obezity. Snížení hmotnosti lze dosáhnout pravidelným cvičením, ale pravděpodobně pouze se současným dietním opatřením [7].
Výsledky studií posuzující vliv cvičení na lipidový metabolizmus se často velmi liší, což je samozřejmě dané odlišnými přístupy, ale i současným ovlivněním dietou nebo farmakologicky. Meta analýza 95 studií, z nichž většina nebyla randomizovaná, uzavírá, že cvičení vede ke snížení celkového cholesterolu o 6,3%, o 10,1% u LDL, snížení poměru celkový cholesterol/HDL o 13,4% a zvýšení HDL cholesterolu o 5% [8]. Zdá se, že tréninková intenzita nezbytná k ovlivnění lipidů nemusí být tak vysoká jako k zlepšení kondice, protože se ukazuje, že HDL se zvyšuje již při nižších intenzitách cvičení. Nedávno byl sledován efekt intenzivní zátěže na HDL cholesterol u žen běžkyň [9]. Hladina HDL stoupala se zvyšující se zátěží a pokračovala dokonce i u žen, které běhaly více než 64km týdně. I když většina studií prokazuje pouze mírně příznivý vliv cvičení na hodnoty lipidů, může mít i tato skutečnost pozitivní dopad na ovlivnění kardiovaskulárního rizika.
Cvičení příznivě ovlivňuje fibrinolytický systém. Namáhavý vytrvalostní trénink po dobu šesti měsíců u zdravých starších mužů měl příznivý vliv na hemostatické ukazatele. Došlo ke snížení plazmatické hladiny fibrinogenu o 13%, zvýšení tkáňového plazmatického aktivátoru o 39%, zvýšení aktivního plazmatického aktivátoru o 141% a snížení inhibitoru plazmatického aktivátoru 1 o 58% [10]. Další studie ukázaly příznivý vliv fyzického tréninku na fibrinolytické enzymy u mladých osob i u nemocných po infarktu myokardu. Krátkodobý i dlouhodobý trénink ovlivňují také aktivitu destiček. Aktivace destiček hraje důležitou roli v patofyziologickém mechanizmu koronární trombózy. Po akutní namáhavé zátěži zhruba stejné intenzity a trvání byla aktivace destiček zvýšená u osob se sedavým způsobem života, ale neměnila se u fyzicky trénovaných osob. Po 12 týdnech tréninku přiměřené intenzity u mužů středního věku s nadváhou a mírnou hypertenzí došlo k poklesu sekundární agregace destiček o 52% oproti 17% u kontrolní skupiny [11]. Ukazuje se, že akutní zátěž může vést ke zvýšené aktivitě destiček, zvlášť u osob se sedavým způsobem života, ale pravidelné cvičení ruší nebo mírní tento efekt.
Pravidelné cvičení zlepšuje funkci endotelu. Ve studii s mladými rekruty a nemocnými se srdečním selháním došlo po fyzickém tréninku ke zlepšení vazodilatace závislé na oxidu dusnatém [12].
Rovnováha mezi sympatickou a parasympatickou aktivitou má vliv na kardiovaskulární funkci. Zvýšená aktivita sympatiku je spojena se zvýšeným rizikem srdečních příhod, zvlášť u nemocných s prokázanou ICHS. Pomocí měření variability srdečního rytmu byla zjištěna vyšší parasympatická aktivita fyzicky trénovaných osob ve srovnání s netrénovanými. Zda fyzický trénink příznivě ovlivňuje tonus autonomního nervstva, není jasné. Změny variability srdečního rytmu však byly pozorovány u nemocných po infarktu myokardu i se srdečním selháním ve spojitosti s fyzickým tréninkem [13]. Změny variability byly popsány i u nemocných s chronickou ischemickou chorobou srdeční a reverzibilní ischemií myokardu prokázanou metodou fotonové emisní počítačové tomografie – SPECT [14].
Fyzický trénink u osob se srdečním onemocněním
Pravidelný vytrvalostní a silový trénink přinášejí charakteristické změny, které vedou ke zlepšení funkční kapacity a síly. Tyto změny nazýváme tréninkovým efektem a dovolují dosáhnout vyššího fyzického zatížení s nižší frekvenční odpovědí. Fyzický trénink střední intenzity 3–5krát týdně vede k zřetelnému zlepšení tělesné kondice již po 8–10 týdnech jak u nemocných se srdečním onemocněním, tak u zdravých.
Některé studie ukázaly ústup ischemické odpovědi, např. anginy pectoris, ST depresí nebo i ústup perfuzních defektů při určité hodnotě dvojproduktu po fyzickém tréninku ve srovnání s předtréninkovým stavem. Někteří autoři zjistili zlepšení kontraktility dysfunkčních segmentů myokardu po tréninku. Tyto nálezy svědčí pro zlepšení dodávky kyslíku myokardu a k vysvětlení se nabízí několik mechanizmů. Vytrvalostní trénink vedl v experimentu k rozšíření epikardiálních koronárních artérií a zvýšené denzitě myokardiálních kapilár. Nejednoznačné jsou nálezy týkající se zmnožení kolaterál. Byla rovněž prokázána regrese aterosklerotických změn koronárních tepen u nemocných zapojených do multifaktoriální redukce rizikových faktorů, které zahrnují i tělesný trénink [15]. Udává se, že vytrvalostní trénink s výdejem více než 2 000 kcal týdně může vést k regresi angiografických změn ICHS [16]. Výdej kolem 2 000 kcal týdně představuje např. hodinová chůze rychlostí 6km/h šestkrát týdně nebo hodinová jízda na kole rychlostí 20km/hod třikrát týdně.
Zlepšená perfuze myokardu může být následkem změn koronární vazomotorické reaktivity. Zdá se, že příznivý vliv cvičení na myokardiální perfuzi přináší klinický prospěch, včetně snížení kardiogenních komplikací.
Doba, za kterou můžeme výše popsané změny očekávat, je samozřejmě různá pro jednotlivé ukazatele. Zlepšení funkční kapacity a myokardiální perfuze se popisuje od 8. týdne po zahájení fyzického tréninku. Na druhé straně, regrese aterosklerotických změn byla pozorována po roce tréninku.
Fyziologický efekt pravidelného cvičení
Z kardiologického hlediska má pravidelný fyzický trénink přímý i nepřímý vliv na kardiovaskulární systém, přičemž oba tyto vlivy mohou zlepšit funkční kapacitu organizmu a snížit pravděpodobnost srdečních komplikací. Nepřímý vliv zahrnuje především redukci rizikových faktorů, posílení svalstva a určité změny životního stylu. Přímé vlivy pak představují snížení klidové i zátěžové frekvence, snížení krevního tlaku, zvýšení periferního žilního tonu, zlepšení kontraktility myokardu. Možné je i zvýšení koronárního průtoku a zvýšení fibrilačního prahu (tab. 1).
1. Vlivy pravidelného cvičení na organizmus. 
Tréninkem navozené snížení tepové frekvence je nejnápadnější projev pravidelné fyzické aktivity. Měření klidového pulzu představuje jednoduchý ukazatel odpovědi na trénink. Tato reakce v sobě zahrnuje změnu autonomní rovnováhy a zvýšení tepového objemu. Zvýšená aktivita parasympatiku je pravděpodobně důsledkem změny reakce arteriálních baroreceptorů [17–18]. Může se též jednat o sníženou reaktivitu beta-adrenergních receptorů v myokardu. Tréninková aktivita vede současně k snížení zátěžové tepové frekvence, což má za následek zvýšení srdeční rezervy a funkční kapacity, pokles dvojproduktu s následným omezením provokace ischemie a také prodloužení diastolické fáze srdečního cyklu se zlepšením prokrvení myokardu.
Klidové, ale i zátěžové hodnoty krevního tlaku se při určitých stupních zátěže v důsledku tréninku snižují. Dotížení levé komory je nižší, což může vést k zvýšení tepového objemu a ejekční frakce. Navíc nižší hodnoty krevního tlaku při určité zátěži také vedou k snížení dvojproduktu a snížení rizika ischemie.
Fyzický trénink vede ke zvýšení periferního žilního tonu. Zvyšuje se centrální krevní objem a tím předtížení levé komory. Tepový objem je vyšší a pravděpodobnost hypotenze po intenzivnější zátěži se snižuje. Ischemická ST deprese a komorová fibrilace mohou být provokovány náhlým poklesem tlaku na konci zátěže. Zvýšení žilního tonu může přispět k limitaci tohoto problému, ale základním opatřením je zařazení relaxační části (cool down) vždy na závěr cvičení. Ta je nejlepší prevencí poklesu tlaku i arytmií.
Zvýšení objemu krevní plazmy je časnou odpovědí na fyzický trénink, pravděpodobně zprostředkovanou renin angiotenzinovým systémem. U trénovaných jedinců dochází k zvýšení předtížení se zvýšením tepového objemu. Současně ale může dojít k snížení množství hemoglobinu na objemovou jednotku, množství kyslíku na litr minutového objemu se tedy nemění [19].
V průběhu tréninku dochází i k zlepšení kontraktility srdečního svalu. To přispívá k zvýšení tepového objemu. Zvýšená kontraktilita sice zvyšuje spotřebu kyslíku v myokardu, dochází ale k snížení tenze stěny levé komory, a tím k zlepšení perfuze myokardu.
Fyzický trénink zvyšuje tepový objem zhruba o 20% jak v klidu, tak při zátěži. Jak již bylo zmíněno, tento mechanizmus zahrnuje zvýšení předtížení (způsobené zvýšením periferního žilního tonu a zvýšením objemu plazmy) a snížení dotížení (snížení krevního tlaku a zesílení kosterního svalstva). Dochází též k zlepšení kontraktility.
U nemocných s kompenzovaným srdečním selháním s těžkým postižením funkce levé komory oddaluje fyzický trénink začátek anaerobního metabolizmu a může vést k zlepšení endoteliální funkce. Fyzická aktivita také zvyšuje aktivitu oxidativních enzymů v kosterním svalstvu. Je pravděpodobné, že u nemocných s nízkou ejekční frakcí fyzický trénink zlepšuje prognózu. Potenciálně ochranný efekt se dává do vztahu se změnou autonomního nervového systému. Zlepšení fyzického výkonu však trvá pouze po dobu provádění cvičení. U krátkodobých tréninkových programů funkční zlepšení mizí po třítýdenní inaktivitě [20].
Rehabilitace nemocných po infarktu myokardu
Rehabilitační proces se zpravidla dělí na čtyři fáze. První je fáze nemocniční. Ta se za poslední roky změnila zásadně. Vzhledem k invazivní léčbě je hospitalizace velmi krátká a nemocného lze připravit pouze na propuštění.
Před propuštěním by měl být nemocný poučen alespoň o základní strategii redukce rizikových faktorů, dietních opatřeních a doporučených pohybových režimech. Kontrolu a vedení dalšího rehabilitačního plánu by měl zajišťovat ošetřující kardiolog.
Význam druhé, posthospitalizační fáze tím značně narůstá, ať již je realizována jako řízený ambulantní trénink, individuální pohybová aktivita nebo časná lázeňská léčba.
Pro individuální přístup k rehabilitaci nemocného po IM slouží stratifikace do rizikových skupin. Na podkladě klinického nálezu a zhodnocené funkce levé komory rozdělujeme nemocné do tří skupin (tab. 2).
2. Stratifikace rizikových skupin. 
Podle daného rizika se řídí průběh doporučeného tréninkového programu. Základní ukazatele jsou intenzita, frekvence, trvání, způsob a progrese tělesného zatěžování.
Většina rehabilitačních programů je organizována třikrát týdně po dobu dvou až tří měsíců. Samozřejmě se předpokládá určitá pohybová aktivita i v ostatních dnech. Zahájení rehabilitace by mělo následovat co nejdříve, pokud možno do tří týdnů po propuštění. Cvičební jednotka se skládá z fáze zahřívací, vlastního aerobního a rezistenčního cvičení a na závěr z relaxační části. Celková doba cvičební jednotky je asi 60 min. Před jejím zahájením je třeba zjistit hodnoty TK a tepové frekvence a zeptat se nemocného na subjektivní potíže (stenokardie, dušnost). Hodnoty TK a pulzu je třeba sledovat i v průběhu aerobní zátěže a bezprostředně po ní, u osob s vyšším rizikem nebo arytmiemi je vhodné napojení na monitor [4].
Zlepšení funkce kardiovaskulárního systému představuje zásadně důležitý krok k plnohodnotnému životu. Je si však třeba uvědomit, že řada denních činností vyžaduje určitou svalovou sílu, kterou nemocní při nečinnosti brzy ztrácejí. Použití silového tréninku však dlouho představovalo tabu při cvičení kardiaků z obavy provokace ischemie a možného arytmogenního efektu při výraznějším zvýšení krevního tlaku a nověji také pro možný nepříznivý efekt na remodelaci. V dosavadních pracích se žádná z těchto obav neprokázala, naopak procento vyprovokovaných ischemií nebo arytmií je při silovém tréninku nižší než při klasickém aerobním cvičení. Dnes je rezistenční cvičení běžnou součástí rehabilitačních programů a zařazuje se i u nemocných se srdečním selháním [21–22].
Individuální domácí trénink se týká většiny nemocných po propuštění, a proto by na něj měl být kladen patřičný důraz. Vedle nezbytných informací, které by měl nemocný získat již během hospitalizace, je nutné poučení o vhodném způsobu a intenzitě cvičení. V počátečním období je nejvhodnější aktivitou chůze. Orientační hodnoty jsou uvedeny v tab. 3.
3. Individuální domácí trénink. 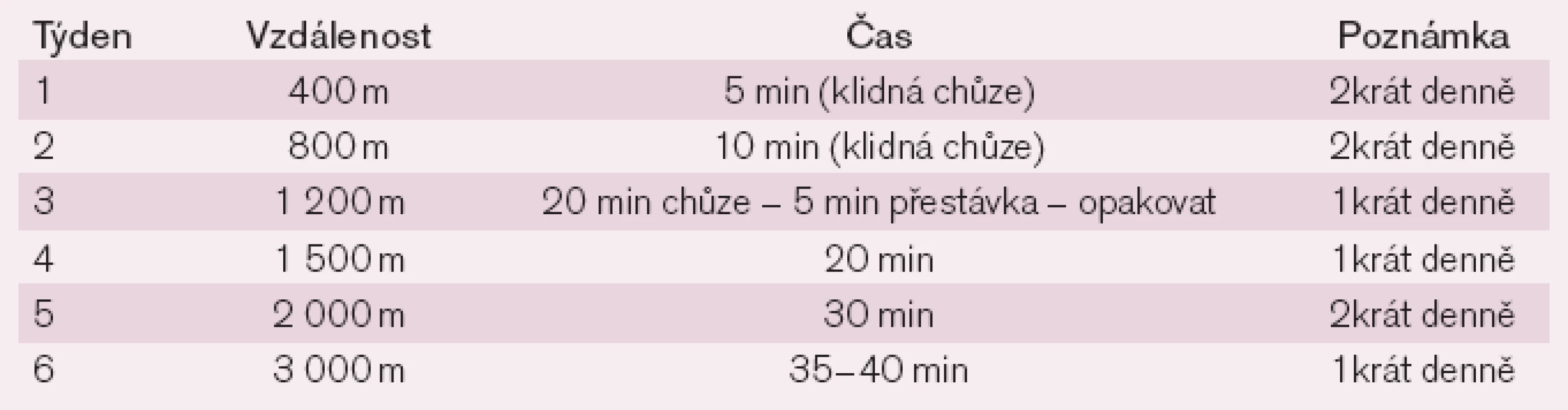
Nejčastěji doporučované aktivity jsou vedle chůze, která představuje nejbezpečnější fyzickou aktivitu, také jízda na kole nebo rotopedu, plavání a běh. Je třeba zdůrazňovat přednost vytrvalostního tréninku před ostatními pohybovými aktivitami. Intenzita a frekvence zátěže se řídí stejnými zásadami jako u organizovaného rehabilitačního programu.
Optimální zátěž představuje chůze. Z pohledu muskuloskeletálního postižení i výskytu arytmií je nejbezpečnější. I chůzí lze intenzivně trénovat. V poslední době je velmi populární severská chůze (nordic walking), což je běžná, nejlépe svižná chůze se speciálními holemi. Technika chůze se blíží technice při klasickém běhu na lyžích. Udává se, že kalorický výdej je ve srovnání s běžnou chůzí až o 40% vyšší.
Řada nemocných však preferuje zábavnější fyzickou aktivitu. Jedná se o plavání, tenis, lyžování, volejbal, basketbal, fotbal a další. Při provozování těchto aktivit hrají zásadní roli dva faktory. Jsou to technická vyspělost a soutěživost. Technická vyspělost snižuje námahu spojenou s určitou činností (např. u sjezdového lyžování) a soutěživost ji zvyšuje, včetně rizika komplikací. Nemocným tyto sporty nezakazujeme, ale doporučujeme, aby je prováděli s menším emočním zaujetím nebo použili různé modifikace, např. hrát tenis bez počítání atd.
Nemocní, u kterých se v průběhu domácího rehabilitačního programu objeví stenokardie, by měli být bez prodlení odesláni na kardiologické pracoviště.
Progrese fyzického zatěžování se zpravidla dělí na iniciální období, období zlepšování (III. fáze) a období udržovací (fáze IV). V úvodní části se nemocný adaptuje na fyzický trénink nižší intenzitou i frekvencí. Délka závisí na klinickém nálezu a fyzické kondici. V období zlepšování, trvajícím čtyři až šest měsíců, nemocný postupně zvyšuje intenzitu i trvání tréninku tak, aby denní kalorický výdej byl 200–400 kcal a týdenní minimálně 1 000 kcal [23].
Cílem pravidelného tréninku je nejen kondici zlepšit, ale také ji udržet. Ta se zhoršuje již po dvou týdnech nečinnosti s návratem k předtréninkovým hodnotám po deseti týdnech až osmi měsících. Udržení tréninkového efektu je v nepřímém poměru k délce tréninku, ale může být ovlivněno fyzickou kondicí, věkem nebo přidruženým onemocněním. Ze tří základních faktorů – intenzity, frekvence a trvání – má intenzita zásadní význam. Jinak řečeno, omezení frekvence a trvání nemá tak negativní vliv jako pokles intenzity.
Je třeba zvážit absolutní a relativní kontraindikace fyzického tréninku. Za absolutní se obecně pokládají: nestabilní angina pectoris, manifestní srdeční selhání, dissekující aneuryzma aorty, komorová tachykardie nebo jiné život ohrožující arytmie, sinusová tachykardie > 120/min, těžká aortální stenóza, podezření na plicní embolii, akutní infekční onemocnění, systolický TK > 200 mmHg a diastolický tlak > 115 mmHg a symptomatická hypotenze [24].
Srdeční selhání
Ještě nedávno se na chronické srdeční selhání (CHSS) pohlíželo pouze jako na neodvratitelné poslední stadium srdečních onemocnění, především ICHS a dilatační kardiomyopatie. I když tomu tak často je, moderní patofyziologické pohledy a s nimi spojená farmakologická léčba ukázaly, že progresivní zhoršování se dá v řadě případů zastavit nebo alespoň zpomalit. Mění se i pohled na fyzické zatěžování nemocných s CHSS a nabízí se analogie s IM. Ukázalo se, že inaktivita nemocných vede k dekondici a k atrofii kosterních svalů. Tyto změny dále zhoršují toleranci zátěže omezenou dušností a únavou. Fyzické zatěžování jako součást komplexní rehabilitace zlepšuje toleranci zátěže a je spojeno se zlepšením oxidativní kapacity cvičících svalů. Ukazatelé rovnováhy sympatikus-vagus se mohou zlepšovat, a tak mít ochranný vliv na progresi onemocnění. Problematice rehabilitace nemocných se srdečním selháním se věnuje v poslední době velká pozornost. Je to pochopitelné, protože nemocných s tímto závažným stavem bude přibývat. I když v současné době zůstává řada otázek otevřená, zvláště výběr nemocných pro fyzický trénink, optimální způsob, intenzita a trvání zátěže, vliv na prognózu nemocných a řada dalších, je velmi pravděpodobné, že se fyzický trénink stane u mnoha nemocných s CHSS nedílnou součástí racionální léčby.
Případné pochybnosti o vhodnosti a bezpečnosti řízené fyzické aktivity se pokusila vyřešit dosud největší studie u nemocných s CHSS – HF-ACTION Trial (A Controlled Trial Investigating Outcomes Exercise TraiNing), prezentovaná na sjezdu AHA na podzim 2008.
Zařazeno bylo 3 331 nemocných se srdečním selháním NYHA II–III s průměrnou ejekční frakcí 25%. Nemocní byli radomizováni 1 : 1 na skupinu s obvyklou léčbou a na skupinu s obvyklou léčbou a fyzickým tréninkem, který byl zahájen jako řízený, třikrát týdně 30 min po dobu 18 týdnů. Následoval domácí trénink na rotopedu nebo běhátku s doporučením 40 min pětkrát týdně. Průměrná doba sledování byla 2,5 roku.
Primární cíl studie bylo snížení všech (all cause) hospitalizací a úmrtí. Studie ukázala pouze statisticky nevýznamný pokles ve skupině s fyzickým tréninkem. Během studie zemřelo nebo bylo hospitalizováno 796 (68%) nemocných běžně léčených a 759 (65%) ve skupině s tréninkem. V první skupině zemřelo 198 nemocných (17%) a ve druhé 189 (16%).
Autoři ale zjistili statisticky významné (15%) snížení kardiovaskulárního rizika úmrtí nebo hospitalizace pro komplikace srdečního selhání (p = 0,03), a také zjistili významné zlepšení kvality života u nemocných s fyzickým tréninkem. Nejdůležitějším zjištěním ale pravděpodobně je, že řízená fyzická aktivita je pro nemocné s CHSS nejen prospěšná, ale i bezpečná [25].
Závěr
Rehabilitace u nemocných s ischemickou chorobou srdeční vede k zlepšení zátěžové tolerance i aerobní kapacity. Zlepšení zátěžové tolerance je úzce spjato s lepší prognózou. Nedávné údaje týkající se fyzického tréninku u nemocných po IM ukazují významné snížení celkové i kardiovaskulární mortality a také snížení srdečních příhod. Fyzický trénink vede ke zlepšení transportu kyslíku v organizmu, snížení nároků myokardu na kyslík pro daný objem práce a zmenšení rozsahu ischemie při fyzické námaze.
Fyzická aktivita má vliv na redukci rizikových faktorů a nesporným efektem kardiovaskulární rehabilitace je i zlepšená kvalita života nemocných s ICHS. Nemocní, kteří mají pozitivní vztah k fyzické aktivitě, lépe dodržují i ostatní zásady sekundární prevence.
Doručeno do redakce 2. 3. 2009
Přijato po recenzi 24. 4. 2009
doc. MUDr. Václav Chaloupka, CSc.
IKK FN Brno-Bohunice
vchaloup@fnbrno.cz
Sources
1. Hellerstein HK, Ford AB. Rehabilitation of the cardiac patient. J Amer Med Assoc 1957; 164 : 225–231.
2. WHO Committee. Rehabilitation after cardiovascular disease, with special emphasis on developing countries: a report of a WHO Committee. World Health Organ Tech Rep Ser 1993; 831 : 1–122.
3. Joliffe JA, Rees K, Taylor RS et al. Exercise‑based rehabilitation for coronary heart disease. Oxford: Update Software 2002.
4. Chaloupka V, Siegelová J, Špinarová L et al. Rehabilitace u nemocných s kardiovaskulárním onemocněním. Doporučené postupy ČKS. Cor Vasa 2006; 48: K127–K145.
5. Blair SN, Kampert JB, Kohl HW 3rd et al. Influences of cardiorespiratory fitness and other precursors on cardiovascular disease and all‑cause mortality in men and women. JAMA 1996; 276 : 205–210.
6. Pescatello LS, Fargo AE, Leach CN Jr et al. Short‑term effect of dynamic exercise on arterial blood pressure. Circulation 1991; 83 : 1557–1561.
7. Blair SN. Evidence for success of exercise in weight loss and control. Ann Intern Med 1993; 119 : 702–706.
8. Tran ZV, Weltman A. Differential effect of exercise on serum lipid and lipoprotein levels seen with changes in body weight. JAMA 1985; 254 : 919–924.
9. Williams PT. High‑density lipoprotein cholesterol and other risk factors for coronary heart disease in female runners. N Engl J Med 1996; 334 : 1298–1303.
10. Stratton JR, Chandler WL, Schwartz RS et al. Effects of physical conditioning on fibrinolytic variables in young and old healthy adults. Circulation 1991; 83 : 1692–1697.
11. Rauramaa R, Salonen JT, Seppänen K et al. Inhibition of platelet aggregability by moderate-intensity physical exercise: a randomized clinical trial in overweight men. Circulation 1986; 74 : 939–944.
12. Charo S, Gokce N, Vita JA. Endothelial dysfunction and coronary risk reduction. J Cardiopulm Rehabil 1998; 18 : 60–67.
13. Jančík J, Várnayová L, Siegelová J et al. Heart rate variability in patients with chronic ischemic heart disease: effect of 8‑week exercise training. In: Halberg F, Kenner T, Fišer B (eds). Proceedings of symposium The importance of chronobiology in diagnosing and therapy of internal diseases. IDVPZ Brno 2002 : 179–184.
14. Belardinelli R, Georgiou D, Ginzton L et al. Effects of moderate exercise training on thallium uptake and contractile response to low‑dose dobutamine of dysfunctional myocardium in patients with ischemic cardiomyopathy. Circulation 1998; 97 : 553–561.
15. Gould KL, Ornish D, Kirkeeide R et al. Improved stenosis geometry by quantitative coronary angiography after vigorous risk factor modification. Am J Cardiol 1992; 69 : 845–853.
16. Niebauer J, Hambrecht R, Velich T et al. Attenuated progression of coronary artery disease after 6 years of multifactorial risk intervention: role of physical exercise. Circulation 1997; 96 : 2534–2541.
17. Gwirtz PA, Brand MA, Mass HJ et al. Endurance training alters arterial baroreflex function in dogs. Med Sci Sports Exerc 1990; 22 : 200–206.
18. Jančík J, Svačinová H, Siegelová J et al. Baroreflex sensitivity in patients with chronic coronary artery disease: influence of eight weeks exercise training. Scripta medica 2001; 74 : 39–44.
19. Green HJ, Jones LL, Hughson RL et al. Training‑induced hypervolemia: lack of an effect on oxygen utilization during exercise. Med Sci Sports Exerc 1987; 19 : 202–206.
20. Mayer K, Samek L, Schwailbold S et al. Physical response to different modes of interval exercise training in patients with chronic heart failure – application to exercise training. Eur Heart J 1996; 17 : 1040–1047.
21. Williams MA, Haskell WL, Ades PA et al. Resistance Exercise in Individuals With and Without Cardiovascular Disease: 2007 Update: a scientific statement from the American Heart Association Council on Clinical Cardiology and Council on Nutrition, Physical Activity, and Metabolism. Circulation 2007; 116 : 572–584.
22. Chaloupka V, Elbl L, Nehyba S. Silový trénink u nemocných po infarktu myokardu. Vnitř Lék 2000; 46 : 829–834.
23. ACSM‘s Guidelines for exercise testing and Prescription. 6th ed. Lippincott Williams&Wilkins 2000.
24. Camm AJ, Lüscher TF, Serruys PW. The ESC Text Book of Cardiovascular Medicine. Oxford: Blackwell Publishing 2006.
25. Colleta AP, Clark AL, Cleland JG. Clinical trials update from the Heart Failure Society of America and the American Heart Association meetings in 2008: SADHART-CHF, COMPARE, MOMENTUM, thyroid hormone analogue study, HF-ACTION, I-PRESERVE, {beta}-interferon study, BACH, and ATHENA. Eur J Heart Fail 2009; 11 : 214–219.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2009 Issue 2-
All articles in this issue
- Diagnosis and treatment mistakes in acute forms of ischaemic heart disease
- Brno registr – has the post‑MI pharmacotherapy changed in recent years?
- Rehabilitation of patients with ischemic heart disease
- Immunosuppression treatment following heart transplantation
- Mistakes and errors in identification and treatment of valvular heart diseases
- What is new in hypertension?
- Cardiometabolic risk is a threat for the 21st century cardiology
- Achieving the LDL‑cholesterol target levels in clinical practice. Information from the IN-CROSS study.
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnosis and treatment mistakes in acute forms of ischaemic heart disease
- Immunosuppression treatment following heart transplantation
- Cardiometabolic risk is a threat for the 21st century cardiology
- Rehabilitation of patients with ischemic heart disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

