-
Medical journals
- Career
Katetrizační ablace fibrilace síní
Authors: R. Lábrová; J. Špinar
Authors‘ workplace: Interní kardiologická klinika LF MU a FN Brno
Published in: Kardiol Rev Int Med 2008, 10(3): 103-110
Overview
Fibrilace síní je nejčastější poruchou srdečního rytmu a její incidence a prevalence stále narůstá. U fibrilace síní stále zůstává léčbou první volby farmakologická terapie, která se stává při dlouhodobém podávání postupně neúčinnou a nese s sebou řadu nežádoucích účinků. Selektivní katetrová ablace zasahuje do patofyziologických mechanizmů vzniku a udržení fibrilace síní a dochází k obnovení sinusového rytmu. U paroxyzmální formy fibrilace síní se provádí elektrická izolace ektopických ložisek v antrech plicních žil. U perzistentní nebo permanentní formy fibrilace síní, kdy již bývá přítomná elektrická a funkční remodelace síní, je nutný již komplexní ablační přístup. Kromě širších obkružujících lézí kolem anter plicních žil se provádí další ablační linie v levé síni, někdy i v pravé síni či koronárním sinu. Ablační lineární léze ovlivňují reentry okruhy ve stěně síně, které slouží k udržení fibrilace síní. Katetrová ablace paroxyzmální fibrilace síní se stává již rutinní léčebnou metodou u symptomatických pacientů, rezistentních na antiarytmickou terapii. Stále častěji se indikují ke katetrové ablaci i pacienti s organickým postižením srdce a srdečním selháním. Obnovení sinusového rytmu může vést ke zlepšení až normalizaci systolické funkce levé komory. Vzhledem k náročnosti ablačních výkonů se zkoumají další ablační techniky, které by měly urychlit a usnadnit tyto náročné výkony.
Klíčová slova:
fibrilace síní – paroxyzmální – perzistentní – permanentní – radiofrekvenční katetrová ablace – elektrická izolace plicních žil – kombinované technikyÚvod
Fibrilace síní (FS), která byla poprvé popsána v roce 1909, je nejčastější poruchou srdečního rytmu [1]. Incidence a prevalence fibrilace síní exponenciálně roste s věkem. Postihuje asi 5 % lidí ve věku mezi 60–70 lety a 10–15 % pacientů ve věku nad 80 let [2]. Podle nedávno publikovaných údajů došlo v posledních třech dekádách až k trojnásobnému zvýšení prevalence FS. Asi třetina pacientů byla ve věku 80 let a více. Stárnutím populace se počet pacientů s fibrilací síní ještě zvýší. Předpokládá se, že v průběhu 50 let se zvýší počet pacientů s FS 2,5-5krát [3]. Zřejmě i tyto údaje jsou ještě podhodnocené, protože podle nedávné studie bylo u jednoho pacienta až 70 % atak FS asymptomatických [4]. Zvyšující se výskyt FS v celosvětové populaci přerůstá ve velký problém, který s sebou přináší značné ekonomické náklady.
FS může být klinicky asymptomatická, nebo může být provázená řadou subjektivních potíží – od palpitací, námahové dušnosti, anginy pectoris až po presynkopální či synkopální stavy, které mohou významně snížit kvalitu života pacienta. FS může zhoršit již existující srdeční selhání u pacientů s organickým postižením srdce. FS sama, zvláště při rychlé nekontrolované frekvenci komor, může být příčinou tachykardické kardiomyopatie se snížením systolické funkce levé komory a s rozvojem srdečního selhání. FS a srdeční selhání mají vzájemný nepříznivý prognostický dopad [5]. Riziko trombembolické mozkové příhody je u FS pětinásobné a pokud je u pacientů chlopenní vada, tak je riziko iktu až 17krát vyšší než u pacientů bez arytmie. FS zvyšuje nejen morbiditu, ale i mortalitu. U pacientů s FS je mortalita dvakrát vyšší než u pacientů se sinusovým rytmem, hlavní příčinou jsou trombembolické mozkové příhody [6]. Spojení FS, hypertenze a mozkové příhody se vysvětluje na základě snížené aortální poddajnosti, hypertrofie levé komory, diastolické dysfunkce a dilatace levé síně, což dává podmínky pro stázu krve a utváření trombu [7].
Léčba FS je obtížná. Léčbu zahajujeme antiarytmiky, jejichž dlouhodobé podávání je spojeno s řadou nežádoucích účinků, včetně proarytmie, a účinnost je většinou dočasná i při kombinaci antiarytmické terapie [8, 9]. Žádné antiarytmikum nezabrání recidivám FS, ale při jejich podávání jsou recidivy FS méně časté, kratší a jsou pacientem lépe tolerovány. Nejúčinnější v prevenci rekurence FS je amiodaron, který má ale nejvíce nežádoucích účinků, až u 20 % pacientů lze očekávat vedlejší účinky [10]. Výsledky posledních studií (CACAF, A4, APAF, RAAF) srovnávaly účinek ablace a podávání antiarytmik I. a III. třídy na rekurenci FS. Po podávání antiarytmik byly recidivy FS u 63–91 % pacientů, kdežto po katetrové ablaci u 13–44 %. Výsledky těchto studií vyšly jednoznačně ve prospěch ablace. Nedávné výsledky nerandomizované studie naznačují, že pacienti, kteří podstoupili katetrovou ablaci FS, mají nižší morbiditu a mortalitu než pacienti, kteří drží sinusový rytmus na antiarytmické terapii. Prognóza pacientů, kteří podstoupili nefarmakologickou terapii, se stává srovnatelnou s běžnou populací ve stejném věku, kdežto pacienti na antiarytmické terapii měli prognózu horší [11, 12].
U symptomatických pacientů, u kterých selhala antiarytmická terapie v prevenci rekurence FS, je indikována nefarmakologická terapie. Katetrová ablace působí přímo na mechanizmy vzniku, event. udržování FS, je tedy předpoklad trvalého odstranění arytmie. Katetrová ablace se stává již standardní léčbou u symptomatických pacientů a její úspěšnost se odvíjí od formy FS, přítomnosti organického postižení srdce a použité techniky. U paroxyzmální formy FS je úspěšnost ablace v jednotlivých pracovištích 70–90 %, u perzistentní či permanentní formy do 60 %.
FS je charakterizovaná rychlou nekoordinovanou aktivací síní s nepravidelným převodem na komory [13]. Frekvence komor závisí na převodních vlastnostech atrioventrikulárního uzlu (AV uzel), vlivu vegetativního nervstva a podávání antiarytmické terapie. Dlouhodoběji rychlá nekontrolovaná frekvence komor může vést ke kardiomyopatii (tzv. tachykardická) s progresí do srdečního selhání.
Velmi rychlá frekvence komor bývá u FS při antegrádně vedoucí akcesorní síňokomorové spojce u Wolffova-Parkinsonova-Whiteova syndromu, kdy chybí ochranná funkce AV uzlu. U FS při rychle vedené síňové aktivitě na komory přes akcesorní síňokomorovou spojku hrozí degenerace do flutteru či fibrilace komor. Pokud je u FS na povrchovém EKG preexcitovaný RR interval menší než 250 ms, je zvýšené riziko náhlé srdeční smrti [14].
Klasifikace FS:
- První detekovaná ataka FS, která může být symptomatická nebo asymptomatická. Může být jedinou epizodou po řadu let, nebo se mohou objevovat v budoucnu recidivy.
- Paroxyzmální – epizody FS spontánně končí většinou do 48 h, maximálně do sedmi dnů.
- Perzistentní – FS nekončí spontánně, ale verzí buď medikamentózní nebo elektrickou.
- Permanentní (podle Heart Rhythm Society nově nazývaná dlouhotrvající perzistentní FS) – FS trvá nejméně jeden rok a po elektrické kardioverzi recidivuje do jednoho týdne. FS přetrvává i přes snahu o elektrickou kardioverzi a léčbu antiarytmiky. Patří sem i ta forma FS, u které z jakéhokoliv důvodu nebyla navržena terapie k nastolení sinusového rytmu [15] (obr. l).
Image 1. Klasifikace fibrilace síní. Na schématu je znázorněna klasifikace fibrilace síní a šipky ukazují možné konverze fibrilace síní do různých forem. Podle Heart Rhythm Society je permanentní forma fibrilace síní nově nazývána jako dlouhotrvající perzistentní fibrilace síní. 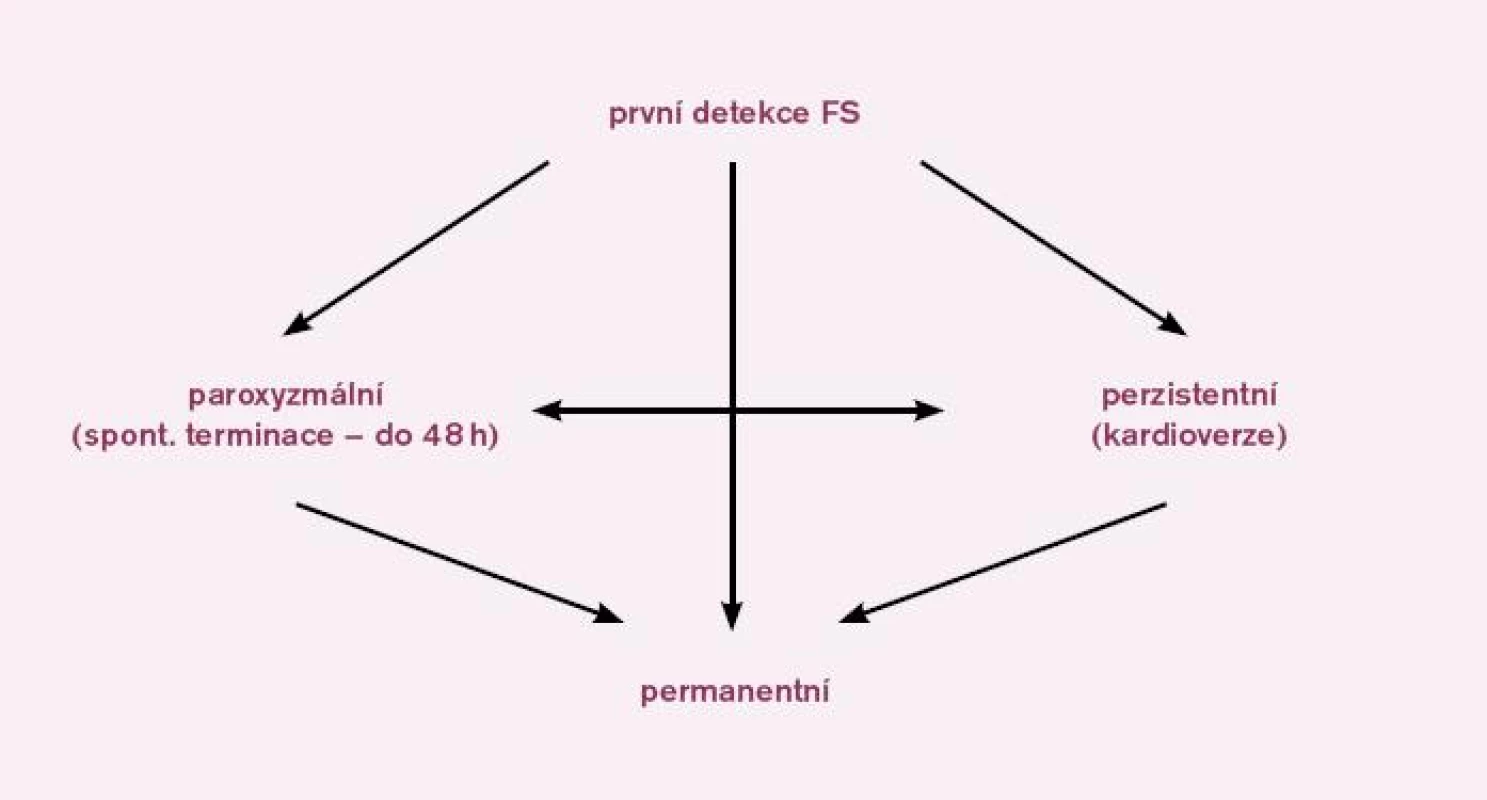
V literatuře je často uváděna lone atrial fibrillation, což je izolovaná FS u pacientů bez prokázaného kardiovaskulárního onemocnění. Dále nonvalvular atrial fibrillation neboli nechlopenní FS u pacientů bez přítomnosti významné chlopenní vady nebo náhrady chlopně, což ukazuje na menší riziko trombembolické komplikace.
Mechanizmus fibrilace síní
Etiologie vzniku FS je multifaktoriální, proto je FS v současnosti středem zájmu klinického výzkumu kardiovaskulárních onemocnění k objasnění těchto primárních příčin vzniku FS. Výzkum je zaměřen na molekulární genetiku vzniku FS a také na odhalení nejdůležitějších rizikových faktorů, jejich vzájemných vztahů a ovlivňování, včetně působení komorbidit ve vyšším věku i působení vlivu životního prostředí [16].
Na mechanizmu vzniku a udržení FS se tedy podílí spouštěcí faktory a přítomnost anatomického arytmogenního substrátu. Spouštěcím faktorem je ektopie, která vzniká nejčastěji v ústích plicních žil, méně často v horní nebo dolní duté žíle, koronárním sinu, Marshallově žíle nebo jiných místech síňového myokardu. Mechanizmem spouštěcího ložiska je převážně zvýšená automacie, méně často mnohočetné reentry okruhy. Při určitých elektrofyziologických, strukturálních i funkčních změnách myokardu se vytvoří arytmogenní substrát a vlastním mechanizmem udržující se FS jsou potom mnohočetné reentry okruhy v síních. Nejčastější příčinou vzniku arytmogenního substrátu je fibrotizace stěny síní, čímž dochází ke snížení kontraktility síní a poruše šíření elektrické aktivity srdečními buňkami. Bývá přítomno zvýšené napětí stěny síní a její dilatace.Vznik a vlastnosti spouštěcí ektopie i arytmogenního substrátu potom ovlivňuje řada modulujících faktorů. Mezi neovlivnitelné modulující faktory řadíme proces stárnutí a genetické faktory. Mezi ovlivnitelné patří hypertenze, diastolická dysfunkce, chlopenní vady, ischemická choroba srdeční, perimyokarditida, kardiochirurgické výkony, srdeční selhání, autonomní nervový systém, porucha funkce štítné žlázy, diabetes mellitus, zánět, obezita, metabolický syndrom, spánková apnoe. Na mechanizmu vzniku a udržování FS se také podílí zřejmě i autonomní pleteně v levé síni, které jsou uložené epikardiálně v blízkosti plicních žil.
Mnohočetné reentry okruhy, arytmogenní substrát pro FS a modulující faktory jsou potom mechanizmem přechodu paroxyzmální FS do formy perzistentní nebo permanentní, kdy je již přítomná elektrická a funkční remodelace síní.
Občas je těžké rozlišit elektrofyziologické nebo strukturální změny, které jsou důsledkem fibrilace síní, nebo změny, které jsou primární příčinou vzniku FS [17].
FS je spojena s poruchou mechanické funkce síní. Při ztrátě systoly síní – efektivní síňové kontrakce – chybí síňový příspěvek a může dojít ke snížení srdečního výdeje až o 20 %. Ke snížení srdečního výdeje může přispívat i zkrácení diastoly při rychlé frekvenci komor. Dilatace síně bývá uváděna jako lepší prediktor mortality než ejekční frakce levé komory po infarktu myokardu či u dilatační kardiomyopatie [18].
FS se vyskytuje samostatně, ale velice často bývá společně s dalšími supraventrikulárními tachyarytmiemi, nejčastěji s flutterem síní nebo také síňovými tachykardiemi, kdy tyto arytmie se mohou střídat nebo mohou přecházet jedna v druhou [19].
V posledních deseti letech došlo ke změně názoru na mechanizmy vzniku a udržení FS a tyto názorové změny se odrazily na značném rozvoji katetrizačních metod. Jednotlivé strategie a techniky kurativní katetrové ablace odrážejí mechanizmy vzniku jednotlivých forem FS a vedou k odstranění FS.
Paroxyzmální fibrilace síní
Fokální teorie vzniku FS byla vypracována Scherfem v roce 1947. Podle jeho teorie je FS spouštěna fokusem v levé síni [20].
Donedávna byla hlavní hypotézou mechanizmu vzniku FS teorie mnohočetných vlnek, která byla vytvořena na podkladě počítačového modelování a popsána v roce 1964 Moem a dále byla propracována v roce 1985 Allesiem [21, 22]. Podle této teorie je FS udržována kroužením elektrické depolarizace po několika nestálých funkčních reentry okruzích především v levé, ale také i v pravé síni, které se rozpadají na další dceřinné okruhy. Pro udržení FS je třeba 4–7 okruhů, které vznikají především na podkladě změn elektrofyziologických vlastností myokardu. Na podkladě této hypotézy vypracoval americký chirurg James Cox MAZE (bludiště) proceduru, což byl systém lineárních incisí a sutur v obou síních, které měly přerušit reentry okruhy a tím docílit fyziologické vedení elektrického impulzu. Byla to první léčebná metoda, která vedla k odstranění FS. Vzhledem k velkému rozsahu operace obou síní a možných komplikací, včetně postižení SA i AV uzlu, nenašla tato metoda širšího uplatnění [23]. Později Sueda vypracoval systém lineárních incisí, které obkružují plicní žíly [24]. Následně potom byly incise nahrazeny obkružujícími a lineárními liniemi aplikací radiofrekvenční energie nebo kryoablací. Pokud pacient podstoupí kardiochirurgickou operaci a současně má některou z forem fibrilace síní, potom tato metoda je v současnosti metodou chirurgické ablace v levé síni.
V současné době je vysvětlen hlavní mechanizmus vzniku a udržení FS hypotézou, která byla popsána Michelem Haissaquerrem z Bordeaux v roce 1998. Tato teorie ukazuje, že se v patofyziologii FS uplatňují jak fokální, tak reentry mechanizmy, a to u jednotlivých forem FS v různé míře. Bylo zjištěno, že spuštění FS je na podkladě fokálního mechanizmu. Vychází z existence jednoho nebo více ektopických fokusů se spontánní elektrickou aktivitou na podkladě abnormální automacie nebo spuštěné aktivity, zřídka i reentry mechanizmu. Ektopické fokusy jsou většinou v ústí plicních žil, méně často i v jiných lokalizacích. A dále je nutná existence jednoho nebo více mateřských reentry okruhů (tzv. rotorů) v levé síni, které jsou lokalizovány ve venózní zadní části levé síně, ale i v antrech plicních žil a slouží k udržení fibrilace síní [25]. Paroxyzmální FS je spouštěna z plicních žil extrasystolami nebo krátkými síňovými tachykardiemi. Je udržována jako fokální tachykardie nebo lokálním reentry mechanizmem v antrech plicních žil nebo i v některých částech stěny levé síně. U paroxyzmální FS převládá význam ektopie.
Patofyziologie perzistentní či permanentní FS je podstatně složitější než u paroxyzmální formy FS. U perzistentní či permanentní FS jsou přítomny významnější strukturální změny stěny levé síně v důsledku fibrotizace a ukládání amyloidu, levá síň je dilatovanější, což tvoří podmínky pro vznik četných mateřských reentry okruhů, které slouží k udržení FS. Místa vzniku reentry okruhů většinou odpovídají epikardiálnímu uložení ganglií sympatického a parasympatického nervstva. Rotory se vyznačují rychlou elektrickou aktivitou a často širokými frakcionovanými elektrickými potenciály [26]. Tyto strukturální změny mohou vzniknout na podkladě různých onemocnění či působením rizikových faktorů, mohou být důsledkem samotné fibrilace síní nebo kombinací obou. U FS dochází k aktivaci renin angiotenzin aldosteronového systému, kdy angiotenzin II je hlavním stimulátorem fibrózy. Inhibitory angiotenzin konvertujícího enzymu (ACEi) a blokátory pro angiotenzin II (ARB) redukují síňový kolagen, čímž brání následné remodelaci, a pravděpodobně inhibují prozánětlivé působení a zvýšený sympatikotonus angiotenzinu II a tím brání rekurenci vzniku FS. Jejich působením se snižuje síňový tlak a snižuje se i napětí stěny síně, předpokládá se i účinek na zlepšení diastolické funkce. Jejich antiarytmický efekt je předmětem dalšího sledování [27].
Arytmogenní substrát zahrnuje nejen venózní část levé síně, ale postihuje difuzně celou levou síň, často i koronární sinus, někdy i některé struktury pravé síně. Proto je u těchto složitějších forem FS již nutná komplexní katetrová ablace v levé síni, ale někdy i v pravé síni, včetně aplikací radiofrekvenční energie v koronárním sinu.
Počátky ablační techniky paroxyzmální FS
První radiofrekvenční katetrové ablace FS napodobovaly chirurgický přístup - MAZE procedury, které bránily šíření elektrické reentry aktivity v síních. Prováděly se lineární linie nejdříve v levé i pravé síni, po zjištění větší účinnosti v levé síni se od katetrové ablace v pravé síni upustilo [28, 29]. Tyto výkony byly velmi složité a byly provázené řadou komplikací.
Po odhalení fokálního spuštění FS se katetrové ablace soustředily na ložiska elektrické aktivity v proximálních částech plicních žil [30]. Od těchto fokálních ablací se brzy upustilo, protože s sebou nesly vysoké riziko významné stenózy plicní žíly a často nebyly ablačně eliminovány všechny ektopie v plicní žíle nebo po ošetření jedné plicní žíly vznikaly recidivy FS z ektopické aktivity neošetřené plicní žíly.
Současné ablační techniky paroxyzmální FS
Snahou současné katetrizační ablace paroxyzmální FS je eliminovat nejlépe všechna arytmogenní ložiska ve všech plicních žilách, event. i rotory v antrech plicních žil, které by mohly spouštět a udržovat paroxyzmální FS [31]. Někteří autoři, kteří se snaží dosáhnout ještě vyšší úspěšnosti zákroku, provádí i u paroxyzmálních FS lineární linie nebo ložiskové léze ve snaze ovlivnit reentry okruhy nebo ganglia autonomního nervstva v levé síni [32]. Ale základem invazivní léčby paroxyzmální FS je ablace plicních žil. K ablaci se používá ablační katetr s 3,5–4 mm chlazeným koncovým tipem elektrody, kdy chlazení se provádí průtokem fyziologického roztoku. Při této technice ablace se dosáhne za kratší dobu hlubší léze a při protékání fyziologického roztoku je menší riziko karbonizace elektrody, vzniku trombu a výkon je méně bolestivý.
Konvenční metoda katetrové ablace podle pracoviště v Bordeaux je metodou elektrofyziologickou. Cílovým momentem výkonu je dosažení elektrické izolace všech čtyř plicních žil. Cirkulárním mapovacím Lasso katetrem, který se zavádí postupně do ústí všech plicních žil, se snímá elektrická aktivita plicní žíly (obr. 2). Konvenční ablace je vedena kolem ústí plicních žil za rentgenové kontroly a podle snímaných elektrických signálů v plicních žilách. Během ablace dochází k přerušení elektrického vedení myokardiálních snopců, které spojují svalovinu levé síně a plicní žíly, a tím dochází k elektrické izolaci plicní žíly. Izolací nepřechází elektrická aktivita z ložisek v plicní žíle do síně a tím se nespustí FS. Při dosažení elektrické izolace plicní žíly vymizí elektrická aktivita snímaná Lasso katetrem v plicní žíle (obr. 3).Myokardiální snopce, které spojují svalovinu síní a plicní žílu, jsou kolem ústí plicních žil nepravidelně uspořádané, a proto se provádí pouze segmentální ablace v oblasti ústí plicních žil, kdy se radiofrekvenční energie nemusí aplikovat kolem celého obvodu [33]. Pokud během výkonu běží paroxyzmální fibrilace síní, tak izolací některé – arytmogenní plicní žíly se většinou arytmie ukončí a nastolí se sinusový rytmus. Udávaná úspěšnost této metody je 70–85 %, riziko vzniku stenózy plicní žíly je malé, 0,5–2 % [34].
Image 2. Rentgenový snímek srdce (RAO – pravá šikmá projekce). 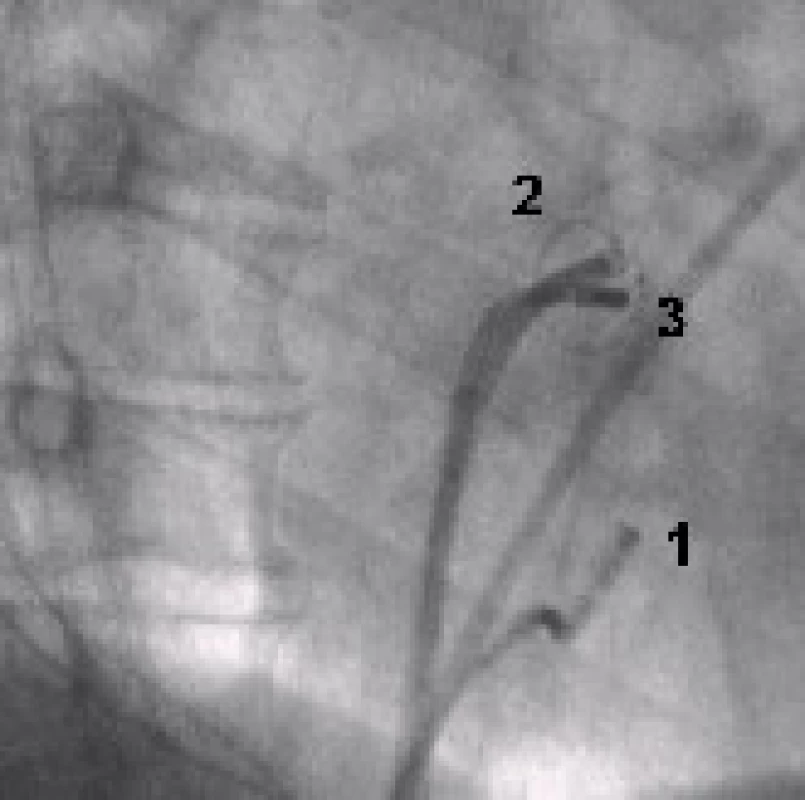
1 – vyšetřovací katetr v koronárním sinu 2 – mapovací Lasso katetr v ústí levé horní plicní žíly 3 – ablační katetr v ústí levé horní plicní žíly Image 3. Elektrická izolace plicní žíly – intrakardiální EKG záznam. 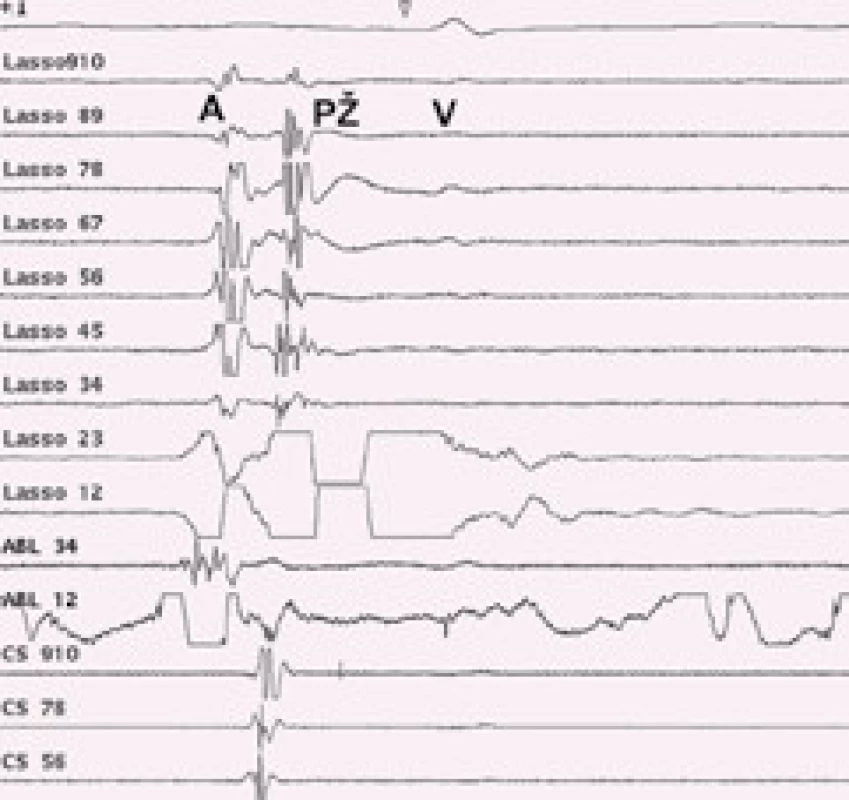
1. Lasso katetr snímá elektrickou aktivitu ze síně (A) a pravé horní plicní žíly (PŽ), plochou komorovou aktivitu (V). 2. Po elektrické izolaci plicní žíly zůstává elektrická aktivita síně (A) a mizí elektrická aktivita plicní žíly (PŽ), ABL – elektrické potenciály v ablačním katetru, CS – záznam z koronárního sinu.
Metoda zavedená Carlo Papponem na pracovišti v Miláně se začala vyvíjet ve stejném období jako konvenční metoda v Bordeaux. Tato metoda používá trojrozměrné elektroanatomické mapování pomocí CARTO systému k anatomické rekonstrukci levé síně a plicních žil a radiofrekvenční energie se aplikuje v širších souvislých obkružujících liniích kolem anter plicních žil [35] (obr. 4). Nehodnotí se elektrická izolace plicních žil, ale snížení amplitudy lokálních elektrických signálů v místech aplikace radiofrekvenční energie. Tyto obkružující léze se provádí na zadní stěně levé síně, takže dochází k přerušení reentry okruhů kolem proximálních částí anter plicních žil i narušení mateřských reentry okruhů i vagových zakončení. Touto metodou dochází ke zmenšení masy myokardu levé síně a tím k ovlivnění arytmogenního substrátu, který se podílí na vzniku a udržení FS. Publikovaná klinická úspěšnost této metody kolísá v rozmezí 70–90 %, ale většinou je udávána kolem 90 %. Vzhledem k tomu, že se obkružující léze vedou na síňové straně anter plicních žil, je minimální riziko vzniku stenózy plicní žíly.
Image 4. Trojrozměrné elektroanatomické mapování pomocí systému CARTO, pohled PA – posteroanteriorní. 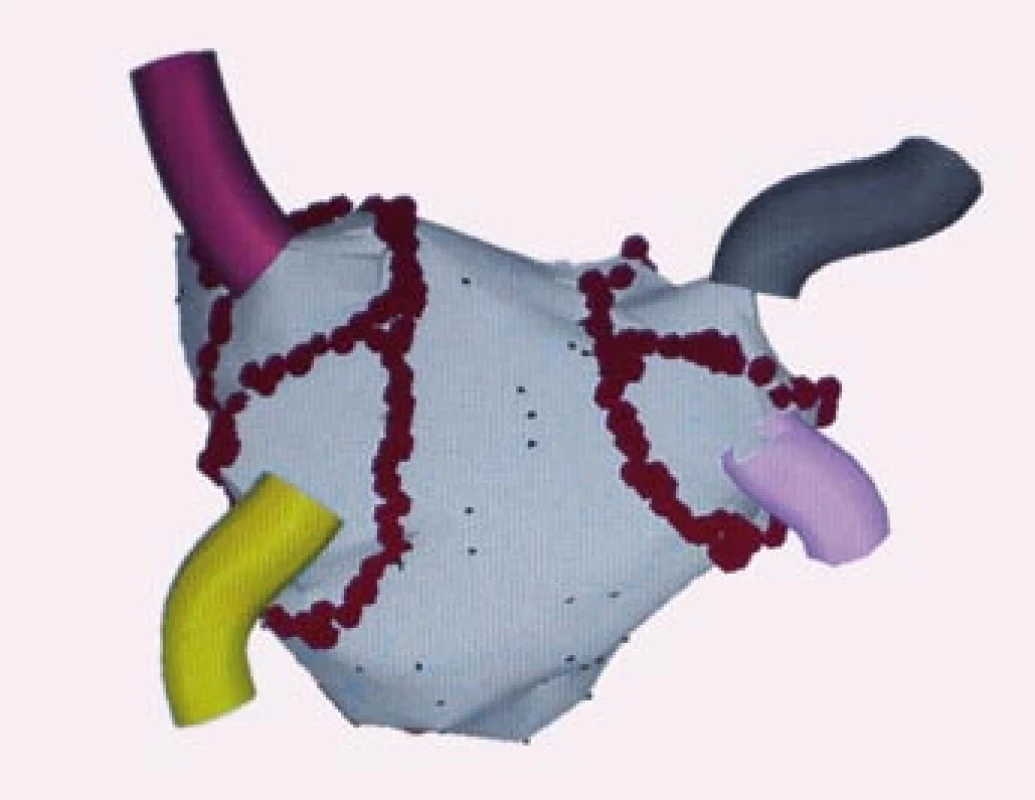
Na obrázku je znázorněna anatomická mapa levé síně a plicních žil. Červené body znázorňují místa aplikace radi ofrekvenční energie při širších obkružujících liniích kolem anterplicních žil u pacienta s paroxyzmální formou fibrilace síní. LHPŽ – levá horní plicní žíla, LDPŽ – levá dolní plicní žíla, PHPŽ – pravá horní plicní žíla, PDPŽ – pravá dolní plicní žíla, MA – mitrální anulus. V poslední době se vyvinuly především dva systémy zobrazovací a mapovací techniky, které umožní trojrozměrné zobrazení srdečních oddílů. Kromě trojrozměrného elektroanatomického mapovacího systému CARTO firmy Biosense Webster se na některých pracovištích používá NavX, vyvinutý firmou Endocardial Solution Inc., která je nyní součástí firmy St. Jude Medical. U NavX se kromě ablačního katetru zobrazí on-line ještě další katetry, např. cirkulární mapovací katetr v plicní žíle.
K dosažení ještě vyšší úspěšnosti zákroku volí některá pracoviště kombinaci ablačních technik. Nejoptimálnějším řešením paroxyzmální FS se jeví kombinace obou zmíněných metod, kdy se provádí elektroanatomicky navigované širší obkružující léze anter plicních žil v kombinaci s elektrickou izolací plicních žil ověřenou mapovacím cirkulárním Lasso katetrem. Klinická účinnost se dostává nad 90 % [36].
Některá pracoviště používají metodu, která vede k parasympatické denervaci a podle publikovaných údajů je vysoce účinná. Radiofrekvenční energie se aplikuje do míst zakončení vagových ganglií [37].
Další metoda spočívá v provedení modifikace elektrofyziologického substrátu. Pomocí trojrozměrného elektroanatomického mapování se vyhledávají mateřské reentry okruhy, které se podílí na udržení FS. Rotory se většinou nachází na zadní stěně levé síně a v oblasti mezisíňového septa a na intrakardiálním záznamu se vyznačují komplexními frakcionovanými elektrickými signály. Aplikace radiofrekvenční energie do míst frakcionovaných potenciálů vedla k ukončení FS. Klinická úspěšnost je autory uváděna kolem 76–90 % [38].
Uvedené poslední dvě techniky katetrové ablace FS zatím ještě nejsou dostatečně propracovány a jejich výsledky je potřeba ověřit i na jiných pracovištích a na větším souboru pacientů.
Katetrová ablace perzistentní a permanentní FS
Stále častěji jsou indikovaní ke katetrové ablaci i pacienti s perzistující formou FS, přítomným organickým postižením srdce a významnou dysfunkcí levé komory. Permanentní FS je ze všech forem FS spojena s nejvyšší morbiditou a mortalitou, protože má nejvyšší riziko vzniku trombembolických komplikací a je nejčastěji spojena s rozvojem srdečního selhání. Permanentní FS se často na snížené funkci levé komory podílí nebo může být i její hlavní příčinou [39]. Odstranění arytmie a nastolení sinusového rytmu vede často ke zlepšení nebo dokonce k normalizaci funkce levé komory [40]. Cílem jednotlivých elektrofyziologických pracovišť je nalezení co nejoptimálnější a nejúčinnější ablační strategie i u těchto nejsložitějších forem FS.
Katetrová ablace perzistentní nebo permanentní FS musí být komplexní, aby postihla celý velmi složitý arytmogenní substrát. Význam reentry okruhů v oblasti anter plicních žil, které tvoří zásadní úlohu pro udržení paroxyzmální FS, mají malý význam v udržení perzistentní nebo permanentní FS. Proto již zmíněná účinná ablační strategie u paroxyzmální FS není účinná u perzistentní nebo permanentní FS.
Některá pracoviště volí čistě anatomický přístup komplexní ablace perzistentní a permanentní FS. Provádí se širší obkružující léze kolem anter plicních žil, ne vždy je kontrolovaná elektrická izolace plicních žil, a dále jsou doplňovány lineární linie v oblasti levé síně, aniž by cílovým momentem bylo ovlivnění charakteru arytmie během výkonu. Jednotlivá pracoviště se liší v počtu a umístění lineárních linií (obr. 5, 6). Tyto linie nejsou pouze v zadní části levé síně, ale i na přední stěně a v oblasti septa. Po výkonu následuje elektrická kardioverze. Předpokládá se, že v době hojení lézí, 1–3 měsíce po výkonu, dojde v levé síni k pozitivní reverzní remodelaci síně a tím se sníží potenciál ke vzniku a udržení FS [41].
Image 5. Trojrozměrné elektro anatomické mapování systémem CARTO, projekce PA‑posteroanteriorní. 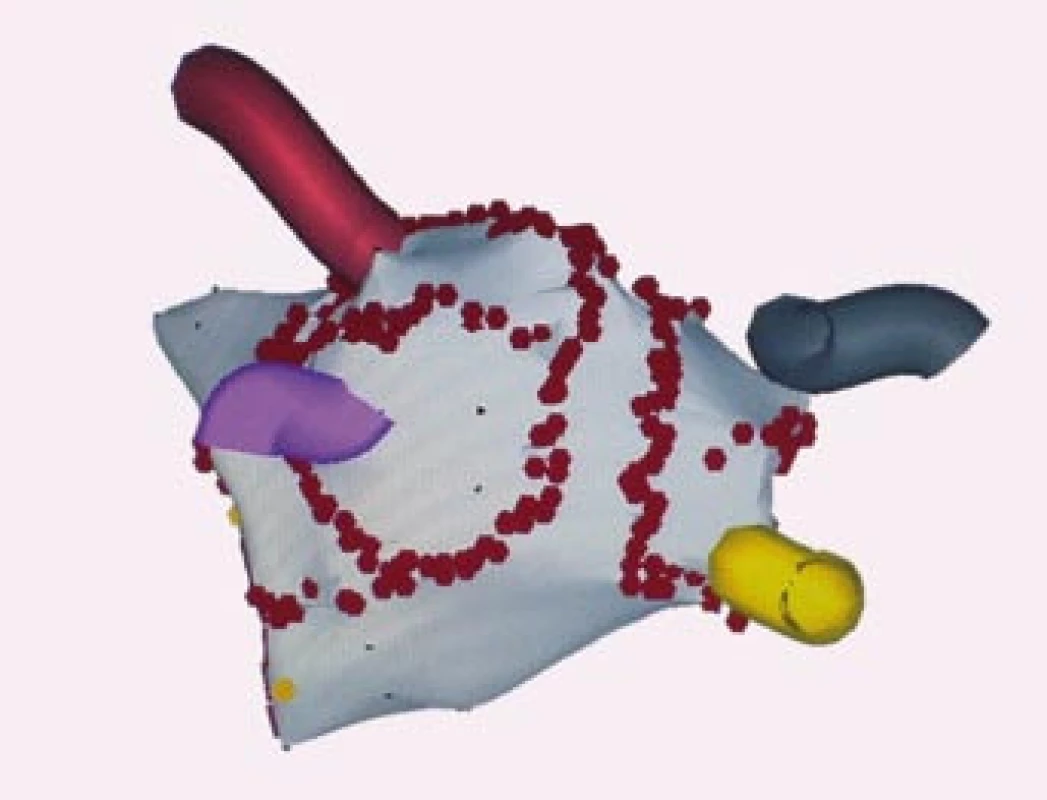
Na obrázku je anatomická mapa levé síně a plicních žil. Červené body jsou místa aplikace radiofrekvenční energie, kdy byly provedeny širší obkružující linie kolem anterplicních žil, 1 – lineární linie, která spojuje dolní část obkružující linie levostranných plicních žil s mitrálním anulem, linie napříč mitrálním můstkem, 2 – lineární linie ve stropu levé síně u pacienta s perzistentní fibrilací síní. LHPŽ – levá horní plicní žíla, LDPŽ – levá dolní plicní žíla, PHPŽ – pravá horní plicní žíla, PDPŽ – pravá dolní plicní žíla, MA – mitrální anulus. Image 6. Trojrozměrné elektro anatomické mapování pomocí systému CARTO, projekce PA – posteroanteriorní. Na obrázku je anatomická rekonstrukce levé síně a plicních žil, červené body jsou místa aplikace radiofrekvenční energie při katetrové ablaci. Jsou znázorněny širší obkružující linie kolem anterplicních žil, 1 – lineární linie ve stropu levé síně, 2,3 – lineární linie, které spojují dolní okraj obkružující linie kolem levostranných plicních žil s mitrálním anulem, 4 – spojnice širších obkružujících linií mezi dolními plicními žilami u pacienta s permanentní fibrilací síní. 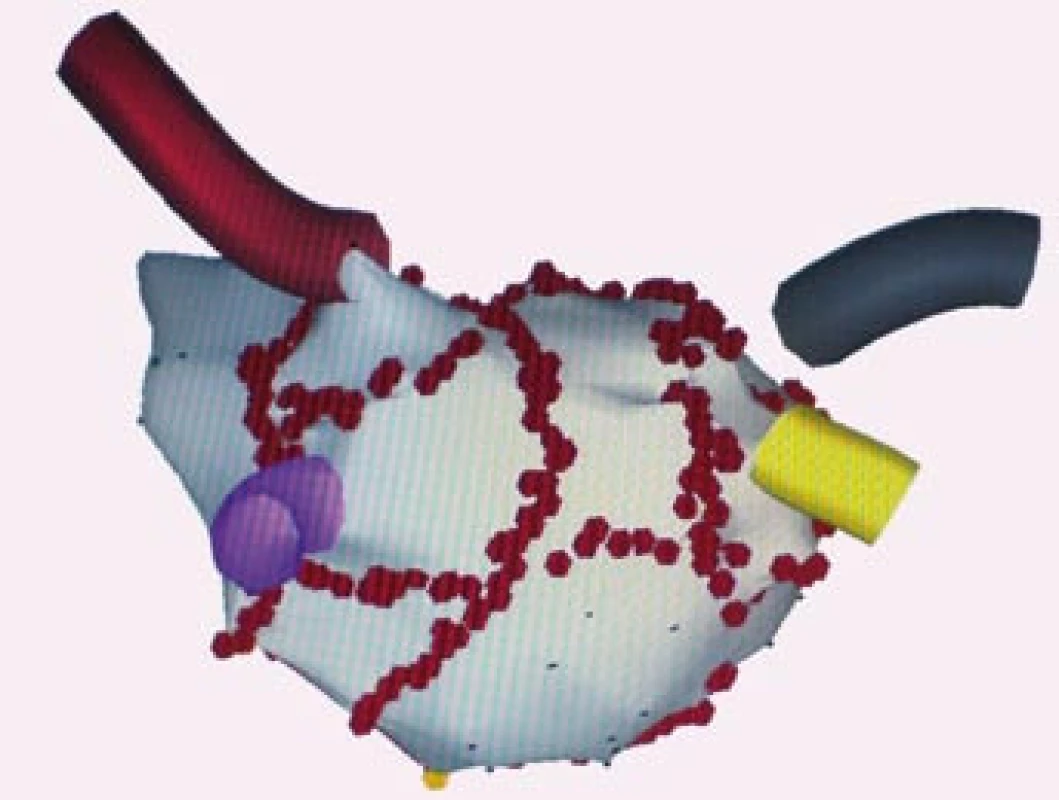
Další strategií je kombinace anatomického a elektrofyziologického přístupu komplexní ablace, aby došlo k co největšímu ovlivnění patofyziologie složitého arytmogenního substrátu. K širším obkružujícím liniím kolem anter plicních žil a dalším lineárním liniím v levé síni se aplikuje radiofrekvenční energie fokálně nebo se provádí další lineární linie v oblastech rychlé elektrické aktivity a širokých frakcionovaných elektrických potenciálů. Potom se většinou fibrilace síní, která je charakterizovaná naprostou elektrickou dezorganizací, mění a organizuje se v levosíňovou monomorfní tachykardii. Po dalším mapování této monomorfní tachykardie a následné aplikaci radiofrekvenční energie dojde v některých případech k nastolení sinusového rytmu (obr. 7) [42]. Ale ani obnova sinusového rytmu po ablaci perzistentní či permanentní FS nemusí zajistit trvalé odstranění arytmie. Po zhojení lézí může dojít k recidivě FS nebo vzniku levosíňové reentry tachykardie. Pokud vznikne recidiva během několika dnů, potom je snaha o co nejrychlejší obnovu sinusového rytmu i za cenu elektrické kardioverze, aby se vytvořily co nejlepší podmínky pro pozitivní reverzní remodelaci síně. Pokud se arytmie objevuje během několika dnů znova, potom se čeká na zhojení ablačních lézí a elektrická kardioverze se provádí asi za měsíc po výkonu. Pokud se arytmie objevuje po 4–6 měsících znova i po úpravě antiarytmické terapie, volí se reablace.
Image 7. Intrakardiální EKG záznam u katetrové ablace permanentní fibrilace síní. U pacienta s dezorganizovanou permanentní fibrilací síní došlo po komplexní ablaci v levé síni k organizaci do levosíňové monomorfní tachykardie. Po aplikaci radiofrekvenční energie do kritického místa reentry okruhu monomorfní síňové tachykardie dochází k nástupu sinusového rytmu. A – pravidelná síňová aktivita monomorfní síňové tachykardie, následně sinusový stah. Lasso – cirkulární mapovací katetr, snímá aktivitu z plicní žíly, CS – záznam z koronárního sinu, ABL – záznam z ablačního katetru. 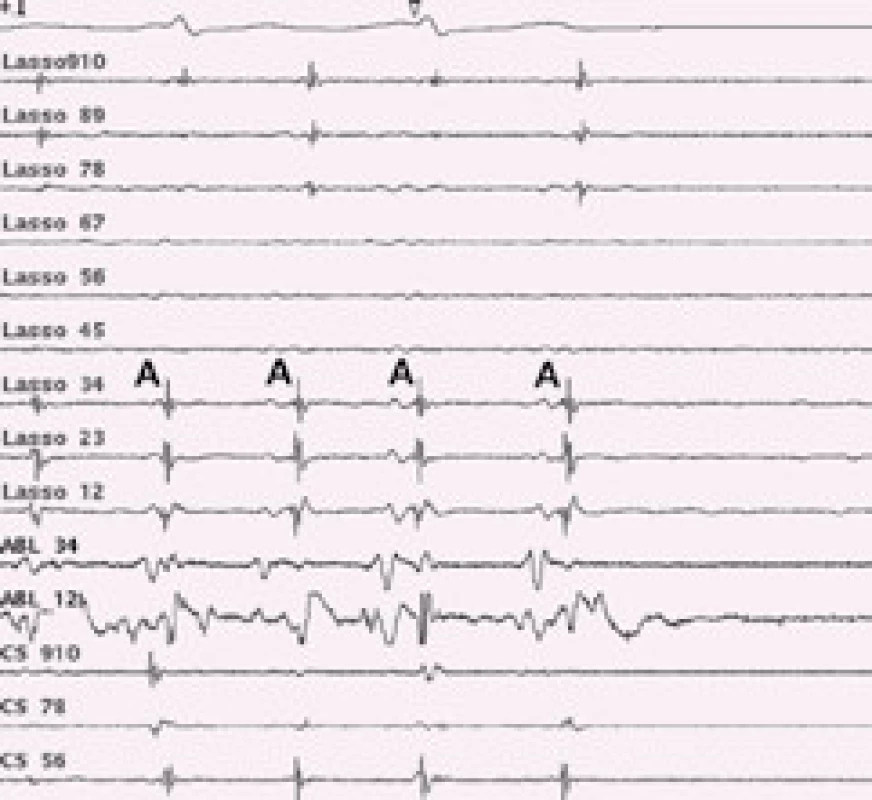
Komplikace
Podle registru komplikací z let 1995–2002 ze 181 kardiologických center byl u 8 745 pacientů s FS léčených katetrovou ablací celkový počet komplikací 6 %. Z nejzávažnějších komplikací se vyskytla cévní mozková příhoda u 0,28 % pacientů, tranzitorní ischemická ataka u 0,66 %, srdeční tamponáda u 1,2 % pacientů a k úmrtí došlo u 0,05 % pacientů [43]. Další vážná komplikace, jakou je atrioezofageální píštěl, je vzácná, vyskytuje se kolem 0,05 %. Při současném přístupu širších obkružujících lézí a provedení elektrické izolace plicních žil se stenóza plicních žil popisuje od 0,5–2 %. Vzhledem k většímu riziku embolizačních příhod jak do koronárních tepen, tak do centrálního nervového systému, je nutné toto embolizační riziko minimalizovat. Pacienti jsou měsíc před zákrokem antikoagulovaní a asi pět dnů před zákrokem jsou převedení na nízkomolekulární heparin v plné terapeutické dávce. Před výkonem se provádí jícnové echo srdce k vyloučení trombu v levé síni. Trombus je kontraindikací výkonu. Během výkonu se kontinuálně podává heparin za kontrol aktivního koagulačního času-ACT a po výkonu se aplikuje nízkomolekulární heparin, než nastoupí účinek warfarinu.
Naše výsledky
Od roku 1995 do konce roku 2007 bylo provedeno na Interní kardiologické klinice FN Brno celkem 1 481 RFA supraventrikulárních tachyarytmií. V roce 2006 tvořily ablace FS 13 % všech ablací SV tachyarytmií, v roce 2007 již 24 %.
V období od září 2004 do prosince 2007 jsme provedli celkem 120 katetrových ablací FS, pacienti byli o průměrném věku 56,2 ± 9,2 let, z toho bylo 40 žen (56,9 ± 9,1 let) a 80 mužů (55,8 ± 9,2 let).
Z toho bylo 97 konvenčních katetrových ablací pro paroxyzmální FS. V našem souboru bylo 37 žen (38 %) a 60 mužů (62 %) o průměrném věku 56,9 ± 9,1 let. K ablaci byli indikovaní pacienti, u kterých selhala antiarytmická terapie. Průměrná doba s paroxyzmy fibrilace síní byla 5,7 ± 4,1 let. Většina pacientů byla bez strukturálního postižení srdce. Průměrná ejekční frakce levé komory byla 63 % ± 7 %, příčný rozměr levé síně 42,8 mm ± 4. Po úspěšné ablaci se zvýšil počet pacientů bez léků z 3,1 na 23,7 % (p < 0,0001), snížil se počet pacientů, kteří medikovali antiarytmika III. třídy – amiodaron z 41,2 % před na 16,5 % po ablaci (p = 0,001) a sotalol z 26,8 % na 10,4 % (p = 0,013). Po ablaci se statisticky významně redukovala antiarytmická i antikoagulační terapie. Bezprostřední úspěšnost konvenční ablace paroxyzmální FS jsme měli 96 %. Pacienti byli sledováni po dobu 23,2 ± 11,2 měsíců. Celková dlouhodobá úspěšnost zákroku byla 82,5 %, shodná s dostupnou literaturou.
Od října 2006 do prosince 2007 jsme provedli celkem 23 katetrových ablací perzistentních nebo permanentních forem FS pomocí trojrozměrného elektroanatomického mapování systémem CARTO. Používali jsme kombinovanou anatomickou a elektrofyziologickou strategii katetrové ablace. Nejdříve jsme provedli širší obkružující linie kolem anter plicních žil s kontrolou elektrické izolace plicních žil, potom jsme přidávali lineární linie v levé síni, nejčastěji ve stropě levé síně a od levostranné „obkružky“ plicních žil k mitrálnímu anulu. Dále jsme vyhledávali rychlé frakcionované potenciály s cílem co nejvíce ovlivnit patofyziologický podklad složitého arytmogenního substrátu se snahou dosáhnout organizace FS do monomorfní síňové tachykardie a nastolení sinusového rytmu. První ablační výkon byl úspěšný u 51 % pacientů, což je také srovnatelné s dostupnou literaturou.
Nové postupy katetrizační ablace FS
V poslední době je snaha dosáhnout co možná nejdokonalejšího trojrozměrného zobrazení srdečních prostor a k tomu se využívá integrace obrazů získaných před zákrokem z počítačové tomografie nebo z magnetické rezonance s trojrozměrnou mapou, získanou systémem Carto nebo NavX [44].
K dokonalejší představě v trojrozměrném prostoru slouží i intrakardiální ultrazvuk, který nám dává informaci bez nutnosti rentgenové kontroly o bezpečném místě transseptální punkce, o umístění ablačního a mapovacího katetru, identifikuje vznik trombu během výkonu, monitorováním mikrobublin nás informuje o přehřátí srdeční tkáně při aplikaci radiofrekvenční energie [45].
Další oblastí vývoje jsou robotizační techniky, které slouží k dálkově řízené katetrizační ablaci. Jedná se o systém elektromagnetické nebo elektromechanické navigace [46].
V poslední době se vyvinula celá řada balónkových katetrů s různým zdrojem energie, jako je laser, kryoenergie, ultrazvuk i radiofrekvenční energie. Využitím těchto balónkových katetrů by mělo dojít ke zjednodušení a zrychlení dlouhých a složitých ablačních výkonů FS. Problémem těchto balónkových katetrů je jejich velikost a zabezpečení jejich dostatečného kontaktu s tkání, aby se dosáhlo účinné ablace [47].
I u katetrizačních ablací FS se zkouší různé zdroje energie. Ale zatím, podobně jako u ostatních arytmií, i u FS je hlavním zdrojem ablační energie energie radiofrekvenční.
V poslední době dochází ke značnému vývoji nových technologií v invazivní terapii FS. Čas ukáže, která z těchto nových technologií se zavede do širší klinické praxe. Za použití nových technik by měla být katetrová ablace nejen jednodušší, rychlejší, ale také účinnější a bezpečnější.
Současné indikace ke katetrizační ablaci FS
V současné době jsou ke katetrizační ablaci indikovaní symptomatičtí pacienti, u kterých nebyla nalezena účinná antiarytmická terapie a většinou nemají přítomné organické postižení srdce. Velmi malé procento tvoří pacienti, kteří preferují invazivní zákrok před léčbou antiarytmiky i po vysvětlení charakteru výkonu a možných rizik.To znamená, že FS by se měla nejlépe léčit již ve stadiu paroxyzmální formy, kdy ještě není přítomná významná remodelace síní. Úspěšná elektrická izolace plicních žil v tomto časném období dává větší pravděpodobnost, že udržíme sinusový rytmus. Pokud zabráníme recidivám paroxyzmální FS, zabráníme tím vzniku elektrické a funkční remodelaci síní. Zabráníme vzniku bludného kruhu fibrilace síní, kdy nám remodelovaná síň prodlužuje trvání fibrilace síní a u déle trvající fibrilace síní – u perzistentní či permanentní formy fibrilace síní – se zase prohlubuje elektrická a funkční remodelace síní.
Stále častěji jsou indikovaní k ablaci i symptomatičtí pacienti s perzistentní nebo permanentní FS, často již s přítomným organickým postižením srdce a dysfunkcí levé komory. Tyto formy FS mají již velmi složitý arytmogenní substrát a je nutná komplexní katetrová ablace v levé síni, ale někdy i v pravé síni, včetně aplikací radiofrekvenční energie v koronárním sinu. Tyto výkony patří k nejsložitějším a nejdelším. Čím složitější je arytmogenní substrát, tím jsou také složitější výkony, které ovlivní patofyziologii substrátu, a je často nutné výkony opakovat.
Jestliže je u srdečního selhání kontrola frekvence rezistentní k farmakologické léčbě a není možná kurativní katetrová ablace FS, je indikována ablace AV junkce s následnou implantací kardiostimulátoru k zajištění efektivní kontroly frekvence. Tato metoda „abluj a stimuluj“ je používána již více než 15 let a má prokázaný efekt [48]. V poslední době se diskutuje především kombinace ablace fibrilace síní s biventrikulární stimulací [49, 50].
Závěr
V posledních deseti letech byla vypracována celá řada strategií k ablační léčbě FS. RF katetrová ablace paroxyzmální fibrilace síní se stává s postupným nabýváním zkušeností katetrizujících dostupnou a účinnou terapií u symptomatických pacientů, u kterých selhala antiarytmická terapie k udržení sinusového rytmu. Předpokládá se, že se bude invazivní terapie indikovat v těch nejčasnějších stadiích FS, kdy ještě nedochází k významné elektrické a funkční remodelaci levé síně, a tím je po zákroku větší šance na udržení sinusového rytmu. Řada studií ukázala, že katetrová ablace je účinnější v zabránění rekurence FS než farmakoterapie. Proto se zřejmě v blízké budoucnosti u některých pacientů, zvláště u paroxyzmální formy, bude uvažovat podobně jako u ostatních supraventrikulárních tachyarytmií o katetrové ablaci jako léčebné metodě první volby.
V současnosti jsou publikovány výsledky, že i u nejtěžších forem permanentních FS u pacientů s organickým postižením srdce a projevy srdečního selhání může být katetrová ablace metodou kurativní s nastolením sinusového rytmu. Jedná se většinou o velmi složité a dlouhé výkony, které se často musí opakovat. Předpokládá se, že další výzkum technik by měl zjednodušit a urychlit techniku ablačního výkonu, aby tato metoda u nejtěžších forem FS našla širší využití.
Práce je podpořena VVZ MŠMT 0021 622 402, grantem IGA MZ NR 9337-3.
Doručeno do redakce 28. 7. 2008
Přijato k otištění po recenzi 1. 9. 2008
MUDr. Růžena Lábrová, Ph.D.
prof. MUDr. Jindřich Špinar, CSc., FESC
Interní kardiologická klinika LF MU a FN Brno
rlabrova@fnbrno.cz
Sources
1. Lévy S, Breithardt G, Campbell RWF et al. Atrial fibrillation: Current knowledge and recommendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J 1998; 19 : 1294-1320.
2. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults. National implications for rhythm management and stroke prevention: The Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285 : 2370-2375.
3. Tsang TS, Petty GW, Barnes ME et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42 : 93–100.
4. Israel CW, Grönefeld G, Ehrlich JR et al. Long-term risk of recurrent atrial fibrillation as documented by an implantable monitoring device: implications for optimal patient care. J Am Coll Cardiol 2004; 43 : 47–52.
5. Fuster V, Ryden LE, Cannom DS et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation - executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation). Eur Heart J 2006; 27 : 1979-2030.
6. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983–988.
7. Madrid AH, Escobar C, Rebollo JM et al. Angiotensin receptor blocker as adjunctive therapy for rhythm control in atrial fibrillation: results of the irbesartan-amiodarone trial. Card Electrophysiol Rev 2003; 7 : 243–246.
8. Roy D, Talajic M, Dorian P et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342 : 913-920.
9. Hohnloser SH. Indications and limitations of class II and III antiarrhytmic drugs in atrial fibrillation. Pacing Clin Electrophysiol 1994; 17 : 1019-1025.
10. Torp-Pedersen C, Møller M, Bloch-Thomsen PE et al. Dofetilide in patients with congestive heart failure and left ventricular dysfunction. Danish Investigations of Arrhythmia and Mortality on Dofetilide Study Group. N Engl J Med 1999; 341 : 857-865.
11. Wazni OM, Marrouche NF, Martin DO et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005; 293 : 2634-2640.
12. Pappone C, Rosanio S, Augello G et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for antrial fibrillation. J Am Coll Cariol 2003; 42 : 185-197.
13. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, patophysiology, and rationale for therapy. Am J Cardiol 2003; 90: D2-D8.
14. Priori SG, Aliot E, Blomstrom-Lundquist C et al. Task force on sudden cardiac death of the European Society of Cardiology. Eur Heart J 2001; 22 : 1374-1450.
15. Oral H, Pappone C, Chung A et al. Circumferantial pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354 : 934-941.
16. Mestroni L. Genomic medicine in atrial fibrillation. J Am Coll Cardiol 2003; 41 : 2193-2196.
17. McGovern PG, Jacobs DR Jr, Shahar E et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota Heart Survey. Circulation 2001; 104 : 19-24.
18. Douglas PS. The left atrium: a biomarker of chronic diastolic dysfunction and cardiovascular disease risk. J Am Coll Cardiol 2003; 42 : 1206-1207.
19. Falk RH. Atrial fibrillation. N Engl J Med 2001; 344 : 1067-1078.
20. Cherf D. Studies on auricular tachycardia caused by aconitine administration. Proc Soc Exp Biol Med 1947; 64 : 233-239.
21. Allessie M, Lammers WJEP, Bonke FIM et al. Experimental evaluation of Moe´s multiple wavelet hypothesis of atrial fibrillation. In: Zipes DP, Jalife J (eds). Cardiac Electrophysiology and Arrhytmias. New York. Grune and Stratton 1985 : 265-275.
22. Moe GK, Rheinboldt WC, Abildskov JA. A computer model of atrial fibrillation. Am Heart J 1964; 67 : 200-220.
23. Cox JL, Schuessler RB, Boineau JP. The development of the Maze procedure for the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg 2000; 12 : 2-14.
24. Sueda T, Nagata H, Shikata H et al. Simple left atrial procedure for chronic atrial fibrillation associated with mitral valve disease. Ann Thorac Surg 1996; 62 : 1796-1800.
25. Haïssaguerre M, Jaïs P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659-666.
26. Nademanee K, Schwab MC, Kosar E et al. A new approach for catheter ablation of atrial fibrillation mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044-2053.
27. Špinar J, Vítovec J. Losartan – víc než pokles krevního tlaku. Kardiol Rev 2006; 8 : 115-120.
28. Haïssaguerre M, Jaïs P, Shah DC et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7 : 1132–1144.
29. Haïssaguerre M, Gencel L, Fischer B et al. Successful catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 1994; 5 : 1045-1052.
30. Haïssaguerre M, Shah DC, Jais P et al. Electrophysiological break-throughs from the left atrium to the pulmonary veins. Circulation 2000; 101 : 1409-1417.
31. Marrouche NF, Dresing T, Cole C et al. Circular mapping and ablation of the pulmonary vein for treatment of atrial fibrillation. J Am Coll Cardiol 2002; 40 : 464–474.
32. Oral H, Chugh A, Good E et al. A tailored approach to catheter ablation of paroxysmal atrial fibrillation. Circulation 2006; 113 : 1824-1831.
33. Fiala M, Chovančík J, Heinz P et al. Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni: bezprostřední a dlouhodobé výsledky u 150 pacientů. Vnitr Lek 2005; 51 : 971-983.
34. Tsang TS, Petty GW, Barnes ME et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42 : 93–100.
35. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation. Efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104 : 2539-2544.
36. Ouyang F, Bänsch D, Ernst S et al. Complete isolation of the left atrium surrounding the pulmonarz veins: new insights form the double-lasso technique in paroxysmal atrial fibrillation. Circulation 2004; 110 : 2090-2096.
37. Pappone C, Santinelli V, Manguso F et al. Pulmonary vein denervation enhances long.term benebit after circumferential ablation for paroxysmal aatrial fibrillation. Circulation 2004; 109 : 327-334.
38. Nademanee K, Schwab MC, Kosar E et al. A new approach for catheter ablation of atrial fibrillation mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044-2053.
39. Lévy S, Maarek M, Coumel P et al. Characterization of different subsets of atrial fibrillation in general practice in France. The ALFA Study. The College of French Cardiologists. Circulation 1999; 99 : 3028-3035.
40. Hsu LF, Jaïs P, Sanders P et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004; 351 : 2373-2383.
41. Oral H, Pappone C, Chung A et al. Circumferantial pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354 : 934-941.
42. Haïssaguerre M, Sanders P, Hocini M et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termintion. J Cardiovasc Electrophysiol 2005; 16 : 1125-1137.
43. Cappato R, Calkins H, Chen SA et al. Worldwide survey on the methods, efficacy and safety of catheter ablation for human atrial fibrillation. Circulation 2005; 111 : 1100-1105.
44. Malchano ZJ, Neuzil P, Cury RC et al. Integration of cardiac CT/MR imaging with three-dimensional electroanatomical mapping to guide catheter manipulation in the left atrium: implications for catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17 : 1221-1229.
45. Marrouche N, Martin DO, Wazni O et al. Phased-array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with atrial fibrillation: impact on outcome and complications. Circulation 2003; 107 : 2710-2716.
46. Pappone C, Vecedomini G, Manguso F et al. Robotic magnetic navigation for atrial fibrillation ablation. J Am Coll Cardiol 2006; 47 : 1390-1400.
47. Reddy VY, Houghtaling C, Fallon J et al. Use of a diode laser ballon ablation catheter to generate circumferential pulmonary venous lesions in an open-thoracotomy caprine model. Pacing Clin Electrophysiol 2004; 27 : 52-57.
48. Wood MA, Brown-Mahoney C, Kay GN, Ellenbogen KA. Clinical outcome after ablation and pacing therapy for atrial fibrillation: a meta analysis. Circulation 2000; 101 : 1138-1144.
49. Gasparini M, Aurichio A, Metra M et al. Long term survival in patients undergoing cardiac resynchronisation therapy: the importance of performing atrio-ventricular junction ablation in patients with permanent atrail fibrillation. Eur Heart J 2008; 29 : 1644-52
50. Leciercq C, Mabo P. Cardiac resynchronisation therapy and atrial fibrillation. Do we have final answer? Eur Heart J 2008; 29 : 1597-1599.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2008 Issue 3
Most read in this issue- Srdeční selhání s normální ejekční frakcí
- Katetrizační ablace fibrilace síní
- Srovnání rozdílů mezi muži a ženami u akutního infarktu myokardu
- Aerobní kapacita u nemocných s ischemickou chorobou srdeční
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

