-
Medical journals
- Career
Srdeční selhání s normální ejekční frakcí
: J. Hradec
: III. interní klinika 1. LF UK a VFN
: Kardiol Rev Int Med 2008, 10(3): 111-116
Srdeční selhání s normální ejekční frakcí (EF), označované také jako srdeční selhání se zachovanou systolickou funkcí nebo diastolické srdeční selhání, představuje více než 50 % všech případů srdečního selhání. K jeho diagnóze musí být splněny následující podmínky: (1) příznaky a známky srdečního selhání, (2) normální systolická funkce (EF) levé komory, (3) průkaz diastolické dysfunkce. Za normální systolickou funkci je považována EF > 0,50. Diagnostický průkaz diastolické dysfunkce levé komory může být získán invazivně (např. plnící tlak levé komory > 16 mm Hg nebo tlak v zaklínění plícnice > 12 mm Hg), nebo neinvazivně, nejlépe tkáňovým Dopplerem (Tissue Doppler Imaging – TDI). Spolehlivým diagnostickým ekvivalentem diastolické dysfunkce je hypertrofie levé komory. Pomocný význam pro neinvazivní průkaz diastolické dysfunkce má dopplerovská transmitrální průtoková křivka nebo krevní tok v plicních žilách, index objemu levé síně a přítomnost fibrilace síní. Diagnózu srdečního selhání zpřesňuje stanovení plazmatických koncentrací natriuretických peptidů. Normální hodnoty mají vysokou negativní prediktivní hodnotu.
Velké množství velkých, randomizovaných, placebem kontrolovaných klinických studií poskytuje důkazy, na nichž je založeno léčení nemocných se systolickým srdečním selháním.
Pro srdeční selhání s normální EF takové studie, až na jedinou výjimku (studie CHARM), chybí nebo ještě nebyly ukončeny. Léčba srdečního selhání s normální EF proto zůstává empirická.Klíčová slova:
srdeční selhání s normální ejekční frakcí – diastolická dysfunkce levé komory – tkáňový Doppler – natriuretické peptidyÚvod
Srdeční selhání může být způsobeno progredující systolickou dysfunkcí levé komory, progredující diastolickou dysfunkcí levé komory nebo jejich kombinací. O srdečním selhání na podkladě systolické dysfunkce je shromážděno obrovské množství informací, jsou stanovena jednoduchá a srozumitelná diagnostická kritéria a existuje velké množství klinických studií, které dávají jasný a na důkazech založený návod, jak ho racionálně léčit. Naproti tomu kolem srdečního selhání na podkladě diastolické dysfunkce levé komory je spousta nejasností. Chybí jednoduchá diagnostická kritéria a takřka neexistují klinické studie, které by poskytly důkazy pro racionální léčbu. Léčba je proto víceméně empirická, vychází většinou z teoretických předpokladů a nahromaděných zkušeností.
Víme vůbec, o čem mluvíme?
Nejednoznačnosti začínají u terminologie. Často se používá termín diastolické srdeční selhání jako analogie k systolickému srdečnímu selhání. Tento termín však vyžaduje objektivní a jednoznačný průkaz diastolické dysfunkce levé komory, podobně jako nezbytnou podmínkou diagnózy systolického srdečního selhání je objektivní a jednoznačný průkaz systolické dysfunkce levé komory, nejčastěji v podobě nízké ejekční frakce. Problémem je, že pro průkaz diastolické dysfunkce levé komory neexistuje takový jednoduchý, srozumitelný a jednoduše měřitelný ukazatel, jakým je ejekční frakce. Diastola je totiž velmi komplexní děj určovaný relaxací myokardu levé komory, jejím pasivním plněním, diastolickou distenzibilitou a myokardiální tuhostí. Přesně charakterizovat diastolickou funkci levé komory je možné pouze invazivně, současným měřením tlaku a objemu levé komory, konstrukcí tlakově-objemových křivek a výpočtem diastolické relaxační konstanty tau a konstanty tuhosti myokardu. Diastolickou dysfunkcí rozumíme abnormality v diastolické distenzibilitě, plnění nebo relaxaci levé komory bez ohledu na to, zda je ejekční frakce normální či abnormální a zda je pacient symptomatický nebo asymptomatický. Teprve když se u takového pacienta rozvine intolerance zátěže a námahová dušnost, zejména v kombinaci s plicní kongescí či dokonce až plicním edémem, je na místě stav označit jako diastolické srdeční selhání [1]. Není úplně jasné, zda a jak rychle progreduje asymptomatická diastolická dysfunkce levé komory do diastolického srdečního selhání. V jedné populační studii se v průběhu pěti let vyvinulo srdeční selhání u 11–15 % osob starších 65 let, které neměly klinicky prokazatelné srdeční onemocnění, ale měly dopplerovské známky diastolické dysfunkce levé komory [2].
Pro stanovení diagnózy diastolického srdečního selhání je tedy nutný spolehlivý objektivní průkaz diastolické dysfunkce levé komory. V klinické praxi však většinou máme k dispozici pouze nepřímé známky poruchy komplexní diastolické funkce, získané většinou některou z echokardiografických a/nebo dopplerovských technik. Tyto techniky však neumožňují diastolickou (dys)funkci kvantifikovat, maximálně jen hrubě semikvantifikovat. Diastolická dysfunkce levé komory také není specifická pouze pro diastolické srdeční selhání, ale pravidelně se objevuje také u nemocných se systolickým srdečním selháním. Při systolickém srdečním selhání dokonce známky diastolické dysfunkce, jakými jsou např. pomalá relaxace nebo zvýšená tuhost levé komory, korelují s klinickými symptomy lépe než ejekční frakce [3]. Mnozí proto trvají na tom, aby byl používán poněkud širší termín srdeční selhání se zachovanou systolickou funkcí levé komory nebo srdeční selhání s normální ejekční frakcí (EF).
Přestože je EF zachována, mají nemocní se srdečním selháním a normální EF myokardiální rychlosti měřené tkáňovým Dopplerem (TDI) snížené a mají abnormální ventrikulo-arteriální „coupling“ [4]. Na základě těchto pozorování byl zpochybněn rozdíl mezi systolickým a diastolickým srdečním selháním [5] a srdeční selhání je považováno stále častěji za jediný syndrom charakterizovaný progresivním snižováním systolické výkonnosti, které je lépe a přesněji dokumentované myokardiálními rychlostmi, měřenými TDI, než ejekční frakcí. Tento koncept jediného syndromu srdečního selhání je posilován také unimodální distribucí EF levé komory ve velkých klinických studiích, do kterých byli zařazeni nemocní s nízkou i normální EF [6]. Ve světle této hypotézy ztrácí EF svoji diskriminační hodnotu a přesnější je pak termín srdeční selhání s normální EF nebo srdeční selhání se zachovanou systolickou funkcí než diastolické srdeční selhání. Podle této hypotézy je hlavním rozdílem mezi oběma konci spektra syndromu srdečního selhání (srdeční selhání s nízkou EF a srdeční selhání s normální EF) stupeň dilatace a změna konfigurace levé komory, tedy to, co nazýváme remodelací levé komory [7]. Srdeční selhání s normální EF (diastolické) se pak může s rozvojem remodelace levé komory vyvíjet do srdečního selhání s nízkou EF (systolického).
Strukturální, funkční a molekulárně biologické argumenty však jednoznačně podporují hypotézu, že klinický syndrom srdečního selhání nevyniká a nerozvíjí se jako jediný syndrom, ale dva syndromy – jeden se sníženou EF a druhý s normální EF a specifickými mechanizmy, které jsou odpovědné za vznik diastolické dysfunkce levé komory. Nemocní se systolickým srdečním selháním mají excentrickou hypertrofii levé komory, zatímco nemocní s diastolickým srdečním selháním mají koncentrickou hypertrofii levé komory. Rozdíly mezi systolickým a diastolickým srdečním selháním existují také na ultrastrukturální úrovni: nemocní s diastolickým srdečním selháním mají o 50 % větší průměr kardiomyocytů než nemocní se systolickým selháním a mají také vyšší denzitu myofilamentů. Kardiomyocyty izolované z myokardiálních biopsií u nemocných s diastolickým a systolickým srdečním selháním se také liší funkčně.
Jak častý je to problém a jaká je prognóza?
V průřezových a populačních průzkumech v devadesátých letech minulého století měla minimálně jedna třetina všech nemocných s chronickým srdečním selháním normální nebo takřka normální EF. Přirozený průběh srdečního selhání s normální EF se zdál být benignější než u systolického srdečního selhání s asi o třetinu nižší celkovou mortalitou a nižší nebo srovnatelnou morbiditou. V uplynulých 15 letech se však tento pohled na srdeční selhání s normální EF dost podstatně změnil. Prevalence srdečního selhání s normální EF stoupla z jedné třetiny na více než polovinu všech případů srdečního selhání [8]. Navíc se ukázalo, že prognóza nemocných se srdečním selháním s normální EF je stejně pochmurná jako prognóza nemocných se systolickým srdečním selháním [9]. Predisponujícími faktory pro vznik srdečního selhání s normální EF jsou vyšší věk, ženské pohlaví, diabetes mellitus, obezita, arteriální hypertenze a hypertrofie levé komory.
Vzhledem k epidemiologickému vývoji s predominancí srdečního selhání s normální EF v populacích rozvinutých zemí byla nedávno redefinována původní diagnostická kritéria srdečního selhání s normální EF [7]. Toto redefinování se soustředilo na body, které byly v původních diagnostických kritériích oprávněně kritizovány [1,10,11], a využilo nové patofyziologické poznatky, moderní zobrazovací technologie a dnes již běžné stanovování biochemických markerů srdečního selhání – natriuretických peptidů BNP a NT-proBNP [7]. Faktory, které vedou k retenci tekutin a precipitují vznik srdečního selhání z asymptomatické dysfunkce levé komory, jsou stejné pro systolické srdeční selhání i srdeční selhání s normální EF. Patří mezi ně nekontrolovaná nebo dekompenzovaná hypertenze, fibrilace síní, špatná compliance k léčbě, vysazení medikace k léčbě srdečního selhání, ischemie myokardu, anémie, renální selhání, užívání nesteroidních antirevmatik nebo thiazolidindionů, přesolování potravy či nadměrná konzumace minerálních vod.
Pro diagnózu srdečního selhání s normální EF musí být splněny tři obligátní podmínky
Podle amerických doporučení ACC/AHA musí být diagnóza srdečního selhání s normální EF postavena na (1) typických symptomech a fyzikálních známkách srdečního selhání (2) u pacienta, který má normální hodnotu EF (> 0,50) nezvětšené levé komory [12]. Doporučení evropská vyžadují navíc ještě (3) objektivní průkaz abnormální relaxace, plnění, diastolické distenzibility nebo diastolické tuhosti levé komory [1]. Algoritmus diagnostiky srdečního selhání s normální EF je uveden na obr. 1. Někteří kardiologové ale argumentují, že dg. srdečního selhání s normální EF může být udělána klinicky pouze na základě spolehlivých dokladů o existenci srdečního selhání a normální EF, tak jak to říkají americká doporučení. Definitivní průkaz diastolické dysfunkce může být získán pouze v katetrizační laboratoři a představuje již jen neoddiskutovatelné potvrzení diagnózy.
1. Algoritmus diagnostiky srdečního selhání s normální ejekční frakcí [7]. ![Algoritmus diagnostiky srdečního selhání s normální ejekční frakcí [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2e17687e44a3a49b6a14fa1f0d652497.jpg)
mPCWP – střední plicní kapilární tlak v zaklínění; LVEDP – tlak v levé komoře na konci diastoly (plnící tlak); tau – časová konstanta relaxace levé komory; b – konstanta tuhosti levé komory; TDI – tkáňový Doppler; E – trasmitrální časně diastolická rychlost toku krve; E’ – časná rychlost prodloužení myokardu levé komory měřená TDI; NT- proBNP – N‑terminální část prohormonu proBNP; BNP – natriuretický peptid typu B; E/ A – poměr časně diastolické (E) a pozdně diastolické (A) transmitrální rychlosti toku krve; DT – decelerační čas; LVMI – index hmotnosti svaloviny levé komory; LAVI – index objemu levé síně. 1. Příznaky a známky srdečního selhání
Symptomy a fyzikální známky jsou specifické pro syndrom srdečního selhání, nikoliv pro jeho etiologii. Jsou proto stejné u srdečního selhání s normální i nízkou EF. Dušnost je obvykle nejčasnějším symptomem, zatímco svalová slabost, únavnost a nevýkonnost se objevují až později, při poklesu srdečního výdeje. Dušnost, podmíněná plicní kongescí, se někdy velmi obtížně interpretuje, zejména u starých a obézních nemocných. Svalovou slabost a sníženou výkonnost můžeme objektivizovat šestiminutovým testem chůzí, jasně snížená výkonnost je ujití vzdálenosti < 300 m. Tento jednoduchý test však u nás nikdy nedoznal větší obliby a provádí se většinou jen při klinických studiích. Asi nejpřesnější potvrzení snížené výkonnosti představuje spiroergometrie se stanovením maximální spotřeby kyslíku VO2max. Tato metoda je ale u nás také málo dostupná a provádí se jen na specializovaných pracovištích.
Fyzikální známky se mohou při chronickém srdečním selhání s normální EF objevit až o dost později než dušnost. Patří mezi ně tachykardie, třetí srdeční ozva, event. svalový rytmus, poslechový korelát plicní venostázy od venostatických chrůpků na plicních bázích až k obrazu plicního edému, periferní otoky, zvýšená náplň krčních žil, event. jejich systolická pulzace a hepatosplenomegalie.
2. Normální systolická funkce levé komory
Jak již bylo řečeno výše, má hodnota EF při srdečním selhání unimodální distribuci, proto hranice mezi normální a sníženou EF bude vždy arbitrární [6]. Za diskriminační je nejčastěji považována hodnota 0,50. Při srdečním selhání s normální EF musí být EF > 0,50 a levá komora by neměla být dilatována, tj. její indexovaný diastolický objem by měl být < 97 ml/m2 a indexovaný systolický objem < 49 ml/m2 [7]. Odstup mezi akutní epizodou srdečního selhání a měřením EF nemá být podle amerických doporučení delší než tři dny [12]. Zdá se ale, že tato podmínka může být již obsolentní, protože při sériovém měření EF a objemů levé komory u nemocných s hypertenzním plicním edémem dopplerovskou echokardiografií se hodnoty v akutní situaci a po stabilizaci stavu nelišily, nebyla pozorována žádná tendence k jejich normalizaci [13].
3. Objektivní průkaz abnormalit diastolické funkce
Tato podmínka, stanovená jako nezbytná pro dg. srdečního selhání s normální EF pracovní skupinou Evropské kardiologické společnosti [1], je některými zpochybňována [14]. Její odpůrci argumentují obtížemi a nespolehlivostí hodnocení diastolické (dys)funkce levé komory v rutinní klinické praxi. Zbytnost či nezbytnost této podmínky pro stanovení dg. srdečního selhání s normální EF proto byla testována. U nemocných s prokázaným srdečním selháním, EF > 0,50 a koncentrickou hypertrofií levé komory mělo 92 % zvýšený plnící tlak levé komory a všichni měli minimálně jeden hemodynamický nebo dopplerovský ukazatel abnormální diastolické funkce levé komory [14]. Koncentrická hypertrofie levé komory tak sama o sobě představuje spolehlivý průkaz diastolické dysfunkce, hledání jakéhokoliv jiného důkazu diastolické dysfunkce je naprosto zbytečné a mělo by jen potvrzovací význam.
Diagnostické metody
Klíčovou úlohu v diagnostice srdečního selhání s normální EF nepochybně hraje echokardiografie. Je tou nejčastější metodou stanovení hodnoty EF v klinické praxi. Navíc rychle a spolehlivě vyloučí jiné diagnózy, které mohou způsobit příznaky a známky srdečního selhání a je při nich normální EF, jako jsou např. mitrální a aortální regurgitace nebo konstriktivní perikarditida. Pro posouzení diastolické funkce je užitečná především dopplerovská echokardiografie, která měří intrakardiální proudění krve. Transmitrální diastolický proud závisí na transmitrálním tlakovém gradientu a je tedy ovlivňován časně diastolickou relaxací levé komory a tlakem v levé síni. Podle charakteru transmitrální dopplerovské průtokové křivky lze posuzovat diastolickou (dys)funkci a alespoň semikvantitativně odhadovat její tíži (obr. 2). Jiným způsobem posouzení diastolické funkce je vyšetření toku krve z plicních žil do levé síně. Přesnější a spolehlivější je metoda tkáňového Dopplera (TDI), která umožňuje přímé měření rychlosti změny myokardiální délky, což je ukazatel komorové relaxace. Nejčastěji používanou TDI metodou je měření bazální (anulární) longitudinální rychlosti myokardiálního zkrácení nebo prodloužení levé komory. Měření se provádí buď na septální, nebo laterální straně mitrálního prstence. Vrcholová systolická rychlost zkrácení (S) je považována za velmi citlivý parametr systolické funkce, dokonce spolehlivější než je hodnota EF. Podobně časně diastolická rychlost zkrácení (E‘) je považována za velmi citlivý ukazatel funkce diastolické. Parametrem, který nejlépe koreluje s plnícím tlakem levé komory, je poměr časně diastolické dopplerovské transmitrální rychlosti E a časně diastolické TDI rychlosti myokardiálního zkrácení E‘, tedy poměr E/E‘. Rychlost E totiž závisí na tlaku v levé síni, relaxaci levé komory a věku, zatímco rychlost E‘ závisí na relaxaci levé komory a věku. V poměru E/E‘ se tak vliv relaxace levé komory a věku vzájemně eliminuje a tento poměr se stává ukazatelem tlaku v levé síni neboli plnícího tlaku levé komory. Když je E/E‘ > 15, je plnící tlak levé komory zvýšen, při E/E‘ < 8 je plnící tlak levé komory nízký [15]. Těsný vztah mezi poměrem E/E‘ a plnícím tlakem levé komory byl potvrzen u nemocných se srdečním selháním s nízkou (< 0,50), stejně jako normální (> 0,50) EF [16], u nemocných s pomalou relaxací levé komory, stejně jako u nemocných s pseudonormalizovanou transmitrální dopplerovskou křivkou [17]. Poměr E/E‘ v rozmezí 8–15 je považován za vzbuzující podezření na diastolickou dysfunkci, ale nikoliv za diagnostický.
2. Charakter transmitrální dopplerovské křivky při diastolické dysfunkci levé komory. 
Nejnověji se intenzivně zkoumá praktický význam nových TDI metod a ukazatelů – měření vnitřní rychlosti regionální deformace (strain) a rychlosti této deformace (strain rate) myokardu. Tyto parametry jsou na rozdíl od myokardiální rychlosti nezávislé na translačních pohybech srdce. Protože se měří regionální deformace, k posouzení diastolické (dys)funkce musí být měření prováděno ve všech (obvykle mnoha) segmentech levé komory. Hodnocení získaných křivek je složité, málo srozumitelné, a proto se v klinické praxi zatím neujalo. Naproti tomu je poměr E/E‘ jednoduchý, srozumitelný a hodnotí globální diastolickou funkci levé komory, a proto je v klinické praxi rutinně používán. Jeho hodnocení je obvyklou součástí softwarového vybavení všech moderních echokardiografických systémů.
Poměrně jednoduchým parametrem s vysokou výpovědní hodnotou o diastolické (dys)funkci je velikost levé síně. Přesnější než prostý průměr nebo plocha je objem levé síně indexovaný na povrch těla – index objemu levé síně (Left Atrial Volume Index – LAVI). Zvýšení LAVI > 32 ml/m2 je u starších lidí mohutným nezávislým prediktorem budoucího výskytu kardiovaskulárních příhod. Jeho hodnota se také zvyšuje při diastolické dysfunkci levé komory z průměrných 23 ± 6 ml/m2 u kontrol na 25 ± 8 ml/m2 u lehké diastolické dysfunkce, 31 ± 8 ml/m2 u středně těžké až k 48 ± 21 ml/m2 u těžké diastolické dysfunkce [18]. V současných diagnostických algoritmech hodnota LAVI < 29 ml/m2 vylučuje a > 40 ml/m2 potvrzuje diastolickou dysfunkci levé komory [7].
Prakticky stejné parametry diastolické funkce levé komory a navíc ještě některé jiné lze získat také vyšetřením magnetickou rezonancí (MRI). Vzhledem k nízké dostupnosti a vysoké ceně přístrojů však zatím MRI zůstává metodou výzkumnou. Lze ale očekávat, že se v budoucnosti bude stále více uplatňovat i v běžné klinické praxi.
Jak nám pomáhají natriuretické peptidy?
Největší problémy v diagnostice srdečního selhání s normální EF dělá průkaz srdečního selhání samotného. Specificita nejčastějších symptomů srdečního selhání – dušnosti, únavy a periferních otoků – je velmi nízká a často vede k falešně pozitivní diagnóze. Spolehlivost diagnózy srdečního selhání významně zvyšuje stanovení plazmatických koncentrací natriuretických peptidů – BNP nebo NT-proBNP. U nemocných se srdečním selháním s normální EF korelují hodnoty NT-proBNP s ukazateli časně diastolické relaxace levé komory, jako je časová relaxační konstanta tau, ukazateli pozdně diastolické relaxace, jako je plnící tlak levé komory, a ukazateli komorové tuhosti [19,20]. Natriuretické peptidy také zhruba korelují se stupněm diastolické dysfunkce levé komory, progresivně se zvyšují od transmitrálních dopplerovských známek abnormální relaxace (E/A < 1,0), přes pseudonormalizaci transmitrální dopplerovské křivky až k restriktivnímu charakteru plnění levé komory [21]. Plazmatické koncentrace natriuretických peptidů jsou nejvíce ovlivňovány plnícím tlakem levé komory, ale má na ně vliv i celá řada extrakardiálních vlivů. Zvyšují se s věkem, u žen, při obezitě, renální insuficienci, jaterním selhání a sepsi. Jejich hlavní předností je vysoká negativní prediktivní hodnota. Jejich normální plazmatické koncentrace, tj. pro BNP < 100 pg/ml a pro NT-proBNP < 120 pg/ml, srdeční selhání prakticky vylučují [22].
Léčení zatím zůstává víceméně empirické
Léčení srdečního selhání s normální EF má dva hlavní cíle: (1) odstranit nebo alespoň zmírnit následky diastolické dysfunkce (např. plicní kongesci a intoleranci zátěže) a (2) eliminovat nebo alespoň zmírnit faktory odpovědné za vznik diastolické dysfunkce.
Počáteční léčba je u nemocných se srdečním selháním s normální EF, stejně jako při systolickém srdečním selhání, zaměřena na snížení plicní kongesce diuretiky. Akutní diastolické selhání, typicky např. plicní edém při hypertenzní krizi, se léčí standardně, tj. inhalací kyslíku, morfinem, parenterálně podanými kličkovými diuretiky a parenterálními nitráty. Při agresivní diuretické léčbě si musíme být vědomi rizika závažné hypotenze, protože prudké snížení preloadu sníží plnění levé komory a vede k následnému poklesu minutového objemu. Tachykardie je při srdečním selhání s normální EF mimořádně nevýhodná. Vede k neúplné relaxaci s poklesem plnícího tlaku levé komory a jejím sníženým plněním. Navíc zhoršuje i koronární perfuzi a může vést k ischemii myokardu i při nepřítomnosti ICHS.
Proto může u nemocných se srdečním selháním s normální EF vést náhle vzniklá fibrilace síní s rychlou komorovou frekvencí až ke vzniku plicního edému s hypotenzí. Taková situace vyžaduje urgentní kardioverzi. Ke kontrole komorové frekvence se u nemocných se srdečním selháním s normální EF používají betablokátory nebo bradykardizující blokátory kalciových kanálů verapamil nebo diltiazem.
Na rozdíl od systolického srdečního selhání, u kterého je léčba založena na přesvědčivých důkazech z desítek velkých klinických studií, jako vodítko k racionální léčbě srdečního selhání s normální EF byly zatím publikovány výsledky jediné velké klinické studie – studie CHARM-Preserved [23]. V této studii bylo 3 025 nemocným s chronickým srdečním selháním ve funkční třídě NYHA II-IV a zachovanou systolickou funkcí levé komory (EF > 0,40) randomizováno k léčbě candesartanem ve vysoké denní dávce 32 mg nebo placebem. Candesartan dosti překvapivě po třech letech nevedl k významnému snížení výskytu primárního endpointu (součet kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání) (RRR = 11 %; p = 0,12). Kardiovaskulární mortalita, výskyt infarktů myokardu a cévních mozkových příhod nebyly vůbec ovlivněny. Candesartan vedl pouze k hraničně významnému snížení hospitalizací pro srdeční selhání (RRR = 15 %; p = 0,047) [23]. Klinické charakteristiky nemocných s předpokládaným diastolickým srdečním selháním, kteří byli zařazeni do studie CHARM-Preserved, se dost významně liší od klinických charakteristik nemocných se srdečním selháním s normální EF, popisovaných v mnoha observačních studiích [24]. Je nejasné, do jaké míry mohou tyto rozdíly vysvětlit nepřesvědčivé výsledky studie CHARM-Preserved.
Zcela nedávno byla ukončena jiná velká randomizovaná, placebem kontrolovaná klinická studie – I. PRESERVE. Její výsledky budou poprvé veřejně prezentovány na kongresu AHA v listopadu 2008. V této studii je u pacientů s chronickým srdečním selháním s normální EF proti placebu testován účinek jiného blokátoru receptorů AT1 pro angiotenzin II – irbesartanu. Zařazovací kritéria do této studie byla přísnější, diastolická dysfunkce musela být lépe objektivně dokumentovaná a také klinické charakteristiky zařazených nemocných lépe odpovídají charakteristikám nemocných z observačních epidemiologických studií [25].
Některé malé krátkodobé studie u hypertoniků, nemocných s ICHS nebo obojím a normální EF naznačují, že v léčbě nemocných se srdečním selháním s normální EF mohou být užitečné inhibitory ACE, blokátory receptorů pro aldosteron a blokátory kalciových receptorů. Všechny tyto léky zvyšují toleranci zátěže.
Při vzniku srdečního selhání s normální EF má klíčový význam hypertenze. Léčba hypertenze včetně izolované systolické hypertenze u starších lidí vede k dramatickému snížení incidence srdečního selhání. Např. ve studii SHEP (Systolic Hypertension in the Elderly Program) vedla antihypertenzní léčba založená na thiazidových diureticích k průměrnému TK = 143/68 mm Hg ve srovnání se 155/72 mm Hg při placebu. Tento průměrný pokles systolického tlaku o 12 mm Hg měl za následek snížení výskytu srdečního selhání o 50 % [26]. Vzhledem k tomu, že 80–90 % nemocných s chronickým srdečním selháním s normální EF má hypertenzi a že tato hypertenze nepochybně hraje při vzniku srdečního selhání s normální EF významnou roli, je důsledná kontrola hypertenze tím nejdůležitějším léčebným opatřením. Antihypertenzivy první volby by měly být léky s největší schopností navodit regresi hypertrofie levé komory, a to jsou především léky blokující na různých úrovních RAAS – inhibitory ACE, blokátory receptorů pro angiotenzin II (sartany), blokátory receptorů pro aldosteron (spironolakton, eplerenon) a nejnověji i blokátory receptorů pro renin (aliskiren).
Také ischemie myokardu je častou (spolu)příčinou diastolické dysfunkce. Proto také u každého nemocného s prokázanou ischemií myokardu je plně indikována katetrizační nebo chirurgická koronární revaskularizace.
Souhrn léčby srdečního selhání s normální EF je uveden v tab. 1.
1. Přehled léčebných postupů u nemocných se srdečním selháním s normální ejekční frakcí. 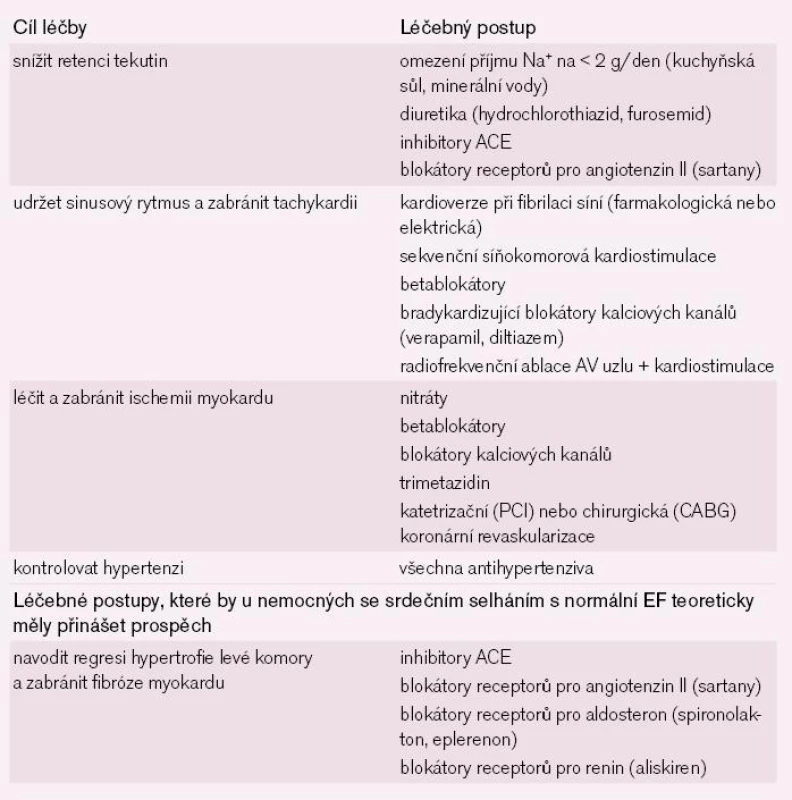
Závěr
Přestože srdeční selhání s normální EF je přítomno u více než 50 % všech nemocných se srdečním selháním a jeho prevalence v populaci stoupá přibližně o 1 % ročně [27], zůstává kolem tohoto klinického syndromu stále mnoho nejasností. Diskuze se vedou dokonce i o tom, zda tento syndrom existuje jako samostatná entita či zda jde jen o dva konce spektra klinického syndromu srdečního selhání. Existují silné argumenty pro i proti. Mnoho nejasností vyplývá i z toho, že diagnostická kritéria jsou stále nedokonalá. Doporučení pracovní skupiny ESC požadují jako jednu ze tří nezbytných podmínek pro diagnózu srdečního selhání s normální EF objektivní průkaz diastolické dysfunkce, ať již v podobě abnormální relaxace, plnění, distenzibility nebo tuhosti levé komory. V rutinní klinické praxi je dnes nejužívanější a relativně nejspolehlivější metodou průkazu diastolické dysfunkce měření diastolické rychlosti longitudinálního prodloužení levé komory pomocí tkáňového Dopplera. Parametry odvozené z tohoto měření v kombinaci s parametry z dopplerovsky hodnocené transmitrální průtokové křivky, konkrétně poměr E/E’, dobře korelují s plnícím tlakem levé komory.
Při chybění klinických studií a z nich vyplývajících důkazů je léčba srdečního selhání s normální EF víceméně empirická. Má za cíl eliminovat vyvolávající nebo precipitující faktory diastolické dysfunkce, jako jsou hypertenze, tachykardie a ischemie. Při známkách retence tekutin jsou na místě diuretika, ovšem v opatrných dávkách, aby nedošlo k přílišnému snížení preloadu. V antihypertenzní léčbě jsou preferované léky, které mohou navodit regresi hypertrofie levé komory, tedy především léky blokující RAAS.
Doručeno do redakce 20. 7. 2008
Přijato k otištění po recenzi 1. 9. 2008
prof. MUDr. Jaromír Hradec, CSc., FESC
III. interní klinika 1. LF UK a VFN
e‑mail: jhradec@vfn.cz
Sources
1. European Study Group on Diastolic Heart Failure. How to diagnose diastolic heart failure. Eur Heart J 1988; 19 : 990–1003.
2. Aurigemma GP, Gottdiener JS, Shemanski L et al. Predictive value of systolic and diastolic function for incident congestive heart failure in the elderly: The cardiovascular health study. J Am Coll Cardiol 2001; 37 : 1042–1048.
3. Hadano Y, Murata K, Yamamoto T et al. Usefulness of mitral annular velocity in predicting exercise tolerance in patients with impaired left ventricular systolic function. Am J Cardiol 2006; 97 : 1025–1028.
4. Vinereanu D, Nicolaides E, Tweddel AC et al. “Pure“ diastolic dysfunction is associated with long-axis systolic dysfunction. Implications for the diagnosis and classification of heart failure. Eur J Heart Fail 2005; 7 : 820–828.
5. Burkhoff D, Maurer MS, Packer M. Heart failure with normal ejection fraction, is it really a disorder of diastolic function? Circulation 2003; 107 : 656–658.
6. Solomon SD, Anavekar N, Skali H et al. Influence of ejection fraction on cardiovascular outcomes in a broad spectrum of heart failure patients. Circulation 2005; 112 : 3738–3744.
7. Paulus WJ, Tschöpe C, Sanderson JE et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007; 28 : 2539–2550.
8. Owan TE, Hodge DO, Herges RM et al. Trend in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355 : 251–259.
9. Cleland JG, Swedberg K, Follath F et al. Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology.
10. Hradec J. Diastolické srdeční selhání. Diagnostika, epidemiologie, prognóza. Kardiol Rev 2004; 4 : 156-160.
11. Hradec J. Diastolické srdeční selhání. Remedia 2004; 14 : 121–125.
12. Hunt SA, Baker DW, Chin MH et al. ACC/AHA Guidelines for the evaluation and management of chronic heart failure in the adult: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to revise the 1995 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol 2001; 38 : 2101–2113.
13. Gandhi SK, Powers JC, Nomeir AM et al. The pathogenesis of acute pulmonary edema associated with hypertension. N Engl J Med 2001; 344 : 17–22.
14. Zile MR, Gaasch WH, Carroll JD et al. Heart failure with normal ejection fraction: is measurement of diastolic function necessary to make diagnosis of diastolic heart failure? Circulation 2001; 104 : 779–782.
15. Ommen SR, Nishimura RA, Appleton CP et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures. A comparative simultaneous Doppler-catheterization study. Circulation 2000; 102 : 1788–1794.
16. Dokainish H, Zoghbi WA, Lakkis NM et al. Optimal noninvasive assessment of left ventricular filling pressures: a comparison of tissue Doppler echocardiography and B-type natriuretic peptide in patients with pulmonary artery catheters. Circulation 2004; 109 : 2432–2439.
17. Nagueh SF, Middleton KJ, Kopelen HA et al. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol 1997; 30 : 1527–1533.
18. Pritchett AM, Mahoney DW, Jacobsen SJ et al. Diastolic dysfunction and left atrial volume: a population-based study. J Am Coll Cardiol 2005; 45 : 87–92.
19. Tschöpe C, Kasner M, Westermann D et al. The role of NT-proBNP in the diagnostics of isolated diastolic dysfunction: correlation with echocardiographic and invasive measurements. Eur Heart J 2005; 26 : 2277–2284.
20. Watanabe S, Shite J, Takaoka H et al. Myocardial stiffness is an important determinant of the plasma brain natriuretic peptide concentration in patients with both diastolic and systolic heart failure. Eur Heart J 2006; 27 : 832–839.
21. Lubien E, DeMaria A, Krishnaswamy P et al. Utility of B-natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recordings. Circulation 2002; 105 : 595–601.
22. McDonagh TA, Holmer S, Raymond I et al. NT-proBNP and the diagnosis of heart failure: a pooled analysis of three European epidemiological studies. Eur J Heart Failure 2004; 6 : 269–273.
23. Yusuf S, Pfeffer MA, Swedberg K et al. Effects of candesartan in patients with chronic heart failure and preserved left ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362 : 777–781.
24. Klapholz M, Maurer M, Löwe AM et al. Hospitalization for heart failure in the presence of a normal left ventricular ejection fraction: results of the New York Heart Failure Registry. J Am Coll Cardiol 2004; 43 : 1432–1438.
25. Carson P, Massie BM, McKelvie R et al. The irbesartan in heart failure with preserved systolic function (I-PRESERVE) trial: rationale and design. J Card Fail 2005; 11 : 576–585.
26. Kostis JB, Davis BR, Cutler J et al. Prevention of heart failure by antihypertensive drug treatment in older persons with isolated systolic hypertension. SHEP Cooperative Research Group. JAMA 1997; 278 : 212–216.
27. Owan TE, Hodge DO, Herges RM et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355 : 251–259.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2008 Issue 3
Most read in this issue- Heart failure with normal ejection fraction
- Catheter ablation of atrial fibrillation
- Comparison of differences between male and female patients with acute myocardial infarction
- Aerobic capacity in patients with ischemic heart disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

