-
Medical journals
- Career
Praktické aspekty a novinky ve farmakologické léčbě arytmií
Authors: P. Heinc
Published in: Kardiol Rev Int Med 2005, 7(1): 10-16
Overview
V oblasti arytmií lze sledovat neustálý vývoj farmakologické a především nefarmakologické léčby. Samostatně je podán přehled léčby bradykardií se základními indikacemi elektrofyziologického vyšetření a radiofrekvenční ablace. Jsou uvedeny elektrofyziologické i klinické aspekty nových antiarytmik. Je podán praktický pohled na diagnostiku, všeobecné zásady farmakoterapie arytmií a praktické postupy farmakologické léčby u supraventrikulárních tachykardií i komorových tachykardií.
Klíčová slova:
bradyarytmie – tachyarytmie – diagnostika – elektrofyziologie – radiofrekvenční ablace – novinky ve farmakoterapiiÚvod
Poruchy srdečního rytmu představují dnes jednu z velmi častých potíží nemocných a v případě maligních arytmií nejčastější příčinu náhlých úmrtí. Svou symptomatičností i závažností nutí k stálému hledání nových a účinnějších antiarytmik i k hledání dalších nefarmakologických přístupů k jejich řešení. Vzhledem k rychlosti vývoje v některých oblastech arytmologie je vhodné mít přehled o současných možnostech léčby i praktické diagnostiky arytmií.
Bradyarytmie
Ve farmakologické léčbě bradyarytmií nedošlo v posledních desetiletích k žádným změnám a léčba spočívá v nefarmakologické léčbě pomocí trvalé kardiostimulace. Základním aspektem u bradyarytmií je z praktického hlediska stanovení závažnosti a určení nutnosti trvalé kardiostimulace. Bradyarytmie, které vedou k zástavě srdce v důsledku sinoatriální nebo atrioventrikulární blokády, způsobují symptomatologii synkop, presynkop, či kolapsů. Pomalá srdeční frekvence bez několikavteřinových zástav vede většinou k námahové dušnosti. V praxi se můžeme setkat s celou řadou bradyarytmií, ale léčba těchto poruch rytmu je indikována jen pro symptomatické bradyarytmie. Z tohoto důvodu je zásadní dát nález bradyarytmií do souvislosti se symptomatikou [1,2]. Léčba jakékoli formy akutní bradyarytmie je jednoduchá a spočívá v dočasné kardiostimulaci. Pokud dočasná stimulace není dostupná, nebo jde o méně závažnou formu bradyarytmie (bez synkopy), lze vést farmakoterapii podáním atropinu v dávce 1 mg i.v. s opakovanou dávkou během 3 minut do maximální dávky 3 mg nebo isoprenalinem v dávce 2–20 μg/min dle frekvenční odpovědi.
Podle českých zásad pro implantace kardiostimulátorů a defibrilátorů je velmi zjednodušeně indikována implantace kardiostimulátoru pro symptomatické bradyarytmie, asystolie trvající déle než 3 vteřiny, záchyt srdeční frekvence pod 40/min, nebo asymptomatická a symptomatická blokáda II. a III. stupně [3,4]. Dokumentované bradyarytmie nejsou indikovány k elektrofyziologickému vyšetření, jelikož závažnost bradyarytmie jsme schopni určit z povrchového EKG záznamu a z korelace se symptomatikou. Pokud bradyarytmie nejsou jednoznačně indikovány k trvalé kardiostimulaci, pak nepodáváme žádné bradykardizující léky. Farmakologická perorální léčba ipratropiem (Itrop tbl.) je sice možná, ale pokud je bradykardie symptomatická, pak je indikovaná trvalá kardiostimulace, protože dlouhodobá farmakologická léčba Itropem je vysoce nákladná (cca 20 000Kč/rok) a většinou v důsledku svých vedlejších účinků výrazněji kvalitu života nezvyšuje. Indikace elektrofyziologického vyšetření při podezření na bradyarytmickou příčinu je pouze u synkopální symptomatiky. Elektrofyziologické vyšetření může odhalit příčinu přechodných bradyarytmií indikovaných následně k trvalé kardiostimulaci, ale daleko častěji odhaluje tachyarytmickou příčinu synkop [5].
Základní indikace elektrofyziologickýchvyšetření a radiofrekvenčních ablací
Dnes jsou indikací elektrofyziologických vyšetření prakticky jen synkopy a tachyarytmie. V případě synkop se indikují k elektrofyziologickému vyšetření jen synkopy, které nejsou vysvětlitelné ani po vyčerpání všech neinvazivních vyšetření, což v praxi znamená echokardiografické vyšetření, elektrokardiografické vyšetření včetně Holterovy monitorace, zátěžovou ergometrii, test na nakloněné rovině (HUTT), masáž karotid a neurologické vyšetření. Na základě diagnostikované skryté blokády je nemocný indikován k implantaci kardiostimulátoru, v případě vyvolané maligní arytmie je nemocný většinou indikován k implantaci defibrilátoru, což představuje pro nemocného prognosticky podstatně účinnější léčbu, než je léčba farmakologická [6–8].
Nejčastější indikací elektrofyziologických vyšetření jsou v dnešní době tachyarytmie: po vyvolání arytmie se určí mechanizmus a lokalizace substrátu odpovědného za tuto arytmii a následuje radiofrekvenční ablace (RFA) [9]. Vzhledem k tomu, že při elektrofyziologických vyšetřeních je možno vyvolat více typů tachyarytmií, je důležitá elektrokardiografická dokumentace klinických tachyarytmií. Proto se k elektrofyziologickému vyšetření indikují především nemocní s dokumentovanou tachyarytmií, aby bylo možno radiofrekvenční ablací odstranit tachyarytmii, která klinicky nemocného skutečně obtěžuje a nedošlo k odstranění pouze neklinické tachyarytmie.
Za pomoci radiofrekvenční ablace je dnes možno potlačit nebo zcela odstranit většinu všech arytmií s výjimkou polymorfních komorových tachykardií (KT) a fibrilací komor (FIK). U některých arytmií je téměř 100% efekt, u jiných je efekt nižší [10,11]. Základní rozdíl mezi farmakoterapií a radiofrekvenční ablací je ten, že u řady tachyarytmií je radiofrekvenční ablace léčbou kurativní, zatímco farmakoterapie zůstane v rovině paliativních řešení. Pro nízké procento závažnějších komplikací (pod 1%) se u tachyarytmií, kde se úspěšnost blíží 100 %, stávají radiofrekvenční ablace léčebnou metodou 1. volby [12,13]. Jedná se především o tyto symptomatické tachyarytmie: flutter síní (FLS) I. typu, atrioventrikulární nodální reentry tachykardie (AVNRT), atrioventrikulární reentry tachykardie (AVRT) a idiopatické komorové tachykardie. Všechny ostatní tachyarytmie jsou indikovány primárně k farmakologické léčbě a ablační řešení se volí až po selhání farmakologické léčby.
Tachyarytmie
Novinky ve farmakoterapii
Původními léky, které měly prokazatelný antiarytmický účinek, byla antiarytmika ze skupiny IA. Tato antiarytmika měla četné vedlejší účinky a efekt na 1roční udržení sinusového rytmu byl např. u fibrilace síní kolem 50% [14]. Antiarytmika ze skupin IC a III byla lépe tolerována a efektivnější [15]. Ani tato antiarytmika však nejsou ideální, jelikož snižují kontraktilitu a ovlivňují vodivost převodního systému. Amiodaron, který má tyto nežádoucí vlastnosti nejméně vyjádřeny, má zase vysoký výskyt nekardiálních vedlejších účinků [16]. Maximum úsilí je v posledních letech věnováno vývoji antiarytmik III. třídy, kde jsou sledovány především 2 parametry – antiarytmický účinek a ovlivnění mortality nemocných. Antiarytmický účinek je zkoumán především na nejrozšířenější a nejkomplexnější supraventrikulární arytmii, kterou je fibrilace síní a mortalita je sledována především u nemocných po prodělaném infarktu myokardu, nebo u nemocných se srdeční slabostí v anamnéze při nízké ejekční frakci, jelikož tito nemocní jsou nejvíce ohroženi maligními arytmiemi. Z nových antiarytmik III. třídy byly mortalitní studie zatím provedeny pouze u dofetilidu a azimilidu. Tyto mortalitní studie neprokázaly ani pozitivní ani negativní vliv na mortalitu nemocných s výrazně sníženou funkcí levé komory u dofetilidu a u nemocných po infarktu myokardu u azimilidu.
V případě výzkumu antiarytmického účinku byla jako vulnerabilní parametr u fibrilace síní stanovena krátká efektivní refrakterní perioda (ERP) síní [17]. Proto je veškeré úsilí posledních 10 let směřováno k hledání tzv. čistých antiarytmik III. třídy, která specificky prodlužují repolarizaci prodloužením refrakterní periody. Od těchto antiarytmik se očekává, že bude minimalizován jejich vliv na kontraktilitu, excitabilitu a vodivost. Prodloužení repolarizační fáze vede k prodloužení vlnové délky, a tím se snižuje počet reentry okruhů. Toho je dosaženo blokádou jednotlivých komponent draslíkového kanálu, nebo aktivací některých komponent vápníkového či sodíkového kanálu. Zvláštní vlastností několika antiarytmik III. třídy je tzv. „reverse–use dependence“ (frekvenčně obrácený účinek) [18]. Jde o fenomén, při kterém má daný preparát maximální účinek při pomalé frekvenci srdeční, zatímco při vyšších srdečních frekvencích se jeho účinek minimalizuje. Efekt je tedy při vyšších frekvencích limitován, a navíc se vytváří predispozice vzniku torsades de pointes (TdP). Tato predispozice je způsobena nárůstem disperze refrakterit při pomalém rytmu především mezi převodním systémem a ostatním myokardem. Tato heterogenita refrakterit vyvolá abnormality na konci repolarizace, kdy vznikají časné následné depolarizace, které spouštějí TdP [19]. Nejdůležitějším faktorem tohoto působení je nejspíše rychlost vazby na iontové kanály a kinetika jednotlivých iontových kanálů. Léky s rychle nastupující blokující aktivitou vykazují maximum účinku již při pomalých frekvencích, zatímco léky s pomalým nástupem blokující aktivity dosahují maxima účinku až při vyšších frekvencích srdečních a minimalizuje se jejich proarytmický efekt při fyziologických frekvencích.
V rámci kinetiky jednotlivých iontových kanálů bylo zjištěno, že pomalá (IKs) a rychlá (IKr) komponenta draslíkového kanálu mají rozdílný vliv na repolarizaci podle srdeční frekvence. Rychlá komponenta draslíkového kanálu (IKr) dosahuje vyrovnaného stavu a má maximum svého působení při pomalých frekvencích, zatímco pomalá komponenta draslíkového kanálu (IKs) je při těchto frekvencích neúplně aktivována a naopak má maximum svého působení při rychlých frekvencích [20,21]. Léky, které blokují IKr, mají největší účinek při nižších srdečních frekvencích, zatímco léky, které blokují IKs, mají největší účinek při vyšších srdečních frekvencích.
Sotalol
Mezi antiarytmika čistě III. třídy, která působí na více kanálech, patří sotalol. Betablokující účinek se objevuje při nižších koncentracích než účinek III. třídy [22]. Oba účinky jsou vztaženy k dávce antiarytmika. Sotalol klinicky lehce prodlužuje PR a QT interval a zpomaluje srdeční frekvenci [23]. Negativní inotropní efekt je jen mírný [24,25], nicméně čím horší je funkce levé komory, tím více se tento efekt uplatňuje [26]. Tím, že se neváže na plazmatické proteiny, nevytváří prakticky žádné interakce s ostatními léky. Intravenózní podání je podstatně méně účinné na konverzi fibrilace síní (FS) nebo FLS než u ibutilidu i flekainidu [27–29]. Tabletová forma k dlouhodobému udržení je přibližně stejně efektivní v dávce 2x 80 mg jako propafenon nebo flekainid, ale je méně efektivní než amiodaron [30–34]. Vedlejší účinky jsou shodné s betablokátory a navíc mají určité riziko vzniku TdP. Především při léčbě komorových arytmií je riziko vzniku TdP závislé na dávce. TdP vznikají většinou na počátku léčby, v průběhu léčby je třeba zvýšeně dbát na rovnováhu elektrolytů a při renální insuficienci je třeba adekvátně redukovat dávky sotalolu.
Dofetilid
Selektivně inhibuje rychlou komponentu draslíkového kanálu (IKr), a tím prodlužují trvání akčního potenciálu a efektivní refrakterní periody v síních a komorách bez ovlivnění převodního systému [35,36]. Prodlužuje QT interval v závislosti na dávce, bez ovlivnění PR intervalu, HV intervalu nebo QRS intervalu. Dofetilid má frekvenčně obrácený účinek „reverse–use dependence“ hlavně při vyšších koncentracích [37,38]. Dofetilid nemá žádný negativní inotropní efekt ani při špatné funkci levé komory [39]. V 8 studiích s dofetilidem byla efektivita na převedení FLS 66% a FS 28%, přitom TdP se objevily ve 4,2 %. Intravenózní podání dofetilidu je vysoce efektní pro verzi FLS, ale méně efektní pro verzi FS. Perorální dofetilid je efektní jak ke konverzi perzistující FS nebo FLS, tak i k udržení sinusového rytmu [40,41]. Jediným závažným vedlejším účinkem je vznik TdP, které vznikají do 50 minut od začátku infuze, nebo do 3 dnů po nasazení perorální léčby [41,42]. Toto riziko je 3–4krát větší u žen, vyšší je při srdeční slabosti a při renální insuficienci. Ve studii DIAMOND se prokázal efekt dofetilidu na konverzi i udržení FS/FLS u nemocných s nízkou ejekční frakcí, a přitom jeho podání nemělo vliv na celkovou mortalitu a naopak restaurace sinusového rytmu signifikantně mortalitu snížila [43]. Léčba by měla být jistě zahájena za 3denní hospitalizační observace [44]. Zatím nebyla prokázána primární prevence náhlé smrti u nemocných se srdeční slabostí, po infarktu myokardu nebo u nemocných se setrvalou komorovou tachykardií či fibrilací komor (FIK) v anamnéze.
Ibutilide
Existuje pouze v intravenózní formě a má prokazatelný vliv na konverzi FLS a FIS. Prodlužuje ERP síní prakticky při všech frekvencích – nemá frekvenčně obrácený účinek „reverse–use dependence“. Aktivací sodíkového kanálu (INa–s) a blokádou IKr prodlužuje QT interval v závislosti na dávce [45,46]. Efektivní dávka je 1–2 mg. Je podstatně efektnější na konverzi FLS (64 %) než na konverzi FS (33 %) – podobně jako dofetilid – a ke konverzi většinou dochází během 30 minut [29,47]. Zatím se jeví jako nejefektivnější lék na konverzi FLS. Je podstatně efektivnější než sotalol, propafenon, amiodaron a procainamid [29,48,49]. Jeho podání usnadňuje efekt elektrické kardioverze [50]. Vedlejší účinky jsou mírné, TdP se objevuje ve 3,5 %, a to v prvních 40 minutách a častěji u žen, v přítomnosti srdeční slabosti nebo při bradykardii [51].
Azimilid
Jde o lék, který blokuje sodíkový kanál, vápníkový kanál a rychlou i pomalou složku draslíkového kanálu. Z humánních studií jsou rozporuplné výsledky efektivity stran udržení sinusového rytmu po konverzi FS/FLS a bezpečnosti podání azimilidu [52]. Azimilid je velmi dobře tolerován, má velmi nízké procento vedlejších účinků, včetně TdP [53]. Nicméně mortalitní studie nemocných po infarktu myokardu neprokázala zlepšení ani zhoršení mortality po azimilidu [53].
Dronedaron
Jde o nejodovaný derivát amiodaronu, který má podobné mnohočetné působení na membránách myocytů [54]. Prodlužuje vedení AV uzlem, trvání stimulovaného QRS komplexu a ERP síní i komor. Má frekvenčně obrácený účinek „reverse–use dependence“ na ERP síní i komor s větším vyjádřením při vyšších frekvencích [55]. Podobně jako amiodaron homogenizuje repolarizaci myokardu a potlačuje vznik TdP vyvolávané jinými léky [56]. Zvláštností je, že intravenózně podaný dronedaron zkracuje komorovou repolarizaci, zatímco perorální podání ji prodlužuje. Ve studiích se zvířaty se zatím neprokázal proarytmogenní efekt po infarktu myokardu Jeho antiarytmický i preventivní účinek se nyní intenzivně zkoumá v klinických studiích.
Závěry výzkumu nových antiarytmik
Od čistých antiarytmik III. třídy se očekávalo nalezení ideálního léku. Jejich vývoj však očekávání nesplnil, i když si některé našly preferované místo ve farmakologické léčbě. Zvláště intravenózní ibutilid se může použít k urgentní verzi akutně vzniklé arytmie v případě, že jiná antiarytmika jsou kontraindikována a může sloužit jako antiarytmikum 1. volby pro verzi flutteru síní. Dronedaron se i přes své určité riziko indukce TdP zvažuje jako lék 2. volby pro dlouhodobou prevenci fibrilace síní v případech, kdy ostatní antiarytmika selhala nebo jsou kontraindikována. Preventivní studie s novými antiarytmiky zatím chybí, nicméně v léčbě 1. volby u maligních arytmií zůstane zřejmě ještě dlouho implantace defibrilátoru.
V současné dekádě probíhá řada studií s výše uvedenými antiarytmiky i s dalšími novými antiarytmiky, jako je tedisamil, ambasilid a jiné, nicméně jejich dosavadní účinek nepřevyšuje uvedené, i když od výsledků studií se opět hodně očekává. Toto očekávání je dáno tím, že působí i na jiné komponenty iontových kanálů, které jsou přítomny například jen v síních a nejsou přítomny v komorách. To je případ ultrarychlé komponenty draslíkového kanálu (IKur) a draslíkového kanálu senzitivního k acetylcholinu (IKach 57,58). Tímto způsobem by bylo možno ovlivnit repolarizace v síních bez rizika vzniku komorových arytmií. Konečně od nových léků, které jsou modifikací současných efektních antiarytmik (dronedaron), se úpravou jejich molekuly (dejodizace molekuly amiodaronu) očekává stejný nebo větší efekt (blokáda několika iontových kanálů) při omezení či odstranění vedlejších účinků.
Diagnostika
Zásadní pro volbu léčby tachyarytmií, včetně výběru optimálního antiarytmika, je nezbytné určení typu arytmie. Při diagnostice je třeba nejdříve rozlišit tachykardii supraventrikulární od komorové. Toto lze jednoduše rozlišit šířkou QRS komplexu: při KT jsou QRS komplexy široké, zatímco při supraventrikulární tachykardii (SVT) jsou QRS komplexy úzké. Široké QRS komplexy mohou být při supraventrikulární tachykardii jen v případě přítomné preexcitace při WPW syndromu nebo v přítomnosti blokády některého z Tawarových ramének. V případě tachykardie s širokým QRS velmi obecně rozlišujeme SVT od KT vztahem P vln ke QRS komplexům a osou srdeční. Pokud prokážeme síňokomorovou disociaci, je diagnóza KT jistá. Pokud je srdeční osa v rozmezí –90 až –180 stupňů a/nebo QRS komplexy ve svodech V4–V6 jsou predominantně negativní a/nebo ve svodech V2–V6 je nejméně v 1 svodu tvar komorového komplexu QR, pak je diagnóza KT vysoce pravděpodobná (obr. 1). Kromě uvedeného však existuje i několik dalších algoritmů k diferenciální diagnostice KT. Pokud jsme diagnostikovali SVT, pak musíme stanovit, o jaký typ tachyarytmie jde. Rozdělení všech typů SVT ukazuje tab. 1. Relativně snadno lze rozpoznat FS a FLS podle přítomných fibrilačních a flutterových vln. Pokud vyloučíme tyto frekventní SVT (FS a FLS), pak jsme schopni určit typ zbývajících tachykardií zjednodušeně rozdělením na tachykardie s dlouhým RP intervalem a s krátkým RP intervalem. Tachykardie s krátkým RP intervalem jsou ty, u kterých je P vlna patrna za QRS komplexem v 1. polovině rozděleného intervalu R–R a tachykardie s dlouhým RP jsou ty, u nichž je P vlna patrna za QRS komplexem ve 2. polovině rozděleného intervalu R–R (obr. 2).
Image 1. Komorová tachykardie. Průkaz atrioventrikulární disociace v případě tachykardie se širokým QRS-komplexem je zcela jistá známka svědčící pro komorovou tachykardii. V tomto případě je frekvence komor 120/min a frekvence síní 45/min. 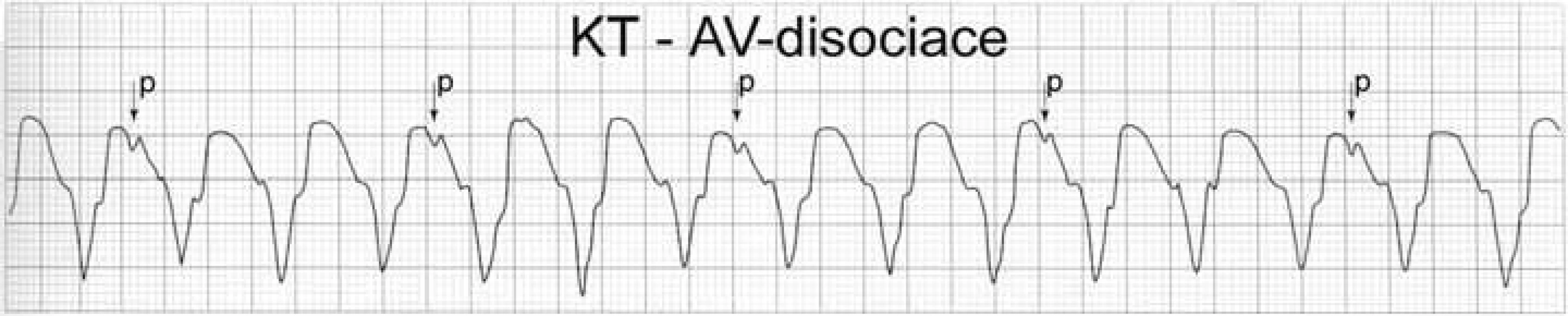
Image 2. Rozdělení tachykardií dle RP-intervalu. V horní části obrázku je běžící atrioventrikulární nodální reentry tachykardie, kde začátek P-vln leží v 1. polovině RR intervalu – jde tedy o tachykardii s krátkým RP intervalem a P-vlny začínají dříve jak 90 ms od začátku QRS-komplexu, proto lze prakticky vyloučit ortodromní atrioventrikulární reentry tachykardii. V dolní části obrázku při sinusovém rytmu je dlouhý RP-interval, podobně jak by tomu bylo při sinusové tachykardii, která se prezentuje dlouhým RP-intervalem. 
Mezi supraventrikulární reentry tachykardie s dlouhým RP intervalem patří sinusové tachykardie, síňové tachykardie, atypická AVNRT a PJRT. Vzhledem k tomu, že atypická AVNRT a zvláště PJRT se vyskytují velice zřídka, lze si je při dif. dg. typu arytmie odmyslet, a tím při tachykardii s dlouhým RP rozlišujeme od sebe vlastně jen sinusové tachykardie od síňových. Toto rozlišení je již celkem jednoduché – při sinusové tachykardii musí být morfologie P vln ve všech 12 svodech povrchového EKG shodná s morfologií P vln při sinusovém rytmu. Pokud se liší morfologie P vln, byť jen v jediném svodu, pak se jedná o síňovou tachykardii (obr. 3, 4).
Image 3. Sinusová reentry tachykardie. Morfologie P-vln v posledních 3 stazích při sinusovém rytmu je ve všech 12 svodech shodná s morfologií P-vln při tachykardii zobrazené v prvních 4 stazích, kdy tachykardie končí prakticky skokem, na rozdíl od nepřiměřené sinusové tachykardie, která by končila pozvolna. 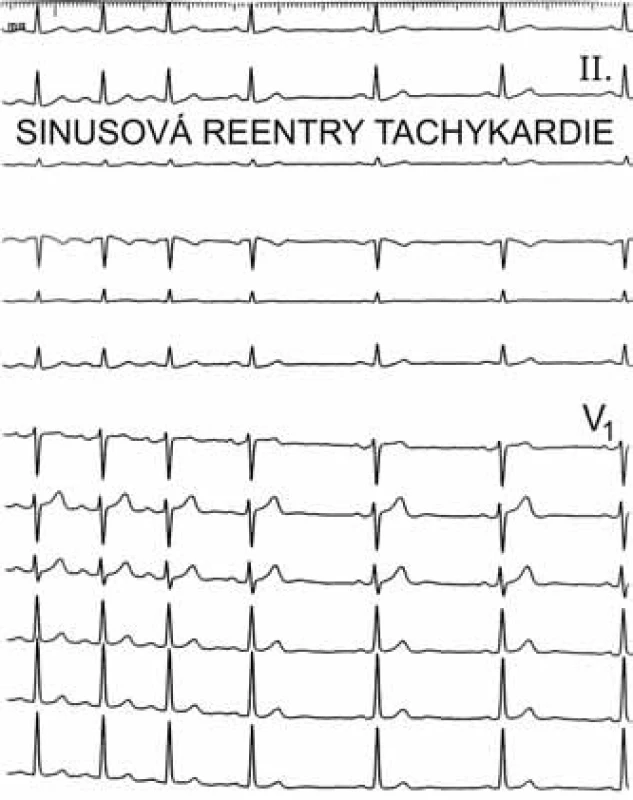
Image 4. Síňová tachykardie. V prvních 6 QRS-komplexech běží síňová tachykardie, poslední 3 QRS-komplexy představují sinusový rytmus. Morfologie P-vln při tachykardii se liší od morfologie P-vln při sinusovém rytmu prakticky jen ve svodu I, nicméně to stačí k diagnostice síňové tachykardie s vyloučením možnosti sinusové tachykardie. 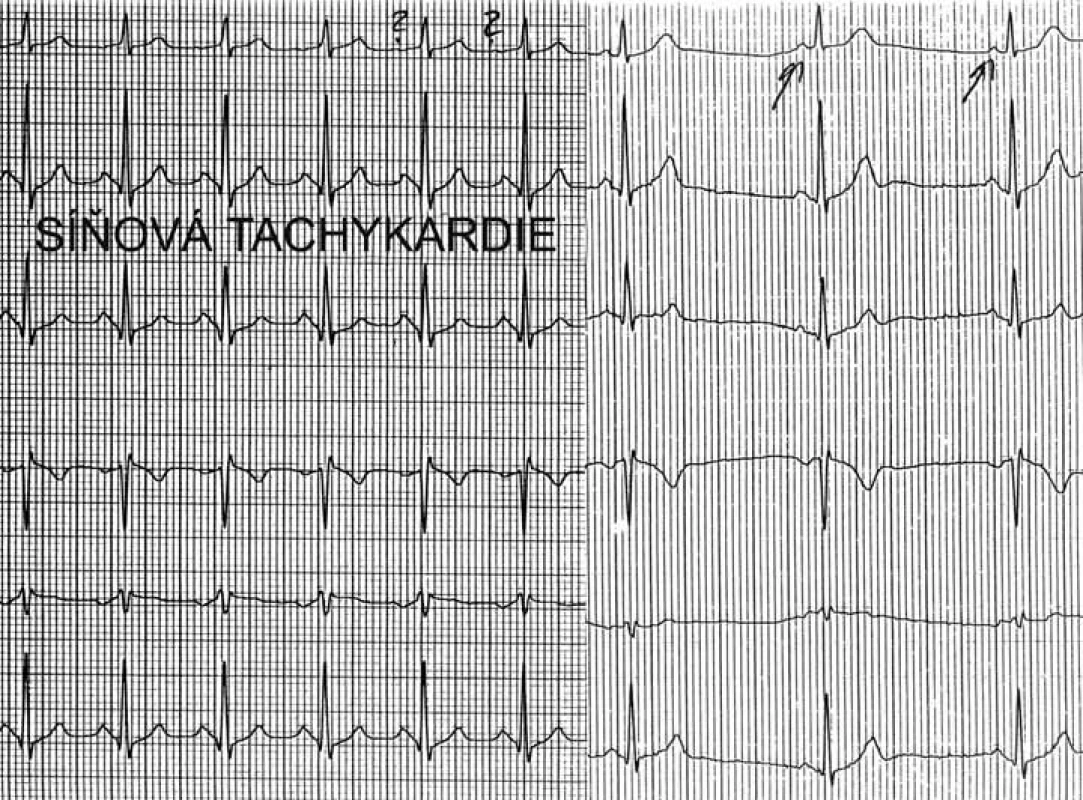
Mezi supraventrikulární reentry tachykardie s krátkým RP intervalem patří při výše uvedeném algoritmu prakticky jen typická AVNRT a ortodromní AVRT. Rozlišení mezi nimi je založeno na vzdálenosti začátku P vlny za začátkem komplexu QRS. Začíná-li P vlna do 90 ms od začátku QRS komplexu, jde téměř jistě o typickou AVNRT; pokud je začátek P vlny v 1. polovině R–R intervalu, ale později než 100 ms po začátku QRS komplexu, pak jde většinou o ortodromní AVRT (obr. 5, 6).
Image 5. Atrioventrikulární nodální reentry tachykardie (AVNRT). Šipky ukazují na negativní morfologii P-vln těsně za QRS komplexem ve svodech II, III, VF, což potvrzuje diagnózu typické AVNRT. Začátek P vln je dobře patrný < 80 ms za začátkem QRS-komplexu v 1. hrudním svodu – C1. 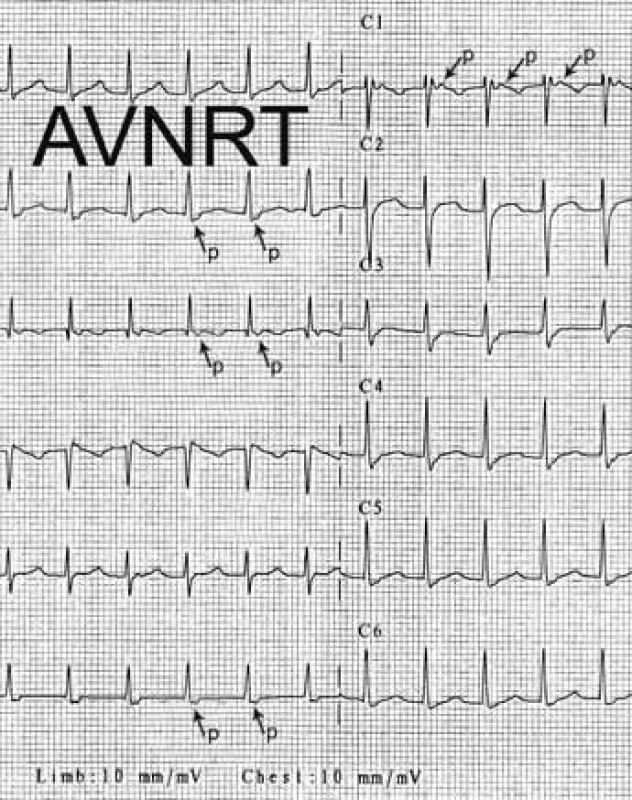
Image 6. Atrioventrikulární reentry tachykardie (AVRT) – ortodromní forma. Posledních 9 QRS-komplexů je následováno P-vlnami (označené šipkami), které jsou 160 ms za počátkem QRS-komplexu, nicméně leží v 1. polovině RR-intervalu a jde tedy o tachykardii s krátkým RP-intervalem. Vzdálenost P-vln více jak 90 ms od začátku QRS-komplexu odlišuje tuto arytmii od typické AV nodální reentry tachykardie. 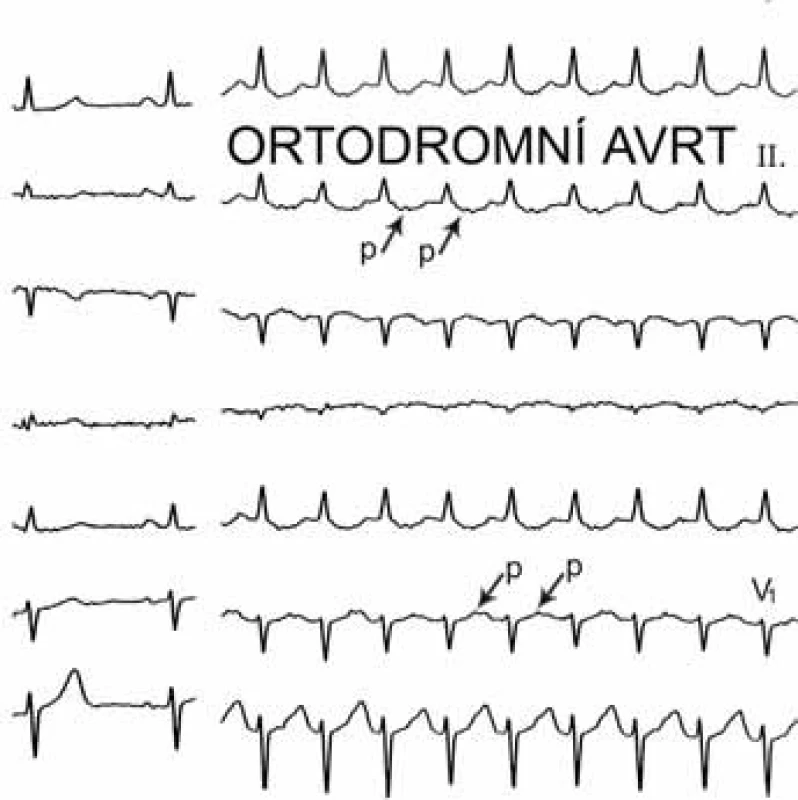
Všeobecné zásady léčebných možností
Základními možnostmi léčby tachyarytmií jsou farmakoterapie a RFA. Farmakoterapie i RFA jsou léčebné metody, které jsou schopny ovlivnit prakticky všechny typy tachyarytmií a v zásadě se postupuje v současné praxi tak, že nejdříve zkusíme ovlivnit arytmie farmakologicky, a pokud tato léčba selhává, pak indikujeme ablační řešení [9]. Arytmie, u nichž lze RFA použít jako léčebnou metodu 1. volby, jsou uvedeny výše. V případě farmakoterapie je třeba si uvědomit, zda od ní očekáváme ukončení arytmie a nastolení sinusového rytmu, zda chceme (z jakéhokoli důvodu) pouze udržet přiměřenou frekvenci komor při ponechané tachyarytmii, nebo zda chceme z dlouhodobého pohledu udržet sinusový rytmus. Obecně lze říci, že s výjimkou uzlových tachykardií (sinusová tachykardie, AVNRT a PJRT) se k akutní konverzi na sinusový rytmus (SR) používají antiarytmika I. a III. třídy v parenterální formě a k dlouhodobému udržení SR stejná antiarytmika v tabletové formě.
Léčba supraventrikulárních tachykardií
Z praktického pohledu lze nejpoužívanější antiarytmika u nás rozdělit na 2 trojice léků, především podle toho, za jakým strategickým účelem je chceme použít. Obecně první trojici antiarytmik používáme ke kontrole srdeční frekvence při běžící rezistentní SVT a druhou trojici používáme především ke konverzi SVT na SR a k udržení SR.
První trojici tvoří betablokátory, nondihydropyridinové kalciové blokátory (verapamil nebo diltiazem) a digitalis [59,60]. Tato trojice antiarytmik se používá především ke zpomalení atrioventrikulárního (AV) převodu na komory, a tedy k udržení přiměřené frekvence komor u všech běžících SVT (nejčastěji u FS a FLS) [61]. Nejčastěji užívané preparáty z této trojice ukazuje tab. 2. Za kontrolovanou frekvenci komor se považuje frekvence 60–80/min v klidu a 90–115/min při mírné námaze [61]. Vzhledem k tomu, že tyto preparáty mají afinitu k sinusovému uzlu i k atrioventrikulárnímu uzlu, indikují se také dle strategie jako léky 1. volby ke konverzi na SR a k udržení SR u SVT využívajících ke svému udržení tyto uzly s výjimkou AVRT (sinusová tachykardie, AVNRT, PJRT) [62].
Druhou trojici tvoří klasická antiarytmika I. a III. třídy – propafenon (I. třída), sotalol a amiodaron (III. třída). Tato trojice antiarytmik se používá především ke konverzi arytmie na SR (parenterální forma) a k udržení SR (perorální forma). Nejčastěji užívané preparáty používané ke konverzi arytmie na SR ukazují tab. 3, 4 a dávkování antiarytmik k udržení SR ukazují tab. 5 a 6. Trojice je pořadově seřazena podle antiarytmických účinků a vedlejších účinků. Propafenon má relativně menší antiarytmický účinek, ale současně i nejméně vedlejších účinků, zatímco amiodaron je nejpotentnější antiarytmikum, ale má rovněž největší vedlejší účinky [63–67]. Z tohoto pohledu je evidentní, že čím méně závažná bude tachyarytmie, tím méně potentní lék (s nejnižšími vedlejšími účinky) se použije jako lék první volby. U této trojice léků je třeba počítat i s proarytmogenním efektem, který se snadněji uplatňuje u nemocných se strukturálním onemocněním srdce (SOS) [63].
Za zvláštní zmínku stojí léčba FIS. Co se týká antiarytmické léčby, platí vše, co bylo uvedeno výše, tedy pro kontrolu frekvence 1. trojice antiarytmik, k prevenci recidiv 2. trojice. Z uvedeného schématu je třeba upozornit, že u nemocných s WPW syndromem by se neměla používat 1.trojice léků z důvodu potenciálního rizika vzniku FIK při FIS (v přítomnosti supervodivé přídatné dráhy). U flutteru síní by se před plánovaným podáním propafenonu nebo současně s propafenonem měl podat verapamil nebo betablokátor k prevenci rychlé frekvence komor v případě, že by nedošlo po podání propafenonu k převedení flutteru síní na SR. Riziko pro nemocné s touto arytmií je však především v tromboembolické nemoci, proto je třeba nemocné u paroxysmálních forem a u chronické FIS trvale antikoagulovat [68].
Léčba komorových tachykardií
Při léčbě komorových arytmií je třeba stanovit přítomnost a závažnost strukturálního onemocnění srdce. Obecně lze říci, že závažnost komorových arytmií stoupá se závažností srdečního strukturálního onemocnění [69]. Za závažné komorové arytmie se pokládají setrvalé komorové tachykardie, flutter komor a fibrilace komor. Závažnost ne tak komplexních forem komorových arytmií, jako jsou kuplety komorových extrasystol až běhy nesetrvalých komorových tachykardií, hodnotíme podle jejich symptomatičnosti a především podle závažnosti základního strukturálního srdečního onemocnění. Proto například symptomatický kuplet komorových extrasystol u jedince bez zjevného strukturálního onemocnění nehodnotíme jako závažnou arytmii, zatímco symptomatický kuplet komorových extrasystol v přítomnosti těžšího strukturálního postižení s nízkou ejekční frakcí musíme hodnotit jako závažnou arytmii.
Základní strategií v léčbě komorových tachyarytmií je, že pokud nejde o závažné komorové arytmie, pak se léčba začíná betablokátory. Závažnější komorové arytmie jsou léčeny druhou trojicí antiarytmik, ev. v kombinaci s betablokátory, nicméně především v přítomnosti závažnějšího strukturálního srdečního onemocnění musí být jejich efekt pečlivě ověřen buď holterovskou monitorací, nebo programovanou stimulací komor.
Léčba nemocných se závažnými komorovými arytmiemi patří dnes do specializovaných center, neboť jen zde je možno indikovat optimální léčbu implantací defibrilátorů, biventrikulárních stimulátorů, léčbu pomocí radiofrekvenčních ablací i eventuálně optimální antiarytmickou farmakologickou léčbu na základě elektrofyziologických i koronarografických nálezů.
Závěr
V důsledku vývoje nových antiarytmik a s progresivním vývojem nefarmakologických možností ovlivnění arytmií je třeba stále aktualizovat povědomí lékařů o optimálním řešení arytmií. Vzhledem k tomu, že kardiocentra, i když disponují stále širšími možnosti nákladné léčby, mají omezené možnosti léčby rostoucího množství nemocných, je třeba celoplošně optimalizovat léčbu a výběr nemocných indikovaných ke složitějším výkonům. K tomu by měl sloužit současný přehled možností diagnostiky a léčby nemocných s arytmiemi.
MUDr. Petr Heinc, Ph.D.
I. interní klinika FN a UP, Olomouc
doc. MUDr. Petr Heinc, Ph.D.
Narodil se 28.10.1954. Promoval na Lékařské fakultě Univerzity Palackého v Olomouci v roce 1979. V letech 1979–1991 pracoval jako sekundární lékař na interním oddělení OÚNZ v Prostějově a od roku 1991 pracuje na I. interní klinice Fakultní nemocnice a Lékařské fakulty Univerzity Palackého v Olomouci. V letech 1991–1996 působil jako odborný asistent a od roku 1996 vykonává funkci zástupce přednosty kliniky. Ve funkčním období 1995–1997 byl zvolen předsedou Pracovní skupiny pro arytmie a kardiostimulaci České kardiologické společnosti a od roku 1999 byl opakovaně členem výboru této pracovní skupiny. Pracovní zaměření: kardiologie, invazivní elektrofyziologie, radiofrekvenční katétrové ablace, kardiostimulace, ICD, echokardiografie. Odborný růst: 1982 – atestace I. stupně z vnitřního lékařství, 1987 – atestace z kardiologie, 2000 – obhájil disertační práci – Ph.D. 47 publikací v odborných časopisech, z toho 1 v zahraničí.
Sources
1. DiMarco JP, Philbrick JT. Use of ambulatory electrocardiografic (Holter) monitoring. Ann Intern Med 1990; 113 : 53–68.
2. Sovová E, Doupal V, Lukl J. Srovnání použití dvou přístrojů pro dlouhodobou monitoraci EKG při vyšetřování srdečních arytmií. Vnitř Lék 2001; 47(10): 670–673.
3. Gregoratos G, Cheitlin MD, Connil A et al. ACC/AHA guidelines for implantation of cardiac pacemakers and antiarrhythmia devices: a report of the ACC/AHA Task Force on Practice Guidelines (Committee on Pacemakers Implantation). J Am Coll Cardiol 1998; 31 : 1175–206.
4. Zásady pro implantaci kardiostimulátorů a implantabilních kardiovertrů – defibrilátorů. Cor Vasa 1997; 39(2; Suppl K): 35–42.
5. Zipes DP, DiMarco JP, Gillettte P et al. Guidelines for clinical intracardiac electrophysiologic studies and catheter ablation procedures. AHA/ACC Task Force report. Circulation 1995; 92 : 673–91.
6. Moss AJ, Hall WJ, Cannon DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmias. N Engl J Med 1996; 335(26): 1933–1940.
7. Buxton AE, Lee KL, Fisher JD et al. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med 1999; 341(25): 1882–1890.
8. Kautzner J. Léčba a prevence náhlé srdeční smrti – reálný cíl? JAMA–CS 1999; 7 : 820–821.
9. Heinc P. Role katetrové ablace u supraventrikulárních tachyarytmií. In: Lukl V, Heinc P et al. Moderní léčba arytmií. Praha: Grada 2001 : 119–135.
10. Hindricks G. The Multicenter European Radiofreguency Survey (MERFS): complicatons of radiofrequency ablation of arrhythmias. Eur Heart J 1993; 14 : 1644–1653.
11. Calkins H, Yong P, Miller JM et al. Catheter ablation of accessory pathways, atrioventricular nodal reentry tachycardia, and the atrioventricular junction: final results of a prospective, multicenter clinical trial. Circulation 1999; 99(2): 262–270.
12. Capatto R, Kuck KH. Catheter ablation in the year 2000. Curr Opin Cardiol 2000; 15 : 29–40.
13. Morady F. Radio–frequency ablation as treatment for cardiac arrhythmias. N Engl J Med 1999; 340 : 534–544.
14. Anderson J. Acute treatment of atrial fibrillation and flutter. J Am Coll Cardiol 1996; 17 : 17–21.
15. Waldo A, Prystowsky EN. Drug treatment of atrial fibrillation in the managed era. Am J Cardiol 1998, 81(5; Suppl C): 23–29.
16. Podrid PJ. Amiodarone: Reevaluation of an old drug. Ann Int Med 1995; 122(9): 689–700.
17. The Sicilian Gambit. A new approach to the classification of antiarrhythmic drugs based on their actions on arrhythmogenic mechanisms. Eur Heart J 1991; 12(10): 1112–1131.
18. Hondeghem LM, Snyders DJ. Class III antiarrhythmic agents have a lot of potential but a long way to go. Circulation 1990; 81 : 686–690.
19. Antzelevith C, Sicouri S. Clinical relevance of cardiac arrhythmias generated by afterdepolarizations. J Am Coll Cardiol 1994; 23(1): 259–277.
20. Jurkiewicz NK, Sanguinetti MC. Rate–dependent prolongation of cardiac action potentials by a methanesulfonanilide class III antiarrhythmic agent: Specific block of rapidly activating delayed rectifier K current by dofetilide. Circ Res 1993; 72(1): 75–83.
21. Wang Z, Fermini B, Nattel S. Delayed rectifier outward current and repolarization in human atrial myocytes. Circ Res 1993; 73(2): 276–285.
22. Woosley RL, Hardey JT, Wang T et al. Concentration response relations for the multiple antiarrhythmic actions of sotalol. Am J Cardiol 1990; 65(2; Suppl A): 22–27.
23. Anastasiou–Nana MI, Gilbert EM, Miller RH et al. Usefulness of DL sotalol for suppression of chronic ventricular arrhythmias. Am J Cardiol 1991; 67 : 511–516.
24. Thumala A, Harnmermeister KE, Campbell WB et al. Hemodynamic studies with sotalol in men performed at rest, during exercise and during right ventricular pacing. Am Heart J 1971; 82(4): 439–447.
25. Lloyd EA, Charles RG, Gordon–GD et al. Beta–blockade by sotalol in early myocardial infarction decreases ventricular arrhythmias without increasing left ventricular volume. S Afr Med J 1988; 74(1): 5–10.
26. Winters SL, Kukin M, Pe E et al. Effect of oral sotalol on systemic hemodynamics and programmed electrical stimulation in patients with ventricular arrhythmias and structural heart disease. Am J Cardiol 1993; 72(4; Suppl A): 38–43.
27. Sung RJ, Tan HL, Karagounis L et a1. Intravenous sotalol for the termination of supraventricular tachycardia and atrial fibrillation and flutter. A multicenter, randomized, double–blind, placebo controlled study. Sotalol Multicenter Studv Group. Am Heart J 1995; 129(4): 739–748.
28. Vos MA, Golitsin SR, Stangl K et al. Superiority of ibutilide (a new class III agent) over DL–sotalol in converting atrial flutter and fibrillation. Heart 1998; 79(6): 568–573.
29. Poelzl G, Kratzer H, Ebner A et al. Prospective comparison of flecainide versus sotalol for immediate cardioversion of atrial fibrillation. Am J Cardiol 1998; 81(12): 1450–1454.
30. Benditt DG, Williams JH, Jin J et al. Maintenance of sinus rhythm with oral DL sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. Am J Cardiol 1999; 84 : 270–277.
31. Reimold SC, Cantillon CO, Friedman PL et al. Propafenone versus sotalol for suppression of recurrent symptomatic atrial fibrillation. Am J Cardiol 1993; 71(7): 558–563.
32. Lee SH, Chen S.A, Tai DT et al. Comparison of oral propafenone and sotalol as an initial treatment in patients with symptomatic paroxysmal atrial fibrillation. Am J Cardiol 1997; 79 : 905–908.
33. Carunchio A, Fera MS, Mazza A et al. A comparison between flecainide and sotalol in the prevention of recurrences of paroxysmal atrial fibrillation. G Ital Cardiol 1995; 25(1): 51–68.
34. Roy D, Talajic M, Dorian P et al. Amiodarone to prevent recurrence of atrial fibrillation. N Engl J Med 2000; 343(13): 913–920.
35. Rasmussen HS. Dofetilide, a novel class 3 antiarrhythmic agent. J Cardiovasc Pharmacol 1992; 20 : 96–104.
36. Tham TCK, Mac Lennan BA, Burke M et al. Pharmacodynamics and pharmacokinetics of the class III antiarrhythmic agent dofetilide in humans. J Cardiovasc Pharmacol 1993; 21 : 507–512.
37. Demolis GM, Funck–Brentano C, Ropers JR et al. Influence of dofetilide on QT interval duration and dispersion at various heart rates during exercise in humans. Circulation 1996; 94(7): 1592–1599.
38. Kowey PR, Marinchack RA, Rials SJ et al. Pharmacologic and pharmacokinetic profile of the class 3 antiarrhythmic drugs. Am J Cardiol 1997; 80(Suppl G): 16–23.
39. Nademanee K, Bailey WM, O'Neill G et al. Electrophysiologic and hemodynamic effects of dofetilide in patients with depressed ventricular function: A randomized, double–blind, placebo–controlled study. PACE 1998; 21 : 867.
40. Singh SN, Zab1 RG, Yellen LG et al. Efficacy and safety of oral dofetilide in converting to and maintaining sinus rhythm in patients with chronic atrial fibrillation or atrial flutter. The symptomatic atrial fibrillation investigative research on dofetilide (SAFIRE–D) study. Circulation 2000; 102 : 2385–2390.
41. Campbell T, Greenbaum RA, Channer KS et al. Mortality in patients with atrial fibrillation –1 year follow up of EMERALD (European and Australian Multicenter Evaluation Research of Atrial Fibrillation Dofetilide). J Am Coll Cardiol 2000; 35(Suppl A): 154.
42. Norgaard BL, Watchell K, Christensen PD et al. Efficacy and safety of intravenously administered dofetilide in acute termination of atrial fibrillation and flutter: A multicenter, randomized, double–blind, placebo–controlled trial. Am Heart J 1999; 137(6): 1062–1069.
43. Pedersen OD, Bagger H, Keller N et al. Efficacy of dofetilide in the treatment of atrial fibrillation–flutter in patients with reduced left ventricular functions. A Danish Investigations of Arrhythmia and Mortality ON Dofetilide (DIAMOND) substudy. Circulation 2001; 104(3): 292–295.
44. Pratt CM, Ruskin JN, Friedrieck T. Dofetilide use in atrial fibrillation: A treatment strategy to minimize proarrhythmic risk. (Abstract). J Am Coll Cardiol 2000; 35(Suppl A): 154.
45. Lee KS. Ibutilide, a new compound with potent class 3 antiarrhythmic activity, activates a slow inward Na+ current in guinea pig ventricular cells. J Pharmacol Exp Ther 1998; 262(1): 99–108.
46. Yang T, Snyders DJ, Roden DM. Ibutilide, a methanesulfonanilide antiarrhythmic, is a potent blocker of the rapidly–activating delayed rectifier K current (I,U) in AT–1 cells. Circulation 1995; 91 : 216–221.
47. Murray KT. Ibutilide. Circulation 1998; 97 : 493–497.
48. Volgman AS, Carberry PA, Stambler BS. Conversion efficacy and safety of intravenous ibutilide compared with intravenous procainamide in patients with atrial flutter or fibrillation. J Am Coll Cardiol 1998; 31 : 1414–1419.
49. Tai ChT, Chen SA, Feng AN et al. Electropharmacologic effect of class I and class III antiarrhythmia drugs on typical atrial flutter. Circulation 1998; 97 : 1935–1945.
50. Oral K, Souza JJ, Michaud GF et al. Facilitating transthoracic cardioversion of atrial fibrillation with ibutilide pretreatment. N Engl J Med 1999; 340(24): 1849–1854.
51. Kowey PR, VanderLugt JR, Luderer JR. Safety and risk/benefit analysis of ibutilide for acute cardioversion of atrial fibrillation/flutter. Am J Cardiol 1996; 78(8; Suppl A): 46–52.
52. Pritchett E, Page R. Connoly S et al. Antiarrhythmic effects of azimilide in atrial fibrillation: Efficacy and dose–response. Azimilide Supraventricular Arrhythmia Program (SVA–)3 Investigators. J Am Coll Cardiol 2000; 36(3): 794–802.
53. Camm AJ, Pratt CM, Schwartz PJ et al. Mortality in patients after a recent myocardial infarction. A randomized, placebo–controlled trial of azimilide using heart rate variability for risk stratification. Circulation 2004; 109(8): 990–996.
54. Manning AS, Bruyninckx C, Ramboux J et al. SR 33589, a new amiodarone–like agent: Effect on ischemia and reperfusion–induced arrhythmias in anesthesized rats. J Cardiovasc Pharmacol 1995; 26 : 453–461.
55. Sun W, Sarma JSM, Singh BN. Electrophysiological effects of dronedarone (SR33589), a non–iodinated benzofuran derivative, in the rabbit heart. Circulation 1999; 100 : 2276–2281. doplnit svazek
56. Verdvin SC, Vos MA, Leunissen HDM et al. Evaluation of the acute electrophysiologic effect of intravenous dronedarone, an amiodaron–like agent, with special emphasis on ventricular repolarization and acquired torsade de pointes arrhythmias. J. Cardiovasc Pharmacol 1999; 33 : 212–222.
57. Wang Z, Fermini B, Nattel S. Sustained depolarization–induced outward current in human atrial myocytes: Evidence for a novel delayed rectifier K current in human ventricle. Circ Res 1993; 73 : 1061–1076.
58. Sato R, Hisatome I, Wasserstrome JA. Acetylcholine sensitive potassium channels in human atrial myocytes. Am J Physiol 1990; 259(6; Suppl H):1730–1735.
59. Farshi R, Kistner D, Sarma JS et al. Ventricular rate control in chronic atrial fibrillation during daily activity and programmed exercise. J Am Coll Cardiol 1999; 33(2): 304–310.
60. Lewis R, Lakhami M, Moreland TA et al. A comparison of verapamil and digoxin in the treatment of atrial fibrillation. Eur Heart J 1987; 8(2): 148–51.
61. Rawles JM. What is meant by a „controlled“ ventricular rate in atrial fibrillation? Br Heart J 1990; 63 : 157–61.
62. Gomes JA, Hariman RI, Kang PS et al. Sustained symptomatic sinus node reentrant tachycardia: Incidence, clinical significance, electrophysiologic observations and the effects of anti–arrhythmic agents. J Am Coll Cardiol 1985; 5 : 545–557.
63. The Cardiac Arrhythmia Supression Trial (CAST) investigators. Preliminary report: Effect of encainide anf flecainide on mortality in randomized trial of arrhythmia supression after myocardial infarction. N Engl J Med 1989; 3321 : 406–412.
64. Waldo AL, Camm AJ, deRuyter H et al. Effect of d–sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. Lancet 1996; 348 : 7–11.
65. Flaker GC, Blackshear JL, McBride R et al. Antiarrhythmic drug therapy and cardiac mortality in atrial fibrillation. J Am Coll Cardiol 1992; 20 : 527–532.
66. Middlekauff HR, Stevenson WG, Saxon LA et al. Amiodarone and torsades de pointes in patients with advanced heart failure. Am J Cardiol 1995; 76(7): 499–502.
67. MacNeil DJ. The side effect profile of class III antiarrhythmic drugs; focus on d, l–sotalol. Am J Cardiol 1997; 80(Suppl G): 90–8.
68. Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic features of patients at risk. The Stroke Prevention in Atrial Fibrillation Investigators. Ann Intern Med 1992; 116(1): 6–12.
69. Kjekshus J. Arrhythmias and mortality in congestive heart failure. Am J Cardiol 1990; 65(Suppl I): 42–48.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2005 Issue 1
Most read in this issue- Trimetazidin v léčbě anginy pectoris a ostatních forem ICHS
- Praktické aspekty a novinky ve farmakologické léčbě arytmií
- Rehabilitace po infarktu myokardu
- Renesance antialdosteronik v soudobé kardiologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career








