-
Medical journals
- Career
Fibrinolýza v kardiochirurgii v postaprotinínovej ére
Authors: Špegár Ján 1,2; Pazderková Petra 1; Vaněk Tomáš 1
Authors‘ workplace: Kardiochirurgická klinika, Kardiocentrum, FNKV a 3. LF UK, Praha 1; Anesteziologicko-resuscitační oddělení, Oblastní nemocnice Mladá Boleslav, a. s., Nemocnice Středočeského kraje 2
Published in: Anest. intenziv. Med., 22, 2011, č. 5, s. 260-264
Category: Anesthesiology - Review Article
Overview
V snahe zabrániť nadmernej strate krvi a zhoršenému perioperačnému priebehu sa stalo požívanie antifibrinolytík bežnou rutinou kardiochirurgických operácií väčšiny centier. Po stiahnutí najsilnejšieho antifibrinolytika aprotinínu, sa pozornosť klinickej praxe stále častejšie uberá k používaniu kyseliny tranexámovej. Tá so sebou prináša benefity v pozorovanej nižšej krvnej strate, ale i vedľajšie nežiaduce účinky. Tento článok prináša sumár súčasných vedeckých poznatkov týkajúcich sa rôznych antifibrinolytík používaných v kardiochirurgickej praxi s dôrazom na ich pozitívne a negatívne účinky.
Kľúčové slová:
aprotinín – kyselina tranexámová – kardiochirurgický výkonÚvod
Záujem o hemostázu je v neustálom popredí chirurgických oborov všade vo svete. Niektoré chirurgické výkony sú spojené s veľkou krvnou stratou, a to i u pacientov bez preexistencie hemostatických abnormalít, obzvlášť to platí v kardiochirurgii. Precíznosť kardiochirurga s obmedzením krvných strát a dokonalý manažment zrážacích faktorov, to všetko napomáha nadbytočnej strate krvi a následnej nutnosti podávania alogénnych krvných derivátov, samo o sebe spojených s rizikom prenosu infekcie, zvýšenej incidencie pneumónie a renálnej insuficiencie, či sepsy [1].
Hemostáza závisí na vyváženom pomere medzi koaguláciou, komplementom a fibrinolýzou, so širokou interakciou medzi plazmatickými proteínmi, krvnými doštičkami, krvným tokom, viskozitou krvi a intaktným endotelom. Použitie mimotelového obehu, reinfúzia mediastinálnej krvi a chirurgická manipulácia s vnútrohrudníkovými štruktúrami sa považujú za hlavné spúšťače hyperfibrinolýzy a doštičkovej dysfunkcie s excesívnymi krvnými stratami [2–4]. Aktivácia fibrinolytických pochodov môže mať za následok nielen zvýšené perioperačné krvácanie, ale môže mať u kardiochirurgických pacientov tiež vplyv na zhoršený klinický pooperačný priebeh [5].
Antifibrinolytiká sa v snahe znížiť perioperačné krvné straty a následné transfúzie požívajú v kardiochirurgii už približne 25 rokov. Jedným z dôvodov je fakt, že veľkoobjemové transfúzie, približne v ekvivalente 5 TU (TU – transfúzna jednotka) sú spojené so zvýšenou mortalitou [6, 7]. V klinickej praxi sú teoreticky dostupné dva druhy liekov: lyzínové analógy (kyselina tranexámova a kyselina ε-aminokapronová) a inhibítor serínových proteáz (aprotinín). Lyzínové analógy reverzibilne obsadzujú lyzínové miesto na molekule plazminogénu, a tak na povrchu fibrínu inhibujú premenu plazminogénu na plazmín [8, 9]. Aprotinín je látka s najmohutnejším antifibrinolytickým účinkom, prejavujúca sa hlavne priamou inhibíciou plazmínu, finálneho enzýmu fibrinolytickej cesty [11]. Na rozdiel od lyzínových analógov, inhibuje aprotinín súbežne aj ďalšie serínové proteázy, ako napr. trypsín, chymotrypsín, trombín, kalikreín, proteín C a tým aj amplifikačné deje v iniciálnom komplexe kontaktnej fázy vnútorného systému koagulačnej kaskády [10]. Je potrebné zmieniť aj jeho protizápalový potenciál spojený s potlačením produkcie voľných radikálov aktivovaných neutrofilmi, inhibíciou aktivácie nukleárneho faktora κB a expresie L-selektínu a ďalších adhezívnych molekúl a zmiernením apoptózy aktivovaných polymorfonukleárnych buniek [10, 12].
Jednotlivé antifibrinolytiká
Aprotinín
Aprotinín bol uvedený na európsky liekový trh v roku 1959 a používal sa predovšetkým pri liečbe pankreatitídy. V roku 1987 odštartoval používanie aprotinínu u kardiochirurgických pacientov v Európe David Royston, ktorý vo svojej práci pozoroval zníženie krvných strát u 11 z 22 reoperovaných pacientov, ktorým bol podaný aprotinín vo vysokej dávke [13]. V roku 1993 bol aprotinín schválený pre použitie u pacientov so zvýšeným rizikom krvácania pri revaskularizačných operáciach myokardu i v USA. Najskôr bol indikovaný na zníženie krvných strát iba u reoperacií, neskôr na základe jeho účinnosti a komplexného mechanizmu účinku sa jeho indikačné kritérium rozšírilo aj na koronárne bypassy s využitím mimotelového obehu. Jeho použitie môže spôsobovať anafylaktické a anafylakotoidné reakcie v pomere 1 : 200 u exponovaných pacientov. Z toho dôvodu sa v jeho aplikácii používala iniciačná testovacia dávka, ktorá potencionálne zabraňovala týmto reakciám.
V roku 2006 začalo byt používanie aprotinínu sporné, keď lieku bolo prisudzované zvýšené riziko renálneho zlyhania, infarktu myokardu, mŕtvice a smrti vo veľkých observačných štúdiách [14, 15, 16]. Pacienti boli liečení aprotinínom ako súčasť štandardnej liečby a tým mohli mať zvýšené riziko nežiaducich účinkov už od samotného počiatku [17, 18]. FDA (Úrad pre kontrolu potravín a liekov – lieková autorita v USA) rýchlo zareagovala varovaním pred týmito nežiaducimi účinkami a vyzvala k ich pozornému sledovaniu [19]. Ďalšie štúdie taktiež spojili aprotinín so zvýšeným rizikom smrti [20, 21]. Polemika a neistota nastali, keď aktualizovaná metaanalýza klinických štúdii neukázala žiadne zvýšené riziko infarktu myokardu, mŕtvice alebo smrti u pacientov dostavajúcich aprotinín. Avšak v súvislosti s podávaním aprotinínu upozorňovala na potencionálne riziko zvýšeného výskytu renálného zlyhania, ale nijako nesignalizovala možné problémy v otázke celkovej bezpečnosti [22, 23].
Ešte pred publikovaním štúdie Mangana et al. [16], začala BART štúdia (Blood Conservation Using Antifibrinolytics in a Randomized Trial). BART bola kanadská, multicentrická, dvojito slepá randomizovaná štúdia, ktorá porovnávala tri antifibrinolytiká (aprotinín, kyselinu tranexámovú a kyselinu ε ε-aminokapronovú) u vysokorizikových srdcových operácii. V štúdii nebola zahrnutá placebo skupina, lebo antifibrinolytická terapia je štandardom používania u vysokorizikových kardiochirurgických pacientov. Primárnym cieľovým ukazateľom tejto štúdie bolo masívne krvácanie (krvácanie väčšie ako 1500 ml v priebehu ôsmych hodín, krvné transfúzie viac ako desiatimi jednotkami krvi, úmrtie v priebehu prvých 24 hodín po operácii na krvácanie, či reoperácie pre krvácanie a tamponádu srdca). Sekundárnym cieľovým ukazateľom bola tridsaťdenná mortalita z akéhokoľvek dôvodu. Práve tento sekundárny cieľový ukazateľ viedol k predčasnému ukončeniu štúdie, pretože tridsaťdenná mortalita bola trvale vyššia v skupine s aprotinínom (6,0%) v porovnaní so skupinami s kyselinou tranexámovou (3,9%) a kyselinou ε-aminokaprónovou (4,0%). Zaujímavé je, že sa tento trend zvýšenej mortality prejavil až po prepustení pacientov z jednotky intenzívnej starostlivosti a rozdiel v mortalite nebol spôsobený kardiálnymi alebo renálnymi príčinami, ani tromboembolickými príhodami [24]. Nežiaduce účinky perioperačne podaného aprotinínu môžu toto obdobie presahovať o mesiace, dokonca roky [25, 26].
Praktické využitie doposiaľ najúčinnejšieho antifibrinolytika – aprotinínu – bolo na základe priebežných výsledkov BART štúdie pozastavené. V októbri 2007 rozhodla bezpečnostná komisia tejto štúdie o zastavení ďalšej randomizácie a nábere nových pacientov a stiahla v USA aprotinín z trhu s liekmi; informovala o tom 5. novembra 2007 FDA. Na základe rozhodnutia Európskej liekovej agentúry EMEA (European Medicines Agency) nasledovalo ukončenie predaja aprotinínu i v Európe a postupne aj v ďalších štátoch na celom svete. Aprotinín tým ustúpil do úzadia.
Jedným z dôvodov, prečo bol aprotinín stiahnutý z obehu až po takej dlhej dobe, bolo podľa Waynea Raya a Michaela Steina [28] to, že v štúdiách bol aprotinín porovnávaný s placebom. Na tlačovej konferencii, ktorá sa konala v Ottawa Health Research Institute, Fergusson povedal, že výsledky štúdie BART neurčili bezpečnosť aprotinínu u pacientov s malým rizikom, vrátane mladých pacientov a pacientov s komorbiditami [29]. Later et al. zistili, že aprotinín je u pacientov s normálnymi renálnymi parametrami, indikovanými na kardiochirurgický výkon s nízkym až stredným rizikom signifikantne účinnejší ako kyselina tranexámová [30].
Závery predčasne ukončenej štúdie BART nie sú do dnešnej doby plne vysvetlené a stále sú publikované ďalšie práce, snažiace sa výsledky tejto štúdie interpretovať [27]. Ostáva niekoľko nevyjasnených otázok vyplývajúcich zo štúdie BART. Prečo sa výsledky mortality líšili od záverov predchádzajúcich metaanalýz? Prečo sa efektívnejšia prevencia krvných strát neprejavila v lepších klinických výsledkoch? Bola v indikačných kritériách skupina pacientov, u ktorých by mohol byť aprotinín naďalej súčasťou liečby? Jedným z vysvetlení týchto diskrepancií je fakt, že metaanalýzy nedetegovali zvýšené riziko smrti po použití aprotinínu a že dáta boli zozbierané z mnohých malých štúdií, ktoré neboli primárne zamerané na štúdium mortality. Vyskytli sa medzi nimi i štúdie nižšej kvality, kde boli zahrnutí pacienti s nízkym aj vysokým rizikom. Ďalšou príčinou bol nedostatok v zistení doby úmrtia po prepustení pacienta z nemocnice.
Dôvodom, prečo sa prevencia krvných strát neprejavila zlepšením klinických výsledkov, je, že aprotinín ako nešpecifický inhibítor serinových proteáz inhibuje nielen plazmín, ale aj biologické mediátory, vrátane kalikreínu, proteázy aktivujúceho receptoru 1 a komplementu [10]. Napríklad inhibíciou kalikreínu sa očakáva zníženie produkcie bradykinínu s potenciálnym ovplyvnením vazodilatácie, zápalu a odpovede na inhibítory angiotenzin-konvertujúceho enzýmu. Tieto vedľajšie účinky môžu niekedy prevyšovať efekt hemostatický. Antifibrinolytiká by sa preto nemali posudzovať výhradne podľa primárneho fyziologického cieľa. Z týchto dôvodov je v súčasnosti dostupnosť aprotinínu limitovaná len pre výskumné účely.
Lyzínové analógy
Účinnosť lyzínových analógov v redukcii krvných strát a obmedzenie použitia transfúznych prípravkov bola preukázaná v mnohých štúdiách u kardiochirurgických operácii s použitím mimotelového obehu [31, 32] a taktiež u výkonov na bijúcom srdci [33–36]. Toto pôsobenie lyzínových analógov sa zdá byť takmer porovnateľné s účinnosťou aprotinínu. Podávanie syntetických analógov lyzínu sa javí aspoň pre túto chvíľu ako bezpečné [37].
Kyselina tranexámová (TXA, 4-aminomethyl-cyklohexánkarboxylová kyselina)
Kyselina tranexámová je väčšinou podávaná intravenóznou cestou, a to ako bolusová dávka, v infúzii, kontinuálne alebo kombinovane, niekedy sa pridáva do primingu do CPB (cardiopulmonary bypass, mimotelový obeh), alebo sa aplikuje lokálne. Celkové intravenózne dávky sú v rozmedzí 1–20 g, podávané v perióde 20 minút až 12 hodín. V porovnaní s placebom kyselina tranexámová znižuje krvné straty, nutnosť podania krvných derivátov a reoperácie, ako u výkonov na bijúcom srdci (off-pump), tak u výkonov s požitím mimotelového obehu (on-pump) [38–41].
Retrospektívna štúdia Vonka et al. preukázala, že u pacientov liečených aprotinínom v nízkej dávke dohromady s kyselinou tranexámovou, bolo v skupine s kyselinou tranexámovou osamote štatisticky vyššie percento pooperačnej straty krvi, reoperácii a nutnosti podávania krvných derivátov, čerstvých mrazených plaziem a krvných doštičiek [42].
Topické použitie
Pooperačné krvácanie je stále jedno z najčastejších komplikácii v kardiochirurgii. Antifibrinolytiká úspešne redukujú krvácanie, ale sú spory ohľadne nežiaducich účinkov po ich systémovom použití. Zdôvodnenie lokálneho použitia TXA môže byť podložené i pozorovaním Tabuchiho et al. a Khalila et al., ktorí zistili, že lokálna fibrinolytická aktivita v perikardiálnej dutine prevyšuje tú v systémovej cirkulácii [43, 44]. De Bonis vo svojej práci zistil, že lokálne použitie TXA v perikardiálnej dutine po mimotelovom obehu signifikantne redukuje u pacientov podstupujúcich aortokoronárne premostenie pooperačné krvácanie [45]. Je však potrebné zistiť účinnosť aj u vysokorizikových pacientov. Baric porovnával súbor 300 pacientov, kde skúmal použitie aprotinínu, kyseliny tranexámovej a placeba aplikovaných látok topicky do perikardiálnej dutiny. Zistil, že lokálne použitie TXA alebo aprotinínu efektívne redukuje pooperačné krvácanie. TXA je prinajmenšom taká účinná ako aprotinín, ale potencionálne bezpečnejšia [46]. Podobné výsledky má aj práca, kde Abul-Azm et al. zistili, že lokálna aplikácia TXA u pacientov podstupujúcich kardiovaskulárny výkon na otvorenom srdci spôsobuje signifikantne zníženú pooperačnú krvácavosť i počet revízii [47]. Taktiež Fawzy et al. získali poznatok, že kyselina tranexámová v porovnaní s placebom znižuje krvné straty u pacientov podstupujúcich aortokoronárny bypass [48]. Potenciovanie účinkov systémového podávania kyseliny tranexámovej jej lokálnym pôsobením sa zdá byť u operácií srdcových chlopní sľubné, no jednoznačnosť tohto odporúčania sa musí oprieť o štúdie s väčším súborom pacientov [49].
Nedávnym stiahnutím aprotinínu vyplýva otázka bezpečnosti TXA, obzvlášť zvýšeného výskytu neurologických komplikácii, vrátane pooperačných mŕtvic a konvulzívnych záchvatov [50]. Bell et al. pozorovali zvýšený nárast mozgových mŕtvic u pacientov podstupujúcich operáciu na otvorenom srdci dostávajúcich TXA, porovnaním pacientov, ktorí TXA nedostali [51]. Možným mechanizmom, ako môže TXA spôsobovať dané neurologické nežiaduce účinky, je jej chemická podobnosť s kyselinou gama-aminomaslovou (GABA) (obr. 1) a inhibíciou GABA receptorov neurónov [51].
Image 1. Chemická štruktúra kyseliny tramexámovej (TXA) a gamma- aminomaslovej (GABA) 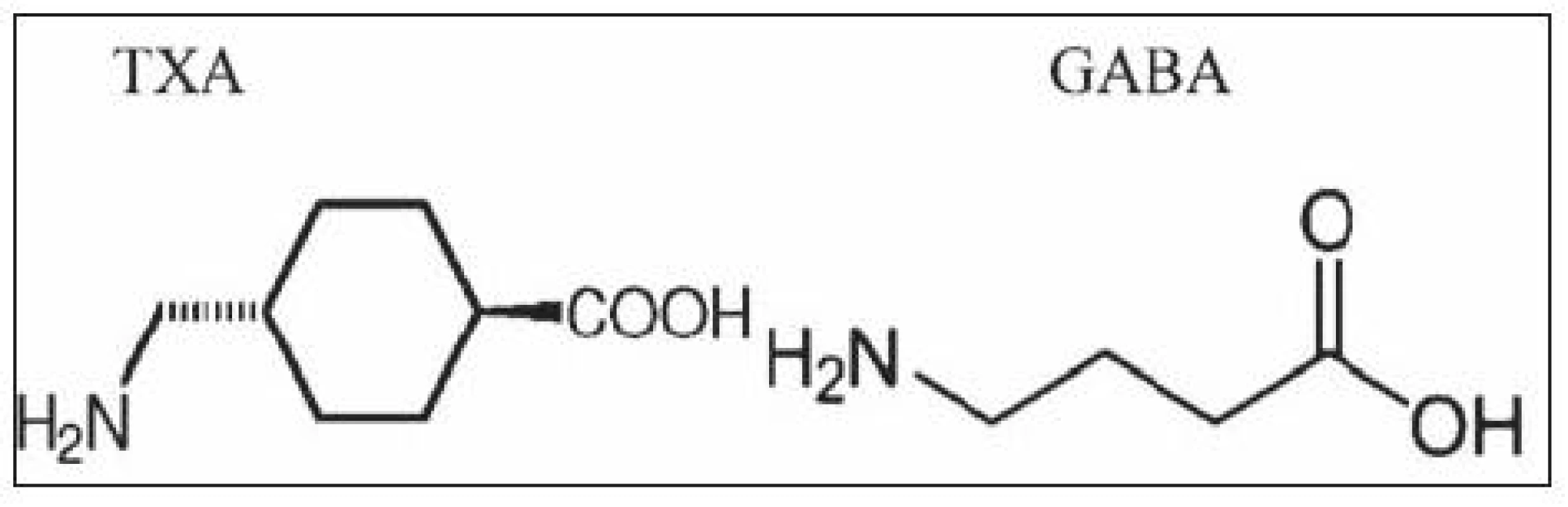
V súčasnej dobe nie sú jasné oficiálne odporúčania v používaní TXA u kardiochirurgických výkonov, no napriek tomu je jej použitie vedecky odôvodnené a TXA je súčasťou liečebných protokolov mnohých kardiochirurgických centier všade vo svete.
Kyselina ε-aminokaprónová (EACA)
Kyselina ε-aminokaprónová sa zdá byť minimálne rovnako účinná ako nízkodávková schéma aprotinínu [52]. Samotná kyselina ε-aminokaprónová nie je v Európe príliš rozšírená, používa sa hlavne v USA [53]. V súčasnej dobe nie je v Českej republike ani na Slovensku registrovaná. Môže indukovať mŕtvice, delíria [54] a dokonca myonekrózy [55].
Štúdia zaoberajúca sa porovnávaním dvoch skupín v rámci perioperačného obdobia zistila, že pooperačný výskyt mŕtvice je vyšší u pacientov s TXA, zatiaľ čo pacienti s EACA mali vyššiu incidenciu pooperačného renálneho zlyhania [56]. Táto štúdia ale nebola randomizovaná. Skupina pacientov s TXA mala niekoľko signifikantných odlišností od skupiny pacientov s EACA. Napríklad, viac ako dvojnásobný počet diabetikov, nižšiu hladinu perioperačného hemoglobínu a dlhý čas mimotelového obehu.
Posledná veľká metaanalýza týkajúca sa používania aprotinínu a lyzínových analógov, zahrňujúca 250 randomizovaných štúdii, bola uverejnená v roku 2011 v Cochranovej databáze. Bolo v nej zahrnutých 25 000 pacientov. Porovnával sa účinok jednotlivých antifibrinolytík oproti placebu a antifibrinolytík navzájom. Henry et al. zistili, že aprotinín je v redukcii pooperačného krvácania účinnejší ako kyselina tranexámová a ako aj kyselina ε-aminokaprónová. Porovnaním účinkov zistili u kyseliny tranexámovej nižšiu incidenciu mortality. Porovnaním rizík jednotlivých antifibrinolytík a placeba nebol zistený rozdiel v riziku úmrtia, infarktu myokardu, mozgovej mŕtvice, hlbokej žilnej trombózy, pľúcnej embólie či renálneho zlyhania [57].
Kyselina para-aminometylbenzoová (PAMBA)
V kardiochirurgii sa štandardne nepoužíva. Nie je dostatok klinických štúdii, ktoré by podporovali jej klinický benefit v tejto indikácii.
Záver
Myslíme si, že v súčasnosti je stále veľmi málo dôkazov ohľadom odporúčania jedného lieku pred druhým. Rozhodnutie v použití musí byť individualizované na konkrétneho pacienta. Vyhnutie sa používaniu CPB ako jedného z hlavných spúšťačov SIRS (Systemic inflammatory response syndrome, syndróm systémovej zápalovej odpovede organizmu) separátne odsávanie z operačného poľa, či šetrná chirurgická manipulácia [58], to všetko môže zlepšiť klinický výsledok kardiochirurgických výkonov.
Kyselina tranexámová je používaná v mnohých centrách ako dôležitá súčasť prevencie krvácania. Neexistuje však jednotnosť v protokole podávania a v jej dávkovaní. Odporúčaná dávka 10 mg/kg ako bolus na jednotku telesnej hmotnosti je častokrát v praxi nadhodnotená. V niektorých štúdiách týkajúcich sa nízkorizikovej populácie sa aprotinín javí v redukcii celkových krvných strát takmer dvakrát účinnejší [59]. Priame porovnávanie kyseliny tranexámovej a aprotinínu, hlavne čo sa týka nežiaducich účinkov a úmrtia, vyznieva v prospech kyseliny tranexámovej [60].
V súčasnosti sa používanie kyseliny tranexámovej v kardiochirurgii javí ako metóda voľby predovšetkým v Európe, kde je najviac rozšírená. Kyselinou tranexámovou sa zaoberá aj súčasná celosvetová štúdia CRASH-2. V tejto štúdii kyselina tranexámová bezpečne znížila riziko úmrtia u krvácajúcich pacientov po úraze [61]. Úvodný bolus je najvhodnejšie podať ešte pred sternotómiou a následné kontinuálne podávanie ako udržiavaciu dávku do konca operácie.
Hodnotenie budúcich medikamentov v prevencii krvných strát v srdcovej chirurgii by mala zahrňovať i otázky nežiaducich účinkov, mortality a ďalších klinických ukazovateľov bezpečnosti.
Tento projekt je podporovaný Kardiovaskulárnym výskumným zámerom Univerzity Karlovej v Prahe č. MSM 0021620817.
Došlo dne 11. 9. 2011.
Přijato do tisku dne 23. 9. 2011.
Adresa pre korešpondenciu:
MUDr. Ján Špegár
Kardiochirurgická klinika, Kardiocentrum
FNKV 3. LF UK
Ruská 87
100 00 Praha 10
e-mail: janspegar@hotmail.com
Sources
1. Koch, C. G. et al. Morbidity and mortality risk associated with red blood cell and blood - component transfusion in isolated coronary artery bypass grafting. Rit. Care Med., 2006, 34, p. 1608–1616.
2. Biglioli, P. et al. Biological effects of off-pump vs. on-pump coronary artery surgery: focus on inflammation, hemostasis and oxidative stress. Eur. J. Cardiothorac. Surg., 2003, 24, p. 260–269.
3. Vaněk, T., Jareš, M., Šnircová, J., Malý, M. Fibrinolysis in coronary artery surgery: detection by thromboelastography. Interact. Cardiovasc. Thorac. Surg., 2007, 6, p. 700–704.
4. Scott Beattie, W. et al. The Post-BART Anti-Fibrinolytic Dilemma? J. Thorac. Cardiovasc. Surg., 2011, 25, p. 3–5.
5. Cvachovec, K., Horáček, M., Vislocký, I. A retrospective survey of fibrinolysis as an indicator of poor outcome after cardiopulmonary bypass and a possible early sign of systemic infl ammatory syndrome. Eur. J. Anaesthesiol., 2000, 17, p. 173–176.
6. Karkouti, K., Wijeysundera, D. N., Beattie, W. S. et al. Variability and predictability of large-volume red blood cell transfusion incardiac surgery: a multicenter study. Transfusion, 2007, 47, p. 2081–2088.
7. Karkouti, K., Wijeysundera, D. N., Yau, T. M. et al. The independent association of massive blood loss with mortality in cardiac surgery. Transfusion, 2004, 44, p. 1453–1462.
8. Thorsen, S. et al. Differences in the binding to fibrin of native plasminogen and plasminogen modified by proteolytic degradation: influence of omega-aminocarboxylic acids. Biochim. Biophys. Acta, 1975, 393, p. 55–65.
9. Hoylaerts, M., Lijnen, H. R., Collen, D. Studies on the mechanism of the antifibrinolytic action of tranexamic acid. Biochim. Biophys. Acta, 1981, 673, p. 75–85.
10. McEvoy, M. D., Reeves, S. T., Reves, J. G., Spinale, F. G. Aprotinín in cardiac surgery: a review of conventional and novel mechanisms of action. Anesth. Analg., 2007, 105, p. 949–962.
11. Kuitunen, A., Hiippala, S., Vahtera, E., Rasi, V., Salmenpera, M. The effects of aprotinín and tranexamic acid on thrombin generation and fibrinolytic response after cardiac surgery. Acta Anaesthesiol. Scand., 2005,49, p. 1272–1279.
12. Day, J. R., Landis, R. C., Taylor, K. M. Aprotinín and the protease activated receptor 1 thrombin receptor: antithrombosis, inflammation, and stroke reduction. Semin. Cardiothorac. Vasc. Anesth., 2006, 10, p. 132–142.
13. Royston, D., Taylor, K. M., Bidstrup, B. P., Sapsford, R. N. Effect of aprotinin on need for blood transfusion after repeat open-heart surgery. Lancet, 1987, 330, p. 1289–1291.
14. Karkouti, K., Beattie, W. S., Dattilo, K. M. et al. A propensity score case-control comparison of aprotinín and tranexamic acid in high-transfusion-risk cardiac surgery. Transfusion, 2006, 46, p. 327–338.
15. Mangano, D. T., Tudor, I. C., Dietzel, C. The risk associated with aprotinín in cardiac surgery. N. Engl. J. Med., 2006, 354, p. 353–365.
16. Mangano, D. T., Miao, Y., Vuylsteke, A. et al. Mortality associated with aprotinin during 5 years following coronary artery bypass graft surgery. JAMA, 2007, 297, p. 471–479.
17. Levy, J. H., Ramsay, J. G., Guyton, R. A. Aprotinin in cardiac surgery. N. Engl. J. Med., 2006, 354, p. 1953–1957.
18. Bidstrup, B. P. et al. Aprotinin and tranexamic acid in high--transfusion-risk cardiac surgery. Transfusion, 2006, 46, p. 2208–2210.
19. U.S. Food and Drug Administration “Information for Healthcare Professionals; Aprotinin (marketed as Trasylol)”. Dostupný na www: http://www.fda.gov/cder/drug/InfoSheets/ HCP/aprotininHCP.htm.
20. Schneeweiss, S., Seeger, J. D., Landon, J., Walker, A. M. Aprotinin during coronary-artery bypass grafting and risk of death. N. Engl. J. Med., 2008, 358, p. 771–783.
21. Shaw, A. D., Stafford-Smith, M., White, W. D. et al. The effect of aprotinín on outcome after coronary-artery bypass grafting. N. Engl. J. Med., 2008, 358, p. 784–793.
22. Ray, W. A. et al. Learning from aprotinin – mandatory trials of comparative efficacy and safety needed. N. Engl. J. Med., 2008, 358, p. 840–842.
23. Henry, D. A., Carless, P. A., Moxey, A. J. et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane Database Syst. Rev., 2007, 4, CD001886.
24. Fergusson, D. A. et al. For the BART Investigators. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery. N. Engl. J. Med., 2008, 358, p. 2319–2331.
25. US Food and Drug Administration FDA public health advisory aprotinín injection (marketed as Trasylol), FDA alert P06-19, February 8, 2006. Dostupné na www: http://www.fda.gov/cder/drug/advisory/aprotinin.htm.
26. US Food and Drug Administration Questions and answers on aprotinín (marketed as Trasylol). Dostupné na www: http:// www.fda.gov/cder/drug/infopage/aprotinin/aprotininQA.htm.
27. Murkin, J. Lessons learned in antifi brinolytic therapy: the BART trial. Semin. Cardiothorac. Vasc. Anesth., 2009,13, p. 127–131.
28. Ray, W. A., Stein, C. M. The aprotinin story – Is BART the final chapter? N. Engl. J. Med., 2008, 358, p. 2398–2400.
29. Fergusson, D. A., Hébert, P. C., Mazer, C. D. et al. A clinical trial comparing aprotinin with lysine analogues in high-risk cardiac surgery. N. Engl. J. Med., 2008, 358, p. 2319–2331.
30. Later, A. F. et al. Tranexamic acid and aprotinín in low - and intermediate-risk cardiac surgery: a non-sponsored, double-blind, randomised, placebo-controlled trial. Eur. J. Cardiothorac. Surg., 2009, 36, p. 322–329.
31. Levy, J. H. et al. Pharmacologic preservation of hemostatic system during cardiac surgery. Ann. Thorac. Surg., 2001, 72, p. 1814–1820.
32. Thiagarajamurthy, S., Levine, A., Dunning, J. Does prophylactic tranexamic acid safely reduce bleeding without increasing thrombotic complications in patients undergoing cardiac surgery? Interact. Cardiovasc. Thorac. Surg., 2004, 3, p. 489–494.
33. Vaněk, T., Jareš, M., Fajt, R. et al. Fibrinolytic inhibitors in off-pump coronary surgery: a prospective, randomized, double-blind TAP study (tranexamic acid, aprotinin, placebo). Eur. J. Cardiothorac. Surg., 2005, 28, p. 563–568.
34. Jareš, M., Vaněk, T., Straka, Z., Brůček, P. Tranexamic acid reduces bleeding after off -pump coronary artery bypass grafting. J. Cardiovasc. Surg., 2003, 44, p. 205–208.
35. Casati, V., Della Valle, P., Benussi, S. et al. Effects of tranexamic acid on postoperative bleeding and related hematological variables in coronary surgery: comparison between on-pump and off-pump techniques. J. Thorac. Cardiovasc. Surg., 2004, 128, p. 83–91.
36. Murphy, G. J., Mango, E., Lucchetti, V. et al. A randomized trial of tranexamic acid in combination with cell salvage plus a meta-analysis of randomized trials evaluating tranexamic acid in off-pump coronary artery bypass grafting. J. Thorac. Cardiovasc. Surg., 2006, 132, p. 475–480.
37. Henry, D., Carless, P., Fergusson, D., Laupacis, A. The safety of aprotinin and lysine-derived antifi brinolytic drugs in cardiac surgery: a meta-analysis. CMAJ, 2009,180, p. 183–193.
38. Ngaage, D. L., Bland, J. M. Lessons from aprotinin: is the routine use and inconsistent dosing of tranexamic acid prudent? Meta-analysis of randomised and large matched observational studies. Eur. J. Cardiothorac. Surg., 2010, 37, p. 1375–1383.
39. Casati, V. et al. Effects of tranexamic acid on postoperative bleeding and related hematochemical variables in coronary surgery: Comparison between on-pump and off-pump techniques. J. Thorac. Cardiovasc. Surg., 2004, 128, p. 83–91.
40. Wang, G. et al. Tranexamic Acid Reduces Blood Loss After Off-Pump Coronary Surgery: A Prospective, Randomized, Double-Blind, Placebo-Controlled Study. Anesth. Analg., 2011.
41. Adler Ma, S. C. et al. Tranexamic acid is associated with less blood transfusion in off-pump coronary artery bypass graft surgery: a systematic review and meta-analysis. Cardiothorac. Vasc. Anesth., 2011, 25, p. 26–35.
42. Vonk, A. B. et al. Removal of aprotinin from low-dose aprotinin/tranexamic acid antifibrinolytic therapy increases transfusion requirements in cardiothoracic surgery. Interact. Cardiovasc. Thorac. Surg., 2011, 12, p. 135–139.
43. Tabuchi, N. et al. Activation of fibrinolysis in the pericardial cavity during cardiopulmonary bypass. J. Thorac. Cardiovasc. Surg., 1993, 106, p. 828–833.
44. Khalil, P. N. et al. Activation of fibrinolysis in the pericardial cavity after cardiopulmonary bypass. Thromb. Haemost., 2004, 92, p. 568–574.
45. De Bonis, M. J. et al. Topical use of tranexamic acid in coronary artery bypass operations: a double-blind prospective, randomized, placebo. Controlled study. Thorac. Cardiovasc. Surg., 2000, 119, p. 575–580.
46. Baric, D. et al. Topical use of antifibrinolytic agents reduces postoperative bleeding: a double-blind, prospective, randomized study. Eur. J. Cardiothorac. Surg., 2007, 31, p. 366–371.
47. Abul-Azm, A., Abdullah, K. M. Effect of topical tranexamic acid in open heart surgery. Eur. J. Anaesthesiol., 2006, 23, p. 380–384.
48. Fawzy, H. et al. Can local application of Tranexamic acid reduce post-coronary bypass surgery blood loss? A randomized controlled trial. J. Cardiothorac. Surg., 2009, 18, p. 25–30.
49. Špegár, J., Vaněk, T., Šnircová, J. et al. Local and systemic application of tranexamic acid in heart valve surgery: a prospective, randomized, double blind LOST study. J. Thromb. Thrombolysis, 2011, 32, p. 303–310.
50. Martin, et al. The risk of aprotinin and tranexamic acid in cardiac surgery: A one-year follow up of 1188 patients. Anesth. Analg., 2008, 107, p. 1783–1790.
51. Bell, D., Marasco, S., Almeida, A., Rowland, M. Tranexamic Acid in cardiac surgery and postoperative seizures: a case report series. Heart Surg. Forum, 2010, 13, p. 257–259.
52. Morozov, IuA. et al. Effects of aminocapronic acid and small--dose trasilol on blood loss after cardiac surgery with extracorporeal circulation. Anesteziol. Reanimatol., 2005, 4, p. 58–60.
53. Lobato, et al. Anticoagulation management during cardiopulmonary bypass: A survey of 54 North American Institutions. J. Thorac. Cardiovasc. Surg., 2010, 139, p. 1665–1666.
54. Wysenbeek, A. J., Sella, A., Blum, I. et al. Acute delirious state after epsilon-amino caproic acid administration. Clin. Toxicol., 1979, 14, p. 93–95.
55. Galassi, G., Gibertoni, M., Corradini, L. et al. Why may epsilon-aminocaproic acid (EACA) induce myopathy in man? Report of a case and literature review. Ital. J. Neurol. Sci., 1983, 4, p. 489–492.
56. Martin, K., Knorr, J., Brever, T. et al. Seizures after open heart surgery: Comparison of -aminocaproic acid and tranexamic acid. J. Cardiothorac. Vasc. Anesth., 2011, 25, p. 20–25.
57. Henry, D. A. et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane Database Syst Rev, 2011, 16, 3, CD001886.
58. Biglioli, P. et al. Biological effects of off-pump vs. on-pump coronary artery surgery: focus on inflammation, hemostasis and oxidative stress. Eur. J. Cardiothorac. Surg., 2003,24, p. 260–269.
59. Ranucci, M. et al. Living without aprotinín: the results of a 5-year blood saving program in cardiac surgery. Acta Anaesthesiol. Scand., 2009, 53, p. 573–580.
60. Later, A. F. et al. Tranexamic acid and aprotinin in low - and intermediate-risk cardiac surgery: a non-sponsored, double-blind, randomised, placebo-controlled trial. Eur. J. Cardiothorac. Surg., 2009, 36, p. 322–329.
61. CRASH-2 trial collaborators Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomized, placebo controled trial. Lancet, 2010, 376, p. 23–32.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2011 Issue 5-
All articles in this issue
- Ultrazvukem naváděný mediální cervikální blok
- Fibrinolýza v kardiochirurgii v postaprotinínovej ére
- Mechanismus vzniku hypotenze po i. v. paracetamolu u kriticky nemocných
- Je rozdiel v prežívaní pacientov s kraniocerebrálnym poranením s meraným a nemeraným intrakraniálnym tlakom?
- Vliv teploty na výsledky tromboelastografie – prospektivní studie
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ultrazvukem naváděný mediální cervikální blok
- Je rozdiel v prežívaní pacientov s kraniocerebrálnym poranením s meraným a nemeraným intrakraniálnym tlakom?
- Mechanismus vzniku hypotenze po i. v. paracetamolu u kriticky nemocných
- Fibrinolýza v kardiochirurgii v postaprotinínovej ére
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

