-
Medical journals
- Career
Vliv podání transfuzních jednotek erytrocytárních koncentrátů na koncentrace elektrolytů a acidobazickou rovnováhu in vivo
Authors: Uvízl Radovan; Klementa Bronislav; Neiser Jan; Fritscherová Šárka; Adamus Milan
Authors‘ workplace: Klinika anesteziologie a resuscitace, Fakultní nemocnice Olomouc
Published in: Anest. intenziv. Med., 22, 2011, č. 1, s. 13-18
Category: Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Vlivem metabolismu erytrocytů a jejich rozpadem dochází v konzervě erytrocytů ke změnám výchozí koncentrace některých biochemických veličin. Podání většího množství erytrocytární náhrady může vést ke změnám vnitřního prostředí pacienta. Předmětem práce bylo sledování vlivu podaných erytrocytárních koncentrátů na hladiny vybraných biochemických veličin in vivo v závislosti na množství a stáří podané transfuze.Typ studie:
Prospektivní observační studie.Typ pracoviště:
Lůžková část kliniky anesteziologie a resuscitace fakultní nemocnice.Materiál a metoda:
Vzorky arteriální krve pacientů jsme odebrali před transfuzí a po podání transfuze sledovaného počtu TU EBR (transfuzní jednotka erytrocytárního koncentrátu bez buffy coatu) a vyšetřili jsme je bed-side analyzátorem. Stanovili jsme hodnoty sledovaných biochemických veličin (K+, laktát, pH, Na+, Ca++, glykémie) v plazmě pacientů. Analýzou naměřených dat jsme sestavili křivky závislosti hodnot jednotlivých biochemických veličin na množství a stáří podaných TU EBR.Výsledky:
Prospektivně jsme vyšetřili 46 pacientů, kterým bylo podáno celkem 354 TU EBR. Rozmezí podané erytrocytární náhrady bylo 2–38 TU EBR, průměr 7,7 TU EBR/pacienta. Podáním 1 TU EBR došlo in vivo ke zvýšení kalémie průměrně o 0,07 mmol/l, zvýšení hladiny laktátu průměrně o 0,13 mmol/l. U hodnot pH, Na+, Ca++ a glykémie došlo jen k minimálním změnám.Závěr:
Podání většího množství konzerv erytrocytárních koncentrátů může vést ke změnám hladin kalia a laktátu v plazmě pacienta.Klíčová slova:
erytrocyty – transfuze – hyperkalémie – laktát – EBRÚvod
Akutní krvácivé stavy jsou často spojeny s nutností transfuze krevních derivátů, zejména EBR. Biochemické složení obsahu konzerv EBR se mění v závislosti na délce skladování [1]. Převod většího objemu EBR se může podílet na změnách plazmatických biochemických hodnot u pacientů [2] a může tedy souviset nejen s množstvím podané erytrocytární náhrady, ale i s jejím stářím [3]. V konzervách EBR dochází k postupnému vzestupu hladiny kalia a laktátu, a také k poklesu pH [4]. Tyto změny jsou dány metabolismem erytrocytů (anaerobní glykolýzou), nastupující dekompozicí erytrocytů a vlivem blokády adenozintrifosfatázy chladem.
Cílem práce bylo zhodnotit vliv podání vícečetné transfuze erytrocytů na změnu hladin sledovaných biochemických veličin v plazmě pacientů. Kromě četnosti podaných TU EBR jsme sledovali i jejich stáří.
Soubor a metody
Prospektivně jsme vyšetřili soubor 46 pacientů, jimž byla z důvodu nutné substituce erytrocytů podána transfuze TU EBR různého stáří. Sledovali jsme plazmatické hodnoty K+, laktátu, pH, Na+, Ca++ a glykémie před transfuzí a po podání různého množství erytrocytární náhrady. Vyšetřované krevní vzorky jsme získali odběrem 0,5 ml krve z arteriálního katétru pacientů odběrovou stříkačkou Marquest Quik A.B.G. Vzorky jsme analyzovali v kombinovaném acidobazickém analyzátoru Stat Profile CCX, Nova Biomedical. Práce byla provedena na lůžkové části KAR FN Olomouc.
Do souboru jsme nezařadili nemocné s renálním selháváním (nutnost podpory diurézy furosemidem, urea nad 20 mmol/l, kreatinin nad 300 µmol/l, dialýza), dále nemocné s manifestní hepatální insuficiencí (elevace jaterních transamináz nad dvojnásobek horní hranice normy, elevace bilirubinu nad 25 µmol/l) a pacienty s podporou oběhu noradrenalinem v dávce nad 0,1 µg/kg/min. Nezařadili jsme také nemocné, kterým byl v intervalu sledování podán bikarbonát sodný nebo byla nutná substituce vstupní hypokalémie kaliumchloridem. Zhodnotili jsme vliv četnosti podání TU EBR na změny plazmatických hladin biochemických veličin u pacientů in vivo.
Výsledky jsme vyhodnotili parametrickým párovým t-testem a neparametrickým párovým Wilcoxonovým testem. Korelace mezi počtem podaných TU EBR a vzestupem hladiny kalia a laktátu jsme prokázali Spearmanovým korelačním koeficientem. Metodou regresní analýzy jsme sestavili křivky závislosti plazmatických koncentrací jednotlivých biochemických veličin na podaném množství erytrocytární náhrady.
Vzhledem k metodice sběru dat nebyl vyžadován souhlas etické komise s protokolem studie.
Výsledky
Do souboru jsme zařadili 46 pacientů, z nichž bylo 31 mužů (67,4 %) s věkovým průměrem 56,97 roku a 15 žen (32,6 %) s věkovým průměrem 57,66 roku. Složení souboru pacientů s ohledem na primární diagnózu: krvácení v souvislosti s chirurgickým výkonem 28 nemocných, úrazové krvácení 18 nemocných. Pacientům bylo podáno průměrně 7,71 TU EBR/pacienta, medián 6,3 TU EBR, rozmezí 2–38 TU EBR. Celkové množství podaných TU EBR bylo 354 a jejich průměrné stáří 16,18 dne, medián 15,8 dne. Ženám bylo podáno průměrně 6,33 TU EBR/pacientku (průměrné stáří EBR 15,78 dne) a mužům 8,38 TU EBR/pacienta (průměrné stáří 16,33 dne).
1. Zvýšení hladiny kalia nastalo u 34 pacientů (74 %; průměrné množství 8,47 TU EBR, průměrné stáří EBR 16,32 dne). Z toho u 7 pacientů (15 %) toto zvýšení vedlo k hyperkalémii (průměrné množství 11,85 TU EBR/pacienta, průměrné stáří EBR 16,78 dne). Těžká hyperkalémie byla zaznamenána u 1 pacienta, příjemce 38 TU EBR (průměrné stáří EBR 18,62 dne), u kterého kalémie vzrostla ze 4,0 mmol/l na 7,3 mmol/l (tab. 1).
Table 1. Vzestup kalémie v souvislosti s podáním EBR 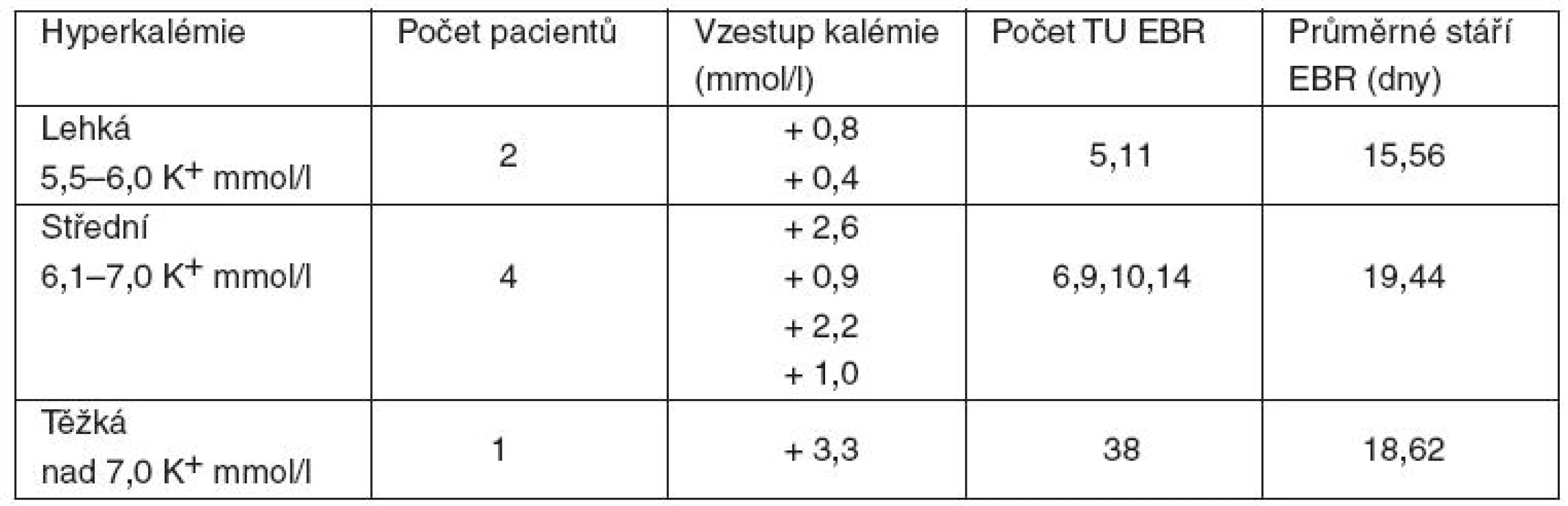
Beze změny hladiny kalia zůstali 4 nemocní (9 %; průměrné množství 2,75 TU EBR/pacienta, průměrné stáří EBR 14,63 dne). Ke snížení hladiny kalia došlo u 9 pacientů (20 %; průměrné množství 6,0 TU EBR/pacienta, průměrné stáří EBR 11,74 dne).
Podání průměrného množství 7,71 TU EBR/pacienta vedlo ve sledovaném souboru pacientů ke zvýšení kalémie o 0,54 mmol/l. Výpočtem jsme zjistili, že podání 1 TU EBR bylo spojeno se zvýšením kalémie in vivo průměrně o 0,07 mmol/l. Statistickým zpracováním jsme prokázali středně silnou pozitivní korelaci mezi počtem podaných TU EBR a změnou hladiny K+. Zvýšení bylo statisticky významné (p = 0,0002) – tabulka 2, graf 1.
Table 2. Změny hodnot koncentrací K<sup>+</sup>, pH, laktátu, Na<sup>+</sup>,Ca<sup>++</sup>, glykémie in vivo po podání 2–38 (průměr 7,7) TU EBR 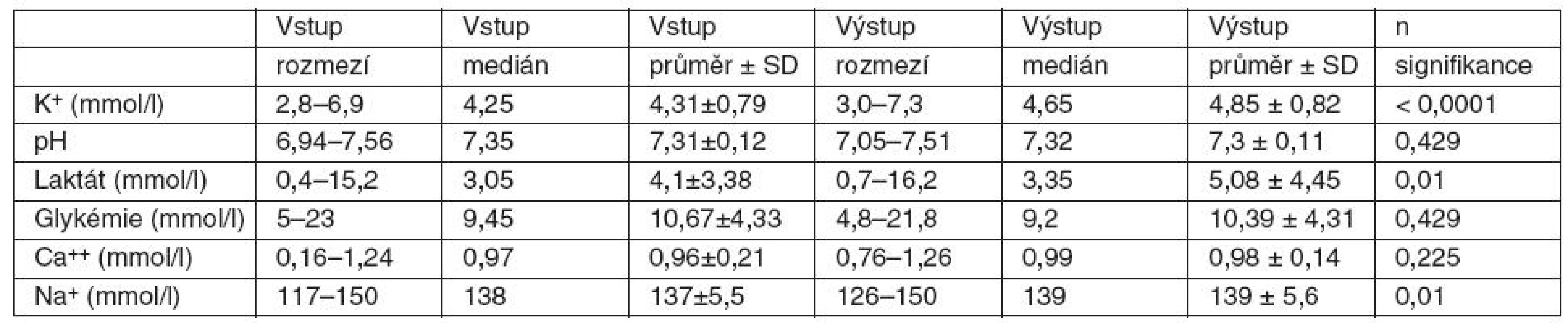
Graph 1. Změna kalémie po podání různých množství TU EBR (průměrné stáří EBR 16,18 dne) 
2. Při sledování hladin laktátu jsme zaznamenali statisticky významný rozdíl mezi pohlavími. Ke zvýšení hladiny laktátu došlo u 28 pacientů (61 %). Z nich bylo 21 mužů (46 %; průměrné množství 10,72 TU EBR/pacienta, průměrné stáří EBR 15,46 dne) a 6 žen (13 %; průměrné množství 8,83 TU EBR/pacientku, průměrné stáří EBR 15,05 dne). Snížení hladiny laktátu jsme zaznamenali u 8 mužů (17 %; průměrné množství 4,88 TU EBR/pacienta, průměrné stáří EBR 15,79 dne) a 9 žen (20 %; průměrné množství 4,66 TU EBR/pacientku, průměrné stáří EBR 16,09 dne). U 2 mužů (5 %; průměrné množství 2 TU EBR/pacienta, průměrné stáří EBR 20 dní) nedošlo ke změně hladiny laktátu. Výpočtem jsme zjistili, že podání 1 TU EBR bylo spojeno in vivo u mužů s průměrným zvýšením hladiny laktátu o 0,2 mmol/l. U žen naopak s poklesem laktatémie průměrně o 0,06 mmol/l. Statistickým zpracováním jsme prokázali středně silnou pozitivní korelaci mezi počtem podaných TU EBR a změnou hladiny laktátu. Zvýšení bylo statisticky významné (p = 0,01) – tabulka 2. Neparametrickým testem Mann-Whitney jsme prokázali, že u mužů došlo k signifikantně větším změnám hodnot laktátu než u žen. U mužů bylo průměrné zvýšení laktatémie o 1,52 mmol/l (medián 1,0), zatímco u žen došlo k jejímu snížení v průměru o 0,16 mmol/l (medián – 0,1).
3. U hodnot pH, Na+, Ca++ a glykémie nenastaly statisticky významné změny (viz tab. 2). Při srovnání sledovaných plazmatických změn po podání EBR u mužů a u žen jsme zjistili rozdílné hodnoty pouze u laktatémie. U ostatních sledovaných hodnot jsme neprokázali rozdíly mezi pohlavími.
Diskuse
Zjištěné výsledky s ohledem na nárůst kalémie korespondují se závěry studie Aboudary et al. z r. 2008 [5]. Studie sledovala výskyt hyperkalémie (nad 5,5 mmol/l) v souboru 131 traumatických pacientů nepostižených crush syndromem, kteří prodělali kardiopulmonální resuscitaci v průběhu úvodních 12 hodin hospitalizace. Z tohoto souboru byla 96 nemocným (73,3 %) podána erytrocytární náhrada (průměrné množství 11,2 TU/pacienta, rozmezí 1–55 TU). Zajímavým zjištěním bylo dosažení hyperkalémie u 38,5 % pacientů s erytrocytární náhradou, zatímco bez transfuze erytrocytů se do pásma hyperkalémie dostalo pouze 2,9 % nemocných. Studie dokumentovala strmější nárůst kalémie ve skupině pacientů s erytrocytární náhradou (ze 3,7 mmol/l na 5,3 mmol/l) ve srovnání se skupinou bez transfuze (ze 3,6 mmol/l na 4,0 mmol/l).
Obdobné závěry ukazuje i studie Smithe et al. [6] z r. 2006. Pracoval s retrospektivně sestaveným souborem pacientů, kteří byli operováni na Mayo Clinic v letech 1988–2006 a došlo u nich k hyperkalemické peroperační zástavě v souvislosti s podáním vícečetné krevní náhrady. Identifikovali takto 16 nemocných (11 dospělých a 5 dětí), kterým byla podána peroperačně erytrocytární náhrada v množství mezi 1 (novorozenec 2,7 kg) a 54 TU EBR. Střední hodnota kalémie u nich v průběhu srdeční zástavy byla 7,2 ± 1,4 mmol/l (rozmezí 5,9–9,2 mmol/l). Střední doba resuscitace byla 32 minut (rozmezí 2–127 min) a přežití do propuštění z nemocnice bylo 12,5 %.
Retrospektivním vyhodnocením námi získaných dat z biochemické analýzy 80 vzorků TU EBR jsme v práci z r. 2009 stanovili koncentrace sledovaných biochemických veličin v konzervách v závislosti na jejich stáří. Dokumentovali jsme především signifikantní nárůst koncentrace kalia a laktátu, snížení pH a hladiny natria v průběhu „stárnutí“ konzervy erytrocytárního koncentrátu [4]. V konzervě EBR dochází postupně k uvolňování K+ extracelulárně a vstupu iontů Na+ do erytrocytů. Zároveň se změnami pH může u pacienta dojít při masivní krevní náhradě k výraznému nárůstu kalémie [7].
Z biochemických hodnot, zjištěných během stárnutí jednotek EBR, vyplývá možnost překročení maximální dodávky kalia, která je podle doporučení [8, 9] stanovena na 20 mmol/hod (při substituci hypokalémie až 40 mmol/hod [10]. K jejímu dosažení může dojít již při podání průměrně 6 TU EBR/hod (při průměrném stáří EBR 14 dní je koncentrace kalia 23 mmol/l). Při průměrné hodnotě hematokritu v EBR 0,50 a objemu transfuzní jednotky 290 ml ± 20 ml je celkové množství extracelulární tekutiny v TU EBR 145 ml a množství kalia ve 14 dní starém EBR průměrně 3,33 mmol K+. Za výrazné riziko nadlimitní dodávky kalia (a ostatních možných nežádoucích změn vnitřního prostředí) lze považovat rychlou a masivní krevní náhradu. Důležitou roli hraje i stáří použitých krevních náhrad. Prodloužení skladování EBR z 35 na 42 dní zvyšuje hemolýzu erytrocytů v průměru o 30 % [11]. Rozdíl v životnosti transfundovaných erytrocytů ve skupině krátkodobě skladovaných erytrocytů (1–10 dní) a dlouhodobě skladovaných erytrocytů (25–35 dní) ukázal po 24 hodinách od podání transfuze rozdíl v přežívání erytrocytů ve prospěch mladší populace 86,4 ± 17,8 procent proti 73,5 ± 13,7 procent u starší populace erytrocytů [12]. Naproti tomu podání déle skladovaných erytrocytů nemá u kriticky nemocných pacientů nepříznivý vliv na gastrickou tonometrii nebo na tkáňovou oxygenaci [13]. Z aktuálně publikovaných údajů je obtížné určit vztah mezi stářím EBR a morbiditou, respektive mortalitou u dospělých pacientů, s výjimkou traumatologických pacientů s masivní krevní náhradou, u nichž je riziko starších EBR prokázáno [14]. Nedávné publikace naznačují, že trasfuze EBR starších než 2 týdny jsou spojeny s nárůstem rizika pooperačních komplikací a vyšší mortalitou [15, 16, 17]. Metabolické změny v organismu příjemce transfuze, mezi něž patří hyperkalémie, citrátová toxicita, laktátová acidóza a hypotermie, mohou způsobit depresi funkce levé komory [2]. EBR starší než 2 týdny zvyšují u kardiochirurgických pacientů riziko pooperačních komplikací i mortalitu [18, 19]. Transfuze erytrocytů zvyšuje mozkovou oxygenaci u pacientů s těžkým mozkovým poraněním, s výjimkou transfuze EBR starších než 19 dní [20]. Z hlediska neurokognitivního deficitu jsou však erytrocyty staré 3 týdny stejně efektivní při substituci akutní anémie jako EBR staré 3,5 hodiny. Vyžadování čerstvé krve tedy z tohoto pohledu není opodstatněné [21].
S prodlužováním možnosti skladování konzerv EBR užitím nových zásaditých roztoků až na 10 týdnů [22] se ukazuje možnost eliminace rizika hyperkalémie použitím K+ adsorbčních filtrů před podáním starších koncentrátů EBR. Hladina K+ před filtrací 28 dní starých koncentrátů EBR byla v další publikované studii 60,6 ± 2,68 mmol/l. Po přefiltrování byla hladina K+ pouze 3,42 ± 2,91 mmol/l [23].
V současné době však v klinické praxi K+ adsorbční filtry nemáme. Nabízí se otázka, zda u pacientů ohrožených hyperkalémií (masivní krevní náhrada, renální selhání, preexistující hyperkalémie) s ohledem na další komplikace, které se s podáním „starých“ EBR u kriticky nemocných pojí (TRIM, schopnost přenosu O2, zhoršení deformability erytrocytů a jejich vliv na průtok již tak postiženou mikrocirkulací atd.), uvažovat o preferenčním podání EBR, které nebyly dlouho skladovány. Zda tedy předem s transfuzním oddělením domluvit preferenční výběr „mladých“ EBR pro tyto nemocné. Bylo prokázáno, že stáří EBR, podaných v prvních šesti hodinách substituce krevní ztráty je nezávislým rizikovým faktorem pro rozvoj posttraumatického multiorgánového selhání. Čerstvá krev by měla být vyžadována v iniciální fázi objemové resuscitace traumatizovaných pacientů [28].
Při monitorování laktatémie jsme zaznamenali statisticky významný rozdíl mezi pohlavími, když u mužů hladina laktátu v průměru vzrostla, zatímco u žen došlo k jejímu poklesu. Pro toto zjištění nemáme uspokojivé vysvětlení. Zároveň se nabízí otázka zkreslení interpretace hladiny laktátu – markeru šoku a úspěšnosti jeho léčby – u pacientů s vícečetnou transfuzí.
K poklesu hladiny ionizovaného kalcia při intoxikaci citrátem, a tím také ke klinickým známkám hypokalcémie v důsledku transfuze citrátového krevního derivátu, dochází zřídka. V takovém případě je možné podat 10 ml 10% CaCl2, avšak rutinní podání vápníku je v současné době stále předmětem diskuse. Vazba citrátu na kalcium v organismu příjemce vede ke snížení hladiny ionizovaného kalcia. Ke klinickým známkám citrátové toxicity (deprese inotropie myokardu, prodloužení QT intervalu, snížení cévní rezistence) může dojít při aplikaci krevních derivátů s citrátovými konzervačními roztoky, je-li rychlost podání takového derivátu vyšší než 100 ml/minutu, případně u pacientů s hepatopatií i při nižší rychlosti podání [24].
Změny pH v plazmě pacienta spojené s podáním transfuze EBR nebyly zaznamenány, přestože acidifikačně mohou působit jak metabolit anaerobní glykolýzy erytrocytů – laktát, tak i pH konzervačního roztoku. Na pokles pH konzervy má zřejmě vliv i podíl vzestupu pCO2 jejího obsahu. Skladovaná krev má nízké pH v důsledku přítomné kyseliny mléčné a citrátového antikoagulancia, ale může dojít i k projevům metabolické alkalózy, jejíž příčinou je metabolismus citrátu na bikarbonát. Výsledný posun pH tedy závisí jak na rychlosti a množství podané transfuzní náhrady, tak na aktuální metabolické funkci jater [24]. Rychlost podání erytrocytárního koncentrátu závisí na toleranci pacientem: nejvyšší doporučená rychlost podání je 100 ml/min, nejpomaleji lze 1 TU EBR aplikovat během 4 hodin (riziko bakteriální kontaminace). Je-li třeba aplikovat pomaleji (u nemocných s kardiálním selháváním) je vhodné požádat transfuzní stanici o rozdělení přípravku do menších objemů [25].
Pokles 2,3-DPG v erytrocytech je úměrný stáří konzervy. Vede k posunu disociační křivky hemoglobinu doleva a ke zvýšení afinity hemoglobinu ke kyslíku. Důsledkem je snížené uvolňování kyslíku ve tkáních a hrozba tkáňové hypoxie. V průběhu skladování EBR dochází v erytrocytech kromě redukce 2,3-difosfoglycerátu i ke snížení jejich deformability a k redukci ATP. Tyto změny snižují potransfuzní životnost erytrocytů, snižují dostupnost tkáňové oxygenace, mají prozánětlivé a imunomodulační účinky. Po podání EBR starších než 21 dní došlo ve studii k poklesu tkáňové oxygenace ve srovnání se skupinou pacientů po transfuzi mladší krve. Délka skladování EBR tedy může mít vliv na dodávku kyslíku do tkání [26]. Nejsou však k dispozici randomizované kontrolované studie dokazující vliv délky skladování EBR na morbiditu a mortalitu [3].
K přetížení železem může dojít u pacientů po opakovaném podání transfuzí erytrocytů. Denní extrakce železa je za normálních okolností okolo 1 mg. 1 TU EBR obsahuje okolo 250 mg železa. Plné saturace plazmatického transferinu železem je dosaženo po podání 10–15 TU EBR, nenavázané železo pak může způsobit poškození orgánů tvorbou jeho depozit ve tkáních myokardu, jater a pankreatu. Negativně se může projevit rovněž proinfekční působení železa. U jednorázové masivní krevní náhrady však k přetížení železem nedochází [24, 27].
Uvažovaný vliv ostatních krevních derivátů (čerstvé zmrazené plazmy, trombokoncentrátu) na změny plazmatických hladin sledovaných veličin je pravděpodobně nevýznamný. Hodnoty pH a kalia nejsou výrazně odlišné od fyziologických plazmatických hodnot.
Při komentáři výsledků práce je třeba uvažovat o možném vlivu řady proměnných, které hrají roli v aktuálním stavu vnitřního prostředí pacienta. V různé míře se uplatňují při rozvinutí hemoragického šoku a mohou prezentované výsledky do značné míry zkreslovat. Záleží především na schopnosti nárazníkových systémů korigovat snižující se pH. Změna o 0,1 pH vede ke změně o 0,4 mmol/l kalémie (podle některých pramenů o 0,6 mmol/l K+ [10]), acidóza kalémii zvyšuje, alkalóza ji snižuje. Výsledná změna vnitřního prostředí závisí také na schopnosti respiračního systému korigovat nastupující metabolickou acidózu. Důležitý je stav renálních funkcí, schopnost ledvin zvýšit exkreci kalia ať při spontánně zachované diuréze, ale zvláště pak po podání kličkového či osmotického diuretika. Výrazným rizikovým faktorem pro možné dosažení kritické hyperkalémie je již preexistující hyperkalémie. Zohlednit je třeba i pokračující krevní ztrátu (tedy již relativně hyperkalemické krve po předchozím podání transfuze), stupeň tkáňové a orgánové hypoperfuze (jež sama prohlubuje acidózu) a schopnost jater metabolizovat citrát na bikarbonát a laktát na glukózu. Nelze přehlédnout možný vliv podávaných náhradních roztoků s obsahem kalia (Plasmalyte 5 mmol/l, Ringer acetát 5 mmol/l, Ringer laktát 5 mmol/l, Ringerfundin 4 mmol/l, Tetraspan 4 mmol/l, Voluven a fyziologický roztok kalium neobsahují), nebo roztoků alkalizujících (Plasmalyte) či udržujících neutrální pH (Ringerfundin).
V jednom ze sledovaných případů jsme zaznamenali výrazný pokles kalémie, k němuž došlo po nasazení peroperační rekuperace krve přístrojem Cell-saver. Rekuperát (krev na návratu k pacientovi) byl hypokalemický (2,7 mmol/l K+). K promývání aspirované krve je v rekuperátoru použit heparinizovaný fyziologický roztok, který kalium neobsahuje. Centrifugací je stažena nadbytečná tekutina, jež obsahuje ionty. Na návratu k pacientovi není krev standardně biochemicky monitorována, a pokles kalémie tak nemusí být zaznamenán.
Za úvahu stojí provedení předtransfuzního screeningu pacientů s rizikem hyperkalémie, u kterých by bylo vhodné preferovat podání „čerstvých“ erytrocytů. Je vhodné (pokud je to z časových a organizačních důvodů možné) jednat s krevní bankou o preferenčním výběru „mladých“ EBR pro tyto nemocné.
Závěr
Ze zjištěných změn plazmatických hodnot biochemických parametrů vyplývá riziko rozvoje hyperkalémie a hyperlaktatémie v závislosti na charakteru podané náhrady EBR. Toto riziko je tím větší, čím větší je množství podané EBR substituce, čím vyšší je rychlost transfuze a čím starší je populace podávaných erytrocytů. Vhodné je intermitentní sledování biochemických hodnot nejen u všech pacientů v průběhu masivní krevní náhrady, ale i u těch nemocných, u nichž je limitována schopnost vyloučit nálož draslíku (renální insuficience) nebo u pacientů s preexistující hyperkalémií.
Předběžné výsledky práce byly prezentovány na IV. česko-slovenském kongresu ČSIM v Brně a na XVII. kongresu ČSARIM ve Zlíně.
Došlo dne 26. 5. 2010.
Přijato dne 8. 11. 2010.Adresa pro korespondenci:
MUDr. Radovan Uvízl
KAR FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: radovan.uvizl@seznam.cz
Sources
1. Larsen, R. Anestezie. Praha: Grada publishing, 2004, p. 718–753.
2. Brecher, M. E. Noninfectious complications of blood transfusion. AABB technical manual, 2005, p. 577–600.
3. Ho, J., Sibbald,W. J., Chin-Yee, I. H. Effects of storage of red cell transfusion: when is it not safe? Crit. Care Med., 2003, 31, p. 687–697.
4. Uvízl, R. et al. Vliv stáří transfuzních jednotek erytrocytárních koncentrátů na koncentrace vybraných biochemických veličin. Anest. intenziv. Med., 2009, 5, p. 257–261.
5. Aboudara, et al. Hyperkalemia after packed red blood cell transfusion in trauma patients. J. Trauma, 2008, 64, p. 86–91.
6. Smith, H. et al. Cardiac Arrests Associated with Hyperkalemia During Red Blood Cell Transfusion: A Case Series. Anesth. Analg., 2008, 106, p. 1062–1069.
7. Hillyer, C. D., Hillyer, K. L., Strobl, F. J., Jefferies, L. C., Silberstein, L. E. Handbook of transfusion medicine. Academic Press, 2001, p. 275–282.
8. Larson, P. J. Other noninfectious coplications of transfusion. In Hillyer, C. D., Hyllier, K. L., Strobl, F. J., Jefferies, L. C., Silberstein, L. E. Handbook of transfusion medicine. Academic Press, 2001, p. 263–271.
9. Vítovec, J, Špinar J. Intenzivní péče v kardiologii. IPVZ: Brno, 1994, p. 12–14.
10. Zima, T. et al. Laboratorní diagnostika. Praha: Galén 2002, p. 276–278.
11. Hess, J. R., Sparrow, R. L., Van der Meer, P. F., Acker, J. P., Cardigan, R. A., Devine, D. V. Red blood cell hemolysis during blood bank storage: using national quality management data to answer basic scientific questions. Transfusion, 2009, 49, p. 2599–2603.
12. Luten, M., Roerdinkholder-Stoelwinder, B., Schaap, N. P., de Grip, W. J., Bos, H. J. Survival of red blood cells after transfusion: a comparison between red cells concentrates of different storage periods. Transfusion, 2008, 48, p. 1478–1485.
13. Walsh, T. S., McArdle, F., McLellan, S. A., Maciver, C., Maginnis, M., Prescott, R. J., McClelland, D. B. Does the storage time of transfused red blood cells influence regional or global indexes of tissue oxygenation in anemic critically ll patients? Crit. Care Med., 2004, 32, p. 364–371.
14. Lelubre, C., Piagnerelli, M., Vincent, J. L. Association between duration of storage of transfused red blood cells and morbidity and mortality in adult patients: myth or reality? Transfusion, 2009, 49, p. 1384–1394.
15. Yap, Koch et al. Clinical impact of blood storage lesions - Recent Reports. Ann. Thorac. Surg., 2008, 86, p. 554–559, 358, 1229–1239.
16. Weinberg, J. A., McGwin, G. Jr., Marques, M. B., Cherry, S. A. 3rd., Reiff, D. A., Kerby, J. D., Rue, L. W. 3rd. Transfusions in the less severely injured: does age of transfused blood affect outcomes? J. Trauma, 2008, 65, p. 794–798.
17. Eikelboom, J. W., Cook, R. J., Liu, Y., Heddle, N. M., Am Heart, J. Duration of red cell storage before transfusion and in-hospital mortality, 2010, 159, p. 737–743.
18. Basran, S., Frumento, R. J., Cohen, A., Lee, S., Du, Y., Nishanian, E., Kaplan, H. S., Stafford-Smith, M., Bennett - -Guerrero, E. The association between duration of storage of transfused red blood cells and morbidity and mortality after reoperative cardiac surgery. Anesth. Analg., 2006, 103, p. 15–20.
19. Koch, C. G., Li, L., Sessler, D. I., Figueroa, P., Hoeltge, G. A., Mihaljevic, T., Blackstone, E. H. Duration of red-cell storage and complications after cardiac surgery. N. Engl. J. Med., 2008, 20, p. 1229–1239.
20. Leal-Noval, S. R., Munoz-Gomez, M., Arellano-Orden, V., Marin-Caballos, A., Amaya-Villar, R., Marin, A., Puppo - -Moreno, A., Ferrandiz-Millon, C., Flores-Cordero, J. M., Murillo-Cabezas, F. Impact of age of transfused blood on cerebral oxygenation in male patients with severe traumatic brain injury. Crit. Care Med., 2008, 36, p. 1290–1296.
21. Weiskopf, R. B., Feiner, J., Hopf, H., Lieberman, J., Finlay, H. E., Quah, C., Kramer, J. H., Bostrom, A., Toy, P. Fresh blood and aged stored blood are equally efficacious in immediately reversing anemia-induced brain oxygenation deficits in humans. Anesthesiology, 2006, 104, p. 911–920.
22. Hess, J. R., Rugg, N., Knapp, A. D., Gormas, J. F., Silberstein, E. B., Greenwalt, T. J. Su1ccessful storage of RBCs for 10 weeks in a new additive solution. Transfusion, 2000, 40, p. 1012–1016.
23. Cid, J., Ramiro, L., Bertran, S., Martinez, N., Claparols, M., Maymo, R. M., Puig, L., Pla, R. P. Efficacy in reducing potassium load in irradiated red cell bags with a potassium adsorption filter. Transfusion, 2008, 48, p. 1966–1970.
24. Rose, B. D., Post, T. W. Clinical Physiology of Acid-Base and Electrolyte Disorders. 5th ed, McGraw-Hill: New York, 2001, p. 383–396, 898–910.
25. Friedman, D. F. Hepatitis. In: Hillyer, C. D., Hillyer, K. L., Strobl, F. J., Jefferies, L. C., Silberstein, L. E. Handbook of transfusion medicine, Academic Press 2001, p. 275–282.
26. Kiraly, L. N., Underwood, S., Differding, J. A., Schreiber, M. A. Transfusion of aged packed red blood cells results in decreased tissue oxygenation in critically injured trauma patients. J. Trauma, 2009, 67, p. 29–32.
27. Kaplan, H. S. et al. The medical event reporting system for transfusion medicine: Will it help to get the right blood to the right patient? Transfusion Medicine Reviews, 2002, 16, p. 86–102.
28. Zallen, G., Offner, P. J., Moore, E. E., Blackwell, J., Ciesla, D. J., Gabriel, J., Denny, C., Silliman, C. C. Age of transfused blood is an independent risk factor for postinjury multiple organ failure. Am. J. Surg., 1999, 178, p. 570–572.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2011 Issue 1-
All articles in this issue
- Anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie
- Vliv podání transfuzních jednotek erytrocytárních koncentrátů na koncentrace elektrolytů a acidobazickou rovnováhu in vivo
- Klasifikace a diagnostika renálního poškození – stále nedokonalá?
- Nové biomarkery v diagnostice poruch renálních funkcí
- Odkud byl ovlivňován vývoj oboru anesteziologie a resuscitace v poválečném Československu?
- Vývoj oboru anesteziologie a resuscitace na lékařských fakultách v Praze
- Czech Society of Anaesthesiology and Intensive Care Medicine
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klasifikace a diagnostika renálního poškození – stále nedokonalá?
- Vliv podání transfuzních jednotek erytrocytárních koncentrátů na koncentrace elektrolytů a acidobazickou rovnováhu in vivo
- Vývoj oboru anesteziologie a resuscitace na lékařských fakultách v Praze
- Nové biomarkery v diagnostice poruch renálních funkcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

