-
Medical journals
- Career
Klasifikace a diagnostika renálního poškození – stále nedokonalá?
: Gerlichová Monika 1; Živný Pavel 2; Matějovič Martin 3; Černý Vladimír 1
: Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, LF v Hradci Králové a Fakultní nemocnice Hradec Králové 1; Ústav klinické biochemie a diagnostiky, Univerzita Karlova v Praze, LF v Hradci Králové a Fakultní nemocnice Hradec Králové 2; I. interní klinika – JIP, Univerzita Karlova v Praze, LF v Plzni, Fakultní nemocnice Plzeň 3
: Anest. intenziv. Med., 22, 2011, č. 1, s. 19-22
: Intensive Care Medicine - Review Article
Navzdory podrobným znalostem příčin a patofyziologie renálního poškození zůstává stále řada nejasností v oblasti prevence, léčby a především časné diagnostiky tohoto onemocnění. Řada studií přinesla důkazy o zásadním vlivu i malého zvýšení sérového kreatininu na průběh onemocnění a prognózu různých populací pacientů, tím zdůraznila nutnost hledání nových preventivních a terapeutických opatření, která by negativnímu dopadu renální dysfunkce na organismus zabránila. Předpokladem jejich použití je včasná diagnostika akutního renálního poškození, výzkumné aktivity se proto nyní zaměřují na detekci časných markerů v plazmě a moči, které by detekovaly poškození během hodin. Do ověření jejich spolehlivosti zůstává zlatým standardem v diagnostice sledování diurézy, hodnot sérového kreatininu, eventuálně výpočet glomerulární filtrace, v odlišení prerenálního poškození a akutní tubulární nekrózy nabývá na významu vyšetření močového sedimentu. Nové klasifikace RIFLE a AKIN upřesnily definici akutního renálního poškození, sjednotily klasifikaci, a umožnily tak lepší srovnávání výsledků studií.
Klíčová slova:
akutní renální poškození (AKI) – sérový kreatinin – glomerulární filtrace (GF) – klasifikace RIFLE a AKIN – časné markery renální dysfunkceÚvod
Hodnocení renálních funkcí není jen záležitostí nefrologů, setkávají se s ním lékaři řady dalších medicínských oborů. Problém udržení homeostázy organismu a změna farmakokinetiky léčiv nabývá na významu především při akutním poklesu renálních funkcí, které je doménou intenzivní péče. Navzdory podrobným znalostem příčin a patofyziologie renálního poškození zůstává stále řada nezodpovězených otázek v oblasti prevence, léčby a především včasné diagnostiky tohoto onemocnění. Není náhoda, že doporučené postupy v intenzivní medicíně zahrnují téměř všechny orgánové dysfunkce s výjimkou ledvin.
Literatura zabývající se akutním renálním poškozením (acute kidney injury, AKI) obsahuje především informace o eliminačních technikách, které v posledních desetiletích zaznamenaly prudký vývoj. Možnost relativně dokonalé náhrady renálních funkcí může vyvolávat dojem, že tato orgánová dysfunkce je snadno zvládnutelnou komplikací.
Rozsáhlá multicentrická studie u 17 126 kriticky nemocných dokumentovala 4krát vyšší riziko úmrtí u pacientů, jejichž základní onemocnění je komplikováno rozvojem AKI vyžadujícím užití eliminačních technik, ve srovnání s pacienty se stejnou závažností onemocnění, ale bez AKI [1]. Rozvoj AKI není tedy jen marker závažnosti onemocnění, ale řadou mechanismů zásadně ovlivňuje průběh onemocnění a prognózu. Mezi tyto mechanismy patří metabolické faktory, ztráta antioxidační kapacity organismu, zhoršení imunokompetence a indukce prozánětlivé odpovědi vedoucí k poškození vzdálených orgánů [2]. Několik experimentálních i klinických studií provedených u různých populací pacientů přineslo důkazy o tom, že nejen rozvoj AKI, ale i malý vzestup sérového kreatininu má zásadní vliv na průběh onemocnění a tedy i prognózu nemocných. Studie provedené v kardiochirurgii, všeobecné chirurgii, u nemocných s infarktem myokardu nebo kontrastem-indukovanou nefropatií prokázaly souvislost mezi zvýšením kreatininu a mortalitou. [3, 4, 5, 6].
Přestože se použití eliminačních technik stalo nedílnou součástí postupů orgánové podpory, nepřineslo očekávané snížení mortality nemocných s AKI. Nyní se pozornost zaměřuje na aplikaci farmakologických postupů v oblasti prevence a léčby, jednou z hlavních překážek výzkumu v této oblasti je však nedokonalá a opožděná diagnostika renálního poškození.
Další překážkou ve srovnání výsledků studií, ale i sledování výskytu AKI, mortality a morbidity těchto pacientů, byla nejednotná klasifikace renálních funkcí.
Definice a klasifikace akutního a chronického poškození ledvin
Skupina ADQI (Acute Dialysis Quality Initiative group) vyvinula snahu o dosažení standardizace definice a klasifikace v oblasti akutní renální dysfunkce, v roce 2002 navrhla nový systém, který má v názvu akronym RIFLE (R – risk, I – injury, F – failure, L – loss a E – end stage) [7].
Na základě klinických a laboratorních kritérií (změn sérového kreatininu nebo diurézy) rozlišuje tři kategorie závažnosti (Risk, Injury a Failure) a dvě kategorie klinického výsledku (Loss a End-stage kidney disease). Tato kritéria byla později modifikována expertní skupinou s názvem Acute Kidney Injury Network (AKIN) složenou z představitelů mezinárodních nefrologických a intenzivistických společností. AKIN klasifikace (tab. 1.) upravuje systém RIFLE v souladu s klasifikací chronického poškození ledvin (chronic kidney disease, CKD) [8]. RIFLE i AKIN využívají velikost změny sérového kreatininu (Skr) oproti výchozím hodnotám, a tím umožňují zařazení pacientů s již existujícím chronickým onemocněním ledvin. Kromě toho mají i prognostický význam, s pokročilejším klasifikačním stadiem narůstá i mortalita a zhoršuje se klinický výsledek.
Klasifikace AKIN umožnila definovat akutní renální poškození jako náhlý pokles renálních funkcí (během 48 hod) spojený se vzestupem sérového kreatininu o více než 26 μmol/l nebo 1,5násobným vzestupem oproti výchozí hodnotě či snížením diurézy pod 0,5 ml/kg/hod. po dobu více než 6 hodin.
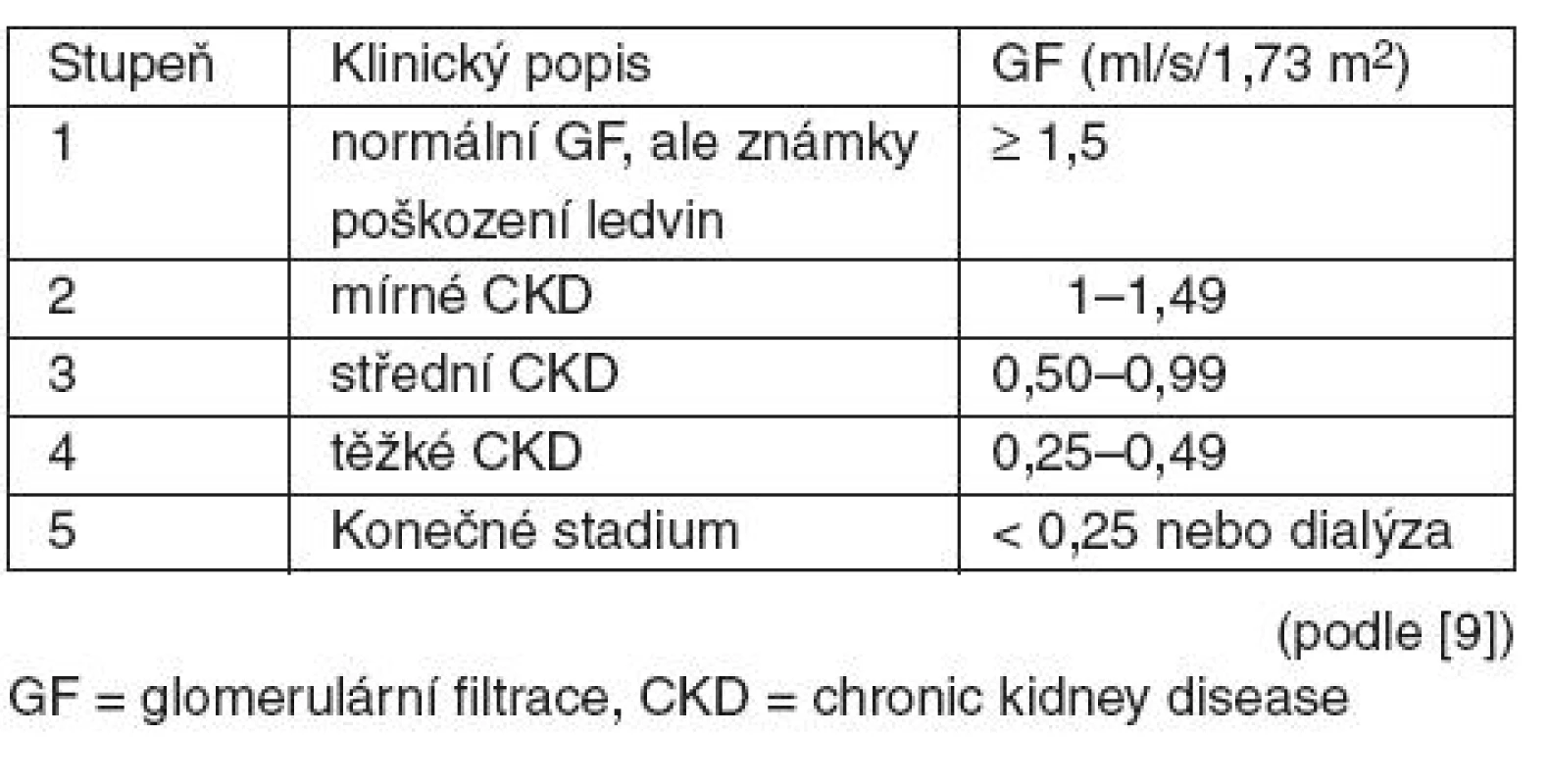
Jakékoliv strukturální nebo funkční poškození ledvin nebo pokles glomerulární filtrace (GF) pod 1 ml/s/1,73 m2 trvající déle než 3 měsíce jsou hodnoceny jako chronické poškození ledvin (chronic kidney disease, CKD) [9]. Tato diagnóza představuje celosvětový problém s narůstající incidencí a prevalencí. Mezi hlavní komplikace patří renální selhání a onemocnění kardiovaskulárního aparátu, jejichž rozvoj lze oddálit rozpoznáním časných stadií onemocnění a adekvátní léčbou. Nejednotná definice a klasifikace CKD spolu s chyběním jednoduchých laboratorních testů bránila včasné diagnóze a zahájení adekvátní léčby, proto skupina K/DOQI (Kidney Disease Outcomes Quality Initiative) spadající pod NKF (National Kidney Foundation) v roce 2002 publikovala 15 klinických doporučení pro CKD. Jejich cílem bylo definovat a klasifikovat CKD bez ohledu na vyvolávající příčinu (tab. 2), stratifikovat riziko komplikací a sumarizovat hlavní doporučení pro včasnou detekci a léčbu.
Diagnostika renálního poškození
V současné klinické praxi jsou možnosti diagnostiky AKI omezené. Sledování diurézy a dynamiky sérového kreatininu zůstává i přes řadu nevýhod zlatým standardem.
Hodnota sérového kreatininu samotná je nepřesně prediktivní, je ovlivněna věkem, pohlavím, svalovým metabolismem, stavem hydratace, příjmem bílkovin a odráží stav renálních funkcí až po dosažení ustáleného stavu, tedy s 2–3denním zpožděním [10].
Stanovení kreatininu se provádí nejčastěji tzv. Jaffého reakcí, při níž vzniká komplex kyseliny pikrové nejen s kreatininem, ale také s jinými Jaffé pozitivními chromogeny (glukózou, kyselinou močovou, léky zvyšujícími sérový kreatinin a dalšími látkami), např. u nemocných s dekompenzací diabetu nebo během léčby cefalosporiny může nepřesnost ve stanovení sérového kreatininu vést až k mylné diagnóze.
Enzymové stanovení kreatininu eliminuje většinu těchto interferencí, což nabývá na významu právě u nemocných v intenzivní péči. Širšímu použití těchto metod brání jejich vysoká cena.
Významné je užití hodnot Skr pro stanovení glomerulární filtrace. Závislost mezi GF a Skr je hyperbolická, nikoliv lineární, proto úvodní pokles GF je spojen pouze s malým vzestupem Skr a i významný pokles GF tak může uniknout rozpoznání. Naopak vzestup Skr nad horní hranici normy u jedinců s normální GF je málo častý.
Vyšetření GF je základní funkční vyšetření ledvin charakterizující schopnost udržet stálé složení vnitřního prostředí, snížení GF slouží jako klasifikační marker stupně závažnosti poškození ledvin. V akutních stavech postačí znalost trendu GF, není nutná přesná hodnota. Použití metod se sběrem moči (clearance endogenního kreatininu a inulinu) se v intenzivní péči příliš nevyužívá, nevýhodou je především nutnost přesného sběru moči. Endogenní kreatinin navíc není vylučován jen glomerulární filtrací, ale i tubulární sekrecí, jejíž podíl na vylučování kreatininu je za fyziologických okolností 10–20%, zatímco při poklesu glomerulární filtrace se relativně zvyšuje, kreatininová clearance pak může přesahovat GF až o 100 %.
V současnosti se častěji používá odhad hodnoty GF pomocí výpočtových metod bez sběru moči. Rovnice podle Cockcroft-Gaulta je již považována za obsolentní, celosvětově je doporučována rovnice, která vznikla na podkladě velké multicentrické studie o vztahu příjmu bílkovin a progrese chronického renálního onemocnění [11]. Tato MDRD rovnice (Modification of Diet in Renal Disease) původně pracovala s několika proměnnými (věk, pohlaví, rasová příslušnost a sérové hladiny kreatininu, urey a albuminu) (tab. 3), nyní je používána její zjednodušená čtyřparametrická podoba, která eliminuje hodnotu urey a albuminu (tab. 4). Tento vzorec pro výpočet GF je doporučován i Českou nefrologickou společností a Českou společností klinické biochemie ČLS JEP s omezením pro děti a těhotné [12].
K metodám umožňujícím hodnocení GF bez sběru moči patří také vyšetření cystatinu C v séru a radionuklidové metody. Hladina cystatinu C v séru stoupá při malém poklesu GF dříve než kreatinin, není ovlivněna věkem, pohlavím, složením stravy a množstvím svalové hmoty. K výpočtu GF jej nelze použít pouze při podávání kortikoidů, onemocnění štítné žlázy, systémovém zánětu a při diagnóze kolorektálního karcinomu. Radionuklidové metody nejsou vhodné pro sledování vývoje renálních funkcí nemocných v intenzivní péči.
K vyšetření tubulárních funkcí, rozlišení akutní tubulární nekrózy (ATN) a prerenální azotémie, je možné využít biochemické vyšetření moči, nicméně s limitovanou výpovědní hodnotou. Nejcitlivější metodou je frakční exkrece natria (FE Na), která ovšem selhává při podání diuretik, řada prací dokumentuje v těchto případech vyšší přesnost frakční exkrece urey a kyseliny močové [13, 14, 15].
V diferenciální diagnostice AKI lze využít i mikroskopické vyšetření močového sedimentu. Studie provedené v posledních letech vykazují vysokou senzitivitu a specificitu tohoto vyšetření v odlišení ATN od prerenálního AKI. Na základě charakteristického nálezu v močovém sedimentu (přítomnost tubulárních epiteliálních buněk a granulovaných válců) byl vytvořen i skórovací systém pro ATN [16], který bude třeba ověřit ještě v dalších studiích.
Uvedené metody detekují renální poškození s odstupem desítek hodin až dnů od působení inzultu, do centra pozornosti se proto dostávají biomarkery umožňující včasnou diagnózu a zahájení terapie. V posledních letech bylo objeveno několik slibných markerů detekovatelných v plazmě nebo moči, nicméně stále neexistuje jistota, zda budou mít dostatečnou přesnost pro časnou detekci AKI různé etiologie, např. nefrotoxické poškození, AKI v sepsi, AKI po transplantaci ledvin. Mezi nejvíce nadějné patří neutrophil gelatinase-associated lipocalin (NGAL), N-acetyl-β-D-glukosaminidáza (NAG), kidney injury molekule-1 (KIM 1), interleukin 18 (IL-18) a cystatin C [10, 17, 18].
Dosud publikované studie s těmito markery mají řadu omezení, především jsou monocentrické, zahrnují relativně malý počet pacientů a eliminují nemocné s chronickým renálním selháním. Studie jsou nejčastěji prováděny u nemocných po kardiochirurgickém výkonu s mimotělním oběhem jako modelem ischemicko-reperfuzní zátěže a nemocných po zátěži kontrastní látkou při angiografickém vyšetření jako modelem nefrotoxického poškození.
Závěr
Sledování hodnot sérového kreatininu nebo výpočet GF jsou vhodné pro déletrvající poruchy renálních funkcí, v akutních stavech však poskytují informace pozdní, navíc jsou ovlivněny řadou non-renálních faktorů. Nadějí jsou v tomto směru tzv. časné markery renálního poškození (NGAL, NAG, KIM 1, IL-18 a cystatin C), pomocí kterých bychom detekovali poruchy renálních funkcí během hodin. K ověření jejich spolehlivosti a přesnosti nebyly zatím provedeny dostatečně rozsáhlé, multicentrické studie.
Práce vznikla za podpory Výzkumného záměru MZO 00179906 a Výzkumného záměru Univerzity Karlovy v Praze MSM 0021620819: Náhrada a podpora funkce některých životně důležitých orgánů.
Došlo dne 15. 3. 2010.
Přijato dne 8. 11. 2010.Adresa pro korespondenci:
MUDr. Monika Gerlichová
Rybova 1896/19
50009 Hradec Králové
e-mail: monika.gerlichova@centrum.cz
Sources
1. Metnitz, P. G., Krenn, C. G., Steltzer, H. et al. Effect of acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit. Care. Med., 2002, 30, 9, p. 2051–2058.
2. Druml, W. Acute renal failure is not a „cute“ renal failure! Intensive Care Med., 2004, 30, p.1886–1890.
3. Antunes, P. E., Prieto, D., Ferrao de Oliveira, J., Antunes, M. J. Renal dysfunction after myocardial revascularization. Eur. J. Cardiothorac. Surg., 2004, 25, 4, p. 597–604.
4. O`Brien, M. M., Gonzales, R., Shroyer, A. L. et al. Modest serum creatinine elevation affects adverse outcome after general surgery. Kidney Int., 2002, 62, 2, p. 585–592.
5. Fácila, L., Nunez, J., Bodí, V. et al. Prognostic value of serum creatinine in non-ST-elevation acute coronary syndrome. Rev. Esp. Cardiol., 2006, 59, 3, p. 209–216.
6. Kini, A. S., Sarkar, K., Rafael, O. C. et al. Serum creatinine ratio: a novel predictor of mortality after percutaneous coronary intervention in patient with normal and abnormal renal function. Catheter Cardiovascular Interv., 2009, 74, 1, p. 49–55.
7. Bellomo, R., Ronco, C., Kellum, J. A. et al. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit. Care, 2004, 8. Dostupný na www: http://ccforum.com/content/8/4/R204.
8. Mehta, R. L., Kellum, J. A., Shah, S. V. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit. Care, 2007, 11. Dostupný na www: http://ccforum.com/content/11/2/R31.
9. Kidney Disease Outcome Quality Initiative. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am. J. Kidney Dis., 2002, 39, p.1–246.
10. Coca, S. G., Yalavarthy, R., Concato, J., Parikh, C. R. Biomarkers for the diagnosis and risk stratification of acute kidney injury: A systemic review. Kidney Int., 2008, 73, p. 1008–1016.
11. Klahr, S. The Modification of Diet in Renal Disease study. N. Engl. J. Med., 1989, 320, p. 864–866.
12. Zíma, T., Teplan, V., Tesař., V. et al. Doporučení České nefrologické společnosti a České společnosti klinické biochemie ČLS JEP k vyšetřování glomerulární filtrace. Aktuality v nefrologii, 2009, 3, p. 129–139.
13. Carvounis, C. P., Nisar, S., Guro-Razuman, S. Significance of the fractional excretions of urea in the differential diagnosis of acute renal failure. Kidney Int., 2002, 62, 6, p. 2223–2229.
14. Fahimi, D., Mohajeri, S., Hajizadeh, N. et al. Comparison between fractional excretions of urea and sodium in children with acute kidney injury. Pediatr. Nephrol., 2009, 24, 12, p. 2409–2412.
15. Steinhauslin, F., Burnier, M., Magnin, J. L. et al. Fractional excretion of trace lithium and uric acid in acute renal failure. J. Am. Soc. Nephrol., 1994, 4, 7, p. 1429–1437.
16. Perazella, M. A., Coca, S. G., Kanbay M. et al. Diagnostic Value of Urine Microscopy for Differential Diagnosis of Acute Kidney Injury in Hospitalized Patients. Clin. J. Am. Soc. Nephrol., 2008, 3, 6, p. 1615–1619.
17. Waikar, S. S., Bonventre J. V. Biomarkers for the diagnosis of acute kidney injury. Current Opinion in Nephrology and Hypertension, 2007, 16, p. 557–564.
18. Nguyen, M. T., Devarajan, P. Biomarkers for the early detection of acute kidney injury. Pediatr. Nephrol., 2008, 23, p. 2151–2157.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2011 Issue 1-
All articles in this issue
- The Czech Anaesthesia Day 2010 – a national prospective observational one-day prevalence study of the current anaesthesia practice in the Czech Republic
- The administration of packed red blood cells and its influence on electrolyte and acid-base balance disturbances in vivo
- Classification and diagnosis of kidney injury – are they still imperfect?
- New biomarkers in the diagnosis of renal dysfunction
- What influenced the evolution of the specialty of anaesthesia and intensive care in postwar Czechoslovakia?
- Evolution of Anaesthesiology and Resuscitation at Prague’s Medical Faculties
- Czech Society of Anaesthesiology and Intensive Care Medicine
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Classification and diagnosis of kidney injury – are they still imperfect?
- The administration of packed red blood cells and its influence on electrolyte and acid-base balance disturbances in vivo
- Evolution of Anaesthesiology and Resuscitation at Prague’s Medical Faculties
- New biomarkers in the diagnosis of renal dysfunction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career