-
Medical journals
- Career
Plazmafiltrace spojená s adsorpcí v experimentálním septickém šoku – překlad originálního článku*
Authors: Sýkora Roman 1,2; Chvojka Jiří 1,2; Kroužecký Aleš 1,2; Raděj Jaroslav 1,2; Kuncová Jitka 3; Varnerová Veronika 2; Karvunidis Thomas 1,2; Novák Ivan 1,2; Matějovič Martin 1,2
Authors‘ workplace: Jednotka intenzivní péče, I. interní klinka, Fakultní nemocnice Plzeň 1; Lékařská fakulta v Plzni, Univerzita Karlova v Praze 2; Ústav fyziologie, Lékařská fakulta v Plzni, Univerzita Karlova v Praze 3
Published in: Anest. intenziv. Med., 21, 2010, č. 2, s. 95-103
Category: Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Plazmafiltrace spojená s adsorpcí (CPFA) je hemoeliminační metoda založená na adsorpci a vyvinutá k neselektivnímu odstraňování mediátorů sepse. Cílem studie je zhodnotit účinnost této hemopurifikační metody v průběhu septického šoku na celkovou a regionální hemodynamiku, mikrocirkulaci, energetický metabolismus, oxidativní/nitrosativní stres, endoteliální a koagulační dysfunkci.Typ studie:
Kontrolovaná randomizovaná experimentální studie.Materiál a metody:
U 16 selat jsme v celkové anestezii a na umělé plicní ventilaci indukovali peritonitidu, která postupně za tekutinové resuscitace progredovala do hyperdynamického septického šoku. Noradrenalin jsme použili v případě, že objemová resuscitace nestačila k udržení MAP nad 65 mm Hg. Po 12 hodinách peritonitidy jsme zvířata rozdělili do dvou skupin – pouze s podpůrnou léčbou (Control, n = 8), nebo byla navíc napojena na CPFA (CPFA, n = 8).Výsledky:
Před zahájením peritonitidy, ve 12., 18. a 22. hodině jsme měřili systémovou hemodynamiku, regionální hemodynamiku hepatosplanchniku a ledvin, systémový a regionální metabolismus kyslíku a energetický metabolismus (laktát/pyruvát, poměr ketolátek v jaterní žilní krvi), mikrocirkulaci sliznice ilea a kůry ledviny, markery zánětu (TNF-α, IL-6), parametry nitrosativního/oxidativního stresu (reaktanty s kyselinou thiobarbiturovou, nitráty+nitrity), endoteliální a koagulační dysfunkci (asymetrický dimetylarginin, von Willebrandův faktor, komplexy trombin-antitrombinu a počet trombocytů). Léčba CPFA neoddálila rozvoj hypotenze, ani neovlivnila použitou dávku noradrenalinu. Léčba CPFA neovlivnila sepsí způsobené poškození mikrocirkulace, markery buněčné energetiky, endoteliálního poškození a systémového zánětu. Plicní a jaterní dysfunkce nebyly léčbou CPFA ovlivněny, a dokonce došlo ke zhoršení sepsí indukovaných poruch koagulace a oxidativního/nitrosativního stresu.Závěry:
V experimentálním modelu septického šoku selete nevedlo časné zahájení léčby CFPA k ovlivnění sepsí vyvolaných poruch orgánových funkcí ani ostatních biologických systémů podílejících se na patogenezi sepse. Efektivitu i účinnost CPFA je potřeba vyhodnotit v dalších klinicky relevantních experimentech.Klíčová slova:
sepse, septický šok – experimentální model – plazmafiltrace spojená s adsorpcí – mikrocirkulace – energetický metabolismus – oxidativní stres – nitrosativní stres – koagulační porucha – endoteliální dysfunkce*Studie byla publikována v originálním znění: Coupled plasma filtration adsorption in experimental peritonitis-induced septic shock. Shock, 2009 May; 31(5):473–480. Studie byla oceněna cenou Poster Award na 28th International Symposium on Intensive Care and Emergency Medicine v Bruselu 18.–21. března 2008 a cenou za nejlepší poster na II. kongresu ČSARIM, Plzeň 2008. Roman Sýkora a Jiří Chvojka přispěli ke studii stejnou měrou. Studie byla provedena v experimentální laboratoři centrálního zvěřince Lékařské fakulty v Plzni.
Úvod
Použití mimotělních hemoeliminačních metod jako podpůrné terapie v léčbě sepse je v poslední době velmi diskutovaným a dosud neuzavřeným tématem [1–3]. Nedávno byla vyvinuta eliminační metoda, plazmafiltrace spojená s adsorpcí (CPFA, coupled plasma filtration adsorption). Jedná se o adsorpční metodu hemopurifikace zaměřenou na neselektivní odstraňování cirkulujících solubilních mediátorů, které se podílejí na patogenezi sepse a septického šoku [4–7]. Tato metoda se skládá z plazmafiltru, adsorpční kapsle obsahující syntetickou makroporézní pryskyřici s vysokou adsorpční kapacitou a ze standardního hemofiltru [4]. K neselektivnímu odstraňování zánětlivých mediátorů dochází na hydrofobní makroporózní styrénové pryskyřici, která efektivně adsorbuje četné cytokiny a mediátory [8, 9], což podporují in vitro a ex vivo studie [10, 11]. Dosud však byla provedena jen jedna experimentální studie na modelu endotoxémie u králíka [12]. V této studii byla léčba CPFA zahájená před podáním endotoxinu a výsledkem bylo lepší krátkodobé přežívání (72 h) u léčené skupiny [12]. V klinické studii [11] u deseti pacientů v septickém šoku Ronco et al. ukázali, že desetihodinová léčba CPFA zlepší systémovou hemodynamiku a reaktivitu leukocytů více než hemofiltrace [11]. Formica et al. v observační klinické studii, bez kontrolní skupiny, zkoumali efekt opakované léčby CPFA na hemodynamiku u dvanácti pacientů v septickém šoku. V této studii pozorovali zvýšení středního arteriálního tlaku a vyšší než predikované přežívání nemocných [13]. U obou těchto klinických studií [11, 13] je výpovědní hodnota slibných a pozitivních výsledků limitována především velikostí souborů sledovaných pacientů a absencí randomizace. Na základě těchto výsledků jsme provedli studii hodnotící hypotézu, že neselektivní odstraňování cirkulujících solubilních mediátorů metodou CPFA působí pozitivně v průběhu sepse. Tuto hypotézu jsme testovali na zvířecím modelu (sele) hyperdynamického septického šoku s tekutinovou resuscitací a podpůrnou léčbou. Abychom co nejvíce napodobili obvyklý průběh a získali klinicky relevantní data, zahajovali jsme léčbu CPFA až během plně rozvinuté sepse.
Materiál a metody
Experimentální práce byly provedeny v souladu se závaznými doporučeními pro práci s laboratorními zvířaty a schváleny etickou komisí Lékařské Fakulty UK v Plzni.
Anestezie a instrumentace experimentálních zvířat
V experimentech jsme použili 16 selat obou pohlaví vážících 34 kg [32, 38]. Jako premedikaci jsme intramuskulárně podali atropin (1 mg), ketamin (50 mg) a azaperon titrovaný podle klinického efektu. Na úvod do anestezie byl podán intravenózně atropin (0,5 mg), propofol 2% (1–2 mg . kg-1), ketamin (2 mg . kg-1) a pancuronium (4 mg). Po intubaci byla selata napojena na umělou plicní ventilaci (FiO2 0,4; PEEP 5–10 cm H2O; dechový objem 10 ml . kg-1; dechová frekvence byla nastavena tak, aby se cílový arteriální pCO2 pohyboval mezi 4,0 a 5,0 kPa). Během chirurgické instrumentace byla celková anestezie vedena kontinuálním intravenózním podáváním thiopentalu (10 mg . kg-1 . h-1) a fentanylu (10–15 µg . kg-1 . h-1). Po dokončení operace byly sníženy dávky thiopentalu (5 mg . kg-1 . h-1) i fentanylu (5 µg . kg-1 . h-1) a touto rychlostí byly podávány do konce experimentu. Svalová relaxace byla zajištěna kontinuálním intravenózním podáváním pancuronia (0,2 mg . kg-1 . h-1) po celou dobu experimentu. Infuzní roztok PlasmaLyte byl podáván v průběhu chirurgické instrumentace rychlostí 15 ml . kg-1 . h-1, poté byla snížená dávka na 7 ml . kg-1 . h-1. Hladina glykémie v arteriální krvi byla udržována mezi 4,5–7 mmol . l-1 infuzí 20% glukózy v průběhu celého experimentu.
Do levé jugulární žíly byl zaveden trojcestný centrální žilní katétr k podávání farmak a infuzí. Cestou pravé jugulární žíly byl zaveden plicnicový katétr. Do levé femorální tepny jsme zavedli katétr, který sloužil k invazivnímu monitorování krevního tlaku, sběru vzorků a zavádění fibrooptického katétru k měření nitrohrudního objemu krve (ITBV, intrathoracic blood volume) a extravaskulární plicní tekutiny (EVLW, extravascular lung water). Do pravé femorální žíly byla zavedena dialyzační kanyla, přes kterou byla selata napojována na CPFA. Po provedení horní střední laparotomie jsme na portální žílu, společnou jaterní tepnu a renální tepnu vlevo upevnili ultrazvukové průtokové sondy (Transonic Systems, Ithaca, New York). Poté jsme do portální a renální žíly vlevo zavedli katétry ke sběru vzorků. Do jaterní žíly jsme zavedli katétr až po ukončení instrumentace pod ultrazvukovou kontrolou. Přímo na povrch ledviny, skrze incizi v renální kapsuli, jsme umístili laser Doppler sondu (PF 404, Suturable angled probe, Perimed, Jarfalla, Švédsko) sloužící k monitorování mikrocirkulace. Následovalo vyšití dvouhlavňové ileostomie, kterou jsme použili k monitorování střevní mikrocirkulace, a to laser Doppler sondou (PF 409, Straight endoscopic probe, Perimed, Jarfalla, Švédsko) a intravitalní videomikroskopií (Microscan, MicroVision Medical, Amsterdam, Holandsko). Ileostomie byla mezi měřeními přikryta sterilní gázou navlhčenou fyziologickým roztokem a zakryta stomickým sáčkem. Na konci operace jsme umístili skrze břišní stěnu dva trubicové drény k derivaci ascitu a k indukci peritonitidy. Perkutánně jsme zavedli cystostomický katétr pod ultrazvukovou kontrolou a měřili výdej moči. Po uzavření laparotomie následovalo 6 hodin pooperační stabilizace. Současně s úvodem do anestezie bylo 0,5 g . kg-1 autologní stolice selete rozpuštěno ve 200 ml fyziologického roztoku a kultivováno ve vodní lázni při 37 °C. Tento roztok byl použit následně k indukci peritonitidy.
Měření systémové a regionální hemodynamiky, mikrocirkulace a výpočty
Z parametrů systémové hemodynamiky byly měřeny tyto parametry: srdeční výdej, systémová vaskulární rezistence, ITBV a plnicí tlaky obou komor. Na úrovní regionální hemodynamiky hepatosplanchniku byly monitorovány průtoky krve portální žilou, společnou jaterní tepnou a levou renální tepnou. Odebírali jsme vzorky arteriální, portální, jaterní a renální žilní krve k analýze pH, pO2, pCO2 a saturaci hemoglobinu kyslíkem. Následně jsme podle obvyklých vzorců vypočítávali systémovou a především regionální dodávku kyslíku, spotřebu kyslíku jater a ledviny [14–16].
Mikrovaskulární perfuze sliznice ilea a kůry ledviny byla hodnocena za použití laser dopplerometrické metody (LDF) hodnocením perfuzních jednotek při adekvátním zpětně odráženém signálu (back scattered light) [14–16]. Současně jsme využili techniku intravitální videomikroskopie (SDF, Side-stream Dark imaging) k přímému zobrazení mikrocirkulace sliznice ilea. Během každého měření jsme natočili ze tří různých míst sliznice ilea dvacetivteřinovou videosekvenci. Za pomoci softwaru vyvinutého k hodnocení těchto sekvencí: Microscan Analyzing Software (MicroVision Medical, Amsterdam, The Netherlands) jsme určovali microvascular flow index (MFI) a flow heterogeneity index (FHI) [17, 18]. MFI je založen na hodnocení jednotlivých charakterů průtoku v kapilárách a cévách do 20 mikrometrů průměru v každém ze 4 kvadrantů videosekvence (žádný průtok = 0, intermitentní = 1, zpomalený = 2, kontinuální = 3). Průměr hodnot z jednotlivých kvadrantů je MFI, v naší studii jako výsledek uvádíme průměrný MFI ze tří náhodně vybraných lokalit sliznice ilea. FHI ukazuje spíše než na charakter průtoku na prostorovou heterogenitu perfuze. Výpočet FHI provádíme jako rozdíl mezi nevyšší a nejnižší hodnotou MFI dělenou průměrným MFI [17].
Odběr a hodnocení vzorků krve, plazmy a tkání
Z arteriální, portální, jaterní a renální žilní krve jsme stanovili koncentrace laktátu (L) a pyruvátu (P), dále byly stanoveny atreriální sérová hladina alanin aminotransferázy (ALT) a poměru ketolátek z jaterní žilní krve (KBR, acetoacetát/β-hydroxybutyrát) [14–16]. K posouzení oxidativního a nitrosativního stresu jsme použili meření arteriálních reaktantů s kyselinou thiobarbiturovou (TBARS, thiobarbituric acid reactive species) a koncentraci arteriálních nitrátů a nitritů [14–16]. Z arteriální krve jsme stanovili také aktivitu von Willebrandova faktoru (vWF), koncentraci komplexů trombinu-antitrombinu (TAT), počet krevních destiček, koncentraci asymetrického dimetylargininu (ADMA), tumor necrosis faktoru alfa (TNF-α) interleukinu 6 (IL-6) a arteriální hladiny neuropeptidu Y (NPY) a vazoaktivního intestinalního peptidu (VIP). Všechny vzorky jsme hodnotili dvojmo a abychom odstranili efekt hemodiluce při objemové resuscitaci, korigovali jsme následující hodnoty na celkovou bílkovinu: NOx, TBARS, AMDA, ALT, vWF, TAT, NPY a VIP [14–16].
Protokol studie
První měření a sběry vzorků byly provedeny po 6hodinovém zotavení z chirurgické instrumentace. Následovala indukce peritonitidy inokulací 0,5 g/kg autologní stolice rozpuštěné v 200 ml fyziologického roztoku do břišní dutiny jedním z drénů. Druhý set měření a sběru vzorků byl proveden po 12 hodinách od indukce peritonitidy. V této době byla již plně rozvinutá hyperdynamická sepse, tekutinově resuscitovaná krystaloidem i koloidem podle protokolu. Poté byla zvířata rozdělena do kontrolní skupiny (Control, n = 8) s podpůrnou léčbou, nebo byla navíc napojena na CPFA (CPFA, n = 8) na 10 hodin; další měření byla provedena v 18. a 22. hodině, v průběhu CPFA.
Tekutinová resuscitace
K základní udržovací infuzi roztoku Plasma Lyte jsme od šesté hodiny od indukce peritonitidy přidali infuzi 6% hydroxyetylškrobu 130 kD/0,4 rychlostí 10 ml . kg-1 . h-1 (7 ml . kg-1 . h-1 v případě, že byl CVP nebo PAOP vyšší než 18 mm Hg) tak, abychom udrželi plnicí tlaky komor vyšší než 12 mm Hg. Kontinuální infuze noradrenalinu byla zahájena, pokud se tekutinovou resuscitací nedařilo udržet střední arteriální tlak (MAP) nad 65 mm Hg. Poté, co jsme získali poslední set měření a odebrali poslední vzorky, byla zvířata utracena za hluboké celkové anestezie injekcí KCl.
Nastavení CPFA
Léčba CPFA byla prováděna na komerčně dostupném přístroji určeném k různým modalitám extrakorporální hemoeliminace (LYNDA, Bellco®, Mirandola, Itálie), za použití kitu CPFA kit (ABL 814, Bellco SpA), který obsahuje polyétersulfonový plazmafiltr (MPS 05, 0,5 m2) v sérii s vysoce propustným polyétersulfonovým hemofiltrem (HFT 14, 1,4 m2, Bellco SpA) a adsorbční kapslí obsahující styrénovou pryskyřici s makroporézní strukturou (Mediasorb, 50 000 m2/cartridge). Průtok krve byl nastaven na 150 ml . min-1, objem separované plazmy na 20 % v plazmafiltru (průtok plazmy 30 ml . min-1). Poté, co byla plazma očištěna v adsorpční kapsli společně se zbytkem krve, ještě prošla hemofiltrem, na kterém byla nastavena hemofiltrace 35 ml . kg-1 . h-1 s nulovou ultrafiltrací. K substituci byl použit bikarbonátový (35 mmol . l-1) roztok, který byl napojen postdilučním způsobem. K prevenci poklesu tělesné teploty v mimotělním okruhu byl substituční roztok ohříván na 39 °C v hemoeliminačním přístroji a současně byl zapojen na venózní linku i ohřívač HOTLINE®. K antikoagulaci všech zvířat jsme použili intravenózní bolus 0,2 ml .10 kg-1 nadroparinu před napojením na CPFA. V průběhu studie jsme neměnili ani filtry, ani adsorpční kapsle.
Použité statistické metody
Hodnoty výsledků prezentujeme jako medián a 25. a 75. percentil (interkvartilové rozpětí). Absenci normálního rozložení hodnot jsme testovali testem normality Kolmogorovova-Smirnovova. Rozdíly v čase před indukcí a po indukci peritonitidy v rámci jedné skupiny byly otestovány statistickým testem ANOVA při opakovaných měřeních (Friedman ANOVA on ranks), za následného použití post hoc Dunnova testu pro identifikaci statisticky významných rozdílů při mnohočetném porovnávání. Rozdíly mezi skupinami v měřených intervalech byly testovány za pomoci Mannova-Whitneyova U testu (rank sum test). Grafy jsou buď jednoduché bodové grafy, nebo standardní krabicové grafy zobrazující medián, interkvartilové rozpětí a rozpětí rozsahu neodlehlých hodnot (koeficient 1,5).
Výsledky
Ve vstupních hodnotách nebyly žádné statisticky významné rozdíly mezi oběma skupinami.
Systémová hemodynamika, kinetika kyslíku, metabolismus a plicní funkce
Celkové množství koloidních roztoků nutných k udržení srovnatelného srdečního preloadu se mezi skupinami nelišilo (Control 169 [148; 209], CPFA 188 [147; 211] ml . kg-1) – tabulka 1. Tekutinovou resuscitací byly udrženy ITBV i plnicí tlaky (data nejsou prezentována) bez meziskupinových rozdílů. Všechna selata rozvinula hyperdynamickou cirkulaci s narůstajícím srdečním výdejem a nízkou systémovou vaskulární rezistencí. U všech selat jsme museli použít podporu oběhu noradrenalinem. Medián času do rozvoje arteriální hypotenze, definované poklesem MAP pod 65 mm Hg, a stejně tak i dávka noradrenalinu se nelišily mezi skupinami (graf 1). U všech zvířat vedl zvýšený srdeční výdej k významnému zvýšení celkové dodávky kyslíku, zatímco celková spotřeba kyslíku se v průběhu času nezměnila. U všech zvířat jsme také pozorovali rozvoj metabolické acidózy a postupný pokles poměru PaO2/FiO2 bez meziskupinového rozdílu. Ve skupině CPFA došlo k poklesu teploty tělesného jádra na konci experimentu oproti vstupním hodnotám. Množství ascitu a EVLW bylo stejné u obou skupin (data nejsou prezentována).
Table 1. Systémová hemodynamika, kyslíkový metabolismus a acidobazická rovnováha 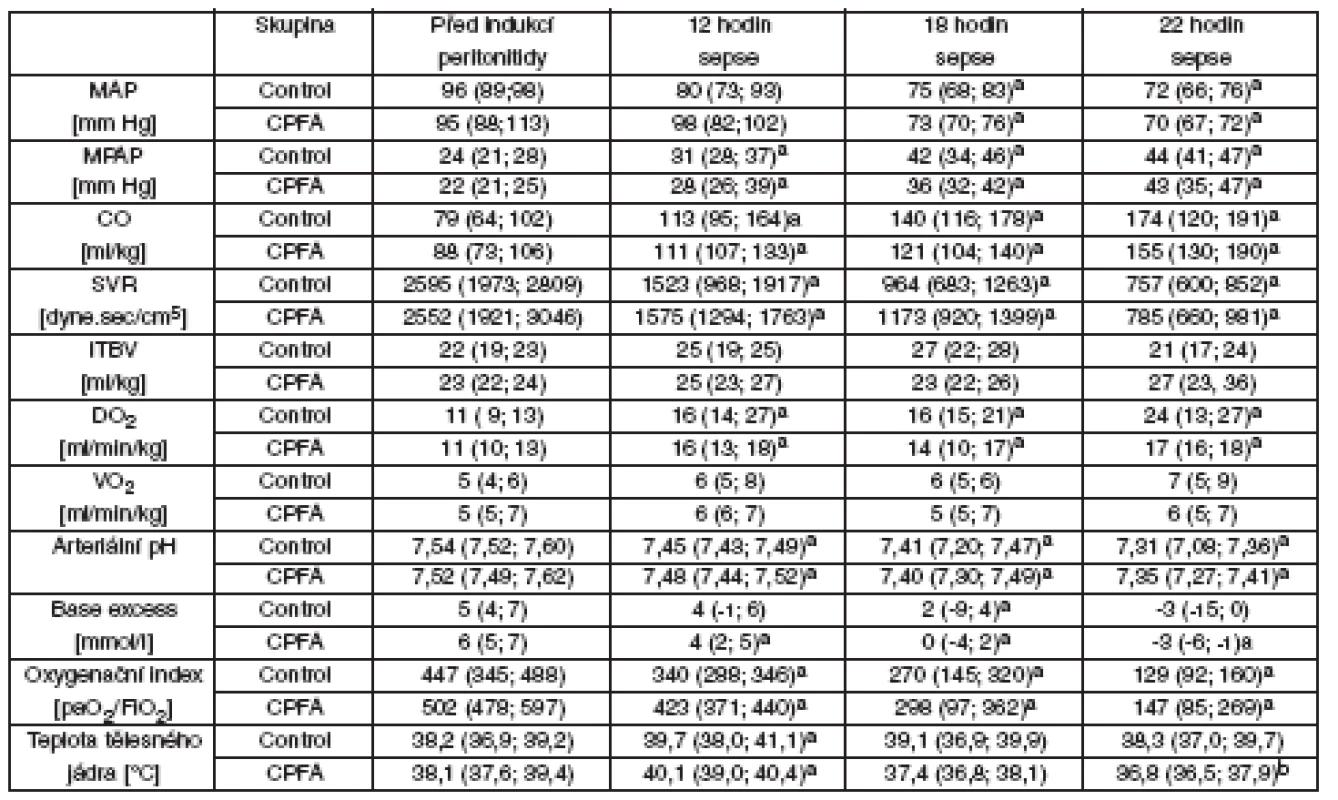
MAP – střední arterální tlak, CO – srdeční výdej, MPAP – střední tlak v plicnici, SVR – systémová cévní rezistence, ITBV – nitrohrudní objem krve, DO2 – systémová dodávka kyslíku, VO2 – systémová spotřeba kyslíku, CPFA – plazmafiltrace spojená s adsorpcí, asignifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05), bsignifikantní rozdíl oproti kontrolní skupině Graph 1. Podpora oběhu noradrenalinem 
V prvních dvou bodových grafech (kolečka) je zobrazen čas do zahájení infuze noradrenalinu a druhé dva bodové grafy (čtverečky) vyjadřují celkovou dávku noradrenalinu v kontrolní skupině (bíle) a CPFA skupině (šedé). Regionální hemodynamika, mikrocirkulace, energetický metabolismus a orgánové funkce
Průtoky krve játry a ledvinou, regionální dodávka a spotřeba kyslíku byla obdobná v obou skupinách (tab. 2). I přes dobrou regionální perfuzi orgánů docházelo k progresivnímu zhoršování mikrocirkulace sliznice ilea a ledvinné kůry u obou skupin bez rozdílu (viz tab. 2). Zhodnocení přímého zobrazení mikrocirkulace sliznice ilea (SDF) ukazovalo na zhoršování charakteru průtoku (MFI) u obou skupin bez rozdílu, ale mikrovaskulární perfuze sliznice ilea vykazovala významně vyšší heterogenitu (FHI) v průběhu léčby CPFA. Sepse při peritonitidě v našem modelu vedla k progresivní metabolické acidóze v portální, jaterní i ledvinné žíle, současně se zvýšeným regionálním poměrem laktátu a pyruvátu a sníženým poměrem KBR – tyto hodnoty nebyly léčbou CPFA ovlivněny. U skupiny s CPFA narůstala ke konci experimentu sérová koncentrace ALT, zatímco u kontrolní skupiny jsme tento nárůst nepozorovali. Kontrolní skupina vyvinula akutní poškození ledvin s významným zvýšením koncentrace sérového kreatininu a podle očekávání hemofiltrace spojená s CPFA zabránila vzestupu hodnot kreatininu u skupiny CPFA (tab. 3).
Table 2. Regionální hemodynamika, metabolismus kyslíku a mikrocirkulace 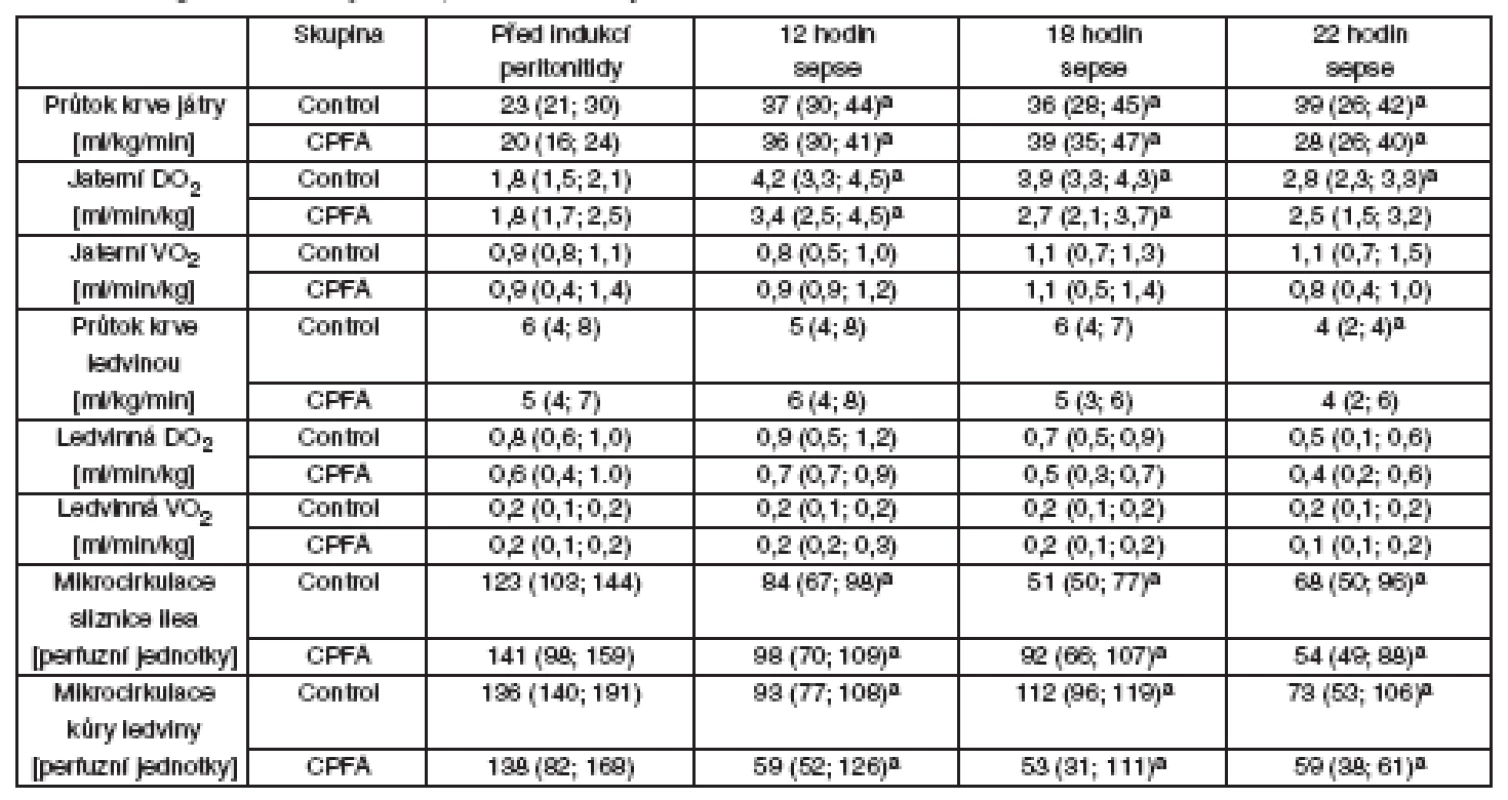
Jaterní DO2 – dodávka kyslíku do jater, jaterní VO2 – spotřeba kyslíku játry, ledvinná DO2 – dodávka kyslíku do ledviny, ledvinná VO2 – spotřeba kyslíku ledvinou, CPFA – plazmafiltrace spojená s adsorpcí, asignifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05). Table 3. Regionální acidobazická rovnováha a energetický metabolismus 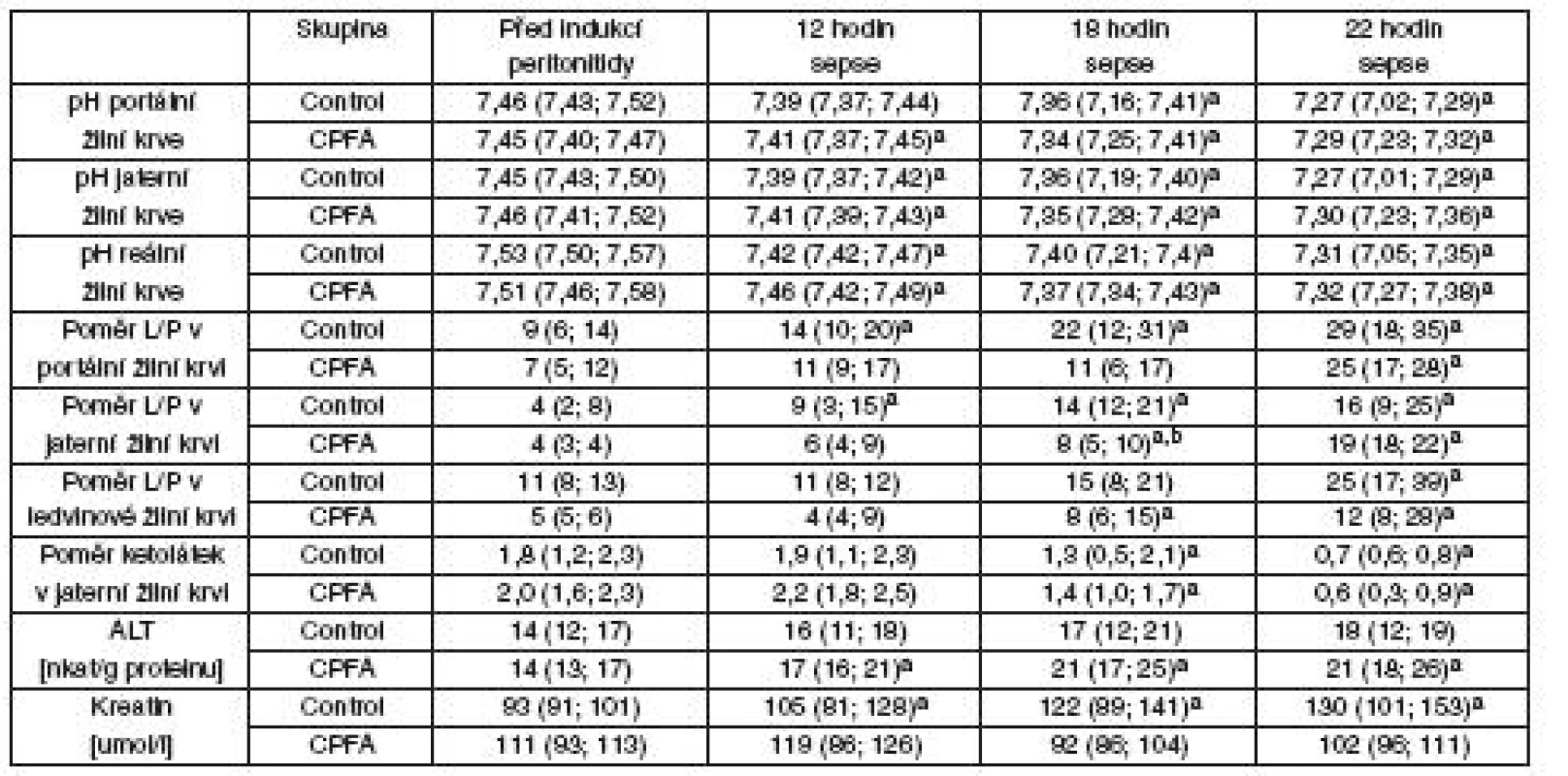
L/P – poměr laktát/pyruvát, ALT – alanin aminotransferáza, CPFA – plazmafiltrace spojená s adsorpcí, asignifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05), bsignifikantní rozdíl oproti kontrolní skupině Oxidativní/nitrosativní stres, koagulace, endoteliální dysfunkce a zánět
V průběhu peritonitidy došlo ke zvýšení hodnot NOx a TBARS v arteriální krvi (graf 2). Nárůst těchto markerů nitrosativního/oxidativního stresu byl více vyjádřen u skupiny léčené CPFA. Ve srovnání s kontrolními zvířaty docházelo u skupiny léčené CPFA k prudšímu poklesu počtu krevních destiček a vyšší intravaskulární tvorbě komplexů TAT (graf 3). Postupný nárůst aktivity vWf a ADMA v sepsi nebyl léčbou CPFA ovlivňen (viz graf 3). Systémová zánětlivá odpověď byla provázena nárůstem plazmatických hladin TNF-α and IL-6 u všech zvířat bez rozdílu. CPFA také neovlivnila nárůst plazmatických koncentrací NPY a VIP (tab. 4).
Graph 2. Arteriální hypotenze 
Horní vlevo: Microvascular flow index, mikrocirkulace sliznice ilea hodnocená sidestream darkfield imaging. Horní vpravo: Flow heterogeneity index, mikrocirkulace sliznice ilea hodnocená sidestream darkfield imaging. Dolní vlevo: Plazmatické hladiny nitrátů a nitritů. Dolní vpravo: Plazmatické hladiny reaktantů s kyselinou thiobarbiturovou (TBARS). Kontrolní skupina (bílé krabice) a CPFA skupiny (šedé krabice), #signifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05), §signifikantní rozdíly mezi skupinami (p < 0,05) Graph 3. Vliv léčby CPFA 
Horní vlevo: Plazmatické hladiny asymetrického dymetylargininu. Horní vpravo: Plazmatické hladiny von Willebrandova faktoru. Dolní vlevo: Počet trombocytů. Dolní vpravo: Komplexy trombinu-antitrombinu. Kontrolní skupina (bílé krabice) a CPFA skupiny (šedé krabice), #signifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05), §signifikantní rozdíly mezi skupinami (p < 0,05) Table 4. Zánětlivé cytokiny a neuropeptidy 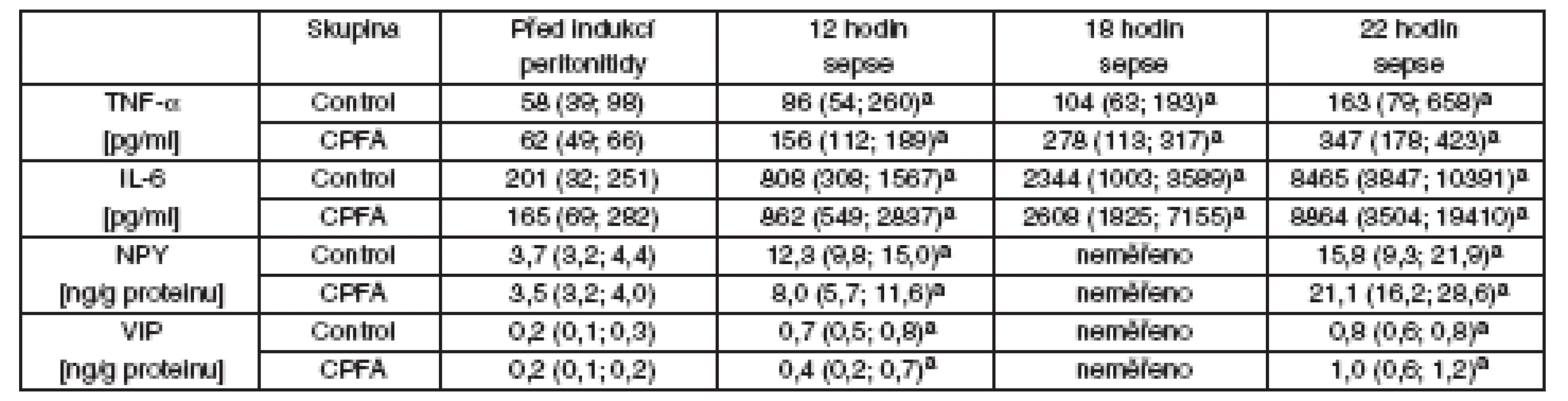
TNF-α – plazmatické hladiny tumor necrosis faktoru alfa, IL-6 – plazmatické hladiny interleukinu 6; NPY – plazmatické hladiny neuropeptidu Y, VIP – plazmatické hladiny vazoaktivního intestinálního peptidu, CPFA – plazmafiltrace spojená s adsorpcí, asignifikantní rozdíl v čase vs před indukcí peritonitidy (p < 0,05), bsignifikantní rozdíl oproti kontrolní skupině Dikuse
V této, dosud první kontrolované experimentální studii navržené ke zhodnocení účinnosti CPFA jsme použili klinicky relevantní model, ve kterém jsme zahajovali CPFA až v plně rozvinuté hyperdynamické sepsi (post-inzult režim). Cílem naší práce bylo zhodnotit nejen hemodynamiku, ale také různé biologické systémy hrající významnou úlohu v patogenezi sepse. Hlavními výsledky naší studie dokládají, že léčba CPFA:
- nezabránila rozvoji hypotenze a progresi sepse do septického šoku;
- nedokázala pozitivně ovlivnit poškození mikrocirkulace, energetického metabolismu a orgánových funkcí;
- dokonce zhoršila sepsí indukovanou poruchu koagulace a parametry oxidativního/nitrosativního stresu.
Dosud byla publikována jen jediná experimentální studie zabývající se účinkem CPFA v preklinickém modelu [12]. Účinek CPFA byl zkoumán na králičím modelu endotoxinového šoku navozeného letálním bolusem endotoxinu E. coli. V této studii byla léčba CPFA spojena s prodloužením doby přežití (72 hodin) [12]. Studie je však omezena řadou limitací:
a) výsledkem bolusového podání endotoxinu a absence tekutinové resuscitace byl hypodynamický endotoxinový šok, který je zcela v protikladu k obvyklé klinické situaci;
b) léčba CPFA byla zahájena před indukcí šoku, tzn. ve schématu, které nelze klinicky uplatnit.
V naší studii jsme zahajovali léčbu CFPA v plně rozvinuté polymikrobiální sepsi (po 12 hodinách od inzultu) s hyperdynamickou cirkulací, poruchou mikrocirkulace, známkami systémového zánětu a metabolické alterace. V tomto nastavení studie za použití přísně protokolem řízené tekutinové resucitace, umělé plicní ventilace a podpůrné terapie, které není plánováno k hodnocení přežití, jsme během 10hodinové léčby CPFA nepozorovali žádné pozitivní ukazatele svědčící ve prospěch této léčby. Rozdíl v naší studii je oproti výše zmíněnému experimentálnímu modelu především v rozdílném načasováním hemopurifikace, což je velmi důležité pro interpretaci výsledků těchto dvou studií. Toto je podporováno výsledky experimentálních studií hemofiltrace v sepsi, ve kterých bylo lepších výsledků dosahováno zejména tehdy, pokud byla eliminace zahájena krátce po septickém inzultu, nebo mu dokonce předcházela [19]. Prodloužení doby přežití ve studii Tetty et al. však nebylo spojeno s jednoznačným zlepšením hemodynamické stabilizace, redukcí cirkulujícího bioaktivního TNF-α, plazmatického lipopolysacharidu či zmenšením tíže metabolické acidózy [12].
V naší studii jsme hodnotili několik klinicky relevantních a vzájemně nezávislých ukazatelů, jako jsou mikrocirkulace, energetický metabolismus, oxidativní stres, dysfunkce endotelu, systémový zánět a orgánové funkce. V této šíři ukazatelů není pravděpodobné, že by unikl některý z pozitivních léčebných efektů metody CPFA. Lze namítat, že delší doba CPFA by mohla přinést signifikantní změny v některých našich výstupech. Doba studie je však stejná jako u obou malých pilotních klinických studií [11, 13], v nichž byl pozorován vzestup MAP již po 10hodinové léčbě CPFA a na základě jejichž výsledků bychom případné pozitivní účinky měli pozorovat také v průběhu naší studie. Léčba CPFA působila dokonce škodlivě na koagulaci, především poklesem počtu destiček a narůstem komplexů TAT, a současně zhoršovala oxidativní a nitrosativní stres, jak je vyjádřeno nárůstem TBARS a nitrátů a nitritů. Prokoagulační aktivita CPFA společně s významně zhoršenou heterogenitou mikrovaskulární perfuze (FHI) u zvířat léčených CPFA může vybízet ke spekulaci o zvýšené tvorbě mikrovaskulární trombózy. Námi pozorované nežádoucí účinky CPFA mohou být přisouzeny tzv. bioinkompatibilitě metody (tj. aktivaci humorální i buněčné imunitní odpovědi při interakci krve s umělým materiálem) nebo také možnosti, že dochází k odstraňování prospěšných a nezbytných molekul. Kontakt krve s cizím povrchem, jakým je dialyzační membrána, vede k aktuní zánětlivé odpovědi, aktivaci koagulace a vyšší produkci kyslíkových radikálů a oxidu dusnatého, jak bylo prokázáno u chronicky dialyzovaných nemocných [20–23]. Toto tvrzení podporuje i vyšší spontánní produkce TNF-αin vitro u plné krve nemocných, která byla pozorována po ukončení léčbou CPFA; tento efekt byl v nejvyšší míře pozorován po průchodu krve hemofiltrem [11]. Obdobně v průběhu frakcionované separace plazmy a adsorpce byly pozorovány významné poruchy koagulace [24] a byl dokumentován pokles počtu krevních destiček u septických pacientů léčených adsorpčním systémem založeným na imobilizovaném lidském albuminu [25]. Navíc poruchy mikrocirkulace byly v recentních studiích použity jako další možné ukazatele bio(in)kompatibility [26, 27]. Prozatím nelze vyloučit, že prozánětlivé, prokoagulační a prooxidační účinky CPFA mohou omezovat její účinnost. V našem pokusu jsme se zaměřili na hodnoceni bioinkompatibility, a také proto jsme nezařazovali skupinu, u které bychom hodnotili účinek okruhu CPFA per se, a ani jsme nenabírali vzorky před adsorpční kapslí a za ní.
Závěr
V tomto modelu septického šoku při peritonitidě nezabránilo časné zahájení CPFA rozvoji poruchy hemodynamiky a ostatních patofyziologických odpovědí, navíc jsme zaznamenali vliv na zhoršení oxidativního stresu a koagulační dysfunkci. Selhání účinnosti CPFA metody a naopak riziko nežádoucích účinků, plynoucích pravděpodobně z procesů bioinkompatibility, dokládá nutnost dalších studií, které musí dostatečně zhodnotit jak účinnost, tak bezpečnost této jinak koncepčně perspektivní metody. Do té doby nelze CPFA metodu přes slibné výsledky pilotních klinických studií či kazuistik doporučit pro klinické účely.
Studie byla vypracována s podporou v rámci hlavního výzkumného záměru č. MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
Poděkování: Děkujeme L. Trefilovi, L. Vítovi a L. Reifové za technickou pomoc a firmě Biomedica CS za laskavé zapůjčení přístroje LYNDA.
Adresa pro korespondenci:
Prof. MUDr. Martin Matějovič, Ph.D.
I. interní klinka FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: matejovic@fnplzen.cz
Sources
1. Bellomo, R. et al. Extracorporeal blood treatment (EBT) methods in SIRS/Sepsis. Int. J. Artif Organs, 2005, 28, p. 450–458.
2. Vincent, J. L. et al. A pilot-controlled study of a polymyxin B-immobilized hemoperfusion cartridge in patients with severe sepsis secondary to intra-abdominal infection. Shock, 2005, 23, p. 400–405.
3. Schefold, J. C. et al. A novel selective extracorporeal intervention in sepsis: immunoadsorption of endotoxin, interleukin 6, and complement-activating product 5a. Shock, 2007, 28, p. 418–425.
4. Formica, M. et al. Coupled plasma filtration adsorption. Contrib. Nephrol., 2007, 156, p. 405–410.
5. Bellomo, R. et al., Tetta, C., Ronco, C. Coupled plasma filtration adsorption. Intensive Care Med., 2003, 29, p. 1222–1228.
6. Ronco, C. et al. Coupled plasma filtration adsorption: rationale, technical development and early clinical experience. Blood Purif., 2003, 21, p. 409–416.
7. Tetta, C. et al. Use of adsorptive mechanisms in continuous renal replacement therapies in the critically ill. Kidney Int. Suppl., 1999, 72, p. S15–S19.
8. Winchester, J. F. et al. Sorbents in acute renal failure and the systemic inflammatory response syndrome. Blood Purif., 2003, 21, p. 79–84.
9. Cole, L. et al. The effect of coupled haemofiltration and adsorption on inflammatory cytokines in and ex vivo model. Nephrol. Dial. Transplant., 2002, 17, p. 1950–1956.
10. Tetta, C. et al. Removal of cytokines and activated complement components in an experimental model of continuous plasma filtration coupled with sorbent adsorption. Nephrol. Dial. Transplant., 1998, 13, p. 1458–1464.
11. Ronco, C. et al. A pilot study of coupled plasma filtration with adsorption in septic shock. Crit. Care Med., 2002, 30, p. 1250–1255.
12. Tetta, C. et al. Coupled plasma filtration-adsorption in a rabbit model of endotoxic shock. Crit. Care Med., 2000, 28, p. 1526–1533.
13. Formica, M. et al. Hemodynamic response to coupled plasmafiltration-adsorption in human septic shock. Intensive Care Med., 2003, 29, p. 703–708.
14. Matejovic, M. et al. Selective inducible nitric oxide synthase inhibition during long-term hyperdynamic porcine bacteremia. Shock, 2004, 21, 458–465.
15. Matejovic, M. et al. Effects of tempol, a free radical scavenger, on long-term hyperdynamic porcine bacteremia. Crit Care Med., 2005, 33, p. 1057-1063.
16. Matejovic, M. et al. Effects of combining inducible nitric oxide synthase inhibitor and radical scavenger during porcine bacteremia. Shock, 2007, 27, p. 61–68.
17. De Backer, D. et al. How to evaluate the microcirculation: report of a round table conference. Crit. Care, 2007, 11, p. R101.
18. Szabó, A. et al. Flow motion in the intestinal villi during hemorrhagic shock: a new method to characterize the microcirculatory changes. Shock, 2004, 21, p. 320–328.
19. Bouman, C. S. et al. Hemofiltration in sepsis and systemic inflammatory response syndrome: the role of dosing and timing. J. Crit. Care, 2007, 22, p. 1–12.
20. Hakim, R. M. Clinical implications of biocompatibility in blood purification membranes. Nephrol. Dial. Transplant., 2000, 15 (Suppl 2), p. 16–20.
21. Pertosa, G. et al. Clinical relevance of cytokine production in hemodialysis. Kidney Int. Suppl., 2000, 76, p. S104–S111.
22. Wratten, M. L. et al. Oxidant stress in hemodialysis: prevention and treatment strategies. Kidney Int Suppl., 2000, 76, p. S126–S132.
23. Gorbet, M. B. et al. Biomaterial-associated thrombosis: roles of coagulation factors, complement, platelets and leukocytes. Biomaterials, 2004, 25, p. 5681–5703.
24. Meijers, B. K. et al. Major coagulation disturbances during fractionated plasma separation and adsorption. Am. J. Transplant., 2007, 7, p. 2195–2199.
25. Reinhart, K. et al. Open randomized phase II trial of an extracorporeal endotoxin adsorber in suspected Gram-negative sepsis. Crit. Care Med., 2004, 32, p. 1662–1668.
26. Teatini, U. et al. Microcirculation as a novel marker of membrane biocompatibility. Int. J. Artif. Organs, 2006, 29, p. 1117–1120.
27. Sato, M. et al. Effect of different dialyzer membranes on cutaneous microcirculation during hemodialysis. Clin. Nephrol., 2006, 66, p. 426–432.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 2-
All articles in this issue
- Vliv věku na farmakodynamické vlastnosti cisatrakuria, rokuronia a vekuronia u mužů během totální intravenózní anestezie – prospektivní studie
- Výuka základní resuscitace rodičů nedonošených dětí – retrospektivní analýza dotazníků
- Plazmafiltrace spojená s adsorpcí v experimentálním septickém šoku – překlad originálního článku*
- Multimodální monitorování v intenzivní péči u těžkých neurotraumat
- Memoriál Tomáša Kadlica – kto bol doc. MUDr. Tomáš Kadlic
- Translating Basic Science to Clinical Care
- TAP blok a pooperační bolest – prospektivní audit
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- TAP blok a pooperační bolest – prospektivní audit
- Multimodální monitorování v intenzivní péči u těžkých neurotraumat
- Memoriál Tomáša Kadlica – kto bol doc. MUDr. Tomáš Kadlic
- Vliv věku na farmakodynamické vlastnosti cisatrakuria, rokuronia a vekuronia u mužů během totální intravenózní anestezie – prospektivní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

