-
Medical journals
- Career
Využití ultrasonografie u kriticky nemocného
Authors: M. Balík
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny VFN, Praha
Published in: Anest. intenziv. Med., 19, 2008, č. 1, s. 54-61
Category: Intensive Medicine
Overview
Ultrazvuk na jednotkách intenzivní péče významně rozšiřuje diagnostiku a zefektivňuje management kriticky nemocných. Přibývající množství publikací potvrzuje fakt, že kvalifikovaní intenzivisté mohou zajistit přesnou, bezpečnou a obsažnou diagnostiku hemodynamiky pomocí echokardiografie. Intenzivisté zapojení do managementu kriticky nemocných si jsou vědomi všech klinických a laboratorních parametrů a měli by být schopni interpretovat echokardiografické vyšetření komplexním způsobem a s okamžitou aplikací pro další terapii. Vyšetření plic a pleurální dutiny, kvantifikace pleurální tekutiny a případné vyloučení ventrálního pneumotoraxu by mělo být integrální součástí transtorakálního echokardiografického vyšetření. Vyšetření břicha u sepse nejasné etiologie, náhlých příhod břišních či u renálního selhání může nasměrovat další diagnostické a terapeutické kroky u kriticky nemocného pacienta. Časový faktor je zvláště naléhavý u příjmu těžkých traumat a polytraumat, kde přežití pacienta závisí z velké části na správně zvoleném diagnostickém algoritmu. Zde má ultrazvuk nezastupitelnou roli. Vyšetření lineární sondou pomahá před provedením perkutánní dilatační tracheostomie, stejnou technikou lze zaměřit centrální žílu před kanylací u rizikového pacienta a ušetřit ho transfuze destiček. Vysokofrekvenční lineární sonda významně pomáhá i při zavádění nervových blokád v regionální anestezii. Již zavedenou roli má ultrazvuk ve vyšetřování žilního systému při suspektní hluboké žilní trombóze. Transkraniální dopplerometrie je významnou pomůckou v diagnostice průtoku krve mozkem, zvláště u subarachnoidálního krvácení a intrakraniální hypertenze. Pořizovací cena multimodálního ultrazvukového přístroje je značná. Tento přístroj však v rukou erudovaného intenzivisty může zachránit život pacienta a ušetřit čas, komplikace a peníze celému oddělení.
Klíčová slova:
ultrasonografie – echokardiografie – hrudní ultrasonografie – sepse – trauma – transkraniální dopplerometrieÚvod
Tento článek má za úkol nastínit možnosti využití multimodálního ultrazvukového přístroje (obr. 1) v prostředí intenzivní péče. Cílem je stimulovat zájem o ultrazvuk a poukázat na již navržené postupy a algoritmy, které by mohly intenzivistům pomoci v jejich každodenní praxi.
Image 1. Příklad multimodálního ultrazvukového přístroje vybaveného transtorakální, abdominální a lineární sondou (HP Image Point) 
Echokardiografie
Rutinní aplikace echokardiografie v intenzivní medicíně významně rozšiřuje diagnostické a následně terapeutické možnosti poruch hemodynamiky. Vyšetření může diagnostikovat ventrikulární systolickou a diastolickou funkci, přítomnost či absenci myokardiální ischémie, poruchu chlopenního aparátu (obr. 2), přítomnost vegetací, patologie aorty (obr. 3), onemocnění perikardu, septální defekty, pleurání výpotky (obr. 4) a nemoci mediastina. Echokardiografie může být prováděna u každého hemodynamicky nestabilního pacienta nebo v diferenciální diagnostice srdečního selhání, bolestí na hrudi, arytmií, šelestů, kardiomegalie nebo u podezření na centrální či periferní embolizace. Vyšetření je rychlé, neinvazivní a může být libovolně opakováno u lůžka pacienta. V praxi obvykle zahajujeme transtorakální echokardiografií (TTE). V průměru 36 % pacientů na umělé plicní ventilaci vyžaduje rozšíření vyšetření o transezofageální přístup (TEE) (data autora). TEE je prováděno primárně pro diagnostiku endokarditidy, vyšetření aorty, zdroje embolie, vyloučení intrakardiálního zkratu, po kardiochirurgickém výkonu, při vyšetřování chlopenních protéz a někdy u dárcovského srdce před transplantací.
Image 2. Příjem pacientky resuscitované pro arytmii, příjmové vyšetření odhalilo těsnou aortální stenózu (AVA 0,4 cm2) Jde o vyšetření TEE ze středního jícnu, nahoře levá síň, v centru těžce degenerovaná aortální chlopeň, která byla druhý den po příjmu nahrazena protézou. 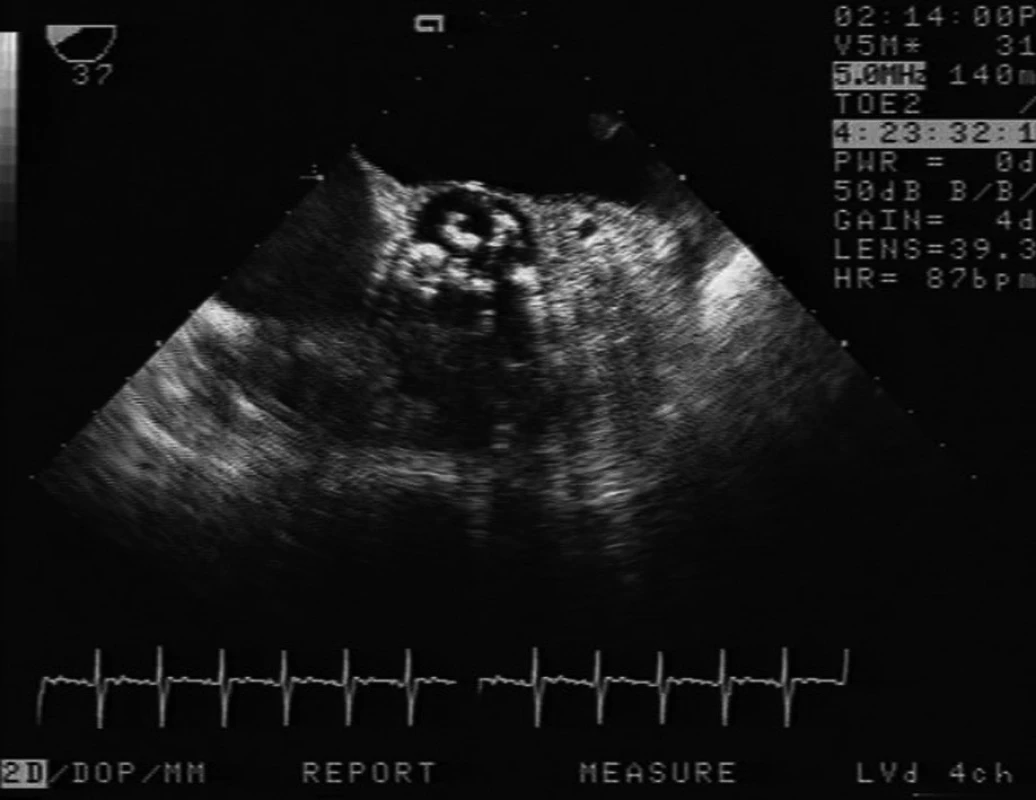
Image 3. Příjem polytraumatu, který měl nejasný stín v mediastinu a rozšíření aorty na CT Na TEE je patrna traumatická disekce sestupné aorty s pravým lumen v levé dolní (z pohledu pacienta) části sektoru dopplerometrie, turbulence nahoře je vstup do falešného lumen. Pacient podstoupil urgentní stenting. 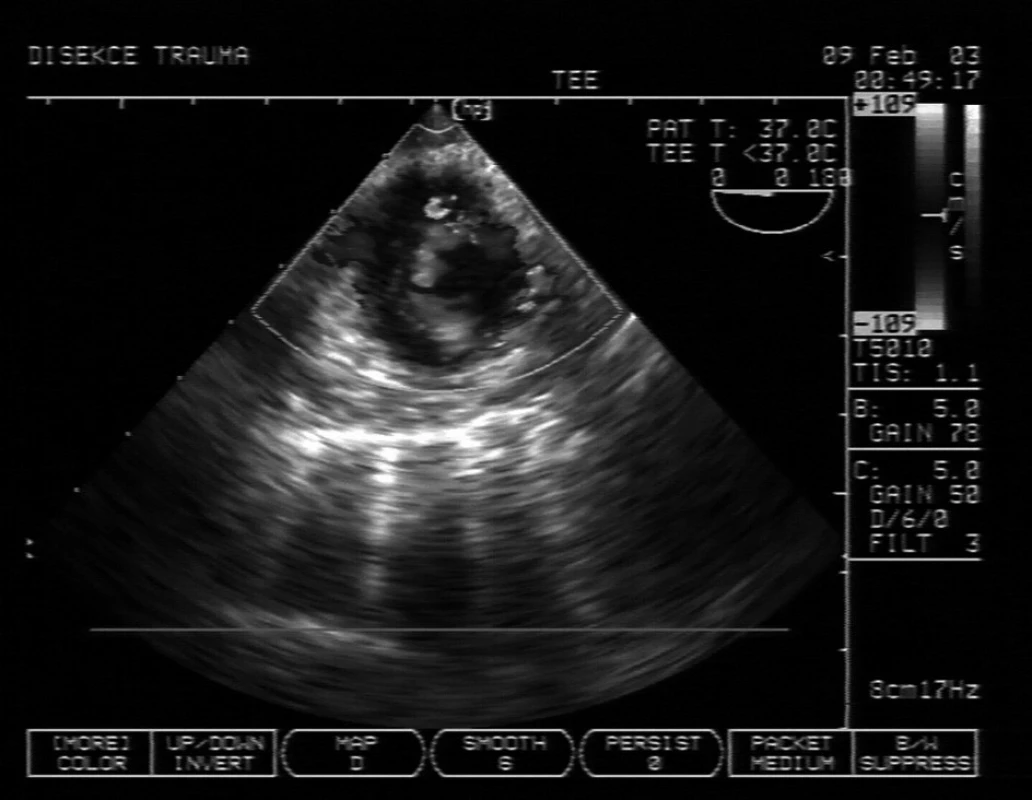
Image 4. Levostranný pleurální výpotek se separací 3,72 cm v zadní axilární čáře V centru UZ sektoru je atelektatická plíce, projasnění je bronchogram (vzduch v distálních bronchiolech). 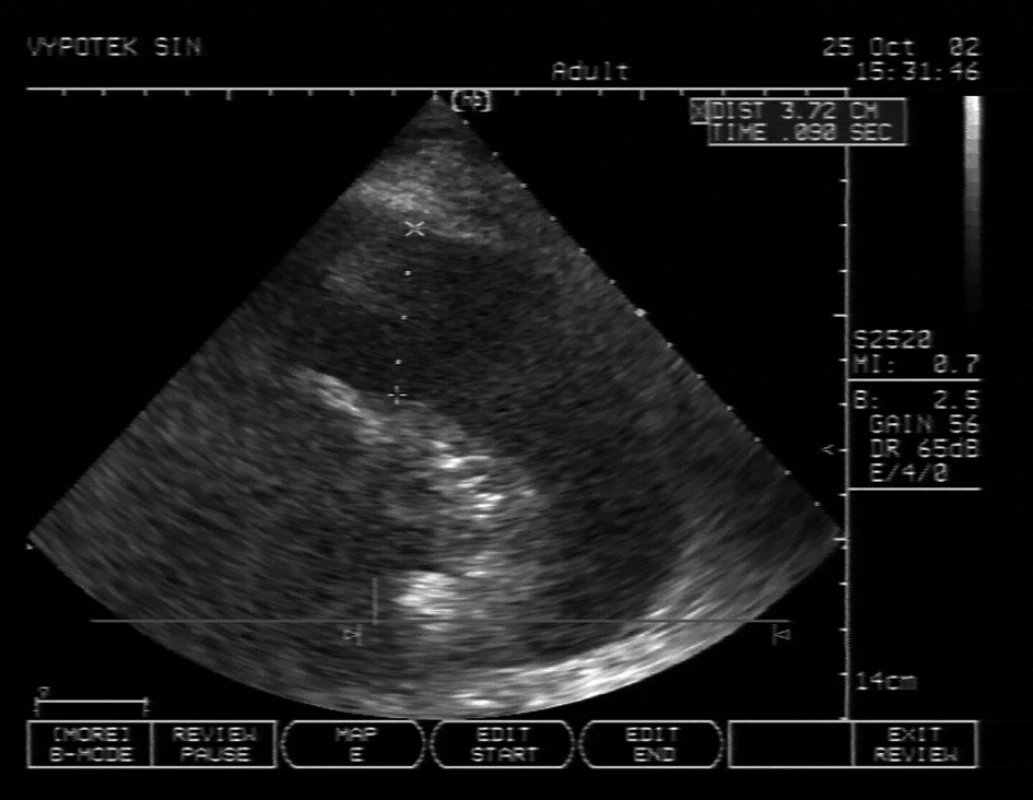
S ohledem na možnosti, které metodika nabízí, považuje autor tohoto článku za vhodné provádět komplexní vyšetření tak, jak je známe z echokardiografických laboratoří s přihlédnutím k hemodynamickým specifikům kriticky nemocných pacientů [1]. Kompletní echokardiografické vyšetření kriticky nemocných by mělo zahrnout následující položky: preload, globální a segmentální kontraktilitu, diastolickou funkci, afterload, poruchy chlopenního aparátu, srdeční výdej, pravé srdce, plicnici a plicnicový tlak, patologie aorty, perikardu a vyšetření pleurální dutiny (tab. 1). Rutinně vyšetřujeme minimálně 10–11 zobrazení transtorakálně a 12 zobrazení u transezofageálního vyšetření [1]. Transtorakální vyšetření nemá kontraindikací, u jícnového jsou relativní kontraindikací krvácení z úst a horního gastrointestinálního traktu, stavy po jícnové a žaludeční chirurgii, jícnové varixy, cervikální spinální trauma a nestabilita, dále je vyšetření třeba zvážit u endoskopicky zavedené nazojejunální sondy.
Table 1. Základní echokardiografické vyšetření u kriticky nemocného 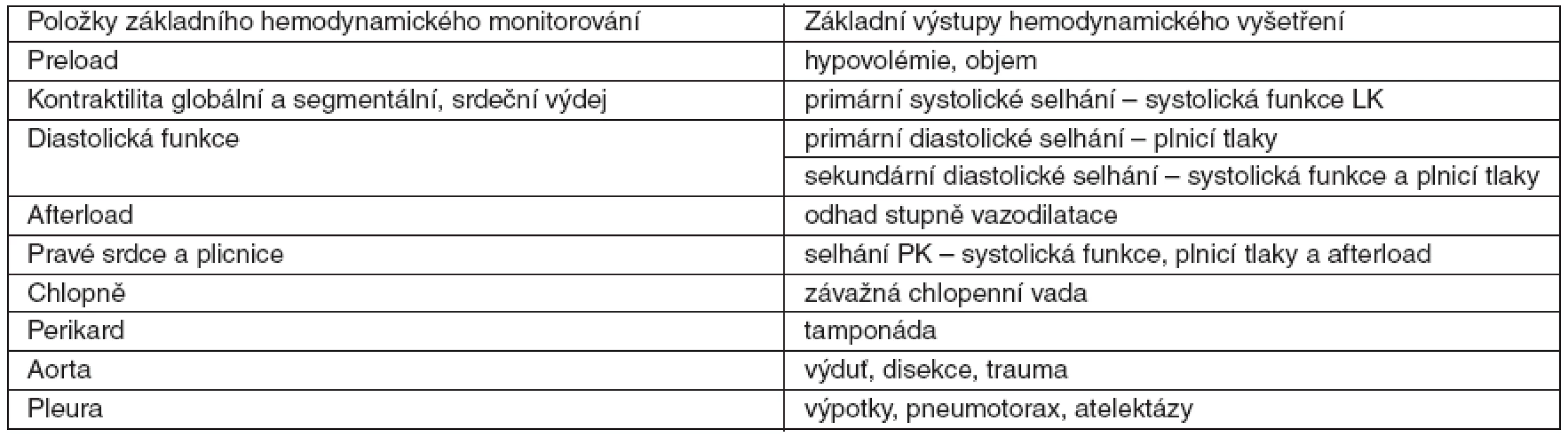
V rámci rutinního hemodynamického monitorování je echokardiografie nejpřínosnější pro diagnostiku a terapii u nejasné hemodynamické nestability. Aplikace echokardiografie objasnila 70 % příčin a vedla k okamžitému chirurgickému výkonu u 22 % nemocných. Frekvence následné katetrizace plicnice byla 35% u všech hypotenzních pacientů [2]. Příspěvek echokardiografie pro diagnostiku byl popsán nejen pro změny terapie u 40 % pacientů bez plicnicového katétru (PAC), ale i u 40–50 % pacientů s již zavedeným PAC bez ohledu na základní diagnózu [3, 4]. Zdá se, že provozování echokardiografie u všech hemodynamicky nestabilních pacientů redukuje potřebu zavádět PAC, která může být přibližně na polovině průměrné frekvence zavádění PAC v evropských jednotkách intenzivní péče [5, 6]. Potřeba zavádět PAC a kontinuální monitorování tlaků v plicnici může být limitována pro stavy hemodynamické nestability kardiálního původu, jiné příčiny mohou být zvládány jen pomocí echokardiografie. Tento postup může na druhou stranu přinést zvýšení morbidity a mortality ve skupině monitorované pomocí PAC, protože stav méně závažně nemocných pacientů bude zvládán jen pomocí intermitentní echokardiografie. Pokud pomineme vysoké pořizovací náklady, echokardiografie je jako rutinní postup lacinější než PAC. Multimodální ultrazvukový přístroj vybavený TEE sondou by měl být součástí všech větších jednotek intenzivní péče, kde jeho přítomnost bude zdůvodněna vysokým počtem diagnostikovaných a léčených pacientů. S tím souvisejí úspory na plicnicových katétrech, rentgenovém materiálu a krevních destičkách bez ohledu na okamžitou a téměř kompletní diagnostiku kardiovaskulárního systému.
V akutních situacích může být kardiolog nebo sonografista obtížně dosažitelný po 24 h denně. Přibývající množství publikací potvrzuje fakt, že kvalifikovaní intenzivisté mohou zajistit přesnou, bezpečnou a obsažnou diagnostiku hemodynamiky pomocí TEE a TTE. Intenzivisté zapojení do managementu kriticky nemocných si jsou vědomi všech klinických a laboratorních parametrů a měli by být schopni interpretovat echokardiografické vyšetření komplexním způsobem a s okamžitou aplikací pro další terapii. Provozování echokardiografie však vyžaduje dokonalou znalost instrumentária a principů srdečního ultrazvuku. Spojeným úsilím European Society of Cardiology a European Society of Cardiothoracic Anaesthetists vznikla v roce 2004 kurikula pro trénink v transtorakální a transezofageální echokardiografii; podmínkou získání akreditace je v obou případech splnění předepsaného log book a echo praxe po dobu 1 roku, dále multiple choice test a video test. Všechny tyto snahy umožnit nejen kardiologům kvalifikační zkoušku z echokardiografie by měly stimulovat trénink intenzivistů v aplikaci srdečního ultrazvuku.
Hrudní ultrasonografie
Vyšetření hrudníku by nemělo být limitováno pouze na echokardiografii. Odhad stupně a rozsahu alveolární konsolidace je možný pomocí TEE [7]. Vyšetření pleurální dutiny, kvantifikace pleurální tekutiny a případné vyloučení ventrálního pneumotoraxu pomocí TTE by mělo být integrální součástí transtorakálního echokardiografického vyšetření. Adekvátní drenáž pleurální dutiny lze považovat za součást „open lung concept“ a může být velmi efektivně iniciována a provedena na podkladě ultrazvukového vyšetření [8, 9]. Podobně patologie bránice lze nejlépe ověřit pomocí bedside ultrazvukového vyšetření.
Prevalence výpotků na intenzivní péči je vysoká a u interních pacientů se pohybuje mezi 15–62 % [10]. Hrudní sonografie vykazuje lepší senzitivitu a specificitu pro diagnostiku pleurální tekutiny než rentgenové vyšetření hrudníku, které má senzitivitu 80–83%. Je známo, že rentgen může „opominout“ 300–500 ml tekutiny [11]. Ultrazvuk navíc vylučuje atelektázu, konsolidaci a zvýšený stav bránice, a tím potencionálně „iatrogenizující torakocentézu“. Je rychlejší než rentgenové vyšetření, může být libovolně opakován u lůžka pacienta a má významně nižší frekvence komplikací než u punkcí bez UZ asistence [12, 13, 14]. U pacientů s úspěšně provedenou torakocentézou je trend ke kratšímu pobytu na JIP a nižší mortalitě. V případě malých výpotků je na zvážení benefit punkce vs riziko komplikací jako pneumotorax nebo krvácení, a to zvláště u pacientů na UPV nebo u trombopenických pacientů [15, 16, 17]. Z patofyziologie pacientů na umělé plicní ventilaci je zřejmé, že adekvátní drenáž významných pleurálních výpotků udržuje nízký pleurální tlak, udržuje dostatečný transpulmonální tlak a funkční reziduální kapacitu za cenu nižšího peak a plateau airway pressure [18, 19, 20].
Kromě studií, pokoušející se kvantifikovat pleurální tekutinu pomocí UZ na spontánně ventilujících ambulantních pacientech [12], byly v posledních letech publikovány studie kvantifikující pleurální tekutinu také u kriticky nemocných pacientů [21] a u pacientů na umělé plicní ventilaci [9, 23]. Zkušený intenzivista by neměl mít problém určit i kvalitu výpotku, tedy zda se jedná o transudát/exsudát, pyotorax, krev s koaguly, nebo zda jsou přítomna septa. Přes tekutinu jako vhodné UZ médium lze určit i rozsah konsolidace plicního parenchymu komprimovaného výpotkem. Zobrazení bránice, jater a sleziny před punkcí a určení tloušťky hrudní stěny má význam pro výběr kanyly či interkostálního drénu a bezpečnost punkce (viz obr. 4). Při tomto postupu se procento úspěšnosti blíží 100 % a frekvence komplikací je 0 % [13, 15, 17].
Pneumotorax je na UPV závažná komplikace vyžadující okamžitou diagnózu. Problémem rentgenového vyšetření u lůžka pacienta je nízká senzitivita, neboť nezachytí až 30 % pneumotoraxů u pacientů v supinní poloze, z nichž polovina přechází do tenzního pneumotoraxu [23, 24]. Celá diagnóza je postavena na vyšetření pleurálních listů pod úrovní žeber jako rozhraní echolucentních měkkých tkání a echokontrastní vzdušné plíce. Tzv. pleural sliding je navozen posunem listů pleury po sobě v rámci dechového cyklu. „Fenomén komety“ vede z pleurální linie vertikálně přes celý sektor a má dynamickou synchronizaci s lung sliding v podobě kyvadlového pohybu. „Lung point“ je rozhraní normálního „sliding“ a jeho absence (zóna separace pleurálních listů plynem = pneumotorax). Pro interpretaci je třeba vědět, že amplituda lung sliding se zvyšuje od apexu k bazi a lze ji obtížně nalézt u HF-IPPV, v apnoi, po pleuritidě, talkáži, těžkém emfyzému, u fibróz, kompletní atelektázy a bazálně až u třetiny těžkých ARDS a pneumonií (měl by být přítomen ventrálně). Přenos srdeční pulzace „plicní pulz“ je obvykle markantní u atelektáz a nemožnosti vybavit „lung sliding“, oba fenomény mohou být samozřejmě vidět najednou u normálního nálezu.
Ultrazvuk má senzitivitu 95% pro diagnostiku PNO, posun pleurálních listů (sliding) má negativní predikční hodnotu 100 % pro diagnostiku PNO [8]. Při nenalezení „lung sliding“ ventrálně nelze pneumotorax vyloučit, ani s jistotou potvrdit. Pokud je přítomen klinický nález, je možno jistě rozhodnout o drenáži, nicméně jistotu přinese až nález „lung point“. Při posunu sondy laterálně a dorzálně obvykle nalezneme oblast přechodu „absence sliding s reverberacemi pleurální linie“ ventrálně a do obrazu „sliding a fenoménu komety“ dorzálně (typicky v oblasti přední a střední axilární linie u ventrálního pneumotoraxu). Tento nález má sice senzitivitu 66%, ale specificitu 100% pro diagnózu PNO [25]. Až 80 % ventrálních radiookultních PNO je diagnostikováno pomocí lung point, který určuje i rozsah PNO. Při možnosti hrudního UZ vyšetření by tak měla zcela vymizet z praxe pleurální drenáž naslepo v urgentní situaci. Podobně u uzavřeného drénu před vytažením lze vyloučit potřebu pokračující drenáže pomocí pleurálního nálezu.
Atelektázy a konsolidace plicní tkáně jsou detekovatelné při kontaktu s pleurou (periferní segmenty bazálně) nebo v levé plíci paravertebrálně a bazálně pomocí TEE [26]. Plicní tkáň je hepatizovaná, ohraničená ostrou hranicí (pleura) a neostře v hloubce (přechod do vzdušné tkáně). Někdy lze sledovat i dynamický bronchogram jako průnik vzduchu do hepatizované tkáně v inspiriu – typicky (60 %) u infekční alveolární konsolidace (pneumonie). Absence dynamiky bronchogramu je k vidění spíše u atelektáz [7].
Intersticiální syndrom reprezentuje zmnožení tekutiny v interlobulárních septech. Reprezentuje ALI, ARDS, kardiální plicní edém, pneumonii, exacerbaci chronických intersticiálních procesů. Kromě normálního pleurálního nálezu jsou k vidění difuzní „plicní rakety“, typicky pod anterolaterální hrudní stěnou jako B linie. Jejich senzitivita je 93%, specificita 94% pro alveolární intersticiální syndrom [27]. Klinický význam je v časných fázích akutní dušnosti, kde je RTG metoda negativní [28].
Vyšetření bránice se provádí na úrovni jater (pravá bránice) a sleziny (levá). Spontánně ventilující pacient nebo na UPV má normální amplitudu pohybu mezi 10–20 mm (bez vlivu výpotků), amplituda pod 10, respektive 5 mm je patologická. Důležité je zohlednit pleurální fibrotizace, atelektázy, nízké dechové objemy a vzestup intraabdominálního tlaku. Největší význam má vyšetření v péči o pacienty po kardiotorakální chirurgii (n. phrenicus).
Sonografie peritoneální dutiny a retroperitonea pro intenzivisty
Vyšetření abdominální oblasti lze rozdělit na vyšetření peritoneální dutiny a retroperitonea s uropoetickým systémem. Detekce tekutiny v peritoneální dutině je snadná (obr. 5) a zahrnuje vyšetření ve všech abdominálních kvadrantech s důrazem na vyšetření Morrisonova prostoru mezi játry a pravou ledvinou, perisplenického prostoru pod levou bránicí, obou parakolických prostorů, obou kyčelních jam a prostorů před močovým měchýřem a za ním (ideálně při uzavřené močové cévce nebo před vycévkováním). Toto vyšetření je důležitou součástí příjmového vyšetření traumat, je velmi přínosné při podezření na náhlou příhodu břišní nebo při sekvestraci volné tekutiny v břiše u portální hypertenze či pravostranného selhání. Detekce volné tekutiny usnadňuje její nekomplikovanou punkci, což může zásadně změnit další diagnosticko-terapeutický algoritmus, např. diagnostikovat peritonitidu či střevní perforaci. Podobně UZ cílená punkce umožňuje vyloučit spontánní bakteriální peritonitidu u cirhotiků a při zavedení katétru drenáž peritonea a přímé měření intraabdominálního tlaku u extrémních ascitů. Ideální místo pro punkci je obvykle v dolních kvadrantech, ale je nejspíše dáno aktuálním sonografickým obrazem při vědomí průběhu epigastrických cév v břišní stěně.
Image 5. Ascites u pravostranného městnání V centru sektoru je hydropický žlučník, okrouhlý stín pod ním je distendovaná dolní dutá žíla. Vpravo (z pohledu pacienta) od žlučníku je pravý jaterní lalok. 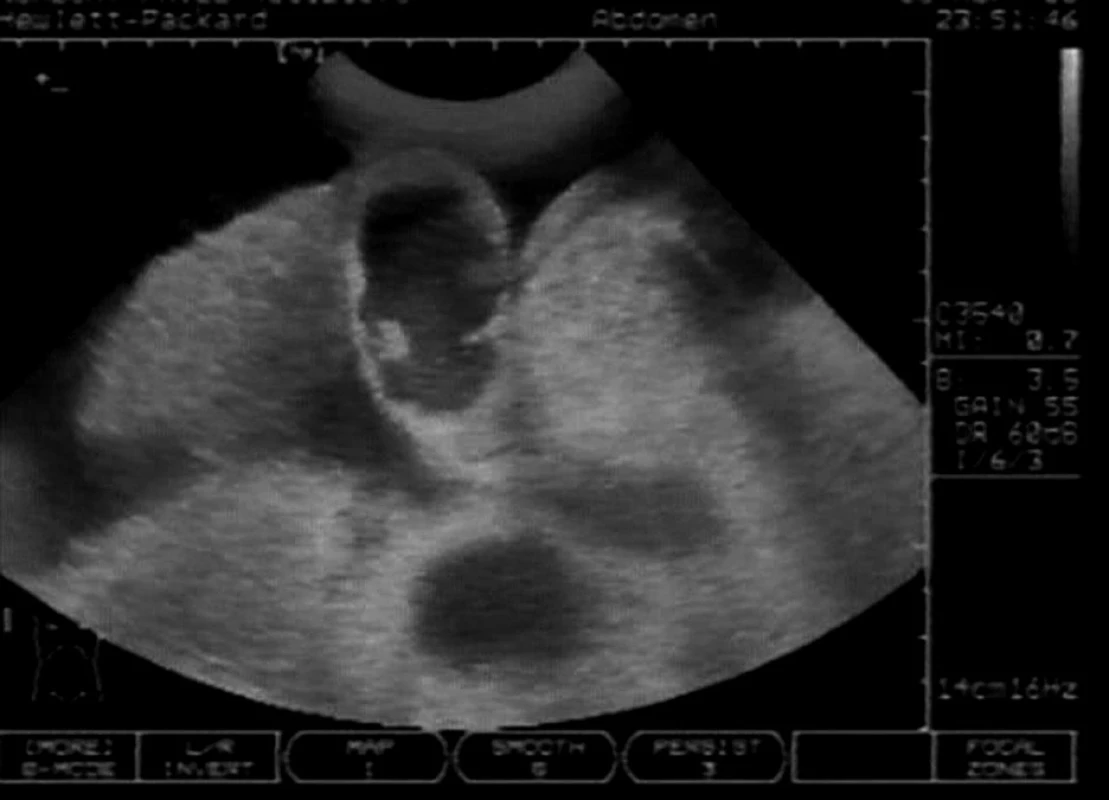
UZ vyšetření peritoneální dutiny umožňuje nejen detekci tekutiny, ale usnadňuje i časnou diagnostiku pneumoperitonea. Pneumoperitoneum je klasicky diagnostikováno jako vzduch pod pravou či levou bránicí. Přesnost RTG je mezi 55–85 % [29, 30] v závislosti na poloze pacienta. UZ vyšetření je založeno na podobném principu jako vyšetření pro pneumotorax. Volný plyn je obvykle na vertexu peritoneální dutiny, tj. typicky supraumbilikálně a okolo jater. Diagnózu může usnadnit pohyb jater s ventilací navozující dynamický obraz intraabdominálních orgánů. Senzitivita tohoto vyšetření dosahuje 93 % a specificita 64 % [31, 32].
Samotné vyšetření střevních kliček umožňuje vidět jejich tekutý obsah (při plynném není vyšetření střeva možné), peristaltiku a tloušťku střevní stěny. Pokud není střevo zaplynováno, je možné diagnostikovat ileus nebo třeba megakolon. Vyšetření sleziny umožňuje s určitou přesností monitorovat např. trauma nebo splenické infarkty. Játra jsou rutinní součástí UZ vyšetření břicha, při pátrání po zdroji sepse často vyšetřujeme žlučník a žlučový strom. Akutní cholecystitida je diagnostikována při stěně žlučníku nad 4 mm (v závislosti na enterálním příjmu), žlučníku distendovaném nad 5 cm, pericholecystickém infiltrátu/tekutině a sludge/kamenech u kalkulózního zánětu [33]. Žlučník se někdy vyklene pod jaterní lalok a lze ho punktovat pod kontrolou UZ jak transperitoneálně, tak i transhepaticky [34]. Výhody transhepatálního postupu zahrnují nižší riziko perforace kolon, riziko vypadnutí katétru a úniku žluči do peritonea. Barevný „doppler“ vylučuje poškození cév při punkci přes jaterní parenchym.
Vyšetření pankreatu je u kriticky nemocných velmi obtížné pro interferenci s plynem v střevních kličkách. Význam ultrazvuku je v možnosti perkutánní drenáže v případě rozsáhlých pseudocyst (obvykle nad 5–6 cm v průměru) u pankreatitid, pokud jsou UZ dosažitelné a není riziko pukce solidních nekróz, které by implikovaly spíše chirurgickou intervenci [35].
Renální ultrasonografie je často indikována mezi prvními vyšetřeními u renálního selhání pro vyloučení subrenální blokády. Podélný rozměr ledviny a velikost centrálního echokomplexu je nejjednodušeji dosažitelný parametr. V závislosti na věku a pohlaví měří ledvina 9–12 cm, centrální echokomplex 6–7 cm. Komplexní vyšetření s pulzním a barevným „dopplerem“ v renálních tepnách lze však indikovat i jako možný monitor splanchnické perfuze. Akutní tubulární nekróza asociuje se vzestupem rezistivního indexu (RI) [36]. Normální nález pulzním „dopplerem“ na renálních tepnách má významnou diastolickou komponentu charakteristickou pro nízkorezistentní cirkulaci. Nejdůležitější semikvantitativní parametry jsou RI (systolický peak – diastolický peak/systolický peak, normálně 0,5–0,1) a akcelerační čas (ACT) systolické fáze. RI nad 0,8 jsou abnormální, ACT by neměl překročit 100 ms. Vyšší hodnoty je třeba interpretovat s ohledem na možnou přítomnost aortální vady, aneuryzmata hrudní aorty, stenózu nebo arteriosklerózu renální tepny. Renální hypoperfuze je charakterizována poklesem absolutní výšky systolického průtoku, daleko více však redukcí průtoku v diastole. To má za následek vzestup RI až k maximu 1,0. Někdy lze pozorovat inverzi průtoku v diastole díky vysoké intravaskulární rezistenci při vazokonstrikci v malých periferních cévách.
Toto vyšetření renálních cév nabývá na významu u náhlých příhod břišních, cirhóz a pankreatitid, neboť stupeň zhoršení renálního průtoku krve souvisí exponenciálně se vzestupem IAP (pokles na polovinu při vzestupu IAP z 18 na 25 mm Hg) [37, 38].
Cílené UZ vyšetření u polytraumatu
I když je koncept „zlaté hodiny“ již 20 let starý, k většině úmrtí na rozsáhlá traumata dochází během prvních desítek minut až hodin po příjmu do nemocnice (až 48 %) [39]. Nejčastěji souvisí se zajištěním dýchacích cest, traumatem hrudníku a hemoragickým šokem [39, 40, 41]. Podíl rozsáhlých fatálních traumat mozku je sice významný, jejich primární terapie a reverzibilita je však omezená. Rychlá schopnost ultrazvuku detekovat volnou tekutinu a tuto tekutinu pod kontrolou UZ drénovat z něj dělá ideální nástroj pro primární vyšetření polytraumatu. Jde především o rychlé cílené vyšetření perikardu, obou pleurálních dutin pro hemotorax a pneumotorax a diagnostiku hemoperitonea. Toto vyšetření nezabere více jak několik desítek sekund při současném zajišťování pacienta invazivními kanylacemi. V závislosti na objemu krve v drénech a dynamice krvácení je bez dalšího prodlení indikována torakotomie, v případě hemoperitonea laparotomie. Je třeba si uvědomit, že transport i na blízké CT a postupná diagnostika hrudníku, břicha a hlavy může v závislosti na kvalitě spirální mechaniky a rentgenek vést ke ztrátě času a zhoršení šance na přežití. Toto CT vyšetření je lépe provést až po iniciálním ultrazvukovém vyšetření, které souhrnně tvoří Focused Assessment with Sonography for Trauma (FAST) [42]. Tento koncept během posledních let vytěsnil z použití diagnostickou peritoneální laváž jako iniciální diagnostiku abdominálního traumatu [43]. Masivní hemoperitoneum lze rychle diagnostikovat vyšetřením Morrisonova prostoru v 82 až 90 % případů, vyšetření je nutné doplnit o perisplenickou oblast, pánev (retro - a paravezikálně) a parakolické prostory. Negativní FAST obvykle znamená, že pacient má jiný zdroj krvácení než výše uvedené dutiny, nelze vyloučit retroperitoneum, intraparenchymové krvácení či traumatické krvácení do trávicího traktu. Vyšetření je omezeno u obézních a u podkožního emfyzému. Indikace k torakotomii na podkladě množství hemotoraxu jsou známy (nad 800 ml jednorázově, nebo pokračující krvácení nad 200 ml/h). Indikace k laparotomii na podkladě sonografické kvantifikace krve v peritoneální dutině je obtížněji definovatelná. Má význam nejvíce v subakutní fázi konzervativně řešených parenchymových traumat primárně diagnostikovaných pomocí CT (subkapsulární ruptury jater a sleziny). Lze shrnout, že čím těžší trauma, tím je výtěžnost UZ větší. Echokardiografie u traumatu vylučuje kromě hemoperikardu především trauma aorty, zde při podezření provádíme transezofageální vyšetření (viz obr. 2).
Zobrazení horních dýchacích cest a trachey
Význam ultrazvuku spočívá v diagnostice polohy ET kanyly, zvláště při použití biluminální rourky a vyšetření spodiny dutiny ústní a krku před provedením perkutánní dilatační tracheostomie (PDTS). Jestliže je endotracheální kanyla dobře zavedena, vidíme bilaterální pohyb bránice a oboustrannou expanzi plic s posunem pleurálních listů. V případě vyřazení plíce z ventilace je patrný „plicní pulz“ přenesením srdečních pulzací a absenci posunu pleurálních listů. Toto vyšetření nahrazuje auskultační nález a bronchoskopii, která je obtížná při použití úzkých biluminálních rourek. Vyšetření krku před PDTS pomahá rozhodnout o samotném výkonu vyloučením významného isthmu thyroidey a vaskulárních struktur před tracheou. Místo samotné lze zvolit pomocí UZ, podobně lze určit potřebnou hloubku preparace. Před výkonem lze pod kontrolou UZ povytáhnout ET kanylu mimo místo punkce a měřit průměr trachey pro volbu správné kanyly [44].
Transkraniální dopplerometrie
Význam transkraniálního dopplerovského vyšetření (TCD) je v diagnóze a monitorování vazospasmu u pacientů se subarachnoidálním krvácením (SAH), detekci elevací intrakraniálního tlaku (ICP), reaktivity na změny ventilace a v diagnóze mozkové smrti.
Vazospasmus se vyskytuje až u 40 % pacientů s aneuryzmatickým SAH a asociuje s 15–20% rizikem mozkové ischémie a smrti [45]. Diagnóza spasmu pomocí TCD je založena na principu inverzního vztahu průtoku krve v artérii k ploše průtokového ústí (lumen artérie) [46]. Se zužováním cévy při spasmu dochází ke zrychlení průtokových rychlostí. Vyšetření z temporálního okna umožňuje vyšetřit arteria cerebri media (ACM), arteria cerebri anterior (ACA), podobně lze z orbitálního okna vyšetřit intrakraniální část vnitřní karotidy (ACI) a z foraminálního okna suboccipitálně arteria cerebri posterior (ACP), vertebrální (AV) a bazilární (AB) tepnu. Submandibulárně lze vyšetřit extrakraniální část ACI. TCD obvykle vyšetřujeme druhý den po SAH pro získání referenčních parameterů. Kontrolní TCD měření pokračuje po prvních 14 dní. Vazospastická ACM má obvykle rychlosti nad 120 cm/s [47], rychlosti nad 200 cm/s asociují s průměrem ACM pod 1 mm (normální průměr ACM je 3 mm). Nižších rychlostí pro diagnózu je třeba pro ACA, pro AV a AB již nad 80–95 cm/s. TCD má senzitivitu 38–91% a specificitu 94–100% pro detekci vazospasmu na ACM. Extrakraniální vyšetření cervikální ACI je důležité pro stanovení Lindegaardova indexu zohledňujícího průtok mozkovými tepnami vůči průtoku extrakraniálně. Nejvyšší rychlost intrakraniálně je v čitateli indexu a nejvyšší rychlost na stejnostranné extrakraniální ACI je ve jmenovateli indexu. Lindegaardův index [47] je normálně 1,7 ± 0,4 [48] a s ohledem na anatomické odchylky v populaci je důležité stanovit individuální výši tohoto indexu před obdobím vazospasmů. ACM/cervikální ACI index nad 3 implikuje středně významný proximální ACM vazospasmus, index nad 6 asociuje s těžkým vazospasmem. U AB je těžký vazospasmus již při indexu (vůči extrakraniální části AV) nad 3. Kompletní vyšetření ACM, ACI a ACA je výtěžnější než izolované vyšetření ACM.
U mozkového edému v rámci kraniocerebrálního poranění byl při hodnotách CPP pod 70 mm Hg nalezen vzestup v TCD indexu pulsatility (pulsatility index = [peak systolic velocity - end-diastolic velocity]/timed mean velocity). Podobně byl nacházen vztah umožňující odvodit CPP z TCD vyšetření [49], jehož přesnost závisí na korelaci ACM průtoků a celkových průtoků mozkem. Zhoršení reaktivity na změny pCO2 a ztráta tlakové autoregulace asociuje se špatným neurologickým výsledkem po kraniocerebrálním poranění [50]. TCD lze použít k měření reaktivity na změny CO2 reaktivity a tlakové autoregulace, což může intenzivistům umožnit upravit CPP a UPV pro individuálního pacienta.
Diagnóza mozkové smrti zahrnuje krátké systolické průtoky s obráceným nebo žádným průtokem v diastole nebo průtok není TCD detekovatelný vůbec. TCD má pro diagnózu mozkové smrti specificitu 98% a senzitivitu 75% [51], význam vyšetření v našich podmínkách je pro vyloučení částečného průtoku nad mozkovou bazí před zamýšlenou angiografií či scintigrafií.
Vyšetření žilního systému
Ultrazvukové vyšetření pro suspektní žilní trombózu spočívá ve verifikaci zachovaného lumen žíly a jeho náchylnost ke kolapsu při přímém tlaku sondou. V případě trombu lumen nekolabuje. Vyšetření pokračuje aplikací „duplexní sonografie“ neboli kombinací 2 modalit: barevného a pulzního „dopplera“. Po zaměření základních hodnot vyšetřující zvedne končetinu nebo zmáčkne periferii (lýtko) a sleduje odpověď v dopplerovském vyšetření. Chronický trombus je více echogenní, může být i centrálně rekanalizován. Tromby obvykle hledáme v oblasti dolních končetin, dolní duté žíly, jater a zkušený sonografista v oblasti pánve. V prostředí intenzivní péče však nacházíme významné procento trombóz i v oblasti horní hrudní apertury související s kanylacemi centrálního žilního systému. Recentní práce uvádějí až 18 % všech hlubokých žilních trombóz pochází z oblasti horních končetin [52].
Zavádění centrálních žilních katétrů a kardiostimulace pod kontrolou UZ
U pacientů s rizikem krvácení je na místě před rizikovou kanylací využít možnosti zaměření centrální žíly, např. pomocí lineární sondy. V ideálním případě takový postup ušetří pacienta transfuze destiček. Kanylaci lze provést pod přímou kontrolou UZ pomocí speciálního sterilního nástavce na sondu, do kterého se vkládá punkční jehla, nebo s nepřímou kontrolou, kdy kanylujeme po označení průběhu žíly (obr. 6). Problém při přímé kontrole je v transverzálním zaměření cévy, kdy kontrastní bod v žíle lze považovat za hrot, ale stejně dobře se může jednat o část jehly za hrotem.
Image 6. Levá vnitřní jugulární žíla přibližně na úrovni vrcholu větvení sternálního a klavikulárního úponu m.sterno cleidomastoideus, okrouhlé lumen pod ní a mediálně (z pohledu pacienta) je levá společná karotida. 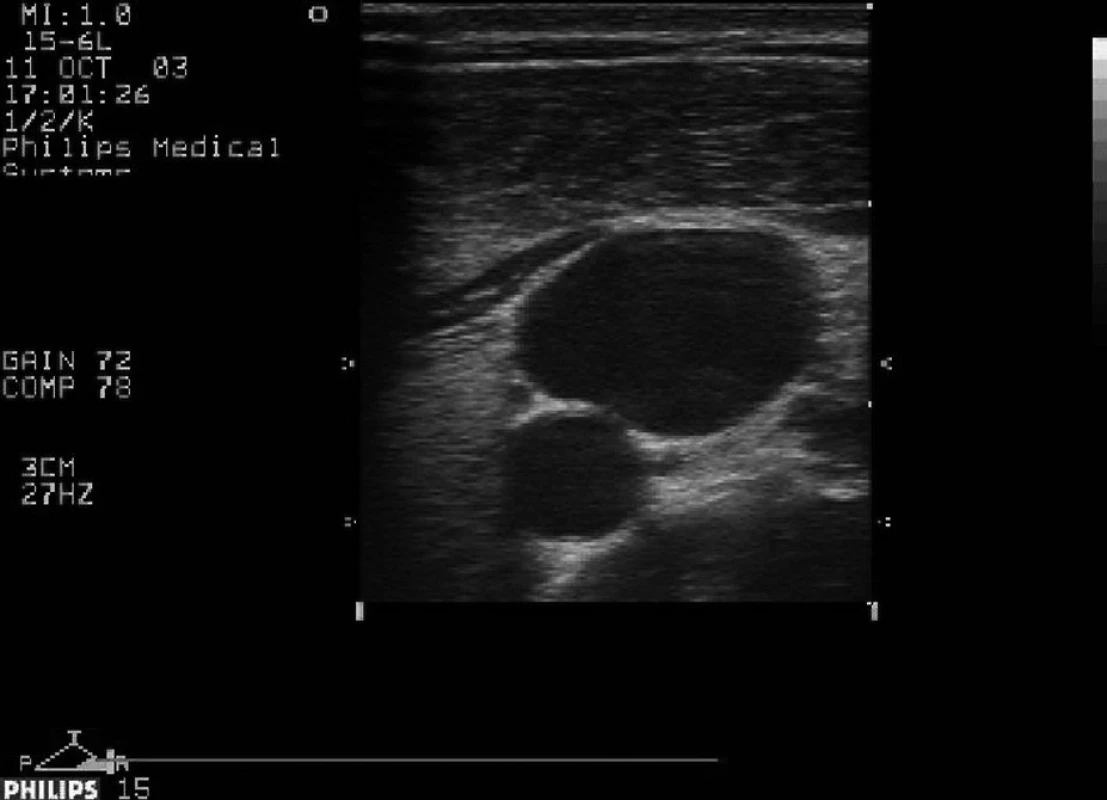
Důležitost zaměření, např. vnitřní jugulární žíly u rizikových pacientů, dokumentují anatomické práce nacházející tuto cévu na úrovni vrcholu větvení sternálního a klavikulárního úponu m. sternocleidomastoideus, přibližně v 5 % mediálně od společné karotidy, v 15 % před společnou karotidou, v 80 % laterálně od ní a s četností 0–9 % za ní [53]. Déletrvající kanylace pomocí ultrazvuku se tedy může vyplatit v podobě nižšího počtu komplikací [54].
Zavedení externí stimulace patří mezi základní dovednosti intenzivisty, na které někdy závisí přežití pacienta. Nasměrování bipolární elektrody přes trikuspidální chlopeň do hrotu pravé komory usnadňuje transtorakální echokardiografie, zvláště v apikální 4komorové projekci nebo v parasternální projekci na vtokový trakt pravé komory.
Periferní nervové blokády pod kontrolou UZ
Ultrazvuk ozřejmuje anatomické poměry a vede samotnou punkci a aplikaci lokálního anestetika u regionálních blokád. Lze tak dosáhnout úspěšnosti až 100% s redukcí času nutného k zavedení analgezie, redukci dávky anestetika a menší četnosti komplikací. To je výhodou u kriticky nemocných, dětí a u pacientů, kteří vyžadují kombinovanou blokádu (např. femorální a ischiadický blok).
Základem je poznání nervové tkáně a vizuální kontrola jehly. Diferenciace spíše hyperechogenního vaziva a šlach od hypoechogenních nervových kořenů a vláken vyžaduje správný úhel vyšetření a frekvenční nastavení sondy. Základem je obvykle vyšetření v krátké (transverzální ose). V dlouhé ose lze verifikovat šlachu jejím úponem do svalové či kostní tkáně. Dávka anestetika je řízena v optimálním případě vizuálně dosažením kompletního obtečení nervové tkáně pomocí „V techniky“, tj. aplikací anestetika k jedné straně nervu a po povytažení jehly k druhé straně [55].
Závěr
Pořizovací cena multimodálního ultrazvukového přístroje je značná. Tento přístroj však v rukou erudovaného intenzivisty může zachránit život pacienta a ušetřit čas, komplikace a peníze celému oddělení. Výstupy rozsáhlého spektra vyšetření jsou okamžitě aplikovány lékařem, který vyšetření provádí, pacient je ušetřen často komplikovaného transportu na CT, radiační a kontrastní zátěže. Současný rozvoj ultrazvukových metod v intenzivní péči slibuje další aplikace v dosud neprobádaných oblastech. Tento článek nabízí přehled ultrazvukových aplikací, které budou vyžadovat další výzkum a zavádění protokolů, které dnes nelze odvodit z běžných postupů v radiologii.
Adresa pro korespondenci:
MUDr. Martin Balík, Ph.D.
KARIM VFN
U Nemocnice 2
120 00 Praha 2
e-mail: martin.balik@vfn.cz
Sources
1. Balík, M. Echokardiografie u kriticky nemocného. Anesteziologie a Intenzivní Medicína, 2006, 17, s. 116–122.
2. Colreavy, F. B., Donovan, K., Lee, K. Y., Weekes, J. Transesophageal echocardiography in critically ill patients. Crit. Care Med., 2002, 30, p. 989–996.
3. Poelaert, J., Trouerbach, J., De Buyzere, M., Everaert, J., Colardyn, F. A. Evaluation of Transesophageal Echocardiography as a Diagnostic and Therapeutic Aid in a Critical Care Setting. Chest, 1995, 107, p. 774–779.
4. Benjamin, E., Griffin, K., Leibowitz, A. B., Manasia, A., Oropello, J. M., Geffroy, V., DelGiudice, R., Hufanda, J., Rosen, S., Goldman, M. Goal-directed Transesophageal echocardiography performed by intensivists to assess left ventricular function: comparison with pulmonary artery catheterization. J. Cardiothorac. Vasc. Anesth., 1998, 12, p. 10–15.
5. Balik, M., Pazout, J., Fric, M., Sidak, M. Echokardiografie jako součást managementu hemodynamiky v intenzivní péči. Anesteziologie a neodkladná péče, 2001, 12, p. 120–124.
6. Vincent, J. L., Dhainaut, J. F., Perret, C., Suter, P. Is the pulmonary artery catheter misused? A European view. Crit. Care Med., 1998, 26, p. 1283–1287.
7. Lichtenstein, D., Lascols, N., Meziere, G., Gepner, A. Ultrasound diagnosis of alveolar consolidation in critically ill. Intensive Care Med., 2004, 30, p. 276–281.
8. Lichtenstein, D., Menu, Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill: lung sliding. Chest, 1995, 108, p. 1345–1348.
9. Balik, M., Plasil, P., Waldauf, P., Pazout, J., Fric, M., Otahal, M., Pachl, J. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med., 2006, 32, p. 318–321.
10. Sahn, S. A. Pleural disease in critically ill patient. In Irwin, R. S., Cerra, F. B., Rippe, J. M. (eds) Intensive Care Med. Lippincott Raven : Philadelphia, 1999, p. 710–727.
11. Coppage, L., Jolles, H., Henry, D. A. Imaging of the chest in the intensive care setting. In: Shoemaker, W. C., Ayres, S. M., Grenvik, A., Holbrook, P. R. (eds) Textbook of critical care. Saunders : Philadelphia, 1995, p. 332–347.
12. Eibenberger, K. L., Dock, W. I., Ammann, M. E., Dorffner, R., Hormann, M. F., Grabenwoger, F. Quantification of pleural effusions: sonography versus radiography. Radiology, 1994, 191, p. 681–684.
13. Mayo, P. H., Goltz, H. R., Tafreshi, M., Doelken, P. Safety of Ultrasound-Guided Thoracentesis in Patients Receiving Mechanical Ventilation. Chest, 2004, 125, p. 1059–1062.
14. Jones, P. W., Moyers, J. P., Rogers, J. T., Rodriguez, R. M., Lee, G., Light, R. W. Ultrasound-Guided Thoracentesis 2003. Is It a Safer Method? Chest, 123, p. 418–423.
15. Fartoukh, M., Azoulay, E., Galliot, R. et al. Clinically Documented Pleural Effusions in Medical ICU Patients. How Useful Is Routine Thoracentesis? Chest, 2002, 121, p. 178–184.
16. Barterr, T. The Evaluation of Pleural Effusion. Chest, 1994, 106, p. 1209–1214.
17. Lichtenstein, D., Hulot, J. S., Rabiller, A., Tostivint, I., Meziere Feasibility and safety of ultrasound-aided thoracentesis in mechanically ventilated patients. Intensive Care Med., 1999, 25, p. 955–958.
18. Gattinoni, L., Vagginelli, F., Chiumello, D.,Taccone, P., Carlesso, E. Physiologic rationale for ventilator setting in acute lung injury/acute respiratory distress syndrome patients. Crit. Care Med., 2003, 31, p. S300–S304.
19. Ahmed, S. H., Ouzounian, S. P., DiRusso, S., Sullivan, T., Savino, J., Del Guercio, L. Hemodynamic and Pulmonary Changes after Drainage of Significant Pleural Effusions in Critically Ill, Mechanically Ventilated Surgical Patients. J. Trauma, 2004, 57, p. 1184–1188.
20. Talmor, M., Hydo, L., Gershenwald, J. G., Barie, P. S. Beneficial effects of chest tube drainage of pleural effusion in acute respiratory failure refractory to PEEP ventilation. Surgery, 1998, 123, p. 137–143.
21. Vignon, P., Chastagner, C., Berkane, V. et al. Quantitative assessment of pleural effusion in critically ill patients by means of ultrasonography. Crit. Care Med., 2005, 33, p. 1757–1763.
22. Roch, A., Bojan, M., Michelet, P. et al. Usefulness of Ultrasonography in Predicting Pleural Effusions > 500 ml in Patients Receiving Mechanical Ventilation. Chest, 2005, 127, p. 224–232.
23. Tocino, I. M., Miller, M. H., Fairfax, W. R. Distribution of pneumothorax in the supine and semirecumbent critically ill adult. Am. J. Roentgenol., 1985, 144, p. 901–905.
24. McGonigal, M. D., Schwab, C. W., Kauder, D. R. et al. Supplemented emergent chest CT in the management of blunt torso trauma. J. Trauma, 1990, 30, p. 1431–1435.
25. Lichtenstein, D., Meziere, G., Biderman, R. et al. The lung point: an ultrasound sign specific to pneumothorax. Intensive Care Med., 2000, 26, p. 1434–1440.
26. Tsubo, T. Intensive Care Med., 2001, 27, p. 1881–1886.
27. Lichtenstein, D., Meziere, G., Biderman, R. et al. The comet-tail artifact: an ultrasound sign of alveolar-intersticial syndrome. Am. J. Respir. Crit. Care Med., 1997, 156, p. 1640–1646.
28. Lichtenstein, D., Meziere, G. Ultrasound diagnosis of an acute dyspnea. Crit. Care, 2003, 7, p. S93.
29. Maull, K. I., Reath, D. B. Pneumogastrography in the diagnosis of perforated peptic ulcer. Am. J. Surg., 1984, 148, p. 340–345.
30. Roh, J. J., Thompson, J. S., Hamed, R. K. et al. Value of pneumoperitoneum in the diagnosis of visceral perforation. Am. J. Surg., 1983, 146, p. 830–833.
31. Chen, S. C., Yen, Z. S., Wang, H. P. et al. Ultrasonography is superior to plain radiography in the diagnosis of pneumoperitoneum. Br. J. Surg., 2002, 89, p. 351–354.
32. Chen, S. C., Wang, H. P., Chen, W. J. et al. Selective use of ultrasonography for the detection of pneumoperitoneum. Acad. Emerg. Med., 2002, 9, p. 643–645.
33. Ralls, P. W., Colletti, P. M., Lapin, S. A. et al. Realtime sonography in suspected acute cholecystitis: Prospective evaluation of primary and secondary signs. Radiology, 1985, 155, p. 767–771.
34. Kadir, S. Teaching Atlas of Interventional Radiology: Non-Vascular Interventional Procedures. Thieme : New York, 2005.
35. Malecka-Panas, E., Juszynski, A., Chrzastek, J. et al. Pancreatic fluid collections: Diagnostic and therapeutic implications of percutaneous drainage guided by ultrasound. Hepatogastroenterology, 1998, 45, p. 873–878.
36. Platt, J. F. Doppler ultrasound of the kidney. Semin Ultrasound, 1997, 18, p. 22–26.
37. Sugrue, M., Jones, F., Deane, S. A. et al. Intraabdominal hypertension is an independent cause of postoperative renal impairment. Arch. Surg., 1999, 134, p. 1082–1085.
38. Kirkpatrick, A. W., Colistro, R., Fox, D. L. et al. Renal arterial resistive index response to intra-abdominal hypertension in a porcine model. Crit. Care Med., 2007, 35, p. 320–321.
39. Maio, R. F., Burney, R. E., Gregor, M. A. et al. A study of preventable trauma mortality in rural Michigan. J. Trauma, 1996, 41, p. 83–90.
40. Papadopoulous, I. N., Bukis, D., Karalas, E. et al. Preventable prehospital trauma deaths in a Hellenic urban health region: An audit of prehospital trauma care. J. Trauma, 1996, 41, p. 864–869.
41. Esposito, T. J., Sanddal, N. D., Hansen, J. D. et al. Analysis of preventable trauma deaths and inappropriate trauma care in a rural state. J. Trauma, 1995, 39, p. 955–962.
42. Scalea, T. M., Rodriguez, A., Chiu, W. C. et al. Focused assessment with sonography for trauma (FAST): Results from an international consensus conference. J. Trauma, 1999, 46, p. 466–472.
43. Wherrett, L. J., Boulanger, B. R., McLellan, B. A. et al. Hypotension after blunt abdominal trauma: The role of emergent abdominal sonography in surgical triage. J. Trauma, 1996, 41, p. 815–820.
44. Sustic, A., Zupan, Z., Esskinja, N. et al. Ultrasonography guided percutaneous tracheostomy with dilatation forceps after anterior cervical spine fixation. Acta Anaesthesiol. Scand., 1999, 43, p. 1078–1080.
45. Bleck, T. P. Rebleeding and vasospasm after SAH: New strategies for improving outcome. J. Crit. Illn., 1997, 12, p. 572–582.
46. Seiler, R., Grolimund, P., Huber, P. Transcranial Doppler sonography: An alternative to angiography in the evaluation of vasospasm after subarachnoid hemorrhage. Acta Radiol. Suppl., 1986, 369, p. 99–102.
47. Lindegaard, K. F., Nornes, H., Bakke, S. J. et al. Cerebral vasospasm diagnosis by means of angiography and blood velocity measurements. Acta Neurochir. (Wien), 1989, 100, p. 12–24.
48. Aaslid, R., Markwalder, T. M., Nornes, H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries. J. Neurosurg., 1982, 57, p. 769–774.
49. Steiner, L. A., Balestreri, M., Johnston, A. J. et al. Sustained moderate reductions in arterial CO2 after brain trauma time-course of cerebral blood flow velocity and intracranial pressure. Intensive Care Med., 2004, 30, p. 2180–2187.
50. Lee, J. H., Kelly, D. F., Oertel, M. et al. Carbon dioxide reactivity, pressure autoregulation, and metabolic suppression reactivity after head injury: A transcranial Doppler study. J. Neurosurg., 2001, 95, p. 222–232.
51. Dosemeci, L., Dora, B., Yilmaz, M. et al. Utility of transcranial Doppler ultrasonography for confirmatory diagnosis of brain death: Two sides of the coin. Transplantation, 2004, 77, p. 71–75.
52. Blaivas, M. Ultrasound in the detection of venous thromboembolism. Crit. Care Med., 2007, 35, p. S224–S234.
53. Maecken, T., Grau, T. Ultrasound imaging in vascular access. Crit. Care Med., 2007, 35, p. S178–S185.
54. Randolph, A., Cook, D., Gonzales, C. et al. Ultrasound guidance for placement of central venous catheters: A meta-analysis of the literature. Crit. Care Med., 1996, 24, p. 2053–2058.
55. Wiebalck, A., Grau, T. Ultrasound imaging techniques for regional blocks in intensive care patients. Crit. Care Med., 2007, 35, p. 268–274.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2008 Issue 1-
All articles in this issue
- Některé aspekty molekulární biologie kriticky nemocných v kontextu současné laboratorní medicíny
- Nové trendy v klinickém výzkumu mikrocirkulace
- Je léčba inhibitory krevního srážení u pacientů se sepsí vhodná, či nikoli?
- Novinky v UPV v pediatrii
- Novinky v oblasti prevence, diagnostiky a léčby nozokomiální pneumonie ventilovaných nemocných
- Novinky v nefrologii u kriticky nemocných
- Očišťovací metody a akutní selhání ledvin – načasování, výběr metody a dávka RRT
- Neuromonitorování nemocných s kraniotraumaty
- Polyneuropatie a myopatie kriticky nemocných – co je nového?
- Současné léčebné postupy v dětské sepsi
- Postup u těžké formy akutní pankreatitidy – současný stav
- Využití ultrasonografie u kriticky nemocného
- Pokroky umělé výživy v intenzivní péči – orgánově specifické substráty
- Nerozšiřování a omezování léčby na resuscitačním oddělení – francouzský přístup
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postup u těžké formy akutní pankreatitidy – současný stav
- Polyneuropatie a myopatie kriticky nemocných – co je nového?
- Současné léčebné postupy v dětské sepsi
- Očišťovací metody a akutní selhání ledvin – načasování, výběr metody a dávka RRT
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

