-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou ako príčina akútnej encefalopatie
Steroid responsive encephalopathy associated with autoimmune thyroiditis as a cause of acuteencephalopathy
Steroid-responsive encephalopathy associated with autoimmune thyroiditis (SREAT), known as Hashimoto’s encephalopathy (HE), represents a heterogeneous group of neurological and neuropsychiatric symptoms associated with a presence of antithyroid antibodies in case of other causes of encephalopathy were excluded. Clinical symptoms most commonly includes acute onset of encephalopathy, behaviour changes and cognitive dysfunction, epileptic seizures as well as cerebellar and extrapyramidal symptoms. Corticoids provides rapid and sustained therapeutic benefit in most patients and only a few patients require other immunosuppressive therapy such as plasmapheresis, intravenous immunoglobulins, or others. We present the cases of two patients with acute onset of encephalopathy, status epilepticus based on SREAT, with rapid improvement after steroid treatment.
Keywords:
Steroid therapy – SREAT – status epilepticus
Autoři: Milan Maretta 1; Alexandra Lacková 1; Hedviga Wagnerová 2; Eva Feketeová 1; Zuzana Gdovinová 1
Působiště autorů: Neurologická klinika UPJŠ LF a UN LP v Košiciach 1; I. interná klinika UPJŠ LF a UN LP v Košiciach 2
Vyšlo v časopise: Vnitř Lék 2023; 69(E-5): 25-29
Kategorie: Kazuistiky
doi: https://doi.org/10.36290/vnl.2023.068Souhrn
Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou (SREAT) označovaná ako aj Hashimotova encefalopatia (HE) predstavuje heterogénne ochorenie s neurologickými a neuropsychiatrickými príznakmi, pri laboratórnom náleze protilátok proti štítnej žľaze a absencii inej príčiny encefalopatie. V klinickom náleze sa najčastejšie stretávame s akútnym vznikom encefalopatie pod obrazom porúch pamäti a správania, prítomnosťou epileptických záchvatov ako aj cerebelárnej alebo extrapyramídovej symptomatológie. U väčšiny pacientov pozorujeme dobrý efekt kortikoidov (metylprednisolon, prednison) s rýchlou úpravou stavu, a len malá časť pacientov vyžaduje inú imunosupresívnu terapiu (plazmaferéza, intravenózne imunoglobulíny). V práci prezentujeme prípady dvoch pacientok s akútnym rozvojom encefalopatie, status epilepticus na poklade SREAT, s úpravou stavu po kortikoidnej terapii.
Klíčová slova:
kortikoidy – SREAT – status epilepticus
Úvod
Hashimotova encefalopatia (HE) bola prvýkrát opísaná v roku 1966 v prípade 48-ročného pacienta s prejavmi encefalopatie prejavujúcej sa poruchou správania, zmätenosťou, poruchou vedomia a elektroencefalografickými abnormalitami s anamnézou Hashimotovej choroby (1). Vzhľadom na pozitívny vplyv kortikoidnej liečby sa v súčasnosti preferuje označenie steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou (steroid responsive encephalopathy associated with autoimmune thyreoiditis; SREAT) (2). Toto zriedkavé ochorenie postihuje častejšie ženy v šiestej dekáde života, s prevalenciou približne 2,1/100 000 (3). Manifestácia SREAT je variabilná, ochorenie sa prejavuje širokou škálou neurologických príznakov od akútne vzniknutých porúch správania, pamäti, epileptických záchvatov až po extrapyramídové prejavy ako je chorea, opsoklonus alebo myoklonus.
Vzhľadom na rozmanitý klinický obraz a kombináciu pyramídovej, extrapyramídovej a cerebelárnej symptomatológie môže toto ochorenie svojimi príznakmi napodobňovať aj priebeh Creutzfeldtovej-Jakobovej choroby (CJD) (4–7). U tretiny pacientov sú prítomné aj psychiatrické symptómy v podobe epizód psychózy, bipolárnej afektívnej poruchy alebo demencie (8–10). V diferenciálnej diagnostike akútnych stavov zmätenosti by sme preto spoločne s inými neurologickými alebo psychiatrickými ochoreniami mali uvažovať aj nad SREAT ako možnou príčinou encefalopatie. V práci prezentujeme dva prípady pacientok, u ktorých sme na základe klinického obrazu stanovili diagnózu SREAT so zlepšením stavu po kortikoidnej terapii.
Opis prípadu 1
59-ročná pacientka liečená na arteriálnu hypertenziu, bez anamnézy ochorenia štítnej žľazy bola prijatá na Neurologickú kliniku UPJŠ LF a UNLP pre stav po poruche vedomia a pravostrannú slabosť končatín. Pre výrazný psychomotorický nepokoj jej bol rýchlou lekárskou pomocou (RLP) podaný midazolam za účelom sedácie. Anamnesticky rodina pacientky udávala postupný, približne trojmesačný, vývoj porúch pamäte. Náhla progresia stavu nastala dva týždne pred hospitalizáciou, keď pacientka prekonala generalizovaný tonicko-klonický epileptický záchvat s následným rozvojom poruchy správania a dezorientáciou. Pacientka vtedy s hospitalizáciou nesúhlasila. Ambulantne bolo realizované elektroencefalografické (EEG) vyšetrenie, ktoré epileptické grafoelementy neodhalilo. Pri príjme na jednotku intenzívnej starostlivosti neurologickej kliniky bola pacientka kardiálne kompenzovaná, hypotenzná (95/60 mm Hg), tachykardická (110/min), afebrilná. Vstupné laboratórne vyšetrenie odhalilo eleváciu zápalových parametrov (CRP 28 mg/l), leukocytózu (14˄10×9) s neutrofíliou (82 %), ľahkú hypokaliémiu (3,4 mmol/l), hraničnú hypochloremickú (96,4 mmo/l) hyponatriémiu (134,8 mmol/l). Po doznení sedatívneho účinku midazolamu bol prítomný psychomotorický nepokoj, dezorientácia, v neurologickom náleze dominovali zmiešané fatické poruchy a pravostranná lateralizácia. CT vyšetrenie mozgu neodhalilo prítomnosť čerstvých ložiskových zmien. Po stabilizácii stavu bolo doplnené MRI vyšetrenie mozgu, ktoré odhalilo prítomnosť obojstranných splývavých hyperintenzívnych (T2W, FLAIR) lézií, lokalizovaných supratentoriálne (fronto-temporo-parietálne) ako aj infratentoriálne v oblasti mezencefala aj mozočka (Obr. 1). Nález mal charakter difúznej leukoencefalopatie, čerstvé ischemické zmeny prítomné neboli. EEG vyšetrenie neodhalilo prítomnosť špecifických epileptických grafoelementov.
Vyšetrenie mozgovo-miechového moku preukázalo zvýšenú hladinu bielkovín (proteinorachia 1 702 mg/l; norma 150 – 450 ml/l) bez prítomnosti bunkových elementov. Mikrobiologické vyšetrenie likvoru vylúčilo infekčný pôvod. Oligoklonálna syntéza imunoglobulínov bola pozitívna s prítomnými 4 pásmi v likvore aj v sére. Panel so zameraním na protilátky asociované s autoimunitnými encefalitídami (anti-NMDAR, anti-AMPA, anti-CASPR, anti-LG1, anti-GABAB-R) ako aj onkoskríning bol negatívny. Po úvodnom zlepšení neurologického nálezu na desiaty deň hospitalizácie pacientka prekonala generalizovaný tonicko-klonický epileptický záchvat, po ktorom perzistovala porucha vedomia, s rozvojom respiračnej insuficiencie. Stav sme hodnotili ako status epilepticus, bola nasadená protizáchvatová liečba levetiracetamom (3 g denne) a pacientka bola za účelom intenzívnej starostlivosti preložená na pracovisko anesteziológie a intenzívnej medicíny. Kontrolné EEG vyšetrenie potvrdilo nález regionálnej abnormity hemisferálne vľavo s ojedinelým výskytom komplexov hrot-vlna. Opakované vyšetrenie mozgovo-miechového moku potvrdilo perzistujúci obraz proteino-cytologickej disociácie (proteinorachia 1 859 mg/l). Laboratórne vyšetrenia realizované v rámci diferenciálnej diagnostiky odhalili pozitivitu protilátok proti štítnej žľaze (Tab. 1). Endokrinologické vyšetrenie potvrdilo novozistenú primárnu hypotyreózu na podklade autoimunitnej tyreoiditídy, indikovaná bola substitučná liečba levotyroxínom (50 μg denne).
Obr. 1. MRI nález difúznej leukoencefalopatie u pacientky so SREAT (vľavo axiálny rez, vpravo koronáry rez, FLAIR sekvencia) 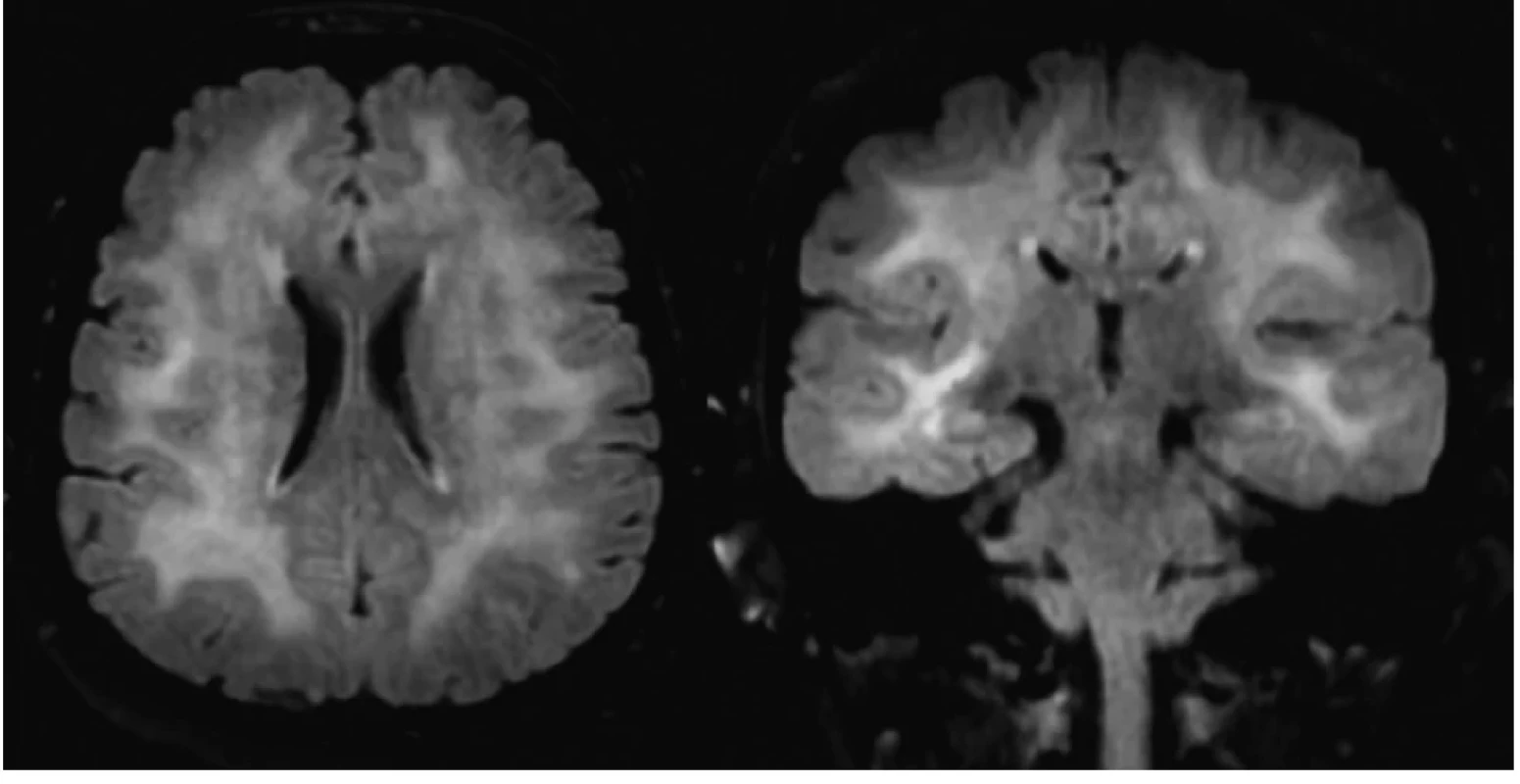
Tab. 1. Laboratórny nálezy u pacientov so SREAT 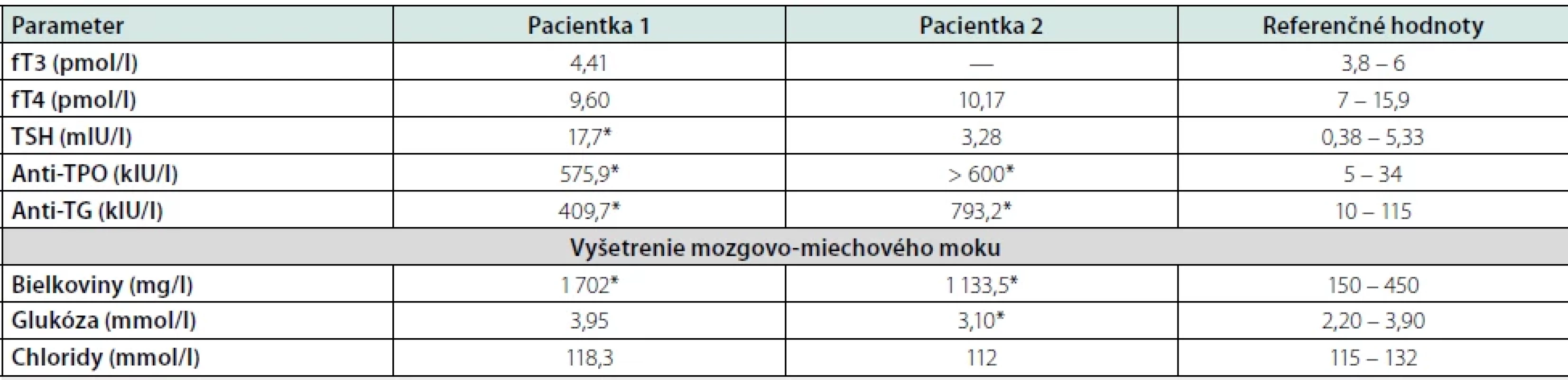
*patologická hodnota Vzhľadom na klinický obraz sme suponovali diagnózu SREAT, iniciovali sme pulznú liečbu metylprednisolonom v dávke 1 g/denne po dobu piatich dní, s následným prechodom na per os formu prednisonu (60 mg denne) s postupným vysadzovaním v priebehu štyroch mesiacov. Kontrolné EEG vyšetrenie po pulznej liečbe metylprednisolonom bolo bez prítomnosti špecifickej epileptickej aktivity. Pri kontrolnom laboratórnom vyšetrení klesli hladiny antityreoidálnych protilátok (anti-TPO 258,4 kIU/l; anti-TG 98,5 kIU/l). Pri prepustení bol neurologický nález upravený, bez rekurencie porúch vedomia, pacientka bola pri vedomí, správne orientovaná, bez porúch reči, bez fokálneho neurologického deficitu. Pacientka bola po prepustení sledovaná ambulantne, bez rekurencie záchvatovej aktivity, postupne sme redukovali až následne ukončili protizáchvatovú liečbu. MRI vyšetrenie mozgu s odstupom štyroch mesiacov odhalilo kompletnú regresiu difúznej leukoencefalopatie (Obr. 2).
Opis prípadu 2
59-ročná pacientka s negatívnym predchorobím bola prijatá na Neurologickú kliniku UPJŠ LF a UNLP pre štyri dni trvajúce poruchy reči. Pacientka pri príjme bola kardiálne kompenzovaná, normotenzná, afebrilná, bez EKG zmien, laboratórny skríning neodhalil patologický nález. V neurologickom náleze boli prítomné fatické poruchy charakteru anomickej afázie, bez lateralizácie na končatinách. Vstupné CT vyšetrenie mozgu prítomnosť čerstvých ložiskových zmien neodhalilo. Doplnené MRI vyšetrenie mozgu nepotvrdilo prítomnosť čerstvých ischemických zmien, alebo lézií bielej hmoty mozgu. Počas hospitalizácie sme zaznamenali rozvoj dezorientácie, halucinácií a prejavov kortikálnej dysfunkcie (dysgrafia, dyskalkúlia). Vzhľadom na klinický nález sme doplnili vyšetrenie mozgovo-miechového moku, s nálezom proteino-cytologickej disociácie (proteinorachia 1 133 mg/l), bez prítomnosti bunkových elementov (Tab. 1). Likvorologický nález vylúčil neuroinfekciu. Intratekálna oligoklonálna syntéza imunoglobulínov v likvore nebola dokázaná. V diferenciálnej diagnostike CJD nebola potvrdená génová mutácia E200K. Laboratórny skríning na prítomnosť paraneoplastických protilátok bol negatívny. EEG vyšetrenie zobrazilo difúzne abnormálny záznam nešpecifického charakteru, špecifické epileptické grafoelementy neboli prítomné. V laboratórnom vyšetrení boli prítomné antityreoidálne (anti-TPO, anti-TG) protilátky (Tab. 1). Ultrasonografické vyšetrenie zobrazilo nodóznu strumu pravého laloka štítnej žľazy, endokrinológom bola nasadená suplementačná liečba tyroxínom (50 μg denne). Na základe klinického obrazu sme vyslovili podozrenie na SREAT, iniciovali sme liečbu metylprednisolonom v celkovej dávke 5 g (1 g/deň) s prechodom na per os formu prednisonu (60 mg denne) s postupnou redukciou dávky počas dvoch mesiacov. Kontrolné EEG vyšetrenie, po kortikoidnej liečbe, potvrdilo regresiu nešpecifických difúznych EEG abnormalít. Počas hospitalizácie sme pozorovali zlepšenie neurologického nálezu v zmysle regresie kortikálnej dysfunkcie a psychiatrických symptómov. Pri prepustení pacientka bola pri vedomí, orientovaná, bez fokálneho neurodeficitu. U pacientky sme počas dispenzarizácie v našej ambulancii nezaznamenali rekurenciu neurologických alebo psychiatrických symptómov.
Obr. 2. Kontrolné MRI vyšetrenie mozgu (po 4 mesiacoch) odhaľuje regresiu prejavov difúznej leukoencefalopatie (vľavo koronárny rez, vpravo axiálny rez; FLAIR sekvencia) 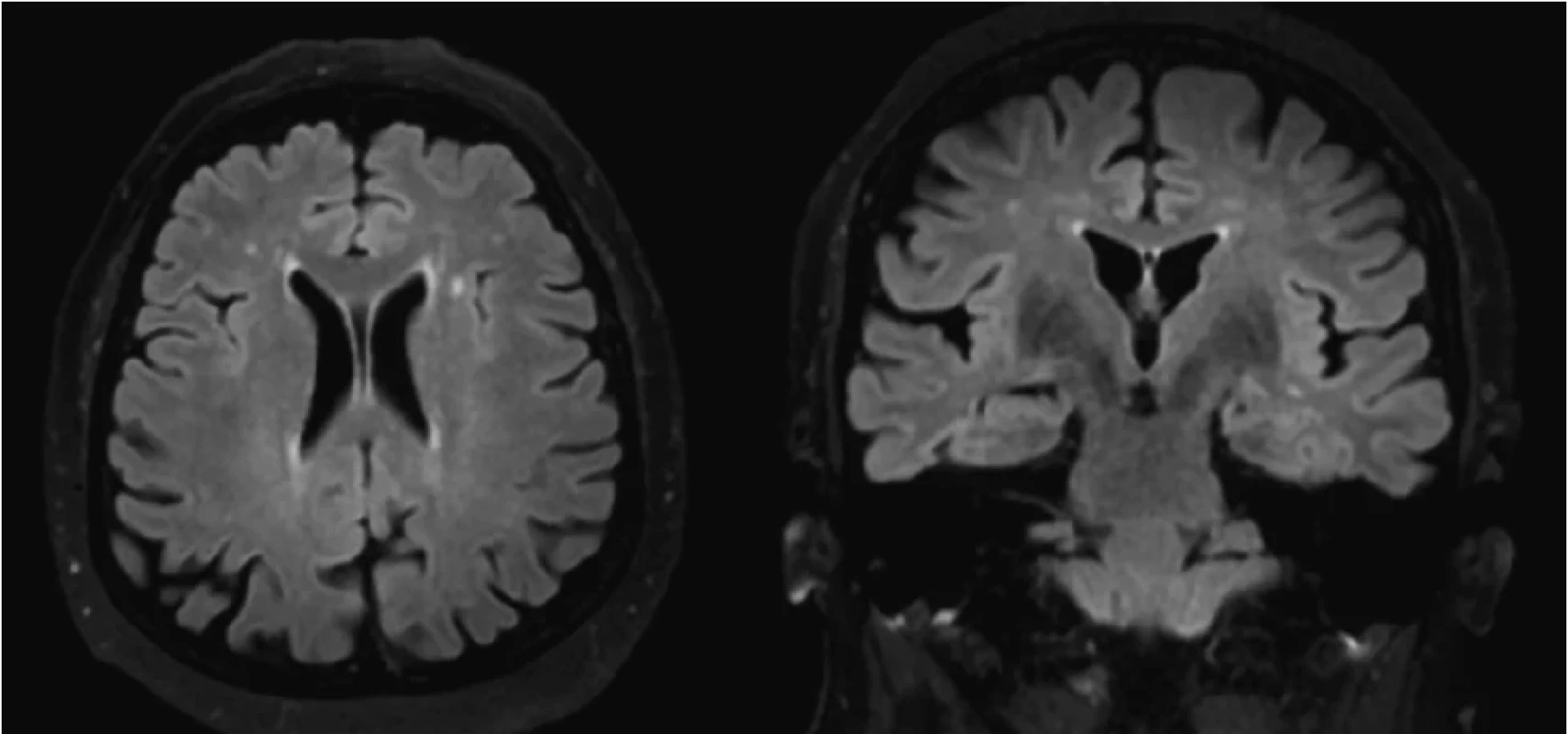
Diskusia
SREAT, pôvodne označovaná aj ako Hasimotova encefalopatia, je aj v súčasnosti pre niektorých autorov kontroverzná téma, a to z viacerých pohľadov (11–12). V prvom rade, protilátky proti štítnej žľaze, ktoré sú prítomné u pacientov so SREAT, sa často vyskytujú aj v zdravej populácii, pričom ich výskyt stúpa s vekom a autori zároveň poukazujú na fakt, že nebola zistená korelácia medzi ich hodnotou a závažnosťou klinického obrazu u pacientov so SREAT (13). Súčasne väčšina pacientov v čase manifestácie encefalopatie nemá poruchu funkcie štítnej žľazy a SREAT sa môže manifestovať aj bez ohľadu na aktuálny hormonálny status (14). Mattozzi (12) prezentoval súbor 24 pacientov, ktorí spĺňali kritériá pre SREAT, z ktorých len 34 % dosiahlo zlepšenie stavu po kortikoidnej liečbe, a títo pacienti mali hladiny anti-TPO protilátok porovnateľné s pacientami s inými autoimunitnými neurologickými ochoreniami ako je sclerosis multiplex, neuromyelitis optica alebo autoimunitná encefalitída (12). Na druhej strane, práve dobrá terapeutická odpoveď na kortikoidy (a inú imunosupresívnu liečbu) u väčšiny pacientov naznačuje autoimunitný poklad ochorenia. V roku 2016 boli navrhnuté diagnostické kritériá HE (SREAT), podľa ktorých musia byť splnené všetky podmienky na stanovanie diagnózy, medzi ktoré patrí aj prítomnosť anti-TPO a anti-TG protilátok a absencia iných neuronálnych protilátok, ktoré sú asociované napríklad s autoimunitnými encefalitídami. Súčasne musí byť vylúčená iná príčina vzniku encefalopatie (Tab. 1).
Patogenéza vzniku SREAT nie je úplne objasnená, nepredpokladá sa však vplyv hormónov vo vzťahu k manifestácii ochorenia, keďže väčšina pacientov v čase klinických symptómov nemá prítomnú poruchu funkcie štítnej žľazy. Práve prítomnosť protilátok proti štítnej žľaze a následná regresia klinického ako aj rádiologického nálezu po imunosupresívnej liečbe podčiarkuje možný autoimunitný podklad, pričom protilátky sú skôr považované za markery autoimunitného procesu, ako za etiologický agens (16). Napriek vysokým hladinám týchto protilátok zistených v likvore aj v sére pacientov so SREAT, nebola ich prítomnosť potvrdená v nervovom systéme (17).
Klinická manifestácia je pomerne variabilná, najčastejšie sa stretávame s epileptickými záchvatmi (47 %), zmätenosťou a poruchami pamäte (46 %), naopak izolovaná porucha pamäte alebo psychiatrické prejavy ako je depresia alebo paranoidná schizofrénia sú menej časté (11 % resp. 10 %) (18). Časový priebeh encefalopatie môže mať relaps-remitujúci (50 %) alebo progresívny priebeh (40 %) a podľa klinického prejavu sa SREAT môže manifestovať stroke-like epizódami s motorickým deficitom a poruchou vedomia (tzv. vaskulitický typ), alebo prejavy encefalopatie môžu mať progresívny priebeh s deterioráciou kognitívnych funkcií a epileptickými záchvatmi (19–21). V prípade našej prvej pacientky bola prítomná niekoľkomesačná anamnéza progresívnych porúch pamäte, ku ktorej sa pridružili epileptické záchvaty s následnou dezorientáciou a poruchy správania s rozvojom refraktérneho status epilepticus. Status epilepticus nie je častý prejav SREAT (12 %), na druhej strane, epileptické záchvaty sú prítomné u viac ako polovice (52 – 66 %) pacientov (22).
Ako už bolo spomenuté, jedným z predpokladov stanovenia diagnózy SREAT je prítomnosť protilátok proti štítnej žľaze (anti-TPO, anti-TG) v čase manifestácie ochorenia. Približne tri štvrtiny pacientov (69 %) majú zvýšené hladiny anti-TPO aj anti-TG protilátok, u tretiny (34 %) pacientov boli prítomné vyššie hodnoty anti-TPO protilátok, a len 7 % pacientov má izolované zvýšenie hodnôt protilátok proti tyreoglobulínu (7 %). Porucha funkcie štítnej žľazy je prítomná u približne tretiny pacientov (32 %; 80/248), najčastejšie pod obrazom hypotyreózy (18). Avšak aj samotná prítomnosť protilátok nám diagnózu SREAT neurčuje, keďže ich prítomnosť môžeme odhaliť u tretiny žien vo veku nad 60 rokov, a preto pri absencii klinickej symptomatológie a prejavov SREAT musíme ich laboratórne potvrdenie brať s opatrnosťou (13). Obidve nami prezentované pacientky mali v čase prejavov SREAT zaznamenané abnormálne hladiny anti-TPO a anti-TG protilátok a kortikoidná liečba viedla následne k poklesu týchto hodnôt u jednej pacientky. Podobný nález bol prítomný v literatúre u väčšiny sledovaných pacientov, kde úprava neurologickej dysfunkcie bola spojená s poklesom hladín antityreoidálnych protilátok, avšak samotný klinický obraz nie je závislý od ich hodnôt (18, 22).
Vzhľadom na absenciu jednoznačných markerov SREAT, ktoré by nám jednoznačne potvrdili diagnózu, pri jej stanovení musíme v prvom rade vylúčiť iné príčiny encefalopatie (infekčné, paraneoplastické, autoimunitné encefalopatie, štrukturálne poškodenie mozgu), v čom nám pomáha vyšetrenie mozgovo-miechového moku a neurozobrazovacie vyšetrenie mozgu. Likvorologický nález u pacientov so SREAT je nešpecifický, najčastejším nálezom je zvýšená hladina bielkovín v likvore (hyperproteinorachia), u pätiny pacientov je dokázaná aj prítomnosť bunkových elementov (priemerne 8 buniek/mm3) (18). Podobne ako v sére, boli aj v likvore zaznamenané vyššie hladiny protilátok (23/53), ale táto kvantifikácia nemusí byť relevantná vzhľadom na absenciu štandardných vyšetrovacích metód týchto protilátok v likvore (18). V prípade našich pacientok nebolo možné laboratórne stanoviť ich hladiny v mozgovo-miechovom moku. Neurozobrazovacie vyšetrenie mozgu má za úlohu vylúčiť iné príčiny encefalopatie. Podobne ako v prípade vyšetrenia likvoru, je aj neurozobrazovací nález u pacientov so SREAT nešpecifický a môže zahŕňať prítomnosť demyelinizačných lézií bielej hmoty mozgu aj v difúznej forme, pod obrazom leukoencefalopatie. Polovica pacientov však nemá abnormálny MRI nález (18, 20–21). Popisované zmeny sú často reverzibilné s ich regresiou po kortikoidnej liečbe (23–24). Takýto priebeh ochorenia a MRI nálezu bol typický aj v prípade našej pacientky, kde vstupné MRI vyšetrenie odhalilo difúzne prejavy leukoencefalopatie, s kompletnou regresiou po kortikoidnej liečbe s odstupom troch mesiacov. Neurozobrazovací nález druhej pacientky bol negatívny na prítomnosť ložiskových zmien. Nielen vstupné, ale aj kontrolné neurozobrazovacie vyšetrenie, má význam v sledovaní priebehu ochorenia.
Tab. 2. Diagnostické kritéria Hashimotovej encefalopatie (15) 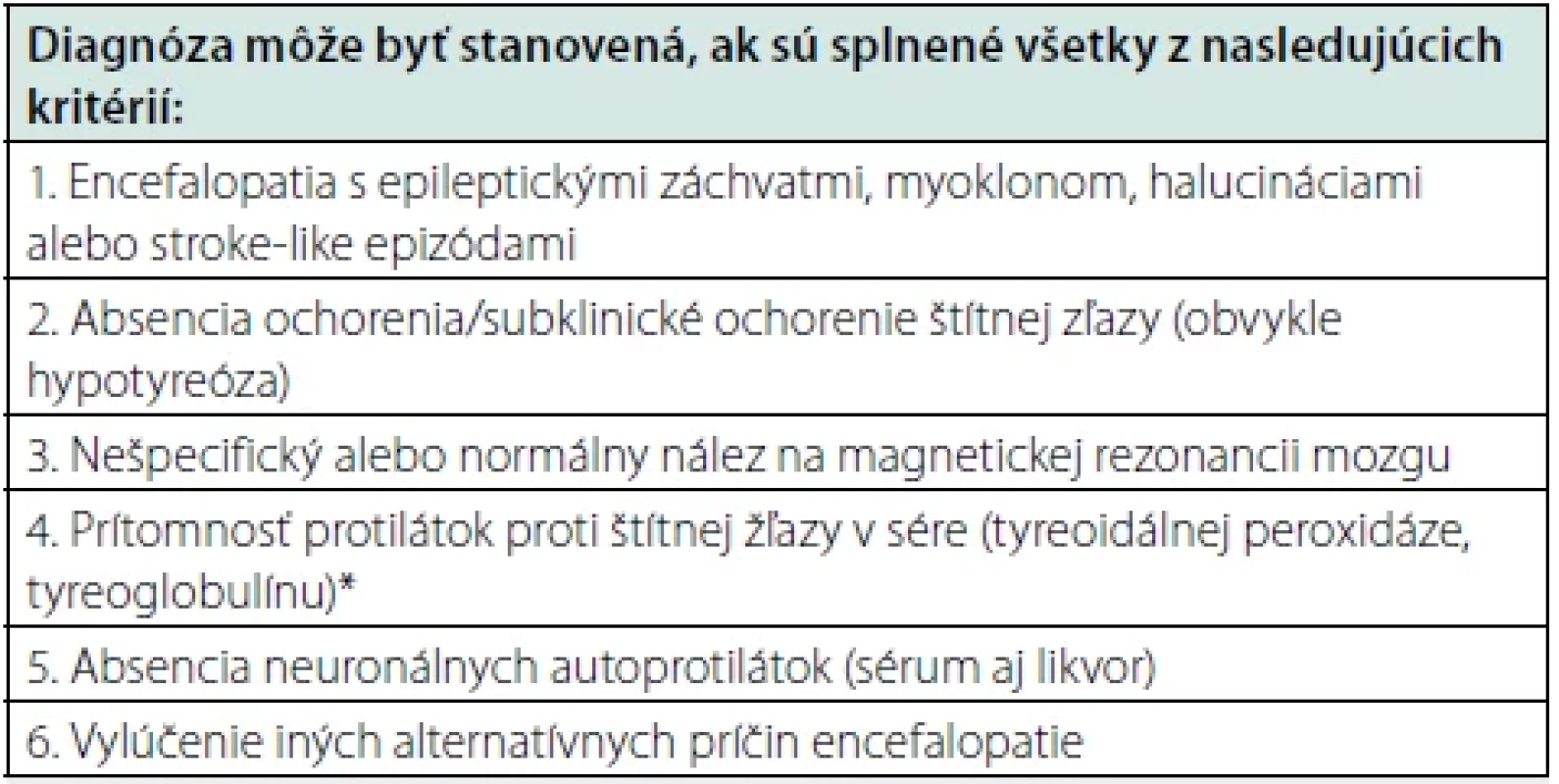
*bez kvantifikácie cut-off hladiny Vzhľadom na predpokladaný autoimunitný pôvod SREAT v liečbe sa uplatňuje imunosupresívna terapia. Vysokoúčinná je kortikoidná liečba, kde až 91 % pacientov dosiahne kompletnú alebo parciálnu remisiu stavu. Spravidla sa liečba začína pulznou dávkou, metylprednisolonu (1 g/denne v trvaní 3 – 5 dní) s pokračovaním v perorálnej forme prednisonom (1 g/kg) s postupným redukovaním dávky (22, 25). V oboch prípadoch našich pacientok sme po kortikoidnej liečbe zaznamenali rýchle zlepšenie neurologického stavu s regresiou symptómov a v prípade jednej pacientky aj regresiu MRI abnormalít mozgu. Približne štvrtina pacientov (59/228) bola liečených druhou líniou liečby (azathioprin, plazmaferéza, intravenózne imunoglobulíny a iné) či už z dôvodu nedostatočného efektu predchádzajúcej liečby (14/59), alebo relapsu ochorenia (5/59). Liečba vedie k rýchlemu zlepšeniu klinického stavu (v priemere päť dní), so súčasným poklesom hladín protilátok. Relapsy ochorenia sa vyskytujú u približne 16 % pacientov v prvom roku sledovania (18).
Záver
SREAT predstavuje zriedkavú formu encefalopatie, ktorej mechanizmus vzniku nie je úplne objasnený. Heterogenita symptómov často napodobňujúcich iné neurologické (extrapyramídové, autoimunitné, neurodegeneratívne) ochorenia predstavuje nevyspytateľnosť tejto diagnózy. Aj keď nemáme v súčasnosti špecifický test, ktorý by nám SREAT potvrdil, a nález sa opiera o často nešpecifické výsledky laboratórnych alebo neurozobrazovacích vyšetrení, SREAT by mal byť zahrnutý do diferenciálnej diagnostiky akútne manifestovaných neurologických alebo neuropsychiatrických prejavov, aj keď prítomnosť protilátok proti štítnej žľaze v laboratórnom náleze sama o sebe ešte diagnózu SREAT nepotvrdzuje.
MUDr. Milan Maretta, PhD.
Neurologická klinika UPJŠ LF a UNLP v Košiciach
milan.maretta@upjs.sk
Zdroje
- Brain EH, Jellinek KB. Hashimoto’s disease and encephalopathy. The Lancet.1966;288(7462):512-514.
- Castillo P, Woodruff B, Caselli R, et al. Steroid-responsive encephalopathy associated with autoimmune thyroiditis. Arch Neurol.2006;63 : 197-202.
- Ferracci F, Bertiato G, Moretto G. Hashimoto’s encephalopathy: epidemiologic data and pathogenetic considerations. J Neurol Sci.2004;217(2):165-168.
- Sharan A, Sengupta S, Mukhopadhyay S, et al. Hashimoto’s encephalopathy presenting with chorea. J Assoc Physicians India.2015;63(9):83-84.
- Salazar R, Mehta C, Zaher N, et al. Opsoclonus as a manifestation of Hashimoto’s encephalopathy. J Clin Neurosci.2012;19(10):1465-1466.
- Arya R, Anand V, Chansoria M. Hashimoto encephalopathy presenting as progressive myoclonus epilepsy syndrome. Eur J Pediart Neurol.2013;17(1):102-104.
- Gauthier AC, Baehring JM. Hashimoto’s encephalopathy mimicking Creutzfeldt-Jakob disease. J Clin Neurosci.2017;35 : 72-73.
- Müssig K, Bartels M, Gallwitz B, et al. Hashimoto’s encephalopathy presenting with bipolar affective disorder. Bipolar disorders.2005;7(3):292-297.
- Lin YT, Liao SC. Hashimoto encephalopathy presenting as schizophrenia-like disorder. Cogn Affect Behav Neurosci.2009;22(3):197-201.
- Arrojo M, Perez-Rodriguez M, Mota M, et al. Psychiatric presentation of Hashimoto’s encephalopathy. Psychosomatic medicine 2007;69(2): 200-201.
- Tyler KL, Rüegg S. The neuromythology of Hashimoto encephalopathy: The emperor has no clothes. Neurology.2020;94(2):55-56.
- Mattozzi S, Sabater L, Escudero D, et al. Hashimoto encephalopathy in the 21st century. Neurology 2020;94(2):e217-e224.
- Hollowell JG, Staehling NW, Flanders WD. Serum TSH, T4, and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab.2002;87(2):489-499.
- Payer J, Lisý L, Baqi L, et al. Hashimotova encefalopatia–vzácny a neobvyklý syndróm. Vnitř Lék.2007;53(3):300-306.
- Graus F, Titulaer M, Balu R. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol.2016;15 : 391-404.
- Waliszewska-Prosół M, Ejma M. Hashimoto Encephalopathy—Still More Questions than Answers. Cells 2022;11(18):2873.
- Ragusa F, Fallahi P, Elia G, Gonnella D, Paparo SR, Giusti C, Churilov LP, Ferrari SM, Antonelli A. Hashimoto’s thyroiditis: Epidemiology, pathogenesis, clinic and therapy. Best Pract Res Clin Endocrinol Metab. 2019;33 : 101367
- Laurent C, Capron J, Quillerou B, et al. Steroid-responsive encephalopathy associated with autoimmune thyroiditis (SREAT): characteristics, treatment and outcome in 251 cases from the literature. Autoimmun Rew.2016;15(12):1129-1133.
- Kothbauer-Margreiter I, Sturzenegger M, Komor J, et al. Encephalopathy associated with Hashimoto thyroiditis: diagnosis and treatment. J Neurol.1996;243(8):585-593.
- Castillo P, Woodruff B, Caselli R, et al. Steroid-responsive encephalopathy associated with autoimmune thyroiditis. Arch Neurol.2006;63(2):197-202.
- Mocellin R, Walterfang M, Velakoulis D. Hashimoto’s encephalopathy. CNS drugs 2007;21(10):799-811.
- Montagna G, Imperiali M, Agazzi P, et al. Hashimoto’s encephalopathy: A rare proteiform disorder. Autoimmun Rev.2016;15(5):466-476.
- Bohnen NILJ, Parnell KJ, Harper CM. Reversible MRI findings in a patient with Hashimoto’s encephalopathy. Neurology.1997;49(1):246-247.
- Chang T, Riffsy MTM, Gunaratne PS. Hashimoto encephalopathy: clinical and MRI improvement following high-dose corticosteroid therapy. The neurologist.2010;16(6):394-396.
- Zhou JY, Xu B, Lopes J, et al. Hashimoto encephalopathy: literature review. Acta Neurol Scand. 2017;135(3):285-290.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo E-5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Vybrané biomarkery ortostatickej intolerancie
- Pacient s akutní závratí – role klinického vyšetření a zobrazovacích metod
- Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou ako príčina akútnej encefalopatie
- Úspěšná léčba SAPHO syndromu (nebakteriální osteomyelitidy a akné) anakinrou a denosumabem. Popis případu a přehled léčebných možností
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Úspěšná léčba SAPHO syndromu (nebakteriální osteomyelitidy a akné) anakinrou a denosumabem. Popis případu a přehled léčebných možností
- Pacient s akutní závratí – role klinického vyšetření a zobrazovacích metod
- Vybrané biomarkery ortostatickej intolerancie
- Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou ako príčina akútnej encefalopatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



