-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Recidivujúce uroinfekcie u pacientov po transplantácii obličky s polycystickou chorobou obličiek
Recurrent urinary tract infections in kidney transplant patients with polycystic kidneys
Introduction: Kidney transplantation is now a routine method used to treat end-stage renal disease. About 10 % of kidney transplant patients are patients with autosomal dominant polycystic kidney disease (ADPKD). After successful kidney transplantation, recurrent urinary tract infections also occur in initially asymptomatic patients.
Material and methods: The group included 320 patients after kidney transplantation. We compared patients with ADPKD versus patients without ADPKD in terms of the presence of recurrent urinary tract infections.
The results: The incidence of recurrent urinary tract infections (rIMCs) was 18% in patients without ADPKD and 48% in patients without ADPKD. Nephrectomy after kidney transplantation due to recurrent urinary tract infections eliminated this infectious complication (in 86% of patients).
Conclusion: Kidney transplant patients with ADPKD have a significantly higher incidence of recurrent urinary tract infections. Removal of polycystic kidneys is a suitable solution if the infection persists.
Keywords:
kidneys – Transplantation – recurrent urinary tract infection – polycystic kidneys – ADPKD
Autoři: Marcel Čellár 1; Martina Konko Ová 1; Eva Lacková 1; Terézia Hrubá 2; Peter Galajda 3; Ivana Dedinská
Působiště autorů: II. interná klinika, Slovenská zdravotnícka univerzita, Nefrologicko‑transplantačné oddelenie, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica 1; Oddelenie rádiológie, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica 2; I. interná klinika, Univerzitná nemocnica Martin a Jesseniova lekárska fakulta Univerzity Komenského 3; Transplantačné centrum a I. interná klinika, Univerzitná nemocnica Martin a Jesseniova lekárska fakulta Univerzity Komenského 4
Vyšlo v časopise: Vnitř Lék 2022; 68(E-4): 4-9
Kategorie: Původní práce
Souhrn
Úvod: Transplantácia obličky je dnes rutinnou metódou, ktorá sa používa v liečbe terminálneho zlyhania obličiek. Asi 10 % pacientov po transplantácii obličky predstavujú pacienti s autozomálne dominantnou polycystickou chorobou obličiek (ADPKD). Po úspešnej transplantácii obličky sa aj u pôvodne asymptomatických pacientov vyskytujú recidivujúce uroinfekcie.
Materiál a metódy: Do súboru bolo zaradených 320 pacientov po transplantácii obličky. Porovnali sme pacientov s ADPKD versus pacientov bez ADPKD z hľadiska prítomnosti recidivujúcich uroinfekcií.
Výsledky: Výskyt recidivujúcich uroinfekcií (rIMC) po transplantácii bol u pacientov bez ADPKD 18 % a u pacientov po transplantácii s ADPKD to bolo 48 %. Nefrektómia po transplantácii obličky z dôvodu recidivujúcich uroinfekcií viedla k eliminácii tejto infekčnej komplikácie (u 86 % pacientov).
Záver: Pacienti po transplantácii obličky s ADPKD majú signifikantne vyšší výskyt recidivujúcich uroinfekcií. Vhodným riešením pri pretrvávaní infekcie je odstránenie polycystických obličiek.
Klíčová slova:
transplantácia – obličky – recidivujúca uroinfekcia – polycystické obličky – ADPKD
Úvod
Transplantácia obličky predstavuje metódu voľby liečby pacientov s terminálnym zlyhaním obličiek, ktorá je spojená s dlhším prežitím pacientov a ponúka lepšiu kvalitu života v porovnaní s dialyzačnými metódami (1, 2). Štvrtou najpočetnejšou skupinou pacientov s chronickou chorobou obličiek sú pacienti s ADPKD (3).
Pacienti po transplantácii môžu mať komplikácie, ktoré sú spojené s ich základnou chronickou chorobou obličiek a môžu významne ovplyvniť dobre fungujúci štep a potransplantačný život pacienta. Preto je nutné pacienta pred transplantáciou dôsledne pripraviť (4).
Najčastejšími komplikáciami po transplantácii sú infekčné komplikácie, ktoré sú zároveň najčastejšou príčinou morbidity po transplantácii obličky. Z nich uroinfekcie predstavujú najčastejšie infekcie po transplantácii obličky (5, 6, 7). Ich liečba býva problematická a výrazne finančne nákladná. Najčastejším pôvodcom uroinfekcií je Escherichia coli (8). Výskyt recidivujúcich uroinfekcií u celkovej populácie pacientov po transplantácii obličky sa v literatúre udáva okolo 7–14 % (9, 10, 11, 12). U pacientov s ADPKD je v rámci prípravy veľmi často diskutovanou otázkou aj nefrektómia (13, 14).
ADPKD je multisystémová choroba charakterizovaná početnými bilaterálnymi obličkovými cystami, asociovaná s cystami ďalších orgánov ako je pečeň, pankreas, pľúca, slezina, štítna žľaza a arachnoidea (13). Je to geneticky podmienené ochorenie spôsobené mutáciou v dvoch génoch. Touto chorobou je postihnutých 12,5 milióna ľudí na celom svete (15). Výskyt ADPKD sa udáva v rôznych populáciách okolo 1 : 200 až 1 : 1000 živonarodených detí (13, 16).
Asi tretina nositeľov mutácie zostáva po celý život asymptomatická a ďalšie dve tretiny postihnutých majú početné renálne a extrarenálne klinické príznaky, ktoré sa prejavia v rôznom čase a v rôznej závažnosti. Veľmi častou komplikáciou ADPKD sú uroinfekcie. V prípade opakovaných recidív spôsobujú progresiu základného ochorenia.
Liečba ADPKD je komplexná vrátane liečby špecifických komplikácií. Konzervatívna terapia je zhodná s terapiou väčšiny obličkových ochorení. Liečba hypertenzie je jedným z najdôležitejších terapeutických opatrení. Od roku 2020 je na Slovensku registrovaná špecifická liečba tolvaptanom, ktorý spomaľuje rast cýst a rýchlosť straty funkcie obličiek. Uvedený účinok liečby bol potvrdený v štúdii TEMPO 3 : 4, TEMPO 4 : 4 a REPRISE (17, 18, 19). Tolvaptan v priemere odďaľuje dobu terminálneho zlyhania obličiek o 6,5 roka a dobu prežívania predlžuje o 2,6 roka. Najčastejšie nežiaduce účinky sú polydipsia, polyúria, nyktúria a hepatopatia (19). Pacienti s ADPKD vstupujú do dialyzačného programu v lepšej zdravotnej kondícii ako ostatní pacienti. Dôvodom tohto stavu je menej vyjadrená anémia pri vyššej produkcii erytropoetínu a nižšia komorbidita. Taktiež lepšie profitujú z dialýzy ako ostatní pacienti (13).
Transplantácia obličky u pacientov s ADPKD je spojená s dlhším prežitím pacientov v porovnaní s dialyzačnými metódami. Podľa dostupných dát nie je rozdiel medzi prežívaním štepu u pacientov s ADPKD v porovnaní s ostatnou populáciou transplantovaných pacientov (13). Literatúra uvádza rovnaký výskyt komplikácií vrátane infekcií po transplantácii obličky u pacientov s ADPKD v porovnaní s pacientmi bez ADPKD (13, 14). Stále prebiehajú diskusie ohľadne nefrektómie polycystických obličiek pred transplantáciou. Potreba nefrektómie sa zdôvodňuje nutnosťou vytvoriť dostatočný priestor pre štep, odstrániť existujúce alebo potenciálne ložisko infekcie vzhľadom na nevyhnutné užívanie imunosupresív, odstrániť zdroj opakovanej hematúrie a ako riešenie hypertenzie a nezvládnuteľných bolestí.
Proti predtransplantačnej nefrektómii však existujú dôvody. Väčšina pacientov má aj v terminálnom štádiu dostatočnú diurézu, menej vyjadrenú anémiu a poruchu kalciovo‑fosfátového metabolizmu a takisto je nezanedbateľné riziko operačného výkonu a pooperačným komplikácií (20).
Preto sa v poslednom čase väčšina odborníkov zhoduje na tom, že predtransplantačná nefrektómia nie je potrebná (13, 14, 20, 21). Zistilo sa, že po úspešnej transplantácii zvyčajne vymizne bolesť, hematúria a často sa zmenší aj veľkosť obličiek (13). Momentálne je preferovaný názor, že obličky by sa nemali rutinne odstraňovať pred transplantáciou, pretože nefrektómia u pacientov s ADPKD je spojená s významnou morbiditou a mortalitou (15).
Cieľ práce
Cieľom práce bolo zistiť výskyt recidivujúcich uroinfekcií u pacientov s ADPKD po transplantácii obličky oproti ostatným pacientom po transplantácii obličky a definovať rizikové faktory. Ďalej sme chceli zistiť vplyv nefrektómie na pretrvávanie rIMC u pacientov s ADPKD. Snažili sme sa vyvodiť určité odporučenia, ktoré by pomohli zlepšiť posttransplantačné obdobie u našich pacientov.
Materiál a metódy
Zhodnotili sme 320 pacientov transplantovaných v Transplantačnom centre Banská Bystrica od 1. 1. 2007 do 31. 12. 2016. Spracovali sme údaje pacientov s ADPKD verzus pacientov bez ADPKD, ktorí podstúpili transplantáciu obličky z hľadiska prítomnosti recidivujúcich uroinfekcií, pridružených komplikácií a nefrektómie. Pacienti boli zaradení podľa exklúznych a inklúznych kritérií a sledovaní v dĺžke 36 mesiacov. U pacientov sme zistili vek v čase transplantácie, pohlavie, výskyt rIMC, typ imunosupresívnej liečby, hodnotu kreatinínu na konci sledovanej doby, výskyt rejekcie v sledovanom období, prítomnosť DM v anamnéze (diabetes mellitus) a výskyt PTDM (posttransplantačný diabetes mellitus). Ďalej sme zistili dôvody nefrektómie u pacientov s ADPKD a jej vplyv na rIMC.
Inklúzne kritériá:
• vek pacienta 19 a viac rokov,
• dosiahnutie požadovanej dĺžky sledovania v trvaní 36 mesiacov,
• začiatok sledovania 3 mesiace po transplantácii, po odstránení double J stentu.
• Exklúzne kritériá:
• vek pacienta do 19 rokov,
• bilaterálna nefrektómia u ADPKD pacientov,
• úmrtie do ukončenia sledovaného obdobia 36 mesiacov (mimo uroinfekcie),
• strata štepu do ukončenia sledovaného obdobia 36 mesiacov (mimo uroinfekcie),
• preexistujúca urologická abnormalita pred transplantáciou (neovezika, ureteroileoanastomóza),
• dehiscencia neoureteroanastomózy,
• stenóza neoureteroanastomózy,
• benígna hyperplázia prostaty s poruchou odtoku moču,
• nutnosť ponechania močového katétra z inej príčiny,
• recidivujúca leukoplakia prítomná už predtransplantačne.
Recidivujúca infekcia močových ciest bola definovaná ako minimálne 3 epizódy infekcie horných a/alebo dolných močových ciest v priebehu posledných 12 mesiacov alebo minimálne dve IMC (infekcia močových ciest) za obdobie posledných 6 mesiacov.
Močová infekcia bola stanovená na základe prítomnosti pozitívneho močového sedimentu so signifikantnou leukocytúriou a bakteriúriou. Signifikantná leukocytúria znamenala počet leukocytov nad 20 000 v 1 mililitri. Druhou podmienkou bola pozitívna močová kultivácia. Klinické príznaky v zmysle dyzúrie a celkovej klinickej alterácie mohli, ale nemuseli byť prítomné.
Na štatistickú analýzu sme použili certifikovaný štatistický program MedCalc verzia 13. 1. 2. (VAT registračné číslo BE 0809 344 640). Na porovnanie kontinuálnych premenných sme použili parametrický t‑test, asociácia medzi kategorickými premennými bola analyzovaná pomocou χ2 (chí‑kvadrát) testu. Nezávislé prediktory boli identifikované pomocou logistickej regresie. Za štatisticky významnú bola považovaná hodnota P < 0,05.
Výsledky
Celkovo sme za toto obdobie transplantovali a zhodnotili 320 dospelých a z toho bolo 41 pacientov s ADPKD, čo tvorilo 13 %. Po splnení exklúznych a inklúznych kritérií sme porovnali 208 pacientov bez základnej diagnózy ADPKD verzus 35 pacientov s ADPKD (tabuľka 1).
Tab. 1. Charakteristika pacientov súboru číslo 2 v TC Banská Bystrica (10-ročné obdobie) 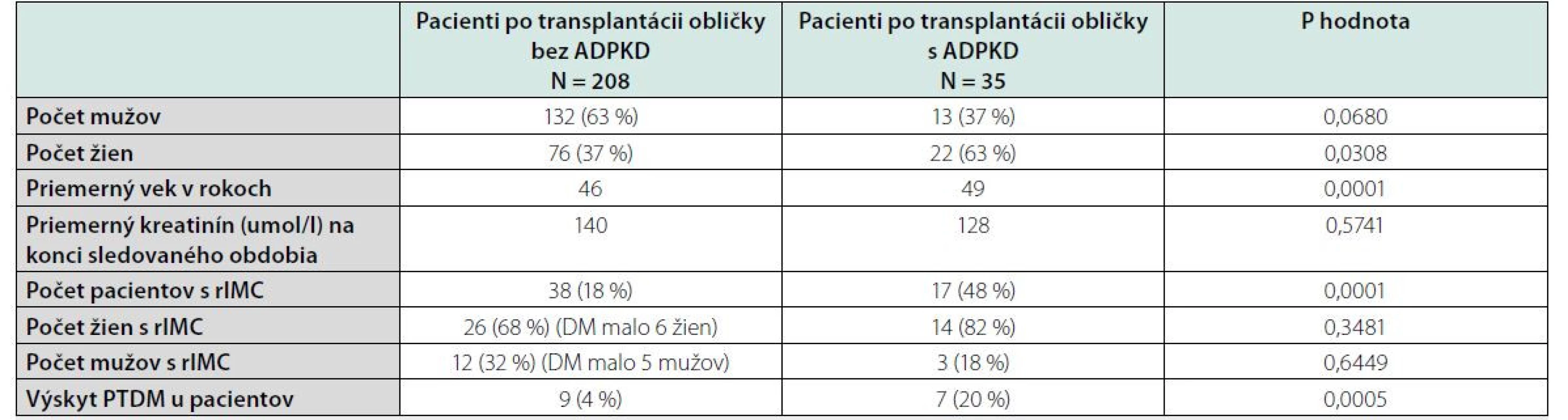
Zdroj: vlastné spracovanie Výskyt recidivujúcich uroinfekcií po transplantácii bol u pacientov bez ADPKD 18 % a u pacientov po transplantácii s ADPKD bol 48 % (p = 0,0001). Výskyt recidivujúcich uroinfekcií u pacientov s ADPKD pred transplantáciou bol 9 %, teda došlo k výraznému vzostupu (p = 0,0003).
Najčastejším pôvodcom bola Escherichia coli (tabuľka 2). Po zhodnotení výskytu rIMC podľa pohlavia bol častejší výskyt u žien s ADPKD aj bez ADPKD. V skupine bez ADPKD to bolo 26 žien (68 %) a s ADPKD to bolo 14 žien (82 %) (p = 0,00654).
Tab. 2. Bakteriálny pôvodcovia recidivujúcich uroinfekcií 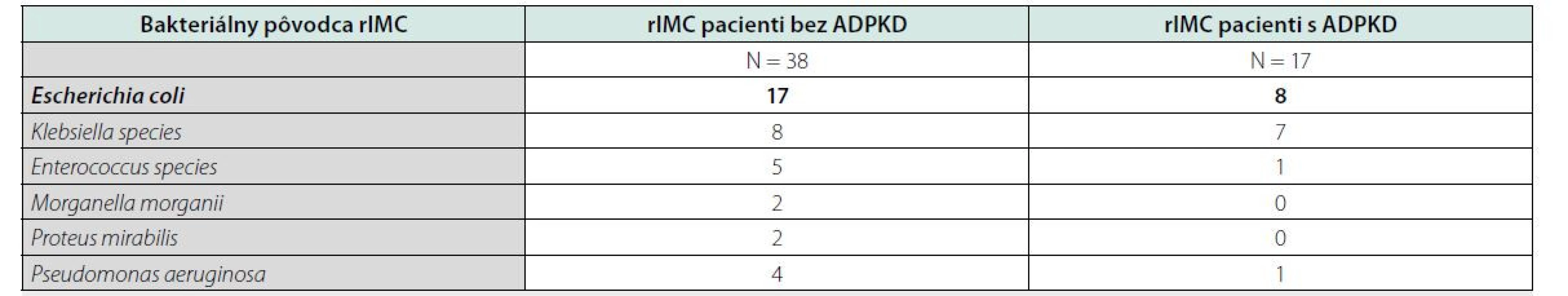
Zdroj: vlastné spracovanie Nefrektómia obličky pred transplantáciou bola vykonaná u 8 pacientov. Z toho 1 pacient podstúpil bilaterálnu nefrektómiu a 7 pacientov podstúpilo unilaterálnu nefrektómiu.
Dôvody na nefrektómiu pred zaradením na čakaciu listinu boli nasledovné. U 2 pacientov išlo o opakované ruptúry cýst, krvácania do cýst a následné hematúrie, ktoré ich ohrozovali opakovanou anemizáciou a krvácaním do retroperitonea. U 2 pacientov išlo o recidivujúce infekcie močových ciest, ktoré si vyžadovali opakovanú antibiotickú liečbu a hospitalizácie (u oboch pacientov bola vykonaná unilaterálna nefrektómia pre abscedujúcu pyelonefritídu). U 4 pacientov bola indikácia na nefrektómiu útlakový syndróm s bolesťami brucha a poruchou črevnej pasáže alebo z priestorového hľadiska.
Po transplantácii obličky podstúpilo nefrektómiu celkovo 7 pacientov. 4 pacienti mali bilaterálnu nefrektómiu a 3 pacienti unilaterálnu. U 3 pacientov bol pooperačný priebeh komplikovaný v zmysle tekutinových kolekcií v rane, nutnosti antibiotickej liečby a sekundárneho hojenia rany.
Jedinou indikáciou na unilaterálnu alebo bilaterálnu nefrektómiu po transplantácii u všetkých 7 pacientov bol recidivujúci uroinfekt.
Všetci pacienti, ktorí po transplantácii podstúpili nefrektómiu, boli naďalej sledovaní z hľadiska výskytu rIMC. U šiestich pacientov došlo k vymiznutiu uroinfekcií, u jednej pacientky ešte rIMC pretrvávali. Bola to pacientka po unilaterálnej nefrektómii a u nej je plánovaná aj druhostranná nefrektómia. V prípade druhých 2 pacientov po unilaterálnej nefrektómii, títo podstúpili jednostrannú nefrektómiu už pred transplantáciou. Jedenkrát bola indikácia v zmysle rIMC s infikovanou cystou a jedenkrát ruptúry cýst a hematúrie.
Ako vedľajší parameter sme hodnotili výskyt PTDM (posttransplantačný diabetes mellitus) v súbore pacientov, nakoľko pri zbere dát sa nám zdal pomerne veľký výskyt tejto nozologickej jednotky u pacientov s diagnózou ADPKD. U pacientov s ADPKD, ktorí podstúpili transplantáciu, došlo počas sledovaného obdobia k rozvoju PTDM u 7 pacientov, čo tvorilo 20 %. U ostatných pacientov sledovaných v súbore bol výskyt PTDM 4 %, čo bolo 9 pacientov. Ak sme v súbore pacientov bez ADPKD vynechali preexistujúcich pacientov s diagnózou diabetes mellitus prvého alebo druhého typu, čo bolo 34 s celkového počtu 208 pacientov, tak stúpol výskyt PTDM na 5 % (p = 0,0441).
Po použití štatistickej analýzy sme porovnali skupinu pacientov s ADPKD a kontrolnú skupinu v sledovaných parametroch. Zistili sme, že pacienti v skupine ADPKD boli signifikantne starší, v tejto skupine bolo signifikantne viac žien, častejšie boli prítomné recidivujúce infekcie močových ciest, častejšie bol prítomný PTDM a naopak, menej pacientov v skupine ADPKD malo anamnézu diabetes mellitus pred transplantáciou a signifikantne viac pacientov užívalo kortikosteroidy (tabuľka 3).
Tab. 3. Porovnanie kontrolnej skupiny a pacientov s ADPKD 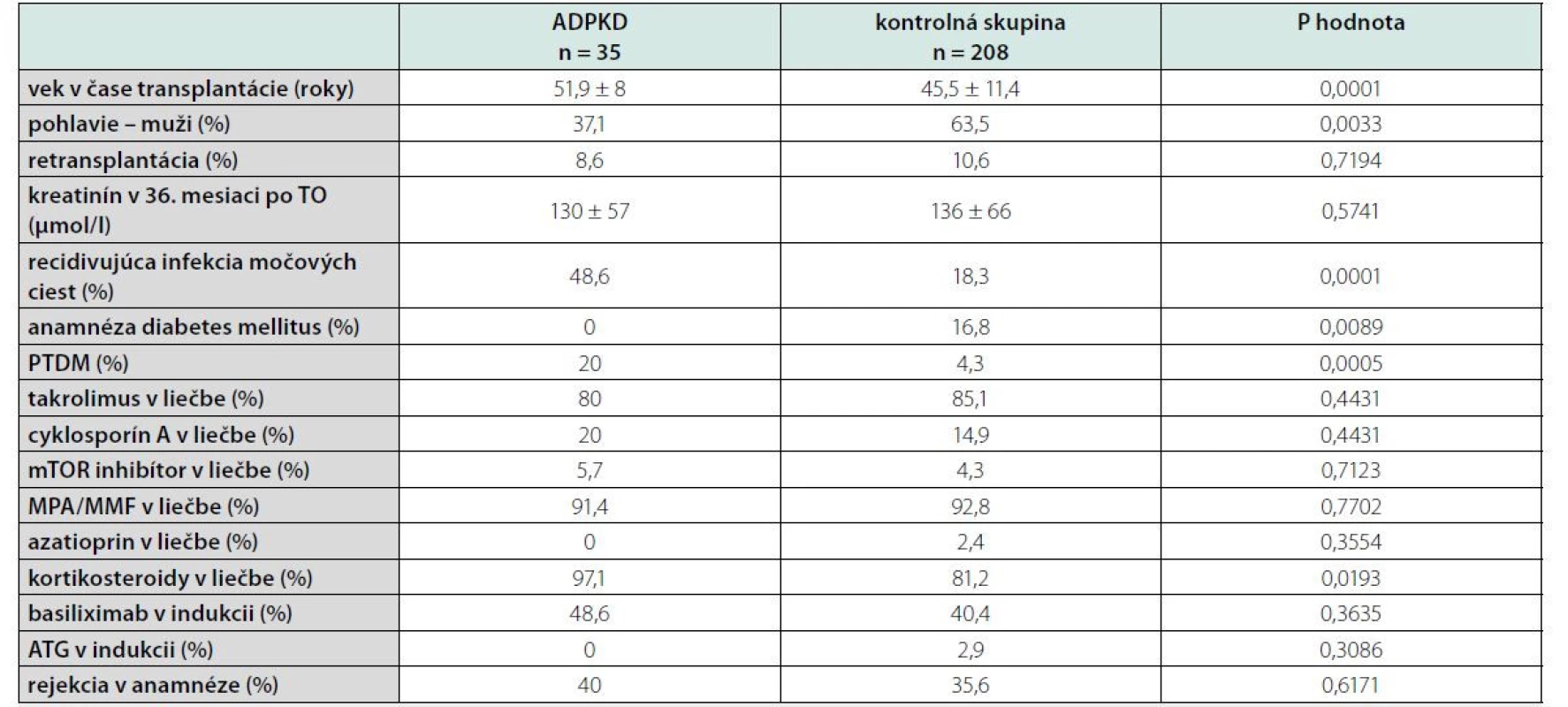
TO – transplantácia obličky; PTDM – potransplantačný diabetes mellitus; mTOR – mammalian target of rapamycin; MPA – kyselina mykofenolová; MMF – mykofenolát mofetil; ATG – antitymocytárny globulín
Zdroj: vlastné spracovanieĎalej sme súbor rozdelili podľa výskytu rIMC a porovnali sme skupinu pacientov s rIMC a kontrolnú skupinu pacientov bez rIMC. Zistili sme, že v skupine pacientov s rIMC bolo signifikantne viac žien v porovnaní s kontrolnou skupinou, viac pacientov s ADPKD a pacientov s anamnézou diabetes mellitus (tabuľka 4).
Tab. 4. Porovnanie pacientov s rIMC verzus kontrolná skupina pacientov bez rIMC 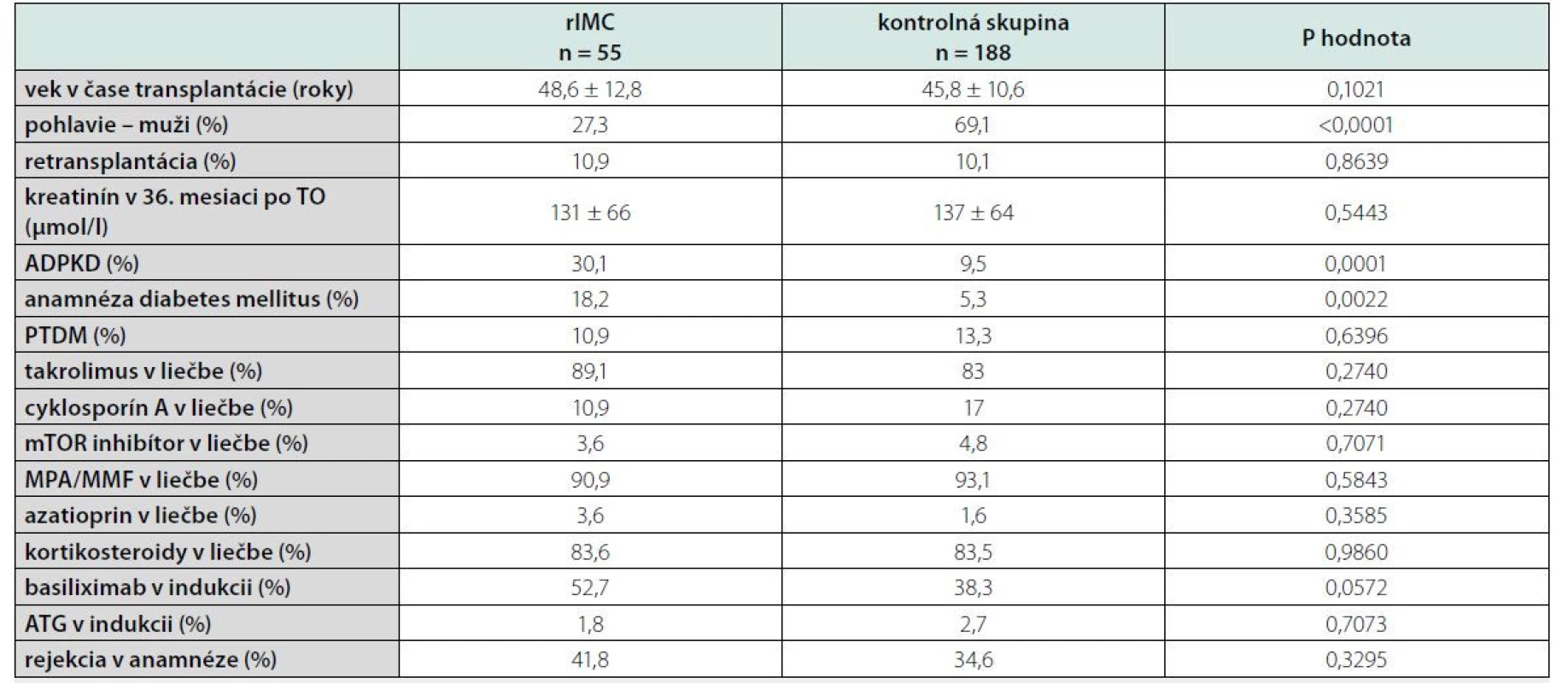
rIMC – ricidivujúca infekcia močových ciest; TO – transplantácia obličky; PTDM – potransplantačný diabetes mellitus; mTOR – mammalian target of rapamycin; MPA – kyselina mykofenolová; MMF – mykofenolát mofetil; ATG – antitymocytárny globulín
Zdroj: vlastné spracovanieNásledne sme použili multivariantnú analýzu na identifikovanie prediktorov pre rIMC. Použitím logistickej regresie sme identifikovali nasledovné nezávislé prediktory pre rIMC: ženy [OR 8,6791 (95%CI 3,7074-20,3180), P < 0,0001], ADPKD [OR 14,3654 (95%CI 3,5455-58,2035), P = 0,0002] a anamnéza diabetes mellitus [OR 2,5177 (95%CI 1,1775-5,2177), P < 0,0001] (tabuľka 5).
Tab. 5. Logistic regression 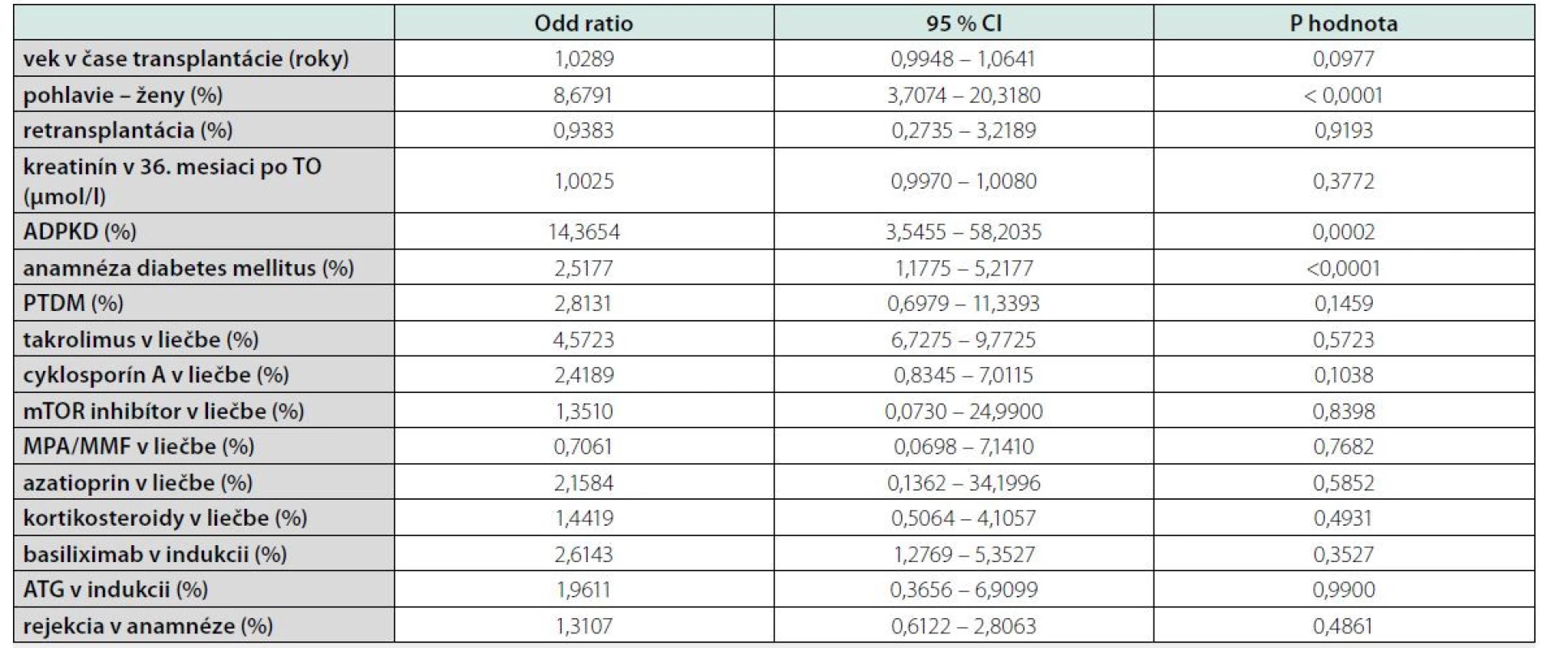
TO – transplantácia obličky; PTDM – potransplantačný diabetes mellitus; mTOR – mammalian target of rapamycin; MPA – kyselina mykofenolová; MMF – mykofenolát mofetil; ATG – antitymocytárny globulín; Odds ratio (OR); 95 % coincidence interval
Zdroj: vlastné spracovanieDiskusia
Množstvo pacientov s ADPKD, ktorí sa nachádzajú na čakacej listine, je pomerne významné. A títo pacienti vzhľadom na prítomnosť polycystických obličiek majú aj svoje špecifické komplikácie. U týchto pacientov dominujú uroinfekcie, hemorágie do cýst a riešenie priestorového hľadiska pre natransplantovanie štepu. A práve z týchto dôvodov býva v rámci ich čo najlepšej prípravy pred zaradením na čakaciu listinu veľmi často diskutovanou otázkou indikácia nefrektómie pred transplantáciou (14).
Všimli sme si, že pacienti s ADPKD po transplantácii obličky sú pomerne často liečení a hospitalizovaní pre uroinfekcie. Je všeobecne známe, že uroinfekcie zvyšujú morbiditu a mortalitu pacienta po transplantácii obličky a taktiež skracujú prežívanie štepu. Ďalším nezanedbateľným faktorom sú ekonomické náklady spojené s liečbou týchto infekcií vzhľadom na častú nutnosť hospitalizácie a používanie drahých antibiotík. Preto sme zhodnotili náš súbor z hľadiska výskytu recidivujúcich uroinfekcií ako aj nefrektómie polycystických obličiek. Bolo veľkým problémom porovnať naše dáta ohľadne výskytu recidivujúcich uroinfekcií s dátami v literatúre, pretože sa tu pomerne často voľne zamieňal pojem uroinfekcia a recidivujúca uroinfekcia. Sporadické uroinfekcie prekoná veľké počet pacientov. Ich množstvo variuje od 15 po 60 %. Výskyt recidivujúcich uroinfekcií u pacientov s ADPKD po transplantácii obličky sa udáva okolo 7 – 14 % (9, 10, 11, 12).
Čo sa týka predtransplantačnej nefrektómie, okrem niektorých indikácií sa názory odborníkov líšia a sú nejednoznačné. Za indikované sú považované neovplyvniteľné bolesti, recidivujúce uroinfekcie, opakované krvácanie a ruptúry cýst, ťažká hypertenzia, nádor obličky, urolitiáza, extrémne veľké obličky s nutnosťou vytvorenia priestoru na transplantáciu. Existuje však aj celý rad dôvodov, prečo k nefrektómii pred transplantáciou nepristupovať. Tie hlavné sú: menšia anémia, zachovanie diurézy, menej vyjadrená porucha kalciovo‑fosfátového metabolizmu a riziko samotného operačného výkonu. Preto sa dnes väčšina odborníkov zhoduje v tom, že odstránenie polycystických obličiek v rámci prípravy na transplantáciu obličky nie je u väčšiny pacientov potrebné (13, 14, 20, 21).
V našom súbore boli zhodnotení pacienti po transplantácii obličky s ADPKD oproti ostatným pacientom bez ADPKD v časovom období 10 rokov (sledovaní 36 mesiacov). Pacienti boli zaradení podľa presných kritérií. V súbore bol u pacientov s ADPKD výskyt rIMC pred transplantáciou okolo 9 % a po transplantácii stúpol na 48 %. U pacientov bez ADPKD, ktorí podstúpili transplantáciu, bol výskyt rIMC 18 %. Výskyt rIMC u pacientov s ADPKD je teda výrazne vyšší. Z tohto hľadiska sa zdá výskyt recidivujúcich uroinfekcií závažným problémom v populácii pacientov s ADPKD. Celkovo sme pre rIMC indikovali na nefrektómiu 7 pacientov, avšak pred transplantáciou to boli 2 pacienti. Po nefrektómii došlo k ústupu rIMC u 86 % pacientov. Z výsledkov vyplýva, že nefrektómia viedla k vyriešeniu problému recidivujúcich uroinfekcií po transplantácii, a preto ju v takýchto prípadoch odporúčame. Predpokladáme, že tieto opatrenia by mohli pomôcť týmto pacientom a štepom z hľadiska čo najlepšieho prežívania po transplantácii a v nemalej miere by mohli šetriť aj finančné náklady.
Ako vedľajší parameter sme zhodnotili výskyt PTDM v súbore pacientov, nakoľko pri zbere dát sa nám zdal pomerne veľký výskyt tejto nozologickej jednotky u pacientov s diagnózou ADPKD. U pacientov s ADPKD počas sledovaného obdobia došlo k rozvoju PTDM u 7 pacientov, čo tvorilo 20 %. U ostatných pacientov sledovaných v súbore bol výskyt PTDM 4 %, čo bolo 9 pacientov. Vo väčšine dostupnej literatúry nebýva diagnóza ADPKD zaradená medzi rizikové faktory pre rozvoj PTDM. Našli sme však práce, kde bolo opísané väčšie riziko rozvoja PTDM u pacientov s polycystickou chorobou obličiek (22). Avšak naopak, niektoré práce túto súvislosť spochybňujú (23). Uvedená, nami zistená koncidencia však bude potrebovať zhodnotenie rozsiahlejších súborov. Taktiež budú potrebné ďalšie štúdie, aby sa získal prehľad o mechanizmoch asociácie medzi ADPKD a posttransplantačným diabetom mellitom.
Záver
Na Slovensku je dnes v dialyzačnom programe okolo 3 500 pacientov. Transplantácia obličky je najvhodnejšou liečbou pre pacienta s terminálnym zlyhaním obličiek a pri neprítomnosti kontraindikácií sú títo pacienti zaradení na čakaciu listinu za účelom transplantácie vhodnej obličky. Spektrum pacientov, ktorí sa tu nachádzajú, má rôzne základné ochorenie, ktoré viedlo k zlyhaniu obličiek. Z nich asi 10 % tvoria pacienti s ADPKD.
Vzhľadom na svoje základné ochorenie, majú títo pacienti určité špecifické komplikácie. Jednou z nich je aj výskyt recidivujúcich uroinfekcií. Je dôležité nájsť určité odporúčania ohľadom ich manažmentu a umožniť týmto pacientom dosiahnuť čo najplnohodnotnejší život po transplantácii obličky, ktorý by bol zaťažený minimálnym množstvom komplikácií.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Marcel Čellár, MPH
II. interná klinika SZU, Nefrologicko-transplantačné oddelenie, FNsP F. D. Roosevelta
Námestie Ludvíka Svobodu 1, 975 17 Banská Bystrica
Cit. zkr: Vnitř Lék. 2022;68(4):X-X
Článek přijat redakcí: ?. ?. 2022
Článek přijat po recenzích: ?. ?. 2022
Zdroje
1. Kaballo MA, Canney M, O‘Kelly P et al. A comparative analysis of survival of patients on dialysis and after kidney transplantation. Clin Kidney J 2018; 11(3): 389-393.
2. Oxford handbook of nephrology and hypertension. 2nd ed. Oxford: Oxford University Press (2014) s. 336, ISBN 978-0-19-965161-0.
3. Chebib FT, Torres VE. Autosomal Dominant Polycystic Kidney Disease: Core Curriculum 2016. Am J Kidney Dis 2016; 67(5): 792-810.
4. Teplan V et al. Praktická nefrologie, Praha: Grada Publishing 2006, ISBN 80-247-1122-2, 496 s.
5. Stuart FP, Abecassis MM, Kaufman DB. Vademecum Organ Transplantation 2nd Edition, Georgetown: Landes Bioscience 2003, ISBN 1-57059-675-1, 810 s.
6. Viklický O, Janoušek L, Baláž P. Transplantace ledviny v klinické praxi, Praha: Grada Publishing 2008, ISBN 978-80-247-2455-3, 384 s.
7. Basu G. Infections After Kidney Transplantation: The Bug BEAR Of Kidney Transplantation in Tropics. The Open Urology & Nephrology Journal 2015; 8 : 76-87
8. Breza J, Žilinská Z et al. Transplantácia obličky, Ľubotice: Cofin, a. s. 2020, ISBN 978-80-973466-1-4, 289 s.
9. Mitra S, Alangaden GJ. Reccurent Urinary Tract Infections in Kidney Transplant Recipients. Curr Infect Dis Rep 2011; 13 : 579-587.
10. Schiescher J. Reccurent UTIs After Renal Transplant. 2010, Dostupné na: http://www. renalandurologynews.com/recurrent‑utis‑after‑renal‑transplants/ article/180801/#
11. Spithoven E, Kramer A, Meijer E et al. Renal replacement therapy for autosomal dominant polycystic kidney disease (ADPKD) in Europe: prevalence and survival‑an analysis of data from the ERA‑EDTA Registry. Nephrol Dial Transplant 2014; 29 : 15-25.
12. Britt NS, Hagopian JC, Brennan DC et al. Effect of reccurent urinary tract infection on graft and patient outcomes after kidney transplantation. Nephrology Dialysis Transplantation 2017; 32, (10): 1758–1766.
13. Feehally J, Floege J, Tonelli M. Comprehensive Clinical Nephrology Sixth Edition, Elsevier 2018, ISBN 978-0-323-47909-7, 1360 s.
14. Rozanski J, Kozlowska I, Myslak M et al. Pretransplant nephrectomy in patient with autosomal dominat polycystic kidney disease. Transplant proc 2005; 37 (2): 666-668.
15. Chapman AB, Devuyst O, Eckardt KU. Autosomal – dominant polycystic kidney disease (ADPKD): executive sumary from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Published online 2015 Mar 18. doi: 10.1038/ki.2015.59, Dostupné na : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4913350/
16. Teplan V et al. Praktická nefrologie, Praha: Grada Publishing 2006, ISBN 80-247-1122-2, 496 s.
17. Torres VE, Chapman AB, Devuyst O et al. Tolvaptan in patients with autosomal dominant polycystic kidney disease. N Engl J Med 2012; 367 : 2255-2266.
18. Torres VE, Chapman AB, Devuyst O et al. Multicentric, open label, extension trial to evaluate the long‑term efficacy and safety of early versus delayed treatment with tolvaptan in autosomal dominant polycystic kidney disease: the TEMPO 4 : 4 trial. Nephrol Dial Transplant 2017; 32 : 1262.
19. Torres VE, Chapman AB, Devuyst O et al. Tolvaptan in later‑stage autosomal dominant polycystic kidney disease. N Engl J Med 2017; 377 : 1930-1943.
20. Veroux M, Zerbo D, Basile G et al. Simultaneous Native Nephrectomy and Kidney Transplantation in Patients With Autosomal Dominant Polycystic Kidney Disease. June 2016, Dostupné na WWW: https://doi.org/10.1371/journal.pone.0155481
21. Kirkman MA, Dellen D, Mehra S et al. Native nephrectomy for autosomal dominant polycystic disease: before or after kidney transplantation. December 2010, Dostupné na WWW: https://doi.org/10.1111/j.1464-410X.2010.09938.x
22. Dedinská I, Laca L, Miklušica J et al. Diabetes mellitus after transplantation. Annals of transplantation research 2017; 1(1): 1005.
23. Nowacka MP, Safranow K, Rózański, J et al. Autosomal Dominant Polycystic Kidney Disease Is Not a Risk For Post‑transplant Diabetes Mellitus. Matched‑pair Design Multicenred Study. Archives of medical research 2008; 39(3): 312-319.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo E-4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Postavení a význam farmakovigilance v České republice a ve světě
- Získaný von Willebrandův syndrom
- Pacient s jaterní cirhózou na interním oddělení – intervence případného abúzu alkoholu
- Multimorbidity working group
- Recidivujúce uroinfekcie u pacientov po transplantácii obličky s polycystickou chorobou obličiek
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Získaný von Willebrandův syndrom
- Postavení a význam farmakovigilance v České republice a ve světě
- Recidivujúce uroinfekcie u pacientov po transplantácii obličky s polycystickou chorobou obličiek
- Pacient s jaterní cirhózou na interním oddělení – intervence případného abúzu alkoholu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



