-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPlicní střádání
Pulmonary storage
Interstitial lung diseases (ILDs) are not just a matter of scarring or inflammation in the lung tissue. The lungs can also serve as a repository for products that can be produced in excessive amounts in the human body as a result of disease.
Geneticaly based dysfunctions of lysosomal enzymes, which leads to an unefficient degradation and transport of various macromolecules from lysosomes, are considered to be storage diseases sensu stricto. ILDs were described in patients with Gaucher disease, Niemann-Pick disease and Fabry disease. In a broader context, however, the accumulation of various substances in the lung tissue is also encountered in cases of pediatric pulmonary interstitial glycogenosis (PIG), alveolar lipoproteinosis or pulmonary amyloidosis.
The cause of PIG is not clear. The disease was first described in 2002 and a lung tissue sample is required to establish this diagnosis. Even though PIG usually goes well in childhood and the patients‘ difficulties spontaneously subside over time, the long-term prognosis of the patients is unknown.
Alveolar lipoproteinoses can be acquired (e.g. after massive exposure to silica dust), autoimmune, but also genetically determined. Unlike lysosomal storage diseases, in the case of pulmonary alveolar lipoproteinosis, accumulation of abnormal macromolecules occurs only in the lungs of affected individuals. Similarly, amyloidosis is not a single disease, but a group of diseases with different etiopathogenesis, as a result of which amyloid – a group of different proteins with a distinctvive conformation, which can be deposited in various organs, including the lungs – is formed. The diagnosis of pulmonary alveolar lipoproteinosis is based on the typical appearance and biochemical composition of the fluid obtained by bronchoalveolar lavage, the diagnosis of amyloidosis is histological.
Keywords:
Amyloidosis – lysosomal storage diseases – pulmonary alveolar proteinosis – pulmonary interstitial glycogenosis
Autoři: Martina Šterclová
Působiště autorů: Pneumologická klinika 1. LF UK a Fakultní Thomayerovy nemocnice, Praha ; Pneumologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Vnitř Lék 2022; 68(8): 525-531
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2022.111Souhrn
Intersticiální plicní procesy (IPP) nejsou jen otázkou jizvení nebo zánětu v plicní tkáni. Plíce mohou sloužit také jako úložiště produktů, které mohou v lidském organismu v důsledku onemocnění vznikat v nadměrném množství.
Za střádavá onemocnění sensu stricto jsou považována geneticky podmíněná onemocnění, která spočívají v dysfunkci lysozomálních enzymů, která vede k poruše degradace a transportu různých makromolekul z lysozomů. S intersticiálním plicním postižením se můžeme setkat u nemocných s Gaucherovou nemocí, Niemann‑Pickovou nemocí a Fabryho nemocí. V širším kontextu se ale s hromaděním různých látek v plicní tkáni setkáváme i v případech dětské plicní intersticiální glykogenózy (PIG), alveolární lipoproteinózy nebo plicní amyloidózy.
Příčina PIG není objasněna. Onemocnění bylo popsáno poprvé v roce 2002 a ke stanovení této diagnózy je nutný odběr vzorku plicní tkáně. I když v dětském věku probíhá PIG obvykle příznivě a obtíže nemocných spontánně v čase ustupují, dlouhodobá prognóza nemocných není známa.
Alveolární lipoproteinózy mohou být získané (např. po masivní expozici křemičitému prachu), autoimunitní, ale i geneticky podmíněné. Na rozdíl od lysozomálních střádavých nemocí v případě plicní alveolární lipoproteinózy dochází k hromadění abnormálních makromolekul pouze v plicích postižených jedinců. Obdobně amyloidóza není jednou nemocí, ale skupinou chorob s různou etiopatogenezí, v jejichž důsledku vzniká amyloid – skupina různých proteinů s porušenou konformací, která se můžou ukládat v různých orgánech včetně plic. Diagnostika plicní alveolární lipoproteinózy je založena na typickém vzhledu a biochemickém složení tekutiny získané bronchoalveolární laváží, diagnostika amyloidózy je histologická.
Klíčová slova:
plicní alveolární proteinóza – amyloidóza – lysozomální střádavé nemoci – plicní intersticiální glykogenóza
Úvod
Střádavá nemoc je termín historicky vyhrazený pro skupinu nemocí, jejichž příčinou je deficit/absence enzymů sloužících k degradaci zejména lipidů s jejich následným hromaděním v lysozomech. K hromadění, tedy střádání, dochází v oblasti plic i při dalších chorobách, pro které je typické hromadění proteinů nebo lipoproteinů. Přehled nemocí, pro které je charakteristické střádání tělu vlastních látek v plicní tkáni, přináší tabulka 1.
Tab. 1. Nemoci provázené střádáním tělu vlastních substancí v plicní tkáni 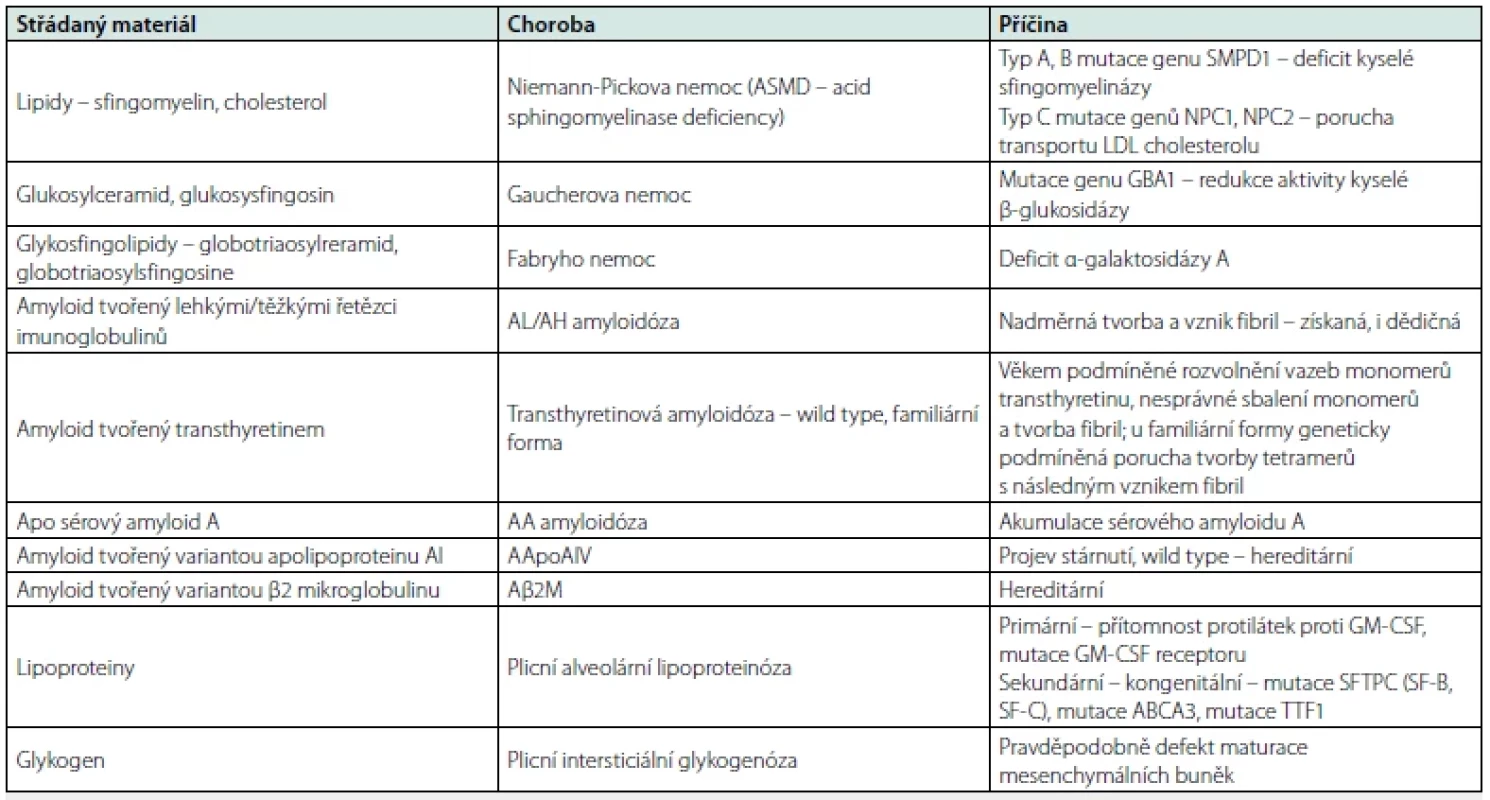
SMPD1 – sfingomyelin fosfodiesteráza 1; NPC – Niemann Pick typ C; LDL lipoproteiny s nízkou denzitou; GBA – kyselá β‑ glukosidáza; AL – amyloidóza s lehkými řetězci; AH – amyloidóza s těžkými řetezci; GM‑ CSF – kolonie stimulující faktor pro granulocyty a makrofágy; SFTPC – surfaktantový protein C; SF‑ B surfaktant B; SF‑ C surfaktant C; ABCA3 – ATB‑ binding cassette subfamily A member 3; TTF1 – thyroid transcription factor 1 Patogeneze plicního poškození při střádavých nemocech
Lysozomální střádavé nemoci
Pro Gaucherovu chorobu je typická infiltrace interalveolárních sept Gaucherovými buňkami (makrofágy, v jejichž lysozomech jsou nahromaděny glykolipidy). Gaucherovy buňky mohou obturovat i lumen cév, což může vést k rozvoji plicní hypertenze (1). U pacientů s tímto onemocněním se na rozvoji choroby podílí ale také dysfunkční autofagie a narušení autofagických mechanismů je způsobeno především abnormálním obsahem lysozomů (2). Niemann‑Pickovy buňky (makrofágy, jejichž lysozomy jsou vyplněny sfingomyelinem a cholesterolem), obdobně infiltrují interalveolární septa a stěnu bronchů u nemocných s Niemann‑Pickovou chorobou. U nemocných s Fabryho nemocí se v patogenezi plicního postižení podílí i aktivace imunitního systému v reakci na akumulovaný materiál, s produkcí prozánětlivých a profibrotických cytokinů, kyslíkových radikálů a dalších látek, které mohou spustit proces fibrotizace plicní tkáně (3).
Amyloidóza
Amyloid je tvořen dlouhými proteinovými vlákny nebo fibrilami, které jsou obvykle uspořádány do struktury beta skládaného listu. Není jasné, proč původní protein změní konformaci a vytvoří vlákna, která jsou základem struktury amyloidu. Například u amyloidózy z lehkých řetězců dochází k rozbalení proteinů, jejich dimerizaci a oligomerizaci s následnou tvorbou beta skládaných listů. Dosud není známo, zda ke změně konformace proteinů dochází v krevním řečišti, nebo přímo v postižených orgánech. Cytotoxicita amyloidu nespočívá pouze v ukládání nerozpustných fibril extracelulárně v postižených tkáních. Cytotoxické jsou velmi pravděpodobně i oligomery proteinů, které mohou negativně ovlivňovat integritu buněčných membrán. Fibrily brání správnému kontaktu buněk, ovlivňují růst a buněčné dělení a rozbalené proteiny podporují apoptózu postižených buněk (4).
K fibrilám tvořícím amyloid bývají navázány i další proteiny, vždy je přítomen např. heparan sulfát proteoglykan (HSPG) a sérová amyloidová P‑komponentna (SAP) totožná prakticky s plazmatickým proteinem sérovým amyloidem P. Tento konkrétní protein brání degradaci fibril.
Plicní alveolární proteinóza
Proteinem, který se hromadí v oblasti plicních sklípků u nemocných s alveolární proteinózou, je surfaktant. Nemoc může být způsobena tvorbou abnormálního surfaktantu nebo vadnou clearance surfaktantu, obojí vede k akumulaci surfaktantových proteinů v pneumocytech II typu a k jejich poškození (5). Rozdělení plicních alveolárních proteinóz (PAP) je shrnuto v tabulce 2.
Tab. 2. Plicní alveolární proteinózy – klasifikace 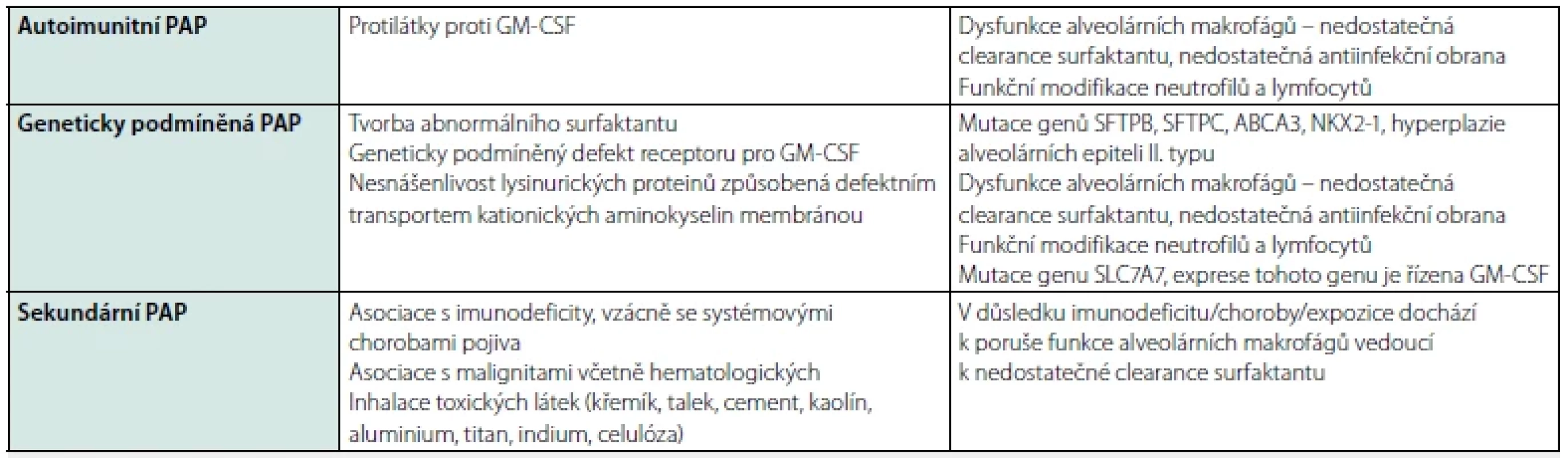
PAP – plicní alveolární proteinóza; GM-CSF – kolonie stimulující faktor pro granulocyty a makrofágy; SFTPB – surfaktantový protein B; SFTPC – surfaktantový preotein C; ABCA3 – ATB-binding cassette subfamily A member 3; NKX2-1 – NK2 homeobox 1 Obr. 1. Sekundární plicní alveolární proteinóza po masivní expozici křemíku 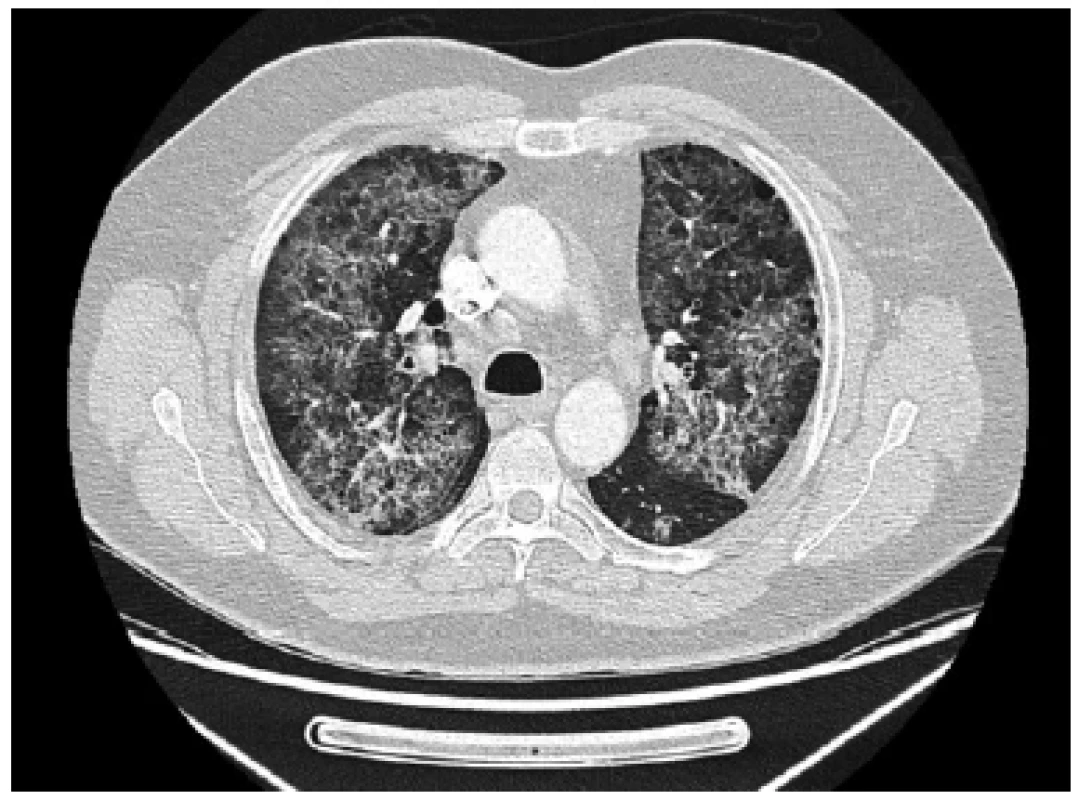
Obr. 2. Počítačová tomografie s vysokou rozlišovací schopností u pacienta s hereditární plicní alveolární proteinózou 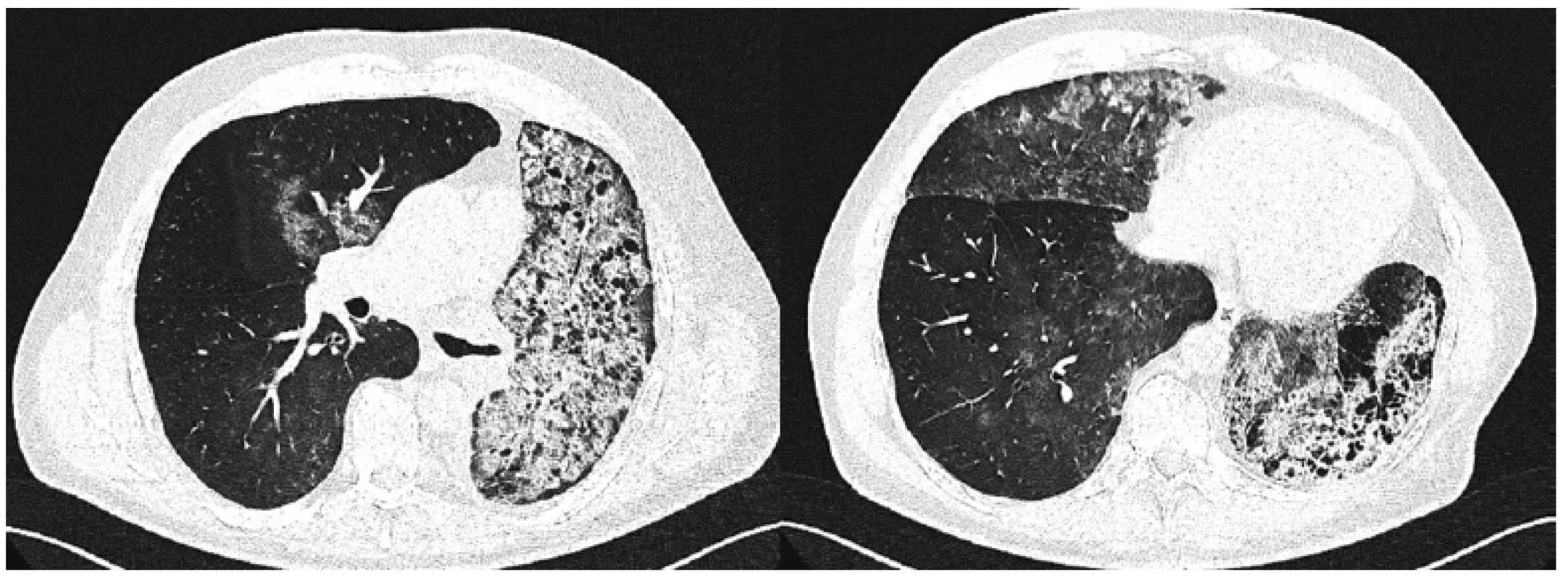
Plicní intersticiální glykogenóza
Plicní intersticiální glykogenóza (PIG) je onemocnění manifestující se nejčastěji u novorozenců a charakteristickým nálezem u dětí s touto nemocí je rozšíření plicního intersticia dané přítomností vřetenitých buněk vyplněných glykogenem. Zda se jedná o reakci na dosud neidentifikované poškození, či zda se jedná o specifickou poruchu maturace není známo. Pro druhou zmíněnou teorii svědčí paralelně často zjištěná porucha růstu alveolů, mimoplicní postižení nejčastěji v podobě vrozených srdečních vad a spontánní regrese v čase. Byla však popsána i asociace PIG s mukopolysacharidózami a někteří autoři se přiklánějí k tomu, že PIG může být u části pacientů první manifestací mukopolysacharidóz (které jinak ale plíce prakticky nepostihují).
Klinický obraz onemocnění
Lysozomální střádavé nemoci
Střádavé choroby nepostihují izolovaně plicní tkáň, plicní postižení bývá obvykle jedním z mnoha, která onemocnění provázejí. Pro Gaucherovu nemoc 1. typu (bez neurologického postižení) bývá typické postižení kostí, hepatosplenomegalie, trombocytopenie a anémie, u těchto nemocných se můžeme setkat i s plicním postižením. Intersticiální plicní postižení může být také součástí obrazu Niemann‑Pickovy choroby B, společně s hepatomegalií, hyperlipidemií a trombocytopenií, případně neurologickým postižením (1/3 nemocných). Nemoc se může manifestovat v dětství, ale i v dospělosti, diagnóza IPP někdy dokonce předchází diagnózu Niemann‑Pickovy nemoci. Přestože Fabryho nemoc také představuje multisystémovou chorobu, nejčastějším projevem bývá hypertrofická kardiomyopatie. Plicní postižení připomíná chronickou obstrukční plicní nemoc, intersticiální plicní proces nebývá častým (7).
Amyloidóza
Mezi časté projevy u nemocných s plicním postižením v důsledky amyloidózy patří námahová dušnost, kašel, hubnutí a bolesti hrudníku. Vzhledem k tomu, že plíce bývají jedním z postižených orgánů, kromě výše uvedeného může podezření na amyloidózu vyvolat i nefrotický syndrom (u nediabetiků), srdeční selhání se zachovalou ejekční frakcí, nevysvětlitelné zažívací obtíže a/nebo hepatomegalie. Pozornost je třeba věnovat také pacientům s recidivujícím pleurálním výpotkem nejasné etiologie a anamnézou syndromu karpálního tunelu nebo periferní neuropatie (8). Tracheobronchiální depozita amyloidu mohou vést k rozvoji fixované obstrukce dýchacích cest a hemoptýze. Příznaky AA amyloidózy navíc zahrnují příznaky základního onemocnění, které k rozvoji choroby vedlo. Kromě nedostatečně léčených infekčních chorob, systémových nemocí pojiva, nádorových nemocí a idiopatických střevních zánětů bývají AA amyloidózou komplikovány i neléčené autoinflamatorní procesy, zejména hereditární středomořská horečka.
Plicní alveolární proteinóza
Manifestace PAP souvisí s jejich patogenezí. Nejčastější jsou pravděpodobně autoimunitní PAP, s mediánem stanovení diagnózy v 5. dekádě, k manifestaci může ale dojít kdykoliv od kojeneckého věku do senia. Třetina nemocných může být asymptomatických, u třetiny postižených dominuje dušnost a u pětiny kašel. Sekundární PAP často provází kromě výše uvedeného horečka. Geneticky podmíněná PAP má variabilní dědičnost a penetranci a k prvním projevům nemoci může dojít jak v časném dětství, tak v dospělosti (9).
Plicní intersticiální glykogenóza
PIG se manifestuje nejčastěji hned po porodu, i když byly zaznamenány i případy, kdy se projevy onemocnění rozvinuly až několik týdnů po narození. U nemocných dominuje tachypnoe, hypoxémie, zatahování a inspirační chrůpky. U většiny dětí s PIG se v průběhu prvních let života situace upravuje, u některých ale může dlouhodobě přetrvávat nižší tolerance fyzické zátěže (10).
Diagnostika
Tabulka 3 zahrnuje typický radiologický obraz nemocí s plicním střádáním a diagnostické metody. Níže je uvedeno několik poznámek k diagnostice.
Tab. 3. Typický radiologický obraz a další diagnostické metody u chorob s plicním střádáním 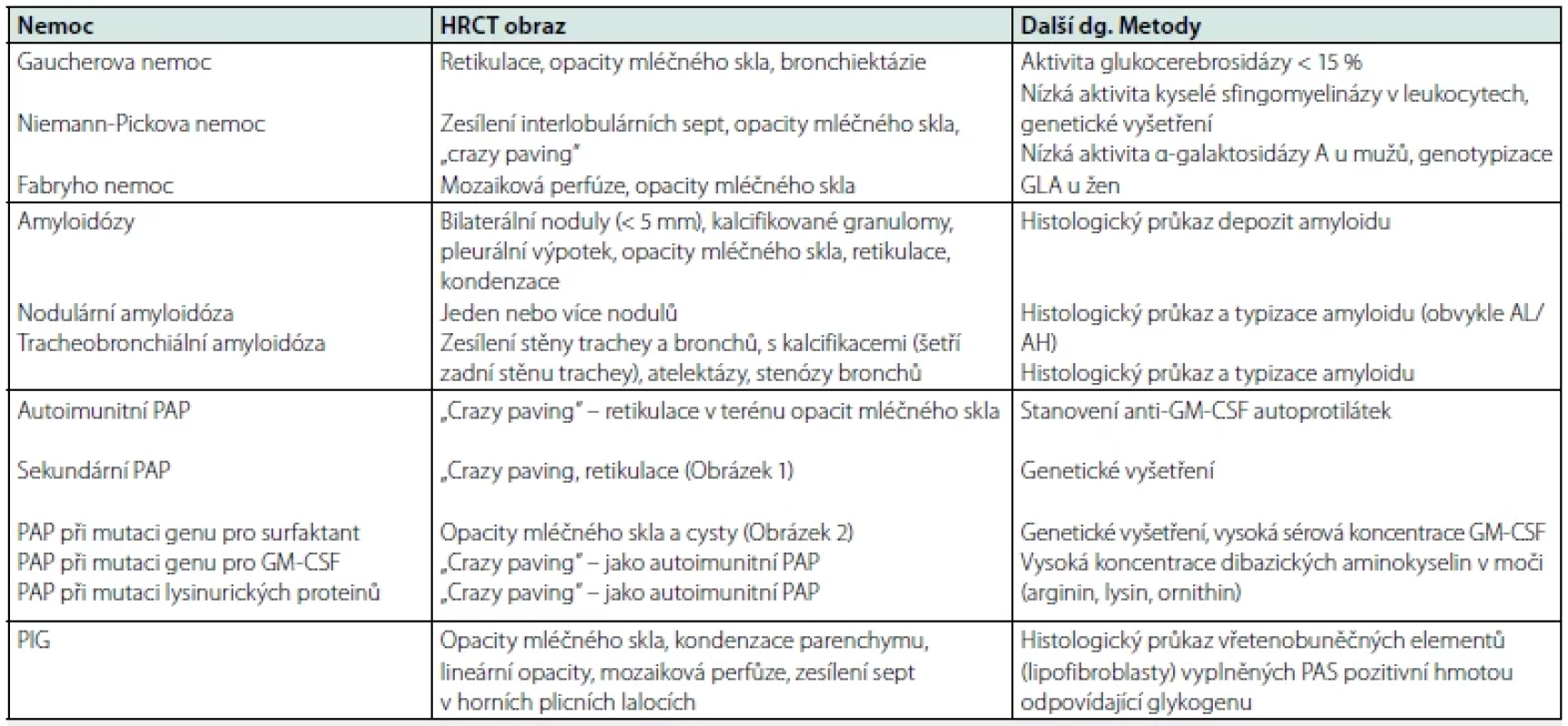
HRCT – počítačová tomografie s vysokou rozlišovací schopností; GLA – α‑ galaktosidáza; AL – amyloid z lehkých řetězců imunoglobulinů; AH – amyloid z těžkých řetězců imunogobulinů; PAP – plicní alveolární proteinóza; GM‑ CSF – kolonie stimulující faktor pro granulocyty a makrofágy; PIG – plicní intersticiální glykogenóza; PAS- periodic acid‑Schiff Lysozomální střádavé nemoci
V tekutině získané bronchoalveolární laváží u nemocných s Gaucherovou nemocí nacházíme pěnovité makrofágy s obsahem lipidů, u Niemann‑Pickovy choroby pak histiocyty s mnoha vakuolami a granuly, které se při barvení podle May‑Grunwald‑Giemsy barví jasně modře.
Amyloidóza
U nemocných s amyloidózou je diagnostika založena na histologickém vyšetření tkáně s průkazem tkáňových depozit amyloidu. U nemocných s transthyretinovou amyloidózou může v diagnostice pomoci také pyrofosfátový sken – scintigrafické vyšetření s využitím technecium 99 m‑pyrofosfátu (99mTc‑PYP). U nemocných s hematologickými malignitami a s AL/AH amyloidózou může na onemocnění upozornit přítomnost paraproteinu (v riziku jsou pacienti s monoklonální gamapatií nejasného významu, mnohočetným myelomem a dalšími dyskraziemi plazmatických buněk). Standardním barvením, které se používá k vizualizaci depozit amyloidu ve vzorku tkáně, je barvení konžskou červení s následným vyšetřením preparátů v polarizovaném světle. Patolog by měl kromě identifikace amyloidu popsat, zda jsou depozita amyloidu lokalizovaná stromálně, nebo vaskulárně. Dalším krokem, který je klíčovým pro specifikaci amyloidu, je imunofluorescenční vyšetření nativního vzorku nebo imunohistochemické vyšetření parafinem konzervovaného vzorku. V některých laboratořích lze k typizaci amyloidu využít také hmotnostní spektrometrie.
Plicní alveolární proteinóza
Diagnostickou metodou pro PAP je bronchoskopie s bronchoalveolární laváží. CAVE: pokud je laváž prováděna z málo postižené oblasti, získaná tekutina nemusí mít učebnicový mléčný charakter. Cytologicky bývá zachycena lymfocytóza a mandatorní při podezření na PAP je barvení PAS (periodic acid‑Schiff).
Léčba
Lysozomální střádávé nemoci
Gaucherova nemoc byla první lysozomální střádavou chorobou, kterou lze kauzálně léčit. Symptomatičtí pacienti s Gaucherovou nemocí 1. typu mohou být kandidáty substituční léčby (ERT, enzyme replacement therapy, používají se imigluceráza, velagluceráza, taligluceráza), která má výborný efekt při organomegalii a abnormalitách krevního obrazu, efekt na intersticiální plicní postižení nebo plicní hypertenzi, která tuto chorobu také může provázet, je sporný (11). ERT olipudázou alfa je od roku 2021 možností léčby pro pacienty s Niemann‑Pickovou nemocí (12). ERT (agalsidase alfa, agalsidase beta) lze nabídnout i nemocným s Fabryho chorobou, efekt na plicní postižení bývá ale minimální. Migalastat (chaperon) plicní postižení pravděpodobně též zásadně neovlivňuje (13).
Amyloidóza
Nodulární plicní amyloidóza (obvykle se jedná o depozita AL/AH amyloidu) při absenci postižení jiných orgánů může být řešena excizí ložiska bez nutnosti další systémové léčby. Tracheobronchiální amyloidóza také obvykle spočívá v depozitech AL amyloidu, velmi často bez příznaků systémové nemoci nebo dalšího mimoplicního postižení. V léčbě mohou být použity endobronchiální intervenční metody s cílem desobliterovat dýchací cesty, u nemocných s progresivním charakterem onemocnění byla využita i systémová léčba. Blíže se léčbě amyloidóz věnuje tabulka č. 4 (14–16).
Tab. 4. Léčba amyloidóz 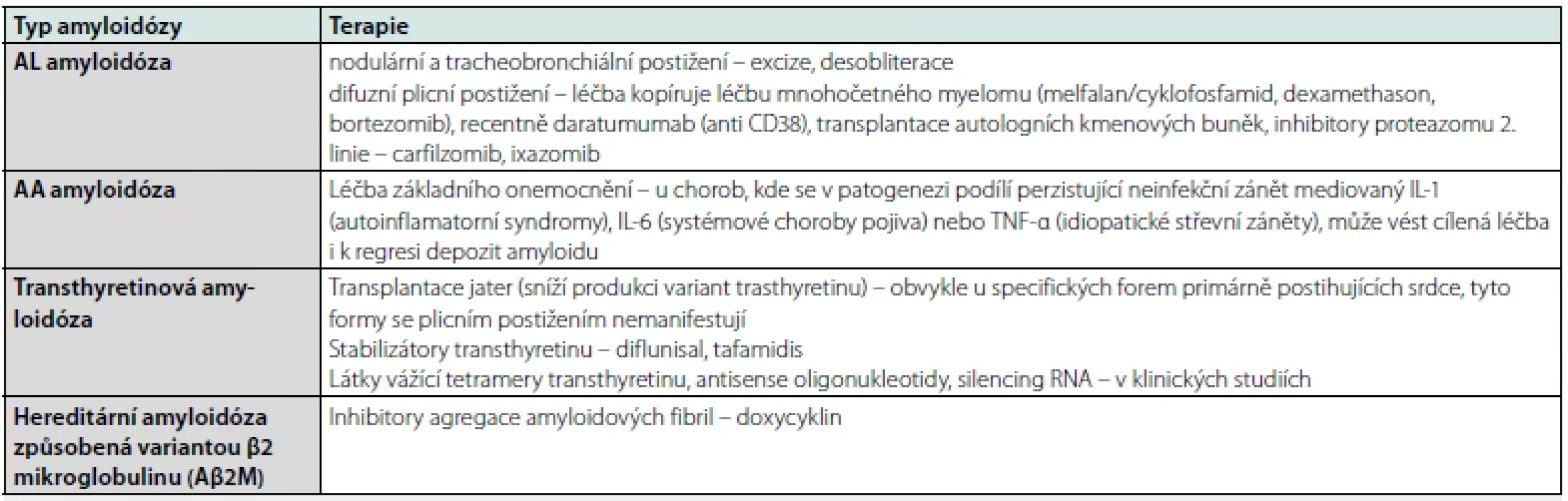
AL – amyloidóza z lehkých řetezců; IL-1 – interleukin 1; IL-6 – interleukin 6; TNF-α – transformující růstový faktor alfa; RNA – ribonukleová kyselina Plicní alveolární proteinóza
Léčba PAP se opírá o laváž celých plic v celkové anestezii. U autoimunitní PAP je alternativou celoplicní laváže podání GM‑CSF buď subkutánně, nebo inhalačně. U vybraných nemocných s autoimunitní PAP může mít příznivý efekt podání rituximabu nebo plazmaferéza. Geneticky podmíněná PAP při mutacích genů pro surfaktant může odpovídat dobře na systémovou kortikoterapii případně azitromycin a hydroxychlorochin. Léčba intolerance lysinurických proteinů se opírá o nízkoproteinovou dietu a podávání citrulinu, v případě manifestace PAP je doporučována laváž celých plic a nebulizace GM‑CSF. Vzhledem k tomu, že prognózu nemocných s PAP ovlivňují také oportunní infekce, za kterými stojí dysfunkce makrofágů, je ke zvážení dlouhodobá antibiotická profylaxe (17).
Plicní intersticiální glykogenóza
Léčba PIG je založena na podávání systémových glukokortikosteroidů s obvykle dobrým efektem, který je přičítán efektu této léčby na maturaci lipofibroblastů.
Závěr
Diferenciální diagnostika intersticiálních plicních procesů nebyla nikdy jednoduchá a vždy vyžadovala a vyžaduje multidisciplinární přístup. Pro správné rozhodnutí jsou ale klíčovým momentem kvalitní vstupní data. Ošetřující lékař pacienta musí vždy řešit pacienta jako celek a nebagatelizovat mimoplicní postižení. Právě kombinace mimoplicního postižení a intersticiálního plicního procesu jsou typickým znakem některých vzácnějších nozologických jednotek včetně lysozomálních střádavých nemocí nebo amyloidóz. Vzhledem k tomu, že u řady těchto procesů byla prokázána genetická predispozice a dědičnost, je potřeba vždy důkladně odebrat také rodinnou anamnézu, někdy i v širších souvislostech. U celé řady těchto vzácných onemocnění je k dispozici specifická léčba, která modifikuje průběh choroby a zlepší prognózu pacienta. Bez správné diagnózy však dveře k těmto moderním postupům zůstávají zavřené.
Anotace: RVO FN Motol 00064203.
KORESPONDENČNÍ ADRESA AUTORKY:
doc. MUDr. Martina Šterclová, Ph.D.
martina.sterclova@ftn.cz
Pneumologická klinika 2. LF UK a FN Motol
Vídeňská 800, 140 00 Praha 4 – KrčCit. zkr: Vnitř Lék. 2022;68(8):525-531
Článek přijat redakcí: 12. 9. 2022
Článek přijat po recenzích: 26. 10. 2022
Zdroje
1. Ramaswami U, Mengel E, Berrah et al. Throwing a spotlight on under‑recognized manifestations of Gaucher disease: Pulmonary involvement, lymphadenopathy and Gaucheroma. Mol Genet Metab. 2021;133(4):335-344.
2. Myerowitz R, Puertollano R, Raben N. Impaired autophagy: The collateral damage of lysosomal storage disorders. EBioMedicine. 2021;63 : 103166.
3. Faverio P, Stainer A, De Giacomi F, Gasperini S, Motta S, Canonico F, Pieruzzi F, Monzani A, Pesci A, Biondi A. Molecular Pathways and Respiratory Involvement in Lysosomal Storage Diseases. Int J Mol Sci. 2019;20(2):327.
4. Benson MD, Buxbaum JN, Eisenberg DS, Merlini G, Saraiva MJM, Sekijima Y, Sipe JD, Westermark P. Amyloid nomenclature 2020: update and recommendations by the International Society of Amyloidosis (ISA) nomenclature committee. Amyloid. 2020;27(4):217-222.
5. Iftikhar H, Nair GB, Kumar A. Update on Diagnosis and Treatment of Adult Pulmonary Alveolar Proteinosis. Ther Clin Risk Manag. 2021;17 : 701-710.
6. Liptzin DR, Baker CD, Darst JR, Weinman JP, Dishop MK, Galambos C, Brinton JT, Deterding RR. Pulmonary interstitial glycogenosis: Diagnostic evaluation and clinical course. Pediatr Pulmonol. 2018;53(12):1651-1658.
7. Borie R, Crestani B, Guyard A, Lidove O. Interstitial lung disease in lysosomal storage disorders. Eur Respir Rev. 2021;30(160):200363.
8. Baker KR, Rice L. The amyloidoses: clinical features, diagnosis and treatment. Methodist Debakey Cardiovasc J. 2012;8(3):3-7.
9. Salvaterra E, Campo I. Pulmonary alveolar proteinosis: from classification to therapy. Breathe (Sheff). 2020;16(2):200018.
10. Seidl E, Carlens J, Reu S, et al. Pulmonary interstitial glycogenosis - A systematic analysis of new cases. Respir Med. 2018;140 : 11-20.
11. Pastores GM, Hughes DA. Gaucher Disease. 2000 Jul 27 [updated 2018 Jun 21]. In: Adam MP, Everman DB, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2022.
12. Thurberg BL, Diaz GA, Lachmann RH, Schiano T, Wasserstein MP, Ji AJ, Zaher A, Peterschmitt MJ. Long‑term efficacy of olipudase alfa in adults with acid sphingomyelinase deficiency (ASMD): Further clearance of hepatic sphingomyelin is associated with additional improvements in pro - and anti‑atherogenic lipid profiles after 42 months of treatment. Mol Genet Metab. 2020;131(1-2):245-252.
13. Beck M, Ramaswami U, Hernberg‑Ståhl E, Hughes DA, Kampmann C, Mehta AB, Nicholls K, Niu DM, Pintos‑Morell G, Reisin R, West ML, Schenk J, Anagnostopoulou C, Botha J, Giugliani R. Twenty years of the Fabry Outcome Survey (FOS): insights, achievements, and lessons learned from a global patient registry. Orphanet J Rare, DiS. 2022;17(1):238.
14. Moy LN, Mirza M, Moskal B, Asado N, Shah B, Bitran J. Pulmonary AL amyloidosis: A review and update on treatment options. Ann Med Surg (Lond). 2022;80 : 104060.
15. Raimondi S, Porcari R, Mangione PP et al. A specific nanobody prevents amyloidogenesis of D76N β2-microglobulin in vitro and modifies its tissue distribution in vivo. Sci Rep. 2017;7 : 46711.
16. Nevone A, Merlini G, Nuvolone M. Treating Protein Misfolding Diseases: Therapeutic Successes Against Systemic Amyloidoses. Front Pharmacol. 2020;11 : 1024.
17. Ataya A, Knight V, Carey BC, Lee E, Tarling EJ, Wang T. The Role of GM‑CSF Autoantibodies in Infection and Autoimmune Pulmonary Alveolar Proteinosis: A Concise Review. Front Immunol. 2021;12 : 752856.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Hlavní téma – Hematologie
- Dnešní pohled na dědičné trombofilie
- Venózní tromboembolismus u antifosfolipidového syndromu
- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Vývoj léčby žilní trombózy od pijavic k mechanické trombektomii
- Tradiční a nové biomarkery kongesce u srdečního selhání
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Plicní střádání
- Porucha kognitivních funkcí a hrozba pandemie demence aneb cesta hypertoniků k nesoběstačnosti
- Antitrombotická léčba a digestivní endoskopie
- Jak dobře jsme léčili hypertenzi v posledních 25 letech?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vybrané závažné „hematologické“ syndromy u dospělých pacientů v intenzivní péči
- Dnešní pohled na dědičné trombofilie
- Alergenová imunoterapie v léčbě alergického eozinofilního astmatu
- Antitrombotická léčba a digestivní endoskopie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



