-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tranzientní elastografie – přínos v hodnocení vývoje jaterního onemocnění
Transient elastography – role in the assessment of the liver disease development
Transient elastography, an examination based on the liver stiffness measurement, is a method validated for the non-invasive liver fibrosis staging. This method was recently successfully introduced into routine clinical practice. In accordance with the global - wide screening of viral hepatitis (chronic viral hepatitis type B and type C) and with the increasing effectiveness of antiviral therapy, as well as with the increasing prevalence of non-alcoholic fatty liver disease (NAFLD), the part of population requiring the care of hepatologists is certain to increase. Now more than ever we need a non-invasive, fast, safe, inexpensive and reliable method for evaluating patients with chronic liver disease. A new area of use of elastography appears to be used to measure the stiffness of the spleen as a prediction of the presence of esophageal varices or the stiffness (or rather fibrosis) of transplanted kidneys. The aim of this review is to provide a comprehensive view of transient elastography, its principles, advantages and pitfalls, including its use in everyday clinical practice.
Key words:
cirrhosis – fibrosis – renal allograft – transient elastography
Autoři: Nikola Uzlová 1; Nikola Mejzlíková 1; Soňa Fraňková 2; Pavla Libicherová 1; David Nosek 1; Ivan Rychlík 1
Působiště autorů: I. interní klinika 3. LF UK a FN Královské Vinohrady, Praha 1; Klinika hepatogastroenterologie IKEM, Praha 2
Vyšlo v časopise: Vnitř Lék 2018; 64(10): 916-922
Kategorie: Přehledné referáty
Souhrn
Tranzientní elastografie je ultrasonografické vyšetření založené na metodě měření tuhosti jaterní tkáně. Jedná se o ověřenou metodu, která je určena k neinvazivnímu hodnocení stupně jaterní fibrózy a která je již zavedena do klinické praxe. V kontextu celosvětově rozšířeného screeningu virových hepatitid (chronických virových hepatitid B a C) a s narůstající efektivitou jejich terapie, stejně jako se vzrůstající prevalencí nealkoholového ztučnění jater (Non-Alcoholic Fatty Liver Disease – NAFLD) roste i potřeba vyšetření hepatologem. Nyní více než dříve potřebujeme neinvazivní, rychlou, bezpečnou, levnou a spolehlivou metodu k vyšetřování pacientů s chronickým jaterním onemocněním. Novou oblastí využití elastografie se jeví použití k měření tuhosti sleziny jako predikce přítomnosti jícnových varixů či k měření tuhosti, resp. stupně fibrózy transplantované ledviny. Cílem tohoto přehledového článku je podat souhrnný pohled na metodu tranzientní elastografie, její principy, výhody i nástrahy, včetně jejího využití v praxi.
Klíčová slova:
cirhóza – fibróza – štěp ledviny – tranzientní elastografie
Úvod
Jaterní fibróza a cirhóza jsou nevyhnutelným důsledkem chronického jaterního onemocnění. Diagnostika fibrózy se dosud opírala o histologický průkaz v jaterní biopsii. Bylo otázkou času, kdy potřeba kvantitativně a neinvazivně měřit tuhost jaterní tkáně povede k rozvoji sofistikované techniky, jako je elastografie. Výzkum na tomto poli byl zahájen teprve v 80. letech 20. století. Klinicky nejvíce ověřenou metodou je kvantitativní elastografie provedená metodou Vibration-Controlled Transient Elastography (VCTETM), tedy mechanickým energetickým impulzem. Přístroj Fibroscan® (Echosens, France), který je založen na metodě VCTETM, je čím dál tím častěji používán v každodenní rutinní praxi. Vyšetření se tak stalo alternativou k jaterní biopsii v diagnostice jaterní fibrózy a cirhózy jater [1]. Druhým typem elastografie je metoda s ultrasonografickým silným impulzem zahrnující bodovou elastografii Acustic Radiation Force Impuls (ARFI) a 2D shear wave elastografii (SWE) . Jejich výhodou je integrace do konvenčního ultrasonografického (USG) přístroje.
Princip metody
Tranzientní elastografie (Vibration-controlled transient elastography – VCTE), přístroj FibroScan® (Echosens, Paris, France), pracuje na principu užití Youngova modulu pružnosti. Jedná se o jednoúčelový ultrasonografický (USG) přístroj k měření tuhosti jaterní tkáně. Principem metody je měření rychlosti propagace USG vlny v závislosti na pružnosti (resp. tuhosti) vyšetřované tkáně.
VCTE měří rychlost příčné vlny (shear wave) procházející játry. Vyšetřovací sonda obsahuje USG transducer, který vysílá a snímá mechanickou vlnu (vibraci) generovanou nízkou frekvencí (50 Hz). Vyšetřovací sonda je umístěna do mezižeberního prostoru vpravo (6.–8. mezižebří), nad pravý lalok jaterní, obvykle do místa, v němž by byla prováděna jaterní biopsie (zhruba na spojnici mečovitého výběžku hrudní kosti a střední axilární čáry), obr. 1 . Rychlost odražené příčné vlny je měřena v hloubce 2,5–6 cm od kožního povrchu, je konvertována použitím Hookova zákona do tzv. Liver Stiffness Measurement (LSM) – měření jaterní tuhosti. Výsledná hodnota tuhosti jaterní tkáně je vyjádřena na základě Youngova modulu pružnosti v kilopaskalech (kPa) [1,2]. Výsledek vyšetření je udáván jako medián všech platných měření tuhosti při běžném vyšetření. Software automaticky vypočítá i poměr interkvartilového rozpětí a mediánu hodnot všech platných měření (IQR/medián), který nemá přesáhnout 30 % hodnot LSM > 7,1 kPa. Výrobce doporučuje provést alespoň 10 platných měření [3]. Uvedený způsob měření tak umožňuje získat konzistentní odhad tuhosti jater. S novějšími typy zařízení vyšetření obvykle trvá 2–5 min. Vyšetřovanou oblastí je válec jaterní tkáně o délce 40 mm a průměru 10 mm (jeho skutečná velikost však závisí na vlnové délce příčné vlny). Tento objem je asi 200krát větší než je objem tkáně obvykle získaný při perkutánní necílené jaterní biopsii (váleček 20 × 1 mm) [1,2].
Obr. 1. Vyšetření pacienta přístrojem FibroScan® 502 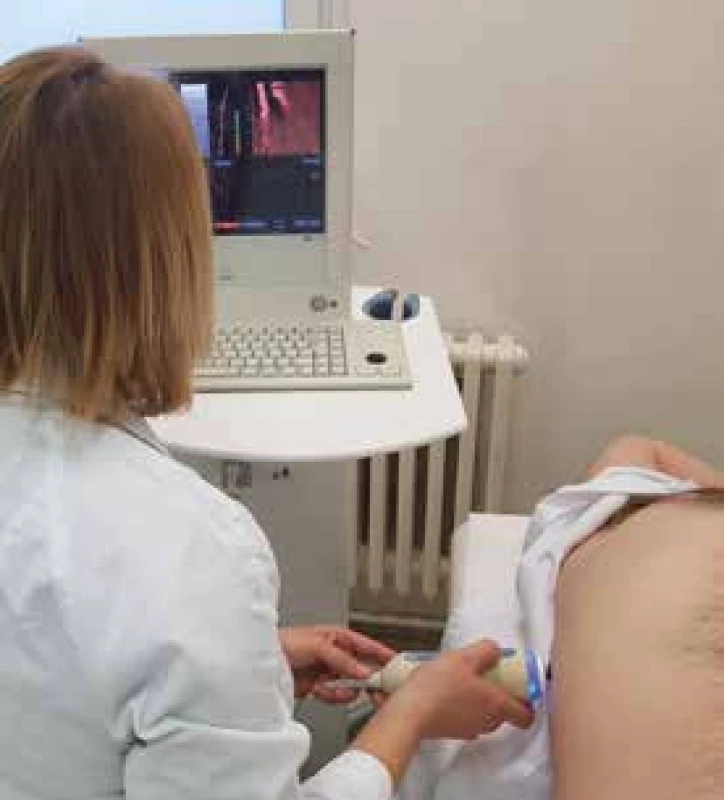
Limity vyšetření – zkreslující faktory
Hlavním omezením použití přístroje FibroScan je přítomnost ascitu a významné obezity u vyšetřované osoby, a to vzhledem ke skutečnosti, že v tekutině se příčné vlny nešíří a tuková tkáň jejich šíření významně tlumí. V případě přítomnosti ascitu přístroj není schopen provést měření, avšak víme, že ascites je již sám o sobě známkou pokročilého jaterního onemocnění. Měření je možno provést po úplné eliminaci ascitické tekutiny. Existují další důležité zkreslující jevy měření tuhosti jaterní tkáně zahrnující zánět, cholestázu, městnavá játra a příjem potravy před vyšetřením [4].
Tloušťka podkožní tkáně může mít za následek silné aberace ultrasongrafických anebo příčných vln. V důsledku toho dochází k chybám měření, nebo dokonce není možné pacienta vyšetřit. Reprodukovatelnost VCTE byla validována na více skupinách, poprvé v roce 2007. Tato skupina zahrnovala 800 pacientů, u kterých bylo provedeno vyšetření VCTE, z nichž 2,4 % mělo neurčité výsledky [5]. Faktory významně spojené se selháním vyšetření zahrnovaly zvýšení indexu tělesné hmotnosti (Body Mass Index – BMI) ≥ 25 kg/m2, steatózu a nízký stupeň fibrózy. Podobně i v dalších studiích bylo prokázáno selhání metody, které při BMI > 40 kg/m2 dosáhlo až 88 % vyšetřených [5]. Studie autorů Castéra et al, prokázala selhání metody u pacientů s BMI > 30 kg/m2 (odds ratio – OR 7,5). Konečně selhání metody je spojeno i se zkušenostmi vyšetřujícího, který provedl méně než 500 vyšetření [6]. Nicméně, nyní je k dispozici i tzv. XL sonda, která tato omezení překonává díky změně proporcí a nastavení vyšetřovací sondy.
Kromě obezity může mít vliv na LSM v podstatě jakýkoliv proces, který mění jaterní viskoelasticitu. Zánět jater, akutní nebo chronický, může vést k falešně zvýšeným hodnotám LSM. Nevýrazná steatóza sama o sobě nemá vliv na VCTE na rozdíl od steatohepatitidy. Extrahepatální cholestáza, hepatální městnání kardiogenní etiologie, ukládání amyloidu a požití jídla před vyšetřením jsou situace, u kterých byl prokázán vliv na tuhost jater při měření VCTE. V neposlední řadě hraje úlohu i zkušenost vyšetřujícího. Obecně platí, že vyšetřující by ideálně měl mít provedeno více než 500 vyšetření, aby získal potřebnou rutinu [4].
Stručně řečeno, existuje několik faktorů, které je třeba brát v úvahu z pohledu kvality vyšetření. V současné době je doporučováno provedení alespoň 10 platných měření provedených v jednom místě pravého laloku jater, s maximálním poměrem IQR/medián 30 %, pouze pokud je konečný výsledek měření tuhosti jater > 7,1 kPa [7,8]. Dřívější podmínka, že úspěšnost měření LSM musí být minimálně 60 %, již neplatí. Úspěšnost měření není relevantním kritériem. Pacienti by měli být vyšetřeni nalačno, alespoň 2 hod, v ideálním případě 3 hod po jídle (tab. 1) [9–11]. Měl by být brán zřetel na elevaci aktivity jaterních aminotransferáz nad 3násobek normy, která je známkou aktivního jaterního onemocnění, což vede ke zkreslení měření ve smyslu nadhodnocení výsledků (falešná pozitivita) .
Tab. 1. Korelace mezi LSM (kPa) a stadiem fibrózy ve vztahu k etiologii jaterního onemocnění. Upraveno podle [13–15] ![Korelace mezi LSM (kPa) a stadiem fibrózy ve vztahu k etiologii jaterního onemocnění.
Upraveno podle [13–15]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fa17b7a34caf6c745c4579f35f71cf04.jpeg)
alkohol – alkoholové poškození jater s normální hladinou jaterních enzymů HBV – chronická virová hepatitida B HCV – chronická virová hepatitida C HCV/HIV – koinfekce HCV a HIV HCV (rekurence) – rekurence HCV po transplantaci jater LSM – měření jaterní tuhosti/Liver Stiffness Measurement NAFLD – nealkoholové ztučnění jater/Non-Alcoholic Fatty Liver Disease Kritéria spolehlivého vyšetření
- minimálně 10 platných měření provedených v jednom místě v pravém laloku jater
- poměr IQR/medián ≤ 30 %, pouze pokud je hodnota LSM > 7,1 kPa
- vyšetření provádět minimálně 2, ideálně 3 hod po jídle
Hodnocení výsledků vyšetření
Tuhost jaterní tkáně se zvyšuje se stupněm fibrózy, což bylo prokázáno v mnoha srovnávacích studiích s histologickými nálezy především u pacientů s chronickou hepatitidou B a C, cholestatickými onemocněními, alkoholickou chorobou jater a v poslední době i s nealkoholovým ztučněním jater. Na základě metaanalýzy zahrnující 38 studií byl pro diagnostiku významné fibrózy, u níž byla průměrná AUROC 0,84 (0,82–0,86), resp. 0,91 po zavzetí pouze kvalitní jaterní biopsie, stanovena optimální hodnota cut-off 7,7 kPa. Pro diagnózu cirhózy byla průměrná AUROC 0,94 (0,93–0,95), resp. 0,99 a po zavzetí pouze kvalitní jaterní biopsie, s optimální hodnotou cut-off 13,0 kPa [1,2].
Na základě studie, která porovnávala histopatologické obrazy s hodnotami LSM, byly stanoveny všeobecné cut-off hodnoty pro jednotlivá stadia fibrózy v korelaci s Metavir skóre [12]. Na základě mnoha studií pak byla výrobcem navržena skórovací tabulka, která koreluje s histologickou klasifikací Metavir a je evaluována dle etiologie jaterního onemocnění (tab) [13–15]. Tato tabulka slouží jako vodítko k interpretaci výsledků měření a konečné zhodnocení je na ošetřujícím lékaři.
Hodnocení fibrózy u pacientů s chronickou virovou hepatitidou C
Nejvíce studií, na základě kterých byly stanoveny klíčové parametry pro vyšetření, bylo provedeno u pacientů s chronickou virovou hepatitidou C (HCV). V některých z nich byla prokázána korelace mezi histologicky verifikovanou významnou zánětlivou aktivitou se zvýšenými hodnotami ALT se vzrůstající hodnotou LSM. Tak jak byla u těchto pacientů histologicky potvrzena stadia F0-F2, tak při vyšetření přístrojem FibroScan byly některé hodnoty rovny přítomnosti cirhózy. Tyto nálezy byly podpořeny dalšími vyšetřeními, podle nichž došlo k poklesu LSM v průběhu antivirové terapie [15].
Hodnocení fibrózy u pacientů s chronickou virovou hepatitidou B
Indikace k léčbě chronické virové hepatitidy B (HBV) je založena na tíži zánětlivého poškození, tedy sérových koncentracích ALT v séru, hodnotách HBV DNA a často i histologickém nálezu. Vzhledem k ovlivnění LSM při zánětlivé odpovědi v játrech byl navržen speciální algoritmus pro použití VCTE u HBV. Při normálních hodnotách ALT a hodnotách LSM 6,0–9,0 kPa biopsii provádět nemusíme, avšak při zvýšení ALT nad horní limit a při hodnotách LSM 7,0–12,0 kPa bychom měli biopsii zvážit [4,16].
Hodnocení fibrózy u pacientů s NAFLD
V USA je prevalence NAFLD 46 % a neakoholické steatohepatitidy (Non-Alcoholic Steatohepatitis – NASH) 12 % [4]. Přesná prevalence těchto onemocnění v České republice není známa [17]. Vzhledem k rostoucímu počtu pacientů s NAFLD je v zájmu lékařské veřejnosti zajistit screeningovou metodu, která by odhalila stupeň pokročilosti tohoto onemocnění, navíc s ohledem na nízkou finanční náročnost a prakticky žádná rizika spojená s výkonem. VCTE je schopna posoudit stupeň fibrózy nebo přítomnost cirhózy, nikoli však diferencovat prostou steatózu od NASH. Problém nastává u pacientů s BMI > 30 kg/m2, u nichž tato metoda selhává až v 20–25 % [18]. Zavedením XL sondy byla překonána tloušťka podkožního tuku, tedy vzdálenost od kožního povrchu k povrchu jater, jak prokázaly i některé studie, které se tímto problémem zabývaly [4]. Ve srovnání s M sondou má XL sonda větší průměr špičky, nižší centrální frekvenci a větší amplitudu kmitu. Měření tuhosti jater tudíž probíhá ve větší hloubce (3,5–7,5 cm). U pacientů s BMI > 30 kg/m2 tak došlo ke snížení selhání metody o polovinu, tj. z 50 % u M sondy na 25 % u osob vyšetřovaných XL sondou. Několik vyšetřujících zjistilo, že LSM podle XL sondy je nižší než u M sondy až o 1,7 ± 2,3 kPa [19,20]. Ačkoli tato nová sonda zlepšuje spolehlivost VCTE u obézních pacientů, je nutný další výzkum ke stanovení hodnoty cut-off pro vyšší BMI ke zlepšení spolehlivosti a přesnosti vyšetření.
Vyšetření pacientů s alkoholickou chorobou jater
Alkoholická choroba jater je hlavně v počátečních stadiích charakterizována perisinusoidální fibrózou, při pokročilém nálezu cirhózou a přítomností významného zánětu, což vede ke zkreslení LSM. Abstinence může dramaticky ovlivnit výsledky VCTE. Abstinence je spojena s poklesem LSM zhruba o 4,9 kPa. LSM se signifikantně snižuje již po 7 dnech abstinence, což má za následek snížení odhadovaného stadia fibrózy [21]. Vzhledem k této skutečnosti musí lékař při vyšetření brát v úvahu současné množství konzumovaného alkoholu a přítomnost možné alkoholické steatohepatitidy [4].
Cholestatická onemocnění
Zkušenosti s VCTE u biliárních onemocnění jater jsou omezené. Extrahepatální cholestáza zvyšuje tuhost jater u všech pacientů. U nemocných s primární biliární cholangiitidou (PBC) jsou cut-off hodnoty tuhosti pro pokročilou fibrózu (F3-F4) a cirhózou 9,8, resp. 17,3 kPa, LSM 9,8 kPa byla spojena s OR 72,7 (95 % CI: 11,0–1488,2) indikující přítomnost pokročilé fibrózy. V poslední době je zkoumána role VCTE u pacientů s PBC léčenou kyselinou ursodeoxycholovou. Autoři zjistili, že celková míra progrese je 0,48 ± 0,21 kPa za rok, ale nebyla zjištěna žádná progrese ve stadiích Metavir [22].
Predikce progrese jaterního onemocnění
Zvýšení tuhosti jater koreluje s tíží portální hypertenze. VCTE může predikovat významnou portální hypertenzi (jaterní žilní tlakový gradient/Hepatic Venous Pressure Gradient – HVPG ≥ 10 mm Hg), přítomnost jícnových varixů a vyšší riziko krvácení. Pacienti s výsledky LSM ≤ 20 kPa a trombocyty > 150 000 nemusí podstupovat endoskopické vyšetření [23]. Poměrně novou záležitostí v tranzientní elastografii je měření tuhosti sleziny, což má rovněž za cíl predikovat tíži portální hypertenze. Tuhost sleziny ukazuje městnání ve slezině, a tím reflektuje tlak v portálním systému. Je však zapotřebí uspořádat více studií k měření tuhosti sleziny. Poprvé byla tato metoda popsána v roce 2011. Optimální cut-off bylo 52,5 kPa, AUROC činilo 0,74 pro predikci přítomnosti varixů [24].
Portální hypertenze a dekompenzace jaterní cirhózy
Metaanalýza u 150 francouzských pacientů, kteří podstoupili transjugulární jaterní biopsii a měření portálního tlaku, z nichž 59 % mělo cirhózu, byla LSM ≥ 21 a HPVG ≥ 10 mm Hg. Cut-off 11,7 kPa měl pozitivní prediktivní hodnotu (Positive Predictive Value – PPV) a negativní prediktivní hodnotu (Negative Predictive Value – NPV) z 77,4 % a 93,1 % v uvedeném pořadí, zatímco 21,0 kPa měl PPV a NPV 92,5 % a 90,7 % v uvedeném pořadí [25]. V retrospektivní americké studii, která analyzovala 124 pacientů s cirhózou, kteří podstoupili endoskopii, z nichž 63 mělo jícnové varixy, bylo zjištěno, že tuhost jater s cut-off 20 kPa podle VCTE přineslo PPV a NPV pro přítomnost varixů 80 a 75 %. Ukázalo se, že VCTE je stejně účinná jako měření tlakového gradientu v predikci klinické dekompenzace pacientů s cirhózou [4]. Další studie ukázala, že u pacientů s cirhózou na podkladě PBC, kteří byli opakovaně vyšetřování VCTE, došlo ke zvýšení tuhosti jater, která byla spojena s klinickými důsledky, jako je dekompenzace, transplantace jater nebo úmrtí. Stejně tak v kohortě 128 korejských pacientů s cirhózou při hepatitidě B bylo cut-off 19 kPa pro riziko rozvoje klinické dekompenzace včetně hepatocelulárního karcinomu [26].
Jícnové varixy
Rumunská studie na 1 000 pacientech s cirhózou jater prokázala, že průměrné hodnoty LSM u 647 pacientů bez jícnových varixů nebo s varixy 1. stupně byly statisticky významně nižší než u 353 pacientů s významnými varixy (26,29 ± 0,60 kPa vs 45,21 ± 1,07 kPa, p < 0,0001). Na základě výsledků tak stanovili cut-off hodnotu 31 kPa pro přítomnost jícnových varixů s citlivostí 83 % (95% CI: 79,73–85,93 %) a specificitou 62 % (95% CI: 57,15–66,81 %), PPV (95% CI: 72,72–79,43 %) a 71,3 % NPV (95% CI: 66,3–76,05 %) (AUROC 0,7807, P < 0,0001). Průměrné hodnoty LSM u pacientů s pozitivní anamnézou variceálního krvácení (165 pacientů) byly statisticky signifikantně vyšší než u pacientů bez proběhlého krvácení (375 pacientů). Pro predikci krvácení z jícnových varixů byla stanovena cut-off hodnota na 50,7 kPa se senzitivitou 53,33 % a specificitou 82,67 % [27].
V roce 2013 byla provedena metaanalýza zahrnující 3 644 pacientů (18 studií) s cílem posoudit schopnost LSM v predikci portální hypertenze, stejně jako přítomnosti a velikosti jícnových varixů. Celková citlivost a specificita byla 0,90 (95% CI: 0,81–0,95) a 0,79 (95% CI: 0,58–0,91) pro významnou portální hypertenzi a 0,87 (95% CI: 0,80–0,92) a 0,53 (95% CI: 0,36–0,69) u jícnových varixů a 0,86 (95% CI: 0,71–0,94) a 0,59 (95% CI: 0,45–0,72) u velkých jícnových varixů. Metaanalýza prokázala, že tranzientní elastografie je dobrým nástrojem pro identifikaci portální hypertenze, nicméně pro predikci přítomnosti či velikosti jícnových varixů se zdá být nedostatečná [28].
Hepatocelulární karcinom
Cirhóza jater je současně prekancerózou hepatocelulárního karcinomu (HCC). HCC má celosvětově 3. největší mortalitu mezi nádorovými onemocněními celkově. 80–90 % HCC vzniká v terénu cirhózy. Multicentrická retrospektivní studie zahrnující 432 pacientů s cirhózou jater a s LSM ≥ 20 kPa prokázala, že riziko HCC se zvyšuje se vzrůstajícími hodnotami LSM. U 41 pacientů, kteří byli 3 roky vyšetřováni přístrojem FibroScan, se rozvinul hepatocelulární karcinom. Pacienti s LSM 30–40 kPa mají trojnásobně vyšší riziko rozvoje HCC než pacienti s LSM 20–25 kPa. Riziko stoupá statisticky signifikantně na 4,8násobek u LSM > 40 kPa. FibroScan umožňuje spolehlivou neinvazivní stratifikaci rizika rozvoje HCC [29].
Regrese jaterní fibrózy
Tranzientní elastografie umožnila častější sledování pacientů s HCV po antivirové terapii. V posledních letech přibývá studií, které dokazují přítomnost regrese jaterní fibrózy a reverzibilitu jaterní cirhózy, nejvíce studií s chronickými virovými hepatitidami C a B. Studie na 91 pacientech s HCV a LSM > 7,0 kPa prokázala signifikantní pokles tuhosti jaterní tkáně již během terapie a další pokles po ukončení antivirové terapie po dosažení setrvalé virologické odpovědi (sustained virological response – SVR). Vyšetření provedené dříve než 6 měsíců po ukončení terapie odráží spíš regresi nekroinflamatorního procesu než regresi jaterní fibrózy. Signifikantní pokles LSM je detekovatelný až po 1,5–3 letech sledování [30].
Kazuistika
Na našem pracovišti se opakovaně setkáváme s poklesem LSM během a po antivirové terapii. Jako příklad uvádíme kazuistiku 57letého pacienta s HCV. Pacient byl poprvé léčen v roce 2010 kombinací pegylovaného interferonu a ribavirinu. Na počátku terapie došlo k výraznému zvýšení virové nálože, proto došlo k předčasnému ukončení terapie. Následně došlo ke konverzi na genotyp 2. Pacient byl u nás poprvé vyšetřen v roce 2013, tehdy výsledky byly LSM 23,3 kPa (F4 dle Metavir). Bylo rozhodnuto o zahájení antivirové terapie, opět pegylovaným interferonem a ribavirinem a počátkem roku 2014 byla zahájena 6měsíční terapie. Další kontrola proběhla ke konci roku 2014, po ukončení terapie. Naměřené hodnoty LSM poklesly na 17, 7 kPa, tedy o 5,6 kPa, odpovídající stále stadiu F4. Poslední kontrola proběhla na konci roku 2015 při SVR 16 měsíců, s normálními laboratorními hodnotami jaterních enzymů. Vyšetření ukázalo pokles hodnot LSM na 8,9 kPa, tedy do stadia fibrózy F2.
Výsledkem je pokles LSM o 2 stupně dle Metavir. Vstupně se tedy nemuselo jednat o přítomnost cirhózy jater, ale pravděpodobně o těžkou fibrózu s aktivně probíhajícím zánětem, který měl za následek nadhodnocení vyšetření. Prvotní pokles LSM po terapii hodnotíme jako vymizení nekroinflamatorního procesu. Další pokles LSM by již mohl být regresí fibrózy. U tohoto pacienta by měla proběhnout další kontrola, zda dochází k další regresi fibrózy. Na místě je potom posouzení, zda je nutné pacienta nadále sledovat v poradně i po úspěšné terapii. U pacientů, kteří měli před léčbou stadium fibrózy F3 a F4, se dle současných poznatků doporučuje provádět i nadále screening HCC. Naopak pacienti, kteří měli před léčbou F 0–2 je možné po roce negativní hladiny HCV RNA vyřadit z dispenzarizace, pokud nemají jinou jaterní nemoc [31].
Hodnocení stupně steatózy
Technika vyvinutá pomocí VCTE k hodnocení stupně steatózy se nazývá Controlled Attenuation Parameter (CAP). Jedná se o algoritmus založený na zeslabení ultrasonografických vln ve steatotických játrech. Sleduje rychlost atenuace USG vln při průchodu játry o frekvenci 3,5 MHz. CAP používá stejná data jako LSM a je hodnocen pouze v případě, že je měření platné. Vyjadřuje se v decibelech na metr. V původní práci, v níž bylo vyšetření porovnáváno s histologickými nálezy [32], měl CAP AUROC 0,91, 0,95 a 0,89 pro stupeň steatózy 1, 2 a 3. Stejní autoři poté hodnotili 615 pacientů s chronickou HCV, u nichž CAP měl AUROC 0,80, 0,86 a 0,88 pro stupně steatózy 1, 2 a 3. Vzhledem k tomu, že steatóza je reverzibilním markerem odrážejícím potenciální jaterní poškození, je CAP slibnou vyšetřovací metodou k hodnocení rizik a zvolení vhodné terapeutické strategie pro lékaře v běžné klinické praxi. Klinické využití CAP u NASH a netrpělivě očekáváno je v kombinaci s XL sondou [4].
Neinvazivní hodnocení fibrózy ledvinného štěpu
Vzhledem k fyzikálním limitacím přístroje FibroScan není možné hodnotit orgány uložené hlouběji pod kožním povrchem. Proto není možné použít FibroScan např. na vyšetření ledvin, nicméně využití jeho potenciálu se jeví jako reálné při vyšetření transplantované ledviny, která se obvykle ukládá do pravé jámy kyčelní a je tudíž dobře přístupná vyšetření. Chronické poškození štěpu (Chronic Allograft Injury – CAI) je nejběžnějším případem selhání štěpu ledviny po prvním roce po transplantaci. Německá studie z Berlína provedená na 57 pacientech, z nichž 20 podstoupilo též biopsii ledvinného štěpu, prokázala, že tuhost štěpu ledviny signifikantně koreluje s rozsahem intersticiální fibrózy [33]. Další studie, provedená v Heidelbergu, zahrnující 164 pacientů po transplantaci ledviny, prokázala signifikantní tuhost ledviny u histologicky verifikované pokročilé fibrózy. Tuhost ledviny (Kidney Stiffness – KS) rovněž korelovala s hodnotami renálních funkcí, resp. glomerulární filtrace [34].
Závěr
Vyšetření tranzientní elastografií je přínosem v rutinní praxi při hodnocení pokročilosti jaterního onemocnění převážně u pacientů s chronickými virovými hepatitidami a nově i u pacientů s metabolickým onemocněním jater (NAFLD). Rozumné využívání VCTE zahrnuje výběr vhodných kandidátů nebo alespoň zohledňování zkreslujících faktorů. Za minimum je považována znalost základního onemocnění, BMI (obezita), hodnota ALT, tedy posouzení míry zánětu, alkalické fosfatázy (přítomnost cholestázy) a to, zda je pacient nalačno. Konečné zhodnocení je vždy na ošetřujícím hepatologovi, který je dobře obeznámen s anamnézou a laboratorními výsledky pacienta.
Je doporučeno výsledky VCTE posuzovat s dalšími sérologickými markery fibrózy, jako je Fibrotest, Hepascore, FIB4 (Fibrosis-4) nebo AST to Platelet Ratio Index (APRI) [4]. Souhlasné testy jsou považovány za vzájemně se potvrzující, nesouhlasné testy mohou být opakovány v odstupu a biopsie je vyhrazena pro pacienty, u nichž zůstávají nesouhlasné výsledky nevyřešeny. Pokud máme stanovenu diagnózu cirhózy jater, je tranzientní elastografie vhodná ke sledování progrese onemocnění a stratifikaci rizika rozvoje portální hypertenze, jícnových varixů a hepatocelulárního karcinomu. V éře nových přímo působících antivirotik, která mají téměř 100% úspěšnost, se do popředí zájmu dostává i sledování regrese jaterní fibrózy a reverzibility cirhózy.
MUDr. Nikola Uzlová
I. interní klinika 3. LF UK a FN Královské Vinohrady, Praha
Doručeno do redakce 23. 11. 2017
Přijato po recenzi 19. 3. 2018u
Zdroje
- Sandrin L, Oudry J, Bastard C et al. Non-Invasive Assessment of Liver Fibrosis by Vibration-Controlled Transient Elastography (Fibroscan®). Dostupné z WWW: <https://www.intechopen.com/books/liver-biopsy/non-invasive-assessment-of-liver-fibrosis-by-vibration-controlled-transient-elastography-fibroscan>.
- Sandrin L, Fourquet B, Hasquenoph JM et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol 2003; 29(12): 1705–1713.
- Boursier J, Zarski JP, de Ledinghen V et al. Determination of reliability criteria for liver stiffness evaluation by transient elastography. Multicentric Group from ANRS/HC/EP23 FIBROSTAR Studies. Hepatology 2013; 57(3): 1182–1191. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.25993>.
- Tapper EB, Castera L, Afdhal NH. FibroScan (Vibration-Controlled Transient Elastography): Where Does It Stand in the United States Practice. Clin Gastroenterol Hepatol 2015; 13(1): 27–36. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2014.04.039>.
- Fraquelli M, Rigamonti C, Casazza G et al. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut 2007; 56(7): 968–973. Dostupné z DOI: <http://dx.doi.org/10.1136/gut.2006.111302>.
- Castéra L, Foucher J, Bernard PH et al. Pitfalls of liver stiffness measurement: a 5-year prospective study of 13,369 examinations. Hepatology 2010; 51(3): 828–835. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23425>.
- Lucidarme D, Foucher J, Le Bail B et al. Factors of accuracy of transient elastography (fibroscan) for the diagnosis of liver fibrosis in chronic hepatitis C. Hepatology 2009; 49(4): 1083–1089. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.22748>.
- Boursier J, Zarski JP, de Ledinghen V et al. Determination of reliability criteria for liver stiffness evaluation by transient elastography. Hepatology 2013; 57(3): 1182–1191. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.25993>.
- Mederacke I, Wursthorn K, Kirschner J et al. Food intake increases liver stiffness in patients with chronic or resolved hepatitis C virus infection. Liver Int 2009; 29(10): 1500–1506. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1478–3231.2009.02100.x>.
- Berzigotti A, De Gottardi A, Vukotic R et al. Effect of meal ingestion on liver stiffness in patients with cirrhosis and portal hypertension. PLoS One 2013; 8(3): e58742. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0058742>.
- Arena U, Lupsor Platon M, Stasi C et al. Liver stiffness is influenced by a standardized meal in patients with chronic hepatitis C virus at different stages of fibrotic evolution. Hepatology 2013; 58(1): 65–72. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.26343>.
- Friedrich-Rust M, Ong MF, Martens S et al. Performance of transient elastography for the staging of liver fibrosis: a meta-analysis. Gastroenterology 2008; 134(4): 960–974. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2008.01.034>.
- de Ledinghen V, Vergniol J. Transient elastography (FibroScan). Gastroenterol Clin Biol 2008; 32(6 Suppl 1): 58–67. Dostupné z DOI: <http://dx.doi.org/10.1016/S0399–8320(08)73994–0>.
- Pavlov CS, Casazza G, Nikolova D et al. Transient elastography for diagnosis of stages of hepatic fibrosis and cirrhosis in people with alcoholic liver disease. Cochrane Database Syst Rev 2015; 1: CD010542. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD010542.pub2>.
- Wong VW, Vergniol J, Wong GL et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology 2010; 51(2): 454–462. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23312>.
- Chan HL, Wong GL, Choi PC et al. Alanine aminotransferase-based algorithms of liver stiffness measurement by transient elastography (Fibroscan) for liver fibrosis in chronic hepatitis B. J Viral Hepat 2009; 16(1): 36–44. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2893.2008.01037.x>.
- Ehrmann J, Hůlek P. Hepatologie. 2. vyd. Grada: Praha 2014. EAN 24780214. ISBN 978–80–247–8021–4.
- Wong VW, Verginiol J, Wong GL et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology 2010; 51(2): 454–462. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23312>.
- Myers, RP, Pomier-Layrargues G, Kirsch R et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology 2012; 55(1): 199–208. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.24624>.
- Wong VW, Verginiol J, Wong GL et al. Liver stiffness measurement using XL probe in patients with nonalcoholic fatty liver disease. Am J Gastroenterol 2012; 107(12): 1862–1871. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2012.331>.
- Trabut JB, Thépot V, Nalpas B et al. Rapid decline of liver stiffness following alcohol withdrawal in heavy drinkers. Alcohol Clin Exp Res 2012; 36(8): 1407–1411. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1530–0277.2012.01737.x>.
- Corpechot C, Carrat F, Poujol-Robert A et al. Noninvasive elastography-based assessment of liver fibrosis progression and prognosis in primary biliary cirrhosis. Hepatology 2012; 56(1): 198–208. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.25599>.
- de Franchis R. [Baveno VI Faculty]. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63(3): 743–752. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2015.05.022>.
- Stefanescu H, Grigorescu M, Luspor M et al. Spleen stiffness measurement using fibroscan for the noninvasive assessment of esophageal varices in liver cirrhosis patients, J Gastroenterol Hepatol 2011; 26(1): 164–170. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1440–1746.2010.06325.x>.
- Bureau C, Metivier S, Peron JM et al. Transient elastography accurately predicts presence of significant portal hypertension in patients with chronic liver disease. Aliment Pharmacol Ther 2008; 27(12): 1261–1268. Dostupné z DOI: <http://dx.doi.oerg/10.1111/j.1365–2036.2008.03701.x>.
- Kim SU, Lee JH, Kim DY et al. Prediction of liver-related events using fibroscan in chronic hepatitis B patients showing advanced liver fibrosis. PLoS One 2012; 7(5): e36676. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0036676>.
- Sporea I, Raţiu I, Sirli R et al. Value of transient elastography for the prediction of variceal bleeding. World J Gastroenterol 2011; 17(17): 2206–2210. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v17.i17.2206>.
- Shi KQ, Fan YC, Pan ZZ et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int 2013; 33(1): 62–71. Dostupné z DOI: <http://dx.doi.org/10.1111/liv.12003>.
- Adler M, Larocca L, Trovato FM et al. Evaluating the risk of hepatocellular carcinoma in patients with prominently elevated liver stiffness measurements by FibroScan: a multicentre study. HPB (Oxford) 2016; 18(8): 678–683. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hpb.2016.05.005>.
- Hezode C, Castera L, Roudot-Thoraval F et al. Liver stiffness diminishes with antiviral response in chronic hepatitis C. Aliment Pharmacol Ther 2011; 34(6): 656–663. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2011.04765.x>.
- [European Association for the Study of the Liver]. EASL Recommendations on Treatment of Hepatitis C 2016. J Hepatol 2017; 66(1): 153–194. Dostupné z DOI: Dostupné z DOI: <https://doi.org/10.1016/j.jhep.2016.09.001>.
- Kleiner DE, Brunt EM, Van Natta M et al. [Nonalcoholic Steatohepatitis Clinical Research Network]. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41 : 1313–1321. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.20701>.
- Arndt R, Schmidt S, Loddenkemper Ch et al. Noninvasive evaluation of renal allograft fibrosis by transient elastography – a pilot study. Transpl Int 2010; 23(9): 871–877. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1432–2277.2010.01057.x>.
- Sommerer C, Scharf M, Seitz Ch et al. Assessment of renal allograft fibrosis by transient elastography. Transpl Int 2013, 26(5): 545–551. Dostupné z DOI: <http://dx.doi.org/10.1111/tri.12073>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2018 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Elastografie jater: moderní trend v diagnostice chronických jaterních onemocnění
- Tuk, pankreas a metabolický syndrom – editorial
- Je funkčná dyspepsia skutočne tak častá?
- Ovlivňuje doba od potíží do léčení průběh žilní trombózy dolních končetin?
- Tranzientní elastografie – přínos v hodnocení vývoje jaterního onemocnění
- Některé příčiny špatné adherence k dlouhodobé terapii statiny a jejich řešení
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
- Obštrukčné spánkové apnoe a dyslipidémia
- CD38 cílená léčba u mnohočetného myelomu
- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Mnohočetné postižení tenkého střeva neuroendokrinním tumorem: kazuistika a přehled literatury
-
Rozlúčka s profesorom Milanom Pavlovičom
*21. 11. 1931 – †3. 7. 2018 -
Za profesorom MUDr. Miroslavom Mydlíkom, DrSc.
*21. 7. 1932 – †6. 9. 2018 - Z odborné literatury
-
Příspěvek ke článku Matýšková M et al. Antitrombotika dnes,
Vnitř Lék 2018; 64(5): 565–574
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



