-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pečeň pri srdcovom zlyhávaní
Liver in heart failure
Heart failure (HF) is a syndrome with multiple organ manifestations. Liver is due to its high metabolic activity and the resulting demands on oxygenation and also due to its anatomical position close to the heart damaged by heart failure very often. Despite the signs of liver damage are common in heart failure, clinically significant impairment of liver function rarely occurs. Liver lesion is caused by impaired hepatic circulation in terms of congestion and/or hypoperfusion. Congestive lesion is more common. Typically manifests as painful hepatomegaly, increased direct bilirubin and alkaline phosphatase. Pure ischemic lesion is rare. It occurs in a cases with severe and prolonged liver hypoperfusion often in combination with hypoxemia and results to the sharp rise of total bilirubin and transaminase levels. Short-term prognosis of this disorder, unless the cause hypoperfusion treated successfully, is poor. Increase in bilirubin and transaminase tests as well as signs of impaired proteosynthetic liver function are associated with poor prognosis. The worst prognosis have patients with HF and current primary liver disease. Knowledge phenotypes hepatic lesions in HF is important in choosing the tactics of treatment of acute HF decompensation.
Key words:
heart failure – liver – congestion – hypoperfusion
Autoři: Eva Goncalvesová
Působiště autorů: Oddelenie Zlyhávania a transplantácie srdca, prednostka doc. MUDr. Eva Goncalvesová, CSc., FESC, Národného ústavu srdcových a cievnych chorôb, Bratislava, Slovenská republika, generálny riaditieľ ing. Mongi Msolly, MBA
Vyšlo v časopise: Vnitř Lék 2014; 60(4): 298-303
Kategorie: 60. narozeniny prof. MUDr. Petra Widimského, DrSc., FESC, FACC
Souhrn
Srdcové zlyhávanie (SZ) je syndróm s multiorgánovou manifestáciou. Pečeň je, vzhľadom na svoju vysokú metabolickú aktivitu a z nej vyplývajúce nároky na oxygenáciu, ale aj vzhľadom na jej anatomické uloženie v blízkosti srdca, orgánom poškodeným srdcovým zlyhávaním veľmi často. Napriek tomu, že sú znaky poškodenia pečene pri srdcovom zlyhávaní časté, funkcia pečene je však len zriedka klinicky významne narušená. Lézia je spôsobená poruchou hepatálnej cirkulácie v zmysle kongescie a hypoperfúzie. Kongestívna lézia je častejšia. Typicky sa prejavuje bolestivou hepatomegaliou, zvýšenou hladinou priameho bilirubínu a alkalickej fosfatázy. Vyhranená ischemická lézia je zriedkavá a dochádza k nej pri prudkej a protrahovanej poruche perfúzie často sprevádzanej s hypoxémiou. Prejaví sa vzostupom celkového bilirubínu a výrazným vzostupom hladín transamináz. Krátkodobá prognóza tejto poruchy, pokiaľ na nepodarí priaznivo ovplyvniť príčinu hypoperfúzie, je zlá. Zvýšenie hladiny bilirubínu a transamináz ako aj znaky porušenej proteosyntetickej funkcie pečene sú spojené so zlou prognózou. Najhoršiu prognózu majú pacienti so SZ a súčasným primárnym ochorením pečene. Poznanie fenotypov hepatálnej lézie pri SZ je dôležité pri voľbe taktiky liečby akútnej dekompenzácie.
Kľúčové slová:
srdcové zlyhávanie – pečeň – kongescia – hypoperfúziaÚvod
Srdcové zlyhávanie (SZ) je syndróm s multiorgánovou manifestáciou. Pečeň je, vzhľadom na svoju vysokú metabolickú aktivitu a z nej vyplývajúce nároky na oxygenáciu, ale aj vzhľadom na jej anatomické uloženie v blízkosti srdca, orgánom poškodeným srdcovým zlyhávaním veľmi často.
Vedecké správy o hepatálnej dysfunkcii pri SZ sa v literatúre objavovali už v 1. polovici 20. storočia. Už v roku 1930 N. Jolliffe referoval o tom, že až 80 % pacientov s kongestívnym srdcovým zlyhávaním má zvýšenú hladinu bilirubínu a u viac ako 90 % sa dá dokázať nejaká porucha hepatálnej funkcie [1]. Zdá sa však, že povedomie o poškodení pečene pri SZ a klinickom obraze hepatálnej lézie v kontexte akútneho alebo chronického SZ nie je primerané jeho frekvencii. Podľa údajov z posledného obdobia sa u chorých prijímaných do nemocnice pre akútne srdcové zlyhávanie zisťuje zvýšenie hodnoty celkového bilirubínu (TB) v 20–26 % prípadov, veľmi časté je zvýšenie cholestatických enzýmov a predovšetkým GMT (62 %) [2,3]. Izolované zvýšenie transamináz (AST, ALT) sa pozorovalo u 26 % chorých [4]. Pri chronickom srdcovom zlyhávaní bol TB zvýšený u 13 % pacientov, transaminázy u 3,1 %. Zníženú hladinu albumínu malo 18,3 % chorých [5].
Hepatálna cirkulácia
Pečeň má vysokú metabolickú aktivitu a na jej udržanie je potrebná dostatočná perfúzia, ktorá sa pohybuje okolo 1 ml/g/min. Za pokojových podmienok preteká pečeňou 20–25 % minutového výdaja srdca. Pečeň má duálne krvné zásobenie. Plne oxygenovaná krv prichádza hepatálnou artériou pod systémovým tlakom. Táto poskytuje asi 35 % objemu pritekajúcej krvi a asi 50 % zásobenia kyslíkom. Portálna véna zbiera krv zo splanchnickej oblasti a prináša okrem metabolických substrátov aj zvyšné množstvo potrebného kyslíka. Arteriálna a portálna krv sa mieša v hepatálnych sínusoidoch, ktoré predstavujú pórovité kanáliky spájajúce portálne priestory s centrálnou vénou hepatálneho acinu. Centrálne vény sa drenujú do postupne sa zväčšujúcich hepatálnych vén. Hlavné hepatálne vény vyúsťujú do v. cava inferior v blízkosti pravej predsiene. Tlakové pomery plnenia pravej komory sa tak bezprostredne prenášajú do hepatálnej cirkulácie.
Tlak v portálnej véne možno merať nepriamo zaklinením katétra zavedeného cez v. femoralis alebo v. jugularis do hepatálnej vény. Tlak na konci katétra potom odráža tlak v hepatálnych sínusoch. Tento sa je za normálnych okolností 5–6 mm Hg. Tlak v zaklinení > 10 mm Hg sa považuje za jednoznačný prejav portálnej hypertenzie [6].
Patologický obraz a patofyziológia hepatálnej lézie pri SZ
Základnou štrukturálnou jednotkou pečene je hepatálny lobulus zložený z centrálnej eferentnej vény obkolesenej sínusoidami vystlanými makrofágmi, stĺpcami hepatocytov, a na okraji sú portálne trakty. Portálne trakty obsahujú tzv. triády zložené z terminálnych vetiev hepatálnej artérie, portálnej vény a zo žlčových kanálikov. Funkčnou jednotkou je acinus, ktorý predstavuje malá časť pečeňového parenchýmu, v centre ktorého je portálna triáda. V závislosti na vzdialenosti od portálnej triády sa rozoznávajú v acine 3 zóny. Zóna 3 je v okolí centrálnej vény, najvzdialenejšia od portálnej triády. Práve bunky v tejto zóne sú v oblasti s najnižšou koncentráciou kyslíka v pritekajúcej krvi a sú tak najcitlivejšie na hypoxiu [7]. V situáciách, kedy dochádza k zvýšeniu tlaku v pravej predsieni, dochádza ku kongescii v oblasti centrálnej vény a dilatácii okolitých sínusoidov zóny 3 (obr. 1). To vedie ku kompresii hepatocytov a v kombinácii s hypoxiou k atrofii, nekrózam a následnej fibróze.
Obr. 1. Makroskopický a mikroskopický obraz pečene pri srdcovom zlyhaní. Hore firbóza pečene, na reze pripomína muškátový oriešok. Dole dilatácia centrálnej vény a kongescia v pericentrálnych sinusoidoch. 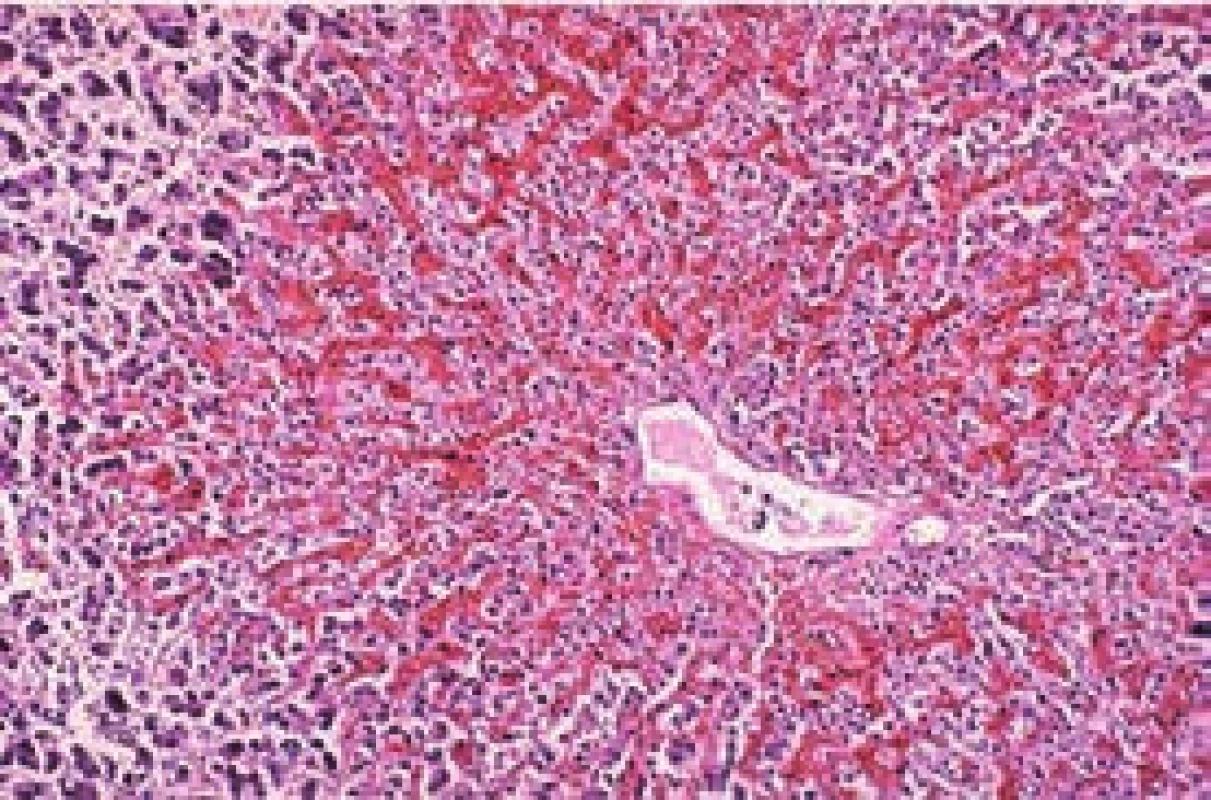
Pri akútnej dekompenzácii SZ alebo pokročilom SZ dochádza tiež k funkčným zmenám na úrovni lokálnej regulácie cirkulácie. V portálnej véne sa nachádzajú predovšetkým α-adrenergné receptory, zatiaľ čo β2-receptory prevažujú v hepatálnych vénach. Výsledkom aktivácie sympatika je portálna vazokonstrikcia s následnou splanchnickou stázou a prehĺbenie ischémie pečene. Naopak vazodilatácia hepatálnych vén uľahčí odsun krvi z pečene a vedie k zvýšeniu preloadu [8].
Histopatologické zmeny a ich vzťahy k poruchám cirkulácie skúmala podrobne už S. Sherlock v polovici minulého storočia [9]. Pravidelným nálezom pri hepatálnej lézie v dôsledku SZ je centrilobulárna nekróza. Pri zhoršovaní a predlžovaní SZ sa nekróza šíri periférne, zatiaľ čo pri úspešnej liečbe dochádza k hojeniu. Fibrotické zmeny sú na začiatku koncentrované do miest v okolí centrálnej vény, pri dlhotrvajúcom a opakovanom poškodení dochádza k premosťujúcej fibróze medzi centrálnymi vénami, čo sa interpretuje ako kardiálna cirhóza. Makroskopický obraz takejto prestavby je tradične pripodobňovaný k muškátovému oriešku, tzv. nutmeg liver (obr. 1). Typicky sa vyvíja najmä u chorých, u ktorých dominuje obraz zlyhávania pravej komory, ako je pľúcna artériová hypertenzia, pľúcna hypertenzia v dôsledku mitrálnej stenózy, primárne zlyhanie pravej komory s trikuspidálnou regurgitáciou, reštrikčná kardiomyopatia alebo konstriktívna perikarditída. Dôležitou charakteristikou kardiálnej cirhózy je skutočnosť, že pri nej nedochádza k intrahepatálnej obštrukcii portálnych vén [9], a tak k vývoju hepatálnej formy portálnej hypertenzie.
Histologické zmeny, ako aj akútne kongestívne zmeny možno študovať kvantitatívne a neinvazívne meraním tuhosti pečene použitím tranzientnej elastografie. Hodnoty tuhosti pečene boli zvýšené u pacientov s akútnym aj chronickým srdcovým zlyhávaním [10]. Hodnoty tuhosti korelovali s hladinou NTpro BNP. Eliminácia kongescie viedla ku zníženiu tuhosti, ale hodnoty sa nenormalizovali [11].
Poškodenie hepatálnych funkcií pri SZ môže mať ďalekosiahle následky, vrátane negatívneho ovplyvnenie samotnej funkcie myokardu. Tieto vzťahy sú však len málo preskúmané. Okrem proteosyntetickej a početných metabolických funkcií zohráva pečeň kľúčovú úlohu aj pri odstraňovaní cirkulujúcich endotoxínov. Porušená mikrocirkulácia zpôsobuje pokles klírensu endotoxínov a zvyšuje sa sekrécia proinflamačných cytokínov. Takáto imunitná aktivácia negatívne zasahuje do nutričných pochodov, ovplyvňuje metabolizmus železa a podieľa sa na vzniku kardiálnej kachexie a anémie [12].
Klinický obraz
U chorých so SZ sa stretávame s 2 fenotypmi manifestácie hepatálnej lézie. U väčšiny pacientov dominuje tzv. kongestívny (venostatický) fenotyp. Tento býva pri akútnom zhoršení ochorenia sprevádzanom poruchou perfúzie kombinovaný s ischemickým fenotypom. Izolované ischemické poškodenie je relatívne zriedkavé. Ischemická lézia pečene, niekedy nesprávne označovaná aj ako ischemická hepatitída, sa rozvíja v situáciách, kedy dôjde k rýchlemu a významnému poklesu perfúzie pečene. Často sa dá zistiť súčasná hypoxia spôsobená súčasnou poruchou výmeny plynov. U pacientov s akútne dekompenzovaným SZ sa väčšinou stretávame s prelínajúcimi sa formami poškodenia pečene, prejavy tejto poruchy sa môžu meniť v závislosti od progresie SZ a jeho liečby.
Klinicky sa kongestívne (venostatické) poškodenie pečene prejavuje bolesťami v pravom hypochondriu, epigastriu, ťažobou po jedle. Tieto „gastrointestinálne“ prejavy môžu byť výrazné až dominantné a na ich vzniku sa podieľa celková splanchnická kongescia sprevádzaná zvýšením intraabdominálneho tlaku [8]. Výrazná gastrointestinálna symptomatológia pri manifestácii SZ je typická najmä u adolescentov a mladších dospelých. Podľa jednej z analýz bola u adolescentov s prvou manifestáciou SZ abdominálna bolesť jediným príznakom až v 23 % prípadov [13].
Pri fyzikálnom vyšetrení je typický nález hepatomegalie s pozitívnym hepatojugulárnym refluxom. Ascites sa vyskytuje asi u 25 % pacientov hospitalizovaných s pravostranným srdcovým zlyhávaním. Splenomegalia je prítomná len výnimočne. Ultrasonograficky nachádzame zväčšenú hypoechogénnu pečeň. Pri pokročilejších fibrotických zmenách môže echogenita narastať. Povrch pečene je hladký. Viditeľná je dilatácia dolnej dutej žily a hepatálnych vén. Portálna véna nie je rozšírená. Ultrasonograficky možno diagnostikovať aj malé množstvo ascitu. Pri výraznejšej splanchnickej kongescii vidno zhrubnutie steny žlčníka a niekedy aj črevnej steny. Bolesti v pravom hypochondriu v spojení s nálezom zhrubnutej steny žlčníka a hyperbilirubinémiou bývajú niekedy nesprávne interpretované ako akalkulózna cholecystída [14]. Pri SZ sa mení aj charakter prietoku v hepatálnych vénach aj v portálnej véne. V hepatálnych vénach sa prietok stáva dopredný len v diastole komory, pričom v systole, najmä pri súčasnej trikuspidálnej regurgitácii, býva smer toku obrátený. V portálnej véne je za normálnych okolností kontinuálny alebo ľahko undulujúci hepatálny prietok. Pri progredujúcom SZ a venostáze sa mení na pulzatilný, niekedy s viditeľne hepatofugálnou fázou pri systole (obr. 2), [15]. Biochemické vyšetrenie odhalí hyperbilirubinémiu s prevažujúcim zvýšením konjugovanej formy (priamy bilirubín) spojenú s ľahko zvýšenou hladinou alkalickej fosfatázy a GMT. Koncentrácia transamináz (AST, ALT) je obyčajne normálna alebo len ľahko zvýšená. Proteosyntetická funkcia pečene je normálna alebo len ľahko zhoršená. To sa prejaví predĺžením protrombínového času (INR), ktoré nie je korigovateľné podávaním vitamínu K. Hypoalbuminémia býva prítomná v pokročilých fázach ochorenia u pacientov s kardiálnou kachexiou alebo inými poruchami ako napr. enteropatiou spojenou so stratou proteínov [16–18].
Obr. 2. Bifázický prietok portálnou žilou pri pokročilej venostáze v pečeni 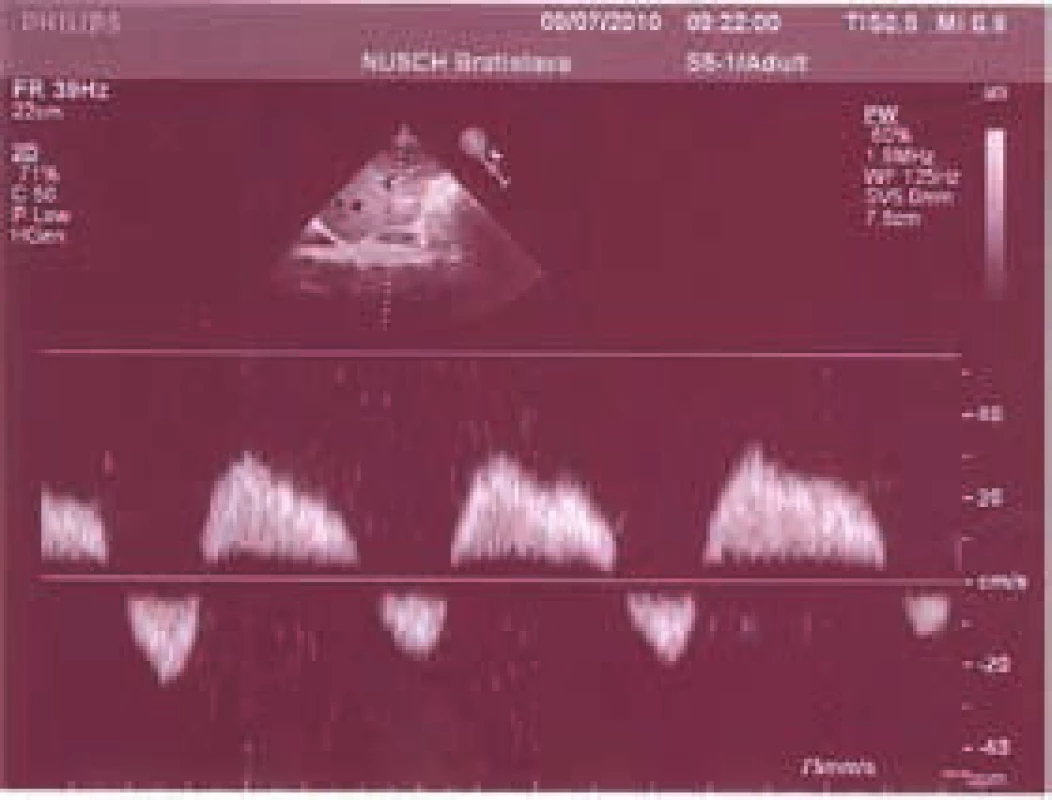
Ischemické poškodenie nazývané aj hypoxická hepatopatia, šoková pečeň alebo ischemická hepatitída je porucha, ktorá vzniká pri signifikantom poklese perfúzie, v dôsledku ktorej dochádza k centrilobulárnej nekróze hepatocytov. K ischemickej lézii obyčajne nestačí hypoperfúzia samotná a veľmi často možno identifikovať aj hypoxémiu spôsobenú pridruženým ochorením pľúc. Charakteristickou laboratórnou abnormalitou je prudký, často viac ako stonásobný vzostup koncentrácie sérových transamináz. Zvýšená býva aj koncentrácia bilirubínu, len zriedka sa však vyvíja zjavný ikterus. Zaznamenáva sa tiež výrazné zvýšenie hladiny laktátdehydrogenázy (LDH) a predĺženie protrombínového času. Ak sa podarí príčinu poruchy odstrániť, laboratórne hodnoty sa rýchlo normalizujú. Zlyhanie pečene ischemickej etiológie je príčinou asi 5 % hospitalizácií v centrách orientovaných na akútne zlyhanie a transplantáciu pečene a je zaťažené viac ako 50% hospitalizačnou mortalitou [19]. Najsilnejším prediktorom mortality bol srdcový index (CI) a jeho zmena pri liečbe. Pacienti, ktorí zomreli, mali pri prijatí priemerný CI 1,6 l/min/m2, kým pacienti, ktorí prežili 2,1 l/min/m2. V priebehu SZ sa nezriedka 2 základné mechanizmy vedúce k poškodeniu pečene – kongescia a hypoperfúzia – kombinujú. Dobre to dokumentuje pozorovanie van Dreusena et al [20], ktorí u pacientov so SZ študovali poruchy hepatálnych funkcií v závislosti od hemodynamického profilu. Zvýšenie centrálneho venózneho tlaku (CVP) bolo spojené so zvýšením všetkých ukazovateľov hepatálnej dysfunckie, ale najmä priameho bilirubínu a gamaglutamyltransferázy (GMT). S nízkym CI bolo asociované zvýšenie AST, ALT a celkového bilirubínu. Prehľad typických laboratórnych zmien pri krajných fenotypoch poškodenia pečene pri SZ ukazuje tab.
Tab. 1. Základné biochemické abnormality poškodenia pečene pri SZ 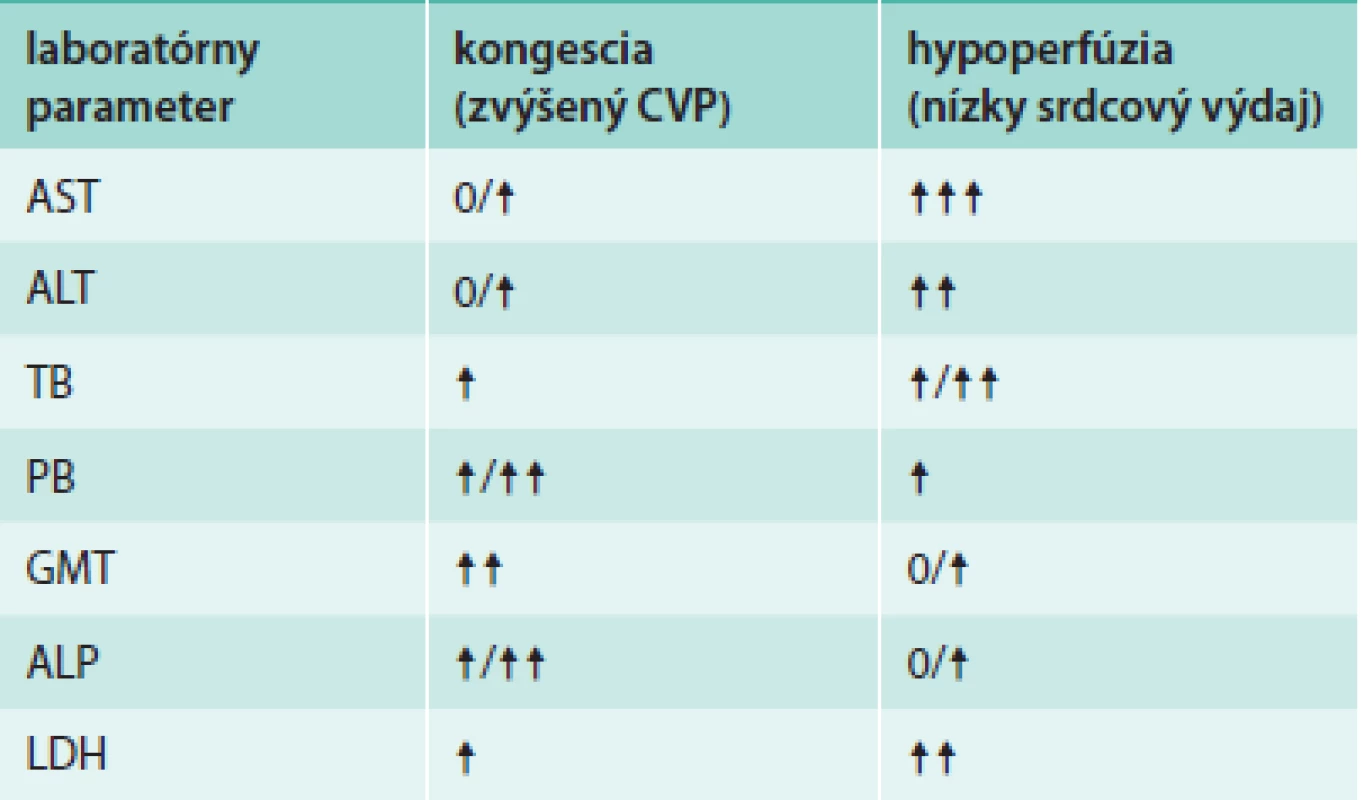
ALP – alkalická fosfatáza ALT – alanín aminotransferáza AST – aspartát aminotransferáza CVP – centrálny venózny tlak GMT – glutamylransferáza LDH – laktátdehydrognáza PB – priamy bilirubín TB – celkový bilirubín Prognostické a liečebné implikácie hepatálneho poškodenia pri srdcovom zlyhávaní
Z praktického klinického hľadiska má rozpoznanie prítomnosti a pochopenie charakteru hepatálnej lézie pri SZ význam pri hodnotení prognózy, ako aj pre usmernenie a modifikáciu liečby. V kontexte akútneho srdcového zlyhávania u pacientov bez anamnézy primárneho ochorenia pečene sa ukázalo, že zvýšené hodnoty TB a znížená koncentrácia albumínu pri prijatí pre akútnu dekompenzáciu sú spojené s vyšším rizikom úmrtia zo všetkých príčin v nasledujúcich mesiacoch [2,4]. Prognosticky výpovednejšie sú zmeny týchto ukazovateľov v počas hospitalizácie. Vzostup TB a pokles koncentrácie albumínu signalizujú vyššie riziko ako celkovej, tak aj kardiovaskulárnej mortality, ako aj potrebu rehospitalizácie pre SZ [2]. Práve hypoalbuminémia sa ukazuje ako významný ukazovateľ zlej krátkodobej prognózy u chorých vo funkčných štádiách NYHA III/IV a pacientov so SZ podstupujúcich chirurgické zákroky [21]. V štúdii analyzujúcej priebeh ochorenia u viac ako 330 pacientov Poelzl et al [3] ukázali, že sérová koncentrácia GMT poskytuje prognostickú informáciu nezávisle od iných klinických a biochemických prognostických markerov. Prediktívna výpovedná hodnota zvýšenej hladiny GMT je pritom vyššia u chorých s ľahšími symptómami (NYHA I/II) v porovnaní s pacientmi vo funkčnej triede NYHA III/IV.
Prítomnosť hepatálnej dysfunkcie je tiež dôležitou skutočnosťou pre odhad prognózy po implantácii mechanickej podpory ľavej komory (LVAD). Analýzy údajov z viacerých pracovísk potvrdili, že porucha funkcie pečene kvantifikovaná použitím MELD skóre je jednoduchým a významným prediktorom rizika krvácania a úmrtia po operácii. Výpočet MELD skóre sa rutinne používa pre prognostickú stratifikáciu pacientov s ochoreniami pečene. Do rovnice sa dosadzujú hodnoty sérového kreatinínu, celkového bilirubínu a INR. Pacienti s MELD skóre ≥ 17 mali 2,5-krát vyššie riziko úmrtia do 6 mesiacov od implantácie LVAD [22,23].
Z hľadiska taktiky a modifikácie liečby môže biochemický profil poškodenia nasmerovať liečbu k posilneniu diuretík alebo eliminačnej terapii v prípade, že dominuje tzv. kongestívny fenotyp. Na druhej strane, ak prevláda tzv. ischemicko/hypoxický fenotyp, je vhodné iniciovať alebo intenzifikovať inotropnú a vazoaktívnu liečbu s cieľom zvýšiť perfúziu a zabezpečiť dostatočnú oxygenáciu.
Ďalším aspektom, ktorý je potrebné zohľadniť pri liečebných rozhodnutiach u pacientov so SZ a poruchou hepatálnych funkcií, je hepatotoxicita liekov, ako aj úloha pečene pre ich účinok alebo degradáciu. Porucha hepatálnych funkcií môže znižovať efekt liekov podávaných ako tzv. pro drugs (napr. klopidogrel). Na druhej strane hrozí akumulácia v prípade, že lieky sú degradované a vylučované hepatálnou cestou. Z hľadiska kardiovaskulárnej farmakoterapie hrozí akumulácia a zvýšený toxický efekt amiodaronu, statínov, niektorých ACE inhibítorov, diltiazemu a verapamilu. Zvláštnu pozornosť treba venovať antikoagulačnej liečbe antagonistami vitamínu K, ktoré majú vyšší a nepravidelný účinok.
Srdcové zlyhávanie v kontexte primárnej hepatálnej lézie
Primárne ochorenie pečene (ako napr. cirhóza) je pri rozvinutom SZ relatívne zriedkavá komorbidita. Klinicky signifikantné primárne ochorenie pečene a vyskytuje asi u 1–2 % pacientov s rozvinutým SZ. Ukázalo sa, že u chorých prijímaných do nemocnice pre akútne SZ je súčasná prítomnosť cirhózy najsilnejším prediktorom 30-dňovej, aj ročnej mortality [24]. Jedným z dôvodov je možno aj skutočnosť, že hepatálna dysfunkcia pri cirhóze pečene priamo negatívne ovplyvňuje funkciu myokardu.
Hemodynamické abnormality sprevádzajúce cirhózu pečene sú dlhodobo známe. Tieto zmeny spočívajú v redukcii periférnej vaskulárnej rezistencie a kompenzačnom zvýšení srdcového výdaja. V poslednom období sa opakovane u pacientov s cirhózou identifikovali zmeny funkcie myokardu, ktoré nemožno vysvetliť iným ochorením srdca. Cirhotická kardiomyopatia sa definuje ako chronická dysfunkcia myokardu u pacientov s cirhózou charakterizovaná nedostatočnou kontraktilnou rezervou, porušenou diastolickou funkciou a elektrofyziologickými abnormalitami v neprítomnosti iného identifikovateľného ochorenia srdca [25]. Viac ako 50 % pacientov podstupujúcich transplantáciu pečene má príznaky dysfunkcie myokardu a až 20 % úmrtí po transplantácii je spôsobené zlyhaním srdca [26].
Patofyziológia tohto syndrómu je multifaktoriálna a neúplne preskúmaná. Na redukcii kontraktility sa podieľa down regulácia β-adrenergných receptorov, sprevádzaná aj vnútornou poruchou β-adrenergnej stimulácie. Dokázané sú tiež poruchy fluidity membrány kardiomyocytov, draslíkových a vápnikových kanálov. Dysfunkciu myokardu prehlbujú zvýšená aktivita a hladiny cykokínov, kanabinoidov a NO [27]. Pozorovaná systolická dysfunkcia spočíva predovšetkým v nedostatočnej schopnosti výšiť srdcový výdaj pri fyzickej alebo farmakologickej záťaži. Pozoruje sa tiež prudké zvýšenie plniacich tlakov ľavej komory pri zvýšení afterloadu. Na neschopnosti zvýšiť minútový objem pri záťaži sa okrem poruchy kontraktility podieľa aj chronotropná insuficiencia. Diastolická dysfunckia je charakteru poruchy relaxácie a je pravdepodobne výsledkom ľahkej hypertrofie ľavej komory, fibrózy a edému. Tieto zmeny sú viac vyjadrené u pacientov s pokročilou cirhózou a ascitom. Sú čiastočne reverzibilné antialdosterónovou liečbou. Opakovane boli opísané aj ďalšie zmeny. Veľmi typické je predĺženie QT intervalu, ktoré súvisí predovšetkým so závažnosťou portálnej hypertenzie. Podávanie betablokátorov QT interval skracuje. Klinický význam týchto nálezov je nejasný, pretože závažné komorové tachykardie sú u chorých s cirhózou zriedkavé. Rovnako význam zistenej zníženej senzitivity baroreflexu a poklesu variability srdcovej frekvencie ostáva nejasný [27]. Ukazuje sa, že po transplantácii pečene dochádza k postupnej normalizácii myokardiálnej funkcie.
U 6–8 % pacientov s cirhózou pečene a sprievodnou portálnou hypertenziou dochádza k vývoju pľúcnej artériovej hypertenzie, tzv. portopulmonálnej. Títo pacienti majú zvlášť zlú prognózu a transplantácia pečene je u nich relatívne kontraindikovaná [28]. Na portopulmonálnu pľúcnu hypertenziu nutno myslieť predovšetkým u pacientov s nevysvetlenou výraznou námahovou dýchavicou a prejavmi zlyhávania pravej komory. Títo majú byť odoslaní na cielené echokardiografické vyšetrenie a v prípade podozrenia na invazívne vyšetrenie. Po potvrdení diagnózy je u niektorých indikovaná špecifická liečba [29].
Ochorenia súčasne zasahujúce srdca a pečeň
Hoci hepatálna dysfunkcia pri SZ je dôsledkom kongescie, prípadne ischémie pečene, existuje viacero systémových ochorení, ktoré priamo poškodzujú pečeň aj srdce. Tento obraz môžu spôsobovať početné zriedkavé ochorenia, ale na mieste je pri diferenciálnej diagnostike súbežného poškodenia srdca a pečene myslieť predovšetkým na hemochromatózu, amyloidózu a sarkoidózu.
Záver
Poškodenie pečene pri srdcovom zlyhávaní je časté, funkcia pečene je však len zriedka klinicky významne narušená. Lézia je spôsobená poruchou hepatálnej cirkulácie v zmysle kongescie a hypoperfúzie. Kongestívna lézia je častejšia. Typicky sa prejavuje bolestivou hepatomegaliou, zvýšenou hladinou priameho bilirubínu a alkalickej fosfatázy. Vyhranená ischemická lézia je zriedkavá a dochádza k nej pri prudkej a protrahovanej poruche perfúzie často sprevádzanej hypoxémiou. Prejaví sa vzostupom celkového bilirubínu a výrazným vzostupom hladín transamináz. Prognóza tejto poruchy, pokiaľ sa nepodarí priaznivo ovplyvniť príčinu hypoperfúzie, je zlá. Zvýšenie hladiny bilirubínu a hepatálnych testov ako aj znaky porušenej proteosyntetickej funkcie pečene sú spojené so zlou prognózou. Najhoršiu prognózu majú pacienti so SZ a súčasným primárnym ochorením pečene. Poznanie fenotypov hepatálnej lézie pri SZ je dôležité pri voľbe taktiky liečby akútnej dekompenzácie.
Venované životnému jubileu prof. MUDr. Petra Widimského, CSc., ktorého prácu na poli kardiológie aj pôsobenie v prospech kardiologickej obce si mimoriadne vážim.
doc. MUDr. Eva Goncalvesová, CSc.
eva.goncalvesova@nusch.sk
Oddelenie zlyhávania a transplantácie srdca, Národný ústav srdcových a cievnych chorôb, Bratislava, Slovensko
www.nusch.sk
Doručeno do redakce: 23. 1. 2014
Zdroje
1. Jolliffe N. Liver Function in Congestive Heart Failure. J Clin Invest 1930; 8(3): 419–33.
2. Ambrosy AP, Vaduganathan M, Huffman MD et al. Clinical course and predictive value of liver function tests in patients hospitalized for worsening heart failure with reduced ejection fraction: an analysis of the EVEREST trial. Eur J Heart Fail 2012; 14(3): 302–311.
3. Poelzl G, Ess M, Mussner-Seeber C et al. Liver dysfunction in chronic heart failure: prevalence, characteristics and prognostic significance. Eur J Clin Invest 2012; 42(2): 153–163.
4. Nikolaou M, Parissis J, Yilmaz MB et al. Liver function abnormalities, clinical profile, and outcome in acute decompensated heart failure. Eur Heart J 2013; 34(10): 742–749.
5. Allen LA, Felker GM, Pocock S et al. Liver function abnormalities and outcome in patients with chronic heart failure: data from the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) program. Eur J Heart Fail 2009; 11(2): 170–177.
6. Dooley JS , Burroughs AK, Heathcote EJ. Sherlock´s Diseases of the Liver and Biliary System. Wiley-Blackwell: Oxford 2011. 12th Edition. ISBN 9781405134897.
7. Rappaport AM. Hepatic blood flow: morphologic aspects and physiologic regulation. Int Rev Physiol 1980; 21 : 1–63.
8. Verbrugge FH, Dupont M, Steels P et al. Abdominal contributions to cardiorenal dysfunction in congestive heart failure. J Am Coll Cardiol 2013; 62(6): 485–495.
9. Sherlock S. The liver in heart failure; relation of anatomical, functional, and circulatory changes. Br Heart J 1951; 13(3): 273–293.
10. Hopper I, Kemp W, Porapakkham P et al. Impact of heart failure and changes to volume status on liver stiffness: non-invasive assessment using transient elastography. Eur J Heart Fail 2012; 14(6): 621–627.
11. Alegre F, Herrero JI, Inarrairaegui M et al. Increased liver stiffness values in patients with heart failure. Acta Gastroenterol Belg 2013; 76(2): 246–250.
12. Valentová M, von Haehling S, Doehner W et al. Liver dysfunction and its nutritional implications in heart failure. Nutrition 2013; 29(2): 370–378.
13. Hollander SA, Addonizio LJ, Chin C et al. Abdominal complaints as a common first presentation of heart failure in adolescents with dilated cardiomyopathy. Am J Emerg Med 2013; 31(4): 684–686.
14. Huffman JL, Schenker S Acute acalculous cholecystitis: a review. Clin Gastroenterol Hepatol 2010; 8(1): 15–22.
15. Goncalvesova E, Lesny P, Luknar M et al. Changes of portal flow in heart failure patients with liver congestion. Bratisl Lek Listy 2010; 111(12): 635–639.
16. Auer J. What does the liver tell us about the failing heart? Eur Heart J 2013; 34(10): 711–714.
17. Cogger VC, Fraser R, Le Couteur DG. Liver dysfunction and heart failure. Am J Cardiol 2003; 91(11): 1399.
18. Alvarez AM, Mukherjee D. Liver abnormalities in cardiac diseases and heart failure. Int J Angiol 2011; 20(3): 135–142.
19. Saner FH, Heuer M, Meyer M et al. When the heart kills the liver: acute liver failure in congestive heart failure. Eur J Med Res 2009; 14 : 541–546.
20. van Deursen VM, Damman K, Hillege HL et al. Abnormal liver function in relation to hemodynamic profile in heart failure patients. J Card Fail 2010; 16 : 84–90.
21. Samsky MD, Patel CB, DeWald TA et al. Cardiohepatic interactions in heart failure: an overview and clinical implications. J Am Coll Cardiol 2013; 61(24): 2397–2405.
22. Matthews JC, Pagani FD, Haft JW et al. Model for end-stage liver disease score predicts left ventricular assist device operative transfusion requirements, morbidity, and mortality. Circulation 2010; 121(2): 214–220.
23. Yang JA, Kato TS, Shulman BP et al. Liver dysfunction as a predictor of outcomes in patients with advanced heart failure requiring ventricular assist device support: Use of the Model of End-stage Liver Disease (MELD) and MELD eXcluding INR (MELD-XI) scoring system. J Heart Lung Transplant 2012; 31(6): 601–610.
24. Lee DS, Austin PC, Rouleau JL et al. Predicting mortality among patients hospitalized for heart failure: derivation and validation of a clinical model. JAMA 2003; 290(19): 2581–2587.
25. Bernardi M. Cirrhotic cardiomyopathy. Clinical Liver Disease 2013; 2(3): 99–101.
26. Zardi EM, Abbate A, Zardi DM et al. Cirrhotic Cardiomyopathy. J Am Coll Cardiol 2010; 56(7): 539–549.
27. Møller S, Hove JD, Dixen U et al. New insights into cirrhotic cardiomyopathy. Int J Cardiol 2013; 167(4): 1101–1108.
28. Simonneau G, Gatzoulis MA, Adatia I et al. Updated Clinical Classification of Pulmonary Hypertension. J Am Coll Cardiol. 2013; 62(25 Suppl): D34-D41.
29. Luknár M, Štefanková I, Goncalvesová R. Portopulmonálna artériová hypertenzia — opis prípadu a literárny prehad. Cardiol 2008; 17(1): 33–38.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 4- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




