-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výskyt reumatických manifestácií a orgánovo nešpecifickej autoimunity u chorých s autoimunitnou tyreopatiou
Prevalence of rheumatic manifestations and non‑organ specific autoimmunity in patients with autoimmune thyreopathy
Introduction:
A variety of rheumatic manifestations (RM) has been described in association with autoimmune thyroiditis (AIT). In the past, most of these manifestations were attributed to the underlying thyroid dysfunction, in particular hypothyroidism. AIT is often associated with non‑organ specific autoimmunity. Increased prevalence of non‑organ specific autoantibodies in patients with AIT without any evidence of rhemautic manifestations is clinically unclear. Aim of this study was to find out the frequency of apperance of non‑organ specific antibodies in serum in patients with AIT and prevalence of RM (arthralgia/ arthitis). Patients and methods: The group consisted of 80 patients with diagnosis AIT. The diagnosis of AIT was made according to established criteria. This diagnosis was primarily based on laboratory markers including thyroid hormone levels (TSH, fT4, fT3), the detection of antithyroid antibodies (anti‑TPO, anti‑TG, anti‑RTSH antibodies) and on ultrasound examination (imaging signs of thyroid autoimmunity) of thyroidal gland. None of the above patients had a history of systemic autoimmune disorders. In the group of patients with AIT we evaluated the prevalence of non‑organ specific antibodies (ANA/ Hep 2, ENA scr., SSA, SSB, nRNP, dsDNA, DNP, RF, ACLA scr., ANCA/ MPO, ANCA/ PR3) and presence of RM (arthritis/ arthralgia). The control group consisted of 34 patients with no overt history of AIT or systemic autoimmune disorders. Results: In the group of patients with AIT ANA positivity was found in 36/ 80 (45%) patients compared with 5/ 34 (14.7%) in healthy controls (p < 0.05). The prevalence of ANA autoantibodies was significantly higher in patients with AIT than in healthy controls. Other levels of non‑organ specific antibodies (ENA scr., SSA, SSB, nRNP, dsDNA, DNP, RF, ACLA scr., ANCA/ MPO, ANCA/ PR3) were not significantly different among patients with AIT and healthy controls. 40/ 80 (50%) of patients with AIT had artralgia compared with 7/ 34 (20.6%) in healthy controls (p < 0.05) and 19/ 80 (23.75%) of patients with AIT had arthritis compared with 1/ 34 (2.9%) in healthy controls (p < 0.05). The prevalence of RM (arthralgia and arthritis) in group of patients with AIT was significantly higher than in healthy controls. Conclusion: The prevalence of ANA autoantibodies and RM (arthralgia/ arthritis – both) was significantly higher in patients with AIT than in healthy controls.Key words:
autoimmune thyreopathy – non‑organ specific autoantibodies – connective tissue diseases – rheumatic manifestations
Autoři: K. Benhatchi 1; I. Lazúrová 1; D. Kozáková 2; J. Rovenský 2
Působiště autorů: I. interná klinika Lekárskej fakulty UPJŠ a FN L. Pasteura Košice, Slovenská republika, prednostka prof. MU Dr. Ivica Lazúrová, CSc., 2Národný ústav reumatických chorôb Piešťany, Slovenská republika, riaditeľ prof. MU Dr. Jozef Rovenský, DrSc., FRCP 1
Vyšlo v časopise: Vnitř Lék 2010; 56(2): 106-110
Kategorie: Původní práce
Souhrn
Úvod:
Pri autoimunitnej tyreopatii (AIT) bolo popísaných viacero reumatických manifestácií (RM). Väčšina z nich je obvykle spojená so základnou dysfunkciou štítnej žľazy. AIT je často spojená s orgánovo ‑ nešpecifickou autoimunitou. Zvýšená prevalencia organovo ‑ nešpecifických autoprotilátok u chorých s AIT bez RM však z hľadiska klinického významu ostáva nejasnou. Cieľom tejto práce bolo zistiť frekvenciu výskytu orgánovo nešpecifických autoprotilátok v sére u chorých s AIT a prevalenciu klinických RM (artralgie/ artritídy) u pacientov s AIT. Súbor a metódy: Súbor chorých tvorilo 80 pacientov s diagnózou AIT, ktorá bola stanovená na základe prítomnosti protilátok proti tyreoglobulínu a/ alebo tyreoperoxidáze a hypoechogenity v ultrasonografickom obraze štítnej žľazy. U týchto chorých sme vyšetrovali orgánovo ‑ nešpecifické autoprotilátky (ANA, ENA, SSA, SSB, nRNP, dsDNA, DNP, ACLA, ANCA, reumatoidný faktor) a výskyt klinických RM (artralgie/ artritídy). Kontrolnú skupinu (KS) tvorilo 34 náhodne vybraných pacientov, bez anamnézy výskytu AIT či systémového ochorenia spojiva (SOS). Výsledky: V súbore chorých s AIT bola zaznamenaná ANA pozitivita u 36/ 80 (45 %) v porovnaní s 5/ 34 (14,7 %) v KS (p < 0,05). Výskyt ostatných orgánovo ‑ nešpecifických autoprotilátok nebol významne častejší ako v KS. V skupine chorých s AIT sme zaznamenali u 40/ 80 (50 %) chorých artralgie v porovnaní s 7/ 34 (20,6 %) v KS (p < 0,05) a u 19/ 80 (23,75 %) chorých artritídy, v porovnaní s 1/ 34 (2,9 %) v KS (p < 0,05). Záver: Pacienti s AIT majú častejší výskyt orgánovo ‑ nešpecifických autoprotilátok ANA a častejšiu prevalenciu RM v porovnaní s KS.Kľúčové slová:
autoimunitná tyreopatia – orgánovo - nešpecifické protilátky – systémové ochorenia spojiva – reumatické manifestácieÚvod
Je známe, že AIT sa preferenčne združuje do prekrývajúcich sa syndrómov s orgánovo špecifickými ochoreniami, ako sú perniciózna anémia, systémová myasthenia, Addisonova choroba, idiopatická trombocytopenická purpura, vitiligo a diabetes mellitus 1. typu. Relatívne menej časté sú však údaje o združujúcich sa syndrómoch AIT s orgánovo-nešpecifickou autoimunitou. V súčasnosti za dokázanú asociáciu sa považuje spojenie AIT so Sjögrenovým syndrómom, systémovým lupus erythematodes a reumatoidnou artritídou.
Viaceré štúdie potvrdili asociáciu AIT s orgánovo-nešpecifickou autoimunitou, prevažne pozitivitou ANA protilátok. Zriedkavejšie bola popísaná asociácia s antifosfolipidovými autoprotilátkami. Vyšší výskyt iných orgánovo-nešpecifických autoprotilátok pri AIT zatiaľ v literatúre nebol jednoznačne potvrdený a je stále predmetom diskusií. Taktiež nie je stále jasný klinický význam ANA pozitivity u pacientov s AIT. V prípade absencie pridruženého SOS sa ich prítomnosť najskôr vysvetľuje polyklonálnou aktiváciou B lymfocytov, ktoré produkujú autoprotilátky nielen proti tyroidálne špecifickým antigénom, ale v menšej miere aj proti orgánovo-nešpecifickým antigénom a môžu súvisieť s mierou aktivity základného ochorenia (AIT). Prítomnosť týchto autoprotilátok je akýmsi nešpecifickým markerom aktivácie imunitného systému [1].
AIT je pre svoju frekvenciu a pre svoje prejavy na muskuloskeletálnom aparáte predmetom dynamickej medzioborovej spolupráce. Väčšina z RM je obvykle spojená so základnou dysfunkciou štítnej žľazy, prevažne hypotyreózou, ktorá je dôsledkom AIT. Najčastejšími manifestáciami sú kĺbne a svalové afekcie. Kĺbne postihnutia (artralgie/ artritídy) sú pri hypotyreóze pomerne časté a môžu imitovať zápalové reumatické ochorenia. Najčastejšie ide o postihnutia kolenných kĺbov a drobných kĺbov rúk, ktoré môžu byť sprevádzané rannou stuhnutosťou, tá však odoznieva rýchlejšie ako pri reumatoidnej artritíde. Synoviálna tekutina nemá zápalový charakter. Do obrazu rozvinutej hypotyreózy patrí aj postihnutie svalstva myopatiou v zmysle myalgií, pocitov stuhnutosti a svalovej slabosti, zvyčajne sprevádzanej vyššou hladinou sérovej kreatinkinázy a pozitívnym myogénnym nálezom pri elektromyografickom vyšetrení, evokujúc tak prítomnosť polymyozitídy. Hypertyreóza sa môže manifestovať na pohybovom ústrojenstve tyreoidálnou akropachyou, proximálnou myopatiou a difúznou osteoporózou. Terapia spočíva v liečbe základného ochorenia – dysfunkcie štítnej žľazy. Mnohí autori však opisujú u eutyreóznych pacientov s AIT širokú škálu zápalových artritíd charakterizovaných len miernym, neerozívnym vývojom, ktoré väčšinou súvisia jednak s nepoznanou koexistenciou s iným zápalovým reumatickým ochorením združeným s AIT, alebo ich prítomnosť dávajú do príčinnej súvislosti s priamym poškodením kĺbneho prostredia tyreoidálnou autoimunitou [2]. V súlade s týmto tvrdením u eutyreóznych pacientov s AIT bolo popísaných viacero artikulárnych a periartikulárnych príznakov.
Súbor chorých a metodika
Sledovaný súbor tvorilo 80 náhodnevybraných pacientov s AIT (77 žien a 3 muži), priemerného veku 52,79 ± 1,76 (medián 52, rozpätie 22 – 89 rokov). Do tejto skupiny sme zaradili71 pacientov s Hashimotovou tyreoi-ditídou (HT), t.j. 88,75 % v štádiu eu-funkcie alebo hypofunkcie a 9 pacien-tov (11,25 %) malo typický obraz Graves-Basedowovej tyreotoxikózy (G-B). Z hľadiska funkcie štítnej žľazy hypertyreózu malo 9 chorých (11,25 %), hypotyreózu malo 16 chorých, t.j. 20 %, a zvyšných 55 chorých bolo eutyreóznych (68,75 %). Diagnóza AIT bola stanovená na základe pozitivity protilátok proti tyreoglobulínu (aTG) a/ alebo tyreoperoxidáze (aTPO), prípadne proti TSH receptoru (TSH-r) a typického ultrasonografického obrazu AIT, t.j. difúznej alebo ložiskovej hypoechogenity štítnej žľazy.
Ako kontrolná skupina (KS) slúžil súbor 34 náhodne vybraných pacientov, ktorí nemali výskyt AIT a SOS. Súbor pozostával z 24 žien a 10 mužov, s priemerným vekom 47,21 ± 4,15 (medián 35, vekové rozpätie 22 – 85 rokov).
V súbore chorých s AIT sme vykonávali odber krvi ráno nalačno a sledovali sme výskyt orgánovo-nešpecifických autoprotilátok (ANA/ Hep 2, ENA scr., SSA, SSB, nRNP, dsDNA, DNP, RF, ACLA scr., ANCA/ MPO, ANCA/ PR3) a zároveň sme zisťovali výskyt klinických RM (artritídy, artralgie). Autoprotilátky ANA/ Hep 2 sme stanovili nepriamym imunofluorescenčným testom pomocou súpravy ANA/ Hep 2, distributor Dynex Servis, s.r.o. Autoprotilátky ENA scr., SSA, SSB, nRNP, ACLA scr., ANCA/ MPO, ANCA/ PR3 boli vyhodnocované pomocou ELISA metódy súpravou firmy AIDA, distributor Roner, s.r.o. Autoprotilátky anti dsDNA a anti DNP boli vyšetrované pomocou metódy house made ELISA-OIP (NÚRCH, Piešťany). Výsledky vyšetrení ENA scr. boli vyhodnocované ako pozitívne alebo negatívne podľa hodnoty cut off 0,298 v jednotkách OD (Optical Density). Za pozitívne hodnoty ENA scr. sme považovali hodnoty nad 0,298 OD a za negatívne sme považovali hodnoty pod 0,298 OD. ENA typizácia (SSA, SSB, nRNP) a ANCA/ MPO, ANCA/ PR3 boli hodnotené pozitívne v prípade, ak boli hodnoty vyššie ako 15 IU/ ml. Anti DNP protilátky boli pozitívne od 24 IU/ ml, ACLA protilátky scr. pozitívne od 20 IU/ ml, anti dsDNA protilátky pozitívne od 15 IU/ ml. Nefelometriou sme stanovili reumatoidný faktor (RF), ktorý bol pozitívny od 20 U/ ml. U chorých s AIT a u KS sme realizovali klinické reumatologické vyšetrenie, kde sme anamnézou a fyzikálnym vyšetrením vyhodnocovali počet bolestivých kĺbov – artralgií – a počet opuchnutých kĺbov – artritíd. V KS sme sledovali výskyt orgánovo-nešpecifických autoprotilátok a frekvenciu výskytu klinických RM.
Štatistické spracovanie a vyhodnotenie
Rozdiely v kvantitatívnych parametroch medzi jednotlivými súbormi sme vyšetrovali nepárovým T-testom a vzťahy medzi kvantitatívnymi údajmi boli hodnotené pomocou lineárnej regresnej analýzy. Na hodnotenie štatistickej významnosti výskytu jednotlivých parametrov sme použili χ2 test.
Výsledky (tab. 1)
Najviac zastúpenými autoprotilátkami v súbore chorých s AIT boli ANA (n = 36, t.j. 45 %), pričom zriedkavo sa vyskytli ENA (n = 2, t.j. 2,5 %), SSA (n = 2, t.j. 2,5 %), RF (n = 1, t.j. 1,25 %). Výskyt ostatných autoprotilátok sme v súbore chorých s AIT nezaznamenali. V KS najčastejšími autoprotilátkami boli ANA (n = 5, t.j. 14,7 %), ENA (n = 4, t.j. 11,76 %), SSA (n = 3, t.j. 8,82 %), SSB (n = 1, t.j. 2,94 %). Výskyt ostatných autoprotilátok sme v KS nezaznamenali. Zistili sme teda signifikantne vyšší výskyt ANA autoprotilátok u chorých s AIT oproti KS. Výskyt ENA, SSA, SSB a RF nebol významne častejší ako v KS. SSB autoprotilátky sme zaznamenali u jedného chorého z KS (2,94 %) a pozitivitu RF u jedného chorého s AIT (1,25 %).
Tab. 1. Výskyt orgánovo-nešpecifických autoprotilátok u chorých s AIT a v KS. 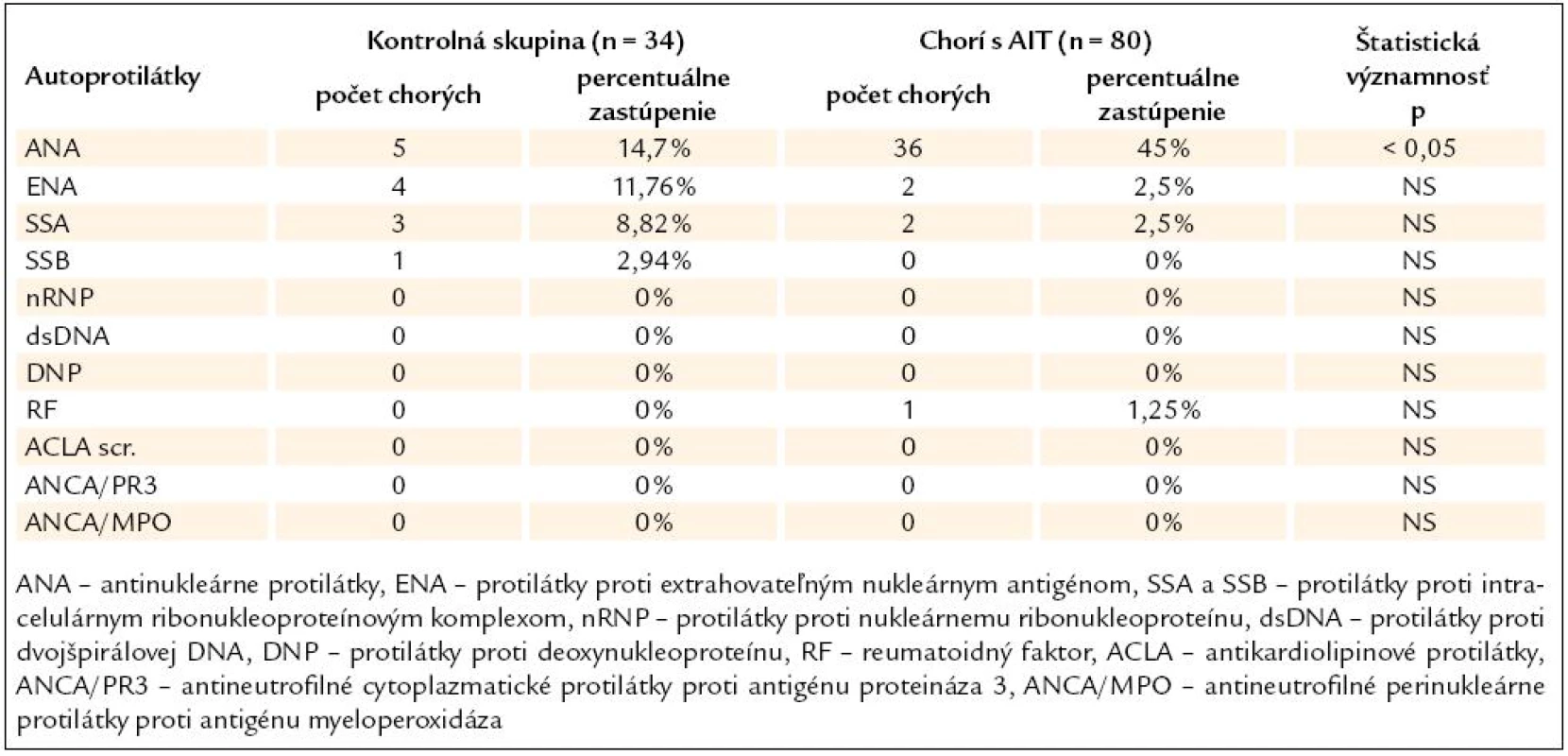
Výskyt reumatických prejavov u chorých s AIT a v KS (tab. 2)
V skupine chorých s AIT sme zaznamenali u 40 z 80 chorých, t.j. u 50 % artralgie, a 19 z 80 chorých, t.j. 23,75 % mali prítomné opuchy kĺbov. V KS sme zaznamenali u 7 pacientov artralgie, t.j. 20,6 % a u 1 pacienta, t.j. 2,9 % bol prítomný opuch členkového kĺbu.
Tab. 2. Výskyt artralgií a opuchov kĺbov v skupine chorých s AIT a v kontrolnej skupine. 
Zistili sme významne vyšší výskyt artralgií (p < 0,05) a opuchov kĺbov (p < 0,05) u chorých s AIT oproti KS.
Diskusia
Viacero súčasných prác a štúdií dostatočne dokazuje zvýšenú prevalenciu ANA autoprotilátok u chorých s AIT oproti bežnej populácii [3 – 6]. Napr. v štúdii gréckych autorov, ktorí vyšetrovali 168 chorých s AIT, registrovali u 58 pacientov, t.j. 35 % pozitivitu ANA autoprotilátok, oproti 7, t.j. 9 % zo 75 členného KS (p = 0,001), čo je podobný nález ako v našom súbore. Z 58 ANA pozitívnych pacientov 6 (10 %) mali prítomné SSA, 1 pacient mal súčasne SSA a SSB protilátky, 7 (12 %) mali prítomné dsDNA protilátky a 7 (12 %) mali prítomné kardiolipínové autoprotilátky. Z KS ani jeden pacient nemal zachytenú pozitivitu anti dsDNA, ENA alebo ACLA protilátky [5]. V štúdii českých autorov, ktorí vyšetrovali výskyt extratyreoidálnych autoprotilátok u 1 508 pacientov s AIT, zaznamenali ANA pozitivitu v 394 prípadoch, t.j. v 26,1 % [6]. Podobné výsledky zaznamenal i Morita et al, kde ANA autoprotilátky boli prítomné u 26 % z 50 pacientov s AIT, zatiaľ čo v 100 - člennej KS boli prítomné len v 8 %. Nijaký z vyšetrovaných pritom nemal zvýšené protilátky proti chorobe špecifickým autoantigénom ako dsDNA, ENA, SSA, SSB [3]. V ďalšej štúdii francúzskych autorov, ktorí vyšetrovali 224 pacientov s AIT (G-B a HT), boli detekované patologicky zvýšené ANA autoprotilátky u 63 % pacientov s G-B tyreotoxikózou a u 65,5 % pacientov s HT. Ani jeden pacient nemal pozitivitu anti ds DNA protilátok [7]. Podobne ani v našom súbore sme nenašli ani v jednom prípade pozitivity ANA súčasne aj pozitivitu anti dsDNA autoprotilátok. Zvýšená prevalencia ANA autoprotilátok pri AIT je dlhodobo známa a všeobecne uznávaná [3,5 – 8]. Ich prítomnosť u chorých s AIT bez RM však z hľadiska klinického významu ostáva nejasnou. Tieto autoprotilátky sa zdajú byť najskôr akýmsi nešpecifickým markerom imunitnej dysregulácie [7]. Nízky titer týchto autoprotilátok nie je zriedkavým nálezom aj u pacientov, ktorí zjavne netrpia na reumatické ochorenie [8]. Vzhľadom k relatívne častému výskytu a nešpecificite ANA autoprotilátok u pacientov s AIT, ktorí sú bez RM, väčšina autorov neodporúča ANA rutínne vyšetrovať. Čo sa týka prevalencie ostatných orgánovo-nešpecifických autoprotilátok (ENA, SSA, SSB, RF n RNP, ds DNA, DNP, ACLA, ANCA) u chorých s AIT, literárne údaje sú menej časté a ostávajú kontroverzné [5,9 – 11]. Rozporuplné výsledky týkajúce sa prevalencie anti dsDNA u chorých s AIT môžu byť sčasti vysvetlené rozličnými diagnostickými metodikami, ktoré boli používané pri detekcii v skorších štúdiách [10 – 13]. V našom súbore chorých s AIT a ani v KS sme pozitivitu anti dsDNA nezaznamenali. V našom súbore sme taktiež nedetekovali ani jeden prípad pozitivity autoprotilátok SSA/ antiRo a SSB/ anti-La, čo je v súlade s výsledkami niekoľkých hore citovaných prác. Pozitivita týchto autoprotilátok u chorých s AIT bola v literatúre opísaná len sporadicky. Hansen et al zaznamenali, že jeden z 63 chorých s AIT mal pozitivitu anti-Ro autoprotilátky a žiaden nemal pozitivitu anti La autoprotilátky [9]. Ďalšie štúdie skúmajúce prítomnosť viacerých orgánovo-nešpecifických autoprotilátok u chorých s AIT nezahŕňali vyšetrenie anti-Ro a ani anti La autoprotilátok, alebo tieto protilátky u chorých s AIT nedetekovali [12,15].
Zvýšená prevalencia ACLA u chorých s AIT je v štúdiách zaznamenaná iba zriedkavo. Paggi et al zaznamenali prítomnosť ACLA IgG a/ alebo IgM u 17 z 31 pacientov s AIT, t.j. 55 %. Žiaden z nich však nevykazoval klinické manifestácie antifosfolipidového syndrómu (APS) [14]. Osundeko et al v roku 2001 našli zvýšené hladiny ACLA autoprotilátok IgG a IgM u 4 (24 %) z 19 chorých s HT. Nezaznamenali však vzťah medzi pozitivitou ACLA protilátok a tyreoidálnou autoimunitou (anti Tg a anti TPO), žiaden pacient s pozitívnymi ACLA nevykazoval manifestáciu APS [1]. Avšak väčšina autorov vo svojich prácach nezaznamenala vyšší výskyt pozitivity ACLA u pacientov s HT alebo GB oproti KS [15], čo bolo evidentné aj v našej štúdii. Aj naše nálezy podporujú hypotézu viacerých autorov, že u chorých s AIT ide najskôr o polyklonálnu aktiváciu B lymfocytov, ktoré produkujú autoprotilátky nielen proti tyroidálne špecifickým antigénom, ktoré sú pre chorobu (AIT) špecifické, ale v menšej miere aj proti orgánovo-nešpecifickým antigénom a môžu súvisieť s mierou aktivity základného ochorenia (AIT).
Punzi et al pri sledovaní 139 chorých s AIT bez iných známych ochorení, ktoré by mohli súvisieť s udávanými reumatickými ťažkosťami, zaznamenali polyartralgie u 26 chorých, t.j. 18,7 % a artritídy taktiež u 26 chorých (18,7 %), ostatné RM (fibromyalgia, svalová bolesť a slabosť, Raynaudov fenomén, syndróm karpálneho kanála) boli zaznamenané menej často [2]. V našom súbore bol výskyt artralgií ešte vyšší a výskyt artritíd bol podobný ako v uvedenej štúdii. Keďže pacienti s AIT mali vyšší vekový priemer, ktorý však nebol štatisticky významný, na vyššej prevalencii artralgií nemôžeme vylúčiť aj spolupodiel osteoartrózy, ktorú sme však u týchto chorých nevyšetrovali. Mnohí autori konštatujú, že pri AIT je možné nájsť širokú škálu RM, medzi najčastejšie však patria artropatie (artralgie a artritídy), svalové a kožné manifestácie [2]. Väčšina z nich sú obvykle spojené so základnou dysfunkciou štítnej žľazy, prevažne hypotyreózou. Pri chýbaní tyreoidálnej dysfunkcie však existujú ďalšie možnosti, ako vysvetliť reumatické symptómy. Prvou možnosťou sú mnohé dôkazy o tom, že časť chorých s AIT má iné autoimunitné ochorenia spojené alebo overlapujúce AIT, ako sú SOS (SS, SLE, RA, SSc). Punzi et al sledoval 33 eutyreóznych pacientov s AIT a prejavmi neklasifikovanej artritídy. Pacienti boli rozdelení do 2 skupín podľa prítomnosti polyartritídy alebo oligoartritídy. Počas 6-ročného sledovania u 8 zo 16 pacientov s polyartritídou sa vyvinula ťažká RA, charakterizovaná kostnými eróziami, vysokými hladinami interleukínu b v synoviálnej tekutine a zvýšenou frekvenciou HLA DR4. U ostatných 8 chorých perzistovala len mierna neerozívna forma artritídy, dobre odpovedajúca na symptomatickú liečbu [16]. Ďalšie teórie predpokladajú priamy vplyv tyreoidálnej autoimunity prostredníctvom antityreoidálnych autoprotilátok. Blake et al detekovali v synoviálnej tekutine u 34 pacientov z 54 s AIT tyreoidálne autoprotilátky, hoci len jedna štvrtina z nich mala pozitívne antityreoidálne protilátky v sére [17]. Títo autori uvažujú o lokálnej produkcii antityreoidálnych protilátok synoviálnymi lymfocytmi, ktoré podobne ako tyreoidálne lymfocyty produkujú autoprotilátky participujúce na postihnutí kĺbneho prostredia a konštatujú, že v spojení s AIT je možné nájsť širokú škálu zápalových artritíd charakterizovaných len miernym, neerozívnym vývojom, a to nezávisle od tyroidálnej funkcie. Avšak uvedené antityreoidálne protilátky v synoviálnej tekutine sme v tejto práci nevyšetrovali.
Záver
Záverom môžeme konštatovať, že výsledky našej práce podporujú existen-ciu vzťahu – asociácie AIT s orgánovo-nešpecifickou autoimunitou. Pacienti s AIT majú významne častejší výskyt orgánovo-nešpecifických autoprotilátok ANA a klinických RM (artralgie, opuchy kĺbov) v porovnaní s kon-trolami. Z klinického aspektu však nemá význam u pacientov s AIT, bez reumatických symptómov realizovať štandardný skríning orgánovo-nešpecifickej autoimunity.
MUDr. Karim Benhatchi, PhD.
www.upjs.sk
e-mail: kbenhatchi@atlas.skDoručeno do redakce: 27. 9. 2009
Přijato po recenzi: 16. 11. 2009
Zdroje
1. Osundeko O, Hasinski S, Rose L. Anti‑cardiolipin antibodies in Hashimoto’s disease. Endocr Pract 2001; 7 : 181 – 183.
2. Punzi L, Batterle C. Chronic autoimmune thyroiditis and rheumatic manifestations. Joint Bone Spine 2004; 71 : 275 – 283.
3. Morita S, Arima T, Matsuda M. Prevalence of nonthyroid specific autoantibodies in autoimmune thyroid disease. J Clin Endocrinol Metab 1995; 80 : 1203 – 1206.
4. Guerin V, Bene MC, Barbe F et al. Stigmates autoimmunitaires thyroidiens au cours de la polyarthrite rhumatoide. Rev Rhum 1987; 54 : 438.
5. Tektonidou MG, Anapliotou M, Vlachoyiannopoulos P et al. Presence of systematic autoimmune disorders in patiens with autoimmune thyroid diseases. Ann Rheum Dis 2004; 63 : 1159 – 1161.
6. Šterzl I, Hrdá P, Matucha P et al. Polyglandulární aktivace autoimunity jako projev subklinických endokrinopatií. Čas Lék Čes 2007; 146 : 256 – 261.
7. Guerin V, Prestat F, Bene MC et al. Prevalence of non‑thyroid autoantibodies in autoimmune dysthyroidies. Ann Endocrinol 1989; 50 : 477 – 482.
8. Weetman A. Non ‑ thyroid autoantibodies in autoimmune thyroid disease. Best Practice and Research Clin Endocrinology and Metabolism 2005; 19 : 17 – 32.
9. Hansen BU, Ericsson UB, Henricsson V et al. Autoimmune thyroiditis and primary Sjogren’s syndrome: clinical and laboratory evidence of the coexistence of the two diseases. Clin Exp Rheumatol 1991; 9 : 137 – 141.
10. Katakura M, Yamada T, Aizawa T et al. Presence of antideoxyribonucleic acid antibody in patients with hyperthyroidism of Grave’s disease. J Clin Endocrinol Metab 1987; 64 : 405 – 408.
11. McDermott MT, West SG, Emlen JW et al. Antideoxyribonucleic acid antibodies in Grave’s disease. J Clin Endocrinol Metab 1990; 71 : 509 – 511.
12. Baethge BA, Levine SN, Wolf RE. Antibodies to nuclear antigens in Grav’s disease. J Clin Endocrinol Metab 1988; 66 : 485 – 488.
13. Loviselli A, Velluzzi F, Pala R et al. Circulating antibodies to DNA‑related antigens in patients with autoimmune thyroid disorders. Autoimmunity 1992; 14 : 33 – 36.
14. Paggi A, Caccavo D, Ferri GM et al. Anti‑cardiolipin antibodies in autoimmune thyroid diseases. Clin Endocrinol 1994; 40 : 329 – 333.
15. Petri M, Karlson EW, Cooper DS et al. Antibody tests in autoimmune thyroid disease: a case ‑ control study. J Rheumatol 1991; 18 : 1529 – 1531.
16. Punzi L, Michelotto M, Pianon M et al. Clinical, laboratory and immunogenetic aspects of arthritis associated with chronic lymfocytic thyroiditis. Clin Exp Rheumatol 1997; 15 : 373 – 380.
17. Blake DR, McGregor AM, Stansfield E et al. Antithyroid ‑ antibodies activity in the synovial fluid of patients with various arthritides. Lancet 1979; 2 : 224 – 226.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Výskyt reumatických manifestácií a orgánovo nešpecifickej autoimunity u chorých s autoimunitnou tyreopatiou
- Probiotika u akutní pankreatitidy – randomizovaná, placebem kontrolovaná, dvojitě slepá studie
- Rizika dlouhodobé antisekreční terapie
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
- Endokanabinoidní systém a ovlivnění trombogeneze
- Antitrombotická terapie v graviditě
- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Infikovaný myxom jako příčina akutní infekční endokarditidy
- Přehodnocení doporučení pro diagnostiku a léčbu hypertenze
- Jubileum Ing. Kataríny Derzsiovej
-
Riečanský I. Aterosklerotické choroby. Epidemiológia a prevencia z pohľadu klinickej praxe
Klener P., Klener jr. P. Nová protinádorová léčiva a léčebné strategie v onkologii - Výskyt revmatických manifestací a orgánově nespecifické autoimunity u nemocných s autoimunitní tyreopatií – editorial
- Několik poznámek k problematice infikovaného myxomu – editorial
- Analýza a srovnání souborů nositelů implantabilního kardioverteru- defibrilátoru v primární a sekundární prevenci
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Centrální diabetes insipidus u dospělých osob – první příznak histiocytózy z Langerhansových buněk a Erdheimovy‑Chesterovy choroby. Popis tří případů a přehled literatury
- Rizika dlouhodobé antisekreční terapie
- Kazuistika mladého pacienta s konstriktivní perikarditidou se subakutním průběhem
- Přímý inhibitor reninu aliskiren v léčbě kardiovaskulárních a renálních onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



