-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSrovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
Comparison of serum levels of selected biological parameters in monoclonal gammopathy of undetermined significance and multiple myeloma
Purpose of study:
The study focuses on evaluation of differences in serum levels of selected biological indicators in monoclonal gammopathy of undetermined significance (MGUS) and multiple myeloma (MM), primarily from the viewpoint of potential asset to clinical practice.Patients and methodology:
The analyse set of 96 patients consisted of 30 individuals with MGUS and 66 patients with MM examined in the context of the disease diagnosis before therapy commencement. Serum levels of the assessed parameters were examined with the help of radio-enzymatic method (thymidinkinase), radioimmunoanalysis (β2-micro-globulin, ICTP, PINP), enzymoimmunoessay method (sIL-6R, sVCAM-1, sICAM-1, sOPG and sRANKL) and the technique of quantitative sandwich enzymatic immunoessay (sHGF, sVEGF, bFGF, syndecan-1/CD138 and sFas). Statistical examination was performed by Pearson and Fischer test, χ2-test, or nonparametric U-test pursuant to Mann-Whitney (p < 0,05).Results:
Statistically significant differences were found between MGUS and MM in the case of serum level comparisons of sIL - 6R (p = 0.02), ICTP (p = 0.001), sHGF (p = 0.001) and syndecan-1/sCD138 (p = 0.001), while no statistically significant differences were present in the case of sVCAM-1, sICAM-1, PINP, sOPG, sVEGF and sFas. During the analysis of frequency of occurrence of abnormal values in the MM and MGUS groups, significant differences were found not only in the case of standard parameters, such as β2-microglobulin, thymidinkinase, creatinin and albumin, but also in the case of sIL-6R, ICTP, sHGF and syndecan-1, but not in comparisons of the levels of sVCAM-1, sICAM-1, PINP, sOPG, sVEGF and sFas. Attempts at examination of serum levels of sRANKL and soluble form of bFGF failed as too low values were measured.Conclusion:
The analysis of behaviour of the 10 parameters, mostly intimately related to biological properties of clonal plasmatic cells or to changes of microclimate of bone marrow, effectively contributed to distinction between MGUS and MM only in the case of serum levels of sIL-6R, ICTP, sHGF and syndecan-l (sCD138), i.e. indicators with demonstrable relevance for MM prognosis assessment.Key words:
multiple myeloma – monoclonal gammopathy of undetermined significance – angiogennic cytokines – indicators of bone turnover – syndecan-1 – sFas
Autoři: V. Ščudla 1; M. Budíková 2
; T. Pika 1; J. Minařík 1; M. Zemanová 1; J. Bačovský 1; V. Heincová 3; Česká Myelomová Skupina
Působiště autorů: III. . interní klinika Lékařské fakulty UP a FN, Olomouc, přednosta prof. MUDr. Vlastimil Ščudla, CSc. 1; Klinika nukleární medicíny Lékařské fakulty UP a FN, Olomouc, přednosta doc. MUDr. Miroslav Mysliveček, CSc. 2; Hematologické a transfuzní oddělení Slezské nemocnice, Opava, přednostka prim. MUDr. Vladimíra Heincová 3
Vyšlo v časopise: Vnitř Lék 2006; 52(3): 232-240
Kategorie: Původní práce
Souhrn
Cíl práce:
Předložená práce je zaměřena na vyhodnocení rozdílů sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu (MGNV) a mnohočetného myelomu (MM), a to především z pohledu potenciálního přínosu pro klinickou praxi.Soubor nemocných a metodika:
Analyzovaná sestava 96 nemocných sestávala ze 30 jedinců s MGNV a 66 nemocných s MM vyšetřených při diagnóze nemoci před nasazením léčby. K vyšetření sérových hladin hodnocených parametrů byla použita radioenzymatická metoda (thymidinkináza), radioimunoanalýza (β2-mikroglobulin, ICTP, PINP), metoda enzymoimunoeseje (sIL-6R, sVCAM-1, sICAM-1, sOPG a sRANKL) a technika kvantitativní sendvičové enzymatické imunoeseje (sHGF, sVEGF, bFGF, syndekan-1/CD138 a sFas). Statistické šetření bylo prováděno s použitím Pearsonova a Fischerova testu, χ2-testu, případně nonparametrického U testu dle Manna-Whitneye (p < 0,05).Výsledky:
Statisticky významné rozdíly byly zjištěny mezi MGNV a MM v případě srovnání sérových hladin sIL-6R (p = 0,02), ICTP (p = 0,001), sHGF (p = 0,001) a syndekanu-1/sCD138 (p = 0,001), zatímco v případě sVCAM-1, sICAM-1, PINP, sOPG, sVEGF a sFas statisticky významné rozdíly nebyly přítomny. Z analýzy frekvence výskytu abnormálních hodnot v souboru MM a MGNV byly shledány významné rozdíly nejen v případě standardních parametrů, jakými jsou β2-mikroglobulin, thymidinkináza, kreatinin a albumin, ale i v případě sIL-6R, ICTP, sHGF a syndekanu-1, nikoliv však při srovnání hladin sVCAM-1, sICAM-1, PINP, sOPG, sVEGF a sFas. Snaha o vyšetření sérových hladin sRANKL a solubilní formy bFGF se nesetkala s úspěchem vzhledem k naměření velmi nízkých hodnot.Závěr:
Z analýzy chování 10 parametrů, majících vesměs intimní vztah k biologickým vlastnostem klonálních plazmatických buněk nebo ke změnám mikroprostředí kostní dřeně, se z hlediska přínosu pro odlišení MGNV od MM jevily v účelném světle pouze sérové hladiny sIL-6R, ICTP, sHGF a syndekanu-l (sCD138), tj. ukazatelé s prokázaným významem pro hodnocení prognózy MM.Klíčová slova:
mnohočetný myelom – monoklonální gamapatie nejistého významu – angiogenní cytokiny – ukazatelé kostního obratu - syndekan-1 - sFasÚvod
Problematice etiopatogeneze a diferencovaného klinického přístupu k jednotlivým typům monoklonálních gamapatií (MG) je věnována v posledních letech zvýšená pozornost. Dokladem je nejen koncepce „multistep“ etiopatogenezy mnohočetného myelomu (MM), popisující postupné změny, ke kterým dochází v průběhu vývoje od normálního plazmocytu zárodečného centra přes klonální nezhoubnou plazmocelulární proliferaci charakteru monoklonální gamapatie nejistého významu (MGNV), až k monoklonální proliferaci neoplasticky transformovaných plazmocytů u MM [19,51], ale i řada diagnostických „guidelines“ ,včetně recentních kritérií MGNV a MM vydaných v roce 2003 IMWG (International Myeloma Working Group) [21]. Nelze pominout, že současná kritéria, sloužící k vymezení MGNV od rozvinuté formy MM jsou víceméně deskriptivní a založená na stanovení limitních hodnot monoklonálního imunoglobulinu (MIG) v séru (30 g/l) nebo odpadu lehkých řetězců imunoglobulinu močí (1 g/24 hod), zastoupení plazmocytů v kostní dřeni (10 %) a chybění specifických orgánových změn typu „CRAB“ (hyperkalcemie, renální insuficience, anémie a myelomové kostní nemoci, tj. „bone disease“) [2,21]. Je nasnadě, že tato víceméně arbitrálně stanovená, kvantitativně laděná kritéria, vyjadřující vesměs jen velikost nádorové masy, neumožňují spolehlivé odlišení preneoplastických od neoplastických stavů a od situací, tvořících přirozený vývojový mezistupeň v linii transformačního procesu, tj. „evolving“ MGNV, a nezabraňují proto zcela možnosti diagnostických nepřesností i terapeutických chyb [5]. Zásadním nedostatkem současných konvenčních diagnostických kritérií MGNV a MM je především nezařazení ukazatelů vyjadřujících vnitřní biologické vlastnosti plazmatických buněk a změn probíhajících v podmínkách mikroprostředí kostní dřeně. Především poznání a využití specifických biologických znaků by mohlo lépe nežli dosavadní standardní kritéria podstatně obohatit možnosti diferenciální diagnostiky MGNV a MM a přispět tak i k včasnému podchycení případného nástupu maligní transformace MGNV.
Náplní předložené studie je srovnání rozdílů sérových hladin vybraných solubilních působků cytokinové sítě (sIL-6R), angiogenezy (sHGF - „hepatocyte growth factor“, sVEGF - „vascular endothelial growth factor“ a solubilní formy bFGF - „basic fibroblast growth factor“), některých ukazatelů kostního obratu (ICTP - „intercellular C-terminal telopeptide colagen-1“, PINP - „N-terminal peptide procolagen-1“, sOPG - osteoprotegerin, sRANKL - „receptor activator of nuclear factor κ-B ligand“), cytoadhezivních molekul (sVCAM-1 - „vascular cell adhesion molecule-1“ a sICAM-1 „intercellular cell adhesive molecule-1“) a dalších ukazatelů majících intimní vztah k biologickým vlastnostem klonálních plazmocytů, tj. syndekan-1 (sCD138) a k apoptóze, tj. sFas antigen (Apo-1/CD95), a to především z pohledu možného využití v klinické praxi. Je nasnadě, že předložené spektrum analyzovaných parametrů představuje jen velmi omezený výčet z široké škály v současnosti diskutovaných působků, i tak však zaujímá poměrně širokou paletu ukazatelů odrážejících biologickou podstatu a chování plazmocelulárního klonu, případně i vlastnosti mikroprostředí kostní dřeně (KD) u MGNV a rozvinuté formy MM.
Soubor nemocných a metody vyšetření
Analyzovanou sestavu 96 nemocných tvořilo 30 jedinců s MGNV splňujících IMWG kritéria [21] a 66 pacientů s MM splňujících SWOG (South West Oncology Group) i IMWG kritéria nemoci vyšetřených při diagnóze před zahájením cytostatické léčby [2,13,21]. Věkový medián v souboru MGNV byl 61 (36-78) let, poměr M/Ž byl 1,0 : 1,1, imunochemický typ IgG byl zastoupen v 83 % (n = 25), IgA ve 13 % (n = 4) a IgM ve 3 % (n = 1), lehký řetězec κ se vyskytoval v 57 % (n = 17) a λ ve 43 % (n = 13). V souboru nemocných s MM byl věkový medián 63 (35-81) let, poměr M/Ž byl 1,0 : 1,3, imunochemický typ IgG byl zastoupen v 58 % (n = 38), IgA ve 27 % (n = 18), Bence-Jonesův typ ve 12 % (n = 8), IgD a nesekretorický typ shodně v 1,5 % (n = 1 a 1); výskyt lehkého řetězce κ a λ byl 70 % (n = 46) a 29 % (n = 19), nesekretorický typ 1,5 % (n = 1). Při hodnocení stupně pokročilosti nemoci s pomocí klinického stážovacího systému dle Durieho-Salmona [13] bylo stadium I zastoupeno v 6 % (n = 4), stadium II ve 38 % (n = 25) a stadium III v 56 % (n = 37). K vyšetření hladiny thymidinkinázy v séru (S-TK - normální rozmezí 0-9 IU/l) byla použita radioenzymatická metoda (REA kit, Immunotech, Praha), beta2-mikroglobulinu (S-B2M - 0,9-2,4 mg/l) metoda radioimunoanalýzy (RIA kit, Immunotech, Praha). Sérové hladiny sIL-6R (10-90 ng/ml), sVCAM-1 (395-714 ng/ml) a sICAM-1 (269-691 ng/ml) byly měřeny metodou enzymoimunoeseje (kity ELISA, Immunotech, Praha), zatímco ICTP (M - 2,1-5,0, Ž - 2,1-5,6 µg/l) a PINP (M - 21-78 µg/l a Ž - 19-102 µg/l) metodou radioimunoanalýzy (RIA kit, Orion Diagnostica, Espoo, Finland), sOPG (3,7-4,4 µmol/l) a sRANKL (0-50 pmol/l) metodou enzymoimunoeseje (ELISA kit, Biomedica Gruppe, Wien), a sHGF (671-1992 pg/ml), sVEGF (62-707 pg/ml), bFGF (bez vymezení normálních hodnot, pg/ml), syndekan-1/sCD138 (37-123 ng/ml) a sFas (4792-17150 pg/ml) technikou kvantitativní sendvičové enzymatické imunoeseje (kit Quantikine RD, Minneapolis). Ke statistickému hodnocení byl použit v případě sIL-6R χ2-test dle Pearsona a Fischerův exaktní test, při hodnocení ostatních ukazatelů byl použit χ2-test a nonparametrický U test dle Manna-Whitneye na hranici významnosti p < 0,05.
Výsledky
Z provedené analýzy vyplynulo, že jedinci s MGNV se od nemocných s nově stanovenou diagnózou MM odlišují výší hladin některých z aktuálně vyšetřených solubilních biologických působků, zatímco v případě sérových hladin některých jiných ukazatelů nebyly shledány významné rozdíly. Jak patrno z tabelárního, a zčásti i z grafického vyjádření byly shledány statisticky významné rozdíly jedinců s MGNV vs MM v případě sérových hladin ICTP (tab. 1, graf 1), sHGF (tab. 1, graf 2) a solubilní formy syndekanu-1 (sCD138) (tab. 1, graf 3). V analyzované sestavě nebyly shledány statisticky významné rozdíly mezi oběma porovnávanými soubory (MGNV vs MM) v případě hodnocení výšky sérových hladin sVCAM-1, sICAM-1, PINP, sOPG, sVEGF a sFas (tab. 1). Hlubší analýza zjistila podstatné rozdíly při srovnání frekvence výskytu zvýšených sérových koncentrací mezi skupinami jedinců s MGNV vs nemocných s MM v případě konvenčních ukazatelů (S-B2M, S-TK, S-kreatinin a S-albumin), zejména však při analýze parametrů zařazených do „designu“ studie, tj. sIL-6R, ICTP, sHGF a solubilní formy syndekanu-1, nikoliv ale při srovnání sVCAM-1, sICAM-1, PINP, sOPG, sVEGF a sFas (tab. 2). Vzhledem k velkému rozptylu hodnot sIL-6R byly hodnoceny vysoké hladiny tohoto cytokinu souborně zařazením do 2 skupin s diskriminační hodnotou 100 IU/l. V souboru 58 nemocných s MM byl výskyt hodnot sIL-6R < 100 IU/l zaznamenán u 22 (38 %) nemocných, zatímco hodnoty > 100 IU/l u 36 (62 %) pacientů. V souboru 30 jedinců s MGNV byly hodnoty sIL-6R < 100 IU/l zjištěny u 22 (73 %) a > 100 IU/l u 8 (27 %) nemocných. Statistická analýza zjistila významný rozdíl mezi oběma skupinami jak s pomocí Pearsonova testu (p = 0,02) tak i s pomocí Fischerova exaktního testu (p = 0,03). Snaha o vyšetření sérových hladin sRANKL v souboru s MM se nesetkala s úspěchem, neboť u 10 z 11 vyšetřených nemocných byly hodnoty sRANKL < 0,08 pmol/l. Stejně rozpačitě vyzněla i snaha o vyhodnocení sérové hladiny solubilní formy bFGF, neboť u všech 26 takto vyšetřených nemocných s MM byla zjištěna hodnota < 3 pg/ml.
Tab. 1. Srovnání rozdílu sérových hladin vybraných biologických ukazatelů mezi souborem nemocných s mnohočetným myelomem vyšetřeném při diagnóze před nasazením léčby a souborem jedinců s monoklonální gamapatií nejistého významu. 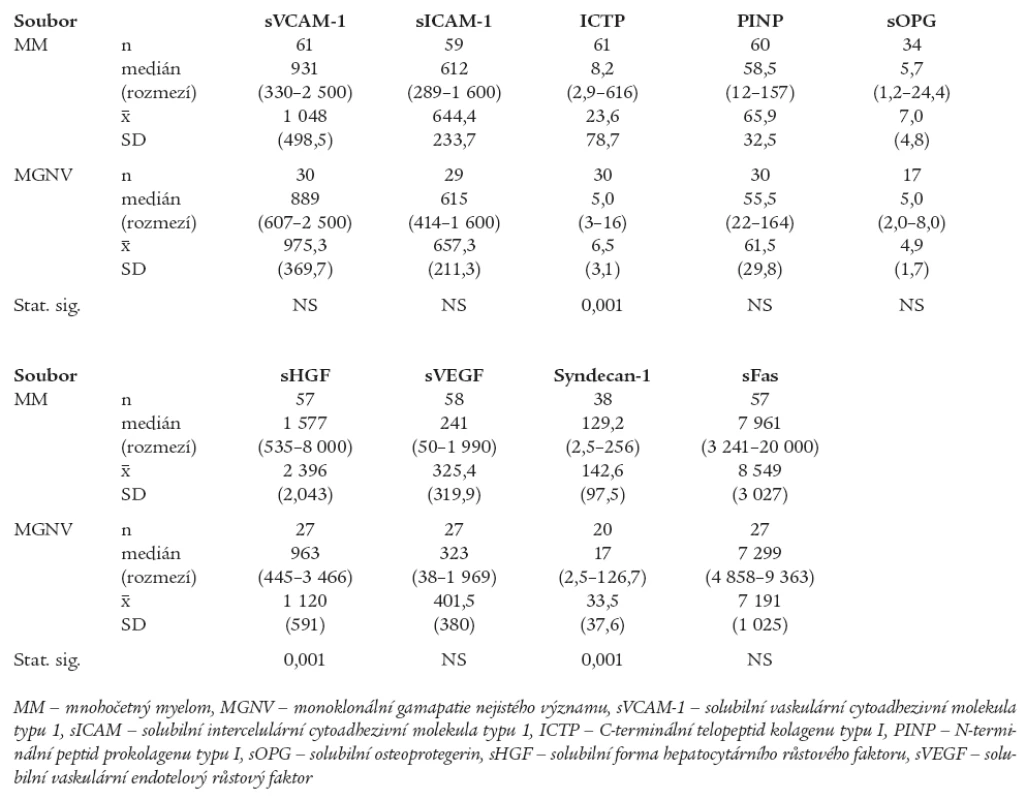
Graf 1. Grafické vyjádření rozdílů v sérových hladinách ICTP (C-terminální telopeptid kolagenu typu I) pomocí bilogaritmického souřadnicového systému mezi souborem 61 nemocných s mnohočetným myelomem (MM) vyšetřeném při diagnóze nemoci a souborem 30 jedinců smonoklonální gamapatií nejistého významu (MGNV), p = 0,001. 
Graf 2. Grafické vyjádření rozdílů v sérových hladinách HGF (hepatocytárního růstového faktoru) pomocí bilogaritmického souřadnicového systému mezi souborem 57 nemocných s mnohočetným myelomem (MM) vyšetřeném při diagnóze nemoci a souborem 27 jedinců s monoklonální gamapatií nejistého významu (MGNV), p = 0,001. 
Graf 3. Grafické vyjádření rozdílů v sérových hladinách syndekanu-1 (sCD<sub>138</sub>) s pomocí bilogaritmického souřadnicového systému mezi souborem 38 nemocných s mnohočetným myelomem (MM) vyšetřeném při diagnóze nemoci a souborem 20 jedinců s monoklonální gamapatií nejistého významu (MGNV), p = 0,001. 
Tab. 2. Srovnání výskytu abnormálních hodnot sérových hladin vybraných biologických ukazatelů mezi souborem nemocných s mnohočetným myelomem vyšetřeném při diagnóze před nasazením léčby a souborem jedinců s monoklonální gamapatií nejistého významu. 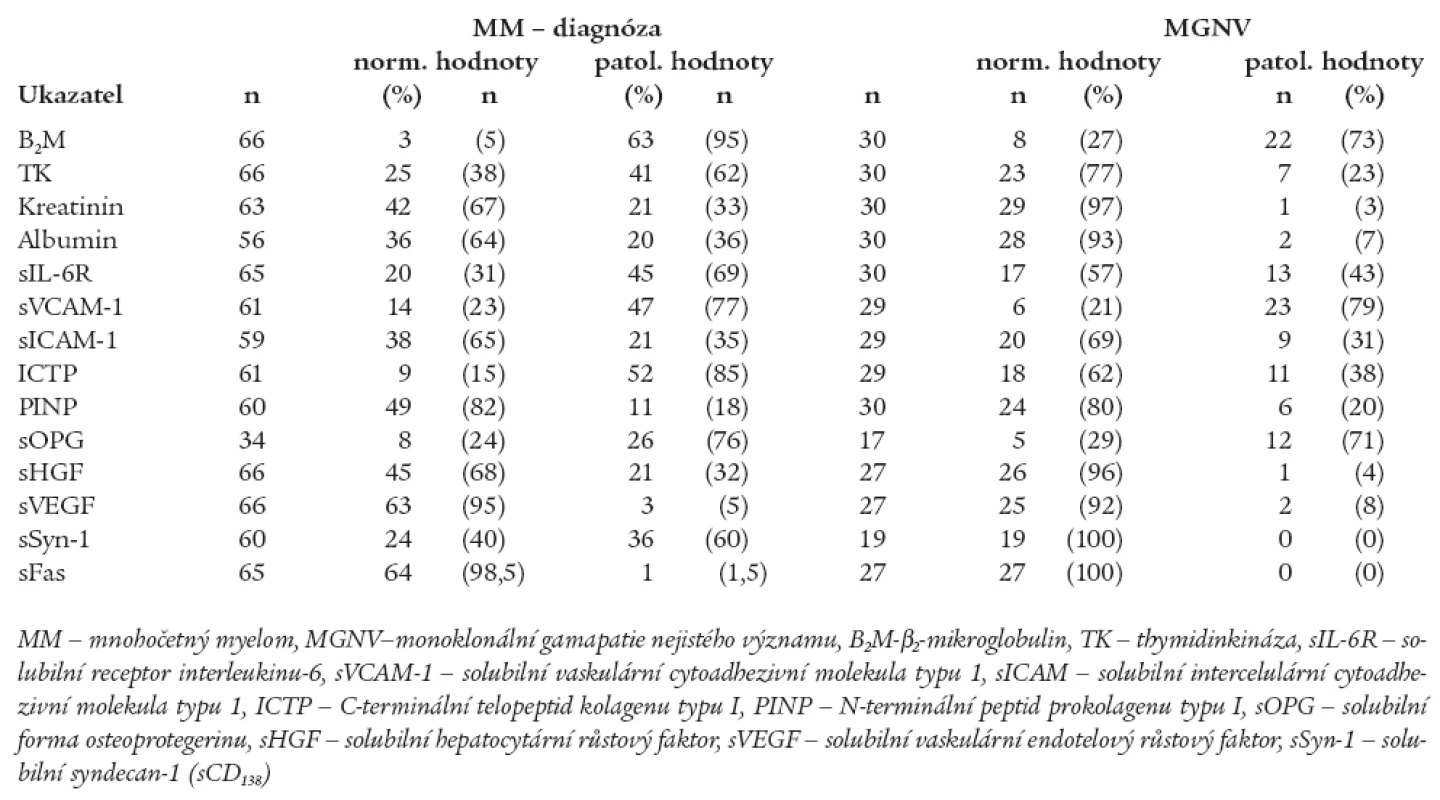
Diskuse
Zkušenosti z klinické praxe nasvědčují, že rozlišení MGNV a mnohočetného myelomu může být někdy dosti obtížné a ani v současnosti neexistuje samostatný ukazatel, který by v hraničních situacích umožňoval spolehlivé odlišení obou klinicky a prognosticky tak odlišných stavů [24,25]. Zatímco MGNV je benigní, resp. premaligní diskrétní klonální expanze plazmocelulární populace stabilizující se ještě před vývinem klinických projevů a nevyžadující tudíž specifickou léčbu, je MM i v současnosti, a to přes výrazné pokroky v terapii, stále uniformně fatálním onemocněním [17]. Mezi běžně dostupné, avšak jen omezeně spolehlivé předpovědní faktory neoplastické transformace MGNV, tj. stavu s rizikem zhoubné konverze u 1-1,5 % jedinců za rok, patří v současnosti zvýšené hodnoty M-proteinu v séru a/nebo v moči, suprese normálních imunoglobulinů, pokles hodnoty Hb, morfologické odchylky a zvýšené zastoupení plazmocytů v kostní dřeni, stupeň kostní remodelace vyhodnocené s pomocí kvantitativní histomorfometrie a některých ukazatelů kostního obratu, zvýšený počet cirkulujících plazmocytů v obvodové krvi, vyšší proliferační aktivita plazmatických buněk, abnormální poměr hladin volných lehkých řetězců v séru (K/L koeficient) a zejména pozitivní výsledky vyšetření skeletu s pomocí MR, CT a FDG-PET, případně i 99TcMIBI, umožňující odhalení konvenční radiografií nepodchytitelných změn [3,6,14,24,25,35]. Recentní studie naznačují, že nadějným příspěvkem k rozlišení MGNV a MM může být srovnání výskytu normálních/polyklonálních plazmocytů v kostní dřeni [32], buněčná exprese N-CAM/CD56 („neural cell adhesive molecule“) případně i hladiny s-NCAM v séru [15], zvýšená aktivita telomerázy [56] či exprese IGF-1 („insulin growth factor-1“). Molekulární mechanizmy, vedoucí k přechodu MGNV v MM, zůstávají přes dílčí pokroky stále do značné míry neobjasněny [51]. V současnosti proto i nadále zůstává rozhodujícím, naneštěstí ale retrospektivním kritériem reálného odlišení MGNV od MM, dlouhodobá klinicko-laboratorní stabilita stavu [17].
Předložená analýza potvrdila všeobecně přijatou zkušenost, že B2M je v diferenciální diagnostice MGNV a MM přes vcelku odlišnou frekvenci výskytu abnormálních hodnot pro svou nespecifitu a značné překrývání sérových hladin nepoužitelný [24]. V poněkud příznivějším světle se jevilo vyhodnocení hladin S-TK, neboť patologické hodnoty byly přítomny při diagnóze MM v 62 %, zatímco u MGNV pouze ve 23 %. Reálnému přínosu pro klinickou praxi však brání nejen nález zvýšených hodnot u 1/5 nemocných s MGNV, ale i chybějící specifita s ovlivněním hladin různými zánětlivými a imunopatologickými procesy. Je nasnadě, že k odlišení MGNV od MM nelze použít z dobře známých příčin i hodnoty S-kreatininu a S-albuminu, i když se jejich výskyt u obou srovnávaných stavů zřetelně lišil.
Hodnocení sIL-6R bylo zařazeno do studie vzhledem ke klíčovému významu IL-6 v patogenezi MM, kdy v rámci sekvenční interakce se specifickým transmembránovým receptorem IL-6Rα dochází prostřednictvím komplexu IL-6/IL-6R k interakci se signální molekulou gp130, spouštějící aktivaci intracytoplazmatických dějů, majících úzký vztah ke stupni proliferace a apoptózy myelomových buněk [4]. Nebyl opomenut ani prokázaný vztah mezi výškou S-sIL-6R ke stupni pokročilosti, aktivitě, délce léčebné odezvy a celkové prognózy nemocných s MM [26,28]. Ukázalo se, že v námi vyhodnoceném souboru nemocných s MM byly zjištěny patologické hodnoty sIL-6R v séru podstatně častěji, nežli v předchozí studii (69 % vs 47 %) [47]. V souladu se závěry zveřejněných prací byla hodnota S-sIL-6R zvýšena u MM podstatně častěji a vyznačovala se i významně vyššími hladinami nežli v souboru MGNV [28,45]. Přes zjištění významných rozdílů je ale nutno přistupovat k posuzování sérových hladin sIL-6R pro malou specifitu v diferenciální diagnostice MG velmi obezřetně.
Cytoadhezivní molekuly typu VCAM-1 a ICAM-1, exprimované širokou škálou buněk mikroprostředí kostní dřeně (KD), se významně uplatňují v patogenezi MM a to v rámci osídlování KD myelomovými buňkami a jejich vazby na stromální a endotelové buňky, ale i v důsledku ovlivňování proliferačních vlastností myelomových plazmocytů a jejich přežívání v mikroprostředí KD [7,51]. Homofilní interakce myelomových elementů vede v důsledku vazby LFA-1 s ICAM-1 k jejich místnímu nakupení [22]. V souladu se závěry naší předchozí studie byly zjištěny abnormální hodnoty sVCAM-1 v séru u více nežli 2/3 nemocných, v případě sICAM-1 u třetiny nemocných [48]. Ukázalo se, že frekvence výskytu patologických hodnot i statistické srovnání sérových hladin sVCAM-1 a sICAM-1 vyznělo při porovnání MGNV s MM nevýznamně. Mezi příčiny je možno uvést rozmanitost vlivů modifikujících uvolňování obou CAM z povrchu buněk a zřejmě i odlišné chování solubilních forem v porovnání s formami VCAM-1 a ICAM-1 exprimovaných na buněčných membránách. Naše studie se tedy zcela neztotožnila se závěry předchozích prací, uvádějících, že zvýšené hodnoty CAM jsou výrazem odezvy organizmu na přítomnost a rozsáhlost nádorového procesu [7,16].
Naprosto stěžejní odlišností MGNV od MM jsou radiografické, případně MR či 99mTcMIBI projevy myelomové kostní nemoci [14] jako výslednice disharmonie většinou snížené osteoblastické formace a vystupňované osteoklastické resorpce, přičemž klíčovou příčinou je dysbalance osy RANKL/OPG [18,37]. Je známo, že myelomové elementy přispívají ke zvýšení exprese RANKL a k poklesu dostupnosti OPG v mikroprostředí KD, což vede k vystupňované osteoklastogenezi. Citlivým indikátorem rozdílnosti kostní resorpce u MGNV a iniciální fáze MM (stadium I dle D-S) je ICTP [37,49]. Sérová hladina tohoto ukazatele je zvýšena u většiny nemocných s MM, koreluje s velikostí nádorové masy a má inverzní vztah k prognóze nemoci. S údaji o přínosu vyšetření ICTP v diferenciální diagnostice MGNV a MM se ztotožnily i výsledky naší analýzy. Využití ICTP v rámci individuálního hodnocení je ale na závadu přítomnost zvýšených hodnot u bezmála 40 % jedinců s MGNV s překrýváním zejména v oblasti nízkých sérových hodnot u MM. V souladu s představou, že v rozvinuté fázi MM dochází k útlumu aktivity osteoblastů, a tím i syntézy kostní matrix vyznělo i námi provedené hodnocení hladin PINP, tj. ukazatele rychlosti syntézy kolagenu I. typu. Ukázalo se, že hladiny PINP byly v normálním rozmezí a v obdobné koncentraci u většiny jedinců s MGNV i s MM (80 a 82 %). Ke stejnému poznání dospěly i obdobně zaměřené studie vycházející z měření sérových hodnot PICP [1]. Z hlediska závěru předchozích studií je zatím nepřehledná situace v hodnocení sérových koncentrací sOPG u MGNV a MM. Z některých analýz vyplynulo, že u MM jsou sérové hodnoty sOPG sníženy [38,50], a to v souladu se závěry imunohistochemicky orientovaných studií prokazujících snížení exprese OPG v osteoblastech kostní trámčiny [18]. Odlišně ale vyznívají závěry jiných autorů, nacházejících zvýšené hodnoty sOPG u MGNV i u MM oproti kontrolní skupině [8,23,33], přičemž mezi hladinami sOPG u MGNV a MM nebyl významný rozdíl [8]. Není tedy překvapením, že i v naší studii nebyly zjištěny odlišné výše hladin sOPG u MGNV a u MM se souhlasným zvýšením sérového sOPG u 3/4 obou stavů. Z uvedených poznatků vyplývá, že stanovení cirkulující, solubilní formy OPG neodráží spolehlivě aktivitu OPG v mikroprostředí KD, neboť sérový sOPG má i jiné zdroje, včetně vaskulární kapilární sítě (OPG je antiapoptotickým faktorem endotelových buněk). Mezi další příčiny tohoto stavu je možno přiřadit i malou srovnatelnost používaných metodik, způsobenou hodnocením odchylných forem OPG [8]. K zamýšlenému hodnocení indexu RANKL/OPG v naší studii nedošlo vzhledem k naměření velmi nízkých koncentrací cirkulujícího sRANKL v iniciálně analyzovaném souboru 11 nemocných, od dalšího vyšetřování tohoto markeru bylo proto upuštěno.
Mezi významné nálezy, odlišující MGNV od MM patří i hustota kapilární sítě v KD, neboť MGNV je považována za „preangiogenní“ zatímco MM za stav „vaskulární“ [36,52,53]. Zvýšená neoangiogeneza KD je u MM vyvolána zejména nadměrnou produkcí potentních proangiogenních cytokinů typu VEGF, HGF a bFGF samotnými klonálními plazmocyty [6,34,36,53], stimulujícími vaskulogenní diferenciaci CD34+ buněk a migraci i proliferaci endotelových buněk [19,42]. Z dosavadních zkušeností vyplývá, že vztah sérových hladin sVEGF a sHGF ke stupni pokročilosti a k prognóze MM nevyznívá vždy souhlasně, neboť existují sdělení popisující pozitivní [12,36,52] i chybějící vztah [42], přičemž neujasněná situace je i při porovnání poměrů u MGNV a MM. Z naší analýzy vyplynulo, že sérové hladiny sHGF byly zvýšeny u 32 % nemocných s MM, tedy obdobně jako ve studii Seidlové nacházející zvýšení sHGF v séru u 43 % myelomů [40]. Vzhledem k výskytu zvýšených hodnot sHGF pouze u 4 % nemocných s MGNV naší sestavy a statistické významnosti nálezu s přítomností dvojnásobně zvýšených hodnot u MM oproti MGNV lze tento ukazatel považovat za další parametr, rozšiřující dosavadní mozaiku testů sloužících potenciálně k odlišení MGNV od MM. Nutno ale zdůraznit, že pro diagnózu MM má praktický význam pouze nález zvýšených hodnot sHGF, nikoliv normální hodnota. Nepochybným zklamáním byl nález chybějící rozdílnosti ve výši hladin sVEGF v souborech MGNV a MM, přičemž průměrná hladina VEGF byla u MGNV dokonce vyšší nežli u MM. Vedle úlohy zvolené analytické metody se může na tomto úkazu podílet i možnost dalších zdrojů, ovlivňujících výši sérové koncentrace sVEGF. Budoucí analýza se tedy bude muset zaměřit mj. i na srovnání hladin sVEGF v krevním séru a v séru získaném z aspirátu KD [34]. Nelze pominout, že šíře našeho pohledu na roli dominantních proangiogenních působků byla oslabena chybějícím hodnocením sérových hladin solubilní formy bFGF, poněvadž v analyzovaném souboru 26 nemocných s MM byly naměřeny jen velmi nízké koncentrace a od analýzy dalších nemocných bylo proto upuštěno. Z uvedených výsledků vyplývá, že v klinicky použitelném světle se jeví v případě MG především vyšetřování hladiny sHGF, které lze využít navíc nejen v monitorování průběhu, ale i při hodnocení celkové prognózy nemocných s MM [40].
Syndekan-1 (CD138) je transmembránový proteoglykan, aktivně uvolňovaný u MM z povrchu neoplastických plazmocytů. Jde o jednu z ústředních regulačních molekul v patobiologii myelomu, neboť se podílí na vazbě komponent extracelulární matrix, v modulaci aktivit řady cytokinů v KD, především však bFGF, a na zpětném ovlivňování chování samotných myelomových buněk i na stimulaci aktivity osteoblastů a útlumu osteoklastů [10,11,30,39]. Jde především o marker viabilních myelomových plazmocytů (CD38+ CD45 - i CD38+ CD45+), jehož exprese se rychle vytrácí v průběhu apoptózy. V naší studii byly zjištěny zvýšené hodnoty solubilní formy syndekanu-1 v séru u 60 % nemocných, což odpovídá spíše závěrům studie Seidlové [40], která zaznamenala zvýšené hodnoty v 79 % nežli studie Dhodapkara, který nalezl patologické koncentrace solubilního syndekanu-1 pouze ve 35 % [10]. Velmi příznivě vyznělo srovnání hladin sCD138 u MGNV oproti MM, neboť žádný z jedinců s MGNV neměl sérovou hladinu tohoto ukazatele zvýšenou zatímco nemocní s MM měli průměrnou hladinu 4krát vyšší. Uvedené zjištění se ale neztotožňuje se závěry studie Witziga, který sice považuje syndekan-1 za excelentní marker plazmocytů, nepřispívající ale k rozlišení MGNV od MM [55]. Ze závěru naší studie i většiny obdobně zaměřených prací je zřejmé, že sérové hladiny solubilní formy syndekanu-1 (sCD138) lze považovat za velmi přínosný ukazatel, obohacující dosavadní algoritmus testů používaných v diagnostice MGNV a MM a mající podle předchozích studií úzký vztah i ke stěžejním prognostickým faktorům MM, např. k výšce M-komponenty, S-B2M, ke klinickému stadiu a k celkové prognóze nemoci [10,29,30,39].
Fas (Apo-1/CD95) je transmembránový receptor, uplatňující se v případě zkřížené vazby s Fas ligand (FasL) na indukci programové smrti buněk [27,31]. Systém Fas/FasL je jedním ze 2 primárních mechanizmů buněčně zprostředkované cytotoxicity [27]. Většina myelomových buněk exprimuje na svém povrchu proapoptotický Fas antigen, takže porucha jeho funkce např. v důsledku bodové mutace, pozorované u 10 % nemocných, se může uplatňovat v progresi MM [27,44]. Je známo, že solubilní forma Fas antigenu (sFas) se uplatňuje i v podmínkách in vivo na ochraně myelomových buněk před apoptózou, přispívá tedy k jejich immortalitě, a tím vlastně i k progresi MM [20]. Přes výše uvedená východiska naše studie neodhalila prozatím žádný prakticky použitelný výsledek měření sérových hladin sFas. Ukázalo se, že u všech jedinců s MGNV a u 98,5 % nemocných s MM byly sérové hladiny sFas v pásmu normálních hodnot a nelišily se dokonce ani průměrné sérové hladiny sFas u obou srovnávaných souborů, tj. u MGNV a MM.
Závěr
Z předložené práce vyplynulo, že nalezení nových ukazatelů, které by podstatným způsobem rozšířily naše současné možnosti diskriminace MGNV od iniciálních fází MM, je nesmírně obtížný úkol. Z analýzy chování 10 parametrů, majících vesměs intimní vztah k biologickým vlastnostem klonálních plazmatických buněk nebo mikroprostředí kostní dřeně, se z hlediska reálného přínosu pro odlišení MGNV od MM jevily v účelném světle pouze sérové hladiny ICTP a solubilní formy HGF a syndekanu-1 (sCD138), zčásti i solubilní forma IL-6R, zatímco hodnocení působků typu sVCAM-1, sICAM-1, PINP, sOPG, sVEGF a sFas vyznělo nepřínosně. Nelze se nezmínit, že rozšíření iniciálního vyšetřovacího algoritmu MGNV a MM o čtyři vytypované ukazatele nenavyšuje náklady příliš podstatně a pohybuje se na úrovni 1,5-2,0 tisíce korun. Je nasnadě, že všeobecná platnost předložených závěrů vyžaduje ověření na rozsáhlejších souborech nemocných i na posouzení v podmínkách běžné klinické praxe.
Podpora grantu IGA MZ ČR NC-7503 a VVZ MSM 619895205.
prof. MUDr. Vlastimil Ščudla, CSc.
www.fnol.cz
e-mail: vlastimil.scudla@fnol.cz
Doručeno do redakce: 14. 12. 2005
Přijato po recenzi: 29. 12. 2005
Zdroje
1. Abildgaard N, Bentzen SM, Nielsen JL et al. Serum markers of bone metabolism in multiple myeloma: Prognostic value of the carboxy-terminal telopeptide of type I collagen (ICTP). Brit J Haematol 1997; 96 : 103-110.
2. Adam Z, Česká myelomová skupina a Myelomová sekce ČHS pro diagnostiku a léčbu mnohočetného myelomu: Diagnostika a léčba mnohočetného myelomu. Transf Hematol dnes 2003; 9(Suppl 1): 3-33.
3. Bataille R, Chappard D, Basle MF. Quantifiable excess of bone resorption in monoclonal gammapothy is an early symptom of malignancy: A prospective study of 87 bone biopsies. Blood 1996; 87 : 4762-4769.
4. Bataille R, Jourdan M, Zhang XG et al. Serum levels of interleukin 6, a potent myeloma cell growth factor, as a reflect of disease severity in plasma cell dyscrasias. J Clin Invest 1989; 84 : 2008-2011.
5. Bladé J. On the „Significance“ of monoclonal gammopathy of undetermined significance. Mayo Clin Proc 2004; 79 : 855-856.
6. Cesana C, Klersy C, Barbarano L et al. Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. J Clin Oncol 2002; 20 : 1625-1634.
7. Cook G, Dumbar M, Franklin IM. The role of adhesion molecules in multiple myeloma. Acta Haematol 1997; 97 : 81-89.
8. Corso A, Dovio A, Rusconi C et al. Osteprotegerin serum levels in multiple myeloma and MGUS patients compared with age-and sex-matched healthy controls. Leukemia 2004; 18 : 1555-1557.
9. Dankbar B, Padró T, Leo R et al. Vascular endothelial growth factor and interleukin-6 in paracrine tumor-stromal cell interactions in multiple myeloma. Blood 2000; 95 : 2630-2636.
10. Dhodapkar MV, Kelly T, Theus A et al. Elevated levels of shed syndecan-1 correlate with tumour mass and decreased matrix metalloproteinase-9 activity in the serum of patients with multiple myeloma. Brit J Haematol 1999; 99 : 368-371.
11. Dhodapkar MV, Abe E, Theus A et al. Syndecan-1 is a multifunctional regulator of myeloma pathobiology: control of tumor cell survival, growth, and bone cell differentiation. Blood 1998; 91 : 2679-2688.
12. Di Raimondo F, Azzaro MP, Palumbo GA et al. Angiogenic factors in multiple myeloma: higher levels in bone marrow than in peripheral blood. Haematologica 2000; 85 : 800-805.
13. Durie BGM, Salmon SE, Moon TE. Pretreatment tumour mass, cell kinetics and prognosis in multiple myeloma. Blood 1980; 55 : 364-372.
14. Durie BGM, Waxman AD, D´Agnolo A et al. Advances in the diagnosis and staging of multiple myeloma. Multiple Myeloma 2004; April 22-24, Torino: 75-77.
15. Ely SA, Knowles DM. Expression of CD56/neural cell adhesion molecule correlates with the presence of lytic bone lesions in multiple myeloma and distinguishes myeloma from monoclonal gammopathy of undetermined significance and lymphomas with plasmacytoid differentiation. Am J Pathol 2002; 160 : 1293-1299.
16. Faid L, Van Riet I, De Waele M et al. Adhesive interactions between tumour cells and bone marrow stromal elements in human multiple myeloma. Eur J Haematol 1996; 57 : 349-358.
17. Fonseca R, Barlogie B, Bataille R et al. Genetics and cytogenetics of multiple myeloma: a workshop report. Cancer Res 2004; 64 : 1546-1558.
18. Giuliani N, Calla S, Rizzoli V. New insight in the mechanism of osteoclast activation and formation in multiple myeloma: Focus on the receptor activator of NF kB ligand (RANKL). Exp Hematol 2004; 32 : 685-691.
19. Hideshima T, Bergsagel PL, Kuehl MW et al. Advances in biology of multiple myeloma: Clinical applications. Blood 2004; 104 : 607-618.
20. Cheng J, Zhon T, Liu C et al. Protection from Fas-mediated apoptosis by a soluble form of the Fas molecule. Science 1995; 263 : 1759-1761.
21. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121 : 749-757.
22. Kawano MM, Huang N, Tanaka H et al. Homotypic cell aggregations of human myeloma cells with ICAM-1 and LFA-1 molecules. Brit J Haematol 1991; 79 : 538-548.
23. Kraj M, Centkowski P, Kruk B. Osteoprotegerin and sRANKL serum levels in multiple myeloma patients. Haematol J 2003; 4: S157.
24. Kyle RA, Rajkumar V. Monoclonal gammopathies of undetermined significance: a review. Immunol Rev 2003; 194 : 112-139.
25. Kyle RA, Therneau TM, Rajkumar SV et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002; 346 : 564-569.
26. Kyrtsonis MC, Dedoussis G, Zervas C et al. Soluble interleukin-6 receptor (sIL-6R), a new prognostic factor in multiple myeloma. Brit J Haematol 1966; 93 : 398-400.
27. Landowski TH, Qu N, Buyuksal I et al. Mutations in the Fas antigen in patients with multiple myeloma. Blood 1997; 90 : 4266-4270.
28. Lauta VM. A review of the cytokine network in multiple myeloma. Cancer 2003; 97 : 2440-2452.
29. Maisnar V, Toušková M, Tichý M et al. The significance of soluble CD138 in diagnosis of monoclonal gammopathies. Neoplasma 2006; (manuscript).
30. Maisnar V, Toušková M, Malý J et al. Význam vybraných laboratorních ukazatelů pro diferenciální diagnostiku a sledování aktivity mnohočetného myelomu. Vnitř Lék 2002; 48 : 290-297.
31. Nagata S, Golstein P. The Fas death factor. Science 1995; 267 : 1449.
32. Ocqueteau M. Immunophenotypic characterization of plasma cells from monoclonal gammopathy of undetermined significance patients: implications for the differential diagnosis between MGUS and multiple myeloma. Am J Pathol 1998; 152 : 1655-1665.
33. Paliton M, Terpos E, Anagnostopoulos A et al. Role of receptor activator of nuclear factor - kappa B ligand (RANKL), osteoprotegerin and macrophage protein 1-alpha (MIP-1a) in monoclonal gammopathy of undetermined significance (MGUS). Brit J Haematol 2004; 126 : 686-689.
34. Pour L, Hájek R, Buchler T et al. Angiogeneze a antiangiogenní terapie u nádorů. Vnitř Lék 2004; 50 : 930-938.
35. Rajkumar SV, Kyle RA, Therneau TM et al. Presence of monoclonal free light chains in the serum predicts risk of progression in monoclonal gammopathy of undetermined significance. Brit J Haematol 2004; 127 : 308-310.
36. Rajkumar SV. Bone marrow angiogenesis in 400 patients with monoclonal gammopathy of undetermined significance, multiple myeloma, and primary amyloidosis. Clin Cancer Res 2002; 8 : 2210-2216.
37. Roux S, Meignin V, Quillard J et al. RANK and RANKL expression in multiple myeloma. Brit J Haematol 2002; 117 : 86-92.
38. Seidel C, Hjertner O, Abildgaard N et al. Nordic Myeloma Study Group serum osteoprotegerin levels are reduced in patients with multiple myeloma with lytic bone disease. Blood 2001; 98 : 2269-2271.
39. Seidel C, Sundan A, Hjorth M et al. Serum syndecan-1: a new independent prognostic marker in multiple myeloma. Blood 2000; 95 : 388-392.
40. Seidel C, Borset M, Turesson I et al. For the Nordic Myeloma Study Group. Elevated serum concentrations of hepatocyte growth factor in patients with multiple myeloma. Blood 1998; 91 : 806-812.
41. Seidel C, Borset M, Hjertner O et al. High levels of soluble syndecan-1 in myeloma-derived bone marrow: modulation of hepatocyte growth factor activity. Blood 2000; 96 : 3139-3146.
42. Sezer O, Jakob C, Eucker J et al. Serum levels of the angiogenic cytokines basic fibroblast growth factor (bFGF), vascular endothelial growth factor (VEGF) and hepatocyte growth factor (HGF) in multiple myeloma. Eur J Haematol 2001; 66 : 83-88.
43. Sezer O, Niemöller K, Jakob C et al. Bone marrow microvessel density is a prognostic factor for survival in patients with multiple myeloma. Ann Hematol 2000; 79 : 574-577.
44. Shima Y, Nishimoto N, Ogata A et al. Myeloma cells express Fas antigen/APO-1 (CD95) but only some are sensitive to anti-Fas antibody resulting in apoptosis. Blood 1995; 85 : 757-764.
45. Stasi R, Brunetti M, Parma A et al. The prognostic value of soluble interleukin-6 receptor in patients with multiple myeloma. Cancer 1998; 82 : 1860-1866.
46. Ščudla V, Bačovský J, Papajík T et al. Tymidinkináza séra u mnohotného myelomu. I. Vztah k vybraným laboratorním ukazatelům nemoci. Vnitř Lék 1994; 40 : 151-156.
47. Ščudla V, Kubalová D, Bačovský J et al. Příspěvek k vyšetření solubilního receptoru interleukinu-6 v séru u mnohočetného myelomu. Čas Lék Čes 1996; 135 : 719-722.
48. Ščudla V, Budíková M, Bačovský J et al. Vztah hladin solubilních cytoadhezivních molekul VCAM-1 a ICAM-1 k vybraným klinickým a laboratorním ukazatelům mnohočetného myelomu. Vnitř Lék 1999; 45 : 583-590.
49. Špička I, Cieslar P, Procházka B et al. Prognostické faktory a markery aktivity u mnohočetného myelomu. Čas Lék Čes 2001; 139 : 208-212.
50. Terpos E, Szydlo R, Apperley JF et al. Soluble receptor activator of nuclear factor kappaB ligand - osteoprotegerin ratio predicts survival in multiple myeloma: proposal for a novel prognostic index. Blood 2003; 102 : 1064-1069.
51. Urashima M, Chen BP, Chen S et al. The development of a model for the homing of multiple myeloma cells to human bone marrow. Blood 1997; 90 : 754-765.
52. Vacca A, Ribatti D, Roccaro AM et al. Bone marrow angiogenesis in patients with active multiple myeloma. Sem Oncol 2001; 28 : 543-550.
53. Vacca A, Ribatti D, Presta M et al. Bone marrow neovascularization, plasma cell angiogenic potential, and matrix metalloproteinase-2 secretion parallel progression of human multiple myeloma. Blood 1999; 93 : 3064-3073.
54. Vejlgaard T, Abildgaard N, Jans H et al. Abnormal bone turnover in monoclonal gammopathy of undetermined significance: analyses of type I collagen telopeptide, osteocalcin, bone-specific alkaline phosphatase and propeptides of type I and type III procollagens. Eur J Haematol 1997; 58 : 104-108.
55. Witzig TE, Kimlinger T, Stenson M et al. Syndecan-1 expression on malignant cells from the blood and marrow of patients with plasma cell proliferative disorders and B-cell chronic lymphocytic leukemia. Leuk Lymphoma 1998; 31 : 167-175.
56. Xu D. Telomerase activity in plasma cell dyscrasias. Br J Cancer 2001; 84 : 621-625.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- PET - možnosti a limitace - editorial
- Molekulární biologie a diabetes: kam teď? - editorial
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Hypertenze v těhotenství
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Jak vidí endokrinologové profesora MUDr. Josefa Marka, DrSc.
- Když přišel Josef Marek před 40 lety na 3. interní kliniku
- I. Žucha, I. Hulín: Myšlienky. Bratislava: Slovak Academic Press 2006. 255 stran. ISBN 80-89104-75-4.
- Sninčák M. Artériová hypertenzia: súčasné klinické trendy. Košice: TypoPress 2005. 284 stran. ISBN 80-89089-39-9.
- Hoffmann GF et al. Dědičné metabolické poruchy. Praha: Grada 2005. 416 stran. ISBN 80-247-0831-0.
- 130. internistický den v Olomouc věnovaný revmatologii
- Sdělení výboru České internistické společnosti
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



